玫瑰RrNUDX1基因在增强植物花香中的应用的制作方法
本发明公开了玫瑰基因rrnudx1在增强植物花香中的应用,属于植物生物技术领域。
背景技术:
玫瑰(rosarugosathunb.)是世界上重要的天然香料植物,也是我国传统的药食同源花卉,单萜类化合物中的香茅醇、香叶醇、橙花醇及其乙酸酯类衍生物是形成玫瑰特征香气的主要成分。
单萜作为萜类化合物主要种类,大多分布在植物的腺体油室等分泌组织中,通常具有较强的香气和生物活性,单萜对于植物生存和人类生活具有重要作用,除了它们在植物防御中的功能外,单萜还用作香料和药物,同时许多名贵植物精油的主要成分均由单萜类化合物组成,如薄荷精油主要由柠檬醛和香芹酮组成。近年来,研究人员通过分离单萜生物合成途径中的关键酶基因,借助基因工程手段,选择性地调控单萜代谢途径,从而提高萜类合成前体和下游单萜类化合物的产量,达到改良植物香气以及精油品质的目的。
nudx1属于nudix水解酶基因家族,在细菌、病毒、真核生物中均有发现,研究表明,nudx1基因是nudx家族中唯一一个马特型酶,其蛋白以8-oxo-(d)gtp(8-氧化脱氧鸟苷三磷酸酶)、dntp、nadh、dihydroneopterin(二氢新蝶呤)为底物,能够有效清除细胞中因ros氧化所受损的核苷酸,减少细胞内氧化损伤的累积,降低细胞突变和程序性死亡,增强对不良环境的适应力。玫瑰rrnudx1基因的cdna全长序列全长777bp,具有起始密码子、完整的开放阅读框453bp,终止密码子、5'非编码区68bp,3′非编码区244bp与poly(a)尾巴12bp,共编码151个氨基酸。基因登陆号为kx096710.1。但是,rrnudx1基因的应用尚未有报道。
技术实现要素:
本发明的目的是提供玫瑰rrnudx1基因的应用。
本发明公开了玫瑰rrnudx1基因在增强植物花香中的应用。
本发明还公开了rrnudx1基因在培育香气浓郁的花卉新品种中的用途。
一种增强香气的转基因花卉新品种的培育方法,是构建rrnudx1基因的过表达载体,采用农杆菌介导法将过表达载体导入待转化花卉,获得转基因花卉新品种。
本发明通过构建rrnudx1基因的过表达载体,采用农杆菌介导法将pcambia1304-rrnudx过表达载体导入矮牵牛,待植株开花后,采用gc-ms技术检测盛开期矮牵牛花朵芳香成分,结果发现,与野生型相比,转rrnudx1基因植株花中苯甲酸甲酯等主要香气成分的含量明显提高,且感官上能闻到浓郁的香气,说明过表达rrnudx1基因具有增强植物花香的功能。
本发明利用现代分子生物学手段,挖掘出调控植物花香形成的关键基因,并培育出香气浓郁的花卉新品种,不仅可以提高切花和盆栽植物的商品价值,还可以提高花卉产品的质量及其经济价值,甚至可以提高植物精油的含量,改良精油的品质,具有重要的经济价值和巨大的潜在应用价值。
附图说明
图1矮牵牛植株转化过程;a:叶片预处理,b:侵染,c:生根,d:壮苗,e:移植。
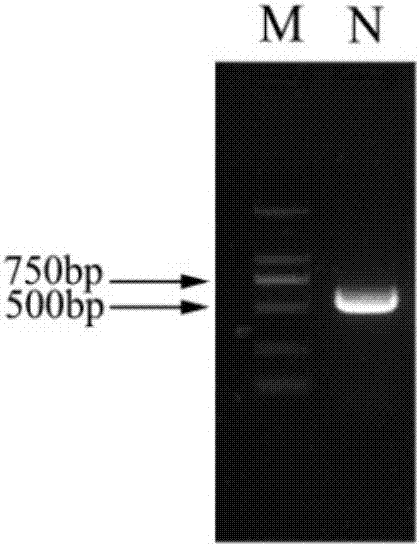
图2pcr产物凝胶检测,m:markerdl2000n:rrnudx1的pcr产物。
图3重组质粒pcambia1304-rrnudx1的单酶切电泳图,
m1:markerdl15000m2:markerdl2000a1-a2:重组质粒单酶切n:阴性对照。
图4rrnudx1-1和rrnudx1-2序列比较,
rrnudx1-1:克隆的目的基因rrnudx1-2:重组质粒。
图5pcambia1304-rrnudx1农杆菌转化子菌液pcr电泳图
m:markerdl2000p1-p3:pcambia1304为模板n1:ddh2o为模板n2:农杆菌eha菌液为模板n3:yeb液体培养基为模板a1-a7:pcambia1304-rrnudx1农杆菌转化子菌液为模板。
图6矮牵牛愈伤gus染色结果
a:wt;b-d:转rrnudx1基因愈伤。
图7转基因矮牵牛植株dna验证
m:markerdl2000;a1-a6:过表达抗性植株;p:pcambia1304-rrnudx1质粒;wt1-2:野生型。
图8野生型与转基因矮牵牛植株的表型观察
a:野生型与转rrnudx1基因植株的生长状态;b:野生型植株开花状态;c:转rrnudx1基因植株的开花状态。
具体实施方式
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
生物材料:pcambia1304表达载体(biovector公司,北京)、eha105农杆菌(华越洋生物科技有限公司,北京)
实施例:
1玫瑰rrnudx1基因转化矮牵牛与功能验证
1.1载体质粒与菌株
pcambia1304表达载体和eha105农杆菌均为本实验室保存。
1.2主要试剂的配制
(1)yeb液体培养基:0.05gmgso4·7h2o、1g酵母提取物、5g蛋白胨、5g牛肉浸膏、5g蔗糖,用ddh2o溶解并定容至1000ml,调ph值至7.0,灭菌后4℃保存。yeb固体培养基:在yeb液体培养基的基础上加20g/l琼脂,灭菌后分装保存。
(2)kan:母液50mg/ml。0.5gkan,溶于10ml灭菌ddh2o中,0.22μm滤膜过滤,用1.5ml离心管分装,-20℃保存。
(3)rif:母液5mg/ml。0.05grif,溶于少量无水乙醇后用灭菌ddh2o定容到10ml,0.22μm滤膜过滤,用1.5ml离心管分装,-20℃保存。
(4)6-ba:母液0.1mg/ml。10mg6-ba,用少量0.1moi/l的naoh溶液溶解,最后用灭菌ddh2o定容至100ml,-20℃避光保存。
(5)iaa:母液0.1mg/ml。10mgiaa,用少量1mol/l的naoh溶液溶解,定容至100ml,0.22μm滤膜过滤,-20℃避光保存。
(6)as:母液50μmol/l。0.1962gas,溶于dmso定容至20ml,0.22μm滤膜过滤,-20℃避光保存。
(7)mes:母液10mg/ml。0.1gmes,溶于10ml灭菌ddh2o中溶解,0.22μm滤膜过滤,用1.5ml离心管分装,4℃保存。
(8)cb:母液50mg/ml。0.5gcb,溶于10ml灭菌ddh2o中溶解,0.22μm滤膜过滤,用1.5ml离心管分装,-20℃保存。
1.3矮牵牛遗传转化基本培养基
ms1:蔗糖30g/l+ms基本成分,ph5.8
ms2(愈伤分化):ms1+6-ba3.0mg/l+iaa0.2mg/l,ph5.8
ms3(生根):蔗糖30g/l+1/2ms,ph5.8
ms4(侵染液):ms+mes1mg/l+as20mol/l,ph5.8
ms5(共培养):ms2+as20mol/l,ph5.8
1.4rrnudx1基因过表达载体构建
1.4.1目的基因的初步获取
1.4.4.1引物的合成与设计
根据rrnudx1基因(kx096710.1)cdna全长序列分别设计上下游引物(引物所跨区域包含完整的cds序列),用于体外分离目的基因,引物信息如下:
表1扩增rrnudx1基因开放阅读框的引物
1.4.4.2目的基因的pcr扩增
(1)反应体系为:
(2)反应条件:
x:退火温度
(3)将pcr反应液在1%的琼脂糖凝胶上电泳检测。
1.4.4.3pcr产物的回收与纯化
参照takara公司的takaraminibestagarosegeldnaextractionkitver.4.0试剂盒进行。
1.4.4.4pcr产物的连接、转化、扩大培养
目的片段的连接、转化参照trans公司的peasytm-t5zerocloningkit试剂盒说明书进行。
1.4.4.5质粒dna的提取及检测
参照axygen公司的axypreptmplasmidminniprepkit50-prep试剂盒说明书提取,委托上海生工进行目的基因序列测序,将测序结果与已登录的rrnudx1基因序列进行同源比对。
1.4.4.6rrnudx1基因的克隆与序列分析
采用玫瑰品种‘唐红’花瓣提取的rna,反转录成cdna为模板,通过pcr扩增后产物电泳图如图2,可以看出,扩增片段介于500-750bp,与预期值相近。回收纯化扩增片段,插入peasytm-t5zerocloningvector,转入大肠杆菌在附加1‰km的lb平板上筛选阳性克隆。测序结果显示,所克隆的目的基因序列为540bp左右,含起始密码子、终止密码子,编码151个氨基酸,经比对与已克隆的rrnudx1基因相似性达100%,推测氨基酸序列相似性达100%。
1.4.2目的基因(含有酶切位点)的获取
1.4.2.1引物的设计与合成
根据in-fusion试剂盒说明书要求,结合目的基因及双元表达载体pcambia1304上的限制性酶切位点,设计用于过表达载体构建的pcr引物,引物名称及其寡核苷酸序列如下:
rrnudx1单酶切引物:
rrnudx1-f:5’-ggactcttgaccatggttatgggaaacgagacagttgtag-3’(ncoi)(seqidno.3)
rrnudx1-r:5’-gtcagatctaccatggtcatgttggaaaagggttaaatc-3’(ncoi)(seqidno.4)
1.4.2.2含有酶切位点目的基因的pcr扩增
以获取的含有rrnudx1基因编码区序列的克隆载体质粒为模板,采用高保真酶进行pcr扩增反应,将ncoi酶切位点引入rrnudx1基因编码区两端。
(1)反应体系为:
(2)反应条件:
(3)用1%的琼脂糖凝胶电泳检测产物,切下含有目的片段的胶块并回收。
1.4.2.3双元表达载体pcambia1304酶切及产物回收
(1)连接rrnudx1基因的过表达载体pcambia1304酶切反应体系为:
(2)反应条件:37℃3h;
(3)用1%的琼脂糖凝胶电泳检测产物。
1.4.2.4目的片段与表达载体的连接
将获取的目的基因与获取的过表达载体以1:3混合连接。
(1)连接反应体系为:
(2)pcr反应条件:50℃15min
1.4.3连接转化
目的片段的连接、转化参照trans公司的peasytm-t5zerocloningkit试剂盒说明书进行。
1.5重组质粒的鉴定及检测
1.5.1酶切鉴定及检测
挑选lb固体培养皿上的单菌落,分别置于含3ml液体lb(含1‰kan)的灭菌10ml离心管中,37℃200rpm振荡过夜培养后,提取pcambia1304-rrnudx1重组质粒的dna。
对pcambia1304-rrnudx1进行单酶切鉴定,反应条件均为37℃3h,用1%的琼脂糖凝胶电泳检测产物。同时酶切pcambia1304作为阴性对照,电泳检测结果如图3所示。可以看出,阴性对照n显示一条长约12000bp的条带,单酶切a1-a2切出一条约为500bp的条带,与rrnudx1开放阅读框大小一致。因此,表明目的基因已初步插入表达载体pcambia1304中。
将经酶切验证后的阳性重组质粒送测序,测序结果用dnaman分析(图4),与已克隆结果进行比对,发现相似性为100%,无碱基突变,推测氨基酸序列完全相同,证明目的基因rrnudx1已成功连入表达载体pcambia1304,过表达载体pcambia1304-rrnudx1构建成功。并将测序正确的重组质粒于-20℃保存。
1.5.2重组质粒导入农杆菌eha105及筛选鉴定
1.5.2.1农杆菌eha105感受态制备
试验方法参照本实验室的方法进行农杆菌eha105感受态制备
1.5.2.2液氮冻融法转化农杆菌
(1)在碎冰上将农杆菌eha105感受态细胞慢慢融化,加入5μl重组质粒并混匀,置于冰上30min,1min液氮速冻,37℃热激5min,冰浴2min;
(2)加入800μl左右的不含抗生素液体yeb,120-160rpm,28℃,4-5h,在含有40mg/l的rif和50mg/l的kan的固体yeb上涂布300μl,28℃暗培养2d左右。
1.5.2.3农杆菌转化子的筛选鉴定
(1)挑取yeb平板上的单菌落,接种于含有3ml(含有40mg/l的rif和50mg/l的kan)液体yeb的灭菌10ml离心管中,28℃200rpm暗培养;
(2)菌液pcr检测阳性转化子;
(3)用1%的琼脂糖凝胶电泳检测产物。
1.5.2.4农杆菌转化子保存
将经菌液pcr鉴定为阳性转化子的农杆菌菌液中加入25%灭菌甘油,混匀后用1.5ml灭菌离心管分装,-70℃保存。
1.5.2.5结果
将检测正确的重组质粒(pcambia1304-rrnudx1)采用液氮冻融法导入农杆菌eha105感受态,在附加有1‰km和1‰rif的yeb固体培养基上筛选阳性转化子,制成菌液后以其为模板进行菌液pcr验证,同时针对模板设置一组阳性对照(p),三组阴性对照(n1、n2、n3),以保证结果的准确性。产物经电泳检测显示(图5),a1-a7均扩增出了长度为500bp左右的目的片段。
1.6矮牵牛遗传转化体系优化
1.6.1植物材料的获得
1.6.1.1无菌苗的获得
将矮牵牛种子置于75%的酒精中浸泡5min,无菌水冲洗3次,再用12.5%的次氯酸钠溶液中浸泡10min,无菌水冲洗3次,接种于1/2ms培养基上培养。
1.6.1.2组培苗移栽
当组培苗长到五叶一心时进行移栽,将瓶盖打开在常温中炼苗一周左右,然后移栽于人工温室气候箱,光/暗周期为16h/8h,光照强度为200umol.m-2s-1,温度为25℃/23℃,相对湿度为70%。
1.6.2矮牵牛遗传转化体系选择压和抑菌剂浓度的确定
1.6.2.1潮霉素选择压的确定
本试验构建的过表达载体pcambia1304-rrnudx1携带潮霉素(hyg)抗性基因,因此确定hgy为农杆菌介导的矮牵牛遗传转化的选择抗生素。在超净工作台上,选取生长旺盛的矮牵牛无菌苗,将叶片切为1cm2的叶盘,分别置于hyg浓度为1、3、5、6、7、9、10、15mg/l的培养基ms1上,每个梯度处理30块叶片组织,培养30天,每15天更换1次培养基,重复3次。
从表2可以看出,hyg的浓度越高,对外植体的分化影响越大,愈伤诱导和芽分化的临界值均为7mg/l,生根的临界浓度6mg/l,因此在选择培养时,分别使用相应浓度的hyg进行筛选,确保阳性率的提高。
表2不同hyg浓度对矮牵牛各时期分化的影响
1.6.2.2羧苄浓度的确定
本试验采用羧苄作为遗传转化的抑菌剂,在超净工作台上,选取生长旺盛的矮牵牛无菌苗,将叶片切为1cm2的叶盘,分别置于cb浓度为100、200、300、400、500、600、700mg/l的培养基ms1上,每个梯度处理30块叶片组织,培养30天,每15天更换1次培养基,重复3次。
从表3可以看出,羧苄对外植体的生长没有明显的抑制作用,浓度为500mg/l时,对愈伤和芽分化有小幅度影响,浓度为500mg/l时,对生根有小幅度影响,故三种选择培养基的抑菌剂浓度均选择500mg/l。
表3不同cb浓度对矮牵牛各时期分化的影响
1.6.2.3农杆菌侵染液的培养
(1)取出-70℃中含有目的基因的农杆菌菌株,在含有km和rif的yeb筛选培养基上划板,28℃暗培养2-3天;
(2)在yeb+kan+rif液体培养基中接种单菌落,培养od为0.8-1.3;
(3)菌液pcr验证,确定菌液中目的基因的正确性;
(4)经过鉴定的菌液,加入50ml不含抗生素液体yeb在28℃200rpm震荡1-2天;
(5)将二次活化的菌液在4℃5000rpm离心12-15min后,收集菌体,再用事先准备好的侵染液(ms4)重悬稀释菌液od为0.3-0.6备用。
1.7矮牵牛的遗传转化
1.7.1叶片的预处理
选取生长旺盛的矮牵牛叶片,在超净工作台上,切成1cm2的小方块,叶片腹面向下,置于ms固体培养基上暗培养2天。
1.7.2侵染
首先在共培养表面平铺无菌滤纸片;第二步将预先培养2天的材料放入已准备好的侵染液中侵染5-8min;第三步取出侵染后的叶片,用无菌滤纸吸干表面的菌液,置于共培养基(ms5)上培养3天。
1.7.3分化筛选培养
将共培养3天后的叶盘取出,用无菌滤纸吸干材料表面的菌液;转移至筛选培养基中诱导培养愈伤组织,置于植物组培室培养,每15d换一次培养基,直至长出再生苗。
1.7.4生根筛选培养
当筛选培养的愈伤组织分化出的再生苗长至2-3cm左右时,切下更换至生根筛选培养基中,没有分化出芽的愈伤组织需要切除褐化变黄的部分,转移到新的分化筛选培养基上,阳性植株2-3周即可生根(图1)。
1.8转基因矮牵牛的检测
采用gus染色法和pcr法检测抗性植株。
1.8.1矮牵牛愈伤组织gus染色
对潮霉素筛选下生长形态正常的矮牵牛愈伤组织进行gus染色,结果显示,野生型呈黄白色,无gus底物活性,转rrnudx1基因的愈伤中染出了不同程度的蓝色(图6),表明筛选标记基因gus正常表达。
1.8.2转rrnudx1基因的矮牵牛植株dna验证
在获得的转rrnudx1基因的矮牵牛植株中随机挑选6个单株,提取叶片dna进行pcr扩增,结果显示6株中5株能扩增出单一的条带且大小为500bp左右,与转入的对照质粒产物大小相似,而野生型不能扩增出条带(图7),由此可见rrnudx1基因已经整合到矮牵牛基因组中。
1.9矮牵牛转基因植株表型观察
将野生型和转rrnudx1基因的矮牵牛植株移栽于人工温室气候箱,相同培养条件下进行培养,观测记录转基因和野生型植株叶片的形态、开花时间、花朵大小、花色和花期等表型方面的变化,发现转基因植株长势变快。如图8
1.10矮牵牛花香成分分析
1.10.1hs-spme取样
试验在扬州大学测试中心进行。取样前先将固相微萃取头在气相色谱进样口老化20min,老化温度250℃。分别盛开期的矮牵牛花朵3朵,用剪刀轻轻剪碎,混匀后称取1g,迅速置于l0ml样品瓶中,并在样品瓶底部加入内标物3-壬酮,然后迅速用聚四氟乙稀丁基合成橡胶隔片密封,将老化好的萃取头插入样品瓶顶空部分,于40℃(水浴)条件下吸附40min。
1.10.2gc-ms分析
吸附完成后将固相微萃取头抽回,插入气相色谱-质谱联用仪(tracedsq,美国thermo公司),于250℃解析2min,启动仪器采集数据。色谱条件:ffap弹性石英毛细管色谱柱,长60m,内径0.32mm,液膜厚1.0μm;载气为he(99.99%),不分流;程序升温,进样口250℃,柱温起始温度50℃保持1min,以5℃/min升温至120℃,再以8℃/min升温至200℃,最后以12℃/min升温至250℃,保持7min。质谱条件:gc-ms接口温度250℃,离子源温度200℃,电离方式ei,电子能量70ev,发射电流200μa;扫描质量范围29~600amu。
1.10.3花香成分的定性和定量分析
定性方法:未知化合物质谱图经计算机检索同时与nistlibrary和wileylibrary2个质谱库相匹配,并结合人工图谱解析及资料分析。仅报道正反匹配度均大于800(最大值1000)的鉴定结果。
定量方法:选择3-壬酮为内标,其浓度为0.8μg/μl,加入体积为2μl。采用sim(选择离子检测)方式定量。计算公式如下:香气成分含量(μg/g)=[该组分的峰面积/内标的峰面积×内标浓度(μg/μl)×内标体积]/样品重量(g)。
1.10.4结果
结果如表4和表5,从表4可以看出,矮牵牛叶片挥发性成分主要以酯类化合物为主,野生型和转基因植株主要挥发性物质为亚油酸甲酯、叔十六硫醇、棕榈酸甲酯、顺式-十八烷酸甲酯、亚麻酸甲酯等。转rrnudx1基因的矮牵牛中亚油酸甲酯的含量有所提高,其他成分的含量变化不明显,说明rrnudx1基因转化后对矮牵牛叶片挥发性成分影响甚微。
表4野生型和转基因矮牵牛叶片主要挥发性成分及含量比较(μg/μl)
从表5可以看出,矮牵牛花香主要成分为酯类和醇类化合物,含量最高的为苯甲酸甲酯。与野生型相比,转基因矮牵牛花中未发现新的挥发性物质,即过表达rrnudx1基因未改变矮牵牛md的花香组分。我们选择了10种主要香气成分进行统计分析(这10种香气成分之和占矮牵牛花中香气成分总量的80.10%),发现转基因矮牵牛酯类花香成分中,除苯甲酸苄酯外含量均有所提高,苯甲酸甲酯含量增加最明显,在转基因植株rrnudx1-1花中,苯甲酸甲酯含量是野生型植株的1.69倍;醇类物质以苯甲醇、苯乙醇为主,转基因植株rrnudx1-1和rrnudx1-2中苯甲醇含量比野生型提高了25.58%、53.49%;另外,两种主要酚类物质含量也有所增加,转基因植株中异丁香酚的含量分别是野生型植株的3.2、4.3和4.9倍。
表5野生型与转rrnudx1基因矮牵牛花香成分及含量比较(μg/μl)
2、结论
综合上述结果,我们发现,与野生型相比,转rrnudx1基因矮牵牛植株花中苯甲酸甲酯等主要香气成分的含量明显提高,且感官上能闻到浓郁的香气,说明过表达rrnudx1基因具有增强矮牵牛花香的功能,这为我们接下来利用rrnudx1基因提高其它植物花香奠定了突破性基础。
sequencelisting
<110>扬州大学
<120>玫瑰rrnudx1基因在增强植物花香中的应用
<130>
<160>4
<170>patentinversion3.3
<210>1
<211>22
<212>dna
<213>人工序列
<400>1
atgggaaacgagacagttgtag22
<210>2
<211>23
<212>dna
<213>人工序列
<400>2
tcatgttggaaaagggttaaatc23
<210>3
<211>40
<212>dna
<213>人工序列
<400>3
ggactcttgaccatggttatgggaaacgagacagttgtag40
<210>4
<211>39
<212>dna
<213>人工序列
<400>4
gtcagatctaccatggtcatgttggaaaagggttaaatc39
- 还没有人留言评论。精彩留言会获得点赞!