一种产卤醇脱卤酶的阴城假单胞菌YC1612及其应用和制备方法与流程
本发明涉及微生物领域,具体而言,涉及一种产卤醇脱卤酶的阴城假单胞菌yc1612及其应用和制备方法。
背景技术:
卤醇脱卤酶(halohydrindehalogenase,hhdhs,ec4.5.1.x)也叫卤醇-卤化氢裂解酶,属于短链脱氢酶/还原酶家族,多存于1,3-二氯丙醇,表卤醇等众多重要的环境污染物的生物降解途径中。卤醇脱卤酶可以广泛应用于合成环氧化物以及β-取代醇。其中叠氮化醇、氰取代醇以及硝基醇是合成氨基醇的前体;手性氨基醇在生物制药领域是一类很重要的化合物,可用来合成多种生物活性物质。异硫氰酸取代醇和噁唑烷酮在农用化学试剂、医药和高分子化学领域中有着广泛应用,其介导的生物催化反应具有反应条件温和、立体选择性高和不需要辅酶等优点。
卤醇脱卤酶因为在污水治理中的应用前景以及在合成手性药物中间体中的应用而得到广泛的重视,但是对于卤醇脱卤酶的研究在国内外均处于起步阶段。迄今为止已利用卤代醇或表氯醇为限制性碳源从土壤中筛选获得卤代醇降解菌株,仅仅包括agrobacteriumradiobacterad1、corynebacteriumsp.n-1074、arthrobactersp.、arthrobactererithiih10a、mycobacteriumsp.gp1、parvibaculumlavamentivorans、agromycesmediolanus和tistrellamobilis等。生物催化剂是不对称生物合成的核心,其来源多样性在很大程度上决定了生物催化反应的多样性。卤醇脱卤酶酶源的匮乏,制约了卤醇脱卤酶立体选择性生物催化在手性β-取代醇合成中的开发应用。
技术实现要素:
本发明的目的在于提供一种产卤醇脱卤酶的阴城假单胞菌yc1612(pseudomonasumsongensisyc1612)。该菌株保藏于中国典型培养物保藏中心,保藏地址为中国武汉武汉大学,保藏编号为cctccno:m2017173,保藏日期为2017年4月10日。该菌株产卤醇脱卤酶,其可作为卤醇脱卤酶的酶源,有大大地拓展了卤醇脱卤酶立体选择性生物催化在手性β-取代醇合成中的开发应用。
本发明的另一目的在于提供上述阴城假单胞菌yc1612的应用。
本发明的另一目的在于提供一种卤醇脱卤酶的制备方法,该制备方法通过上述阴城假单胞菌yc1612制备得到卤醇脱卤酶。
本发明是这样实现的:
一种产卤醇脱卤酶的阴城假单胞菌yc1612,其保藏编号为cctccno:m2017173。
上述的阴城假单胞菌yc1612的应用。
一种卤醇脱卤酶的制备方法,该制备是利用上述的阴城假单胞菌yc1612制备得到卤醇脱卤酶。
本发明具有以下有益效果:
本发明的产生卤醇脱卤酶的新菌株即阴城假单胞菌yc1612(pseudomonasumsongensisyc1612),保藏编号为cctccno:m2017173。该菌株能够产卤醇脱卤酶,在亲核试剂的参与下可以催化环氧化物开环生成手性环氧化物和β-取代醇。以n3-为亲核试剂,催化邻甲基苯基缩水甘油醚开环反应时,(s)-邻甲基苯基缩水甘油醚的ee值可达到98%,生成的(r)-1-叠氮-3-(2-甲基苯氧基)-2-丙醇的ee值达到96.8%。其可在生物催化环氧化物选择性开环制备手性环氧化物和β-取代醇中的进行应用,也可用于制备卤醇脱卤酶,作为卤醇脱卤酶酶源,具有重要应用前景。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实施例2提供的阴城假单胞菌yc1612的菌落形态图;
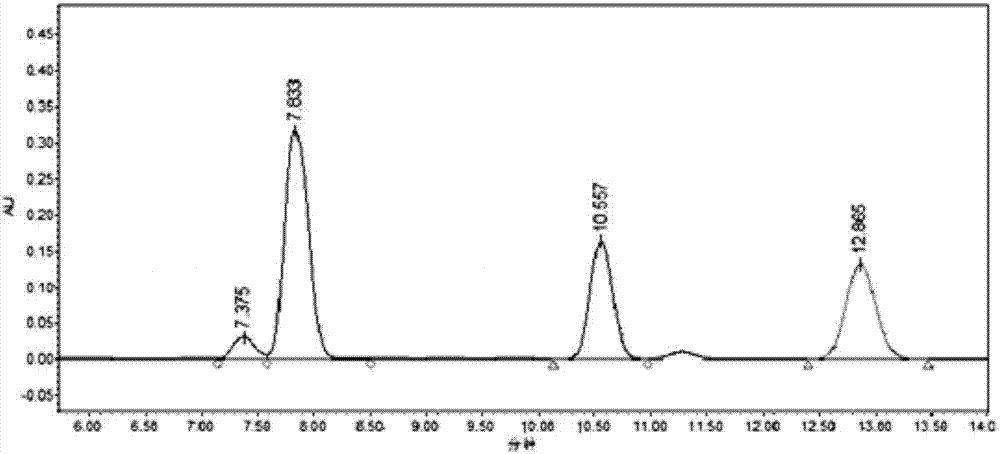
图2为本发明实施例4提供的以苯基缩水甘油醚为底物生物转化后的产物的液相色谱图;
图3为本发明实施例5提供的以邻甲基苯基缩水甘油醚为底物生物转化后的产物的液相色谱图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例的一种产卤醇脱卤酶阴城假单胞菌及其应用和制备方法进行具体说明。
一方面,本发明提供了一种产卤醇脱卤酶的阴城假单胞菌yc1612(pseudomonasumsongensisyc1612),其保藏编号为cctccno:m2017173。
该菌株的具体保藏信息如下:
阴城假单胞菌yc1612,分类学命名为pseudomonasumsongensisyc1612,已于2017年4月10日保藏于中国典型培养物保藏中心,保藏地址为中国武汉武汉大学,保藏编号为cctccno:m2017173。
该阴城假单胞菌yc1612由从江苏盐城滩涂等地的土样中分离得到,其产卤醇脱卤酶,具有较高的脱卤活性。
经进一步的分析鉴定,该阴城假单胞菌yc1612菌落形态为:菌落呈灰白色,边缘整齐,圆形,隆起,表面光滑,不透明(如图1所示);光学显微镜下观察呈杆状,革兰氏染色呈阴性。
该菌株能够产卤醇脱卤酶,在亲核试剂的参与下可以催化环氧化物开环生成手性环氧化物和β-取代醇。以n3-为亲核试剂,催化邻甲基苯基缩水甘油醚开环反应时,(s)-邻甲基苯基缩水甘油醚的ee值可达到98%,生成的(r)-1-叠氮-3-(2-甲基苯氧基)-2-丙醇的ee值达到96.8%。其可在生物催化环氧化物选择性开环制备手性环氧化物和β-取代醇中的进行应用,也可用于制备卤醇脱卤酶,作为卤醇脱卤酶酶源,具有重要应用前景。
另一方面,本发明提供了上述阴城假单胞菌yc1612的应用。
进一步地,在本发明的一些实施方案中,上述应用是将阴城假单胞菌yc1612用于制备手性环氧化物和β-取代醇。
进一步地,在本发明的一些实施方案中,上述应用是在亲核试剂参与下进行催化反应,以制备手性环氧化物和β-取代醇。
进一步地,在本发明的一些实施方案中,上述亲核试剂具体为n3-、no2-或cn-。
进一步地,在本发明的一些实施方案中,上述应用具体为:以环氧化物为底物,以上述阴城假单胞菌yc1612经发酵获得含卤醇脱卤酶菌体细胞为催化剂,以含有亲核试剂的缓冲溶液为反应体系,进行转化反应,得到手性环氧化物和β-取代醇。
进一步地,在本发明的一些实施方案中,上述应用具体为:以邻甲基苯基缩水甘油醚或苯基缩水甘油醚为底物,以上述阴城假单胞菌yc1612经发酵获得含卤醇脱卤酶菌体细胞为催化剂,以含10-40mm叠氮化钠的ph为5.0-7.5的缓冲溶液为反应体系,于25-40℃下进行转化反应,于反应液中萃取手性环氧化物和叠氮醇。
进一步地,在本发明的一些实施方案中,在上述反应体系中,上述底物添加量为10-50mm,上述含卤醇脱卤酶菌体细胞添加量为20-60g/l。
再一方面,本发明提供了一种卤醇脱卤酶的制备方法,该制备方法是利用上述的阴城假单胞菌yc1612制备得到卤醇脱卤酶。
进一步地,在本发明的一些实施方案中,上述制备方法包括:将上述阴城假单胞菌yc1612种子液接种至发酵培养基中,于25-30℃下培养48-64h,取培养液洗涤离心重悬,破壁后得到卤醇脱卤酶。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
阴城假单胞菌yc1612(pseudomonasumsongensisyc1612)的筛选
本发明从江苏盐城滩涂等地取土样,共取土样40份。筛选的具体方法:
称取土壤样品5g,加入50ml无菌水制成土壤悬浮液,取1.0ml上清液,加入到筛选培养基中,于30℃、150rpm/min摇床上振荡培养4天。
选取颜色由蓝变为黄色的摇瓶,之后取该培养液进行梯度稀释,取10-4、10-5、10-6的梯度稀释液涂布到固体lb培养基上,置30℃恒温培养箱培养3天。
挑取生长出的单菌落接种到液体发酵培养基中进行培养。在30℃摇床上培养2天,离心收集菌体,并用磷酸盐缓冲液洗涤。
菌体用于转化,转化条件如下:磷酸盐缓冲液(200mm,ph8.0)中加入菌体,1,3-二氯-2-丙醇20mm,置于30℃水浴摇床转化30min,取1ml转化液,乙酸乙酯萃取后,气相检测分析。
最终获得一株脱卤活性较高的野生菌种,并命名该菌株为yc1612。
其中,所用的各种培养基的组成如下:
筛选培养基:0.2%1,3-二氯-2-丙醇,0.1%(nh4)so4,0.1%k2hpo4,0.1%na2hpo4·2h2o,0.2%nah2po4·12h2o,0.05%mgso4·7h2o,0.001%feso4·7h2o,0.001%cuso4·5h2o,0.001%mnso4·5h2o,ph7.0,并加入溴百里香酚蓝显色剂;
固体lb培养基:1%蛋白胨,0.5%酵母粉,1%nacl,2%琼脂,ph7.0;
发酵培养基:1%甘油,0.5%蛋白胨,1%酵母粉,0.1%(nh4)so4,0.1%k2hpo4,0.1%na2hpo4·2h2o,0.2%nah2po4·12h2o,0.05%mgso4·7h2o,0.001%feso4·7h2o,0.001%cuso4·5h2o,0.001%mnso4·5h2o,0.1%caco3,ph自然。
实施例2
阴城假单胞菌yc1612(pseudomonasumsongensisyc1612)的鉴定
2.1将实施例1筛选得到的菌株yc1612,在lb平板、牛肉膏蛋白胨平板上30℃培养24h,观察形态,结果如图1所示,菌落呈圆形光滑状、湿润、不透明、边缘整齐、乳白色、易挑取。
2.2筛选得到的菌株yc1612,进行生理生化及biolog鉴定(见表1和表2),并按精编分子生物学实验指南方法提取染色体dna,以提取到的细胞总dna为模板,利用引物:p16s-8:5'-agagtttgatcctggctcag-3'(seqidno:2)和p16s-1541:5'-aaggaggtgatccagccgca-3'(seqidno:3)扩增菌株的16srdna基因,将基因产物同t载体连接后,委托上海生工对该菌16srdna扩增及测序,得到该菌株的16srdna序列后,在ncbi网站上用blast检索genbank中相关菌株的16srrna基因序列,并进行同源性比对。基于形态、生理生化特征和16srdna序列及系统发育学分析等方面的鉴定,确定该菌为阴城假单胞菌,分类学命名为阴城假单胞菌yc1612,pseudomonasumsongensisyc1612,该菌已于2017年4月10日保藏在中国典型培养物保藏中心,保藏编号为cctccno:m2017173。
表1.菌株yc1612对biologgenⅲ板上71种碳源的利用能力
表2菌株yc1612对biologgenⅲ板上23种化学物质的化学敏感性
利用引物p16s-8和p16s-1541进行pcr扩增后,经测序确认该片段实际长度为1450bp。菌株yc1612的16srdna序列如seqidno:1所示。
实施例3
阴城假单胞菌yc1612(pseudomonasumsongensisyc1612)湿菌体的制备
将实施例1获得的含有卤醇脱卤酶的野生型菌株阴城假单胞菌yc1612接种至lb液体培养基,在30℃培养24h,再以1%接种量(v/v)接种到新鲜的发酵培养基中,30℃培养48h后,将培养液在4℃、10000rpm离心10min,弃去上清液,收集沉淀,即获得含有卤醇脱卤酶的湿菌体。
实施例4
以苯基缩水甘油醚为底物的生物转化反应
转化体系组成及转化操作如下:在10mltris-so4缓冲液(ph7.5)中加入0.4g实施例3制备得到的阴城假单胞菌yc1612湿菌体和10mm的苯基缩水甘油醚,10mmnan3,反应温度30℃、150r/min条件下摇床反应,用2倍体积乙酸乙酯进行萃取,萃取两次,合并萃取液,过膜后加入无水硫酸钠,用液相色谱分析测定单一构型底物的收率和ee值,反应45min后,剩余底物中(s)-苯基缩水甘油醚的收率为30.1%,ee值达到66%,用液相色谱分析测定单一构型产物的收率和ee值时,产物中(r)-1-叠氮-3-苯氧基-2-丙醇的收率为45.3%,ee值达到30%。
苯基缩水甘油醚的检测条件:采用的液相色谱仪为岛津高效率hplc-2010a。色谱柱为:手性柱chiralcelod-h(0.46cm×25cm),流动相为:正己烷和异丙醇(体积比80:20),检测波长为:220nm,流速为0.8ml/min。在该条件下,出峰情况如图2所示,底物(r)-苯基缩水甘油醚、(s)-苯基缩水甘油醚的出峰时间分别为7.37min和10.57min,产物(r)-1-叠氮-3-苯氧基-2-丙醇、(s)-1-叠氮-3-苯氧基-2-丙醇的出峰时间为7.83min和12.86min。由图2可知,卤醇脱卤酶优先催化(r)-苯基缩水甘油醚开环生成相应的叠氮醇。
实施例5
以邻甲基苯基缩水甘油醚为底物的生物转化反应
转化体系组成及转化操作如下:在10mltris-so4缓冲液(ph7.5)中加入0.4g实施例3制备得到的阴城假单胞菌yc1612湿菌体和10mm的邻苯基缩水甘油醚,10mmnan3,反应温度30℃、150r/min条件下摇床反应,用2倍体积乙酸乙酯进行萃取,萃取两次,合并萃取液,过膜后加入无水硫酸钠,用液相色谱分析测定单一构型底物的收率和ee值,反应45min后,(s)-邻甲基苯基缩水甘油醚的收率为48.6%,ee值达到98%,用液相色谱分析测定单一构型产物的收率和ee值时,(r)-1-叠氮-3-(2-甲基苯氧基)-2-丙醇的收率达到47.1%,ee值达到96.8%。
邻甲基苯基缩水甘油醚的检测条件:采用的液相色谱仪为岛津lc-10as。色谱柱为:手性柱chiralcelod-h(0.46cm×25cm),流动相为:正己烷和异丙醇(体积比80:20),检测波长为:220nm,流速为0.8ml/min。在该条件下,出峰情况如图3所示,底物(r)-邻甲基苯基缩水甘油醚、(s)-邻甲基苯基缩水甘油醚的出峰时间分别为6.53min和7.98min,产物(r)-1-叠氮-3-(2-甲基苯氧基)-2-丙醇、(s)-1-叠氮-3-(2-甲基苯氧基)-2-丙醇的出峰时间为9.19min和9.88min。由图3可知,同样卤醇脱卤酶优先催化(r)-邻甲基苯基缩水甘油醚开环生成对应构型的叠氮醇,而对(s)-邻甲基苯基缩水甘油醚催化活性较低,基本未进行转化。
实施例6
以亚硝酸为亲核试剂的生物转化反应
转化体系组成及转化操作如下:在10mltris-so4缓冲液(ph7.5)中加入0.4g实施例3制备得到的阴城假单胞菌yc1612湿菌体和10mm的邻苯基缩水甘油醚,10mmnano2,反应温度30℃、150r/min条件下摇床反应,用2倍体积乙酸乙酯进行萃取,萃取两次,合并萃取液,过膜后加入无水硫酸钠,用液相色谱分析测定单一构型底物的收率和ee值,反应60min后,(s)-邻甲基苯基缩水甘油醚的收率为48.6%,ee值达到98%。
通过以上实施例得出结论:本发明提供的阴城假单胞菌yc1612可以产生卤醇脱卤酶,进而在亲核试剂存在下催化环氧化物开环生成相应的手性环氧化物和β-取代醇。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110>盐城工学院
<120>一种产卤醇脱卤酶的阴城假单胞菌yc1612及其应用和制备方法
<160>3
<170>patentinversion3.3
<210>1
<211>1450
<212>dna
<213>人工序列
<400>1
ctgctcttgttcgacttcccccagtcatgaatcacaccgtggtaaccgtcctcccgaagg60
ttagactagctacttctggtgcaacccactcccatggtgtgacgggcggtgtgtacaagg120
cccgggaacgtattcaccgcgacattctgattcgcgattactagcgattccgacttcacg180
cagtcgagttgcagactgcgatccggactacgatcggttttatgggattagctccacctc240
gcggcttggcaaccctctgtaccgaccattgtagcacgtgtgtagcccaggccgtaaggg300
ccatgatgacttgacgtcatccccaccttcctccggtttgtcaccggcagtctccttaga360
gtgcccaccattacgtgctggtaactaaggacaagggttgcgctcgttacgggacttaac420
ccaacatctcacgacacgagctgacgacagccatgcagcacctgtctcaatgttcccgaa480
ggcaccaatccatctctggaaagttcattggatgtcaaggcctggtaaggttcttcgcgt540
tgcttcgaattaaaccacatgctccaccgcttgtgcgggcccccgtcaattcatttgagt600
tttaaccttgcggccgtactccccaggcggtcaacttaatgcgttagctgcgccactaag660
agctcaaggctcccaacggctagttgacatcgtttacggcgtggactaccagggtatcta720
atcctgtttgctccccacgctttcgcacctcagtgtcagtatcagtccaggtggtcgcct780
tcgccactggtgttccttcctatatctacgcatttcaccgctacacaggaaattccacca840
ccctctaccatactctagcttgtcagttttgaatgcagttcccaggttgagcccggggat900
ttcacatccaacttaacaaaccacctacgcgcgctttacgcccagtaattccgattaacg960
cttgcaccctctgtattaccgcggctgctggcacagagttagccggtgcttattctgtcg1020
gtaacgtcaaaacagcaaagtattaatttactgcccttcctcccacttaaagggcttaca1080
tcccaaaaacttcttcacacacgcggcatggctggatcaggctttcgcccattgtccaat1140
attccccactgctgcctcccgtaggagtctggaccgtgtctcagttccagtgtgactgat1200
catcctctcagaccagttacggatcgtcgccttggtgagccattacctcaccaactagct1260
aatccgacctaggctcatctgatagcgcaaggcccgaaggtcccctgctttctcccgtag1320
gacgtatgcggtattagcgtccctttcgagacgttgtcccccactaccaggcagattcct1380
aggcattactcacccgtccgccgctgaatcagagagcaagctctctcatccgctcgactt1440
gcattttagc1450
<210>2
<211>20
<212>dna
<213>人工序列
<400>2
agagtttgatcctggctcag20
<210>3
<211>20
<212>dna
<213>人工序列
<400>3
aaggaggtgatccagccgca20
- 还没有人留言评论。精彩留言会获得点赞!