一种西洛多辛中间体的制备方法与流程
本发明涉及医药合成技术领域,尤其涉及一种西洛多辛中间体的制备方法。
背景技术:
西洛多辛是kissei制药公司开发的治疗前列腺增生的α1肾上腺受体拮抗剂,用于治疗前列腺良性增生所致的排尿困难。
结构式如
技术实现要素:
本发明的目的在于提供一种西洛多辛中间体的制备方法,用于提高制得的西洛多辛中间体的收率。
为了实现上述目的,本发明提供如下技术方案:
一种西洛多辛中间体制备方法,包括:
对α-取代丙酮化合物进行还原胺化,得到初始中间体;其中,
所述α-取代丙酮化合物的结构式为:
初始中间体的结构式为:
对初始中间体进行氨基保护,得到氨基保护中间体;其中,
氨基保护中间体的结构式为:
将氨基保护中间体醛化,得到醛化中间体;其中,
醛化中间体的结构式为:
将醛化中间体肟化,得到肟化中间体;其中,
肟化中间体的结构式为:
将肟化中间体氰化,得到氰化中间体;其中,
氰化中间体的结构式为:
将氰化中间体进行氨基脱保护,得到西洛多辛中间体的游离碱;其中,西洛多辛中间体的游离碱的结构式为:
将西洛多辛中间体的游离碱进行成盐处理,得到西洛多辛中间体;其中,西洛多辛中间体的结构式为:
与现有技术相比,本发明提供的西洛多辛中间体制备方法中,首先对α-取代丙酮化合物进行手性诱导的还原胺化,用以提高合成过程的原子经济性,得到初始中间体,然后对初始中间体进行氨基保护,将苄氧羰基引入初始中间体中苯环的丙基上,得到氨基保护中间体,此时,氨基保护中间体中苯环的丙基邻位碳上氢原子的取代位阻比较大,而由于氰化中间体是通过氨基保护中间体醛化、肟化和氰化后得到的,因此,氨基保护中间体中苯环的丙基邻位碳上氢原子的取代位阻比较大,因此,在经氨基保护中间体醛化时,醛基更容易取代苯环中与丙基取代位置相间位置的氢,这就提高现有技术中醛化时苯环上存在多处可以醛化的反应位点所引起的反应选择性不高的问题,从而提高了西洛多辛中间体的收率。
本发明还提供了一种西洛多辛的制备方法,包括:
采用上述技术方案提供的西洛多辛中间体制备方法制备西洛多辛中间体;
利用西洛多辛中间体制备西洛多辛。
与现有技术相比,本发明提供的西洛多辛的制备方法的有益效果与上述技术方案提供的西洛多辛中间体的制备方法的有益效果相同,在此不再赘述。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
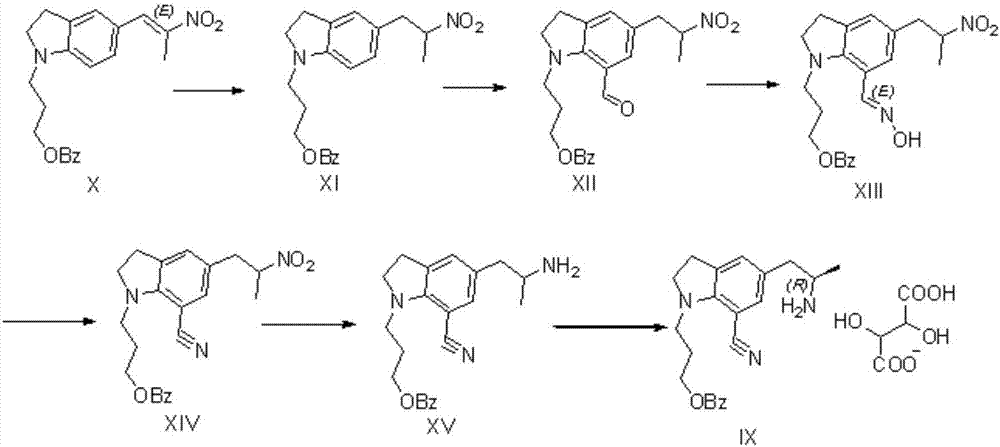
图1为现有技术中制备西洛多辛中间体的化合物转化示意图;
图2为本发明实施例提供的西洛多辛中间体制备方法的流程图一;
图3为本发明实施例提供的西洛多辛中间体制备方法的流程图二;
图4为本发明实施例提供的西洛多辛中间体制备方法的流程图三;
图5为本发明实施例提供的西洛多辛中间体制备方法的流程图四;
图6为本发明实施例提供的西洛多辛中间体制备方法的流程图五;
图7为本发明实施例提供的西洛多辛中间体制备方法的流程图六;
图8为本发明实施例提供的西洛多辛中间体制备方法的流程图七;
图9为本发明实施例提供的西洛多辛中间体制备方法的流程图八;
图10为本发明实施例提供的西洛多辛中间体制备方法的流程图九;
图11为本发明实施例提供的西洛多辛中间体制备方法的流程图十;
图12为本发明实施例提供的西洛多辛中间体制备方法的流程图十一;
图13为本发明实施例提供的西洛多辛中间体制备方法的流程图十二;
图14a为本发明实施例一中还原胺化反应液的液相图谱;
图14b为图14a的10.183min处吸收峰所对应的物质的质谱图;
图14c为图14a的11.150min处吸收峰所对应的物质的质谱图;
图15为本发明实施例一中氨基中间体的质谱图;
图16为本发明实施例一中肟化中间体的质谱图;
图17为本发明实施例一中氰化中间体的质谱图;
图18为本发明实施例一中西洛多辛中间体的质谱图。
具体实施方式
为了进一步说明本发明实施例提供的西洛多辛中间体及西洛多辛的制备方法,下面结合说明书附图进行详细描述。
请参阅图2,本发明实施例提供的西洛多辛中间体制备方法,包括:
s1:对α-取代丙酮化合物进行手性诱导的还原胺化,得到初始中间体;其中,
α-取代丙酮化合物的结构式为:
初始中间体的结构式为:
s2:对初始中间体进行氨基保护,得到氨基保护中间体;其中,氨基保护中间体的结构式为:
s3:将氨基保护中间体醛化,得到醛化中间体;其中,
醛化中间体的结构式为:
s4:将醛化中间体肟化,得到肟化中间体;其中,
肟化中间体的结构式为:
s5:将肟化中间体氰化,得到氰化中间体;其中,
氰化中间体的结构式为:
s6:将氰化中间体进行氨基脱保护,得到西洛多辛中间体的游离碱;其中,
西洛多辛中间体的游离碱的结构式为:
s7:将西洛多辛中间体的游离碱进行成盐处理,得到西洛多辛中间体;其中,
西洛多辛中间体的结构式为:
本实施例提供的西洛多辛中间体制备方法中,首先对α-取代丙酮化合物进行手性诱导的还原胺化,得到初始中间体,然后对初始中间体进行氨基保护,将苄基引入初始中间体中苯环的丙基上,得到氨基保护中间体,此时,氨基保护中间体中苯环的丙基邻位碳上氢原子的取代位阻比较大,而由于氰化中间体是通过氨基保护中间体醛化、肟化和氰化后得到的,因此,氨基保护中间体中苯环的丙基邻位碳上氢原子的取代位阻比较大,在经氨基保护中间体醛化时,醛基更容易取代苯环中与丙基取代位置相间位置的氢,这就提高现有技术中醛化时苯环上存在多处可以醛化的反应位点所引起的反应选择性不高的问题,从而提高了西洛多辛中间体的收率。
示例性的,上述s1对α-取代丙酮化合物进行手性诱导的还原胺化,得到初始中间体包括如下两种方式:
第一种方式:如图3所示,上述s1对α-取代丙酮化合物进行手性诱导的还原胺化,得到初始中间体包括:
s11:在氢气条件下,将α-取代丙酮化合物、还原胺化催化剂和手性胺混合进行手性诱导的还原胺化反应,在还原胺化反应过程中通过薄层色谱监控还原胺化反应进度;示例性的,上述还原胺化催化剂可选用氧化铂、雷尼镍、pd/c中的任意一种,手性胺可选用r-苯甘氨醇、r-萘乙胺、r-苯乙胺中的任意一种;在操作时,将α-取代丙酮化合物溶于四氢呋喃制成初始溶液,然后向初始溶液中依次加入氧化铂和r-苯乙胺,形成还原胺化反应体系,然后将还原胺化反应体系所处环境气氛置换为氢气,将还原胺化反应体系在室温下进行搅拌8h-10h后通过薄层色谱监控还原胺化反应进度;其中,α-取代丙酮化合物与还原胺化催化剂的质量比为1:(0.1%-1%);α-取代丙酮化合物与手性胺的摩尔比为1:(1.0-1.2),可选的,可向上述反应体系中加入乙酸、盐酸等促进剂以促进反应的进行;
s12:当还原胺化反应达到反应终点,利用萃取液萃取所得到的还原胺化反应体系中的有机相;示例性的,萃取液可选用乙酸乙酯;
s13:对萃取出的有机相进行后处理,得到初始中间体;示例性的,将经乙酸乙酯萃取出的有机相进行合并后,依次用饱和碳酸钠溶液和饱和氯化钠溶液进行洗涤,然后经无水硫酸钠干燥,浓缩,得到白色至浅黄色的油状物,即为初始中间体,其中,该初始中间体的de值为66.7%,以α-取代丙酮化合物计算,初始中间体的收率为91%。
第二种方式:如图4所示,上述s1对α-取代丙酮化合物进行手性诱导的还原胺化,得到初始中间体包括:
s11:将α-取代丙酮化合物、手性胺和还原剂混合进行手性诱导的还原胺化,在还原胺化反应过程中通过薄层色谱监控还原胺化反应进度;示例性的,上述手性胺可选用r-苯甘氨醇、r-萘乙胺、r-苯乙胺中的任意一种,还原剂可选用硼氢化钠、氰基硼氢化钠、三乙酰基硼氢化钠中的任意一种;在操作时,将α-取代丙酮化合物溶于有机溶剂制成初始溶液,然后向初始溶液中加入r-苯乙胺和三乙酰基硼氢化钠,将反应体系在室温下进行搅拌8h-10h,然后通过薄层色谱监控还原胺化反应进度;其中,α-取代丙酮化合物与还原剂的摩尔比为1:(1.20-2.00);α-取代丙酮化合物与手性胺的摩尔比为1:(1.0-1.2),示例性的,有机溶剂可以选用甲苯;
s12:当还原胺化反应达到反应终点,利用萃取液萃取所得到的还原胺化反应体系中的有机相;示例性的,当还原胺化反应达到反应终点,向得到的还原胺化反应体系中分次加入饱和碳酸钠溶液进行2次洗涤,然后,向其中分次加入浓度为1m的盐酸进行3次萃取得到有机相,分离出的水相分次用甲苯进行2次洗涤,然后调节水相的ph至9,继续分次使用乙酸乙酯进行3次萃取得到的有机相;
s13:对萃取出的有机相进行后处理,得到初始中间体;示例性的,将萃取出的有机相依次用饱和碳酸钠溶液和饱和氯化钠溶液洗涤,然后经无水硫酸钠干燥,浓缩,得到白色至浅黄色的油状物,即为初始中间体,其中,该初始中间体的de值为57.5%,以α-取代丙酮化合物计算,初始中间体的收率为92%。
示例性的,如图5所示,上述s2对初始中间体进行氨基保护,得到氨基保护中间体包括:
s21:将初始中间体与氯甲酸苄酯混合进行氨基保护反应,在氨基保护反应过程中通过薄层色谱监控氨基保护反应进度;示例性的,将初始中间体溶于有机溶剂中制成初始中间体溶液,将制得的初始中间体溶液在室温条件下搅拌后,向其中滴加氯甲酸苄酯形成氨基保护反应体系,滴加过程中氨基保护反应体系温度不高于30℃,使氯甲酸苄酯和初始中间体进行氨基保护反应;其中,初始中间体与氯甲酸苄酯的摩尔比为1:(1.00-1.30);示例性的,有机溶剂可以选用苯、甲苯或二甲苯;
s22:当氨基保护反应达到反应终点,利用萃取液萃取所得到的氨基保护反应体系中的有机相;示例性的,萃取液可选用苯、甲苯或二甲苯;
s23:对萃取出的有机相进行后处理,得到氨基保护中间体;示例性的,将萃取出的有机相依次用饱和碳酸钠溶液和饱和氯化钠溶液洗涤,然后经无水硫酸钠干燥,浓缩,得到无色至浅黄色的油状物,即为氨基保护中间体,其中,以初始中间体计算,氨基保护中间体的收率为100%。
如图6所示,上述s3将氨基保护中间体醛化,得到醛化化合物包括:
s31:将三氯氧磷和二甲基甲酰胺混合制备甲酰化试剂;示例性的,在0℃的温度条件下,将三氯氧磷滴加入二甲基甲酰胺中,滴加过程中控制体系温度在5℃-10℃,待三氯氧磷滴加完毕后,将反应体系转移至室温搅拌均匀,以得到甲酰化试剂;
s32:将甲酰化试剂与氨基保护中间体混合进行醛化反应,在醛化反应过程中通过薄层色谱监控醛化反应进度;具体的,将通过s31得到的甲酰化试剂降温至8℃-10℃后将氨基保护中间体加入其中,在室温条件下搅拌1h-1.5h后,升温至40℃-50℃下保持4h-5h,使氨基保护中间体发生醛化反应,在此过程中通过薄层色谱监控醛化反应进度;示例性的,二甲基甲酰胺和氨基保护中间体的质量比为1:(0.3-0.4);二甲基甲酰胺和三氯氧磷的摩尔比为1:(1.95-2.15);
s33:当醛化反应达到反应终点,利用萃取液萃取所得到的醛化反应体系中的有机相;示例性的,当醛化反应达到反应终点后,调节醛化反应体系的ph至10,并向上述醛化反应体系中加入乙酸乙酯和水的混合溶液对醛化反应体系进行分液,示例性的,乙醇和水的体积比为2:1;然后选用乙酸乙酯作为萃取液对有机相进行两次萃取;
s34:对萃取出的有机相进行后处理,得到醛化中间体;示例性的,将萃取得到的有机相依次用饱和碳酸钠溶液和饱和氯化钠溶液进行洗涤,后续经无水硫酸钠干燥,浓缩得到黄色油状物,即为醛化中间体,其中,以氨基保护中间体计算,醛化中间体的收率为100%;
如图7所示,上述s4将醛化中间体肟化,得到肟化中间体包括:
s41:将醛化中间体、盐酸羟胺和吡啶混合进行肟化反应,在肟化反应过程中通过薄层色谱监控肟化反应进度;示例性的,向醛化中间体溶于有机溶剂中制成溶液后,向其中加入盐酸羟胺和吡啶形成肟化反应体系,然后将肟化反应体系加热至40℃-50℃保持1h-2h,并通过薄层色谱监控肟化反应进度;其中,醛化中间体、盐酸羟胺和吡啶的摩尔比为1:(1.50-2.70):(5.45-7.55);示例性的,有机溶剂可选用四氢呋喃;
s42:当肟化反应达到反应终点,得到肟化中间体;
如图8所示,上述s5经肟化中间体氰化,得到氰化中间体包括:
s51:将肟化中间体与乙酸酐混合进行氰化反应,在氰化反应过程中通过薄层色谱监控氰化反应进度;示例性的,向肟化中间体中加入乙酸酐,在40℃-50℃的温度下搅拌25min-35min,然后升温至回流,保持约6h-7h,在此过程中通过薄层色谱监控氰化反应进度;其中,肟化中间体与乙酸酐的摩尔比为1:(3.0-5.0);
s52:当氰化反应达到反应终点,利用萃取液萃取所得到的氰化反应体系中的有机相;示例性的,当氰化反应达到反应终点后,旋蒸回收有机溶剂得到剩余物后,向剩余物中加入乙酸乙酯进行萃取得到有机物;
s53:对萃取出的有机相进行后处理,得到氰化中间体;示例性的,可依次用水、盐酸、饱和碳酸钠溶液和饱和氯化钠溶液洗涤萃取出的有机相,并经无水硫酸钠干燥洗涤后的有机相,然后经浓缩得到的油状物即为氰化中间体;其中,以醛化中间体计算,氰化中间体的收率为82%。
如图9所示,上述s6将氰化中间体进行氨基脱保护,得到西洛多辛中间体的游离碱包括:
s61:在氢气条件下,将氰化中间体与钯炭混合进行氨基脱保护反应,在氨基脱保护反应过程中通过薄层色谱监控氨基脱保护反应进度;示例性的,将氰化中间体溶于有机溶剂中形成氰化中间体溶液后,向其中加入钯炭混合均匀形成氨基脱保护反应体系,之后用氢气置换氨基脱保护反应体系中的空气,然后将氨基脱保护反应体系加热至40℃-50℃进行氨基脱保护反应,在氨基脱保护反应过程中通过薄层色谱监控氨基脱保护反应进度;其中,氰化中间体与钯炭的质量比为1:(0.05-0.15),示例性的,在该反应过程中,有机溶剂可选用甲醇;
s62:当氨基脱保护反应达到反应终点,过滤所得到的氨基脱保护反应体系,得到滤液;
s63:将滤液浓缩,得到西洛多辛中间体的游离碱;示例性的,以氰化中间体计算,西洛多辛中间体的游离碱的纯度为98%,收率为95%。
如图10所示,上述s7将西洛多辛中间体的游离碱进行成盐处理,得到西洛多辛中间体的过程是一个手性分离的过程,其具体包括:
s71:在无氧条件下,向西洛多辛中间体的游离碱中滴加l-酒石酸进行成盐处理反应;示例性的,将西洛多辛中间体的游离碱溶于有机溶剂制成西洛多辛中间体的游离碱溶液,将l-酒石酸溶于水中制成l-酒石酸水溶液,将西洛多辛中间体的游离碱溶液加热至回流后向西洛多辛中间体的游离碱溶液中滴加l-酒石酸水溶液,其中,西洛多辛中间体的游离碱与l-酒石酸的摩尔比为1:(0.90-1.10),保护气体可选用氮气或氩气;有机溶剂可选用丙酮;
s72:当l-酒石酸滴加完毕后,过滤所得到的成盐处理反应体系,得到滤饼;具体的,当l-酒石酸滴加完毕后,将体系温度降至室温,搅拌1h-1.5h后,过滤所得到的成盐处理反应体系,得到滤饼。
s73:将滤饼进行后处理,得到西洛多辛中间体;示例性的,将滤饼进行重结晶,其中,重结晶的溶剂可选用丙酮和水的混合溶液,其中丙酮与水的体积比为1:1,将滤饼用丙酮和水的混合溶液进行重结晶得到产物后,可继续用水对产物进行重结晶,得到西洛多辛中间体;示例性的,以西洛多辛中间体的游离碱计算,西洛多辛中间体的收率为65~98%。
为了提高制得的西洛多辛中间体的手性纯度,如图11所示,上述s2对初始中间体进行氨基保护,得到氨基保护中间体包括:
s21':对初始中间体进行手性拆分纯化,得到手性合格中间体;其中,
手性合格中间体的结构式为:
s22':对手性合格中间体进行氨基保护,得到氨基保护中间体。
示例性的,如图12所示,上述s21'对初始中间体进行手性拆分纯化,得到手性合格中间体包括:
s211':向初始中间体中滴加氯化氢成盐,进行手性拆分纯化反应;示例性的,将初始中间体溶于有机溶剂中制成初始中间体溶液,然后向初始中间体溶液中滴加乙醇的氯化氢溶液,在此过程中实时监测溶液的ph;示例性的,有机溶剂可以选用乙酸乙酯;
s212':当反应体系的ph达到6-7时,在无水条件下,过滤所得到的初始中间体盐酸盐,得到滤饼;示例性的,当ph达到6时,可向溶液中加入少量的初始中间体的晶种,以促进手性拆分中间体的生成,然后过滤得到滤饼,需要注意的是,为了避免手性拆分中间体吸潮,在过滤过程中尽量避免手性拆分纯化反应体系接触空气中的水分;
s213':对滤饼进行后处理,得到手性合格中间体;示例性的,可将乙酸乙酯和乙醇按照4:1的体积比配成重结晶溶液,利用重结晶溶液对滤饼进行重结晶,得到手性合格中间体,其中,该手性合格中间体的de值≥99%,以初始中间体计算,手性合格中间体的收率为48%。
示例性的,如图13所示,上述s22'对手性合格中间体进行氨基保护,得到氨基保护中间体包括:
s221':将手性合格中间体与氯甲酸苄酯混合进行氨基保护反应,在氨基保护反应过程中通过薄层色谱监控氨基保护反应进度;示例性的,将手性合格中间体溶于有机溶剂中制成溶液,并向其中加入碳酸钠溶液以中和,室温条件下搅拌后,向其中滴加氯甲酸苄酯形成氨基保护反应体系,滴加过程中氨基保护反应体系温度不高于30℃,使氯甲酸苄酯和手性合格中间体进行氨基保护反应;其中,手性合格中间体与氯甲酸苄酯的摩尔比为1:(1.20-1.30);手性合格中间体与碳酸钠的摩尔比为1:(2.4-2.6);
s222':当氨基保护反应达到反应终点,利用萃取液萃取所得到的氨基保护反应体系中的有机相;示例性的,萃取液可选用苯、甲苯或二甲苯;
s223':对萃取出的有机相进行后处理,得到氨基保护中间体;示例性的,将萃取出的有机相依次用饱和碳酸钠溶液和饱和氯化钠溶液洗涤,然后经无水硫酸钠干燥,浓缩,得到无色至浅黄色的油状物,即为氨基保护中间体,其中,以手性合格中间体计算,氨基保护中间体的收率为100%。
示例性的,上述α-取代丙酮化合物可通过硝基化合物制得;其中,硝基化合物的结构式为:
可以理解的是,上述薄层色谱监控反应的展开剂为石油醚和乙酸乙酯,其中,石油醚和乙酸乙酯的体积比为1:(3-5)。
本实施例还提供一种西洛多辛的制备方法,包括:
采用上述技术方案提供的西洛多辛中间体制备方法制备西洛多辛中间体;
利用西洛多辛中间体制备西洛多辛。
与现有技术相比,本实施例提供的西洛多辛的制备方法的有益效果与上述技术方案提供的西洛多辛中间体的制备方法的有益效果相同,在此不再赘述。
下面结合实施例具体说明本发明提供的西洛多辛中间体及西洛多辛中间体制备方法,以下实施例仅仅是对本发明的解释,而不是限定。基于本发明中的实施例,本领域普通技术人员在没有付出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例一
本实施例提供一种西洛多辛中间体的制备方法,包括:
第一步,在氢气条件下,将α-取代丙酮化合物溶于四氢呋喃中制成初始溶液,然后向其中加入氧化铂和r-苯乙胺,将上述物质在室温下搅拌进行手性诱导的还原胺化反应,8小时后通过薄层色谱监控还原胺化反应进度;其中,α-取代丙酮化合物与氧化铂的质量比为1:0.1%,α-取代丙酮化合物与r-苯乙胺的摩尔比为1:1.2;
当还原胺化反应达到反应终点,过滤回收氧化铂反应得到的铂黑,旋蒸回收溶剂四氢呋喃,然后向剩余物中依次加入乙酸乙酯和盐酸萃取所得到的还原胺化反应体系中的有机相;其中,盐酸的浓度为1m;
利用碳酸钠将萃取出的有机相的ph调至9,然后依次用饱和碳酸钠溶液和饱和氯化钠溶液对萃取出的有机相进行洗涤,洗涤完毕后,用无水硫酸钠进行干燥,然后浓缩得到白色至浅黄色的油状物,即为初始中间体,其中,初始中间体的de值为66.7%,以α-取代丙酮化合物计,初始中间体的收率为91%。
在这一步,对还原胺化反应液进行液相质谱测定,液相图谱如图14a所示,从图14a所示出的液相图谱发现在10.183min和11.150min分别出现了两个比较强的吸收峰,且位置临近,但10.183min处吸收峰较11.150min处吸收峰强,可见,还原胺化反应液中10.183min处吸收峰对应的物质为主产品。
另外,对10.183min处吸收峰所对应的物质进行质谱测定,测定结果如图14b所示,对11.150min处吸收峰所对应的物质进行质谱测定,测定结果如图14c所示,对比图14b和图14c可以发现,二者的分子量相同,均为443,因此,可以确定10.183min处吸收峰和11.150min处吸收峰所对应的物质应当是初始中间体的两个异构体。进一步,分析所要制得的初始中间体的物化性质,可以确定,10.183min处吸收峰为该步骤所要制得的初始中间体。
第二步,在10℃时,将初始中间体溶于乙酸乙酯中形成初始中间体溶液,并向其中缓慢滴加乙醇的氯化氢溶液形成手性拆分纯化反应体系,至手性拆分纯化反应体系的ph为6时,向其中加入初始中间体的晶种,析出固体;然后在无水条件下过滤所得到的初始中间体盐酸盐,得到滤饼;其中,初始中间体与氯化氢的摩尔比为1:1.80,初始中间体的晶种的质量分数为3%;
用体积比为4:1的乙酸乙酯和乙醇的混合溶液对滤饼进行3次重结晶,得到手性合格中间体,其中,手性合格中间体的纯度为99%,de值为99%,以初始中间体计算,手性合格中间体的收率为48%。
第三步,将手性合格中间体溶于甲苯中形成手性拆分中间体溶液后,向其中滴加氯甲酸苄酯形成氨基保护反应体系,滴加过程中使氨基保护反应体系的温度保持在30℃,反应1h后,通过薄层色谱监控氨基保护反应进度,其中,手性合格中间体与氯甲酸苄酯的摩尔比为1:1.20;
当氨基保护反应达到反应终点,利用甲苯萃取所得到的氨基保护反应体系中的有机相;
依次用饱和碳酸钠溶液和饱和氯化钠溶液对萃取出的有机相进行洗涤,然后经无水硫酸钠干燥,浓缩得到无色至浅黄色油状物,即为氨基保护的中间体,以手性拆分纯化的中间体计算,氨基保护的中间体的收率为100%。
第四步,将三氯氧磷和二甲基甲酰胺混合制备甲酰化试剂;
将甲酰化试剂与氨基保护中间体混合进行醛化反应,在醛化反应过程中通过薄层色谱监控醛化反应进度;其中,二甲基甲酰胺和三氯氧磷的摩尔比为1:1.95;二甲基甲酰胺和氨基保护中间体的质量比为1:0.3;
当醛化反应达到反应终点,利用乙酸乙酯萃取所得到的醛化反应体系中的有机相;
依次用饱和碳酸钠溶液和饱和氯化钠溶液对萃取出的有机相进行洗涤,并经无水硫酸钠干燥,浓缩得到黄色油状物,即为醛化中间体,以氨基保护中间体计,醛化中间体的收率为100%。
从图15所示出的醛化反应中间体的质谱图可以确认该步骤生成了分子量为605的醛化反应中间体。
第五步,将醛化中间体、盐酸羟胺和吡啶混合进行肟化反应,在肟化反应过程中通过薄层色谱监控肟化反应进度;其中,醛化中间体、盐酸羟胺和吡啶的摩尔比为1:2.60:7.45;
当肟化反应达到反应终点,肟化中间体制备完毕;然后将肟化中间体与乙酸酐混合进行氰化反应,在氰化反应过程中通过薄层色谱监控氰化反应进度;其中,肟化中间体与乙酸酐的摩尔比为1:4.0;
当氰化反应达到反应终点,利用乙酸乙酯萃取所得到的氰化反应体系中的有机相;之后依次用饱和碳酸钠溶液和饱和氯化钠溶液对萃取出的有机相进行洗涤,洗涤完毕后,用无水硫酸钠进行干燥,然后浓缩得到油状物,即为氰化中间体,以肟化中间体计,氰化中间体的收率为82%。
从图16所示出的肟化中间体质谱图,可以确认该步骤制得分子量为620的肟化中间体。
从图17所示出的氰化中间体质谱图,可以确认该步骤制得分子量为602的氰化中间体。
第六步,在氢气条件下,将氰化化合物与钯炭混合进行氨基脱保护反应,在氨基脱保护反应过程中通过薄层色谱监控氨基脱保护反应进度;其中,氰化中间体与钯炭的质量比为1:0.05;
当氨基脱保护反应达到反应终点,过滤氨基脱保护反应体系,得到滤液;将滤液浓缩,得到西洛多辛中间体的游离碱;其中,西洛多辛中间体的游离碱的纯度为98%,以氰化中间体计,西洛多辛中间体的游离碱的收率为95%。
然后,在氮气条件下,向西洛多辛中间体的游离碱中滴加l-酒石酸进行成盐处理;当l-酒石酸滴加完毕后,过滤所得到的成盐处理反应体系,得到滤饼;其中,西洛多辛中间体的游离碱与l-酒石酸的摩尔比为1:0.90;
利用体积比为1:1的丙酮和水混合溶液将滤饼重结晶,得到西洛多辛中间体,以西洛多辛中间体的游离碱计收率为98%。
从图18所示出的西洛多辛中间体的质谱图可以确认本实施例所制备的产品是分子量为364的西洛多辛中间体。
其中,本实施例提供西洛多辛中间体的制备方法所制备的西洛多辛中间体的总收率为33.3%。
实施例二
本实施例提供一种西洛多辛中间体的制备方法,包括:
第一步,将α-取代丙酮化合物溶于四氢呋喃中制成初始溶液,然后向其中加入r-萘乙胺和硼氢化钠,将上述物质在室温下进行搅拌进行还原胺化反应,8小时后通过薄层色谱监控还原胺化反应进度;其中,α-取代丙酮化合物与硼氢化钠的摩尔比为1:1.80,α-取代丙酮化合物与r-萘乙胺的摩尔比为1:1.12;
当还原胺化反应达到反应终点,过滤回收氧化铂反应得到的铂黑,旋蒸回收溶剂四氢呋喃,然后向剩余物中依次加入乙酸乙酯和盐酸萃取所得到的还原胺化反应体系中的有机相;其中,盐酸的浓度为1m;
利用碳酸钠将萃取出的有机相的ph调至9,然后依次用饱和碳酸钠溶液和饱和氯化钠溶液对萃取出的有机相进行洗涤,洗涤完毕后,用无水硫酸钠进行干燥,然后浓缩得到白色至浅黄色的油状物,即为初始中间体,其中,初始中间体的de值为57.5%,以α-取代丙酮化合物计,初始中间体的收率为92%;
第二步,在8℃时,将初始中间体溶于乙酸乙酯中形成初始中间体溶液,并向其中缓慢滴加乙醇的氯化氢溶液形成手性拆分纯化反应体系,至反应体系的ph为6时,向其中加入初始中间体的晶种,析出固体;然后在无水条件下过滤所得到的初始中间体盐酸盐,得到滤饼;其中,手性诱导中间体与氯化氢的摩尔比为1:1.85,初始中间体的晶种的质量分数为5%;
用体积比为4:1的乙酸乙酯和乙醇的混合溶液对滤饼进行3次重结晶,得到手性合格中间体,其中,手性合格中间体的纯度为99%,de值为99%,以初始中间体计算,手性合格中间体的收率为44%。
第三步,将手性合格中间体溶于甲苯中形成手性拆分中间体溶液后,向其中滴加氯甲酸苄酯形成氨基保护反应体系,滴加过程中使氨基保护反应体系的温度保持在30℃,反应1h后,通过薄层色谱监控氨基保护反应进度,其中,手性合格中间体与氯甲酸苄酯的摩尔比为1:1.25;
当氨基保护反应达到反应终点,利用甲苯萃取所得到的氨基保护反应体系中的有机相;
依次用饱和碳酸钠溶液和饱和氯化钠溶液对萃取出的有机相进行洗涤,然后经无水硫酸钠干燥,浓缩得到无色至浅黄色油状物,即为氨基保护的中间体,以手性拆分纯化的中间体计算,氨基保护的中间体的收率为100%。
第四步,将三氯氧磷和二甲基甲酰胺混合制备甲酰化试剂;
将甲酰化试剂与氨基保护中间体混合进行醛化反应,在醛化反应过程中通过薄层色谱监控醛化反应进度;其中,二甲基甲酰胺和三氯氧磷的摩尔比为1:2.00;二甲基甲酰胺和氨基保护中间体的质量比为1:0.4;
当醛化反应达到反应终点,利用乙酸乙酯萃取所得到的醛化反应体系中的有机相;
依次用饱和碳酸钠溶液和饱和氯化钠溶液对萃取出的有机相进行洗涤,并经无水硫酸钠干燥,浓缩得到黄色油状物,即为醛化中间体,以氨基保护中间体计,醛化中间体的收率为100%。
第五步,将醛化中间体、盐酸羟胺和吡啶混合进行肟化反应,在肟化反应过程中通过薄层色谱监控肟化反应进度;其中,醛化中间体、盐酸羟胺和吡啶的摩尔比为1:2.70:7.55;
当肟化反应达到反应终点,肟化中间体制备完毕;然后将肟化中间体与乙酸酐混合进行氰化反应,在氰化反应过程中通过薄层色谱监控氰化反应进度;其中,肟化中间体与乙酸酐的摩尔比为1:4.5;
当氰化反应达到反应终点,利用乙酸乙酯萃取所得到的氰化反应体系中的有机相;之后依次用饱和碳酸钠溶液和饱和氯化钠溶液对萃取出的有机相进行洗涤,洗涤完毕后,用无水硫酸钠进行干燥,然后浓缩得到油状物,即为氰化中间体,以肟化中间体计,氰化中间体的收率为82%。
第六步,在氢气条件下,将氰化化合物与钯炭混合进行氨基脱保护反应,在氨基脱保护反应过程中通过薄层色谱监控氨基脱保护反应进度;其中,氰化中间体与钯炭的质量比为1:0.10;
当氨基脱保护反应达到反应终点,过滤氨基脱保护反应体系,得到滤液;将滤液浓缩,得到西洛多辛中间体的游离碱;其中,西洛多辛中间体的游离碱的纯度为98%,以氰化中间体计,西洛多辛中间体的游离碱的收率为95%。
然后,在氮气条件下,向西洛多辛中间体的游离碱中滴加l-酒石酸进行成盐处理;当l-酒石酸滴加完毕后,过滤所得到的成盐处理反应体系,得到滤饼;其中,西洛多辛中间体的游离碱与l-酒石酸的摩尔比为1:0.95;
利用体积比为1:1的丙酮和水混合溶液将滤饼重结晶,得到西洛多辛中间体。以西洛多辛中间体的游离碱计收率为98%。
其中,本实施例提供西洛多辛中间体的制备方法所制备的西洛多辛中间体的总收率为30.9%。
实施例三
本实施例提供一种西洛多辛中间体的制备方法,包括:
第一步,在氢气条件下,将α-取代丙酮化合物溶于四氢呋喃中制成初始溶液,然后向其中加入雷尼镍和r-苯甘氨醇,将上述物质在室温下搅拌进行还原胺化反应,8小时后通过薄层色谱监控还原胺化反应进度;其中,α-取代丙酮化合物与雷尼镍的质量比为1:0.1%,α-取代丙酮化合物与r-苯甘氨醇的摩尔比为1:1.0;
当还原胺化反应达到反应终点,旋蒸回收溶剂四氢呋喃,然后向剩余物中依次加入乙酸乙酯和盐酸萃取所得到的还原胺化反应体系中的有机相;其中,盐酸的浓度为1m;
利用碳酸钠将萃取出的有机相的ph调至9,然后依次用饱和碳酸钠溶液和饱和氯化钠溶液对萃取出的有机相进行洗涤,洗涤完毕后,用无水硫酸钠进行干燥,然后浓缩得到白色至浅黄色的油状物,即为初始中间体,其中,初始中间体的de值为66.7%,以α-取代丙酮化合物计,初始中间体的收率为92%;
第二步,将初始中间体溶于甲苯中形成初始中间体溶液后,向其中滴加氯甲酸苄酯形成氨基保护反应体系,滴加过程中使氨基保护反应体系的温度保持在30℃,反应1h后,通过薄层色谱监控氨基保护反应进度,其中,初始中间体与氯甲酸苄酯的摩尔比为1:1.30;
当氨基保护反应达到反应终点,利用甲苯萃取所得到的氨基保护反应体系中的有机相;
依次用饱和碳酸钠溶液和饱和氯化钠溶液对萃取出的有机相进行洗涤,然后经无水硫酸钠干燥,浓缩得到无色至浅黄色油状物,即为氨基保护的中间体,以手性拆分纯化的中间体计算,氨基保护的中间体的收率为100%。
第三步,将三氯氧磷和二甲基甲酰胺混合制备甲酰化试剂;
将甲酰化试剂与氨基保护中间体混合进行醛化反应,在醛化反应过程中通过薄层色谱监控醛化反应进度;其中,二甲基甲酰胺和三氯氧磷的摩尔比为1:2.15;二甲基甲酰胺和氨基保护中间体的质量比为1:0.35;
当醛化反应达到反应终点,利用乙酸乙酯萃取所得到的醛化反应体系中的有机相;
依次用饱和碳酸钠溶液和饱和氯化钠溶液对萃取出的有机相进行洗涤,并经无水硫酸钠干燥,浓缩得到黄色油状物,即为醛化中间体,以氨基保护中间体计,醛化中间体的收率为100%。
第四步,将醛化中间体、盐酸羟胺和吡啶混合进行肟化反应,在肟化反应过程中通过薄层色谱监控肟化反应进度;其中,醛化中间体、盐酸羟胺和吡啶的摩尔比为1:1.50:5.45;
当肟化反应达到反应终点,肟化中间体制备完毕;然后将肟化中间体与乙酸酐混合进行氰化反应,在氰化反应过程中通过薄层色谱监控氰化反应进度;其中,肟化中间体与乙酸酐的摩尔比为1:3.0;
当氰化反应达到反应终点,利用乙酸乙酯萃取所得到的氰化反应体系中的有机相;之后依次用饱和碳酸钠溶液和饱和氯化钠溶液对萃取出的有机相进行洗涤,洗涤完毕后,用无水硫酸钠进行干燥,然后浓缩得到油状物,即为氰化中间体,以肟化中间体计,氰化中间体的收率为82%。
第五步,在氢气条件下,将氰化化合物与钯炭混合进行氨基脱保护反应,在氨基脱保护反应过程中通过薄层色谱监控氨基脱保护反应进度;其中,氰化中间体与钯炭的质量比为1:0.15;
当氨基脱保护反应达到反应终点,过滤氨基脱保护反应体系,得到滤液;将滤液浓缩,得到西洛多辛中间体的游离碱;其中,西洛多辛中间体的游离碱的纯度为98%,以氰化中间体计,西洛多辛中间体的游离碱的收率为95%。
然后,在氮气条件下,向西洛多辛中间体的游离碱中滴加l-酒石酸进行成盐处理;当l-酒石酸滴加完毕后,过滤所得到的成盐处理反应体系,得到滤饼;其中,西洛多辛中间体的游离碱与l-酒石酸的摩尔比为1:1.10;利用体积比为1:1的丙酮和水混合溶液将滤饼重结晶,得到西洛多辛中间体。以西洛多辛中间体的游离碱计收率为65%。
其中,本实施例提供西洛多辛中间体的制备方法所制备的西洛多辛中间体的总收率为46.5%。
表1西洛多辛中间体的总收率结果
由表1可以看出,本发明实施例制得的西洛多辛中间体的收率(以α-取代丙酮中间体计算)在30.9%-46.5%的范围内,远大于采用现有技术制得的西洛多辛中间体的收率。
另外,对比实施例一至三可以发现,实施例一和实施例二最后一步的收率都达到了98%,而实施例三最后一步的收率只有65%,也就是说,实施例三最后一步的收率是三个实施例中最低的,但是实施例三的总收率却是三个实施例中最高的,究其原因可以发现:实施例一和实施例二虽然对初始中间体进行手性拆分,但这也使得初始中间体中的手性合格中间体损失比较大,从而导致西洛多辛中间体的总收率比较低。而实施例三在制备西洛多辛中间体时,跳过对初始中间体的手性纯化,直接对初始中间体进行氨基保护反应、醛化反应、肟化反应、氰化反应、氨基脱保护反应后,在最后一步对氨基脱保护反应所得到的西洛多辛中间体的游离碱进行手性纯化,使得西洛多辛中间体的总收率得到提高。
表2西洛多辛中间体的纯度结果
从西洛多辛中间体的制备过程来看,实施例一和二制备西洛多辛中间体经过了两次手性纯化(第一次是对初始中间体的手性拆分的过程,第二次是利用l-酒石酸第西洛多辛中间体的游离碱成盐处理的过程),而实施例三制备西洛多辛中间体经过了一次手性纯化(利用l-酒石酸第西洛多辛中间体的游离碱成盐处理的过程),这使得实施例一和二所制备的西洛多辛中间体的手性纯度高于实施例三所制备的西洛多辛中间体的手性纯度,但从表2所列出的数据可以发现,虽然实施例三所制备的西洛多辛中间体的手性纯度相对较低,但是只有2%的差距,如此小的差距在制备西洛多辛时,并不会对西洛多辛的制备产生大的影响。另外,从表2可以看出,虽然实施例一和二,与实施例三制备西洛多辛中间体的过程有所差别,但所制备的西洛多辛中间体的化学纯度都在99.5%。
在上述实施方式的描述中,具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!