一种Gal‑1‑预处理IEC诱导免疫耐受细胞模型的制作方法
本发明属于机体免疫技术领域,尤其涉及一种gal-1-预处理iec诱导免疫耐受细胞模型。
背景技术:
免疫耐受是指机体免疫系统接受某种抗原作用后产生的特异性的免疫无应答状态。对特异性抗原产生免疫耐受的个体,再次接触该抗原刺激后,不发生免疫应答或不能发生用常规方法可检测到免疫应答。因此正常的免疫耐受机制对维持机体健康至关重要。目前对免疫耐受产生的机制还不十分明了。虽然近年来国际上和国内对损害免疫耐受的因素研究进展很快,但对于使已经形成的免疫耐受损伤的恢复及其导致的疾病的康复还远不能令人满意。动物实验和临床研究表明,免疫耐受失常和多种疾病的发病有关,例如过敏性疾病(如哮喘、食物过敏),自身免疫性疾病(如糖尿病、系统性红斑狼疮)以及某些非特异性炎症病(如炎症性肠病)等。这些疾病的发病人数众多,每年治疗这些疾病的医疗费用耗资巨大。因此,由于免疫耐受失常而引起的疾病对人类的健康和社会经济有重大的负面影响。gal-1是凝集素家族成员之一。凝集素(lectins)是一类非抗体、对糖蛋白上的糖类具有高度特异性的结合蛋白;具有凝集细胞和沉淀聚糖的作用。在哺乳动物体内已发现15种gal亚型。由于免疫细胞表面富含糖蛋白,gal-1能通过和糖蛋白(例如t细胞受体,cd45,cd43,cd7,cd3,cd2,前b细胞受体等)结合而调节免疫细胞的功能。研究表明,gal-1能调节dc的活性,增强il-10的表达,引起t细胞凋亡,使treg活化,为treg的免疫抑制功能所必需,调节b细胞的生命周期,诱导长寿浆母细胞(llpc)表达免疫耐受分子tgf-β。哮喘病人体内gal-1的水平下降;结肠炎小鼠肠粘膜中gal-1显著减少。食物过敏小鼠的免疫细胞gal-1含量显著降低,并和血清tnf-α水平呈负相关关系(p<0.01);哮喘病人和慢性结肠炎也有这些现象。tnf-α可以抑制gal-1在免疫细胞中表达。受gal-1作用后,iec可表达tgf-β,对微生物产物引起的炎症反应(如分泌il-8)也明显降低。目前对免疫调节细胞的诱导集中在直接用免疫调节剂作用于幼稚t细胞或b细胞;以产生非特异性免疫调节细胞。
综上所述,现有技术存在的问题是:由于免疫耐受失常而引起的疾病对人类的健康和社会经济有重大的负面影响,疗效不佳。现有的免疫调节细胞诱导方法诱导出来的是非特异性的免疫调节细胞。
技术实现要素:
针对现有技术存在的问题,本发明提供了一种gal-1-预处理iec诱导免疫耐受细胞模型。
本发明是这样实现的,一种gal-1-预处理iec诱导免疫耐受细胞模型,所述gal-1-预处理iec诱导免疫耐受细胞模型为:将gal-1和特异性抗原同时作用于iec;使之在处理抗原信息时,同时产生tgf-β;特异性抗原信息和tgf-β同时作用于树突状细胞(dc)时,会诱导产生调节性dc;作用于幼稚t细胞或b细胞时,会诱导产生抗原特异性调节性t细胞和抗原特异性调节性b细胞;抗原特异性调节性t细胞和抗原特异性调节性b细胞可以特异性地杀死引起炎症的t细胞和b细胞;从而使抗原特异性炎症终止,使疾病痊愈。
本发明的另一目的在于一种所述gal-1-预处理iec诱导免疫耐受细胞模型的建立方法,所述gal-1-预处理iec诱导免疫耐受细胞模型的建立方法包括以下步骤:
步骤一,il-10和tgf-β缺陷iec分别用相应的shrna试剂盒制备;用免疫印迹法检测基因沉默效果;
步骤二,培养iec(正常组,il-10缺陷组和tgf-β缺陷组),加gal-1,或gal-1+ova,分别用1μg/ml;或只用培养液,培养48小时;
步骤三,取正常小鼠脾脏,用磁珠抗体法分离th0细胞;
步骤四,制备骨髓来源的dc;
步骤五,收集iec,和th0细胞或骨髓来源的dc共培养(质量比为1:1);诱导treg时,培养液中加il-2等促进淋巴细胞激活的试剂;
步骤六,培养5-9天后,收集细胞,用facs检测培养的细胞中耐受性dc,treg和其它teff细胞的比率;用cfse稀释法检测诱导的treg对其它效应t细胞增殖的抑制作用。
进一步,所述th0细胞为cd3+cd4+cd25-。
进一步,所述iec:th0或dc=0~5:10。
进一步,在收集细胞前3个小时在培养液中加蛋白转运抑制剂。
本发明的优点及积极效果为:模型诱导出抗原特异性调节性t细胞,恢复病人体内的抗原特异性免疫耐受,从而抑制过敏反应。本发明将采用免疫耐受失常所致的疾病中最常见的疾病,过敏性疾病,作为模型;采用sit作为调节免疫耐受功能的方法来调节过敏肠粘膜的免疫耐受状态,阐明了sit的免疫耐受调节作用机制;同时对缩短sit的疗程、进一步提高sit的疗效提出新的策略。三联剂可能显著提高sit对过敏性疾病的疗效;是一种全新的、以去除发病原因为基础的、使失常的免疫耐受机制恢复正常的方法。
本发明gal-1(i型半乳凝集素)-预处理iec(肠上皮细胞)诱导免疫耐受细胞模型,包括:il-10(白介素10)和tgf-β(转化生长因子β)缺陷iec分别用相应的shrna(发夹型小rna)试剂盒制备;培养iec;取正常小鼠脾脏,用磁珠抗体法分离th0细胞;制备骨髓来源的dc(树突状细胞);收集iec,和th0细胞或骨髓来源的dc共培养;诱导treg(调节性t细胞)时,培养液中加il-2等促进淋巴细胞激活的试剂;培养5-9天,收集细胞,用facs(流式细胞术)检测培养细胞中耐受性dc,treg和其它teff(效应性t细胞)细胞的比率;用cfse(绿色荧光染料)稀释法检测诱导的treg对其它效应t细胞增殖的抑制作用。可以用于抑制肠粘膜过敏性炎症,同时抑制过敏性炎症。
本发明不仅仅可以用于抑制肠粘膜过敏性炎症,同时也可用抑制其它系统的过敏性炎症,如哮喘、过敏性皮炎等。
附图说明
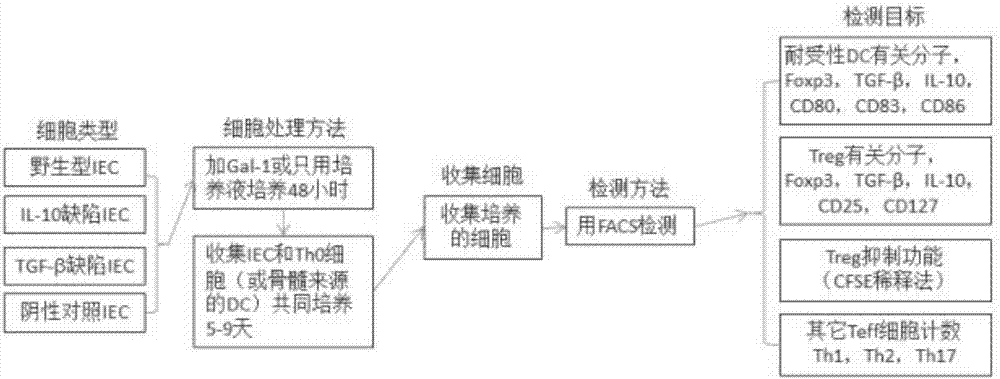
图1是本发明实施提供的gal-1-预处理iec诱导免疫耐受细胞模型的建立方法流程图。
图2是本发明实施提供的gal-1-预处理iec诱导免疫耐受细胞模型的建立方法实现流程图。
图3是本发明实施提供的gal-1诱导iec表达tgf-β示意图。
图4是本发明实施提供的gal-1维持iec对微生物产物(lps)的耐受状况示意图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
下面结合附图对本发明的应用原理作详细的描述。
本发明实施例提供的gal-1-预处理iec诱导免疫耐受细胞模型为:将gal-1和特异性抗原同时作用于iec;使之在处理抗原信息时,同时产生tgf-β;特异性抗原信息和tgf-β同时作用于树突状细胞(dc)时,会诱导产生调节性dc;作用于幼稚t细胞或b细胞时,会诱导产生抗原特异性调节性t细胞和抗原特异性调节性b细胞;抗原特异性调节性t细胞和抗原特异性调节性b细胞可以特异性地杀死引起炎症的t细胞和b细胞;从而使抗原特异性炎症终止,使疾病痊愈。
如图1所示,本发明实施例提供的gal-1-预处理iec诱导免疫耐受细胞模型的建立方法包括以下步骤:
s101:il-10和tgf-β缺陷iec分别用相应的shrna试剂盒制备;用免疫印迹法检测基因沉默效果;
s102:培养iec,加gal-1或只用培养液,培养48小时;
s103:取正常小鼠脾脏,用磁珠抗体法:分离th0细胞;
s104:制备骨髓来源的dc;
s105:收集iec,和th0细胞或骨髓来源的dc共培养;诱导treg时,培养液中加il-2等促进淋巴细胞激活的试剂;
s106:培养5-9天后,收集细胞,用facs检测培养的细胞中耐受性dc,treg和其它teff细胞的比率;用cfse稀释法检测诱导的treg对其它效应t细胞(teff细胞)增殖的抑制作用。
本发明实施例提供的gal-1-预处理iec诱导免疫耐受细胞模型的建立方法具体包括以下步骤:
1:用gal-1调节iec的共刺激分子表达水平
iec有抗原呈递功能(biochembiophysrescommun),可直接启动免疫反应或诱导免疫耐受(clinexpimmunol)。gal-1可能参与了诱导口服耐受,吸收抗原可以增强iec的gal-1表达。因为共刺激分子表达水平和免疫耐受的诱导密切相关,推测gal-1可能使iec共刺激分子的表达下调。因此,计划在细胞培养液中用gal-1刺激iec后,检测iec的共刺激分子的表达水平;包括cd80,cd83,cd86和tim4(t细胞ig粘液区段4)等。
2:用gal-1刺激后,测定iec分泌的免疫耐受分子
iec有诱导免疫耐受的功能(clinexpimmunol);但调节这种功能的因素还不完全清楚。gal-1在诱导免疫耐受功能中可能有重要作用。因为免疫耐受分子是诱导免疫耐受的介质,计划用gal-1预处理iec后,检测iec中除了tgf-β以外的(已发现gal-1可以诱导iec产生tgf-β)与免疫耐受诱导有关的分子表达水平,如il-10,整合素vβ6,泛素a20等。以此来测定gal-1对iec的免疫耐受特性的调节作用。
3:gal-1将微生物刺激转换为对iec的免疫耐受刺激信号
肠道中存在多种微生物及其产物;iec和它们直接接触,但能很好地耐受;说明生理状态下某些因素在调节iec对微生物的耐受。根据(图4)的提示,gal-1可能是iec对微生物的刺激产生耐受的必需物质。因此,用gal-1和微生物产物【如lps,葡萄球菌肠毒素b(seb),霍乱毒素等】混合后,加入培养液刺激iec;然后检测iec分泌的致炎细胞因子,如ifn-,tnf-,il-8等(单独用微生物产物刺激没经过免疫耐受诱导的iec会上调这些分子的表达),和免疫耐受的细胞因子,如il-10,tgf-β,vβ6,泛素a20等(预期gal-1会使这些分子在iec的表达上调)。
4:gal-1预处理的iec诱导产生耐受性dc
gal-1能和肠上皮细胞表面的fcriib结合成复合物。iec表达tgf-β;提示经gal-1刺激后,iec可能通过产生tgf-β而具备诱导产生耐受性dc的功能。如上所述,用gal-1预处理iec;然后收集iec,制备骨髓来源的dc,将两种细胞共培养;5-9天后检测耐受性dc的形成状况。
5:gal-1预处理的iec诱导产生treg
用gal-1预处理iec;然后收集iec和th0细胞共培养;5-9天后检测th0细胞分化为treg的数量。和对照组比较后,评价gal-1刺激后的iec诱导产生treg的能力。为了明确iec是否还促使其它cd4t细胞亚型产生,还将同时检测t细胞群中th1、th17和th2细胞的数量。il-10和tgf-β是诱导产生treg的主要介质分子;为了明确是哪一个分子或两种分子都参与了诱导产生treg,另设一批同样步骤的实验,用基因沉默的方法使iec的il-10或tgf-β的基因沉默。然后检测treg的数量。
6:特异性抗原预处理的iec使抗原特异性t细胞凋亡
gal-1可引起t细胞凋亡(nature)。iec具有抗原呈递功能(curropingastroenterol)。的前期结果表明用抗原刺激iec能使iec产生gal-1升高5倍。激活t细胞受体可以启动t细胞的凋亡程序引起t细胞凋亡。根据这些资料,推测iec吸收特异性抗原后,可能将处理的抗原和产生的gal-1同时传递给抗原特异性t细胞,由抗原引起的t细胞受体激活和gal-1的协同作用,增强引起抗原特异性t细胞凋亡的效应。在这一部分实验中,计划用ova预处理的iec(用gal-1基因沉默的iec作对照)和ova-特异性cd4t细胞共同培养;然后检测cd4t细胞的凋亡状况。为了确定iec调节t细胞凋亡是否需要细胞-细胞接触,将设置另一个实验;用通透性隔离腔培养装置(transwell)将iec和t细胞用一层半透膜隔开,其它实验步骤同上。
下面结合实验对本发明的应用原理作进一步的描述。
1、实验设计原理:gal-1作用于iec使之表达tgf-β(图3),后者能诱导产生免疫耐受细胞。
2、实验条件:
(1)il-10和tgf-β缺陷iec分别用相应的shrna试剂盒(从santacruz生物制品公司购买)按产品说明书步骤制备;用免疫印迹法检测基因沉默效果。
(2)培养iec,加gal-1或只用培养液,培养48小时。
(3)取正常小鼠脾脏,用磁珠抗体法(macs)分离th0细胞(cd3+cd4+cd25-)。
(4)制备骨髓来源的dc。
(5)收集iec,和th0细胞(或骨髓来源的dc)共培养【iec:th0(或dc)=0~5:10】。诱导treg时,培养液中还将加il-2等促进淋巴细胞激活的试剂。
(6)培养5-9天后,收集细胞,用facs检测培养的细胞中耐受性dc,treg和其它teff细胞的比率;用cfse稀释法检测诱导的treg对其它效应t细胞(teff细胞)增殖的抑制作用。为了提高facs检测效率,在收集细胞前3个小时在培养液中加蛋白转运抑制剂(如brefeldina)。
制备骨髓来源的dc;基因沉默;免疫细胞的磁珠抗体分离术(macs);facs;cfse稀释法。实验室已经建立这些实验方案。
备选方案:细胞共培养时间,各种细胞的比例,加进培养液中试剂的浓度可根据实验结果调整。必要时提高对iec刺激的gal-1的浓度,或把gal-1加进iec和t细胞的共培养体系中。
如图3所示,gal-1诱导iec表达tgf-β。根据文献报道肠上皮细胞表达tgf-β(mediatorsinflamm2013;2013:436894),检测了iec-6细胞株tgf-β的表达水平。在只用培养液培养时,检测到iec表达低含量的tgf-β。加gal-1培养48小时后,iec的tgf-β表达显著升高,并和gal-1的浓度呈量效关系。a,直方图显示iec的tgf-βmrna水平(用qrt-pcr检测)。b,免疫印迹显示iec的tgf-β蛋白含量;下方的直方图表示免疫印迹的图像分析结果。直方图数据用平均值±标准差表示。*,p<0.01,和培养液组比较。shrna:fcriibshrna。cshrna:对照shrna。本实验重复3次。
如图4所示,gal-1维持iec对微生物产物(lps)的耐受状况。野生型和gal-1-d(gal-1缺陷)的iec经lps刺激24小时,用培养液洗3次,再加lps培养48小时。收集细胞,提取rna和蛋白;用实时rt-pcr(qrt-pcr)和免疫印迹法检测。a,直方图显示il-8mrna水平。b,免疫印迹显示il-8蛋白水平。c,收集培养液,用elisa检测。直方图显示培养液中il-8蛋白水平。d,gal-1基因沉默结果。iec用gal-1shrna试剂盒处理。基因沉默结果用免疫印迹法测定。cshrna是对照shrna试剂。直方图数据用平均值±标准差表示。*,p<0.01,与正常对照组比较。本实验重复3次。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!