抗PD‑L1纳米抗体及其应用的制作方法
本发明涉及生物医学或生物制药技术领域,更具体地涉及针对pd-l1的纳米抗体及其编码序列和用途。
背景技术:
程序性死亡因子1配体1(programmeddeath1ligand1,pd-l1)又称cd274,为b7家族成员,是pd-1的配体。pd-l1属于i型跨膜蛋白,共290个氨基酸,包含1个igv样区、1个igc样区、1个跨膜疏水区和1个由30个氨基酸组成的胞内区。
与其他b7家族分子不同的是,pd-l1具有负向调节免疫应答的作用。研究发现,pd-l1主要表达于活化的t细胞、b细胞、巨噬细胞和树突状细胞等,除淋巴细胞外,pd-l1也表达于其他多种组织如胸腺、心脏、胎盘等的内皮细胞,以及各类非淋巴系如黑色素瘤、肝癌、胃癌、肾细胞癌、卵巢癌、结肠癌、乳腺癌、食道癌、头颈癌等。pd-l1在调节自身反应性t、b细胞和免疫耐受方面具有一定广泛性,并且在外周组织t和b细胞应答起作用。pd-l1在肿瘤细胞上的高表达与癌症患者的不良预后相关。
与pd-l1相结合的程序性死亡因子1(programmeddeath-1,pd-1)又称cd279,是cd28家族成员,其胞质区含有2个酪氨酸残基,靠近n端的1个位于免疫受体酪氨酸抑制基序(immunoreceptortyrosine-basedinhibitorymotif,itim)中,靠近c端的1个位于免疫受体酪氨酸转化基序(immunoreceptortyrosine-basedswitchmotif,itsm)中。pd-1主要表达在活化的t淋巴细胞、b淋巴细胞和巨噬细胞表面。在正常情况下,pd-1能够抑制t淋巴细胞的功能,促进treg的功能,从而抑制自身免疫应答,防止自身免疫性疾病的发生。但在肿瘤的发生中,肿瘤细胞表达的pd-l1与pd-1结合后却能通过对淋巴细胞的抑制性作用促进肿瘤的免疫逃逸。pd-l1与pd-1的结合可导致多种生物学变化,引起免疫调控,如能够抑制淋巴细胞的增殖和活化、抑制cd4+t细胞向th1和th17细胞分化、抑制炎性细胞因子的释放等。
单克隆抗体在癌症的检测及生物靶向治疗方面成功的应用,引起了肿瘤治疗的变革。然而,传统的单抗(150kd)分子质量过大,难穿透组织,造成肿瘤区域的有效浓度较低,治疗效果不充分;传统的抗体具有很高的免疫原性,而改造的抗体很难达到原来的亲和力。此外,完全人源化的传统抗体开发周期长,生产成本高,稳定性不够等诸多因素限制其在临床中的应用及普及。
纳米抗体是目前最小的抗体分子,其分子量是普通抗体的1/10。纳米抗体除具备单克隆抗体的抗原反应性外,还拥有一些独特的功能特性,如分子质量小,稳定性强、可溶性好、易表达、免疫原性弱、穿透性强、靶向性强、人源化简单,制备成本低廉等,几乎完美克服了传统抗体开发周期长,稳定性较低,保存条件苛刻等缺陷。
然而,目前本领域尚缺乏令人满意的针对pd-l1的纳米抗体。因此,本领域迫切需要开发新的有效针对pd-l1的特异性纳米抗体。
技术实现要素:
本发明的目的就是提供一类有效针对pd-l1的特异性纳米抗体。
在本发明的第一方面,提供了一种种抗pd-l1纳米抗体vhh链的互补决定区cdr区,所述vhh链的互补决定区cdr由seqidno:5所示的cdr1、seqidno:6所示的cdr2,seqidno:7所示的cdr3组成。
在另一优选例中,所述的cdr1、cdr2和cdr3由vhh链的框架区fr1、fr2、fr3和fr4所隔开。
本发明第二方面,提供了一种抗pd-l1纳米抗体的vhh链,所述vhh链包括框架区fr和本发明第一方面所述的互补决定区cdr,所述的框架区fr由
(a)seqidno:1所示的fr1,seqidno:2所示的fr2,seqidno:3所示的fr3,seqidno:4所示的fr4组成;或
(b)seqidno:10所示的fr1,seqidno:11所示的fr2,seqidno:12所示的fr3,seqidno:13所示的fr4组成。
在另一优选例中,所述的抗pd-l1纳米抗体的vhh链如seqidno.:8或14所示。
本发明第三方面,提供了一种抗pd-l1纳米抗体,它是针对pd-l1表位的纳米抗体,并且具有如seqidno.:8或seqidno.:14中所示的氨基酸序列的vhh链。
本发明第四方面,提供了一种多核苷酸,所述多核苷酸编码选自下组的蛋白质:本发明第一方面所述的抗pd-l1纳米抗体vhh链的cdr区、本发明第二方面所述的抗pd-l1纳米抗体的vhh链、或本发明第三方面所述的抗pd-l1纳米抗体。
在另一优选例中,所述多核苷酸具有如seqidno.:9或15所示的核苷酸序列。
在另一优选例中,所述的多核苷酸包括dna或rna。
本发明第五方面,提供了一种表达载体,所述表达载体含有本发明第四方面所述的多核苷酸。
本发明第六方面,提供了一种宿主细胞,所述宿主细胞含有本发明第五方面所述的表达载体,或其基因组中整合有本发明第四方面所述的多核苷酸。
在另一优选例中,所述的宿主细胞包括原核细胞或真核细胞。
在另一优选例中,所述的宿主细胞选自下组:大肠杆菌、酵母细胞。
本发明七方面,提供了一种产生抗pd-l1纳米抗体的方法,包括步骤:
(a)在适合产生纳米抗体的条件下,培养本发明第六方面所述的宿主细胞,从而获得含所述抗pd-l1纳米抗体的培养物;以及
(b)从所述培养物中分离或回收所述的抗pd-l1纳米抗体。
在另一优选例中,所述的抗pd-l1纳米抗体具有如seqidno.:8或14所示的氨基酸序列。
本发明第八方面,提供了一种免疫偶联物,该免疫偶联物含有:
(a)如本发明第二方面所述的抗pd-l1纳米抗体的vhh链、或如本发明第三方面所述的抗pd-l1纳米抗体;和
(b)选自下组的偶联部分:可检测标记物、药物、毒素、细胞因子、放射性核素、或酶。
在另一优选例中,所述偶联部分为药物或毒素。
在另一优选例中,所述偶联部分为可检测标记物。
在另一优选例中,所述偶联物选自:荧光或发光标记物、放射性标记物、mri(磁共振成像)或ct(电子计算机x射线断层扫描技术)造影剂、或能够产生可检测产物的酶、放射性核素、生物毒素、细胞因子(如il-2等)、抗体、抗体fc片段、抗体scfv片段、金纳米颗粒/纳米棒、病毒颗粒、脂质体、纳米磁粒、前药激活酶(例如,dt-心肌黄酶(dtd)或联苯基水解酶-样蛋白质(bphl))、化疗剂(例如,顺铂)或任何形式的纳米颗粒等。
在另一优选例中,所述免疫偶联物含有:多价(如二价)的如本发明第二方面所述的抗pd-l1纳米抗体的vhh链、如本发明第三方面所述的抗pd-l1纳米抗体。
在另一优选例中,所述多价是指,在所述免疫偶联物的氨基酸序列中包含多个重复的如本发明第二方面所述的抗pd-l1纳米抗体的vhh链、本发明第三方面所述的抗pd-l1纳米抗体。
本发明第九方面,提供了本发明第三方面所述的抗pd-l1纳米抗体的用途,用于制备(a)用于检测pd-l1分子的试剂;(b)用于治疗肿瘤的药物。
在另一优选例中,所述的检测包括流式检测、细胞免疫荧光检测。
本发明第十方面,提供了一种药物组合物,含有:
(i)本发明第一方面抗pd-l1纳米抗体vhh链的互补决定区cdr、本发明第二方面所述的抗pd-l1纳米抗体的vhh链、或如本发明第三方面所述的抗pd-l1纳米抗体、或本发明第八方面所述的免疫偶联物;以及
(ii)药学上可接受的载体。
在另一优选例中,所述的药物组合物为注射剂型。
在另一优选例中,所述的药物组合物用于制备治疗肿瘤的药物,所述的肿瘤选自下组:胃癌、肝癌、白血病、肾脏肿瘤、肺癌、小肠癌、骨癌、前列腺癌、结直肠癌、乳腺癌、大肠癌、前列腺癌、宫颈癌、淋巴癌、肾上腺肿瘤、或膀胱肿瘤。
本发明第十一方面,提供了本发明第三方面所述抗pd-l1纳米抗体的一种或多种的用途:
(i)用于检测人pd-l1分子;
(ii)用于流式检测;
(iii)用于细胞免疫荧光检测;
(iv)用于治疗肿瘤;
(v)用于肿瘤诊断。
在另一优选例中,所述用途为非诊断的和非治疗的。
本发明第十二方面,提供了一种重组蛋白,所述的重组蛋白具有:
(i)如本发明第二方面所述的重链可变区vhh的序列或如本发明第三方面所述的纳米抗体的序列;以及
(ii)任选的协助表达和/或纯化的标签序列。
在另一优选例中,所述的标签序列包括6his标签和ha标签
在另一优选例中,所述的重组蛋白特异性结合于pd-l1蛋白。
本发明第十三方面,提供了如本发明第二方面所述的vhh链、如本发明第三方面所述的纳米抗体、或本发明第八方面所述的免疫偶联物的用途,它们被用于制备药剂、试剂、检测板或试剂盒;
其中,所述试剂、检测板或试剂盒用于:检测样品中pd-l1蛋白;
其中,所述药剂用于治疗或预防表达pd-l1蛋白(即pd-l1阳性)的肿瘤。
在另一优选例中,所述肿瘤包括:胃癌、淋巴瘤、肝癌、白血病、肾脏肿瘤、肺癌、小肠癌、骨癌、前列腺癌、结直肠癌、乳腺癌、大肠癌、前列腺癌、或肾上腺肿瘤。
本发明第十四方面,提供了一种检测样品中pd-l1蛋白的方法,所述方法包括步骤:
(1)将样品与本发明第三方面所述的纳米抗体接触;
(2)检测是否形成抗原-抗体复合物,其中形成复合物就表示样品中存在pd-l1蛋白。
本发明第十五方面,提供了一种治疗疾病的方法,所述方法包括,给需要的对象施用本发明第三方面所述的纳米抗体或本发明第八方面所述的免疫偶联物。
在另一优选例中,所述的对象包括哺乳动物,如人。
本发明第十六方面,提供了一种抗pd-l1纳米抗体vhh链的框架区fr,所述的vhh链的框架区fr由seqidno:1所示的fr1,seqidno:2所示的fr2,seqidno:3所示的fr3,seqidno:4所示的fr4组成。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1是抗原蛋白及纳米抗体纯化sds-page图,图中a为核酸分子标准,b为纯化的hpd-l1(ecd)-fc蛋白,c为用tev酶酶切去除fc标签蛋白后纯化的hpd-l1(ecd)蛋白,d为表达纯化的pd-l1nb-fc蛋白,e为生物素化的pd-1-fc蛋白,以上蛋白均由hek293f细胞表达。
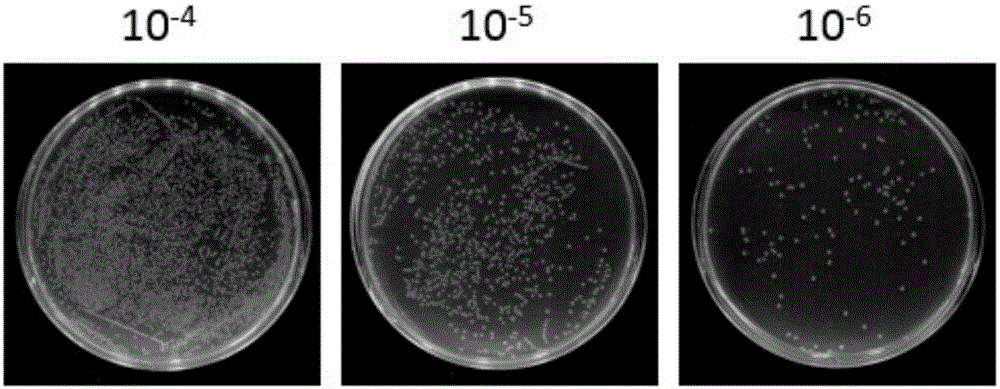
图2是构建文库的库容检测图,构建好的文库被梯度稀释后涂板,图中显示取1/5梯度稀释104倍、105倍、106倍的克隆数目,计算单克隆数确定文库大小。
图3是构建文库的插入率检测图,是构建的纳米抗体文库的插入率检测结果,从左到右凝胶孔的dna条带分别是:第一道为dna分子标记,其余孔道为检测插入片段的pcr产物,pcr产物带约为500bp;经检测,该文库的插入率达到95.8%。
图4是pd-l1纳米抗体筛选富集过程,经第一轮淘选后未出现富集,第二轮淘选出现4倍富集,第三轮淘选出现210倍富集。
图5是1株由大肠杆菌表达pd-l1纳米抗体的纯化图,对应seqidno.8氨基酸序列的纳米抗体,是经镍柱树脂凝胶亲和层析纯化后,pd-l1纳米抗体的sds-page的电泳图。结果显示,pd-l1纳米抗体经过该纯化过程,其纯度可达到90%以上。
图6是facs检测pd-l1纳米抗体的阻断效果,用瞬转表达人全长pd-l1蛋白的hek293f细胞与各组纳米抗体和生物素化的hpd-1-fc蛋白共反应。
图7是真核表达人源化pd-l1纳米抗体纯化图,由hek293f细胞表达四种人源化的pd-l1纳米抗体,其中a为蛋白分子标准,b、为由seqidno.10氨基酸序列编码的humanizedpd-l1nb蛋白,表达的该抗体含有fc标签蛋白,蛋白纯度达到90%以上。
图8是facs检测人源化pd-l1纳米抗体的阻断效果,用天然表达pd-l1蛋白的ebc-1细胞与人源化纳米抗体和生物素化的hpd-1-fc蛋白共反应,可见由空白组及阴性对照组中pd-1-fc-生物素与ebc-1细胞的结合率在90%以上,而加入pd-l1纳米抗体和人源化纳米抗体后,pd-1-fc-生物素与ebc-1细胞的结合率仅在10%以下,这表明加入的纳米抗体能够明显阻断pd-1与pd-l1的相互作用。
图9是pd-l1纳米抗体亲和力测定结果,用biacoret200测定pd-l1纳米抗体的亲和力,可见人源化前人源化前纳米抗体的亲和力为2.34×10-9m,人源化后的纳米抗体的亲和力为2.26×10-9m。人源化改造并未影响抗体的亲和力。
图10是elisa检测pd-l1纳米抗体的特异性结果,可见人源化前后的pd-l1纳米抗体只与人源及猴源的pd-l1相互作用,不与鼠源及pd-l1家族其他成员发生相互作用,两株纳米抗体具有较好的特异性。
图11显示了moa法检测纳米抗体对pd-1/pd-l1相互作用的抑制作用,其中人源化前的纳米抗体基本都比阳性对照组抗体活性强,人源化后本发明纳米抗体的活性则与阳性对照组相当。
图12显示了本发明的纳米抗体以及人源化改造后的抗体均可有效激活t细胞,且激活效果和阳性对照组抗体相似。
图13显示了本发明纳米抗体肿瘤抑制活性研究中的给药方式。
图14显示了接种了人源化nb-fc的小鼠,其肿瘤体积相对于对照组得到了很好的控制,并没有出现显著增加的情况,说明人源化nb-fc有明显的肿瘤抑制作用。
图15显示了本发明人源化nb-fc具有和对照抗体更优的可溶性。
图16显示人源化nb-fc的纯度没有明显变化。
图17显示人源化nb-fc和cho-pdl1细胞的结合没有明显变化。
具体实施方式
本发明人通过广泛而深入的研究,经过大量的筛选,成功获得一类抗pd-l1纳米抗体,实验结果表明,本发明获得的pd-l1纳米抗体能够有效阻断pd-l1与pd-1之间的相互作用,令人意外的是,经本发明人源化后的pd-l1纳米抗体更能够有效阻断pd-l1与pd-1的结合,且经biacoret200鉴定,人源化后的pd-l1纳米抗体亲和力高,稳定性好,且肿瘤抑制作用显著。在此基础上完成了本发明。
具体地,本发明利用人源的pd-l1抗原蛋白免疫骆驼,获得高质量的免疫纳米抗体基因文库。然后将pd-l1蛋白分子偶联在酶标板上,展示pd-l1蛋白的正确空间结构,以此形式的抗原利用噬菌体展示技术筛选免疫纳米抗体基因库(骆驼重链抗体噬菌体展示基因库),从而获得了pd-l1特异性的纳米抗体基因。再将此基因转至大肠杆菌中,从而获得了能在大肠杆菌中高效表达的、且特异性高的纳米抗体株。
如本文所用,术语“本发明纳米抗体”、“本发明的抗pd-l1纳米抗体”、“本发明pd-l1纳米抗体”可互换使用,均指特异性识别和结合于pd-l1(包括人pd-l1)的纳米抗体。特别优选的是vhh链的氨基酸序列如seqidno.:8或14所示的纳米抗体。
如本文所用,术语“抗体”或“免疫球蛋白”是有相同结构特征的约150000道尔顿的异四聚糖蛋白,其由两个相同的轻链(l)和两个相同的重链(h)组成。每条轻链通过一个共价二硫键与重链相连,而不同免疫球蛋白同种型的重链间的二硫键数目不同。每条重链和轻链也有规则间隔的链内二硫键。每条重链的一端有可变区(vh),其后是多个恒定区。每条轻链的一端有可变区(vl),另一端有恒定区;轻链的恒定区与重链的第一个恒定区相对,轻链的可变区与重链的可变区相对。特殊的氨基酸残基在轻链和重链的可变区之间形成界面。
如本文所用,术语“单域抗体(vhh)”、“纳米抗体”(nanobody)具有相同的含义,指克隆抗体重链的可变区,构建仅由一个重链可变区组成的单域抗体(vhh),它是具有完整功能的最小的抗原结合片段。通常先获得天然缺失轻链和重链恒定区1(ch1)的抗体后,再克隆抗体重链的可变区,构建仅由一个重链可变区组成的单域抗体(vhh)。
如本文所用,术语“可变”表示抗体中可变区的某些部分在序列上有所不同,它形成了各种特定抗体对其特定抗原的结合和特异性。然而,可变性并不均匀地分布在整个抗体可变区中。它集中于轻链和重链可变区中称为互补决定区(cdr)或超变区中的三个片段中。可变区中较保守的部分称为构架区(fr)。天然重链和轻链的可变区中各自包含四个fr区,它们大致上呈β-折叠构型,由形成连接环的三个cdr相连,在某些情况下可形成部分β折叠结构。每条链中的cdr通过fr区紧密地靠在一起并与另一链的cdr一起形成了抗体的抗原结合部位(参见kabat等,nihpubl.no.91-3242,卷i,647-669页(1991))。恒定区不直接参与抗体与抗原的结合,但是它们表现出不同的效应功能,例如参与抗体的依赖于抗体的细胞毒性。
如本领域技术人员所知,免疫偶联物及融合表达产物包括:药物、毒素、细胞因子(cytokine)、放射性核素、酶和其他诊断或治疗分子与本发明的抗体或其片段结合而形成的偶联物。本发明还包括与所述的抗pd-l1蛋白抗体或其片段结合的细胞表面标记物或抗原。
如本文所用,术语“重链可变区”与“vh”可互换使用。
如本文所用,术语“可变区”与“互补决定区(complementaritydeterminingregion,cdr)”可互换使用。
在本发明的一个优选的实施方式中,所述抗体的重链可变区包括包括三个互补决定区cdr1、cdr2、和cdr3。
在本发明的一个优选的实施方式中,所述抗体的重链包括上述重链可变区和重链恒定区。
在本发明中,术语“本发明抗体”、“本发明蛋白”、或“本发明多肽”可互换使用,都指特异性结合pd-l1蛋白的多肽,例如具有重链可变区的蛋白或多肽。它们可含有或不含起始甲硫氨酸。
本发明还提供了具有本发明抗体的其他蛋白质或融合表达产物。具体地,本发明包括具有含可变区的重链的任何蛋白质或蛋白质偶联物及融合表达产物(即免疫偶联物及融合表达产物),只要该可变区与本发明抗体的重链可变区相同或至少90%同源性,较佳地至少95%同源性。
一般,抗体的抗原结合特性可由位于重链可变区的3个特定的区域来描述,称为可变区域(cdr),将该段间隔成4个框架区域(fr),4个fr的氨基酸序列相对比较保守,不直接参与结合反应。这些cdr形成环状结构,通过其间的fr形成的β折叠在空间结构上相互靠近,重链上的cdr和相应轻链上的cdr构成了抗体的抗原结合位点。可以通过比较同类型的抗体的氨基酸序列来确定是哪些氨基酸构成了fr或cdr区域。
本发明抗体的重链的可变区特别令人感兴趣,因为它们中至少部分涉及结合抗原。因此,本发明包括那些具有带cdr的抗体重链可变区的分子,只要其cdr与此处鉴定的cdr具有90%以上(较佳地95%以上,最佳地98%以上)的同源性。
本发明不仅包括完整的抗体,还包括具有免疫活性的抗体的片段或抗体与其他序列形成的融合蛋白。因此,本发明还包括所述抗体的片段、衍生物和类似物。
如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持本发明抗体相同的生物学功能或活性的多肽。本发明的多肽片段、衍生物或类似物可以是(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的,或(ii)在一个或多个氨基酸残基中具有取代基团的多肽,或(iii)成熟多肽与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽,或(iv)附加的氨基酸序列融合到此多肽序列而形成的多肽(如前导序列或分泌序列或用来纯化此多肽的序列或蛋白原序列,或与6his标签形成的融合蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。
本发明抗体指具有pd-l1蛋白结合活性的、包括上述cdr区的多肽。该术语还包括具有与本发明抗体相同功能的、包含上述cdr区的多肽的变异形式。这些变异形式包括(但并不限于):一个或多个(通常为1-50个,较佳地1-30个,更佳地1-20个,最佳地1-10个)氨基酸的缺失、插入和/或取代,以及在c末端和/或n末端添加一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在c末端和/或n末端添加一个或数个氨基酸通常也不会改变蛋白质的功能。该术语还包括本发明抗体的活性片段和活性衍生物。
该多肽的变异形式包括:同源序列、保守性变异体、等位变异体、天然突变体、诱导突变体、在高或低的严紧度条件下能与本发明抗体的编码dna杂交的dna所编码的蛋白、以及利用抗本发明抗体的抗血清获得的多肽或蛋白。
本发明还提供了其他多肽,如包含纳米抗体或其片段的融合蛋白。除了几乎全长的多肽外,本发明还包括了本发明纳米抗体的片段。通常,该片段具有本发明抗体的至少约50个连续氨基酸,较佳地至少约50个连续氨基酸,更佳地至少约80个连续氨基酸,最佳地至少约100个连续氨基酸。
在本发明中,“本发明抗体的保守性变异体”指与本发明抗体的氨基酸序列相比,有至多10个,较佳地至多8个,更佳地至多5个,最佳地至多3个氨基酸被性质相似或相近的氨基酸所替换而形成多肽。这些保守性变异多肽最好根据表1进行氨基酸替换而产生。
表1
本发明还提供了编码上述抗体或其片段或其融合蛋白的多核苷酸分子。本发明的多核苷酸可以是dna形式或rna形式。dna形式包括cdna、基因组dna或人工合成的dna。dna可以是单链的或是双链的。dna可以是编码链或非编码链。
编码本发明的成熟多肽的多核苷酸包括:只编码成熟多肽的编码序列;成熟多肽的编码序列和各种附加编码序列;成熟多肽的编码序列(和任选的附加编码序列)以及非编码序列。
术语“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
本发明还涉及与上述的序列杂交且两个序列之间具有至少50%,较佳地至少70%,更佳地至少80%相同性的多核苷酸。本发明特别涉及在严格条件下与本发明所述多核苷酸可杂交的多核苷酸。在本发明中,“严格条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2×ssc,0.1%sds,60℃;或(2)杂交时加有变性剂,如50%(v/v)甲酰胺,0.1%小牛血清/0.1%ficoll,42℃等;或(3)仅在两条序列之间的相同性至少在90%以上,更好是95%以上时才发生杂交。并且,可杂交的多核苷酸编码的多肽与成熟多肽有相同的生物学功能和活性。
本发明的抗体的核苷酸全长序列或其片段通常可以用pcr扩增法、重组法或人工合成的方法获得。一种可行的方法是用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。此外,还可将重链的编码序列和表达标签(如6his)融合在一起,形成融合蛋白。
一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。本发明所涉及的生物分子(核酸、蛋白等)包括以分离的形式存在的生物分子。
目前,已经可以完全通过化学合成来得到编码本发明蛋白(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。
本发明还涉及包含上述的适当dna序列以及适当启动子或者控制序列的载体。这些载体可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属;鼠伤寒沙门氏菌的细菌细胞;真菌细胞如酵母;果蝇s2或sf9的昆虫细胞;cho、cos7、293细胞的动物细胞等。
用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的步骤在本领域众所周知。另一种方法是使用mgcl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔,脂质体包装等。
获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。
在上面的方法中的重组多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。
本发明的抗体可以单独使用,也可与可检测标记物(为诊断目的)、治疗剂、pk(蛋白激酶)修饰部分或任何以上这些物质的组合结合或偶联。
用于诊断目的可检测标记物包括但不限于:荧光或发光标记物、放射性标记物、mri(磁共振成像)或ct(电子计算机x射线断层扫描技术)造影剂、或能够产生可检测产物的酶。
可与本发明抗体结合或偶联的治疗剂包括但不限于:1.放射性核素;2.生物毒;3.细胞因子如il-2等;4.金纳米颗粒/纳米棒;5.病毒颗粒;6.脂质体;7.纳米磁粒;8.前药激活酶(例如,dt-心肌黄酶(dtd)或联苯基水解酶-样蛋白质(bphl));10.化疗剂(例如,顺铂)或任何形式的纳米颗粒等。
药物组合物
本发明还提供了一种组合物。优选地,所述的组合物是药物组合物,它含有上述的抗体或其活性片段或其融合蛋白,以及药学上可接受的载体。通常,可将这些物质配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中ph通常约为5-8,较佳地ph约为6-8,尽管ph值可随被配制物质的性质以及待治疗的病症而有所变化。配制好的药物组合物可以通过常规途径进行给药,其中包括(但并不限于):瘤内、腹膜内、静脉内、或局部给药。
本发明的药物组合物可直接用于结合pd-l1蛋白分子,因而可用于治疗肿瘤。此外,还可同时使用其他治疗剂。
本发明的药物组合物含有安全有效量(如0.001-99wt%,较佳地0.01-90wt%,更佳地0.1-80wt%)的本发明上述的纳米抗体(或其偶联物)以及药学上可接受的载体或赋形剂。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。药物制剂应与给药方式相匹配。本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。药物组合物如针剂、溶液宜在无菌条件下制造。活性成分的给药量是治疗有效量,例如每天约10微克/千克体重-约50毫克/千克体重。此外,本发明的多肽还可与其他治疗剂一起使用。
使用药物组合物时,是将安全有效量的免疫偶联物施用于哺乳动物,其中该安全有效量通常至少约10微克/千克体重,而且在大多数情况下不超过约50毫克/千克体重,较佳地该剂量是约10微克/千克体重-约10毫克/千克体重。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
标记的纳米抗体
在本发明的一个优选例中,所述纳米抗体带有可检测标记物。更佳地,所述的标记物选自下组:同位素、胶体金标记物、有色标记物或荧光标记物。
胶体金标记可采用本领域技术人员已知的方法进行。在本发明的一个优选的方案中,抗pd-l1的纳米抗体用胶体金标记,得到胶体金标记的纳米抗体。
本发明的抗pd-l1纳米抗体具有很好的特异性,很高的效价。
检测方法
本发明还涉及检测pd-l1蛋白的方法。该方法步骤大致如下:获得细胞和/或组织样本;将样本溶解在介质中;检测在所述溶解的样本中pd-l1蛋白的水平。本
在本发明的检测方法中,所使用的样本没有特别限制,代表性的例子是存在于细胞保存液中的含细胞的样本。
试剂盒
本发明还提供了一种含有本发明的抗体(或其片段)或检测板的试剂盒,在本发明的一个优选例中,所述的试剂盒还包括容器、使用说明书、缓冲剂等。
本发明还提供了用于检测pd-l1水平的检测试剂盒,该试剂盒包括识别pd-l1蛋白的抗体,用于溶解样本的裂解介质,检测所需的通用试剂和缓冲液,如各种缓冲液、检测标记、检测底物等。该检测试剂盒可以是体外诊断装置。
应用
如上所述,本发明的纳米抗体有广泛生物应用价值和临床应用价值,其应用涉及到与pd-l1相关的疾病的诊断和治疗、基础医学研究、生物学研究等多个领域。一个优选的应用是用于针对pd-l1的临床诊断和靶向治疗。
本发明的主要优点包括:
(a)本发明纳米抗体高特异性针对人的具有正确空间结构的pd-l1蛋白。
(b)本发明纳米抗体的亲和力强。
(c)本发明纳米抗体的生产简便。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
实施例1:人pd-l1蛋白的表达纯化
(1)将人pd-l1的核苷酸序列合成在pcdna3.1(-)载体(购自invivogen)上,然后将其胞外段序列亚克隆至pfuse-igg1载体(购自invitrogen)上,其中在hpd-l1(ecd)的c端引入一个tev酶切位点,便于制备无fc标签的hpd-l1(ecd)蛋白;
(2)用omega质粒大提试剂盒提取构建好的pfμse-igg1-hpd-l1(ecd)质粒;
(3)培养hek293f细胞至od为2.0×106个/ml;
(4)将质粒与转染试剂pei1:3混合均匀后静置20min,然后加入到hek293f细胞中,37℃,6%co2摇床培养箱中培养5-6天;
(5)收集细胞上清,与proteina珠子在室温下结合1小时;
(6)用磷酸盐缓冲液ph7.0洗涤珠子后,再用0.1mph3.0glycine洗脱蛋白;
(7)将洗脱的蛋白超滤至pbs中,测定产量后取样进行sds-page检测(检测结果如图1b所示),其余蛋白保存于-80℃冰箱;
(8)将表达的hpd-l1(ecd)-fc蛋白进行酶切,用0.1mgtev酶酶切1mghpd-l1(ecd)-fc蛋白,4℃酶切16小时,将蛋白液流过镍柱,再流过proteina柱子,收集流出液,取样进行sds-page检测(检测结果如图1c所示)。
实施例2:pd-l1纳米抗体文库的构建
(1)将1mghpd-l1(ecd)-fc抗原与弗氏佐剂等体积混合,免疫一只新疆双峰驼,每周一次,共免疫7次,刺激b细胞表达抗原特异性的纳米抗体;
(2)7次免疫结束后,提取100ml骆驼外周血淋巴细胞并提取总rna;
(3)合成cdna并利用套式pcr扩增vhh;
(4)利用限制性内切酶psti及noti酶切20μgpmecs噬菌体展示载体(购自biovector)及10μgvhh并连接两个片段;
(5)将连接产物转化至电转感受态细胞tg1中,构建pd-l1纳米抗体文库并测定库容,库容大小为1.3×109cfμ(结果如图2所示)。
与此同时,随机挑取24颗克隆进行菌落pcr检测,结果表明所建文库的插入率为100%,图3显示菌落pcr结果。
实施例3:pd-l1纳米抗体的筛选及鉴定
抗体筛选:
(1)将溶解在100mmnahco3、ph8.2中的10μghpd-l1(ecd)抗原偶联在nunc酶标板上,4℃放置过夜;
(2)第二天加入100μl0.1%bsa,室温封闭2h;
(3)2h后,加入100μl噬菌体(2×1011cfμ免疫骆驼纳米抗体噬菌展示基因库),室温作用1h;
(4)用0.05%pbs+tween-20洗5遍,以洗掉非特异的噬菌体;
(5)用100mm三乙醇胺将与pd-l1特异性结合的噬菌体解离下,并感染处于对数期生长的大肠杆菌tg1细胞,37℃培养1h,产生并纯化噬菌体用于下一轮的筛选,相同筛选过程重复3轮,其富集结果如图4所示。
用噬菌体的酶联免疫方法(elisa)筛选特异性单个阳性克隆:
(1)从上述2-3轮筛选后含有噬菌体的细胞培养皿中,挑选96个单个菌落并接种于含有100μg/ml的氨苄青霉素的tb培养基(1升tb培养基中含有2.3gkh2po4,12.52gk2hpo4,12g蛋白胨,24g酵母提取物,4ml甘油)中,生长至对数期后,加终浓度1mm的iptg,28℃培养过夜。
(2)利用渗透法获得粗提抗体,并将抗体转移到经抗原包被的elisa板中,在室温下放置1小时。
(3)用pbst洗去未结合的抗体,加入抗鼠抗ha抗体(购自北京康为世纪生物科技有限公司),在室温下放置1小时。
(4)用pbst洗去未结合的抗体,加入山羊抗小鼠碱性磷酸酶标记抗体,在室温下放置1小时。
(5)用pbst洗去未结合的抗体,加入碱性磷酸酶显色液,于elisa仪上,在405nm波长,读取吸收值。
(6)当样品孔od值大于对照孔od值3倍以上时(ratio+/->3),判为阳性克隆孔。
(7)将阳性克隆孔的菌转摇在含有100μg/ml的lb液体中以便提取质粒并进行测序。
实施例4:纳米抗体在宿主菌大肠杆菌中表达、纯化:
(1)将前面测序分析所获克隆株的质粒电转化到大肠杆菌wk6中,并将其涂布在la+glucose即含有氨苄青霉素和葡萄糖的培养平板上,37℃培养过夜;
(2)挑选单个菌落接种在5ml含有氨苄青霉素的lb培养液中,37℃摇床培养过夜;
(3)接种1ml的过夜菌种至330mltb培养液中,37℃摇床培养,培养到od值达到0.6-1时,加入iptg,28℃摇床培养过夜;
(4)离心,收菌;
(5)利用渗透法,获得抗体粗提液;
(6)经镍柱离子亲和层析制备纯度达90%以上的纳米抗体,纯化结果如图5所示。
实施例5:流式细胞术检测纳米抗体的阻断功能
(1)制备hpd-1-fc-biotin蛋白(hpd-1-fc制备方法同实施例1,sds-page检测结果如图1e所示),蛋白生物素的方法参照生物素试剂说明书;
(2)每个样品取1×106个瞬转表达人pd-l1全长蛋白的hek293f细胞重悬于0.5%bsa-pbs缓冲液中,加入上述纯化的pd-l1纳米抗体10μg,同时设置阴性对照(higg1)和空白组(pbs),所有样本加入5μghpd-1-fc-生物素,4℃孵育20min;
(3)pbs洗涤2次细胞,加入ebioscience的sa-pe,4℃孵育20min,pbs洗涤2次细胞后用流式细胞仪(bdfacscalibur)检测检测结果如图6所示。
pd-l1纳米抗体的人源化改造
(1)首先以seqidno.:8所示的pd-l1纳米抗体序列为模板在结构数据库中同源结构的搜索,共搜寻到1306个结构,取其中evalue=0.0并且序列等同性≥70%的34个结构;
(2)对这34个结构进行结构比对,并依据晶体结构分辨率大小和构建的进化树,最终选取包括3dwt在内的9个蛋白,进行基于seqidno.:8所示的pd-l1纳米抗体序列的多模板同源模建,最终获得的10个结构,再依据打分函数的高低排序,选取molpdf最低的结构,继续下面的工作;
(3)对模建的最优结构,利用protsa服务器计算残基的溶剂可接触性,即残基的折叠态相对于去折叠态的溶剂可接触面积的比值为判据,取大于40%的残基为暴露于溶剂外的残基;
(4)对模建的最优结构和dp-47进行序列比对,替换相应的暴露于溶剂的残基。最终确定出一种人源化pd-l1纳米抗体,由seqidno.14所示的氨基酸序列编码。人源化前后抗体序列对应如下表2:
表2
人源化前后抗体骨架区与dp-47骨架区的同源性比较如下表3:
表3
实施例6:moa法检测抗pd-l1纳米抗体的活性
本实验采用已经上市的两种市售可得的抗pd-l1抗体(atezolizumab,ate和durvalumab,dur)作为阳性对照抗体,使用moa检测细胞株(promega),通过检测荧光报告基因的表达反应出nfat信号的激活情况,从而检测抗体(序列见实施例5)对pd-1/pd-l1结合的抑制作用。步骤如下:
(1)活性检测前一天铺chok1-pdl1细胞:chok1-pdl1前1-2天传代。弃培养上清,pbs洗涤。加入适量胰酶于37℃/5%co2消化3-5min。加入4倍胰酶体积的培养基,转移细胞至50ml离心管并计数。取所需体积细胞,230g,离心10min。加入培养基,重悬细胞至4×105个细胞/ml。将细胞加入96孔白色细胞培养板,100μl/孔。边孔加入pbs,200μl/孔。细胞于37℃/5%co2培养箱中培养过夜。
(2)处理jurkat-pd1细胞:活性检测前两天进行细胞传代。计数后取所需体积细胞,170g,离心5min。用assaybuffer重悬细胞至1.25×106个细胞/ml。
(3)加入样品和jurkat-pd1细胞至检测板:弃95μl/孔chok1-pdl1细胞上清。加入40μl样品(杂交瘤上清或梯度稀释的杂交瘤上清纯化抗体)及阳性对照、阴性对照。加入40μljurkat-pd1细胞。于37℃/5%co2培养箱中培养6小时。
(4)检测:提前将bio-glotmbuffer融化,加入bio-glotmsubstrate,混匀。6小时后,加入bio-glotmreagent,80μl/孔。室温放置5-10min。读数。
实验结果如表4及图11所示,在各浓度下,本发明人源化前的纳米抗体基本都比阳性对照组抗体活性强,人源化后本发明纳米抗体的活性则与阳性对照组相当。因此nb-fc和人源化nb-fc抗体均可以有效阻断pd1/pd-l1的相互作用。
表4
实施例7:人源化pd-l1纳米抗体在真核细胞hek293中的表达及纯化
(1)将人源化前及人源化后的pd-l1nb序列合成至pfuse-igg1载体(购自invivogen)上,用omega质粒大提试剂盒提取pfuse-igg1-nb(人源化)质粒;
(2)培养hek293f细胞至od为2.0×106个/ml;
(3)将质粒与转染试剂pei1:3混合均匀后静置20min,然后加入到hek293f细胞中,37℃,6%co2摇床培养箱中培养5-6天;
(4)收集细胞上清,与proteina珠子在室温下结合1小时;
(5)用磷酸盐缓冲液ph7.0洗涤珠子后,再用0.1mph3.0glycine洗脱蛋白;
(6)将洗脱的蛋白超滤至pbs中,测定产量后取样进行sds-page检测(检测结果如图1d和图7所示),其余蛋白保存于-80℃冰箱,图7可见纯化后的人源化纳米抗体纯度达到90%以上。
实施例8:流式细胞术检测人源化pd-l1纳米抗体的阻断功能
方法同实施例5:
(1)每个样品取2×105个天然表达pd-l1的人肺癌细胞系ebc-1重悬于0.5%bsa-pbs缓冲液中,加入10μg纯化的人源化pd-l1纳米抗体,同时设置阴性对照(higg1)和空白组(pbs),所有样本加入5μghpd-1-fc-生物素,4℃孵育20min;
(2)pbs洗涤2次细胞,加入ebioscience的sa-pe,4℃孵育20min,pbs洗涤2次细胞后上机检测,检测结果如图8所示:由空白组及阴性对照组可以看出pd-1-fc-生物素与ebc-1细胞的结合率在90%以上,而加入pd-l1纳米抗体和人源化纳米抗体后,pd-1-fc-生物素与ebc-1细胞的结合率在10%以下,这表明加入的纳米抗体能够明显阻断pd-1与pd-l1的相互作用。
实施例9:纳米抗体亲和力测定
用biacoret200进行检测,(1)固定:利用羧基氨基反应将固定相抗原固定在cm-5传感芯片表面;
(2)结合:将抗体用hbs缓冲液稀释成适当浓度(五个浓度梯度),观察抗原抗体结合过程;
(3)芯片再生:进行下一个抗体测定时用10mmglycine冲洗进行再生。
(4)实验结果分析,测定结果如图9所示,人源化前纳米抗体的亲和力为2.34×10-9m,人源化后的纳米抗体的亲和力为2.26×10-9m。人源化改造并未影响抗体的亲和力。
实施例10:酶联免疫法(elisa)鉴定纯化的纳米抗体的特异性:
(1)通过常规方法将人源化前及人源化后的纳米抗体进行生物素化;
(2)包被抗原蛋白pd-l1(人)、pd-l1(鼠)、pd-l1(猴子)、pd-l2(人)、b7h4(人)、b7h3(人):每孔0.5μg(5μg/ml,100μl),包被igg1为对照,4℃过夜;
(3)第二天用pbst洗涤3次,加入200μl的1%bsa室温下封闭2小时;
(4)将每株生物素化的纳米抗体稀释至10μg/ml,分别取100μl与各孔孵育,室温下反应1小时;
(5)用pbst洗去未结合的抗体,加入100μlstreptavidin-hrp(1:1000稀释),在室温下放置1小时;
(6)加入显色液,于elisa仪上,在450nm波长,读取吸收值。根据吸收值判断纳米抗体的特异性,检测结果如图10所示:人源化前后的纳米抗体均能够与人源和猴源的pd-l1相互作用,而不与鼠源的pd-l1相互作用,两株抗体具有较好的种属特异性;且人源化前后的纳米抗体均不与pd-l1家族成员相互作用,具有较好的家族特异性。
实施例11:混合淋巴细胞实验
本实验将抗体和体外培养的、来源于不同供体的成熟dc细胞及cd4+t细胞共同孵育,通过检测体系中il2和ifn-γ的相对表达量,从而反应出不同抗体对t细胞的激活作用。步骤如下:
(1)pbmc分离:取捐赠者新鲜血液50ml,添加2.5倍pbs,轻轻加入到ficoll(thermo)12.5ml分4管,400g,30min离心,0减速度停止。吸取中间白色条带至pbs(gibco)中,pbs洗2次。
(2)dc细胞分离:取分离的pbmc细胞添加5mlt细胞培养基,37℃、6%co2、贴壁培养2hr,吸取悬浮细胞液做cd4+细胞分离,剩下细胞添加3mldc培养基,培养2天后添加3mldc培养基,再培养第5天,然后添加rtnfa(r&dsystems)(1000u/ml),il-1b(r&dsystems)(5ng/ml),il-6(r&dsystems)(10ng/ml)和1μmpge2(tocris)培养2天,作为淋巴细胞混合反应(mlr)的dc细胞。
(3)cd4+细胞分离:pbmc静置培养2hr,吸取悬浮的细胞液至15ml离心管中,200g离心10min,沉淀加入500μl分离液、100μlab型血清、100μl纯化抗体重悬,4℃孵育20min,用分离液清洗一次,再加入500μlbeadbuffer孵育15min,磁场去除bead,t细胞培养基洗一次,使用8ml培养基重悬,37℃、6%co2培养。(按照‘humancd4+tcellenrichmentkit’(19052,stemcell)说明书操作)。
(3)mlr实验:将成熟后的dc细胞与cd4+细胞混合,每孔体积200μl,dc细胞10000个,cd4+细胞100000个,加入抗体,dc、t细胞、mlr作为阴性对照,dc+t细胞+anti-cd3/cd28磁珠作为阳性对照,混合培养5天,cisbio试剂盒(humanil2kit1000test、humanifngamma1000test)检测il2、ifn-gamma浓度。
实验结果如图12所示,本发明的纳米抗体(序列见实施例5)刺激供体产生的细胞因子均高于阳性对照,而经人源化后,所产生的细胞因子与阳性对照相当,因此,本发明的纳米抗体以及人源化改造后的抗体均可有效激活t细胞,且激活效果和阳性对照组抗体相似。
实施例12抗pd-l1纳米抗体的肿瘤抑制活性研究
本实验采用表达人pd-l1的mc38细胞(mc38-pdl1)(南京银河公司)在pd-l1转基因小鼠测定人源化nb-fc的抗肿瘤作用。首先采用皮下接种的方式建立mc38-pdl1荷瘤小鼠模型,成瘤后分组,给予不同抗体(序列见实施例5)和不同剂量的治疗,监测给药期间各组小鼠瘤体积和体重变化,给药频率为2次/周,监测频率均为2次/周,连续监测5周,给药剂量和方式如表5及图13所示。
表5
步骤如下:
1)mc38/pd-l1细胞悬液制备:以pbs(1×)分散mc38细胞,细胞密度为1×107个/ml,制备成mc38细胞悬液;
2)接种:25只c57bl/6背景的pd-l1小鼠右侧背部剃毛,皮下注射mc38/pd-l1细胞1×106个/0.1ml/只。肿瘤细胞接种6天后检测各只小鼠瘤体积,挑选出瘤体积在87.4mm3~228.4mm3范围内的25只小鼠按瘤体积平均分组。
3)给药:见图13。
4)检测:每次给药前和测定体重和肿瘤体积,记录重量。采用电子天平测定体重,每周2次。
5)肿瘤体积测定:采用游标卡尺测定肿瘤的最大长轴(l)和最大宽轴(w),肿瘤体积按如下公式计算:v=l×w2/2。
实验结果如图14所示,随着时间的推移,接种了人源化nb-fc的小鼠,其肿瘤体积相对于对照组得到了很好的控制,并没有出现显著增加的情况,说明人源化nb-fc有明显的肿瘤抑制作用。
实施例13.peg沉淀法检测抗体的可溶性
本实验利用peg沉淀的方法,通过检测备选抗体(序列见实施例5)在不同浓度的peg中的溶解情况,反应了抗体的可溶性。步骤如下:
1)浓缩抗体样品至5mg/ml。
2)在96孔细胞培养板中加样,每孔40μl抗体样品,终浓度1mg/ml。第1至12列分别加入30%peg26.7μl、40μl、46.7μl、53.3μl、60μl、66.7μl、73.3μl、80μl、86.7μl、93.3μl、100μl、106.7μl,ibi301buffer补足至总体积200μl。peg浓度梯度分别为4%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%。
3)室温放置1hr,测od500nm。
研究结果如表6及图15所示,人源化nb-fc均在8%(w/v)peg时出现浑浊,而对照抗体(已经上市的药物humira)在6%(w/v)peg时出现浑浊,表明本发明人源化nb-fc具有比对照抗体更优的可溶性。
表6
实施例14.加速稳定性实验测定
本实验通过检测抗体(序列见实施例5)在40℃放置30天之后的纯度及生物学活性的变化,从而评价该抗体的长期热稳定性。使用sec的方法测定了目的抗体在40℃放置0、14及30天后的纯度,实验结果如表7及图16所示,人源化nb-fc的纯度没有明显变化。本实验利用facs方法检测了加速稳定性实验样品和cho-pdl1细胞的结合情况,步骤如下:
1)细胞准备:将cho-pdl1细胞计数,并稀释至2×106个细胞/ml,向u型底96孔板中加入100μl/孔,第一列孔补加50μl;
2)检测步骤:第一孔加入抗体,终浓度200nm,混匀,吸取50μl至第二孔,依次类推,阴性对照为iggcontrol。冰浴20min。加pbs100μl/孔,400g5min去除上清,pbs洗细胞1遍。加1:100稀释的goatanti-humanigg-pe(ebioscience)100μl/孔,冰浴20min,400g离心5min去除上清,加pbs100μl/孔清洗1次,用100μlpbs重悬,facs检测。
实验结果如图17所示,人源化nb-fc和cho-pdl1细胞的结合没有明显变化。研究结果表明,人源化nb-fc具有较好的热稳定性。
表7
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>信达生物制药(苏州)有限公司
<120>抗pd-l1纳米抗体及其应用
<130>p2017-1228
<150>cn201610634596.x
<151>2016-08-04
<160>15
<170>patentinversion3.5
<210>1
<211>25
<212>prt
<213>骆驼(cameluslinnaeus)
<400>1
glnvalglnleuglngluserglyglyglyservalglnalaglygly
151015
serleuargleusercysglnalaser
2025
<210>2
<211>15
<212>prt
<213>骆驼(cameluslinnaeus)
<400>2
trppheargglnalaproglylysglnarggluglyvalalaala
151015
<210>3
<211>38
<212>prt
<213>骆驼(cameluslinnaeus)
<400>3
sertyrseraspservallysglyargphethrileserleuglyasn
151015
alalysasnthrleutyrleuglumetasnserleulysprogluasp
202530
thralamettyrtyrcys
35
<210>4
<211>11
<212>prt
<213>骆驼(cameluslinnaeus)
<400>4
trpglyglnglythrglnvalthrvalserser
1510
<210>5
<211>10
<212>prt
<213>骆驼(cameluslinnaeus)
<400>5
alatyrthrileserargasnsermetgly
1510
<210>6
<211>7
<212>prt
<213>骆驼(cameluslinnaeus)
<400>6
ilegluseraspglyserthr
15
<210>7
<211>26
<212>prt
<213>骆驼(cameluslinnaeus)
<400>7
alaalaprolysvalglyleuglyproargthralaleuglyhisleu
151015
alaphemetthrleuproalaleuasntyr
2025
<210>8
<211>132
<212>prt
<213>骆驼(cameluslinnaeus)
<400>8
glnvalglnleuglngluserglyglyglyservalglnalaglygly
151015
serleuargleusercysglnalaseralatyrthrileserargasn
202530
sermetglytrppheargglnalaproglylysglnarggluglyval
354045
alaalailegluseraspglyserthrsertyrseraspservallys
505560
glyargphethrileserleuglyasnalalysasnthrleutyrleu
65707580
glumetasnserleulysprogluaspthralamettyrtyrcysala
859095
alaprolysvalglyleuglyproargthralaleuglyhisleuala
100105110
phemetthrleuproalaleuasntyrtrpglyglnglythrglnval
115120125
thrvalserser
130
<210>9
<211>396
<212>dna
<213>骆驼(cameluslinnaeus)
<400>9
caggtgcagctgcaggagtctgggggaggctcggtacaggctggagggtctctgagactc60
tcctgtcaagcctctgcatacaccatcagtagaaactccatgggctggttccgccaggct120
ccagggaagcagcgcgagggggtcgcagctattgaaagtgatggcagcacaagttactca180
gactccgtcaagggccgattcaccatctccttaggcaacgccaagaacactctgtatctg240
gaaatgaacagcctgaaacctgaggacactgccatgtactactgcgcggcgccgaaggtg300
ggcctgggccctaggactgctttaggccatcttgcatttatgaccttaccagccctaaac360
tactggggccagggaacccaggtcaccgtctcctca396
<210>10
<211>25
<212>prt
<213>人工序列
<220>
<223>人源化fr1
<400>10
glnvalglnleuglngluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaser
2025
<210>11
<211>15
<212>prt
<213>人工序列
<220>
<223>人源化fr2
<400>11
trppheargglnalaproglylysglyleugluglyvalalaala
151015
<210>12
<211>38
<212>prt
<213>人工序列
<220>
<223>人源化fr3
<400>12
sertyrseraspservallysglyargphethrileserleuaspasn
151015
serlysasnthrleutyrleuglumetasnserleuargalagluasp
202530
thralavaltyrtyrcys
35
<210>13
<211>11
<212>prt
<213>人工序列
<220>
<223>人源化fr4
<400>13
trpglyglnglythrleuvalthrvalserser
1510
<210>14
<211>132
<212>prt
<213>人工序列
<220>
<223>人源化vhh
<400>14
glnvalglnleuglngluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaseralatyrthrileserargasn
202530
sermetglytrppheargglnalaproglylysglyleugluglyval
354045
alaalailegluseraspglyserthrsertyrseraspservallys
505560
glyargphethrileserleuaspasnserlysasnthrleutyrleu
65707580
glumetasnserleuargalagluaspthralavaltyrtyrcysala
859095
alaprolysvalglyleuglyproargthralaleuglyhisleuala
100105110
phemetthrleuproalaleuasntyrtrpglyglnglythrleuval
115120125
thrvalserser
130
<210>15
<211>396
<212>dna
<213>人工序列
<220>
<223>人源化vhh
<400>15
caggtgcagctgcaggagagcggcggcggcctggtgcagcccggcggcagcctgaggctg60
agctgcgccgccagcgcctacaccatcagcaggaacagcatgggctggttcaggcaggcc120
cccggcaagggcctggagggcgtggccgccatcgagagcgacggcagcaccagctacagc180
gacagcgtgaagggcaggttcaccatcagcctggacaacagcaagaacaccctgtacctg240
gagatgaacagcctgagggccgaggacaccgccgtgtactactgcgccgcccccaaggtg300
ggcctgggccccaggaccgccctgggccacctggccttcatgaccctgcccgccctgaac360
tactggggccagggcaccctggtgaccgtgagcagc396
- 还没有人留言评论。精彩留言会获得点赞!