一种法罗培南钠的制备方法与流程
本发明涉及药物化学领域,具体涉及一种法罗培南钠的制备方法。
背景技术:
法罗培南钠(faropenemsodium),化学名(5r,6s)-6-[(1r)-1-羟乙基]-7-氧代-3-[(2r)-四氢呋喃-2-基]-4-硫杂-1-氮杂双环[3.2.0]庚-2-烯-2-羧酸钠盐二倍半水合物。法罗培南钠是由日本suntory公司开发,并于1997年上市的第一个青霉烯类抗生素,其在青霉烯母核的2-位上接有一个四氢呋喃基团,化学结构较稳定,是青霉烯类中唯一的口服抗菌剂。对法罗培南钠药理和临床研究结果表明,与已上市的几个碳青霉烯类抗生素类似,法罗培南钠具有广谱抗菌活性,尤其对耐药的葡萄球菌、肠球菌等革兰阳性菌和拟杆菌等厌氧菌具有较强的活性;并且对各种β-内酰胺酶都很稳定。
法罗培南钠的结构式如下:
法罗培南钠的剂型种类多,已开发多种口服制剂,用药方便,其中干糖浆剂可作用于儿童,其耐受良好,不良反应较小,临床试验副反应少。
近年来,由于耐药菌问题日益严峻,医院门诊注射给药逐渐被限制,国内用药方式会逐渐改变,使得口服抗生素市场扩容,法罗培南钠具有较好的市场前景,其制备方法将会进一步得到改善。
因此,本发明探索新的合成方法,以获得相较于现有制备方法更高的产品收率,且制备方法简单,操作步骤少,成本低,以适应业界对高品质、低价格的法罗培南钠的需求。
技术实现要素:
本发明目的在于提供一种优化的法罗培南制备方法。通过采用混合溶剂方法,极大提高了反应速度和产品纯度,避免了中间体的柱层析纯化步骤,得到固体中间体ii(5r,6s)-6-[(1r)-1-羟乙基]-7-氧代-3-[(2r)-四氢呋喃-2-基]-4-硫杂-1-氮杂双环[3.2.0]庚-2-烯-2-羧酸烯丙酯,便于存储转移和下一步投料;在脱烯丙基步骤中提高三苯基膦用量,大大降低了重金属催化剂四(三苯基膦)钯用量,得到产物中未检出重金属钯,并且提高产品收率,适合药品工业化生产,从而完成本发明。
本发明的目的在于提供以下方面:
(1)一种法罗培南钠的制备方法,该方法包括以下步骤:
步骤1),将原料化合物i溶解于溶剂i中,进行脱硅烷基反应,得到中间体ii;
步骤2),将中间体ii溶于溶剂ii中后,反应脱除烯丙基,得到法罗培南钠。
根据本发明提供的一种法罗培南钠的制备方法,具有以下有益效果:
(1)本发明在制备中间体ii时,采用设定的溶剂i,尤其采用设定比例的酯类溶剂和酰胺类组成的混合溶剂代替传统的单一溶剂,提高了反应速度和产品纯度,得到中间体ii为固体便于存储转移,避免了中间体ii的柱层析纯化步骤,提高了中间体ii的收率,有利于最终产物产率的提高;
(2)本发明在反应脱除烯丙基步骤中,考虑到现有技术中产品钯残余量高的问题,提高三苯基膦用量,大大降低了重金属催化剂四(三苯基膦)钯用量,在产品中未检出重金属钯的同时,提高了此步骤的产物收率;
(3)本发明基于现有合成方法中存在的缺陷进行改进,获得相较于现有制备方法更高的产品收率,且制备方法简单,操作步骤少,成本低,可适应业界对高品质、低价格的法罗培南钠的需求,适合产品的工业化生产。
附图说明
图1为实施例1中制备得到的中间体ii的液相色谱图;
图2为实施例2中制备得到的中间体ii的液相色谱图;
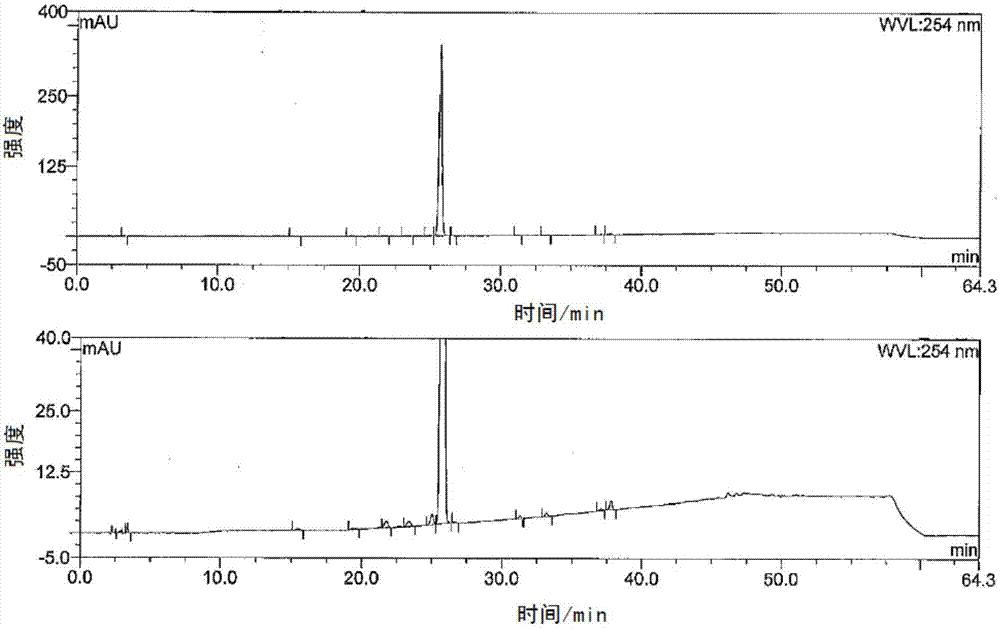
图3为实施例5中制备的法罗培南钠粗品的液相色谱图;
图4为实施例8中制备的法罗培南钠精品的液相色谱图,其中图1~图4中均包括居上的整体图,和居下的放大图。
具体实施方式
下面通过对本发明进行详细说明,本发明的特点和优点将随着这些说明而变得更为清楚、明确。
在这里专用的词“示例性”意为“用作例子、实施例或说明性”。这里作为“示例性”所说明的任何实施例不必解释为优于或好于其它实施例。尽管在附图中示出了实施例的各种方面,但是除非特别指出,不必按比例绘制附图。
本发明的目的是提供一种法罗培南钠的制备方法,该方法包括以下步骤:
步骤1),将原料化合物i溶解于溶剂i中,进行脱硅烷基反应,得到中间体ii;
步骤2),将中间体ii溶于溶剂ii中后,反应脱除烯丙基,得到法罗培南钠。
步骤1中,将原料化合物i即6-(1’-叔丁基二甲基硅氧乙基)-2-(2”-四氢呋喃基)培南-3-羧酸烯丙酯溶解于溶剂i中,加入醋酸、以及脱硅烷保护基试剂,在设定温度和设定时间内进行脱硅烷基反应,得到中间体ii。
其中,此步骤的反应式如下:
经研究发现,现有技术中报道的方法在脱叔丁基二甲基硅烷基(tbs)保护时,反应时间较长,得到中间体ii纯度较低,中间体ii为油状物,无法通过重结晶纯化,需要柱层析纯化,而柱层析纯化操作繁琐,产品损失较大造成收率较低,不适合工业化生产。由于影响产物纯度的因素较多,针对不同的影响因素进行改进的方式也较多,确定和选择何种最有利的改进方式以解决上述问题对技术人员存在较大困难。
本发明人经过深入研究,发现采用特定的溶剂,可获得纯度较高的固体形态的中间体ii。固体中间体ii便于存储、转移,及后续处理。
在一种优选的实施方式中,所述溶剂i为酯类溶剂或酰胺类溶剂中任意一种或两类溶剂组成的混合溶剂;
其中,所述酯类溶剂选自甲酸乙酯、乙酸乙酯、乙酸丁酯或乙酸异丙酯中一种或几种;所述酰胺类溶剂选自甲酰胺、乙酰胺、n,n-二甲基甲酰胺(dmf)、n,n-二甲基乙酰胺(dma)、n,n-二甲基丙酰胺中的一种或多种。
其中,混合溶剂可以为一种或多种酯类溶剂与一种或多种酰胺类溶剂的组合,如乙酸丁酯和n,n-二甲基甲酰胺的组合。
在一种优选的实施方式中,混合溶剂中酯类溶剂与酰胺类溶剂的体积比为0.5:1~20:1。
本发明人经过进一步研究发现,混合溶剂中两类溶剂的比例影响步骤1的反应速率和中间体ii的收率。当酯类溶剂与酰胺类溶剂的体积比小于0.5:1时,反应较快,但反应产生较多杂质;当酯类溶剂与酰胺类溶剂的体积比大于20:1时,由于酯类溶剂过多使得反应速率明显降低。
在进一步优选的实施方式中,混合溶剂中酯类溶剂与酰胺类溶剂的体积比为2:1~4:1时,可更为有效的保证反应速率和产物纯度。
在一种优选的实施方式中,所述脱硅烷保护基试剂为四丁基氟化铵。
在一种优选的实施方式中,溶剂i与原料化合物i的用量比为(4~10)体积份:1重量份,优选为(6~8)体积份:1重量份,其中,将1g计为1重量份时,则将1ml计为1体积份。在上述用量比范围内,可有效保证反应速率,且便于后续中间体ii的分离,保证中间体ii的收率。
在一种优选的实施方式中,在上述反应物和溶剂加入完成后,在15~50℃反应8~20h;优选在30~35℃反应13~17h。
在上述反应温度和反应时间下,经tlc检测,原料可反应完全。更重要的是,在温度低于15℃时,反应速率较慢,反应时间过长;在温度高于50℃时,不利于原料化合物i和中间体ii的结构稳定。
基于对中间体ii收率的进一步提高,本发明人经过研究发现,在反应完成后向反应体系中再次加入溶剂对体系进行稀释,可有效提高中间体ii的收率。
在一种优选的实施方式中,再次加入的溶剂为酯类溶剂,选自乙酸乙酯、乙酸丁酯或乙酸异丙酯中一种或几种;更优选地,在溶剂i中含有酯类的情况下,所述溶剂与溶剂i中酯类相同,便于后续溶剂回收再利用。同时,酯类溶剂的加入,进一步稀释了酰胺类溶剂在反应体系中的比例,使得后续萃取中随酰胺类溶剂的分离不会或极少带出中间体ii,中间体ii的收率得到保证。
在进一步优选的实施方式中,再次加入的溶剂与原料化合物i的用量比为(2~10)体积份:1重量份,优选为(3~6)体积份:1重量份,其中,将1g计为1重量份时,则将1ml计为1体积份。
上述范围内的用量比,同时考虑了对中间体ii收率的影响、以及溶剂的有效利用率;若用量比低于最小临界值,则溶剂的加入对中间体ii的收率影响不明显;若用量比高于最大临界值,虽然有效提高了中间体ii的收率,但是溶剂的有效利用率低,不适合大规模生产。
本发明中,在反应完成后,对反应体系进行降温,温度降至15℃下,优选温度为8℃~15℃。在上述温度范围内,调节体系ph,经萃取、洗涤、干燥、浓缩得到淡黄色固体中间体ii。
在一种优选的实施方式中,通过加入饱和碳酸氢钠溶液调控体系的ph至7~8。优选地,饱和碳酸氢钠溶液通过滴加方式加入体系中。饱和碳酸氢钠对体系中醋酸的中和反应为放热反应,可导致反应体系局部较高温度,因此,在加入饱和碳酸氢钠前使反应体系维持低温,避免局部高温使中间体ii产生开环反应,提高了中间体ii的收率。同时,滴加方式进一步降低了局部高温的风险。
在一种优选的实施方式中,调节反应体系ph后,对体系中有机相进行萃取。萃取用溶剂为酯类溶剂,在溶剂i含酯类溶剂的情况下,所述酯类溶剂与溶剂i中酯类溶剂相同。优选地,有机相的萃取操作重复2~3次。通过此步骤,酰胺类溶剂等水溶性物质可与有机相分离。
在一种优选的实施方式中,对萃取后的有机相进行净化处理:将饱和碳酸钠水溶液与有机相混合,静置分层;有机层再用饱和氯化钠水溶液洗涤。采用饱和氯化钠水溶液可进一步去除溶于水的有机物,且有机相-水相分层明显,不易产生乳化现象,使中间体ii流失。
在一种优选的实施方式中,将无水硫酸镁和针剂活性炭配合使用,在干燥的同时进行脱色,进一步减少杂质含量。
步骤2中,将中间体ii溶于溶剂ii中后,反应脱除烯丙基,得到法罗培南钠。
其中,此步骤的反应式如下:
具体地:将中间体ii加入到二氯甲烷中,加入催化剂、成盐剂,进行反应;反应完成后,向反应体系中加入水、析晶、过滤、干燥得到法罗培南钠。
在一种优选的实施方式中,所述催化剂为四(三苯基膦)钯和三苯基膦的组合物。
本发明人对现有技术进行分析发现,多个文献描述中存在制备的产品中重金属钯超标的情况,需要进一步采用吸附剂进行钯清除;这不可避免的增加了制备步骤,提高了成本。降低钯残余的另一种方式可为降低含钯催化剂的用量,然而这又会造成反应速度慢、反应不彻底。因此,在降低钯残余的同时,保证反应完全和反应速度,同时不增加反应步骤和成本,是存在较大困难的,目前尚未发现解决相关问题的报道。
本发明人经过深入研究发现,在脱烯丙基步骤中,调整催化剂的用量、以及催化剂组分比例,可有效控制重金属钯残余。
本发明人发现,提高三苯基膦用量,降低重金属催化剂四(三苯基膦)钯用量,相较于现有技术中三苯基膦与四(三苯基膦)钯用量相当的情况,同样可以明显加快反应速率且反应完全,得到产物中未检出重金属钯,并且提高了第二步产物法罗培南钠的收率。
在一种优选的实施方式中,设定中间体ii与四(三苯基膦)钯的摩尔比介于1:(0.001~0.006)之间,中间体ii与三苯基膦的摩尔比介于1:(0.1~0.3)之间。
在一种优选的实施方式中,向反应体系中加入成盐剂,所述成盐剂为异辛酸钠。优选地,所述异辛酸钠与中间体ii的摩尔比为(1.10~1.40):1;异辛酸钠过量,有利于形成法罗培南钠;且在上述范围内,异辛酸钠过量受控,便于去除。
在一种优选的实施方式中,步骤2中反应温度为20~35℃,反应时间为30~120min;优选地,反应温度为25~30℃,反应时间为40~60min。在本发明选定的催化剂下,即可在常温下、较短时间内完成反应,降低了操作难度和生产成本。
在一种优选的实施方式中,反应完成后,向反应体系中加入水,常温下搅拌析晶设定时间后,降温继续析晶;优选降温至-5~0℃继续析晶。
在进一步优选的实施方式中,水化析晶得到法罗培南钠后,通过有机溶剂对产品进行洗涤,降低产品中过量的杂质含量。
本发明中,经上述步骤2)后得到的产品中仍含有杂质,为粗品法罗培南钠。
步骤3),通过水-丙酮溶液对粗品法罗培南钠进行纯化。
具体地,向粗品法罗培南钠中加入水,升温溶解,加入活性炭脱色,过滤,室温下滴加设定量丙酮析晶设定时间后,降温至0~-5℃,继续搅拌养晶,用冷丙酮对产物进行洗涤,经低温干燥,得到法罗培南钠精制品。
上述阶段性析晶步骤,有利于获得颗粒均匀、高纯度的法罗培南钠产品。
制备得到的法罗培南钠产品符合《中国药典》2015版法罗培南钠质量标准。具体地,所述法罗培南钠产品为所述法罗培南钠为类白色结晶性粉末,比旋度为+145°~150°,ph5.0~7.0,总重金属含量小于10ppm,重量含量为90.0%~94.3%
实施例
以下通过具体实例进一步描述本发明。不过这些实例仅仅是范例性的,并不对本发明的保护范围构成任何限制。
实施例1中间体ii的制备
室温下,将70g原料化合物i加入到250ml乙酸丁酯中,搅拌至近澄清,缓慢加入冰乙酸48g,搅拌至反应液澄清,用10ml乙酸丁酯淋洗瓶壁,然后加入四丁基氟化铵,用20ml乙酸丁酯淋洗瓶壁,搅拌至澄清后,加入140mldmf,加毕,升温至30~35℃反应15h;
tlc检测反应完毕,补加420ml乙酸丁酯,将反应液降温至10℃左右,控温15℃以下滴加饱和碳酸钠溶液,调ph至7~8,搅拌30min复测ph7~8,静置分层,用70ml×2乙酸丁酯萃取两遍。合并有机层,加入饱和碳酸氢钠400ml×2萃取,静置分层,有机层再用400ml×2饱和氯化钠洗涤。有机层加入无水硫酸镁、针剂炭,搅拌脱色干燥2小时,过滤,滤液控制内温50℃以下,减压浓缩至干。
上述方法制备得到淡黄色固体中间体ii47.7g,摩尔收率92.1%,液相色谱图如图1所示。
实施例2中间体ii的制备
室温下,将140g原料化合物i加入到500ml乙酸乙酯中,搅拌至近澄清,缓慢加入冰乙酸96g,搅拌至反应液澄清,用20ml乙酸乙酯淋洗瓶壁,然后加入四丁基氟化铵,用40ml乙酸乙酯淋洗瓶壁,搅拌至澄清后,加入280mldma,加毕,升温至30~35℃反应17h;
tlc检测反应完毕,补加840ml乙酸乙酯,将反应液降温至10℃左右,控温15℃以下滴加饱和碳酸钠溶液,调ph至7~8,搅拌30min复测ph7~8,静置分层,用140ml×2乙酸乙酯萃取两遍。合并有机层,加入饱和碳酸氢钠800ml×2萃取,静置分层,有机层再用800ml×2饱和氯化钠洗涤。有机层加入无水硫酸镁、针剂炭,搅拌脱色干燥2小时,过滤,滤液控制内温50℃以下,减压浓缩至干。
上述方法制备得到得淡黄色固体中间体ii93.25g,摩尔收率90%,液相色谱图如图2所示。
实施例3中间体ii的制备
室温下,将70g原料化合物i加入到320ml乙酸乙酯中,搅拌至近澄清,缓慢加入冰乙酸48g,搅拌至反应液澄清,用10ml乙酸乙酯淋洗瓶壁,然后加入四丁基氟化铵,用20ml乙酸乙酯淋洗瓶壁,搅拌至澄清后,加入70mldmf,加毕,升温至30~35℃反应,tlc检测反应,原料点消失后停止反应;
反应完毕,补加420ml乙酸乙酯,将反应液降温至10℃左右,控温15℃以下,调ph至7~8,搅拌30min复测ph7~8,静置分层,用70ml×2乙酸乙酯萃取两遍。合并有机层,加入饱和碳酸氢钠400ml×2萃取两遍,静置分层,有机层再用400ml×2饱和氯化钠洗涤两次。有机层加入无水硫酸镁47.6g和针剂炭3.5g,搅拌脱色干燥2小时,过滤,滤液控制内温40℃以下,减压浓缩至干。
上述方法制备得到淡黄色固体中间体ii45.78g,摩尔收率88.4%。
实施例4中间体ii的制备
室温下,将70g化合物i加入到250ml乙酸乙酯中,搅拌至近澄清,缓慢加入冰乙酸48g,搅拌至反应液澄清,用10ml乙酸乙酯淋洗瓶壁,然后加入四丁基氟化铵,用20ml乙酸乙酯淋洗瓶壁,搅拌至澄清后,加入140mldmf,加毕,升温至30~35℃反应,tlc检测反应,大约反应13~14h;
反应完毕,补加420ml乙酸乙酯,将反应液降温至10℃左右,控温15℃以下滴加饱和碳酸钠溶液,调ph至7~8,搅拌30min复测ph7~8,静置分层,用70ml×2乙酸乙酯萃取两遍。合并有机层,加入饱和碳酸氢钠400ml×2萃取两遍,静置分层,有机层再用400ml×2饱和氯化钠洗涤两次。有机层加入无水硫酸镁47.6g和针剂炭3.5g,搅拌脱色干燥2小时,过滤,滤液控制内温40℃以下,减压浓缩至干。
上述方法制备得到淡黄色固体中间体ii46g,摩尔收率88.8%。
实施例5法罗培南钠的制备
室温下,将中间体ⅱ150g用1110ml二氯甲烷搅拌溶解,依次加入三苯基膦18g和异辛酸钠乙酸乙酯溶液(92g异辛酸钠+1110ml乙酸乙酯),得淡黄色澄清液。用n2置换5min,n2保护下加入四(三苯基膦)钯2.664g,加完后,n2保护下25~30℃下反应40min;
室温下,向反应液中加入40g纯化水,20~30℃搅拌析晶2h,降温至-5℃~0℃,搅拌洗净2h,抽滤,滤饼用200ml×3乙酸乙酯淋洗,滤饼35~40℃真空干燥,得类白色粉末119g,摩尔收率73.3%,液相色谱图如图3所示。
实施例6法罗培南钠的制备
室温下,将中间体ⅱ30g(92.2mmol)用220ml二氯甲烷搅拌溶解,依次加入三苯基膦2.4g(9.22mmol)和110.7mmol异辛酸钠乙酸乙酯溶液(18.4g异辛酸钠+222ml乙酸乙酯),得淡黄色澄清液。用n2置换5min,n2保护下加入四(三苯基膦)钯0.532g(0.46mmol),加完后,n2保护下25~30℃下反应40min;
室温下,向反应液中加入8g纯化水,20~30℃搅拌析晶2h,降温至-5℃~0℃,搅拌洗净2h,抽滤,滤饼用40ml×3乙酸乙酯淋洗,滤饼35~40℃真空干燥,得类白色粉末23.1g,摩尔收率71.1%。
实施例7法罗培南钠的制备
室温下,将中间体ⅱ45g用333ml二氯甲烷搅拌溶解,依次加入三苯基膦5.4g和异辛酸钠乙酸乙酯溶液(27.6g异辛酸钠+333ml乙酸乙酯),得淡黄色澄清液。用n2置换5min,n2保护下加入四(三苯基膦)钯399.6mg,加完后,n2保护下25~30℃下反应40min;
室温下,向反应液中加入12g纯化水,20~30℃搅拌析晶2h,降温至-5℃~0℃,搅拌洗净2h,抽滤,滤饼用60ml×3乙酸乙酯淋洗,滤饼35~40℃真空干燥,得类白色粉末35.4g,摩尔收率72.6%。
实施例8法罗培南钠的纯化
将法罗培南钠粗品30g加入到120g纯化水中,升温至45℃搅拌至澄清,加入针剂炭脱色30min,过滤,室温向滤液中滴加360ml丙酮析晶,滴加完毕,室温继续搅拌养晶3h,降温至-5~0℃,继续搅拌养晶1h,抽滤,滤饼用30ml×2冷丙酮洗涤,25℃减压真空干燥,得白色结晶性粉末24g,收率80%。液相色谱图如图4所示。
《中国药典》2015版法罗培南钠质量标准对实施例8中得到的纯化后法罗培南钠进行检测,结果如表1所示:
表1
对比例
对比例1中间体ii的制备
室温下,将70g原料化合物i加入到390ml乙酸丁酯中,搅拌至近澄清,缓慢加入冰乙酸48g,搅拌至反应液澄清,用10ml乙酸丁酯淋洗瓶壁,然后加入四丁基氟化铵,用20ml乙酸丁酯淋洗瓶壁,搅拌至澄清后,升温至30~35℃反应72h;
tlc检测反应完毕,补加420ml乙酸丁酯,将反应液降温至10℃左右,控温15℃以下滴加饱和碳酸钠溶液,调ph至7~8,搅拌30min复测ph7~8,静置分层,用70ml×2乙酸丁酯萃取两遍。合并有机层,加入饱和碳酸氢钠400ml×2萃取,静置分层,有机层再用400ml×2饱和氯化钠洗涤。有机层加入无水硫酸镁、针剂炭,搅拌脱色干燥2小时,过滤,滤液控制内温50℃以下,减压浓缩至干。
上述方法制备得到棕黄色油状物中间体ii36.78g,摩尔收率71%。
对比例2中间体ii的制备
室温下,将70g原料化合物i加入到140mldmf中,搅拌至近澄清,缓慢加入冰乙酸48g,搅拌至反应液澄清,然后加入四丁基氟化铵,搅拌至澄清后,升温至30~35℃反应6h;
tlc检测反应完毕,反应杂,补加700ml乙酸乙酯,将反应液降温至10℃左右,控温15℃以下滴加饱和碳酸钠溶液,调ph至7~8,搅拌30min复测ph7~8,静置分层,用70ml×2乙酸乙酯萃取两遍。合并有机层,加入饱和碳酸氢钠400ml×2萃取,静置分层,有机层再用400ml×2饱和氯化钠洗涤。有机层加入无水硫酸镁、针剂炭,搅拌脱色干燥2小时,过滤,滤液控制内温50℃以下,减压浓缩至干。
上述方法制备得到棕红色油状物中间体ii32.64g,摩尔收率63%。
对比例3法罗培南钠的制备
室温下,将中间体ⅱ15g用111ml二氯甲烷搅拌溶解,依次加入三苯基膦1.03g和异辛酸钠乙酸乙酯溶液(9.2g异辛酸钠+111ml乙酸乙酯),得淡黄色澄清液。用n2置换5min,n2保护下加入四(三苯基膦)钯1.03g,加完后,n2保护下25~30℃下反应40min;
室温下,向反应液中加入4g纯化水,20~30℃搅拌析晶2h,降温至-5℃~0℃,搅拌洗净2h,抽滤,滤饼用20ml×3乙酸乙酯淋洗,滤饼35~40℃真空干燥,得类白色粉末10.07g,摩尔收率62%。
后续纯化步骤同实施例8。
对最终产品的重金属pd残留进行检测,结果发现,pd残留量达到250ppm。
以上结合具体实施方式和范例性实例对本发明进行了详细说明,不过这些说明并不能理解为对本发明的限制。本领域技术人员理解,在不偏离本发明精神和范围的情况下,可以对本发明技术方案及其实施方式进行多种等价替换、修饰或改进,这些均落入本发明的范围内。本发明的保护范围以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!