植物组成型表达启动子及其应用的制作方法
本发明涉及植物分子生物学领域,具体涉及植物组成型表达启动子及其应用。
背景技术:
在转基因植物产品研发过程中,需要通过转基因技术以高水平表达蛋白产物。对植物进行操作以改变或改善表型特征(如对生物或非生物胁迫抗性、产量提升、品质改良等)需要在植物组织中表达特定基因。该基因操作由于以下两个发现已经成为可能,即将异源遗传物质转化进植物细胞的能力,以及存在能够驱动异源遗传物质表达的启动子。
启动子是重要的顺式作用元件,调控基因的转录,根据启动子的转录模式不同将其分为组成型、诱导型和组织特异性启动子三类。目前,应用较为广泛的为组成型启动子,常用于过表达特定的基因。
最常用的启动子包括花椰菜花叶病毒camv35s启动子(odelletal,nature313:810-812(1985))、胭脂碱合酶(nos)启动子(ebertetal,pnas.84:5745-5749(1987))、adh启动子(walkeretal,pnas.84:6624-6628(1987))、蔗糖合酶启动子(yangetal,pnas.87:4144-4148(1990))和玉米泛素启动子ubiquitin(cornejoetal,plantmolbiol.23:567-581(1993))。识别和分离可用于植物中强烈表达特定基因的调控元件在转基因植物的商业品种开发中具有重要的作用。
技术实现要素:
本发明所要解决的技术问题是如何启动目的基因表达。
为解决上述技术问题,本发明首先提供了一种特异dna分子。
本发明所提供的特异dna分子,可为如下a1)或a2)或a3)所示的dna分子:
a1)核苷酸序列是序列表中序列1自5’末端起第7至589位所示的dna分子;
a2)与a1)限定的核苷酸序列具有75%或75%以上同一性的dna分子;
a3)在严格条件下与a1)或a2)限定的核苷酸序列杂交的dna分子。
含有所述特异dna分子的表达盒也属于本发明的保护范围。
含有所述特异dna分子的重组质粒也属于本发明的保护范围。所述重组质粒为将所述特异dna分子插入出发质粒得到的重组质粒。
所述重组质粒具体可为重组质粒pcambia3301-gly。重组质粒pcambia3301-gly为将载体pcambia3301的限制性内切酶hindⅲ和ncoi识别序列间的小片段替换为序列表中序列1自5′末端起第7至589位所示的dna分子。
含有所述特异dna分子的重组微生物也属于本发明的保护范围。
所述重组微生物可通过将所述重组质粒导入出发微生物得到。
所述出发微生物可为酵母、细菌、藻类或真菌。所述细菌可为革兰氏阳性细菌或革兰氏阴性细菌。所述革兰氏阴性细菌可为根癌农杆菌(agrobacteriumtumefaciens)。所述根癌农杆菌(agrobacteriumtumefaciens)具体可为根癌农杆菌eha105或根癌农杆菌gv3101。
所述重组微生物具体可为eha105/pcambia3301-gly::mcry1ab或gv3101/pcambia3301-gly::mcry1ab。eha105/pcambia3301-gly::mcry1ab是将重组质粒pcambia3301-gly::mcry1ab转化根癌农杆菌eha105得到的重组农杆菌。gv3101/pcambia3301-gly::mcry1ab是将重组质粒pcambia3301-gly::mcry1ab导入根癌农杆菌gv3101得到的重组农杆菌。所述重组质粒pcambia3301-gly::mcry1ab可为将载体pcambia3301的限制性内切酶hindⅲ和ncoi识别序列间的小片段替换为序列表中序列1自5’末端起第7至589位所示的dna分子,限制性内切酶ncoi和bsteii识别序列间的小片段替换为序列表中序列2自5’末端起第7至1881位所示的dna分子。
含有所述特异dna分子的转基因细胞系也属于本发明的保护范围。
含有所述特异dna分子的转基因细胞系均不包括繁殖材料。所述转基因植物理解为不仅包含将所述特异dna分子转化受体植物得到的第一代转基因植物,也包括其子代。对于转基因植物,可以在该物种中繁殖基因,也可用常规育种技术将该基因转移进入相同物种的其它品种,特别包括商业品种中。所述转基因植物包括种子、愈伤组织、完整植株和细胞。
所述特异dna分子、所述表达盒或所述重组质粒在启动目的基因表达中的应用也属于本发明的保护范围。
为解决上述技术问题,发明还提供了表达目的基因的方法。
本发明所提供的表达目的基因的方法,具体可为方法一,可包括如下步骤:将所述特异dna分子插入到任何目的基因或增强子的上游,以此来启动目的基因的表达。
本发明所提供的表达目的基因的方法,具体可为方法二,可包括如下步骤:将目的基因插入所述表达盒中的所述特异dna分子的下游,由所述特异dna分子启动所述目的基因的表达。
本发明所提供的表达目的基因的方法,具体可为方法三,可包括如下步骤:将目的基因插入所述重组质粒中的所述特异dna分子的下游,由所述特异dna分子启动所述目的基因的表达。
上述任一所述目的基因可为mcry1ab基因。所述mcry1ab基因的核苷酸序列如序列表中序列2自5’末端起第7至1881位所示。
实验证明,本发明提供的特异dna分子可以在水稻、玉米和拟南芥的各个组织中启动目的基因(如mcry1ab基因,其核苷酸序列如序列表中序列2自5’末端起第7至1881位所示)的表达,具有重要的应用价值。
附图说明
图1为实施例1步骤一的实验结果。
图2为实施例2的实验结果。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
玉米自交系b73来源于国家种质资源库(网址为:http://www.cgris.net/),公众可从中国农业大学(即申请人处)获得,以重复本实验。在下文中,玉米自交系b73简称b73。
peasyt1cloningvector和10×pcrbuffer为北京全式金生物技术有限公司的产品。载体pcambia3301为华越洋生物科技有限公司的产品,产品目录号为vect0150。
fpkm值定义:假如通过二代测序产生了1百万个reads映射到了玉米的基因组上,那么具体到每个基因映射上了多少,而外显子的长度不一,那么每1k个碱基上又有多少reads映射上,这大概就是这个rpkm的直观解释。fpkm=totalexonfragments/(mappedreads(millions)×exonlength(kb))。
n6e培养基的溶质及其浓度为4g/l的n6盐、5ml/l的n6vitaminstock(200×)、2mg/l的2,4-d、0.1g/l的肌醇、2.76g/l的脯氨酸、30g/l的蔗糖、0.1g/l的酪蛋白水解物、2.8g/l的植物凝胶和3.4mg/l的硝酸银;溶剂为蒸馏水;ph值为5.8。
n6vitaminstock(200×):含甘氨酸0.4g/l、烟酸0.1g/l、vb10.2g/l和vb60.1g/l的水溶液。
n6e固体平板:将约55℃的n6e培养基倒入培养皿,冷却后得到n6e固体平板。
浸染培养基:将蔗糖68.4g、n6大量(20×)50ml、b5微量(100×)10ml、n6铁盐(100×)10ml、rtv有机(200×)5ml和100μmol的乙酰丁香酮(acetosyringone,as)溶于1l蒸馏水,调节ph值至5.2。
n6大量(20×):含(nh4)2so49.26g/l、kno356.60g/l、kh2po48.00g/l、mgso4·7h2o3.70g/l和cacl2·2h2o3.32g/l的水溶液。
b5微量(100×):含mnso4·h2o0.7600g/l、znso4·7h2o0.2000g/l、h3bo30.3000g/l、ki0.0750g/l、na2moo4·2h2o0.0250g/l、cuso4·5h2o0.0025g/l和cocl2·6h2o0.0025g/l的水溶液。
n6铁盐(100×):含乙二胺四乙酸钠铁盐1.8300g/l的水溶液。
rtv有机(200×):将氯化胆碱0.0196g、vb20.0098g、d-生物素0.0200g、烟酸0.0400g、叶酸0.0097g、vb10.0944g、d-泛酸钙0.0200g、vb60.0400g、对氨基苯甲酸0.0098g和400μl浓度为0.75mg/100ml的vb12水溶液溶于1l蒸馏水。
共培养培养基:将ms盐4.33g、msvitamins(500×)2ml、盐酸硫胺0.5mg、蔗糖30.0g、l-脯氨酸1.38g、2,4-d0.5mg、6-ba0.01mg、植物凝胶3.5g和100μmol的as溶于1l蒸馏水,调节ph值至5.7。
msvitamins(500×):含甘氨酸1g/l、烟酸0.25g/l、vb10.05g/l和vb60.25g/l的水溶液。
恢复培养基:将ms盐4.33g、msvitamins(500×)2ml、盐酸硫胺0.5mg、蔗糖30.0g、l-脯氨酸1.38g、2,4-d0.5mg、6-ba0.01mg、植物凝胶3.5g、tim100mg、双丙氨膦3.0mg和agno33.4mg溶于1l蒸馏水,调节ph值至5.7。
一次选择培养基:含1.5mg/l双丙氨磷的ms固体培养基。
二次选择培养基:含3.0mg/l双丙氨磷的ms固体培养基。
再生培养基ⅰ:将ms盐4.33g、msvitamins(500×)2ml、盐酸硫胺0.5mg、蔗糖10.0g、葡萄糖20g、l-脯氨酸0.7g、植物凝胶3.5g、酪蛋白水解物0.2g、甘氨酸0.04g、肌醇0.1g和双丙氨膦3.0mg溶于1l蒸馏水,调节ph值至5.7。
再生培养基ⅱ:将ms盐2.165g、蔗糖30.0g、植物凝胶3.5g和双丙氨膦3.0mg溶于1l蒸馏水,调节ph值至5.7。
实施例1、富含甘氨酸的rna结合蛋白2启动子的发现
一、富含甘氨酸的rna结合蛋白2启动子(gly启动子)的发现
本发明的发明人对b73的不同组织(如生长至14d的幼苗、根、第1至7片叶、不同阶段的顶端分生组织、不同阶段的雌穗、不同阶段的雄穗、不同阶段的穗轴、花丝、花药、胚珠、b73自交授粉后不同天数的籽粒)进行细胞转录组分析,fpkm值的结果见图1。结果表明,上述各个组织中均具有高表达量的为富含甘氨酸的rna结合蛋白2(glycine-richrna-bindingprotein2,基因号zm00001d031168,)基因,该基因启动子简称gly启动子;与目前在植物中广泛应用的ubiquitin启动子相比,gly启动子在大部分组织中表达量明显提高。因此,gly启动子的应用前景更加广阔。
利用玉米富含甘氨酸的rna结合蛋白2与水稻、高粱和拟南芥基因组比对,可以鉴定到水稻、高粱和拟南芥的同源基因,基因id分别为os12g0632000,sorbi_001g022600,at4g13850。这些基因转录起始位点上游600bp序列具有与本发明报到的gly启动子序列同样的功能。
二、gly启动子的克隆
1、提取b73的叶片的基因组dna并以其作为模板,采用引物1:5'-aagcttagattacaaggtagtgaattgtgacatg-3'(下划线为限制性内切酶hindiii的识别位点)和引物2:5'-ccatggctcgatccgctcacccacg-3'(下划线为限制性内切酶ncoi的识别位点)组成的引物对进行pcr扩增,得到pcr扩增产物。
反应体系为20μl,由2μl10×pcrbuffer、1.6μl浓度为10mmdntp(即datp、dttp、dctp和dgtp的浓度均为10mm)、0.5μl引物1水溶液、0.5μl引物2水溶液、2μl模板、0.3μltaq酶和13.1μlddh2o组成。反应体系中,引物1和引物2的浓度均为10nm,模板的浓度为10-100ng/μl。
反应条件:94℃预变性6min;94℃变性30s,58℃退火30s,72℃延伸30s,34个循环;72℃延伸10min。
2、完成步骤1后,将pcr扩增产物进行2%(2g/100ml)琼脂糖凝胶电泳检测,然后回收约595bp的pcr扩增产物。
3、完成步骤2后,将约595bp的pcr扩增产物和peasyt1cloningvector连接,得到重组质粒peasyt1-glyp。
对重组质粒peasyt1-glyp进行测序。测序结果表明,重组质粒peasyt1-glyp中含有序列表中序列1所示的dna分子。序列表中序列1自5’末端起第7至589位所示的dna分子即为gly启动子的核苷酸序列。
实施例2、gly启动子在表达mcry1ab基因的应用
一、重组质粒pcambia3301-gly::mcry1ab的构建
1、用限制性内切酶hindⅲ和ncoi双酶切重组质粒peasyt1-glyp,回收约580bp的dna片段1。
2、用限制性内切酶hindⅲ和ncoi双酶切载体pcambia3301,回收约10kb的载体骨架1。
3、将dna片段1和载体骨架1连接,得到重组质粒pcambia3301-gly。
4、人工合成序列表中序列2所示的双链dna分子,然后用限制性内切酶ncoi和bsteii双酶切,回收约1.9kb的dna片段2。序列表中序列2自5’末端起第7至1881位所示的dna分子为编码mcry1ab蛋白的基因(以下简称mcry1ab基因),mcry1ab蛋白的氨基酸序列如序列表中序列3所示。
5、用限制性内切酶ncoi和bsteii双酶切重组质粒pcambia3301-gly,回收约10kb的载体骨架2。
6、将dna片段2和载体骨架2连接,得到重组质粒pcambia3301-gly::mcry1ab。
对重组质粒pcambia3301-gly::mcry1ab进行测序。根据测序结果,对重组质粒pcambia3301-gly::mcry1ab进行结构描述如下:将载体pcambia3301的限制性内切酶hindⅲ和ncoi识别序列间的小片段替换为序列表中序列1自5’末端起第7至589位所示的dna分子,限制性内切酶ncoi和bsteii识别序列间的小片段替换为序列表中序列2自5’末端起第7至1881位所示的dna分子。重组质粒pcambia3301-gly::mcry1ab表达序列表中序列3所示的mcry1ab蛋白。
二、转mcry1ab基因水稻的获得和gly启动子的功能验证
1、重组农杆菌的获得
将重组质粒pcambia3301-gly::mcry1ab导入根癌农杆菌eha105中,得到重组农杆菌,将该重组农杆菌命名为eha105/pcambia3301-gly::mcry1ab。
将重组质粒pcambia3301导入根癌农杆菌eha105中,得到重组农杆菌,将该重组农杆菌命名为eha105/pcambia3301。
2、转mcry1ab基因水稻的获得
采用hiei等的方法(hieiy,ohtas,komarit&kumashirot.efficienttransformationofrice(oryzasatival.)mediatedbyagrobacteriumandsequenceanalysisoftheboundariesofthet-dna.plantj.1994,6:271–282)将eha105/pcambia3301-gly::mcry1ab转化水稻品种日本晴,获得转mcry1ab基因水稻。将其中5个转mcry1ab基因水稻依次命名为os-1至os-5。
按照上述方法,将eha105/pcambia3301-gly::mcry1ab替换为eha105/pcambia3301,其它步骤均相同,得到转空载体水稻。
3、分子鉴定
分别提取os-1至os-5的叶片的基因组dna并以其作为模板,采用引物f4:5’-tccgtgctttcttagaggtgggtt-3’和引物r4:5’-gaactcggaaagaaggaactgggtaa-3’组成的引物对进行pcr扩增,得到pcr扩增产物。
反应体系为20μl,由2μl10×pcrbuffer、1.6μl浓度为10mmdntp(即datp、dttp、dctp和dgtp的浓度均为10mm)、0.5μl引物f4水溶液、0.5μl引物r4水溶液、2μl模板、0.3μltaq酶和13.1μlddh2o组成。反应体系中,引物f4和引物r4的浓度均为10nm,模板的浓度为10-100ng/μl。
反应条件:94℃预变性10min;94℃变性30s,59℃退火30s,72℃延伸1min,34个循环;72℃延伸10min。
按照上述方法,将os-1的叶片的基因组dna替换为水,其它步骤均相同,作为阴性对照。
按照上述方法,将os-1的叶片的基因组dna替换为转空载体水稻的叶片的基因组dna,其它步骤均相同,作为对照1。
按照上述方法,将os-1的叶片的基因组dna替换为水稻品种日本晴的叶片的基因组dna,其它步骤均相同,作为对照2。
按照上述方法,将os-1的叶片的基因组dna替换为重组质粒pcambia3301-gly::mcry1ab,其它步骤均相同,作为阳性对照。
将上述pcr扩增产物进行琼脂糖凝胶电泳。结果表明,以os-1至os-5的叶片的基因组dna或重组质粒pcambia3301-gly::mcry1ab为模板均能扩增得到258bp的条带;以水、转空载体水稻的叶片的基因组dna或水稻品种日本晴的叶片的基因组dna为模板,均不能扩增得到258bp的条带。
经分子鉴定,os-1至os-5均为转mcry1ab基因水稻。
4、实时定量pcr检测
待测水稻为os-1、os-2、os-3、os-4、os-5、转空载体水稻或水稻品种日本晴。
待测组织为叶片、根、茎秆、花、或籽粒。
(1)提取待测水稻的待测组织的总rna,然后进行反转录,得到待测水稻的cdna。待测水稻的cdna中dna含量约为50ng/μl。
(2)使用荧光定量pcr检测待测水稻的cdna中mcry1ab基因的相对表达量(以actin基因作为内参基因)。
检测mcry1ab基因的引物为正向引物1:5’-gtggaggtgcttggtggtgaga-3’和反向引物1:5’-actgggagggaccgaagatgc-3’。检测actin基因的引物为正向引物2:5’-gaagatcactgccttgctcc-3’和反向引物2:5’-cgataacagctcctcttggc-3’。
反应体系为25μl,由2μl待测水稻的cdna、1μl正向引物水溶液、1μl反向引物水溶液、13μlsybr(takara公司的产品)和8μlddh2o组成。反应体系中,正向引物和反向引物的浓度均为10nm。
反应程序:95℃预变性5min;95℃变性15s,60℃退火35s,40个循环;72℃延伸5min;4℃保存。
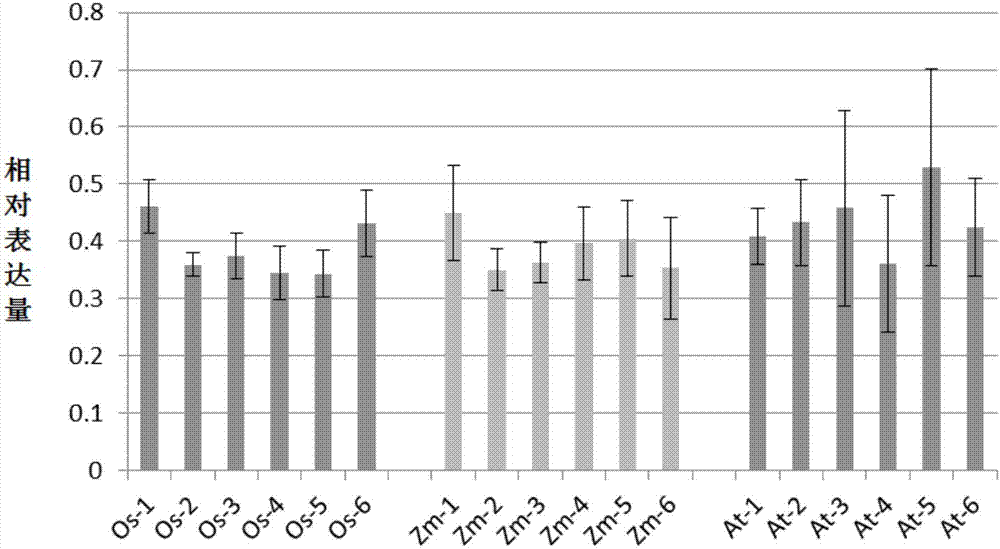
统计待测水稻的cdna中mcry1ab基因的相对表达量。实验结果见图2。结果表明,与水稻品种日本晴相比,os-1、os-2、os-3、os-4和os-5的组织中mcry1ab基因的相对表达量均显著增加,转空载体水稻的组织中mcry1ab基因的相对表达量无显著差异。
上述结果表明,gly启动子可以在水稻的各个组织中启动mcry1ab基因的表达。
三、转mcry1ab基因玉米的获得和启动子的功能验证
1、重组农杆菌的获得
将重组质粒pcambia3301-gly::mcry1ab导入根癌农杆菌eha105中,得到重组农杆菌,将该重组农杆菌命名为eha105/pcambia3301-gly::mcry1ab。
将重组质粒pcambia3301导入根癌农杆菌eha105中,得到重组农杆菌,将该重组农杆菌命名为eha105/pcambia3301。
2、转mcry1ab基因玉米的获得
(1)幼胚的获得及培养
(a)在田间种植玉米品种x178,待自花授粉9-11d后,去除授粉果穗的苞叶,然后把果穗放入盛有消毒液(向700ml的50%(v/v)的漂白剂水溶液或次氯酸钠水溶液(有效氯为5.25%(v/v))中加入一滴tween20得到)的烧杯里浸泡20min,然后用无菌水洗涤3次。浸泡过程中,需不时的旋转果穗同时轻轻拍打烧杯以驱除籽粒表面的气泡,从而达到最佳的消毒效果。
(b)完成步骤(a)后,取果穗,将剥胚刀的刀尖插在胚和胚乳之间,然后轻轻向上撬出幼胚,用小的手术刀尖轻轻托起幼胚,确保幼胚不受到任何的损伤,把幼胚的胚轴面紧贴放有滤纸的n6e固体平板,幼胚的密度大约是2cm×2cm(30个/皿)。
(c)完成步骤(b)后,取所述n6e固体平板,用封口膜封住,28℃暗培养2-3d。
(2)农杆菌浸染液的获得
(a)将eha105/pcambia3301-gly::mcry1ab接种于含33mg/l卡那霉素(kanamycin,kana)和50mg/l链霉素(streptomycin,str)的yep固体培养基上,19℃培养3天,进行活化。
(b)将步骤(a)得到的eha105/pcambia3301-gly::mcry1ab接种于浸染培养基中,25℃、75rpm振荡培养,得到od550nm为0.3-0.4的农杆菌浸染液。
(3)转mcry1ab基因玉米的获得
光暗交替培养(即光照培养和暗培养交替)的条件为:25℃。光照培养时的光照强度为15000lx。光暗交替培养的周期具体为:16h光照培养/8h黑暗培养。
(a)取完成步骤(2)的幼胚,置于离心管中,先用浸染培养基洗涤2次(每次使用浸染培养基2ml),然后加入农杆菌浸染液,轻轻颠倒离心管20次,再直立静置于暗箱5min(确保幼胚全部浸泡在农杆菌浸染液中)。
(b)完成步骤(a)后,将所述幼胚转移至共培养培养基(使幼胚的胚轴接触共培养培养基表面,同时去除共培养培养基表面多余的农杆菌),然后20℃暗培养3d。
(c)完成步骤(b)后,将所述幼胚转移至恢复培养基,然后28℃暗培养7d。
(d)完成步骤(c)后,将所述幼胚转移至一次选择培养基,然后28℃光暗交替培养两周。
(e)完成步骤(d)后,将所述幼胚转移至二次选择培养基,然后28℃光暗交替培养两周,得到抗性愈伤。
(f)完成步骤(e)后,将抗性愈伤转移至再生培养基ⅰ,然后28℃光暗交替培养三周。
(g)完成步骤(f)后,将抗性愈伤转移至再生培养基ⅱ,然后28℃光暗交替培养三周,得到再生苗。待再生苗生长至3-4片叶时转移至温室,正常培养,得到转mcry1ab基因玉米。将其中5个转mcry1ab基因玉米依次命名为zm-1至zm-5。
按照上述方法,将eha105/pcambia3301-gly::mcry1ab替换为eha105/pcambia3301,其它步骤均不变,得到转空载体玉米。
3、分子鉴定
分别提取zm-1至zm-5的叶片的基因组dna并以其作为模板,采用引物f4:5’-tccgtgctttcttagaggtgggtt-3’和引物r4:5’-gaactcggaaagaaggaactgggtaa-3’组成的引物对进行pcr扩增,得到pcr扩增产物。
反应体系同步骤二中3的反应体系。
反应条件同步骤二中3的反应条件。
按照上述方法,将zm-1的叶片的基因组dna替换为水,其它步骤均相同,作为阴性对照。
按照上述方法,将zm-1的叶片的基因组dna替换为转空载体玉米的叶片的基因组dna,其它步骤均相同,作为对照1。
按照上述方法,将zm-1的叶片的基因组dna替换为玉米品种x178的叶片的基因组dna,其它步骤均相同,作为对照2。
按照上述方法,将zm-1的叶片的基因组dna替换为重组质粒pcambia3301-gly::mcry1ab,其它步骤均相同,作为阳性对照。
将pcr扩增产物进行琼脂糖凝胶电泳。结果表明,以zm-1至zm-5的叶片的基因组dna或重组质粒pcambia3301-gly::mcry1ab为模板均能扩增得到258bp的条带;以水、转空载体玉米的叶片的基因组dna或玉米品种x178的叶片的基因组dna为模板,均不能扩增得到258bp的条带。
经分子鉴定,zm-1至zm-5均为转mcry1ab基因玉米。
4、实时定量pcr检测
待测玉米为zm-1、zm-2、zm-3、zm-4、zm-5、转空载体玉米或玉米品种x178。
待测组织为叶片、根、雌穗、雄穗、穗轴、花丝、花药、胚珠或籽粒。
1、提取待测玉米的待测组织的总rna,然后进行反转录,得到待测玉米的cdna。待测玉米的cdna中dna含量约为200ng/μl。
2、使用荧光定量pcr检测待测玉米的cdna中mcry1ab基因的相对表达量(以zssiib基因作为内参基因)。
检测mcry1ab基因的引物同步骤二4中的检测mcry1ab基因的引物。
反应体系同步骤二4中的反应体系。
反应程序同步骤二4中的反应程序。
统计待测玉米的cdna中mcry1ab基因的相对表达量。实验结果见图2。结果表明,与玉米品种x178相比,zm-1、zm-2、zm-3、zm-4和zm-5的组织中mcry1ab基因的相对表达量均显著增加,转空载体玉米的组织中mcry1ab基因的相对表达量无显著差异。
上述结果表明,gly启动子可以在玉米的各个组织中启动mcry1ab基因的表达。
四、转mcry1ab基因拟南芥的获得和gly启动子的功能验证
哥伦比亚生态型拟南芥为arabidopsisbiologicalresourcecenter(网址为:http://abrc.osu.edu/)的产品。在下文中,哥伦比亚生态型拟南芥简称为野生型拟南芥。
1、重组农杆菌的获得
将重组质粒pcambia3301-gly::mcry1ab导入根癌农杆菌gv3101中,得到重组农杆菌,将该重组农杆菌命名为gv3101/pcambia3301-gly::mcry1ab。
将重组质粒pcambia3301导入根癌农杆菌gv3101中,得到重组农杆菌,将该重组农杆菌命名为gv3101/pcambia3301。
2、转mcry1ab基因拟南芥的获得
(1)采用拟南芥花序浸花转化法(记载于如下文献中clough,s.j.,andbent,a.f..floraldip:asimplifiedmethodforagrobacterium-mediatedtransformationofarabidopsisthaliana.plantj.(1998)16,735-743.),将gv3101/pcambia3301-gly::mcry1ab转至野生型拟南芥中,获得t1代转mcry1ab基因的野生型拟南芥的种子。
2、将t1代转mcry1ab基因的野生型拟南芥的种子播种于含有50mg/lbasta的ms培养基上,能够正常生长的拟南芥(抗性苗)即为t1代转mcry1ab基因阳性苗,t1代转mcry1ab基因阳性苗收到的种子即为t2代转mcry1ab基因的野生型拟南芥的种子。
3、将不同株系的t2代转mcry1ab基因的野生型拟南芥的种子播种于含有50mg/lbasta的ms培养基上进行筛选,如果某株系中能够正常生长的拟南芥(抗性苗)的数目与不能够正常生长的拟南芥(非抗性苗)的数目比例为3:1,则该株系为mcry1ab基因插入一个拷贝的株系,该株系中的抗性苗收到的种子即为t3代转mcry1ab基因的野生型拟南芥的种子。
4、将t3代转mcry1ab基因的野生型拟南芥的种子再次播种于含有50mg/lbasta的ms培养基上进行筛选,均为抗性苗的即为t3代纯合转mcry1ab基因的野生型拟南芥。将其中5个t3代纯合转mcry1ab基因的野生型拟南芥的株系依次命名为at-1至at-5。
按照上述方法,将gv3101/pcambia3301-gly::mcry1ab替换为gv3101/pcambia3301,其它步骤均相同,得到t3代纯合转空载体的野生型拟南芥,简称转空载体拟南芥。
3、分子鉴定
分别提取at-1至at-5的叶片的基因组dna并以其作为模板,采用引物f4:5’-tccgtgctttcttagaggtgggtt-3’和引物r4:5’-gaactcggaaagaaggaactgggtaa-3’组成的引物对进行pcr扩增,得到pcr扩增产物。
反应体系同步骤二中3的反应体系。
反应条件同步骤二中3的反应条件。
按照上述方法,将at-1的叶片的基因组dna替换为水,其它步骤均相同,作为阴性对照。
按照上述方法,将at-1的叶片的基因组dna替换为转空载体拟南芥的叶片的基因组dna,其它步骤均相同,作为对照1。
按照上述方法,将at-1的叶片的基因组dna替换为野生型拟南芥的叶片的基因组dna,其它步骤均相同,作为对照2。
按照上述方法,将at-1的叶片的基因组dna替换为重组质粒pcambia3301-gly::mcry1ab,其它步骤均相同,作为阳性对照。
将pcr扩增产物进行琼脂糖凝胶电泳。结果表明,以at-1至at-5的叶片的基因组dna或重组质粒pcambia3301-gly::mcry1ab为模板均能扩增得到258bp的条带;以水、转空载体拟南芥的叶片的基因组dna或野生型拟南芥的叶片的基因组dna为模板,均不能扩增得到258bp的条带。
经分子鉴定,at-1至at-5均为转mcry1ab基因拟南芥。
4、实时定量pcr检测
待测拟南芥为at-1、at-2、at-3、at-4、at-5、转空载体拟南芥或野生型拟南芥。
待测组织为叶片、根、茎或籽粒。
1、提取待测拟南芥的待测组织的总rna,然后进行反转录,得到待测拟南芥的cdna。待测拟南芥的cdna中dna含量约为200ng/μl。
2、使用荧光定量pcr检测待测拟南芥的cdna中mcry1ab基因的相对表达量(以actin基因作为内参基因)。
检测mcry1ab基因的引物同步骤二4中的检测mcry1ab基因的引物。
检测actin基因的引物同步骤二4中的检测actin基因的引物。
反应体系同步骤二4中的反应体系。
反应程序同步骤二4中的反应程序。
统计待测拟南芥的cdna中mcry1ab基因的相对表达量。实验结果见图2。结果表明,与野生型拟南芥相比,at-1、at-2、at-3、at-4和at-5的组织中mcry1ab基因的相对表达量均显著增加,转空载体拟南芥的组织中mcry1ab基因的相对表达量无显著差异。
上述结果表明,gly启动子可以在拟南芥的各个组织中启动mcry1ab基因的表达。
<110>中国农业大学
<120>植物组成型表达启动子及其应用
<160>3
<170>patentinversion3.5
<210>1
<211>595
<212>dna
<213>玉米zeamaysl.
<400>1
aagcttagattacaaggtagtgaattgtgacatgtattcgttcctatccgatccgtcgtt60
tttgagcactaggtgcggtcactgtgacgcgtggacttggcttcgcccactgccatcgtg120
gacccacgtcatcagcaagtgtccatatccaccacccgacccgacgaccgcttgccgtcc180
gatccgtgtgctcccgagggcaaggatggcatttcgccacgcgagatatttttcggtggc240
ctgcacaggccggcagtgcagcggccaaaacgaggtcaggtcagtcacgctgggccccgc300
ctcacgctcccgtcctgctccgggtcccaacaaagccgtccccgggaggtgctcgtgtgc360
tcgtagcgcggtggcgaccccgatgccccgcatattccactgggcgtccgcgccgtcgga420
tgggatcaggacggccgcggcggccccgcgctcggctataaagacgctgcgggggacgca480
ttccctctccgtgctttcttagaggtgggttggcttctcctccccctccggttcgggttc540
gggttcgtgaggttctccggggttcgggttcgtgggtgagcggatcgagccatgg595
<210>2
<211>1888
<212>dna
<213>人工序列
<220>
<223>
<400>2
ccatggatggacaacaatcccaacatcaacgagtgcattccctacaactgcctttccaat60
cccgaggtggaggtgcttggtggtgagaggatcgagaccggttacactcccatcgacatc120
tccctttcccttacccagttccttctttccgagttcgtgcccggtgccggtttcgtgctt180
ggtcttgtggacatcatctggggcatcttcggtccctcccagtgggacgccttccttgtg240
cagatcgagcagcttatcaaccagaggatcgaggagttcgccaggaaccaggccatctcc300
aggcttgagggtctttccaacctttaccagatctacgccgagtccttcagggagtgggag360
gccgatcccaccaatcccgcccttagggaggagatgaggatccagttcaacgacatgaac420
tccgcccttaccaccgccatcccactgttcgccgtgcagaactaccaggtgccactgctg480
tccgtgtacgtgcaggccgccaaccttcacctttccgtgcttagggacgtgtccgtgttc540
ggtcagaggtggggtttcgacgccgccaccatcaactccaggtacaacgaccttaccagg600
cttatcggtaactacaccgaccacgccgtgaggtggtacaacaccggtcttgagagggtg660
tggggtcccgactccagggactggatcaggtacaaccagttcaggagggagcttaccctt720
accgtgcttgacatcgtgtccctgttccctaactacgactccaggacgtaccctatcagg780
accgtgtcccagcttaccagggagatctacaccaacccagtgcttgagaacttcgacggt840
tccttccgcggttccgcccagggtatcgaggggtccatcaggagcccacaccttatggac900
atccttaactccatcaccatctacaccgacgcccaccgcggtgagtactactggtccggc960
caccagatcatggccagcccagtgggtttctccggtcccgagttcaccttcccactttac1020
ggtaccatgggtaacgccgctccacagcagaggatcgtggcccagcttggtcagggtgtg1080
tacaggaccctttcctccaccctttacaggaggcccttcaacatcggtatcaacaaccag1140
cagctttccgtgcttgacggtaccgagttcgcctacggtacctcctccaaccttccctcc1200
gccgtgtacaggaagtccggtaccgtggactcccttgacgagattccaccacagaacaac1260
aacgtgccaccaaggcagggtttctcccacaggctttcccacgtgtccatgttcaggtcc1320
ggtttctccaactcctccgtgtccatcatcagggctccaatgttctcctggatccacagg1380
tccgccgagttcaacaacatcatccccagcagccagatcacccagatccccctgaccaag1440
agcaccaacctgggcagcggcaccagcgtggtgaagggccccggcttcaccggcggcgac1500
atcctgcgccgcaccagccccggccagatcagcaccctgcgcgtgaacatcaccgccccc1560
ctgagccagcgctaccgcgtccgcatccgctacgccagcaccaccaacctgcagttccac1620
accagcatcgacggccgccccatcaaccagggcaacttcagcgccaccatgagcagcggc1680
agcaacctgcagagcggcagcttccgcaccgtgggcttcaccacccccttcaacttcagc1740
aacggcagcagcgtgttcaccctgagcgcccacgtgttcaacagcggcaacgaggtgtac1800
atcgaccgcatcgagttcgtgcccgccgaggtgaccttcgaggccgagtacgacctggag1860
agggctcagaaggccgtgtgaggtcacc1888
<210>3
<211>624
<212>prt
<213>人工序列
<220>
<223>
<400>3
metaspasnasnproasnileasnglucysileprotyrasncysleu
151015
serasnprogluvalgluvalleuglyglygluargilegluthrgly
202530
tyrthrproileaspileserleuserleuthrglnpheleuleuser
354045
gluphevalproglyalaglyphevalleuglyleuvalaspileile
505560
trpglyilepheglyproserglntrpaspalapheleuvalglnile
65707580
gluglnleuileasnglnargileglugluphealaargasnglnala
859095
ileserargleugluglyleuserasnleutyrglniletyralaglu
100105110
serpheargglutrpglualaaspprothrasnproalaleuargglu
115120125
glumetargileglnpheasnaspmetasnseralaleuthrthrala
130135140
ileproleuphealavalglnasntyrglnvalproleuleuserval
145150155160
tyrvalglnalaalaasnleuhisleuservalleuargaspvalser
165170175
valpheglyglnargtrpglypheaspalaalathrileasnserarg
180185190
tyrasnaspleuthrargleuileglyasntyrthrasphisalaval
195200205
argtrptyrasnthrglyleugluargvaltrpglyproaspserarg
210215220
asptrpileargtyrasnglnpheargarggluleuthrleuthrval
225230235240
leuaspilevalserleupheproasntyraspserargthrtyrpro
245250255
ileargthrvalserglnleuthrarggluiletyrthrasnproval
260265270
leugluasnpheaspglyserpheargglyseralaglnglyileglu
275280285
glyserileargserprohisleumetaspileleuasnserilethr
290295300
iletyrthraspalahisargglyglutyrtyrtrpserglyhisgln
305310315320
ilemetalaserprovalglypheserglyprogluphethrphepro
325330335
leutyrglythrmetglyasnalaalaproglnglnargilevalala
340345350
glnleuglyglnglyvaltyrargthrleuserserthrleutyrarg
355360365
argpropheasnileglyileasnasnglnglnleuservalleuasp
370375380
glythrgluphealatyrglythrserserasnleuproseralaval
385390395400
tyrarglysserglythrvalaspserleuaspgluileproprogln
405410415
asnasnasnvalproproargglnglypheserhisargleuserhis
420425430
valsermetpheargserglypheserasnserservalserileile
435440445
argalaprometphesertrpilehisargseralaglupheasnasn
450455460
ileileproserserglnilethrglnileproleuthrlysserthr
465470475480
asnleuglyserglythrservalvallysglyproglyphethrgly
485490495
glyaspileleuargargthrserproglyglnileserthrleuarg
500505510
valasnilethralaproleuserglnargtyrargvalargilearg
515520525
tyralaserthrthrasnleuglnphehisthrserileaspglyarg
530535540
proileasnglnglyasnpheseralathrmetserserglyserasn
545550555560
leuglnserglyserpheargthrvalglyphethrthrpropheasn
565570575
pheserasnglyserservalphethrleuseralahisvalpheasn
580585590
serglyasngluvaltyrileaspargilegluphevalproalaglu
595600605
valthrpheglualaglutyraspleugluargalaglnlysalaval
610615620
- 还没有人留言评论。精彩留言会获得点赞!