一种四环素慢病毒诱导表达载体及其建立方法和应用与流程
本发明涉及功能基因组学研究领域,主要涉及一种四环素慢病毒诱导表达载体及其建立方法和应用。
背景技术:
基因的调控表达可以使基因功能的研究更为精细。1992年gossen等成功地利用原核基因调控元件构建了四环素(tetracycline,tet)真核细胞基因表达调控系统,利用tet或其衍生物对所感兴趣的基因进行诱导表达。四环素诱导系统包括tet-off和tet-on系统,其中tet-on系统利用反义四环素转录激活因子(rtta),在无诱导物多西霉素(doxycycline,dox)的条件下处于关闭状态,只有在dox刺激下才能快速诱导目的基因表达,因而tet-on系统更受人们青睐(gossenm,freundliebsetal,science,1995)。随着人们对该系统的不断改进,使诱导表达具有严密、高效、可控性强、表达泄露小等优点,已广泛应用于基因功能研究和基因治疗研究。urlinger等通过密码子优化、剪切位点移除及vp16激活区的引入等一些列手段开发出了第二代反义四环素转录激活因子蛋白rtta2s-m2,显著地提高了诱导系统对dox的敏感性与诱导效率(urlingers,baronuetal,procnatlacadsci,2000)。ptripz(thermofisher)载体是基于rtta2s-m2突变生成的rtta3变体而开发出来的一个商业化载体,rtta3变体能在保持二代rtta2s-m2体系本底不变的同时,将诱导水平提高五倍,并显著提高系统对诱导物dox的敏感性(dasat,zhouxetal,journalofbiologicalchemistry,2004)。zhou等通过将四环素诱导系统引入到hiv病毒基因组中,通过突变筛选出具有更优诱导倍数的rtta蛋白(zhoux,vinkmetal,genether,2006)。
尽管四环素诱导系统得以长足发展,但依赖于慢病毒载体的tet-on体系还不够完善,这是因为源于慢病毒载体的ltr启动子/增强子会造成表达泄露现象,尤其是在构建同一载体共表达诱导基因和rtta时,更需要优化最佳组合方式。clontech公司研发的lenti-xtet-oneinducibleexpressionsystem是在lentivirus载体上正向插入了pkg启动子控制下的tet-on3g和反向插入的tre3gs诱导性启动子及下游目的基因。
技术实现要素:
鉴于上述现有技术的不足,本发明的目的在于提供一种四环素慢病毒诱导表达载体及其建立方法和应用,发明人经研究系统性比较了诱导型慢病毒表达载体上的各个元件及其组合对tet-on系统的诱导效率及本底表达水平的影响,并将crispr/cas9体系引入到新建立的四环素慢病毒诱导系统中,旨在建立一种更高效的诱导型慢病毒表达体系和更优秀的crispr/cas9系统。
本发明的技术方案如下:
一种四环素慢病毒诱导表达载体,其中,所述四环素慢病毒诱导表达载体包含目的基因表达框和反义四环素转录激活因子(rtta)表达框;目的基因表达框包括四环素诱导型启动子及目的基因;反义四环素转录激活因子表达框包括组成型启动子、反义四环素转录激活因子、连接肽以及筛选标记基因;诱导型crispr/cas9系统将cas9蛋白置于诱导型启动子的下游,并将u6启动表达的sgrna序列置于整个四环素诱导体系的上游。
所述的四环素慢病毒诱导表达载体,其中,诱导型启动子选用tre3gp、tre3gs或teto6。
所述的四环素慢病毒诱导表达载体,其中,反义四环素转录激活因子选用rtta3或teton3g,其启动子选用cmv、pgk、ef1α、ubc或sv40。
所述的四环素慢病毒诱导表达载体,其中,诱导方向选用目的基因表达框与反义四环素转录激活因子相同的正向或相反的反向。
所述的四环素慢病毒诱导表达载体,其中,诱导型启动子采用tre3gp、反义四环素转录激活因子选用teton3g。
所述的四环素慢病毒诱导表达载体,其中,tre3gp启动子和pgk启动子反向插入到慢病毒诱导体系中。
所述的四环素慢病毒诱导表达载体,其中,反义四环素转录激活因子的启动子选用pgk启动子,连接肽选用p2a,筛选基因选用puro。
一种如上所述的四环素慢病毒诱导表达载体的建立方法,其中,包括以下步骤:
改建plvx-puro载体:选用plvx-puro载体作为慢病毒骨架载体,通过定点突变技术突变了puro序列上的tth111i、sacii和bsmbi位点;再以plvx-puro载体为模板,在puro片段前后分别引入bamhi和spei位点,扩增puro片段;再克隆到经bspmi-tth111i双酶切、再补平的plvx-puro载体中,得到改建plvx-puro载体;
teton3g基因合成及plvx-teton3g载体构建:根据已经公布的teton3g序列进行基因合成,并定点突变掉序列上的xbai位点;再在teton3g序列上游引入多克隆位点:clai-mlui-xbai-agei-ecori-xhoi-bstbi,在teton3g序列下游引入连接肽p2a及smai和bamhi位点,smai位点位于teton3g和p2a之间,位于p2a后的bamhi则介导着与puro序列的融合连接,合成基因teton3g-p2a的序列如seqidno.1所示;将合成基因teton3g-p2a用clai-bamhi双酶切,通过相同的酶切位点克隆到改建plvx-puro载体中,得到载体plvx-teton3g;
亚克隆pgk启动子:扩增得到人pgk启动子片段,其核苷酸序列如seqidno.3,用xhoi-bstbi双酶切pcr产物,然后通过相同的酶切位点分别克隆到plvx-teton3g载体中,得到的载体pl/pgk-teton3g;
亚克隆红色荧光蛋白rfp-polya:扩增rfp-polya序列,其核苷酸序列如seqidno.4;用agei-mlui双酶切pcr产物,通过相同的酶切位点克隆到pl/pgk-teton3g载体中,得到载体pl/rfp/pgk-teton3g;
亚克隆含有四环素顺式应答作用元件的诱导型启动子tre3gp:取诱导型启动子tre3gp,其核苷酸序列如seqidno.5,用ecori-agei酶切,通过相同的酶切位点正向或反向插入到pl/pgk-teton3g载体中,得到载体pl/tre3gp-rfp/pgk-teton3g或载体pl/rfp-tre3gp/pgk-teton3g。
一种如上所述的四环素慢病毒诱导表达载体的应用,其中,将所述四环素慢病毒诱导表达载体用于crispr/cas9体系中。
所述的四环素慢病毒诱导表达载体的应用,其中,将所述四环素慢病毒诱导表达载体用于构建crispr/cas9体系,包括以下步骤:
扩增cas9-flag序列,用agei-xbai双酶切pcr产物,然后反向克隆到经同样双酶切的pl/rfp-tre3gp/pgk-teton3g载体中,得到载体pl/cas9-tre3gp/pgk-teton3g;
扩增clai位点突变的u6-ccdb序列,用clai-mlui双酶切pcr产物,然后克隆到经同样双酶切的pl/cas9-tre3gp/pgk-teton3g载体中,得到u6-ccdb与cas9共表达载体pl/u6-ccdb/cas9-tre3gp/pgk-teton3g。
有益效果:通过比较上述不同载体的诱导活性、本底活性以及诱导倍数,得出以下成果:
(1)比较不同诱导型启动子、反义四环素转录激活因子与诱导方向的12种不同组合时发现,pl/rfp-tre3gp/pgk-teton3g载体的诱导活性以及诱导倍数最强,且背景表达水平处于较低程度。本发明首次提出了tre3gp与teton3g的组合效果最佳。
(2)比较插入方向对诱导效果的影响时发现,反向诱导系统本底表达水平显著低于正向诱导系统的同时,诱导活性及诱导倍数也强于正向系统。
(3)比较不同启动子对诱导效率的影响时发现,用pgk启动子组成的反向四环素诱导表达体系的绝对诱导活性与其它启动子的诱导活性无显著性区别,但在不加dox下的本底表达水平显著低于另外四种启动子参与组成的载体,导致其诱导倍数最高。cmv启动子组成的载体虽然具有最高的诱导活性,但其背景最高。
附图说明
图1为本发明中新型四环素慢病毒诱导表达载体的建立流程图。
图2为本发明中新型u6-sgrna及诱导型crispr/cas9慢病毒载体的建立流程图。
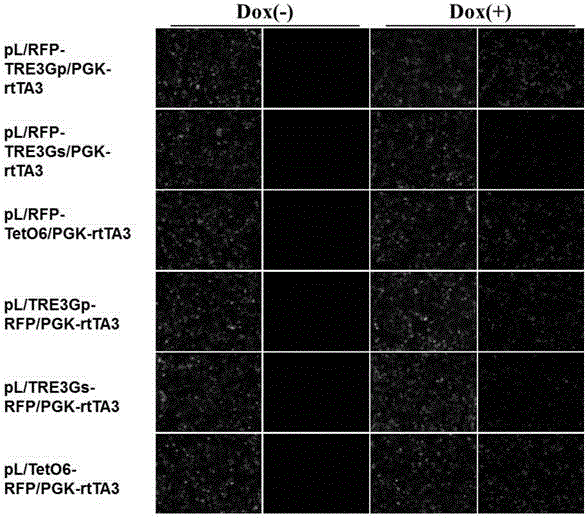
图3a~3d为本发明实施例1中诱导性启动子、反义四环素转录激活因子与诱导方向在四环素诱导系统中的比较结果图。
图4a~4b为本发明实施例2中比较五种不同反义四环素转录激活因子启动子对载体诱导效率的影响的结果图。
图5为本发明中实施例3中新型四环素诱导表达载体诱导表达cas9的免疫印迹结果。
图6为本发明实施例1中载体pl/tre3gp-rfp/pgk-teton3g的质粒图谱。
具体实施方式
本发明提供一种四环素慢病毒诱导表达载体及其建立方法和应用,为使本发明的目的、技术方案及效果更加清楚、明确,以下对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
本发明旨在提供一种更优的适合于慢病毒载体的all-in-onetet-on诱导表达体系,并将其应用于crispr/cas9基因编辑技术。crisprs/cas9技术是基因组编辑领域重要的突破。在cas9与sgrna的共同作用下,定点基因组改变的难度显著降低,而且可进行操作的目标生物种类大大增加。但是脱靶效应以及相应的细胞毒性效果仍然制约着该技术的进一步运用。有研究发现,cas9蛋白的组成型表达可能会增加crispr系统的脱靶效应(hsupd,scottdaetal,natbiotechnol,2013)。本发明中将crispr/cas9体系引入到四环素慢病毒诱导表达系统上,构建了诱导型crispr/cas9系统。
具体地,所述四环素慢病毒诱导表达载体的建立方法,结合图1,包括以下步骤:
(1)改建plvx-puro载体:
选用plvx-puro载体作为慢病毒骨架载体,通过定点突变技术在不改变氨基酸序列的前提下突变了puro序列上的tth111i、sacii和bsmbi位点;再以plvx-puro载体为模板,在puro编码序列前后分别引入bamhi和spei位点,扩增puro片段;再克隆到经bspmi-tth111i双酶切、再补平的plvx-puro载体中,得到改建后的plvx-puro载体骨架。
其中,扩增puro片段是采用上游引物(seqidno:8)和下游引物(seqidno:9)进行扩增。
(2)teton3g基因合成及plvx-teton3g载体构建:
根据已经公布的teton3g序列进行基因合成并定点突变掉序列上的xbai位点,再在teton3g序列上游引入多克隆位点:
clai-mlui-xbai-agei-ecori-xhoi-bstbi,在teton3g序列下游引入连接肽p2a及smai和bamhi位点,smai位点位于teton3g和p2a之间,位于p2a后的bamhi则介导着与puro序列的融合连接。合成基因的全序列(teton3g-p2a)见seqidno.1。将合成的基因片段用clai-bamhi双酶切,然后通过相同的酶切位点克隆到改建后的plvx-puro载体,新克隆载体命名为plvx-teton3g。
(3)plvx-rtta3载体构建
以ptripz载体(thermofisher)为模板,通过pcr扩增得到rtta3片段(其核苷酸序列如seqidno.2),用bstbi-smai双酶切pcr产物,然后通过相同的酶切位点克隆到plvx-teton3g载体中,替换plvx-teton3g载体上的teton3g,从而得到新的克隆载体plvx-rtta3。
其中,扩增rtta3片段是用上游引物(seqidno:10)和下游引物(seqidno:11)。
(4)亚克隆人pgk启动子:
以plko.1(addgene)载体为模板,扩增得到人pgk启动子片段(其核苷酸序列如seqidno.3),用xhoi-bstbi双酶切pcr产物,然后通过相同的酶切位点分别克隆到plvx-teton3g或plvx-rtta3载体中,得到的新载体分别命名为pl/pgk-teton3g或pl/pgk-rtta3。
其中,扩增pgk启动子片段是用上游引物(seqidno:12)和下游引物(seqidno:13)。
(5)亚克隆红色荧光蛋白rfp-polya:
以ptripz(thermofisher)载体为模板,分别扩增rfp片段和polya片段的cdna序列;再以rfp和polya序列为模板,overlappcr扩增rfp-polya序列,rfp、polya序列间隔以xbai(其核苷酸序列如seqidno.4);用agei-ecori双酶切pcr产物,通过相同的酶切位点分别克隆到pl/pgk-teton3g和pl/pgk-rtta3载体中,得到的新载体分别命名为pl/rfp/pgk-teton3g或pl/rfp/pgk-rtta3。
其中,扩增rfp片段是用上游引物(seqidno:14)和下游引物(seqidno:15)。扩增polya片段是用上游引物(seqidno:16)和下游引物(seqidno:17)。扩增rfp-polya序列是用上游引物(seqidno:14)和下游引物(seqidno:17)。
(6)亚克隆含有四环素顺式应答作用元件的诱导型启动子tre3gp、tre3gs或teto6:
用mlui-agei分别酶切pl/rfp/pgk-teton3g或pl/rfp/pgk-rtta3,然后将合成的诱导型启动子tre3gp、tre3gs或teto6(核苷酸序列分别为seqidno5、6、7)启动子分别通过相同的酶切位点插入骨架载体,得到新的载体分别命名为:
pl/tre3gp-rfp/pgk-teton3g;pl/tre3gs-rfp/pgk-teton3g
pl/teto6-rfp/pgk-teton3g;pl/tre3gp-rfp/pgk-rtta3;
pl/tre3gs-rfp/pgk-rtta3;pl/teto6-rfp/pgk-rtta3。
(7)不同诱导方向四环素诱导表达载体的构建:
以pl/tre3gp-rfp/pgk-teton3g、pl/tre3gs-rfp/pgk-teton3g载体为模板,扩增得到tre3gp-rfp-polya、tre3gs-rfp-polya片段;以ptripz载体为模板,pcr扩增得到teto6-rfp-polya片段;用xhoi和ecori双酶切pcr产物,通过相同的酶切位点分别反向插入到pl/pgk-teton3g或pl/pgk-rtta3载体中,六个反向诱导表达红色荧光蛋白的四环素诱导表达载体,得到的新载体命名为:
pl/rfp-tre3gp/pgk-teton3g;pl/rfp-tre3gs/pgk-teton3g
pl/rfp-teto6/pgk-teton3g;pl/rfp-tre3gp/pgk-rtta3;
pl/rfp-tre3gs/pgk-rtta3;pl/rfp-teto6/pgk-rtta3。
其中,扩增tre3gp-rfp-polya、tre3gs-rfp-polya片段是用上游引物(seqidno:18)和下游引物(seqidno:19)。扩增teto6-rfp-polya片段是用上游引物(seqidno:20)和下游引物(seqidno:21)。
(8)不同启动子效果的比较:
通过pcr扩增得到cmv、ef1a、ubc和sv40启动子,经xhoi-bstbi酶切后,分别替换pl/rfp-tre3gp/pgk-teton3g载体上的pgk启动子,得到的新载体命名为:
pl/rfp-tre3gp/cmv-teton3g;pl/rfp-tre3gp/ef1a-teton3g
pl/rfp-tre3gp/ubc-teton3g;pl/rfp-tre3gp/sv40-teton3g
在上述方案中,目的基因两端设有限制性酶切位点agei和ecori,用于构建不同目的基因的诱导型表达体系。
本发明中还提供一种四环素慢病毒诱导表达载体,所述四环素慢病毒诱导表达载体包含目的基因表达框和反义四环素转录激活因子(rtta)表达框;目的基因表达框包括四环素诱导型启动子及目的基因;反义四环素转录激活因子表达框包括组成型启动子、反义四环素转录激活因子、连接肽以及筛选标记基因;诱导型crispr/cas9系统将cas9蛋白置于诱导型启动子的下游,并将u6启动表达的sgrna序列置于整个四环素诱导体系的上游。
其中,诱导型启动子可选用tre3gp、tre3gs及teto6。反义四环素转录激活因子选用rtta3或teton3g,其启动子可选用常见的cmv、pgk、ef1α、ubc和sv40启动子。诱导方向可选用目的基因表达框与反义四环素转录激活因子相同的正向以及相反的反向。
通过比较不同载体的诱导活性、本底活性以及诱导倍数,比较不同诱导型启动子、反义四环素转录激活因子与诱导方向的12种不同组合时发现,当诱导型启动子采用tre3gp、反义四环素转录激活因子选用teton3g时,组合效果最佳。进一步地,反义四环素转录激活因子的启动子选用pgk启动子,连接肽选用p2a,筛选基因选用puro。更进一步地,tre3gp启动子和pgk启动子反向插入到慢病毒诱导体系中。比较插入方向对诱导效果的影响时发现,反向诱导系统本底表达水平显著低于正向诱导系统的同时,诱导活性及诱导倍数也强于正向系统。
该诱导体系引入细胞后可在保持低背景表达的同时,最大水平的诱导表达目的基因。该诱导系统对诱导剂反应灵敏、效率高、分子量小,可广泛应用于基因功能研究中。
本发明中还提供所述四环素慢病毒诱导表达载体的应用,将新开发的四环素诱导系统应用于crispr/cas9体系中,构建新型诱导型crispr/cas9系统。具体的构建方法,结合图2,包括以下步骤:
(1)pl/cas9-tre3gp/pgk-teton3g载体的构建
以lenticrisprv2(addgene)载体为模板,用上游引物(seqidno:31)与下游引物(seqidno:32)pcr扩增cas9-flag序列,用agei-xbai双酶切pcr产物,然后反向克隆到经同样双酶切的pl/rfp-tre3gp/pgk-teton3g载体中,得到新型诱导型crispr/cas9载体并命名为pl/cas9-tre3gp/pgk-teton3g。
(2)pl/u6-ccdb/cas9-tre3gp/pgk-teton3g载体的构建
以lenticrisprv2(addgene)载体为模板,用上游引物(seqidno:33)与下游引物(seqidno:34)pcr扩增clai位点突变的u6-ccdb序列,用clai-mlui双酶切pcr产物,然后克隆到经同样双酶切的pl/cas9-tre3gp/pgk-teton3g载体中,u6-ccdb与诱导型cas9共表达载体命名为pl/u6-ccdb/cas9-tre3gp/pgk-teton3g。
诱导型crispr/cas9体系为新型四环素慢病毒诱导表达系统在crispr/cas9体系中的应用,该诱导型crispr/cas9系统能在u6组成型表达sgrna的同时诱导表达cas9蛋白,消除cas9蛋白组成型表达对细胞及其靶向效果的影响并构建了一种同时表达sgrna及cas9蛋白的新型慢病毒表达体系。
以下通过具体实施例对本发明作进一步说明。
本发明实施例中所用的实验材料来源见表1。扩增不同载体序列所需引物见表2。
表1实验材料及来源
实施例1不同诱导型启动子、诱导方向与反义四环素转录激活因子的载体构建及功能分析
本实施例针对tre3gp、tre3gs及teto6三种诱导型启动子与rtta3、teton3g两种反义四环素转录激活因子并就不同诱导方向进行系统性比较分析,分析12种组合参与构成的相应诱导型载体的目的基因的诱导表达量、本底表达水平及相应的诱导倍数。
(1)改建plvx-puro载体
本系统选用plvx-puro(clontech)载体作为慢病毒骨架载体。首先通过定点突变技术突变掉puro序列上的tth111i、sacii、和bsmbi位点,再以plvx-puro载体为模板,用上游引物(seqidno:8)和下游引物(seqidno:9)扩增puro片段(含有bamhi和spei位点),然后克隆到经bspmi-tth111i双酶切,再补平的plvx-puro载体中,得到改建后的plvx-puro载体骨架。
(2)teton3g基因合成及克隆
根据已经公布的teton3g序列进行基因合成并突变掉序列上的xbai位点,并在teton3g序列上游引入多克隆位点:clai-mlui-xbai-agei-ecori-xhoi-bstbi,在teton3g序列下游引入连接肽p2a及smai和bamhi位点,smai位点位于teton3g和p2a之间,位于p2a后的bamhi则介导着与puro序列的融合连接。合成基因的全序列见seqidno.1。将合成的基因片段用clai-bamhi双酶切,然后通过相同的酶切位点克隆到改建后的plvx-puro载体上,新克隆载体命名为plvx-teton3g。
(3)plvx-rtta3的构建
以ptripz载体为模板,用上游引物(seqidno:10)和下游引物(seqidno:11)扩增rtta3片段(其核苷酸序列如seqidno.2),用bstbi-smai双酶切pcr产物,然后通过相同的酶切位点克隆到plvx-teton3g载体中,新克隆载体命名为plvx-rtta3。
(4)亚克隆pgk启动子:
以plko.1(addgene)载体为模板,用上游引物(seqidno:12)和下游引物(seqidno:12)扩增pgk片段pgk启动子片段(其核苷酸序列如seqidno.3),用xhoi-bstbi双酶切pcr产物,然后通过相同的酶切位点分别克隆到plvx-teton3g或plvx-rtta3载体中,新克隆载体命名为pl/pgk-teton3g或pl/pgk-rtta3。
(5)亚克隆红色荧光蛋白rfp-polya:
以ptripz(thermofisher)载体为模板,用上游引物(seqidno:14)和下游引物(seqidno:15)扩增rfp片段,上游引物(seqidno:16)和下游引物(seqidno:17)扩增polya片段。再以rfp、polya序列为模板,用上游引物(seqidno:14)和下游引物(seqidno:17)overlappcr扩增rfp-polya序列,rfp与polya序列间间隔以xbai位点(其核苷酸序列如seqidno.4)。用agei-ecori双酶切pcr产物,然后通过相同的酶切位点分别克隆到pl/pgk-teton3g和pl/pgk-rtta3载体中,新克隆载体命名为pl/rfp/pgk-teton3g或pl/rfp/pgk-rtta3。
(6)亚克隆四环素诱导型启动子tre3gp、tre3gs或teto6:
用mlui-agei分别酶切pl/rfp/pgk-teton3g或pl/rfp/pgk-rtta3载体,然后将合成的诱导型启动子tre3gp、tre3gs或teto6启动子(核苷酸序列分别为seqidno5、6、7)分别通过相同的酶切位点插入骨架载体,得到新的载体分别命名为:
pl/tre3gp-rfp/pgk-teton3g;pl/tre3gs-rfp/pgk-teton3g;
pl/teto6-rfp/pgk-teton3g;pl/tre3gp-rfp/pgk-rtta3;
pl/tre3gs-rfp/pgk-rtta3;pl/teto6-rfp/pgk-rtta3。
(7)不同诱导方向慢病毒表达载体:
以实施例1(6)中新构建的四环素诱导载体pl/tre3gp-rfp/pgk-teton3g、pl/tre3gs-rfp/pgk-teton3g为模板,用上游引物(seqidno:18)和下游引物(seqidno:19)pcr扩增tre3gp-rfp-polya、tre3gs-rfp-polya。以ptripz载体为模板,用上游引物(seqidno:20)和下游引物(seqidno:19)pcr扩增teto6-rfp-polya序列,用xhoi-ecori双酶切pcr产物,然后通过相同的酶切位点分别反向克隆到pl/pgk-teton3g或pl/pgk-rtta3载体中,得到六个反向诱导表达红色荧光蛋白的四环素诱导表达载体:
pl/rfp-tre3gp/pgk-teton3g;pl/rfp-tre3gs/pgk-teton3g
pl/rfp-teto6/pgk-teton3g;pl/rfp-tre3gp/pgk-rtta3;
pl/rfp-tre3gs/pgk-rtta3;pl/rfp-teto6/pgk-rtta3。
其中,载体pl/rfp-tre3gp/pgk-teton3g的质粒图谱如图6所示。
(8)亚克隆荧光素酶蛋白luc:
以p4xstat6-luc2p(addgene)载体为模板,用上游引物(seqidno:21)和下游引物(seqidno:22)扩增luc片段,扩增之前突变掉luc2p序列中的agei位点。用agei-xbai双酶切pcr产物,然后通过相同的酶切位点分别克隆到实施例1(6)(7)新构建的诱导表达红色荧光蛋白载体中,构建十二个正反向诱导表达luc的定量分析载体。
表2扩增不同载体序列所需引物
(9)不同诱导型启动子、反义四环素转录因子与诱导方向载体的系统性分析
以(6)-(8)中制备得到的重组诱导表达红色荧光载体与表达荧火虫荧光素酶载体进行载体的诱导性启动子、反义四环素转录因子与诱导方向的诱导效率分析,具体包括以下步骤:
使用加10%fbs的dmem培养293a细胞于37℃、5%co2的培养箱中,转染前一天接种细胞于48孔板,细胞密度为5.0×104个细胞/孔,培养12~24h。
诱导红色荧光蛋白表达实验:待细胞密度达到60%~80%时,pl/tre3gp-rfp/pgk-teton3g、pl/tre3gs-rfp/pgk-teton3g等十二种诱导表达红色荧光载体分别与绿色荧光蛋白质粒用pei转染试剂共转细胞。该转染体系所需的重组载体及绿色荧光载体分别为400ng和100ng;将上述质粒混合均匀后,补加nacl(150mm)使solutiona终体积为12.5μl;每组所需转染试剂pei为4μl,solutionb中所需的nacl(150mm)为8.5μl。实验以红色荧光蛋白作为目的基因,绿色荧光蛋白作为归一化内参。
诱导红色荧光素酶表达实验:待细胞密度达到60%~80%时,pl/tre3gp-luc/pgk-teton3g、pl/tre3gs-luc/pgk-teton3g等十二种诱导表达荧光素酶载体分别与海肾荧光素酶表达载体用pei转染试剂共转细胞。该转染体系所需的重组载体及海肾荧光素酶载体分别为50ng和5ng,每组设置4个重复。实验以萤火虫荧光素酶表达量为目的蛋白,海肾荧光素酶表达水平为内参。
solutiona与solutionb混合均匀后,室温静置10min。
将体积为50μl的转染试剂添加到293a细胞培养液中,轻轻混匀后培养箱中培养4-8h,更换新鲜的培养液,实验分为两组,一组换液时加含有dox(doxycycline,终浓度2μg/ml)诱导剂的培养液,另一组更换无dox的新鲜培养液(对照组),红绿荧光转染组48h后在荧光显微镜下观察绿色荧光蛋白及红色荧光蛋白的表达情况。
荧光素酶蛋白表达组转染48h后收集细胞,1×pbs清洗细胞两次,每孔加入20μl1×passivelysisbuffer,室温温和震荡裂解细胞15min,收集细胞裂解液,2500rpm离心5min。每组样品吸取2μl,加入10μl的larii溶液,轻轻涡旋混匀,使用lumat3lb9508仪器检测萤火虫荧光素酶催化底物产生的荧光读值,然后加入10μl的stop&glo溶液,涡旋混匀后检测海肾荧光素酶催化底物产生的荧光读值,萤火虫荧光素酶的活性通过内参荧光素酶的活性来标准化。每次检测时长设为5s。
本实施例对三种诱导性启动子、两种反义四环素转录因子、正反不同诱导方向进行系统性比较分析。在plvx-hpgk-p2a-puro载体骨架上构建了对应的四环素诱导表达载体。从图3a~图3d结果看出,反义四环素转录因子的比较中,teton3g构成的诱导表达载体相比rtta3载体具有更高的目的蛋白诱导表达水平以及更低的本底表达水平。三种诱导性启动子的比较中,tre3gp启动子具有最高的诱导活性,teto6居中,而tre3gs最弱。本底活性比较中,tre3gs最低,tre3gp居中而teto6最高。结果导致对应的tre3gp诱导倍数最高,tre3gs居中而teto6最低。正反诱导方向的比较中,反向诱导系统诱导活性与诱导倍数都强于正向诱导系统,只有teto6的正向诱导系统由于本地表达活性降低而导致诱导倍数强于反向诱导系统。结果表明,由tre3gp和teton3g反向组合的慢病毒诱导表达载体具有最高的诱导活性、诱导倍数以及较低的本底表达水平,具有更好的应用前景。
实施例2不同反义四环素转录激活因子启动子的载体的构建及功能分析
本实施例定量研究了五种不同的反义四环素转录激活因子启动子对系统诱导活性、本底表达水平以及诱导倍数的影响,在已筛选出的载体骨架的基础上对载体进行进一步的优化研究。
(1)不同启动子载体的构建
本实施例中用于扩增不同载体序列所需引物,见表3。以piresneo-flag-ha-ago2(addgene)载体为模板,用上游引物(seqidno:23)和下游引物(seqidno:24)扩增cmv片段;以pcdh-cmv-mcs-ef1-copgfp(sbi)载体为模板,用上游引物(seqidno:25)和下游引物(seqidno:26)扩增ef1a片段;以ptripz(thermofisher)载体为模板,用上游引物(seqidno:27)和下游引物(seqidno:28)扩增ubc片段;以pmirglo(promega)载体为模板,用上游引物(seqidno:29)和下游引物(seqidno:30)扩增sv40片段。用xhoi-bstbi双酶切pcr产物,然后克隆到经同样双酶切的pl/luc-tre3gp/pgk-teton3g载体中,得到四种新的重组载体分别命名为:
pl/luc-tre3gp/cmv-teton3g;pl/luc-tre3gp/ef1a-teton3g;
pl/luc-tre3gp/ubc-teton3g;pl/luc-tre3gp/sv40-teton3g。
表3扩增不同载体序列所需引物
(2)不同反义四环素转录激活因子启动子的诱导表达载体的定量分析
本实施例针对2中制备得到的四种重组载体与pl/luc-tre3gp/pgk-teton3g进行比较,分析五种载体的荧光素酶诱导表达水平、本底表达水平以及诱导倍数,具体步骤如下所示:
转染前一天293a细胞接种于48孔板,接种后细胞培养12-24h。同实施例1。
待细胞密度达到60%~80%时,进行转染实验,同实施例1。
将实施例2中的四种重组质粒、pl/luc-tre3gp/pgk-teton3g质粒与海肾荧光素酶载体共转293a细胞,4~8h后更换dox+/-的新鲜培养液。转染细胞48h后分析其荧光素酶活性以及诱导倍数,具体操作同实施例1。
实施例2在已构建的新型四环素慢病毒诱导表达体系的基础上对五种不同启动子进行了比较分析。从图4a~4b结果看出,反向诱导系统中,cmv启动子虽然具有最高的诱导表达水平,但背景表达水平也很高;pgk启动子则具有最低的背景表达水平,且在诱导活性上与另外三个启动子相近,由于其具有的显著低于其他四着的背景表达水平而导致其诱导倍数显著高于另外四种启动子。故由定量结果可知,pgk启动子由于其不低的诱导活性、最低的背景表达水平以及显著地诱导倍数而最适合于诱导表达体系,具有更好的应用前景。
实施例3新型四环素诱导系统在crispr/cas9体系中的应用
本实施例将新开发的四环素诱导系统应用于crispr/cas9体系中,构建新型诱导型crispr/cas9系统,并于细胞水平验证了诱导型crispr/cas9系统的诱导效率。
(1)pl/cas9-tre3gp/pgk-teton3g载体的构建
以lenticrisprv2(addgene)载体为模板,用上游引物(seqidno:31)与下游引物(seqidno:32)pcr扩增cas9-flag序列,用agei-xbai双酶切pcr产物,然后反向克隆到经同样双酶切的pl/rfp-tre3gp/pgk-teton3g载体中,得到新型诱导型crispr/cas9载体并命名为pl/cas9-tre3gp/pgk-teton3g。
(2)pl/u6-ccdb/cas9-tre3gp/pgk-teton3g载体的构建
以lenticrisprv2(addgene)载体为模板,用上游引物(seqidno:33)与下游引物(seqidno:34)pcr扩增clai位点突变的u6-ccdb序列,用clai-mlui双酶切pcr产物,然后克隆到经同样双酶切的pl/cas9-tre3gp/pgk-teton3g载体中,u6-ccdb与诱导型cas9共表达载体命名为pl/u6-ccdb/cas9-tre3gp/pgk-teton3g。
表4扩增不同载体序列所需引物
(3)新型诱导型crispr/cas9体系的诱导表达水平验证
以(2)制备得到重组载体进行诱导型crispr/cas9系统诱导效率的验证,具体步骤如下所示。
转染前一天293a细胞接种于12孔板,接种后细胞培养12-24h。同实施例1。
待细胞密度达到60%~80%时,进行转染实验,同实施例1。
将实施例3中的诱导型crispr/cas9载体与对照载体pl/luc-tre3gp/pgk-teton3g转染293a细胞。48h后裂解细胞,收集蛋白样品,进行蛋白定量,取30μg的蛋白样品上样,80v恒压条件下跑浓缩胶后再120v恒压跑分离胶。
0.25a恒流转膜2h,转膜后,将膜放置于5%脱脂奶粉封闭液中封闭1h,再用1×tbst将膜洗两遍。
加入用2%bsa(牛血清蛋白)配制的flag、β-actin一抗(1:5000稀释),放置于摇床中,4℃过夜。
第二天用1×tbst将膜洗三次,每次5min,加入用3%脱脂奶粉配制的兔/鼠的二抗(1:5000稀释),置室温杂交1h后进行显色(或化学发光自显影反应)。
实施例3针对新构建的四环素诱导系统在crispr/cas9体系上进行应用,通过诱导表达cas9蛋白构建一种诱导型crispr/cas9系统。从图5结果看出,dox刺激条件下该诱导体系中的反向诱导型启动子tre3gp能高效诱导表达cas9蛋白,且已知u6启动子能启动sgrna的胞内表达,故当研究人员将sgrna通过bsmbi的酶切位点替换掉载体中的ccdb序列,该诱导型crispr/cas9体系能在组成型表达sgrna的同时通过dox诱导表达cas9蛋白。
应当理解的是,本发明的应用不限于上述的举例,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,所有这些改进和变换都应属于本发明所附权利要求的保护范围。
sequencelisting
<110>深圳大学
<120>一种四环素慢病毒诱导表达载体及其建立方法和应用
<160>34
<210>1
<211>863
<212>dna
<213>artificial
<220>
<223>teton3g-p2a基因序列
<400>1
caccatcgatacgcgttctagaaccggtgaattcctcgagttcgaaatgtcaagactgga60
caagagcaaagtcataaactctgctctggaattactcaatggagtcggtatcgaaggcct120
gacgacaaggaaactcgctcaaaagctgggagttgagcagcctaccctgtactggcacgt180
gaagaacaagcgggccctgctcgatgccctgccaatcgagatgctggacaggcatcatac240
ccactcctgccccctggaaggcgagtcatggcaagactttctgcggaacaacgccaagtc300
ataccgctgtgctctcctctcacatcgcgacggggctaaagtgcatctcggcacccgccc360
aacagagaaacagtacgaaaccctggaaaatcagctcgcgttcctgtgtcagcaaggctt420
ctccctggagaacgcactgtacgctctgtccgccgtgggccactttacactgggctgcgt480
attggaggaacaggagcatcaagtagcaaaagaggaaagagagacacctaccaccgattc540
tatgcccccacttctgaaacaagcaattgagctgttcgaccggcagggagccgaacctgc600
cttccttttcggcctggaactaatcatatgtggcctggagaaacagctaaagtgcgaaag660
cggcgggccgaccgacgcccttgacgattttgacttagacatgctcccagccgatgccct720
tgacgactttgaccttgatatgctgcctgctgacgctcttgacgattttgaccttgacat780
gctccccgggagcggagctactaacttcagcctgctgaagcaggctggcgacgtggagga840
gaaccctggacctggatccggtg863
<210>2
<211>719
<212>dna
<213>artificial
<220>
<223>rtta3片段基因序列
<400>2
caccttcgaaatgtctaggctggacaagagcaaagtcataaacggagctctggaattact60
caatggtgtcggtatcgaaggcctgacgacaaggaaactcgctcaaaagctgggagttga120
gcagcctaccctgtactggcacgtgaagaacaagcgggccctgctcgatgccctgccaat180
cgagatgctggacaggcatcatacccacttctgccccctggaaggcgagtcatggcaaga240
ctttctgcggaacaacgccaagtcataccgctgtgctctcctctcacatcgcgacggggc300
taaagtgcatctcggcacccgcccaacagagaaacagtacgaaaccctggaaaatcagct360
cgcgttcctgtgtcagcaaggcttctccctggagaacgcactgtacgctctgtccgccgt420
gggccactttacactgggctgcgtattggaggaacaggagcatcaagtagcaaaagagga480
aagagagacacctaccaccgattctatgcccccacttctgagacaagcaattgagctgtt540
cgaccggcagggagccgaacctgccttccttttcggcctggaactaatcatatgtggcct600
ggagaaacagctaaagtgcgaaagcggcgggccgaccgacgcccttgacgattttgactt660
agacatgctcccagccgatgcccttgacgattttgaccttgacatgctccccgggggtg719
<210>3
<211>519
<212>dna
<213>artificial
<220>
<223>pgk启动子片段基因序列
<400>3
ttccacggggttggggttgcgccttttccaaggcagccctgggtttgcgcagggacgcgg60
ctgctctgggcgtggttccgggaaacgcagcggcgccgaccctgggtctcgcacattctt120
cacgtccgttcgcagcgtcacccggatcttcgccgctacccttgtgggccccccggcgac180
gcttcctgctccgcccctaagtcgggaaggttccttgcggttcgcggcgtgccggacgtg240
acaaacggaagccgcacgtctcactagtaccctcgcagacggacagcgccagggagcaat300
ggcagcgcgccgaccgcgatgggctgtggccaatagcggctgctcagcagggcgcgccga360
gagcagcggccgggaaggggcggtgcgggaggcggggtgtggggcggtagtgtgggccct420
gttcctgcccgcgcggtgttccgcattctgcaagcctccggagcgcacgtcggcagtcgg480
ctccctcgttgaccgaatcaccgacctctctccccaggg519
<210>4
<211>844
<212>dna
<213>artificial
<220>
<223>rfp-polya序列
<400>4
caccaccggtatgagcgagctgatcaaggagaacatgcacatgaagctgtacatggaggg60
caccgtgaacaaccaccacttcaagtgcacatccgagggcgaaggcaagccctacgaggg120
cacccagaccatgaagatcaaggtggtcgagggcggccctctccccttcgccttcgacat180
cctggctaccagcttcatgtacggcagcaaagccttcatcaaccacacccagggcatccc240
cgacttctttaagcagtccttccctgagggcttcacatgggagagaatcaccacatacga300
agacgggggcgtgctgaccgctacccaggacaccagcttccagaacggctgcatcatcta360
caacgtcaagatcaacggggtgaacttcccatccaacggccctgtgatgcagaagaaaac420
acgcggctgggaggccaacaccgagatgctgtaccccgctgacggcggcctgagaggcca480
cagccagatggccctgaagctcgtgggcgggggctacctgcactgctccttcaagaccac540
atacagatccaagaaacccgctaagaacctcaagatgcccggcttccacttcgtggacca600
cagactggaaagaatcaaggaggccgacaaagagacctacgtcgagcagcacgagatggc660
tgtggccaagtactgcgacctccctagcaaactggggcacagataatctagaaacttgtt720
tattgcagcttataatggttacaaataaagcaatagcatcacaaatttcacaaataaagc780
atttttttcactgcattctagttgtggtttgtccaaactcatcaatgtatcttagaattc840
ggtg844
<210>5
<211>358
<212>dna
<213>artificial
<220>
<223>诱导型启动子tre3gp序列
<400>5
gcgttttactccctatcagtgatagagaacgtatgaagagtttactccctatcagtgata60
gagaacgtatgcagactttactccctatcagtgatagagaacgtataaggagtttactcc120
ctatcagtgatagagaacgtatgaccagtttactccctatcagtgatagagaacgtatct180
acagtttactccctatcagtgatagagaacgtatatccagtttactccctatcagtgata240
gagaacgtataagctttaggcgtgtacggtgggcgcctataaaagcagagctcgtttagt300
gaaccgtcagatcgcctggagcaattccacaacacttttgtcttatacttgcggccgc358
<210>6
<211>378
<212>dna
<213>artificial
<220>
<223>诱导型启动子tre3gs序列
<400>6
gcgttttactccctatcagtgatagagaacgtatgaagagtttactccctatcagtgata60
gagaacgtatgcagactttactccctatcagtgatagagaacgtataaggagtttactcc120
ctatcagtgatagagaacgtatgaccagtttactccctatcagtgatagagaacgtatct180
acagtttactccctatcagtgatagagaacgtatatccagtttactccctatcagtgata240
gagaacgtataagcttttgcttatgtaaaccagggcgcctataaaagagtgctgattttt300
tgagtaaacttcaattccacaacacttttgtcttataccaactttccgtaccacttccta360
ccctcgtaaagcggccgc378
<210>7
<211>299
<212>dna
<213>artificial
<220>
<223>诱导型启动子teto6序列
<400>7
cacctctagacgagtttactccctatcagtgatagagaacgatgtcgagtttactcccta60
tcagtgatagagaacgtatgtcgagtttactccctatcagtgatagagaacgtatgtcga120
gtttactccctatcagtgatagagaacgtatgtcgagtttatccctatcagtgatagaga180
acgtatgtcgagtttactccctatcagtgatagagaacgtatgtcgaggtaggcgtgtac240
ggtgggaggcctatataagcagagctcgtttagtgaaccgtcagatcgcaccggtggtg299
<210>8
<211>25
<212>dna
<213>artificial
<220>
<223>引物puro-bamhi-u序列
<400>8
ggatccatgaccgagtacaagccca25
<210>9
<211>26
<212>dna
<213>artificial
<220>
<223>引物puro-spei-d序列
<400>9
actagtcaggcaccgggcttgcgggt26
<210>10
<211>30
<212>dna
<213>artificial
<220>
<223>引物rtta3-bstbi-u序列
<400>10
caccttcgaaatgtctaggctggacaagag30
<210>11
<211>24
<212>dna
<213>artificial
<220>
<223>引物rtta3-smai-d序列
<400>11
cacccccggggagcatgtcaaggt24
<210>12
<211>40
<212>dna
<213>artificial
<220>
<223>引物pgk-xhoi-u序列
<400>12
gcttaattaactcgagttccacggggttggggttgcgcct40
<210>13
<211>42
<212>dna
<213>artificial
<220>
<223>引物pgk-bstbi-d序列
<400>13
tccagccttgacatggtgttcgaaccctggggagagaggtcg42
<210>14
<211>25
<212>dna
<213>artificial
<220>
<223>引物rfp-agei-u序列
<400>14
caccaccggtatgagcgagctgatc25
<210>15
<211>32
<212>dna
<213>artificial
<220>
<223>引物rfp-xbai-d序列
<400>15
aacaagtttctagattatctgtgccccagttt32
<210>16
<211>30
<212>dna
<213>artificial
<220>
<223>引物polya-xbai-u序列
<400>16
acagataatctagaaacttgtttattgcag30
<210>17
<211>25
<212>dna
<213>artificial
<220>
<223>引物polya-ecori-u序列
<400>17
caccgaattctaagatacattgatg25
<210>18
<211>21
<212>dna
<213>artificial
<220>
<223>引物tre3g-xhoi-u序列
<400>18
caccctcgaggcgttttactc21
<210>19
<211>25
<212>dna
<213>artificial
<220>
<223>引物polya-mlui-d序列
<400>19
caccacgcgttaagatacattgatg25
<210>20
<211>21
<212>dna
<213>artificial
<220>
<223>引物teto6-xhoi-u序列
<400>20
caccctcgagtagacgagttt21
<210>21
<211>26
<212>dna
<213>artificial
<220>
<223>引物luc2p-agei-u序列
<400>21
caccaccggtatggaagatgccaaaa26
<210>22
<211>25
<212>dna
<213>artificial
<220>
<223>引物luc2p-xbai-d序列
<400>22
cacctctagattagacgttgatcct25
<210>23
<211>35
<212>dna
<213>artificial
<220>
<223>引物cmv-xhoi-u序列
<400>23
caccctcgagcgcgttattaatagtaatcaattac35
<210>24
<211>38
<212>dna
<213>artificial
<220>
<223>引物cmv-bstbi-d序列
<400>24
ggtgttcgaagcgccggtgccagtaagcagtgggttct38
<210>25
<211>30
<212>dna
<213>artificial
<220>
<223>引物ef1a-xhoi-u序列
<400>25
caccctcgagaaggatctgcgatcgctccg30
<210>26
<211>30
<212>dna
<213>artificial
<220>
<223>引物ef1a-bstbi-d序列
<400>26
caccttcgaagcgccggtcacagcttggat30
<210>27
<211>35
<212>dna
<213>artificial
<220>
<223>引物ubc-xhoi-u序列
<400>27
caccctcgagcgcgtggcctccgcgccgggttttg35
<210>28
<211>38
<212>dna
<213>artificial
<220>
<223>引物ubc-bstbi-d序列
<400>28
ggtgttcgaagcgccggtatggatccgctagcgtctaa38
<210>29
<211>35
<212>dna
<213>artificial
<220>
<223>引物sv40-xhoi-u序列
<400>29
caccctcgagcgcgtgcgcagcaccatggcctgaa35
<210>30
<211>38
<212>dna
<213>artificial
<220>
<223>引物sv40-bstbi-d序列
<400>30
ggtgttcgaagcgccggtaagctttttgcaaaagccta38
<210>31
<211>30
<212>dna
<213>artificial
<220>
<223>引物cas9-agei-u序列
<400>31
caccaccggtatggacaagaagtacagcat30
<210>32
<211>29
<212>dna
<213>artificial
<220>
<223>引物flag-xbai-d序列
<400>32
caccacgcgtttacttatcgtcatcgtct29
<210>33
<211>28
<212>dna
<213>artificial
<220>
<223>引物u6-clai-u序列
<400>33
caccatcgatgagggcctatttcccatg28
<210>34
<211>34
<212>dna
<213>artificial
<220>
<223>引物ccdb-mlui-d序列
<400>34
caccacgcgtaaaaaagcaccgactcggtgccac34
- 还没有人留言评论。精彩留言会获得点赞!