色素上皮衍生因子的衍生多肽系列对于保护缺血心肌的用途的制作方法
本发明属于生物医药技术领域,涉及色素上皮衍生因子的衍生多肽,特别涉及在医学中应用的具有保护缺血心肌的多肽。此外,本发明还涉及该系列多肽用于制备药物组合物以及用以缺血心肌保护的方法。
背景技术:
目前已有色素上皮细胞衍生因子(pigmentepitheliumderivedfactor,pedf)源多肽应用专利,主要保护功能涉及:抑制和/或改善皮肤衰老、治疗血管增生性眼病、治疗骨关节炎、脱发和/或头发褪色、抑制肿瘤血管新生、治疗肝硬化及促进干细胞增殖和伤口愈合等。
当前预防和治疗缺血性心脏病(ischemicheartdisease,ihd)和急性心肌梗死(acutemyocardialinfarction,ami)的主要手段和目标主要是通过抗凝、降压降血脂,舒张血管等方式,以及急性心梗后早期时间窗内,采用血管再通技术挽救濒死心肌,减少梗死心肌面积,促进血管侧枝循环形成,改善缺血心脏功能。但是,由于堵塞冠状动脉有效再通时间窗较短,病变冠状动脉再通的黄金时间窗一旦延误,通常只能选择保守治疗,这将严重影响了患者的生存、生活质量甚至危及生命。
针对缺血性心脏病发病率及死亡率较高以及血管再通治疗时间窗短暂的难题,本发明专利提供了一种可以抑制冠状动脉血管内慢性炎症、减少动脉粥样硬化斑块形成;促进未成熟的的微血管结构趋于稳定,进而在心肌梗死发生时,能够及时的为缺血区域提供替代性的血供来源,并且抑制病理进程中肿大的间质水肿对包括侧枝微循环血管在内的所有血管的压迫情况,维持血管的有效开放,进而达到挽救缺血心肌的目的;改善缺血心肌微循环灌注,延长血管再通治疗时间窗,预防急性心梗事件发生;抗缺血心肌细胞死亡,保护缺血心肌功能的多肽系列。
技术实现要素:
本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本申请的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
鉴于上述和/或现有生物医药技术领域中对保护心肌细胞存在的问题,提出了本发明。
因此,本发明其中一个目的是提供一种具有保护缺血(缺氧)心肌作用的多肽系列。
本发明还有一个目的是提供一种用以缺血心肌保护的组合物。
本发明再一个目的是提供一种用以缺血心肌保护的组合物。
本发明还有一个目的是提供一种用以预防缺血性心脏病发生的保健类方法。
本发明还有一个目的是提供一种用以预防缺血性心脏病的保健类组合物。
本发明所具有的有益效果:
(1)本发明设计的pedf源功能肽具有良好的功能优势,对于心肌组织中微血管的稳定、抗血管渗漏,心肌细胞保护、抗心肌组织炎症等作用效果显著。
(2)本发明设计的pedf源功能肽具有极高的功能选择性,仅在缺血(氧)组织、细胞中发挥作用;对于新生内皮细胞(tipcell)具有促凋亡的抑制生长的作用,对于成熟的内皮细胞(phanlaxcell)具有保护稳定作用。因此,对于缺血性心脏疾病的疗效更高,且副作用更低。
(3)本发明设计的pedf源功能肽具有不同的作用靶点,心肌细胞和内皮细胞表面具有不同的pedf受体,因而可分别发挥不同方面的心血管保护作用。
(4)pedf是人体内天然存在的多功能蛋白质,本发明发现了其在缺血心肌保护方面的作用,而制取针对性功能小肽段组合,相较于化学合成药物,应用生物安全性更高。
(5)基于急性心肌梗死发展的病理阶段合理选用pedf功能肽组合(可选择单种制剂使用或混合制剂),相较于全过程使用全蛋白pedf,可以更好的提高效价,减少副作用。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
图1是筛选能够替代大分子蛋白pedf的多肽的步骤,其中
图a是单独使用4种多肽,以caspase-3凋亡指标筛选它们对缺氧h9c2细胞的保护作用;图b是通过划痕实验,筛选对抑制内皮细胞新生有作用的肽段;图c是通过wb实验定量粘附连接ve-cadherin在膜上和胞浆里的分布情况,筛选具有保护缺氧内皮细胞粘附连接效果的多肽;图d联合使用两种肽段,caspase-3凋亡指标,验证组合使用是否对44mer抑制h9c2细胞凋亡产生影响;图e是通过划痕实验,验证组合使用是否对34mer和33mer抑制内皮细胞新生的效果产生影响;图f是通过wb实验定量粘附连接ve-cadherin在膜上和胞浆里的分布情况,验证联合使用其他肽段是否会对34mer保护粘附连接的效果产生影响。
图2是pedf/34mer通过保护pparγ依赖性的紧密连接,抑制低氧诱导的内皮通透性增高和血管渗漏的示意图,其中,
图a为各分组大鼠心脏伊文斯蓝灌注后染色情况:a.正常组;b.sipedf组;c.pedf转染组;d.空载体转染组;e.溶剂对照组;e.假手术组;图b为各组大鼠心肌组织中伊文斯蓝染料定量统计示意图;图c、d、e为各分组组织蛋白中ve-cadherin、p-ve-cadherin、occludin蛋白表达情况示意图;
图3是pedf能够减少缺氧引起的内皮细胞通透性的增加,同时还可以保护缺氧处理后pparγ蛋白的表达,其中,
图a为冠状动脉内皮细胞缺氧4小时后,各分组内皮细胞渗漏情况示意图;图b为冠状动脉内皮细胞在缺氧时,wb实验检测ppar-γ表达量示意图。
图4是验证pedf保护内皮细胞的紧密连接蛋白从而降低内皮细胞通透性的作用是通过pparγ介导的,其中,
图a为加入g(pparγ抑制剂),观察各分组细胞通透性情况示意图;
图b为加入g(pparγ抑制剂),检测紧密连接蛋白的表达情况示意图。
图5是pedf/34mer通过抑制lr磷酸化保护缺氧状态血管内皮细胞的粘附连接并减少渗漏的发生的示意图,其中,
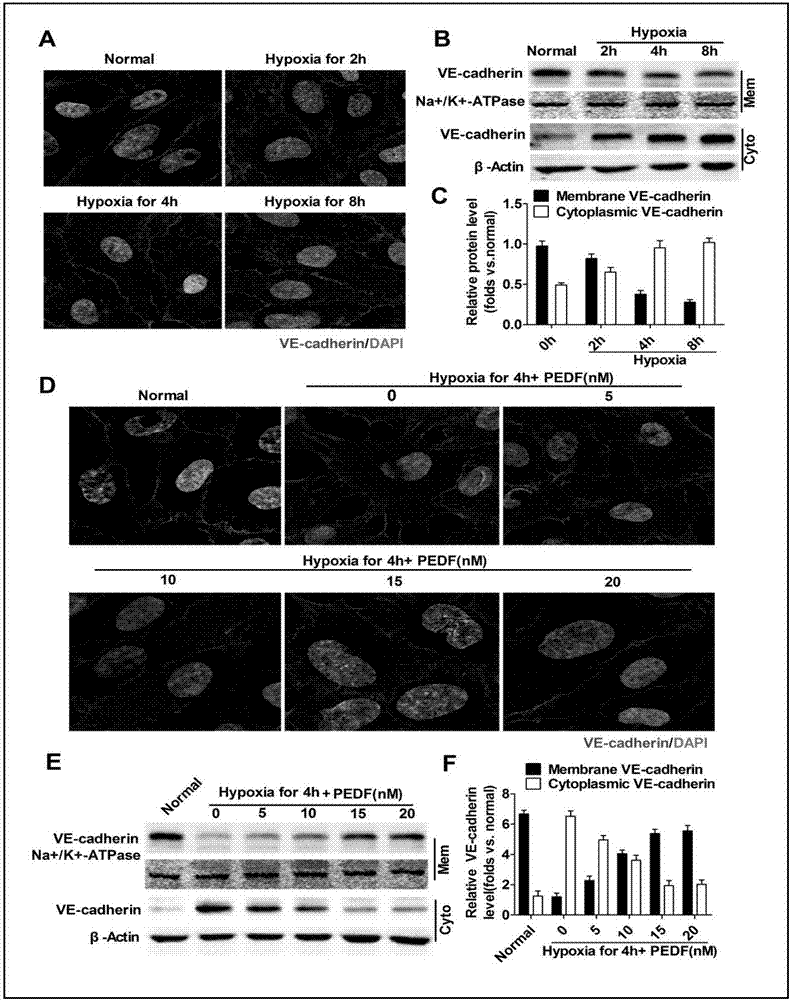
图a为在共聚焦显微镜下,不同缺氧时间下的冠状动脉内皮细胞ve-cadherin免疫荧光染色成像情况示意图;图b、c分别为各分组细胞蛋白提取后wb检测ve-cadherin表达情况示意图;图d为共聚焦显微镜下,缺氧细胞加入pedf后,冠状动脉内皮细胞ve-cadherin免疫荧光染色成像情况示意图;图e、f分别为加入pedf后各分组细胞蛋白提取后wb检测膜上和总的ve-cadherin表达情况示意图。
图6是pedf/44mer对缺氧处理下h9c2细胞以及原代心肌细胞存活的影响示意图。
图7是pedf及44mer对缺氧原代培养心肌细胞的保护作用示意图,其中,
图a为在共聚焦显微镜下,pedf及44mer对缺氧原代培养心肌细胞的保护作用情况示意图;图b为原代心肌细胞条件处理后tunel试剂染色统计凋亡情况示意图。
图8是pedf/44mer对心肌血管渗透性的影响示意图,其中,
左图为各组心脏伊文斯蓝灌注后心肌组织染色情况示意图;
右图为心肌组织中染料的定量统计图示意图。
图9是pedf通过结合心肌细胞的pedfr受体,发挥多重保护心肌细胞的生物学效应示意图,其中,图a为wb检测h9c2细胞膜表面的pedfr蛋白表达示意图;图b为外源性重组pedf孵育12小时后,免疫共沉淀检测pedf与pedfr连接复合物示意图。
图10是pedf与44mer通过pedfr抑制糖氧剥夺诱导的氧化应激示意图,其中,
图a、b分别为ogd处理下的h9c2细胞及sipedfr后pedfr的蛋白与核酸表达水平示意图;图c、d分别为各组处理后ros产生的dcfh-da荧光染色以及荧光强度统计示意图;图e为tba法检测mda含量示意图;
图f为采用黄嘌呤氧化酶法检测sod活性示意图。
图11是pedf/44mer通过pedfr介导的抑制缺氧诱导的凋亡作用保护缺氧下的h9c2细胞示意图,其中,
图a、b分别为各分组下的tunel染色情况及统计示意图;
图c、d、e分别为各分组下caspase3蛋白表达情况示意图。
图12是pedf通过lr介导的多重生物学效应,发挥保护冠状动脉内皮细胞的作用示意图,其中,
图a为位点磷酸化病毒转染后lr等蛋白的表达情况;图b为病毒转染后各分组冠状动脉内皮细胞ve-cadherin(红)荧光染色共聚焦成像情况。
图13是pedf能够促进新生血管内皮细胞的凋亡而对正常的内皮细胞没有任何影响示意图,其中,图a为各分组情况下的c-caspase-8、c-caspase-3蛋白的表达情况示意图;图b为相应分组情况下的c-caspase-8、c-caspase-3蛋白的表达情况统计结果示意图。
图14是pedf对心梗后甘油三酯累积的影响示意图,其中,
图a为wb检测梗死及转染sipedf病毒载体后各心脏组织pedf蛋白的表达情况示意图;图b为梗死及转染sipedf病毒载体后各心脏组织pedf蛋白的表达情况统计示意图;图c为心肌组织脂质油红染色示意图;图d为相应分组组织中tg含量统计示意图;图e为h9c2细胞脂质油红染色示意图;
图f为相应分组统计结果示意图;图g为生化方法检测胞内脂肪含量定量分析示意图;图h为tg含量定量分析示意图。
图15是pedf在缺氧情况下能够抑制缺氧诱导的p53线粒体异位,而pedf对正常细胞的p53的表达不产生任何影响,
其中,图a为各分组情况下p53与mdm2细胞总蛋白的蛋白表达情况示意图;图b为各分组情况下p53与mdm2线粒体中蛋白的表达情况示意图。
图16不仅阐明在正常心脏组织中存在着部分静息状态下不工作但是血管堵塞发生后迅速打开的储备性侧支微血管,这部分血管结构上存在不成熟的特征,如黏附连接不稳定等。pedf及其功能肽段可以促进该部分血管趋于成熟,进而预防堵塞事件的发生并且在堵塞发生时有效的提供替代性灌注维持心肌的存活。
其中,图a为各分组情况下,心脏组织经过lectin灌注之后,行组织冰冻切片,然后进行cd31免疫荧光染色,普通荧光显微镜观察两者的重合情况;图b为正常心脏组织经过lectin灌注之后,行组织冰冻切片,然后进行ve-cadherin免疫荧光染色,激光共聚焦显微镜分别观察侧支微血管和静息供血血管的黏附连接情况,并对比pedf处理前后ve-cadherin的变化。
由此可见,在无冠脉堵塞性疾病的人群中,单独使用34mer或采用34mer+44mer可以稳定和强壮包括侧支微血管在内的冠脉循环微血管,从而达到预防缺血性心脏病发生的效果,具有十分优秀的保健作用。
图17pedf及34mer能够有效的抑制损伤内皮细胞炎症因子的产生和释放。图a34mer能够有效的抑制内皮细胞il-β的产生和释放。图b34mer能够有效的抑制内皮细胞tnf-α的产生和释放。
图1834mer联合44mer在在体水平上能够轻微的改善心脏功能并大幅的提高心脏功能储备。图a为心肌梗死三天后各组大鼠心脏彩超fs情况;图b为心肌梗死三天后各组大鼠心脏彩超ef情况;图c为心肌梗死三天后各组大鼠多巴酚丁胺负荷试验种彩超显示fs情况;图d为心肌梗死三天后各组大鼠多巴酚丁胺负荷试验种彩超显示ef情况。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例对本发明的具体实施方式做详细的说明。
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
根据一般约定书写本文提及的所有的肽序列,其中n端氨基酸在左边,而c端氨基酸在右边。在两个氨基酸残基之间的短线指示肽键。
本发明的化合物可以以药用盐的形式提供。优选的盐的实例是与药用有机酸以及聚合酸形成的那些和与无机酸形成的盐,所述有机酸如乙酸、乳酸、马来酸、柠檬酸、苹果酸、抗坏血酸、琥珀酸、苯甲酸、水杨酸、甲磺酸、甲苯磺酸、三氟乙酸或双羟萘酸,所述聚合酸如鞣酸或羧甲基纤维素,所述无机酸如氢卤酸(例如,盐酸、硫酸或磷酸等)。可以使用本领域技术人员已知的获得药用盐的任何方法。
为了描述本发明的方便,使用各种氨基酸残基的常规和非常规缩写。这些缩写是本领域技术人员熟悉的,但是为了清楚在下面列出:
asp=d=天冬氨酸;ala=a=丙氨酸;arg=r=精氨酸;
asn=n=天冬酰胺;gly=g=甘氨酸;glu=e=谷氨酸;
gln=q=谷氨酰胺;his=h=组氨酸;ile=i=异亮氨酸;
leu=l=亮氨酸;lys=k=赖氨酸;met=m=甲硫氨酸;
phe=f=苯丙氨酸;pro=p=脯氨酸;ser=s=丝氨酸;
thr=t=苏氨酸;trp=w=色氨酸;tyr=y=酪氨酸;
val=v=缬氨酸;cys=c=半胱氨酸。
pedf简述:pedf是一种分子量为50kd的分泌性糖蛋白,它首先在培养人视网膜色素上皮(rpe)细胞分泌产物中被发现并纯化。人类的pedf蛋白编码基因位于人第17号染色体的短臂末端,由418个氨基酸编码的多肽组成,属于丝氨酸蛋白酶非抑制因子超家族的成员。它广泛表达在人体眼部,脑,脊髓,骨,肝,心,肺等多处组织和器官在人体的病理生理过程中扮演着极其重要的角色。pedf是一个多结合位点的多效蛋白,可发挥多种生物学作用,包括抑制内皮细胞迁移和血管生成,抗肿瘤,抗炎,抗氧化以及神经营养、细胞抗坏死、抗凋亡等作用。pedf的肝素结合位点、胶原结合位点可以使得pedf沉积于组织间质中。
我方发明研究显示,pedf在心肌组织中表达极高,是重要的心脏内环境调节及心血管保护性因子,并且本课题组以往的研究已经证明pedf对于缺血性心脏病的具有令人咋舌的多机制的保护作用,若能用于制药,定然会成为广大心梗患者的福音。然而,由于pedf分子量过大,不易制药亦不易吸收,而且pedf是多功能蛋白,虽然具有着多种方向的保护缺血心脏的作用,但是持续使用却难以和缺血性心脏病不同阶段多变的病理生理变化相匹配等弊端,临床用药难度很大。
本发明研究涉及33mer、43mer、34mer、44-mer的内容如下:
33mer:33mer中的氨基酸序列(16-26aa)位于全长pedf的近端,是pedf的短肽中比较重要的一部分,大量的研究证明pedf抑制视网膜黄斑病变以及其他致盲性疾病与该部序列有关。
43mer:43mer的序列包含了pedf结合肝素受体的氨基酸序列、透明质酸受体的氨基酸序列以及部分氨基葡聚糖结合位点。43mer与该部分受体结合后能够发挥多种生物学效应。
34mer:pedf的34-mer是pedf结合内皮细胞表面的层黏连蛋白受体(lamininreceptor--67lr,67-kda)重要的靶点序列,两者结合后能够发挥多种生物学效应。34-mer结合层黏连蛋白受体后可以抑制内皮细胞迁移、诱导jnk依赖的内皮细胞凋亡,进而抑制新生血管的形成;p18(aa39-57,34-mer一个片段)可以如母链(pedf)一样,诱导vegf培养的内皮细胞凋亡。同时,pedf还可以通过下调vegf水平抑制血管新生。
44-mer:pedf的44-mer与它的受体(pedfr)结合的重要靶点序列,两者结合之后具有多种保护缺血性心肌细胞的作用。研究发现,pedf及其衍生肽44mer能通过激活pedf-r的pla2活性,上调pparγ,增强抗氧化能力,抑制h9c2细胞糖氧剥夺(ogd)诱导的细胞凋亡、程序性坏死和氧化损伤;研究还发现,pedf衍生肽44mer也可激活pedfr脂肪酶活性。pedf衍生肽44mer能够有效的保护眼部血管通透性,一定程度上降低血管渗漏的发生。
实施例1
1.1参见说明书附图图1,
通过分析pedf氨基酸排列以及空间结构,从pedf已知的在心脏中能够结合受体的功能性肽段中筛选出对应的维持血管稳定性和抑制心肌细胞凋亡坏死的肽段,并将这些功能性的多肽进行交叉组合,通过一系列的实验验证它们对于保护缺血心肌的作用,从而得出最佳的能够替代pedf的功能肽段或者肽段组合。设计筛选过程分为三步:
第一步:通过整合既往关于pedf的研究结果并进行分析归纳,筛选出全长pedf中结合心脏中pedf受体所对应的功能性多肽,筛选结果如下:
34mer序列(44-77aa):dpffkvpvnklaaavsnfgydlyrvrssmspttn
44mer序列(78-121aa):vllsplsvatalsalslgaeqrtesiihralyydlisspdihgt
33mer序列(5-36aa):vlllwtgallghgssqnvpdssqdspapdstg
43mer序列(131-173aa):apeknfksasrivferklrvkssfvapleksygtrpriltgnp
第二步:分别验证四个肽段对于维持内皮细胞稳定性和抑制缺氧h9c2细胞凋亡坏死的效果。
第三步:探究肽段的组合使用对多肽自身的效价的影响。
人脐静脉内皮细胞培养与胞缺氧模型
人脐静脉内皮细胞购买于sciencell公司。具体培养按说明书操作,现简述如下:所有内皮细胞用ecm培养基培养,其中包含5%胎牛血清,1%的青链霉素。应用3气培养箱,培养条件为37℃,5%co2和21%o2。每24小时更换一次培养基,隔天传代。细胞生长至80%时,可进行传代。应用0.25%的胰酶消化,大约1min后,在显微镜下观察当细胞形成圆形时用带血清培养基中和胰酶,停止消化。传代比例为1:3。所有用于研究的内皮细胞代数在3-6代之间。内皮细胞生长至80%融合后,更换0.1%浓度fbs的ecm,细胞饥饿24h后置于缺氧培养箱(37℃,5%co2,1%o2)。用于模拟心梗时内皮细胞缺氧环境。
蛋白及肽段的使用
根据参考文献及本研究中量效关系的实验,pedf蛋白使用浓度为15nm。为避免蛋白及肽段分解,长期保存放置于-80℃冰箱内,短期使用放置于-20℃,分装使用,避免反复冻融影响效价。蛋白及肽段根据相应浓度,以培养基稀释,干预细胞时需先共孵育1h后再行缺氧处理。
划痕实验方法:
(1)先用marker笔在6孔板背后,用直尺比着,均匀得划横线,大约每隔0.5~1cm一道,横穿过孔。每孔至少穿过5条线。
(2)在空中加入约5x105个细胞,具体数量因细胞不同而不同,掌握为过夜能铺满。
(3)第二天用枪头比着直尺,尽量垂至于背后的横线划痕,枪头要垂直,不能倾斜。
(4)用pbs洗细胞3次,去处划下的细胞,加入无血清培养基。
(5)放入37度5%co2培养箱,培养。按0,6,12,24小时取样,拍照。
蛋白提取及westernblot方法:
(1)裂解细胞:每10cm培养皿加500μl裂解液,冰上或4℃裂解30min。
(2)离心:4℃下,14000rpm离心20min后,取上清。留15-20μl样本用于蛋白定量,其余样本储存于-20℃冰箱备用。
(3)bca法蛋白定量:
取10个试管,按如下标准加入相应试剂(1-4为标准管,5-10为样本),每管共2.4ml。
加入folin甲,每管2ml,立即混匀,30℃水浴箱30min;
加入folin乙,每管200μl。振荡混匀,30℃水浴箱30min;
分光光度计测蛋白od值,计算蛋白浓度;
(4)样本与蛋白处理液按3:1比例混匀后,煮沸10min,使蛋白充分变性;自然冷却,置于-20℃保存备用。
(5)配制聚丙烯酰胺凝胶:
分离胶:
1.5mtris-hcl2ml;acr-bis2.67ml;10%sds0.08ml;双蒸水3.25ml。混匀后加入10%ap0.04ml;temed0.004ml。振荡混匀后,加入电泳槽玻璃板,室温下放置30min待胶凝固。
浓缩胶:
0.5mtris-hcl1ml;acr-bis0.53ml;10%sds0.04ml;40%sucrose1.2ml;双蒸水1.23ml;混匀后加入10%ap0.02ml;temed0.004ml。振荡混匀后,加入电泳槽玻璃板。室温下放置40min待胶凝固。
具体步骤:sds-page蛋白电泳分离样品(电压:浓缩胶80v,分离胶100v;时间约120min)。按照正极-3层blotpaper-硝酸纤维酯膜-电泳胶-3层blotpaper-负极的顺序放置好blot,湿转条件:12h、电压15v。将膜置于封闭液(5%脱脂奶粉,0.1%tween-20溶于pbs中),室温下封闭1h。按检测目的分别加入封闭液稀释一抗,4℃反应过夜,用pbst(0.1%tween20溶于pbs中)洗涤三次,每次5min。加入封闭液稀释荧光二抗(1:100),室温反应1h,pbst洗涤三次,每次10min,避光操作。采用远红外显像系统对结果进行扫描,imagej软件进行蛋白定量分析,采用目的蛋白灰度值与内参(β-actin)灰度值比值进行统计分析。
h9c2细胞培养方法:购买于北纳创联公司。具体培养现简述如下:所有细胞用dmem培养基培养,其中包含5%胎牛血清,1%的青链霉素。应用3气培养箱,培养条件为37℃,5%co2和21%o2。每24小时更换一次培养基,隔天传代。细胞生长至80%时,可进行传代。应用0.25%的胰酶消化,大约1min后,在显微镜下观察当细胞形成圆形时用带血清培养基中和胰酶,停止消化。传代比例为1:3。所有用于研究的细胞代数在3-6代之间。细胞生长至80%融合后,更换0.1%浓度fbs的dmem,细胞饥饿24h后置于缺氧培养箱(37℃,5%co2,1%o2)。用于模拟心梗时心肌细胞缺氧环境。
蛋白提取及westernblot方法参照上述方法。
根据图a、图b和图c可以得出如下结论:
图a.44mer能够发挥全长pedf对于抑制缺氧h9c2细胞凋亡和坏死的70%左右的效价,其他三者效果不佳;
图b33mer与34mer均具有抑制内皮细胞增生的作用,其中34mer够发挥全长pedf对于抑制内皮细胞新生的75%左右的效价,33mer约能发挥全长pedf50%作用的效价。34mer在抑制内皮细胞新生方面优于33mer,其他两者无明显作用。
图c:34mer能够发挥pedf保护缺氧内皮细胞黏附连接稳定大部分的效果,而其他多肽均无这方面的作用
注:总结图a、图b和图c的结果可以发现34mer、33mer与44mer分别发挥维持内皮细胞稳定性以及抑制缺氧h9c2细胞凋亡坏死的效果,其中,在保护内皮细胞稳定性方面,相对于全长pedf来说34mer的效价更高也更全面,我们推测联合使用34mer与44mer能代替大分子量pedf对于治疗急性心梗的疗效。故下一步需验证多肽间的组合使用对各自的功能是否会产生影响。
将四种多肽两两组合,分别在h9c2细胞以及内皮细胞上验证在抑制凋亡和维持内皮稳定方面的功效。具体方法参见上述。
结论:图d44mer与其他三者组合均能发挥一定的抑制缺氧h9c2细胞凋亡和坏死的效果,联合使用34mer和44mer在抑制缺氧h9c2细胞凋亡坏死方面略优于单独使用44mer,其他组合则没有效果。
图e除43mer与44mer组合无作用之外,其他五种组合都具有不同程度的抑制内皮细胞新生的效果,其中33mer+34mer效价最好,34mer+44mer不影响34mer的效价。
图f含有34mer的组都具有一定程度上的保护缺氧条件下内皮黏附连接稳定性的效果,并且与其他三者的组合并不会影响34mer的效果。
1.2参见说明书附图图2,
实验动物,健康成年sd大鼠,雄性,体重(220±30)g,由徐州医科大学动物实验中心提供。实验过程中对动物处置符合中华人民共和国科学技术部颁布的《关于善待实验动物的指导性意见》标准。实验动物生产许可证号:scxk(苏)2010~0003使用许可证号:syxk(苏)2010~0011。
大鼠心肌梗死动物模型建立用2%戊巴比妥钠(2ml/kg)对sd大鼠进行腹腔麻醉,以角膜反射消失,肌张力减弱及呼吸浅慢均匀为麻醉成功的标准,麻醉后将其固定在实验动物操作台。接三导联心电图及动物用呼吸机装置,监测术中心电图的变化。
常规备皮,消毒,铺无菌洞巾;胸骨正中偏左约0.5cm,第3、4肋间隙进胸,剪开心包,充分暴露心脏,探查动脉圆锥,结扎点位于动脉圆锥下方,此处即为大鼠左前降支,用6-0无损伤缝合针缝扎、阻断冠状动脉左前降支。结扎后缺血区域颜色由鲜红变为暗紫色。心电图显示,结扎后st段弓背向上抬高,表明血管结扎确切,心肌梗死模型建立成功,按实验分组处理完毕后关胸,心电监护及呼吸机辅助呼吸下观察10min,状态稳定后将实验动物送动物中心常规饲养。术后肌注青霉素(100mg/kg),预防感染。
实验样本取材
各组实验动物常规饲养,在实验设计时间点,过量麻醉处死动物,开胸,迅速取出心脏,置于冰生理盐水中。pbs缓慢逆行灌注冲洗冠脉系统内血液,各实验组均取病毒注射部位心肌组织,置-80℃冰箱冻存;用于组织学检测的组织oct包埋剂固定、备用。需要进行蛋白检测的组织使用裂解液获得细胞裂解液,通过westernblot进一步检测相应蛋白表达。四周后取材,经主动脉行伊文斯蓝灌注,观察并定量各分组心肌组织中伊文斯蓝染色情况。同时提取组织蛋白行westernblot实验,对各组组织中紧密连接蛋白zo-1、occludin以及粘附连接蛋白ve-adherin定量。结果发现pedf/34mer能够通过保护血管内皮连接功能,发挥抑制心梗状态引起的血管通透性增加并减少渗漏产生的作用,同时证明了这种保护作用是通过pparγ所介导的。
1.3参见说明书附图图3、图4,
内皮细胞培养和蛋白提取以及wb见图1
结果显示pedf保护内皮细胞的紧密连接蛋白从而降低内皮细胞通透性的作用是通过pparγ介导的。
1.4参见说明书附图图5,
人冠状动脉内皮细胞ve-cadherin免疫荧光检测缺氧处理后粘附连接变化,
具体操作如下:
(1)人冠状动脉内皮细胞培养,方法见上;(2)吸去培养基,pbs清洗3遍,按实验目的加入兔抗大鼠抗体ve-cadherin、(为1:800,0.3%trition稀释),4℃孵育过夜;(以下步骤均避光操作)(3)室温下,0.01mol/lpbs洗孔板内细胞,5min×3次;加入alexafluor594标记的驴抗兔igg荧光二抗(1:400)和alexafluor488标记的驴抗山羊igg荧光二抗(1:400),室温孵育1h;(4)0.01mol/lpbs洗孔板内细胞,5min×3次;加入dapi染细胞核5~10min;(5)0.01mol/lpbs洗孔板内细胞,5min×3次;加入荧光防淬灭剂;(6)荧光显微镜下观察,随机选取十个高倍视野(×400倍)拍照,image-proplus软件对细胞计数分析。
人冠状动脉内皮细胞ve-cadherinwb蛋白表达情况,方法如上;
实验通过对各种处理条件下冠状动脉内皮细胞粘附连接蛋白ve-cadherin的免疫荧光染色以及wb定量检测,发现pedf/34mer能够有效的抑制缺氧诱导下的黏附连接蛋白ve-cadherin磷酸化和内吞,维持ve-cadherin和beta-catenin连接复合物的稳定,从而达到保护内皮细胞黏附连接,抑制渗漏发生的作用。同样的实验在大鼠在体上进行,结果证明pedf/34mer能够有效的保护ami大鼠心脏微血管内皮细胞黏附连接,抑制ve-cadherin内吞,减少渗漏的发生并改善心脏灌注功能。
1.5参见说明书附图图6、图7,
原代心肌细胞提取与培养。
从1日龄新生sd大鼠短暂分离心肌细胞,新生大鼠戊巴比妥钠麻醉实施斩首。心脏被迅速地移到冰上的盘子里,丢弃了主动脉、心房和右心室。然后左心室的解剖和切成1毫米片转移到无菌管,冲冷pbs溶液(136.9mmol/lnacl,2.7mmol/lkcl、8.1mmol/lna2hpo4,1.5mmol/l磷酸二氢钾,ph7.3)去除血凝块。在5℃的pbs溶液中加入0.1%胰蛋白酶、0.1%胶原酶和0.02%葡萄糖在37℃下消化,用0.1mmol/l的brdu孵育,通过抑制心肌成纤维细胞的生长,选择性地富集心肌细胞。dmem培养基中培养。
显示出缺氧模型采用心肌细胞原代培养3~4天/h9c2细胞传代1~2天后,细胞换液加入不含fbs或0.1%浓度fbs的高糖dmem,细胞饥饿24h后,pbs洗3遍,加入d-hank's液作为缺氧培养基并置于缺氧培养箱(37℃,5%co2,1%o2)。细胞缺氧的时间为24h。westernblotting法检测凋亡坏死相关蛋白。原代心肌采用tunel凋亡检测。结果证明pedf/44mer能够有效抑制缺氧下的h9c2细胞的凋亡和坏死。h9c2细胞缺氧24小时后,提取蛋白行wb实验检测caspase3和rip3表达。
结果显示pedf及44mer能够显著抑制缺氧心肌细胞的凋亡。
1.6参见说明书附图图8,
大鼠心梗模型建立见1.1.本实验采用大鼠冠状动脉左前降支结扎模型模拟mi状态,取材后,经主动脉行伊文思蓝灌注,观察并定量各分组心肌组织中伊文思蓝染色情况。发现44mer同样具有一定程度上的抑制渗漏的作用。
1.7参见说明书附图图9,
原代心肌细胞培养,方法参照见1.4。应用膜蛋白提取试剂盒(凯基生物)提取膜蛋白,行wb检测pedfr蛋白定量。
心肌细胞pedf-r基因转染
心肌细胞原代培养3~4天,细胞换液加入含pedf-r-lv或sipedf-r-lv(1:100)的dmem继续培养,48h后根据gfp阳性细胞数判断转染效率。
免疫共沉淀
心肌细胞培养72h后,在冰上进行后续操作。刮下细胞,用冷pbs液冲洗2遍,离心,弃上清,加人100μlripa裂解液,冰浴30min,加入1μg兔抗大鼠pedf抗体/山羊抗大鼠pedf-r抗体,4℃旋转混合2h,加入20μl蛋白a,继续混合12h,离心,去上清后,用ripa裂解液洗沉淀3遍,加入20μl2×上样缓冲液,煮沸5min,稍离心后,立即进行电泳。免疫共沉淀确定pedf结合心肌细胞上的pedfr,发挥多重保护作用。
1.8参见说明书附图图10、图11,
dcf法测定活性氧
(1)原理:dcfh-da本身无荧光,可以自由穿过细胞膜,进入细胞内后,可以被细胞内的酯酶水解生成dcfh。而dcfh不能通透细胞膜,从而使探针很容易被装载到细胞内。细胞内的活性氧可以氧化无荧光的dcfh生成有荧光的dcf。检测dcf的荧光即可间接测得细胞内活性氧的水平。
(2)材料与仪器
dcfh-da购自sigma公司,分子量487,用dmso溶解,4.87mg/ml配成10mm,终浓度稀释成25μm;synergy2多功能酶标仪。
(3)步骤
①接种细胞:96孔板,接种细胞数为每孔1.5万个细胞;
②dcfh-da孵育:接种24小时后用pbs液洗两遍,并换上终浓度为25μmdcfh-da培养箱孵育30min;
③处理:dcfh-da孵育结束后,用pbs液洗两遍,给予缺氧处理;
④检测:synergy2多功能酶标仪检测荧光,488nm激发波长,525nm发射波长。
酶联免疫吸附法(elisa)测定
(1)原理:用待测物单抗包被于酶标板上,标准品和样品中的待测物与单抗结合,加入生物素化的单抗,形成免疫复合物连接在板上。辣根过氧化物酶标记的streptavidin与生物素结合,加入底物工作液显蓝色,最后加终止液硫酸,在450nm处测od值,通过绘制标准曲线得出待测物浓度。
(2)样品准备
将细胞样品至于1.5mlep管中,13000r/min4℃离心15-25min,取上清液,编号保存于-20℃冰箱保存。
(3)elisa检测
①每孔加入标准品或待测样品100μl,将反应板充分混匀后置于37℃中,水浴加热40min;
②洗板:用洗涤液将反应板充分洗涤4-6次,像滤纸上印干;
③每孔加入蒸馏水和第一抗体工作液各50μl(空白除外)。将反应板充分混匀后置于37℃中,水浴加热20min;
④洗板:同前;
⑤每孔加酶标抗体工作液100μl,将反应板充分混匀后置于37℃中,水浴加热10min;
⑥洗板:同前;
⑦每孔加入底板工作液100μl,置于37℃中,水浴加热15min(以下步骤需要避光);
⑧每孔加入终止液100μl混匀;
⑨30min内用酶标仪在450nm出测吸光值;
⑩根据样品od值计算出相应含量。
结果可见,pedf以及44mer能够有效的抑制心梗后缺血心肌细胞的凋亡和氧化应激的产生。
1.9参见说明书附图图12,
人冠状动脉内皮培养及粘附连接蛋白ve-cadherin染色参见1.3。
67lr突变体病毒构建
(1)根据质谱分析细胞缺氧时67lr磷酸化位点设计突变体引物。
(2)按照突变体试剂盒说明对67lr质粒进行突变,突变体系为:
混匀后加入1ulpfudnapolymerase
pcr条件:
(3)质粒扩增与测序
将上步pcr产物全部转化到感受态细胞中(stb13大肠杆菌),涂到固态lb培养基中,37℃,14小时后,挑单克隆菌落(每组5个),液态lb培养基摇菌不超过14小时,质粒小提,送样测序。
(4)突变体质粒改造。
由于此突变体载体pcmv6-xl5(4.7kb)不是病毒载体,因此不能用于包病毒,而且此载体没有标记,直接转染质粒不能保证转染效率,因此要对各个突变体质粒进行改造。
(5)酶切体系
(6)改造步骤
①plvx-cmv-zsgreen病毒载体酶切,琼脂糖电泳分离并回收载体片段。
②pcmv6-xl5-67lr突变体质粒酶切,回收67lr片段。
③plvx-cmv-zsgreen-67lr突变片段连接,连接完成后,将产物全部转化到感受态细胞中(stb13大肠杆菌),涂到固态lb培养基中,37℃,14小时后,挑单克隆菌落(每组5个),液态lb培养基摇菌不超过14小时,质粒小提后进行酶切验证。
④突变体病毒质粒大提酶切验证。
(7)病毒包装用lenti-xhtxpackagingsystem生产慢病毒悬浮物,为了获得最高效价的病毒悬液,用lenti-x293t细胞系。
结果见pedf通过抑制缺氧诱导的lr125t位点磷酸化,发挥保护内皮细胞粘附连接的作用。
1.10参见说明书附图图13,
人冠状动脉内皮细胞培养及全蛋白提取见1.1。wb检测c-caspase-8、c-caspase-3蛋白的表达情况。
结果得出pedf能够促进新生血管内皮细胞的凋亡而对正常的内皮细胞没有任何影响。
1.11参见说明书附图图14,
大鼠原代心肌提取与培养见1.6
油红染色:
(1)小心轻缓倒去培养液;(2)用pbs轻缓漂洗;(3)加10%中性甲醛固定5min;(4)稀释油红储存液,油红:去离子水=3:2,滤纸过滤,室温放置10min;(5)染色10min左右;(6)脱色,用60%异丙醇漂洗,除去多余的染料;(7)hoechst33342染核,浓度5μg/μl染10min;(8)甘油明胶封片(封片后长期保存);(9)显微镜观察。
心肌局部tg测定:
分析天平称取左室心肌组织500mg,置于冰冷的匀浆器中,加入500μl组织脂
质匀浆缓冲液,在冰水浴中充分匀浆后取10μl匀浆液置于1.5ml的ep管中,加入叔丁醇10μl、tritonx-100和甲醇的混合液(体积比1:1)5μl,漩涡混匀60min,4℃,3000rpm,5min,取上清液用酶法检测tg浓度。使用bca蛋白定量试剂盒完成心肌组织匀浆液蛋白定量。
结果可见pedf-r介导pedf和44-mer促进缺血心肌细胞甘油三酯分解。
1.12参见说明书附图图15,
(1)细胞复苏
自液氮罐中取出冻存的细胞,迅速置于37~40℃水中复温,至冻存液完全融化后,移至超净台内。使用微量移液器将冻存液转移至50ml离心管内,并由慢至快加入8ml完全培养基,离心(5min,1200rpm),重悬细胞并接种至25cm2培养瓶内。静置5~10min后将培养瓶转移至培养箱内(37℃,5%co2,21%o2)。
(2)细胞传代
待细胞生长至融合度达80%左右,pbs洗去培养基,按1:2比例加入pbs和0.25%胰酶,置于培养箱中60秒后取出,加入与胰酶等量完全培养基中和,微量移液器多次吹打,转移细胞悬液至离心管内,离心(5min,1200rpm),重悬细胞,按照1:3~4比例接种细胞。反复吹打避免细胞成团生长,静置5~10min后转移至培养箱内(37℃,5%co2,21%o2)。
(3)细胞冻存
细胞消化同前,离心后,用4℃预冷的冻存液(高糖dmem:fbs:dmso=7:2:1)重悬细胞,迅速分装至冻存管内,程序性降温(4℃,30min;-20℃,30min,-80℃过夜,液氮罐内长期保存)。
细胞缺氧模型建立
h9c2细胞传代24-48h后,细胞换液为不含fbs或0.1%浓度fbs的高糖dmem,细胞饥饿24h后,pbs洗3遍,加入d-hank's液作为缺氧培养基并置于缺氧培养箱(37℃,5%co2,1%o2)。根据实验分组,加入pedf,预先行sipedf-r-lv病毒转染,或其他相应处理。
线粒体蛋白提取(使用keygenbiotech试剂盒#kgp8100):
①收集不少于5×107个细胞,冷pbs洗涤3次;
②加入冷lysisbuffer1重悬细胞,并将悬液移至2ml玻璃匀浆器中,冰浴下研磨50~80次;
③将匀浆液移至新的冷ep管,于4℃,800g离心5min
④在另一个新的预冷的离心管中预先加入0.5mlmediumbuffer,将匀浆后的上清液0.5ml(mediumbuffer:上清液体积=1:1)沿管壁小心地加入该离心管中,覆盖于mediumbuffer的上层。
⑤4℃,15000g离心10min,离心后的上清含胞浆成分,将上清转移到新离心管,线粒体沉淀在管底;
⑥每20μl线粒体压积中,加入200μl冷lysisbuffer2(每1ml冷lysisbuffer2加入10μl磷酸酶抑制剂,1μl蛋白酶抑制剂和5μl100mmpmsf),置于冰上摇匀15min后,于4℃,14000rpm离心15min。上清为线粒体蛋白提取物,分装保存于–80℃。
pedf蛋白的使用浓度为10nm。为避免蛋白及肽段分解,长期保存放置于-80℃冰箱内,短期使用放置于-20℃,分装使用,避免反复冻融影响效价。
h9c2细胞培养1-2天,细胞换液加入含sipedf-r-lv(1:100)的dmem继续培养,48h后根据gfp阳性细胞数判断转染效率。
1.13参见说明书附图16
(1)大鼠心梗模型构建见上1.6
(2)letin灌注实验
植物凝集素lectin-fitc购买于sigma公司,用pbs溶解稀释,稀释比例1:1000,制备4mllectin,用5ml注射器通过大鼠股静脉推注入循环,经过10s循环后,进行心脏取材,取材方法见1.2。
(3)cd31及ve-cadherin免疫荧光染色见1.4.
pedf源功能选择肽具有极高的功能选择性,仅在缺氧组织中发挥作用。
本发明经过大量的实验发现pedf与其衍生肽段发挥作用强烈的与氧相关,试验中在正常细胞中加入pedf/34mer/44mer可以发现我们所观测的如casepase-3、甘油三酯(tg)、p53、ros等指标未发生任何变化,而一旦缺氧处理后,pedf及相应肽段能够立刻被激活并发挥特有的生物学效应。
显示出pedf在缺氧情况下能够抑制缺氧诱导的p53线粒体异位,而正常细胞pedf对p53的表达不产生任何影响。
1.14酶联免疫吸附法(elisa)测定
(1)样品准备:将细胞样品置于1.5mlep管中,13000r/min,4℃离心15-20min,取上清液,编号保存于-20℃冰箱保存。
(2)elisa测定
①每孔加入标准品和样品100ul,将反应板充分混匀后置于37℃中,水浴加热40min;
②洗板:用洗涤液将反应板充分洗涤4-6次,在滤纸上印干;
③每孔加入蒸馏水和第一抗体工作液各50ul(空白除外)。将反应板充分混匀后置于37℃中,水浴加热20min;
④洗板:同前;
⑤每孔加酶标抗体工作液100ul,将反应板充分混匀后置于37℃中,水浴加热10min;
⑥洗板,同前;
⑦每孔加入底板工作液100ul,置于37℃中,水浴加热15min(一下步骤需要避光);
⑧每孔加入终止液100ul混匀;
⑨30min内用酶标仪在450nm出测吸光值;
⑩根据样品od值计算出相应含量。
1.15心脏彩超
超声心动图心脏功能测定:
模型建立4周后,戊巴比妥钠(30mg/kg)腹腔麻醉下超声心动图(philipsie33,a10-mhztransducer,philipsmedicalsystems.netherlands)检测心脏功能,根据左室缩短率(fs,leftventricularfractionalshortening)j,平价各组大鼠心脏收缩功能。腹腔注射多巴酚丁胺,5-10min内再次检测彩超情况。
实施例2
pedf源34mer/44mer和34mer+44mer在心肌组织中的生物学作用
冠状动脉粥样硬化是诱发心脏缺血梗死的主要病理因素,而冠状动脉内皮的炎症是粥样硬化板块形成的重要因素。研究发现动脉粥样硬化斑块的形成与受损内皮细胞产生和释放的炎症因子有关,抑制受损内皮细胞产生il-1β和tnf-α
人类心脏是功能高效率但自我修复能力极差的器官。心肌梗死(ami)24小时内,大量心肌细胞死亡,随后坏死的心肌纤维逐渐溶解,形成肌溶灶。即使在ami后相当长的时间内,甚至持续终生,都存在心肌细胞死亡。心肌梗死后心力衰竭的主要致病机制是心肌缺血后心肌细胞的丧失,因此,心肌细胞保护是缺血性心脏病治疗的重点。病理学研究还显示,心肌梗死早期,即可见缺血心肌旁支血管的累及,出现梗死周边区的水肿、血管闭塞,进一步扩大了梗死心肌面积。而保护缺血心肌组织微循环可以有效减小梗死心肌区域。
本发明发现:
(1)34mer具有pedf可以抑制内皮的局部炎症,因此,单独使用34mer可以减轻局部粥样硬化斑块的形成,可以从心肌梗死的的致病因素环节降低发病风险;(2)44-mer可通过激活pedf-r的pla2活性,上调pparγ,增强抗氧化能力,减少细胞凋亡及程序性坏死而实现缺氧心肌细胞的保护;(3)44-mer可通过pedf-r/pparγ通路,维持血管内皮细胞紧密连接的稳定,维护动脉内皮细胞的屏障功能,发挥抑制缺血心脏血管渗漏,减少缺血心脏梗死面积,改善梗死后心脏功能;(4)34mer通过内皮细胞膜上的lr受体,调节内皮细胞的紧密连接、粘附连接,抑制缺氧时的内皮细胞连接改变造成的渗漏增加。同时,34mer通过调控ppar-γ通路及血管内皮细胞notch通路,增加缺血心肌细胞fasl的表达,减少vegfr-2/vegfr-3表达,诱导tip细胞凋亡,抑制缺血心肌血管生成。
实施例3
系列pedf源功能肽段的使用方法及优点:
使用方法:
34-mer与44-mer作为pedf的相关功能肽段,通过各自的作用靶点发挥不同的生物学作用。根据34-mer与44-mer相关功能肽段的生物学作用,对于具有心血管疾病高危因素的患者,可单独使用34mer制剂用于预防缺血性心脏病的发生;对于急性心肌梗死早期患者,可使用34mer+44mer复合制剂;而对于心肌梗死进入慢性期者仅使用44mer制剂。
本发明提出了在急(慢)性心肌缺血及心脏功能受损的不同病理状态、不同时间窗,根据缺血心肌时间-病损依赖性特征,应用不同的pedf源多肽,采用时效针对性(单独)及疗效序贯性(联合)的用药策略:采用单种(34mer或44mer)或两种功能肽段复合(34mer+44mer)同期或序贯用药的使用方式,发挥预防和挽救急性心肌梗死后濒死心肌,稳定受损心肌区域微血管结构,减少血管渗漏及心肌水肿,保护缺血心肌细胞,改善缺血心脏功能的心脏保护作用。
实施例4
1.本研究发明在细胞水平证实,pedf/44mer,通过抗氧化应激损伤机制,抑制cleavedcaspase3和rip3蛋白的表达,同时阻断了细胞凋亡和程序性坏死通路,减少细胞内ros生成,提高了心肌细胞在缺氧条件下的存活率。
2.pedf-r介导pedf抑制心肌细胞p53线粒体的转位,抑制缺血心肌细胞线粒体外膜透化(mitochondrialoutermembranepermeabilization,momp)和线粒体渗透转换孔(mitochondrialpermeabilitytransitionpore,mptp)开放,上调mdm2:p53的比例,减少心肌细胞凋亡及坏死,从而保护了缺氧心肌细胞。
3.pedf-r介导pedf/44mer,通过pparγ信号通路,促进缺血心肌细胞甘油三酯代谢,减少缺血心肌细胞甘油三脂沉积;增加溶血磷脂酸(lpa)及磷脂酶a2(pla2),抑制低氧诱导的氧化应激反应,保护了缺氧心肌细胞。
4.在细胞及动物整体水平证实,pedf-r介导pedf减少低氧导致drp1诱导线粒体裂解及线粒体dna(mtdna)及(mtros)的释放,抑制nlrp3炎症小体的激活,减少缺血心肌局部炎症反应,保护缺氧心肌细胞。
pedf-r介导pedf减少低氧导致drp1诱导线粒体裂解及线粒体dna释放,抑制nlrp3炎症小体的激活,减少炎症反应,保护缺氧心肌细胞机制。
5.细胞水平验证pedf/34mer通过抑制缺氧诱导下的内皮细胞il-β、tnfα前体的产生以及成熟后的释放,进而减少血管内炎症,推测在体情况下,34mer抑制血管内皮细胞炎症因子的产生和释放能够减少动脉粥样硬化斑块的形成。
6.pedf及34mer通过促进未成熟的的微血管结构趋于稳定,进而在心肌梗死发生时,能够及时的为缺血区域提供替代性的血供来源,并且抑制病理进程中肿大的间质水肿对包括侧枝微循环血管在内的所有血管的压迫情况,维持血管的有效开放,进而达到挽救缺血心肌的目的。
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
序列表
<110>徐州医科大学
董红燕
<120>色素上皮衍生因子的衍生多肽系列保护缺血心肌的用途
<160>2
<170>siposequencelisting1.0
<210>1
<211>34
<212>prt
<213>人工序列(artificialsequence)
<400>1
aspprophephelysvalprovalasnlysleualaalaalavalser
151015
asnpheglytyraspleutyrargvalargsersermetserprothr
202530
thrasn
<210>2
<211>44
<212>prt
<213>人工序列(artificialsequence)
<400>2
valleuleuserproleuservalalathralaleuseralaleuser
151015
leuglyalagluglnargthrgluserileilehisargalaleutyr
202530
tyraspleuileserserproaspilehisglythr
3540
- 还没有人留言评论。精彩留言会获得点赞!