唾液酸低聚糖及其制造方法、生发和骨骼肌形成促进剂与流程
本发明涉及由含唾液酸糖蛋白的原料制造唾液酸低聚糖的方法、通过该方法制造的唾液酸低聚糖、以及含有该唾液酸低聚糖的生发促进剂和骨骼肌形成促进剂。
背景技术:
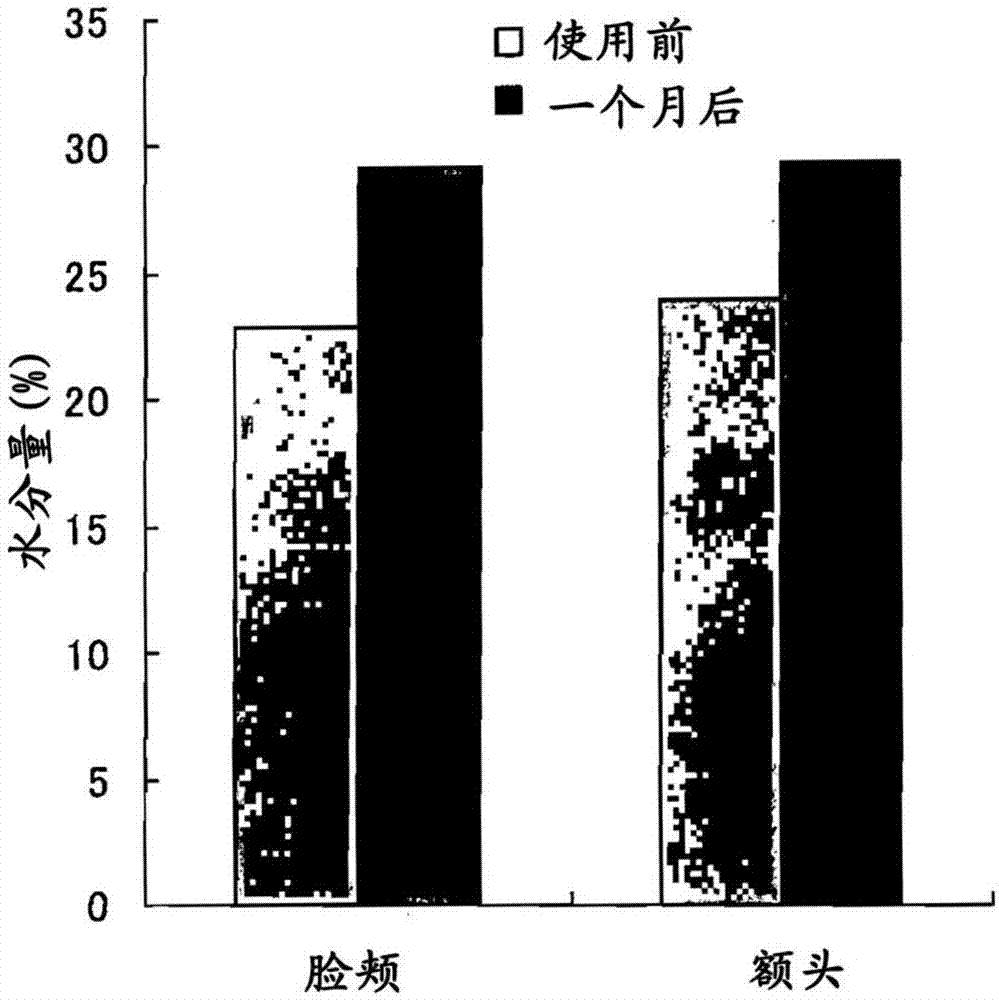
:已知,唾液酸在自然界广泛分布,是发挥生理功能的重要物质。据报告,唾液酸具有细胞间识别功能、感染防御活性、免疫功能控制功能、肌病(myopathy)改善功能、生发-养发功能等(非专利文献1~3)。此外,已知唾液酸促进胰岛素样生长因子-1(igf-1)的产生(非专利文献3)。而且,已知igf-1具有提高养发效果(非专利文献4)、肌肤弹性(非专利文献5)的作用。另一方面,已知口服给药的情况下,唾液酸的药理/生物活性是,与游离体唾液酸相比,作为含有唾液酸的糖链的唾液酸低聚糖的活性更高(非专利文献1和2、以及专利文献1)。作为这样的唾液酸低聚糖的制造法,报告了下述方法:利用有机溶剂萃取和活性炭柱色谱,从除去了脂质和蛋白质的奶进行纯化的方法(专利文献2);利用超滤和凝胶过滤色谱从除去了脂质和蛋白质的奶、乳制品进行纯化的方法(专利文献3);利用离子交换树脂从不含脂质和蛋白质的乳清进行纯化的方法(专利文献4);通过用水或盐溶液从鸟类卵脱脂卵黄进行萃取、超滤、或对用水或盐溶液萃取得到的溶液进行酶消化而制造的方法(专利文献5);在唾液酸转移酶和磷酸酶存在下使胞苷1磷酸-唾液酸与糖链反应、将唾液酸转移至糖链的非还原末端的方法(专利文献6)等。现有技术文献专利文献专利文献1:日本特开2002-128797号公报专利文献2:日本特开2005-8584号公报专利文献3:日本特开2009-23926号公报专利文献4:日本特表2011-513482号公报专利文献5:日本特开平8-99988号公报专利文献6:国际公开第2012/121041号非专利文献非专利文献1:malicdan,mc等,nat.med.,15,690-695(2009)非专利文献2:野口悟,生化学,83(4),316-320(2012)非专利文献3:冈嶋研二,fragrancej.,37(10),43-47(2009)非专利文献4:su,h.y.等,dermatol.onlinej.,5,1(1999)非专利文献5:tavakkol,a.等,arch.dermatol.res.,291,643-651(1999)技术实现要素:发明所要解决的课题上述制造唾液酸低聚糖的方法均复杂且高成本,不能说收获率好。此外,从除去了蛋白质的原料进行纯化的情况下,含有唾液酸的糖蛋白(唾液酸糖蛋白)也会被除去。因此,本发明的目的在于,提供由含有唾液酸糖蛋白的原料、简便、低成本且高收获率地制造唾液酸低聚糖的方法、通过该方法制造的唾液酸低聚糖、以及含有该唾液酸低聚糖的生发促进剂和骨骼肌形成促进剂。用于解决课题的方法本发明人对于使用含有黏蛋白型唾液酸糖蛋白的原料、简便、低成本且高收获率地制造唾液酸低聚糖的方法进行了深入研究,结果发现,通过用碱溶液将金丝燕的巢水解并纯化水解物,能够简便、低成本且高收获率地制造唾液酸低聚糖,从而完成了本发明。即,本说明书包括以下的发明公开。[1]一种唾液酸低聚糖的制造方法,包括(1)通过在碱性水溶液中在70~90℃加热而使唾液酸糖蛋白水解的工序,和(2)纯化水解物而得到唾液酸低聚糖的工序;所述唾液酸低聚糖所含的唾液酸/己糖的重量比为0.5~0.9。[2]根据[1]所述的唾液酸低聚糖的制造方法,唾液酸糖蛋白为黏蛋白型糖蛋白。[3]根据[1]或[2]所述的唾液酸低聚糖的制造方法,唾液酸糖蛋白为金丝燕族的巢所含的黏蛋白型糖蛋白。[4]根据[1]~[3]中任一项所述的唾液酸低聚糖的制造方法,碱性水溶液为氢氧化钾水溶液。[5]根据[1]~[4]中任一项所述的唾液酸低聚糖的制造方法,纯化通过反渗透膜过滤或电渗析来进行。[6]一种唾液酸低聚糖,其通过包括下述工序的制造方法来制造:(1)通过在碱性水溶液中在70~90℃加热而使唾液酸糖蛋白水解的工序,和(2)纯化水解物而得到唾液酸低聚糖的工序;所述唾液酸低聚糖所含的唾液酸/己糖的重量比为0.5~0.9。[7]一种生发促进剂,含有[6]所述的唾液酸低聚糖。[8]一种骨骼肌形成促进剂,含有[6]所述的唾液酸低聚糖。发明的效果根据本发明的唾液酸低聚糖的制造方法,可以由含唾液酸糖蛋白的原料、简便、低成本且高收获率地制造唾液酸低聚糖。唾液酸是从奶、唾液等萃取的高稀缺性成分,价格非常高。因此,尽管充分理解对生物体产生影响的药理作用,但一般并不以生理浓度(20mg/kg体重)使用。通过本发明的制造方法,实现了商业上能够以生理浓度使用的成本来制造唾液酸低聚糖。附图说明图1是显示通过波长265nm和480nm的紫外光吸收检测到的、待测物质通过凝胶过滤色谱分离时的洗脱曲线的图。(1)为待测物质2(盐酸处理)的洗脱曲线,(2)为待测物质1(氢氧化钾处理)的洗脱曲线。纵轴为吸光度,横轴为分级分离的试管的编号。图2为显示使用含待测物质1的护肤液带来的肌肤水分量变化的图。分别显示脸颊(左)和额头(右)使用前和使用1个月后的水分量(重量%)。具体实施方式本说明书中,“唾液酸糖蛋白”是主要在糖链的非还原末端含有唾液酸的糖蛋白。本说明书中,“唾液酸”是对神经氨酸的氨基、羟基被取代的物质进行统称的家族名。本说明书中,“己糖”是具有6个碳原子的单糖。包括例如阿洛糖、阿卓糖、葡萄糖、甘露糖、古洛糖、艾杜糖、半乳糖、塔罗糖、阿洛酮糖、果糖、山梨糖、塔格糖、奎诺糖、鼠李糖、岩藻糖、墨角藻糖等,也包括葡萄糖胺、甘露糖胺、半乳糖胺、果糖胺等己糖胺。本说明书中,“唾液酸低聚糖”是含有唾液酸的低聚糖。本发明的唾液酸低聚糖中,构成的己糖和唾液酸的单糖单元数可以分别为5~10个,优选为4~9个。此外,唾液酸低聚糖中的唾液酸/己糖的重量比例如为0.5~0.9,优选为0.6~0.8。已知,动物的唾液酸糖蛋白一般为天冬酰胺型、黏蛋白型、蛋白聚糖型等。本发明的唾液酸低聚糖的制造方法中使用的唾液酸糖蛋白为任一类型均可。本说明书中,“黏蛋白”是主要由动物的上皮细胞等分泌的粘液所含的、大量含有糖的糖蛋白(粘液糖蛋白)的混合物。本说明书中,“黏蛋白型”是在黏蛋白中的糖蛋白中出现的糖链与蛋白质的结合方式。糖链还原末端的n-乙酰半乳糖胺通过α-o-糖苷键(黏蛋白型键)以高频率结合于主要是丝氨酸或苏氨酸的羟基。本发明的唾液酸低聚糖的制造方法至少包括以下工序。(1)通过在碱性水溶液中加热而使唾液酸糖蛋白水解的工序,和(2)纯化水解物而得到唾液酸低聚糖的工序。本发明的唾液酸低聚糖的制造中使用的唾液酸糖蛋白可以是经分离的,也可以含有其他成分。优选为含有黏蛋白型唾液酸糖蛋白的黏蛋白。通过本发明制造的唾液酸低聚糖可以含有唾液酸低聚糖以外的成分。作为碱的水溶液中使用的碱,可列举氢氧化钾、氢氧化钠等。碱的水溶液的浓度例如为0.01~1.0重量%,优选为0.2~0.5重量%,更优选为0.25~0.5重量%。加热例如在50~105℃、优选在70~90℃、更优选在75~85℃条件下,进行例如30分钟~3小时、优选30分钟~2小时、更优选1~2小时。本发明中,水解物的纯化方法没有特别限定。水解物的纯化例如可以通过反渗透膜过滤、透析、电渗析、超滤进行,优选通过反渗透膜过滤、透析或电渗析进行,更优选通过反渗透膜过滤或电渗析进行。此外,水解物的纯化也可以通过利用例如分子排阻色谱(凝胶过滤色谱、凝胶渗透色谱等)、反相色谱等分离而分级分离来进行,优选通过利用分子排阻色谱、更优选凝胶过滤色谱分离而分级分离来进行。进而,也可以将这些方法组合而进行水解物的纯化。此外,可以通过上述纯化将例如盐和杂质除去。尤其是,从除去原料可能含有的重金属、砷的观点出发,作为一个方式,优选利用电渗析将水解物纯化。此外,水解物的纯化可以在通过例如离心分离、过滤等合适的方法将不溶物除去后进行。作为本发明的制造方法中作为原料使用的唾液酸糖蛋白的例子,可列举含有唾液酸糖蛋白的物质,例如金丝燕族鸟的巢、牛奶等动物的奶、鸡蛋等动物的卵、家畜等动物的唾液、消化液、海参等棘皮动物、海蜇等丝囊动物等天然来源的物质,优选列举含有黏蛋白的物质。自古以来,金丝燕族鸟的巢就在中国料理等中作为高级药膳料理食用。由于近年来促进健康的风靡,市场上有了易于食用的商品、提取物等的销售。但没有形成充分的品质管理,含有高浓度的重金属、砷的商品也在流通。本发明的优选方式中,制造了通过纯化将来自原料的重金属、砷除去至检测下限以下的唾液酸低聚糖。金丝燕族鸟的巢所含的唾液酸糖蛋白为黏蛋白型。由金丝燕族鸟的巢的黏蛋白所含的唾液酸糖蛋白获得唾液酸低聚糖的情况下,因为在酸性条件下唾液酸会从低聚糖脱离,所以在稀碱性的温和条件下进行水解。由其他黏蛋白型唾液酸糖蛋白获得唾液酸低聚糖的情况也能够适用本发明的方法。因此,唾液酸低聚糖的原料不限于金丝燕族鸟的巢。通过本发明制造的唾液酸低聚糖可以用作药品、准药品、健康食品、化妆品等。可以用作例如片剂、胶囊剂(软胶囊剂、硬胶囊剂)、颗粒剂(包括干糖浆)、散剂(粉末剂)、细颗粒剂、丸剂等固体制剂、水性或非水性内服用液(包括液剂、悬浊剂、糖浆剂等)、以及软膏、软食、搽剂、护肤液、外用液剂、散布剂、乳霜、凝胶、乳液、毛发强壮剂、喷发剂等外用制剂。上述各种制剂可以通过将由本发明制造的唾液酸低聚糖与药品、准药品、健康食品、化妆品等中通常可允许的添加剂混和并通过公知的方法来制造。作为那样的添加剂,可列举例如赋形剂、润滑剂(包衣剂)、粘合剂、崩解剂、稳定剂、矫味剂、基础剂、分散剂、稀释剂、表面活性剂、乳化剂、经皮吸收促进剂、ph调节剂、保存剂、着色剂、油分(油脂、矿物油等)、保湿剂、醇、增稠剂、聚合物、皮膜形成剂、紫外线吸收剂、细胞赋活剂、抗氧化剂、防腐剂、清凉剂、除臭剂、颜料、染料、香料、糖类、氨基酸类、维生素类、有机酸、有机胺、植物提取物等,但不限于此。实施例实施例1含唾液酸低聚糖水解物的制造利用稀碱处理的方法将市售的金丝燕(学名:aerodramusfuciphagusgermani)的巢(10g,从印度尼西亚的中国食品店获得)加入至1000ml的0.25重量%氢氧化钾水溶液,利用混合器粉碎。加热至80℃,保持40分钟。冷却至4℃后,通过离心分离和过滤将不溶物除去。然后,通过电渗析将盐和杂质除去,干燥,回收3.33g,作为待测物质1。利用酸处理的方法进行以往为了使糖从糖蛋白游离而使用的酸水解法,作为对比。将与前述等量的金丝燕的巢加入至1000ml的0.5m盐酸,利用混合器粉碎。加热至80℃,保持40分种。然后,按照与前述同样的步骤获得0.81g干燥产物,作为待测物质2。利用凝胶过滤色谱的分析将待测物质1和2分别以1mg/ml的浓度溶解于0.1m磷酸缓冲液(ph6.8),使用凝胶过滤色谱(gfc)进行分离分析。gfc条件树脂:toyopearlhw40s(东曹公司制)(排阻极限分子量:~10,000da)柱:内径20mm×柱长950mm(在山善公司制mm柱(内径20mm×长度1,000mm)中以950mm的长度填充上述树脂而制作)流动相:0.1m磷酸缓冲液(ph6.8)注射:1ml(负载量:1mg)(使用atto公司制注射器)流速:0.3ml/分钟(使用lab-quatec公司制泵,型号:work-21,lp6300)分级分离:2ml/试管(使用gilson公司制馏分收集器,型号:fc203b)检测波长:265nm和480nm将gfc洗脱曲线示于图1。对于各试管内分级分离的试样,测定265nm的紫外光吸收,同时,通过苯酚-硫酸法(吸收波长480nm)测定己糖,结果,通过盐酸处理得到的待测物质2中,在265nm的吸收测定中,观察到跨多个分级分离试样的多峰性吸收,此外在己糖的测定中未观察到吸收,由此认为,糖链中的己糖被分解分散。另一方面,通过氢氧化钾处理得到的待测物质1中,在分级分离至第40~42根试管中的试样中,在己糖的测定中观察到吸收,表现为单峰(峰顶分子量:约2kda)。由此,提示本实施例中通过氢氧化钾处理得到的待测物质1含有推测分子量为1.7~2.3kda的低聚糖。待测物质中唾液酸量和己糖量的测定为了确认待测物质1所含有的低聚糖为唾液酸低聚糖,以及确认待测物质2中不含己糖,进行待测物质中唾液酸量和己糖量的测定。唾液酸直接通过埃利希氏反应(生物化学实验教程4糖质化学(下)(生化学実験講座4糖質の化学(下)),p.p.381,日本生化学会编,东京化学同人,1976年)来测定。即,在1ml试样溶液中,加入将对二甲胺基苯甲醛(5g)溶解于盐酸与水的等体积混合液100ml而得的试剂200μl,在沸水浴中加热30分钟后,用流动水冷却至室温。然后,测定565nm的吸光度。己糖通过苯酚硫酸反应(生物化学实验教程4糖质化学(下),p.p.370,日本生化学会编,东京化学同人,1976年)来测定。即,在100μl试样溶液中加入5体积%苯酚试剂100μl,充分搅拌。在其中加入1ml硫酸,充分振荡混合后,测定480nm的吸光度。将对于各待测物质的回收率、gfc洗脱曲线、唾液酸量和己糖量的测定结果、以及对于唾液酸标准品(和光纯药工业公司制、n-乙酰神经氨酸、制品编号011-26173)的gfc洗脱曲线、唾液酸量和己糖量的测定结果汇总示于表1。[表1]表1.*n-乙酰神经氨酸(c11h19no9)显示待测物质1含有36重量%的唾液酸、51重量%的己糖,确认到待测物质1所含有的低聚糖为唾液酸低聚糖。此外,算出唾液酸/己糖重量比为0.7。另一方面,显示待测物质2含有0.5重量%的唾液酸,但显示仅含有痕量的己糖,确认到不含己糖。实施例2待测物质对产生胰岛素样生长因子-1(igf-1)的促进能力的评价试验将实施例1中制造的待测物质和唾液酸标准品(和光纯药工业公司制,n-乙酰神经氨酸,制品编号011-26173)溶于饮用水,调整浓度,对小鼠(n=5)给药,按5mg/kg体重/天将待测物质给药。饲养3周后,通过elisa法检测外周血中的igf-1浓度。将结果示于表2。[表2]表2.待测物质对产生igf-1的促进能力的评价结果待测物质igf-1(μg/ml)待测物质16.3待测物质20.28唾液酸标准品*4.4对照(无处理)0.03*n-乙酰神经氨酸(c11h19no9)通过氢氧化钾处理得到的待测物质1的含唾液酸低聚糖水解物与唾液酸标准品同样地,在小鼠中,通过口服给药促进了igf-1的产生。将唾液酸标准品与待测物质1对产生igf-1的促进能力进行比较,结果,如表2所示,唾液酸标准品的给药中,igf-1浓度为4.4μg/ml,而待测物质1的给药中,igf-1浓度为6.3μg/ml,因而,待测物质1对产生igf-1的促进能力高约43%。实施例3待测物质1的细胞增殖活性评价试验将nih3t3细胞在96孔微量滴定板中以105细胞/孔的方式培养,加入调整了浓度的待测物质1和唾液酸标准品(和光纯药工业公司制,n-乙酰神经氨酸,制品编号011-26173)10μl,在co2培养箱中进行24小时培养(37℃、4.5%co2)。细胞增殖通过使用了试剂盒(同仁化学公司制,细胞计数试剂盒-8(cellcountingkit-8),制品编号347-07621)的mtt分析法来测定。将结果示于表3。[表3]表3.待测物质1的细胞增殖活性评价结果添加浓度(mg/ml)00.080.311.252.55.010.0待测物质1100103111115113121120唾液酸标准品*10096981019899102*n-乙酰神经氨酸(c11h19no9)以没有添加待测物质1(0mg/ml)的情况作为100,算出各添加浓度的待测物质1带来的细胞增殖率。将没有添加唾液酸标准品(0mg/ml)的情况作为100,算出各添加浓度的唾液酸标准品带来的细胞增殖率。唾液酸标准品即使添加了10.0mg/ml的浓度,增殖率也未确认到变化,而如表3所示,待测物质1依赖于浓度地使细胞增殖率增加,在待测物质1的添加浓度为5.0mg/ml以上时达到平台期。实施例4通过志愿受试者进行的待测物质1的效果的评价试验1.护肤效果制作以使待测物质1为0.5重量%的方式溶解于去离子水而成的护肤液,在50岁以上的10名(男性5名、女性5名)受试者中使用,评价其效果。对于肌肤的水分量,利用数字水分检测仪1175(worldjb公司制)测定早上洗脸前的脸颊和额头的水分量。将结果示于图2。通过使用1个月含待测物质1的护肤液,脸颊的水分量由22.9重量%上升至29.3重量%,额头的水分量由24.1重量%上升至29.5重量%。此外,根据各自的主观感觉,评价上述护肤液对于肌肤状态的效果。将结果示于表4。[表4]表4含待测物质1的护肤液对于肌肤状态的效果的评价总共10名中,男性4名、女性4名合计8名(整体的80%)受试者回答,通过含待测物质1的护肤液的使用,肌肤状态变好或变得非常好。此外,对回答变好或变得非常好的8人,询问关于肌肤状态变化的具体改善之处,结果,“滋润感”为8人中的4人,“光滑感”为8人中的4人。2.少肌症改善效果作为待测食品,制作在乳清蛋白(协同乳业公司制,wpc,wheyproteinconcentration)中配合了0.5重量%的待测物质1的食品,将60~80岁年龄段的男性和女性合计30名的、容易蹒跚走路有点困难的人、膝-肩-腰等存在轻度~中度障碍的人、原因不明的手腕、下肢末端麻木无法治愈的人(均为自己报告)作为表现出少肌症症状的受试者,在一个月内,每天摄取本待测食品5g(1包)。摄取方法、摄取时间没有任何限制,本待测食品的作用机制、目的也完全不告知。这是为了使安慰剂效应为最小限度的处理。按4个阶段评价1个月后的变化。将结果示于表5。[表5]表5待测食品对于少肌症症状的效果的评价总共30名中,男性15名、女性12名合计27名(整体的90%)受试者回答少肌症症状变好或变得非常好。将回答变好或变得非常好的27人(男性15名、女性12名)的更多评价(多个回答)示于表6。[表6]表6对待测食品带来的少肌症症状改善方面的评价评价男性女性走路变得舒适11名10名不再蹒跚9名8名从椅子上起立、入坐变得舒适8名6名走路时不再休息6名4名不再感觉到各关节部、肌肉的疼痛、疲倦5名4名变得能够快走5名3名腕关节、髋关节收紧3名8名3.头发稀疏、脱发等的改善效果7名男性受试者(头发稀疏、脱发不断增加)中,作为待测溶液,将含有0.05重量%的待测物质1、0.01重量%的作为硫酸多糖中的一种的褐藻多糖的水溶液在晚上洗发后涂抹适当的量。按4个阶段评价1个月后的变化。将结果示于表7。[表7]表7待测溶液对于头发稀疏、脱发等的效果的评价评价恶化无变化变好变得非常好合计人数人数0名1名5名1名7名总共7名中,6名(整体的85%以上)受试者回答变好或变得非常好。将感觉变好或变得非常好的6人的更多评价(多个回答)示于表8。[表8]表8待测溶液对头发稀疏、脱发等的改善点的评价评价男性脱发急剧减少5名白发变得不明显2名头发的生长变快4名当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1