阿哌沙班衍生物及其制备方法和用途与流程
技术领域:
本发明属于医药技术领域,涉及阿哌沙班衍生物及其制备方法和用途。
背景技术:
:
血栓性疾病(thromboticdiseases)是当今严重危害人类健康的常见病和多发病之一,其发病率高居各类疾病之首,且近年来还有渐增之势。它是指由于体内的非正常凝血作用导致的血液在血管腔内凝固而形成栓塞,使主要脏器发生缺血和梗死的各种疾病。常见的血栓性疾病有冠状动脉硬化性心脏病、急性心肌梗死、急性脑卒中、脑血栓、血栓性静脉炎、肺栓塞、周围动脉栓塞、缺血性休克等。
美国的第三大死因是肺栓塞,每年约60万人患病,其中约三分之一患者死亡;发生在欧洲各国的每年死亡人数的约12%是由于静脉血栓导致。心血管疾病是目前人类健康的头号杀手,每年死于心血管疾病的人数远远超出任何其它疾病。据who估计,2012年死于心血管疾病的人数约有1750万,占全球死亡总人数的31%。在这些死亡人数中,估计有740万人是死于冠状动脉心脏疾病,占总死亡人数的15.8%,670万人死于中风,占总死亡人数的14.3%。因此,新型抗血栓药物亟需开发且具有较好的市场前景。
抗血栓药物主要包括抗血小板药物、溶血栓药物以及抗凝药物三大类。抗血小板药物通过多种机制抑制血小板的黏附和聚集;溶血栓药物通过直接或间接激活纤维蛋白溶酶原使其转化成纤维蛋白溶酶,进而降解血栓中的纤维蛋白,最终使血栓溶解;抗凝药物通过抑制凝血因子或凝血酶直接抑制血液的凝固作用。本文主要对抗凝血药物进行研究,抗凝血药物占抗血栓药物的市场份额约为30%,目前抗凝血药物的研究方向是开发可口服且不需监测的新型抗凝血药物。
1.凝血机制
血液凝固可通过两个途径进行,分别为内源性途径(intrinsicpathway)和外源性途径(extrinsicpathway),两条途径前半部分的通路不同,在xa因子处汇集进入共同通路。其生理性止血作用相互联系同时进行。macfarlane等提出的凝血瀑布学说(clottingcascade)(图1)认为,凝血是一系列复杂的生物化学反应,涉及多种凝血因子,这些凝血因子在血液中以无活性的酶原形式存在,当某一凝血因子被激活后,可按一定的次序诱发其他凝血因子先后被激活,彼此之间所有的激活过程存在复杂的催化作用,又被称为"瀑布样学说"。具体是指被激活的凝血机制成指数增长,前一因子的激活引起后面多个因子的激活,后面因子的激活再反过来促进前一因子的作用,逐级级联逐级放大,最终催化纤维蛋白原转变为纤维蛋白,血液凝固。
凝血因子是参与凝血过程的各种生化物质的总称,参与内源性途径的凝血因子包括viii、xi、xii,参与外源性途径的凝血因子包括iii(组织因子tf)、vii、ix,参与共同途径的凝血因子包括i、ii、v、x、xiii,以及参与所有途经的凝血因子iv即ca2+。外源性的因子viia与因子iii形成复合物,直接激活因子ix,从而代替了因子xia和xiia的功能;因子ixa/viiia复合物激活因子x的能力是iii/viia复合物的50倍,因此,在组织因子介导的因子ii的活化过程中,因子ix可能处于中枢地位;因子xii的裂解产物和因子ixa也能激活外源性因子vii;凝血酶除了能够促进纤维蛋白形成外,还可以通过激活血小板蛋白酶激活受体(par1,par4)信号传导通路,激活血小板。
2.抗凝血药物
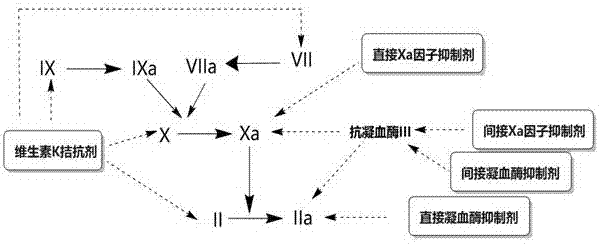
根据作用机制可将抗凝血药物分为:间接凝血酶抑制剂、直接凝血酶抑制剂、维生素k拮抗剂、间接xa因子抑制剂、直接xa因子抑制剂等。各类抗凝血药物的作用靶点如图2所示。
直接xa因子抑制剂
凝血因子xa是生理性凝血瀑布反应中的重要调节子,是新型抗凝血药物设计的一个热门靶点。
利伐沙班(rivaroxaban,商品名:xarelto),是继达比加群酯之后的第二个fda批准的口服抗凝血药物,也是全球第一个fda批准的口服直接xa因子抑制剂,由德国拜耳公司与强生公司联合开发,中文名为拜瑞妥。2008年被批准在加拿大上市,用于预防选择性髋关节或膝关节置换手术患者发生静脉血栓栓塞。2015年,利伐沙班用于治疗和二级预防肺栓塞和深静脉血栓形成在日本获得批准。
利伐沙班是强效的口服直接xa因子抑制剂,它能直接结合到xa因子的丝氨酸内肽酶的活性部位,抑制凝血酶生成。它已被证明不但能抑制游离的xa因子,而且对与凝血酶原酶形成复合物的xa因子和与血块结合的xa因子也能产生抑制作用。在分子水平上,利伐沙班的作用是由于其结构中的中央恶唑烷酮环两侧的氯噻吩和吗啉酮部分,分别与xa因子的s1和s4口袋能够高亲和性的结合。在临床前研究中,利伐沙班对人体血浆中的xa因子抑制作用时间有剂量依赖性。在人血浆中对xa因子的抑制常数(ki)为0.4nmol/l,ic50为21nmol/l。利伐沙班的对血小板没有直接的影响已被证实,然而,虽然利伐沙班不响血小板凝集,但是它能通过有效的抑制组织因子诱导的血小板凝集而间接的抑制凝血酶的产生。
阿哌沙班(apixaban,商品名:eliquis),由辉瑞公司和百时美施贵宝公司联合开发,2011年获得欧洲批准上市,用于预防选择性髋关节或膝关节置换手术患者的静脉血栓栓塞。阿哌沙班对xa因子有高度的选择性,代谢性清除率低,口服生物利用度高,2013年1月,获得cfda颁发的进口药品许可证,用于预防选择性髋关节或膝关节置换手术患者的静脉血栓栓塞。并于2013年4月正式获准在中国上市。
阿哌沙班是吡唑衍生物的小分子选择性的fxa抑制剂。与利伐沙班类似,阿哌沙班与xa因子有两个结合位点,阿哌沙班结构中的4-甲氧基苯基部分结合xa因子的s1口袋,芳基内酰胺部分结合xa因子的s4口袋。阿哌沙班是xa因子的高度选择性抑制剂(表观解离常数kd值0.08nmol/l),在阿哌沙班10mmol/l的浓度下,活化的蛋白c、ⅸa因子、viia因子和凝血酶均不受影响,阿哌沙班对xa因子的选择性抑制是其他凝血酶的3万倍。与利伐沙班相同,阿哌沙班对各种形式的xa因子都有抑制作用,包括游离的xa因子、与凝血酶原酶形成复合物的xa因子和与血块结合的xa因子。阿哌沙班经口服能被胃肠道迅速吸收,对健康志愿者的测试表明,约3h后能达到血药峰值。在人的贫血小板的血浆中,阿哌沙班以浓度依赖的方式对凝血时间有延长作用,其空白血浆凝血酶时间(pt)增加一倍的受试物浓度ec2x为3.6μmol/l,空白血浆活化部分凝血酶时间(aptt)增加一倍的受试物浓度ec2x为7.4μmol/l。在体外,阿哌沙班抑制空白给药凝血酶产生时间增加一倍的受试物浓度ec2x为200nmol/l,抑制空白给药凝血酶峰值产生时间增加一倍的受试物浓度ec2x为300nmol/l,减少空白给药最大凝血酶生成速率产生时间增加一倍的受试物浓度ec2x为35nmol/l,减少空白给药峰值凝血酶浓度产生时间增加一倍的受试物浓度ec2x为70nmol/l。
在兔模型实验中,同等剂量下,阿哌沙班与磺达肝素和华法林的预防血栓形成的效果相当。此外,阿哌沙班与阿司匹林或氯吡格雷同时给药时,能温和的显著提高抗血栓活性,增加出血时间。阿哌沙班与肝素和依诺肝素联合用药时,能显著增强其抗血栓活性,出血时间显著增加(p<0.05)。本发明以阿哌沙班为先导化合物,根据xa因子结构中含有s1-s4口袋、催化区域、阳离子空洞、二硫桥口袋等,其中s1和s4口袋是药物结合的主要口袋。阿哌沙班与xa因子结合的x-衍射结构,显示出了紧密的抑制剂-酶复合物结构。
ca2+作为凝血因子ⅳ,在凝血过程中发挥重要作用。在内源性凝血途径中,ca2+可与ⅸa因子和ⅷa因子在活化的血小板提供的磷脂膜表面结合成复合物,然后进一步激活x因子转化成xa因子。在外源性凝血途径中,血管壁损伤后释放出组织因子(凝血因子ⅲ),活化的组织因子与ⅶa因子、ca2+结合而形成复合物,这个复合物在磷脂和ca2+存在的情况下迅速激活x因子生成xa因子。
技术实现要素:
本发明所解决的技术问题是提供一系列apx化合物,该化合物在阿哌沙班母核c3位酰胺的n原子引入末端含供电子基团的烷基链,在保持与谷氨酸146形成氢键的基础上,使化合物具有与ca2+产生螯合作用的能力,以期获得多靶点作用,因而,得到作用强、不良反应小的抗凝血药物。
本发明所提供了apx化合物或其药学上可接受的盐,其具有如下结构:
本发明化合物的合成是以廉价易得的对硝基苯胺(化合物i)为起始原料,与5-溴戊酰氯通过酰胺化环合一锅煮反应得到化合物ii,ii与五氯化磷进行α位活泼氢的双氯代得到化合物iii,iii与吗啉进行缩合-消除反应得到化合物iv;iv与化合物v环合消除反应得到化合物vi,vi经锌和冰醋酸还原得到化合物vii,vii再经一次酰胺化环合得到中间体
viii。然后以viii与相应试剂反应得到目标衍生物。
本发明的化合物的化合物可与药学上可接受的载体结合制备临床上可接受的制剂,用于制备抗凝血药物。
附图说明
图1为凝血瀑布学说示意图;
图2为抗凝血药物作用靶点;
图3为ca2+与xa因子的相互作用示意图。
具体实施方式
实施例1
1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-腈(apx-01)的合成
1-(4-硝基苯基)哌啶-2-酮(ⅱ)的合成
于1000ml三颈瓶中加入对硝基苯胺(40g,0.28mol),干燥的四氢呋喃(600ml),三乙胺(60ml,0.44mol),机械搅拌下,分批加入5-氯戊酰氯(56ml,0.44mol),加完后60℃反应2h。然后降温至-10℃,分批加入叔丁醇钠(69.8g,0.92mol),加入过程中控制温度低于0℃,加完后升温至50℃反应6h。减压蒸去四氢呋喃,向残渣中加入饱和碳酸钠水溶液500ml浆洗,有大量固体析出,抽滤得产品,土黄色固体,52.6g,m.p.96-99℃,收率85.4%。
3,3-二氯-1-(4-硝基苯基)哌啶-2-酮(ⅲ)的合成
于1000ml茄形瓶中加入化合物ii(40g,0.18mol),氯苯(400ml),搅拌下分批加入五氯化磷(132.4g,0.64mol),加完后升温至55℃反应5h。将反应液冷却至室温,倒入1000ml冰水中,分出下层,再用二氯甲烷3×200ml萃取,合并有机相,用水2×200ml洗涤两次,饱和食盐水400ml洗涤一次,无水硫酸钠干燥,蒸干二氯甲烷得产品,淡黄色固体,49.4g,m.p.115-117℃,收率94.9%。
3-吗啉基-1-(4-硝基苯基)-5,6-二氢吡啶-2(1h)-酮(ⅳ)的合成
于500ml茄形瓶中加入化合物iii(40g,0.14mol),吗啉(160ml,1.84mol),升温至130℃反应5h。减压回收吗啉,向残渣中加入水400ml,搅拌30min后抽滤,干燥,得粗品57.8g,8倍乙酸乙酯重结晶,得产品,淡黄色固体,27.2g,m.p.158-160℃,收率64.5%。
2-氯-2-[2-(4-甲氧基苯基)-腙]乙酸乙酯(ⅴ)的合成
于250ml三颈瓶中加入对甲氧基苯胺(13.5g,0.11mol),水(56ml),浓盐酸(28ml),搅拌溶解后降温至-5℃,滴加nano2(7.9g,0.12mol)水溶液,控制温度低于0℃,滴毕,0℃以下反应30min。于500ml三颈瓶中加入2-氯乙酰乙酸乙酯(18g,0.11mol),乙醇270ml,水30ml,降温至-5℃,加入乙酸钠(13.5g,0.16mol)。再将上述制好的重氮盐溶液滴加入此反应体系中,控制温度低于0℃。滴完后室温反应4h。将反应液倒入1l水中,搅拌,待大量固体析出后抽滤,得产品,黄色固体,20.6g,m.p.106-109℃,收率73.6%。
1-(4-甲氧基苯基)-6-(4-硝基苯基)-7-氧代-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-羧酸乙酯(ⅵ)的合成
于500ml茄形瓶中加入化合物ⅴ(20g,0.078mol),乙酸乙酯(240ml),ki(1.2g,6.5mmol),再加入化合物ⅳ(19.6g,0.065mol)和三乙胺(18.2ml,0.14mol),升温至回流反应4.5h。反应液降温至5℃,滴加4nhcl(80ml,0.32mol)水溶液,滴完后室温反应4h。向反应液中加入300ml水,二氯甲烷3×200ml萃取,饱和食盐水300ml洗涤,无水硫酸钠干燥,蒸干二氯甲烷得粗品,再用60ml乙酸乙酯浆洗,得产品27.2g,m.p.188-191℃,收率94.6%。
1-(4-甲氧基苯基)-6-(4-氨基苯基)-7-氧代-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-羧酸乙酯(ⅶ)的合成
于250ml三颈瓶中加入化合物ⅵ(20g,0.042mol),无水乙醇(40ml),二氯甲烷(100ml),锌粉(12g,0.18mol),冰水浴下搅拌,滴加冰乙酸(20.8ml,0.36mol),控制温度低于20℃,加完后室温反应3h。减压蒸去溶剂后加入水(200ml)浆洗,抽滤,滤饼用乙酸乙酯重结晶,析晶抽滤,得产品,淡黄色固体,15.3g,m.p.164-167℃,收率81.8%。
3.1.2.71-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-羧酸乙酯(ⅷ)与1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-羧酸(ⅸ)的合成
于250ml三颈瓶中加入化合物ⅶ(20g,0.049mol),干燥的四氢呋喃(200ml),三乙胺(10.2ml,0.073mol),降温至0℃,分批加入5-氯戊酰氯(9.4ml,0.073mol),加完后60℃反应2h。然后降温至-10℃,分批加入叔丁醇钠(12.1g,0.16mol),加入过程中控制温度低于0℃,加完后升温至50℃反应4h。减压蒸去四氢呋喃,向残渣中加入饱和碳酸钠水溶液200ml浆洗,有固体析出,抽滤得产品,黄色固体,9.45g,m.p.151-154℃,收率39.4%。向剩余的水相中滴加10%盐酸水溶液,调ph值至3,有大量固体析出,抽滤得淡黄色固体,经结构确证为1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-羧酸(ⅸ),10.4g,m.p.196-198℃,收率43.4%。ms(esi)m/z:461[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表1:
表1化合物ⅸ氢谱数据
1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(阿哌沙班)的合成
于反应釜中加入化合物ⅷ(1g,2mmol),加入10%nh3.meoh溶液40ml,封反应釜,升温至回流反应4h。反应液冷却至室温,减压蒸去反应溶剂,得灰白色固体0.9g,36ml(甲醇:水=4:1)混合溶液重结晶,置于冰箱中冷冻,抽滤,得白色固体0.65g,m.p.169-171℃,收率70.6%。ms(esi)m/z:460[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表2:
表2阿哌沙班氢谱数据
o-(四氢-2h-吡喃-2-基)羟基胺(bxh-2)的合成
于250ml三颈瓶中加入n-羟基邻苯二甲酰亚胺(10g,0.061mol),二氢吡喃(6.1g,0.073mol),四氢呋喃100ml,溶解后加入对甲苯磺酸(1.1g,6.1mmol),室温反应2h。减压蒸去四氢呋喃,向残渣中加水200ml,二氯甲烷3×200ml萃取,饱和nahco3水溶液3×200ml洗涤,饱和nacl水溶液200ml洗涤一次,无水硫酸钠干燥,抽滤,蒸干,得黄绿色固体,15.3g。于1000ml三颈瓶中加入所得固体,乙醇450ml,搅拌溶解,滴加80%水合肼(10.4ml,0.17mol),室温反应1h。反应液直接抽滤,滤液蒸干,得粗品10.6g,加入乙酸乙酯500ml,充分搅拌后,抽滤不溶物,滤液用水3×100ml洗涤,饱和食盐水溶液200ml洗涤一次,无水硫酸钠干燥,抽滤,蒸干,得淡黄色油状物,真空干燥后呈淡黄色固体5.39g,m.p.35-37℃,收率75.3%。
1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-腈(apx-01)的合成
于100ml茄形瓶中加入阿哌沙班(1g,2.2mmol),加入pocl3(15.3g,100mmol),接冷凝管和干燥管,升温至回流反应1h。反应液冷却至室温,倒入200ml冰水中,搅拌至冰全融,二氯甲烷3×100ml萃取,饱和食盐水200ml洗涤,无水硫酸镁干燥,蒸干二氯甲烷得粗品,0.9g。粗品进行柱层析,洗脱剂(二氯甲烷:甲醇=80:1),得产品0.67g,收率68.3%。白色固体,m.p.154-155℃,ms(esi)m/z:442[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表3:
表3化合物apx-01氢谱数据
实施例2
1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲脒(apx-02)的合成
于反应釜中加入化合物apx-01(1g,2.3mmol),加入10%nh3·meoh溶液40ml,封反应釜,升温至回流反应20h。反应液冷却至室温,减压蒸去反应溶剂,得淡黄绿色油状物,加入100ml蒸馏水,冰浴下滴加10%hcl水溶液调ph值至7。二氯甲烷3×100ml萃取,饱和食盐水200ml洗涤,无水硫酸镁干燥,蒸干二氯甲烷得粗品,1.1g。粗品进行柱层析,洗脱剂(二氯甲烷:甲醇=20:1),得产品0.56g,收率53.4%。白色固体,m.p.169-171℃,ms(esi)m/z:459[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表4:
表4化合物apx-02氢谱数据
实施例3
n-((四氢-2h-吡喃-2-基)氧)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-03)的合成
于100ml单口瓶中加入化合物ⅸ(0.5g,1.1mmol),干燥的二氯甲烷10ml,一滴n,n-二甲基甲酰胺,加入二氯亚砜(0.3ml,4.4mmol),加热至回流反应1h。减压蒸馏除去过量的二氯亚砜,蒸干后红褐色固体残渣溶于干燥的二氯甲烷备用。于100ml三颈瓶中加入o-(四氢-2h-吡喃-2-基)羟基胺(bxh-2)(0.64g,5.5mmol),干燥的三乙胺(1.5ml,0.011mol),干燥的二氯甲烷10ml,冰盐浴,降温至-10℃以下,滴加上述制备好的酰氯,控制温度不超过-10℃,滴毕,缓慢升至室温反应8h。反应液中加入10%naoh水溶液50ml洗涤,再用二氯甲烷2×100ml萃取,饱和食盐水100ml洗涤,无水硫酸钠干燥,蒸干二氯甲烷得粗品,0.96g。粗品进行柱层析,洗脱剂(二氯甲烷:甲醇=100:1),得产品0.45g,收率73.1%。黄色固体,m.p.122-124℃,ms(esi)m/z:560[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表-5:
表5化合物apx-03氢谱数据
实施例4
1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰肼(apx-05)的合成
用类似的方法得到以下化合物:
以化合物ⅸ和80%水合肼为原料,合成1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰肼(apx-05),白色固体0.33g,收率为63.4%,m.p.148-150℃。ms(esi)m/z:475[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表6:
表6化合物apx-05氢谱数据
实施例5
n'-(2-羟乙基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰肼(apx-06)的合成
以化合物ⅸ和羟乙基肼为原料,合成n'-(2-羟乙基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰肼(apx-06),白色固体0.51g,收率为75.0%,m.p.130-132℃。ms(esi)m/z:519[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表7:
表7化合物apx-06氢谱数据
实施例6
n-羟乙基-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-07)的合成
以化合物ⅸ和2-氨基乙醇为原料,合成n-羟乙基-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-07),白色固体0.37g,收率为68.5%,m.p.129-131℃。ms(esi)m/z:504[m+h]+,526[m+na]+,502[m-h]-。
1h-nmr(400mhz,cdcl3)数据如表8:
表8化合物apx-07氢谱数据
实施例7
n-羟丙基-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-08)的合成
以化合物ⅸ和3-氨基丙醇为原料,合成n-羟丙基-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-08),白色固体0.42g,收率为73.6%,m.p.126-128℃。ms(esi)m/z:518[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表9:
表9化合物apx-08氢谱数据
实施例8
n-(2-氨基乙基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-09)
以化合物ⅸ和1,2-乙二胺为原料,合成n-(2-氨基乙基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-09),黄色固体0.24g,收率为43.6%,m.p.118-120℃。ms(esi)m/z:503[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表10:
表10化合物apx-09氢谱数据
实施例9
n-(3-氨基丙基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-10)
以化合物ⅸ和1,3-丙二胺为原料,合成n-(3-氨基丙基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-10),黄色固体0.28g,收率为49.3%,m.p.114-116℃。ms(esi)m/z:517[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表11:
表3-11化合物apx-10氢谱数据
实施例10
n-(2-(二甲基氨基)乙基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-11)的合成
以化合物ⅸ和n,n-二甲基乙二胺为原料,合成n-(2-(二甲基氨基)乙基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-11),白色固体0.46g,收率为79.3%,m.p.89-91℃。ms(esi)m/z:531[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表12:
表12化合物apx-11氢谱数据
实施例11
n-(2-(二乙基氨基)乙基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-12)的合成
以化合物ⅸ和n,n-二乙基乙二胺为原料,合成n-(2-(二乙基氨基)乙基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-12),白色固体0.52g,收率为84.5%,m.p.83-85℃。ms(esi)m/z:559[m+h]+,557[m-h]-。
1h-nmr(400mhz,cdcl3)数据如13:
表13化合物apx-12氢谱数据
实施例12
n-(1,3-二羟基丙-2-基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-13)的合成
以化合物ⅸ和2-氨基-1,3丙二醇为原料,合成n-(1,3-二羟基丙-2-基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-13),白色固体0.34g,收率为57.9%,m.p.124-126℃。ms(esi)m/z:534[m+h]+,532[m-h]-。
1h-nmr(400mhz,cdcl3)数据如表14:
表14化合物apx-13氢谱数据
实施例13
n,n-二(2-羟乙基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-14)的合成
以化合物ⅸ和二乙醇胺为原料,合成n,n-二(2-羟乙基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-14),白色固体0.44g,收率为73.1%,m.p.133-136℃。ms(esi)m/z:548[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表15:
表15化合物apx-14氢谱数据
实施例14
o-(2-羟基乙基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酸酯(apx-15)
以化合物ⅸ和乙二醇为原料,合成o-(2-羟基乙基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酸酯(apx-15),白色固体0.46g,收率为82.8%,m.p.72-74℃。ms(esi)m/z:527[m+na]+,503[m-h]-。
1h-nmr(400mhz,cdcl3)数据如表16:
表16化合物apx-15氢谱数据
实施例15
o-(4-羟基丁基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酸酯(apx-16)
以化合物ⅸ和1,4-丁二醇为原料,合成o-(4-羟基丁基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酸酯(apx-16),白色固体0.39g,收率为66.5%,m.p.66-69℃。ms(esi)m/z:533[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表17:
表17化合物apx-16氢谱数据
实施例16
o-(6-羟基己基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酸酯(apx-17)的合成
以化合物ⅸ和1,6-己二醇为原料,合成o-(6-羟基己基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酸酯(apx-17),灰白色固体0.33g,收率为53.5%,m.p.63-65℃。2.56(t,j=6.3hz,2h),1.94(p,j=3.3hz,4h),1.82(t,j=7.0hz,2h),1.62–1.58(m,2h),1.46(m,4h).ms(esi)m/z:561[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表18:
表18化合物apx-17氢谱数据
实施例17
o-((2-二乙基氨基)-乙基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酸酯(apx-18)的合成
以化合物ⅸ和2-(二乙基氨基)-乙醇为原料,合成o-((2-二乙基氨基)-乙基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酸酯(apx-18),白色固体0.40g,收率为64.9%,m.p.76-78℃。ms(esi)m/z:560[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表19:
表19化合物apx-18氢谱数据
实施例18
3-(4-(2-羟乙基)哌嗪-1-羰基)-1-(4-甲氧基苯基)-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-7-酮(apx-19)
以化合物ⅸ和4-(2-羟乙基)哌嗪为原料,合成3-(4-(2-羟乙基)哌嗪-1-羰基)-1-(4-甲氧基苯基)-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-7-酮(apx-19),白色固体0.49g,收率为77.8%,m.p.132-134℃。ms(esi)m/z:573[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表20:
表20化合物apx-19氢谱数据
实施例19
n-(4-羟基环己基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-20)的合成
以化合物ⅸ和4-氨基环己醇为原料,合成n-(4-羟基环己基)-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-20),白色固体0.42g,收率为68.5%,m.p.125-127℃。ms(esi)m/z:558[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表21:
表21化合物apx-20氢谱数据
实施例20
n-羟基-1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶-3-甲酰胺(apx-04)的合成
于100ml单口瓶中加入apx-03(0.5g,0.9mmol),加入20ml甲醇搅拌溶解,再加入20ml2nhcl水溶液,加热至20℃反应10h。反应液减压蒸去甲醇,再加入饱和na2co3水溶液,调ph值至8,再用二氯甲烷3×100ml萃取,饱和食盐水100ml洗涤,无水硫酸钠干燥,蒸干二氯甲烷得粗品,0.48g。粗品进行柱层析,洗脱剂(二氯甲烷:甲醇=40:1),得产品0.29g,收率67.9%。白色固体,m.p.157-159℃,ms(esi)m/z:476[m+h]+。
1h-nmr(400mhz,cdcl3)数据如表22:
表22化合物apx-03氢谱数据
实施例21
药理实验部分
1实验材料
1)受试品:目标化合物apx-01~apx-20。
2)实验血浆:健康成年男性血浆。
3)实验仪器:lg-paber-i型血小板聚集凝血因子分析仪(北京世帝科学仪器公司),测试杯,钢珠,10-100μl量程移液枪及匹配枪头,100-100μl量程移液枪及匹配枪头,24孔板,ep管,采血管,注射器。
4)实验试剂:柠檬酸钠,pt及aptt试剂盒(北京世帝科学仪器公司)。
3.2.2实验方法
1)全血采集:采集健康成年男性血浆,立即将血与3.8%柠檬酸钠按照9:1比例混匀。
2)贫血小板血浆(ppp)制备:将混合均匀的抗凝血离心,转速2000-2500转/分,10min,取上清液,即为贫血小板血浆(ppp)。
3)样品处理:待测样品2.5mg,加100μldmso溶解,再加900μl生理盐水混匀,生理盐水依次稀释浓度为25μg/l,5μg/l,1μg/l。
4)样品测定:按照pt及aptt试剂盒要求操作,通过测定活化部分凝血酶时间(aptt)及凝血酶时间(pt)考察化合物活性。
2.药理活性测试结果
通过测定活化部分凝血酶时间(aptt)及凝血酶时间(pt)考察化合物活性,受试物活性用将空白血浆aptt或pt时间增加一倍的受试物浓度(ec2x)表示,ec2x根据曲线拟合计算得出。所有化合物均表现出一定的抗凝血活性,其中化合物apx-02、apx-15、apx-16具有较强的抑制活性,化合物apx-02、apx-15、apx-16的ec2x(aptt)分别为2.15μg/l、3.65μg/l、2.35μg/l,ec2x(pt)分别为0.12μg/l、3.57μg/l、1.57μg/l,强于阳性对照药阿哌沙班(ec2x(aptt)值3.78μg/l、ec2x(pt)值1.59μg/l),其余化合物的ec2x(aptt)值介于5μg/l和65μg/l之间,ec2x(pt)值介于3μg/l和18μg/l之间。
表3-1.目标化合物抗凝血活性测试结果
本发明的阿哌沙班衍生物均具有明显的抗凝血作用,尤其化合物apx-02、apx-15、apx-16的抗凝血活性最强,可做为开发抗凝血药物的先导化合物,值得深入研究。
- 还没有人留言评论。精彩留言会获得点赞!