靛红唑类化合物及其制备方法和应用与流程
本发明属于化学合成领域,涉及靛红唑类化合物,还涉及该化合物的制备方法和应用。
背景技术:
微生物感染已经成为人类健康的最大威胁,每天全世界大约有5万人死于微生物感染。目前为止,已有大量的抗生素以及合成药用于治疗微生物感染。然而对这些抗微生物药物的过度依赖导致了一些多药耐药菌的出现,例如耐甲氧西林金黄色葡萄球菌,耐甲氧西林表皮葡萄球菌,耐万古霉素屎肠球菌,从而使许多传统的抗生素与合成药失效。因此,开发具有新结构的抗菌药物变得十分迫切,尤其是一些具有高效,低毒以及低耐药性的抗菌药的研发已经引起了广泛的关注。
靛红类化合物在医药领域有较大的潜力,可作为人类与动物的大脑、神经末梢和其他流体部位的生物调节剂。靛红分子结构的多功能性使得其在结构修饰与结构衍生方面成为了一个理想的底物,并且可通过非共价键作用力(氢键、金属离子配位、离子-偶极相互作用、π-π堆积、疏水-疏水相互作用以及范德华力)与生物体内的酶、受体等多种活性靶点结合而呈现出广泛的生物活性,如抗细菌、抗真菌、抗癌、抗抑郁、抗痉挛、抗hiv、抗炎等。靛红衍生物羟吲哚在药物设计中十分具有吸引力,已被广泛用于药物分子的合成,例如美国食品与药物管理局批准上市的含有羟吲哚片段的药su-5416与su-11248已用于治疗胃肠道间质瘤与晚期肾癌。此外,靛红环化生成的噻唑林、噻唑琳酮等能够增加其抗菌活性。随着众多含有靛红结构片段的药物相继问世,靛红类药物分子的合成及其生物活性研究日益成为医药研发领域的热点,主要是通过对其基本骨架进行结构修饰,引入不同的活性基团,期望获得药代动力学性质好、毒副作用低以及生物活性高的靛红类药物。
唑类化合物是一类重要的抗菌药物,例如用于治疗局部感染的咪康唑、益康唑与克霉唑和用于治疗全身性感染的氟康唑、伊曲康唑以及酮康唑。唑环的独特的芳香氮杂环结构使得唑类衍生物能快速高效地与生物体内的蛋白质、酶及受体等生物大分子发生作用而发挥良好的生物活性。唑类化合物在治疗感染疾病时具有高治愈率、好的药代动力学性质、高活性以及低毒性等优点。近年来,通过唑环与其他药效片段的结合以开发具有新靶点或多种作用模式的新化合物已受到广泛关注。因此,使用唑环修饰靛红分子结构以期获得高效低毒的抗菌药物引起了我们的研究兴趣。
技术实现要素:
有鉴于此,本发明的目的之一在于提供一种靛红唑类化合物及其可药用盐;本发明的目的之二在于提供靛红唑类化合物及其可药用盐制备方法;本发明的目的之三在于提供所述的靛红唑类化合物及其可药用盐在制备抗细菌和/或抗真菌药物中的应用;本发明的目的之四在于提供所述的靛红唑类化合物及其可药用盐在制备dna嵌入剂中的应用。
为达到上述目的,本发明提供如下技术方案:
1、靛红唑类化合物及其可药用盐,结构如通式i-vi所示:
式中,
r1、r2、r3、r4、r5、r6为氢、烷基、苯基、取代苯基、硝基;
x、y、z为碳和氮杂原子中的一种。
优选的,x为碳或氮杂原子;y为碳或氮杂原子;z为碳或氮杂原子;r1为氢、甲基、正丙基;r2为氢、硝基;r3为氢、硝基;r4为氢、甲基;r5为氢、甲基;r6为氢、苯基、4-甲基苯基、4-氯苯基、4-羟基苯基。
优选的,为下述化合物中的任一种:
2、所述的靛红唑类化合物及其可药用盐的制备方法,
a.通式vii所示化合物的制备:以靛红为起始原料在n,n-二甲基甲酰胺中,氢化钠做碱,与1,2-二溴乙烷发生取代反应即得靛红衍生物vii;
b.通式i-iii所示靛红唑类化合物的可药用盐的制备:将不同类型的唑类化合物溶于有机溶剂中,在碱的作用下,与通式vii所示靛红衍生物发生取代反应即制得靛红咪唑类化合物的可药用盐。
c.通式iv所示靛红唑类化合物的可药用盐的制备:将通式iii-1所示化合物溶于有机溶剂中,加入不同取代的羰基化合物,在碱的作用下发生缩合反应即制得通式iv所示靛红三唑类化合物的可药用盐。
d.通式v所示靛红唑类化合物的可药用盐的制备:将通式iv所示化合物在酸存在回流下经历脱水作用即制得通式v所示靛红唑类化合物的可药用盐。
e.通式vi所示靛红唑类化合物的可药用盐的制备:将通式iii-1所示化合物溶于有机溶剂中,其在还原剂的作用下发生还原反应,反应无气泡冒出时,反应完全即制得通式vi所示靛红唑类化合物的可药用盐。
优选的,步骤a中,所述取代反应的温度为60℃;反应时长为12h;所述靛红与氢化钠的物质的量之比为1:1.5;
步骤b中,所用有机溶剂为乙腈;所用碱为碳酸钾;不同唑类化合物:通式vii所述化合物:碳酸钾的物质的量之比为2:1:1.1;
步骤c中,所述羰基衍生化反应的溶剂为甲醇;所用碱为二乙胺;反应温度为室温;通式iii-1所述化合物:羰基化合物:二乙胺的物质的量之比为1:1:1。
步骤d中,脱水反应使用的酸为冰醋酸和盐酸的混合酸,盐酸与冰醋酸的体积比为1:3;反应在回流下进行;反应完后需用碳酸氢钠中和。
步骤e中,所用还原剂为硼氢化钠;反应溶剂为二氯甲烷与乙醇的混合溶剂;原料在0℃下加入,在0℃下反应。
3所述的靛红唑类化合物及其可药用盐在制备抗细菌和/或抗真菌药物中的应用。
本发明中,所述细菌为耐甲氧西林金黄色葡萄球菌、金黄色葡萄球菌、粪肠球菌、克雷白氏肺炎杆菌、大肠杆菌、铜绿假单胞菌、鲍曼不动杆菌中的任一种或多种;所述真菌为白色念珠菌、热带假丝酵母菌、烟曲霉菌、近平滑假丝酵母菌中的任一种或多种。
4.所述的靛红唑类化合物及其可药用盐在制备dna嵌入剂中的应用,所述dna为小牛胸腺dna。
本发明的有益效果在于:本发明利用药物设计拼合原理,首次在吲哚上引入不同唑环,设计合成了一系列结构新颖的靛红唑类化合物,这些化合物经体外抗微生物活性检测发现对革兰氏阳性菌(耐甲氧西林金黄色葡萄球菌、粪肠球菌、金黄色葡萄球菌、金黄色葡萄球菌atcc25923、金黄色葡萄球菌atcc29213)、革兰氏阴性菌(克雷白氏肺炎杆菌、大肠杆菌、铜绿假单胞菌、铜绿假单胞菌atcc27853、大肠杆菌atcc25922、鲍曼不动杆菌)和真菌(白色念珠菌、热带假丝酵母菌、烟曲霉菌、白色念珠菌atcc90023、近平滑假丝酵母菌atcc20019)都有一定抑制活性,可以用于制备抗细菌和/或抗真菌药物,从而为临床抗微生物治疗提供更多高效、安全的候选药物,有助于解决日趋严重的耐药性、顽固的致病性微生物以及新出现的有害微生物等临床治疗问题。此外,本发明的靛红唑类化合物还可用于制备dna嵌入剂。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
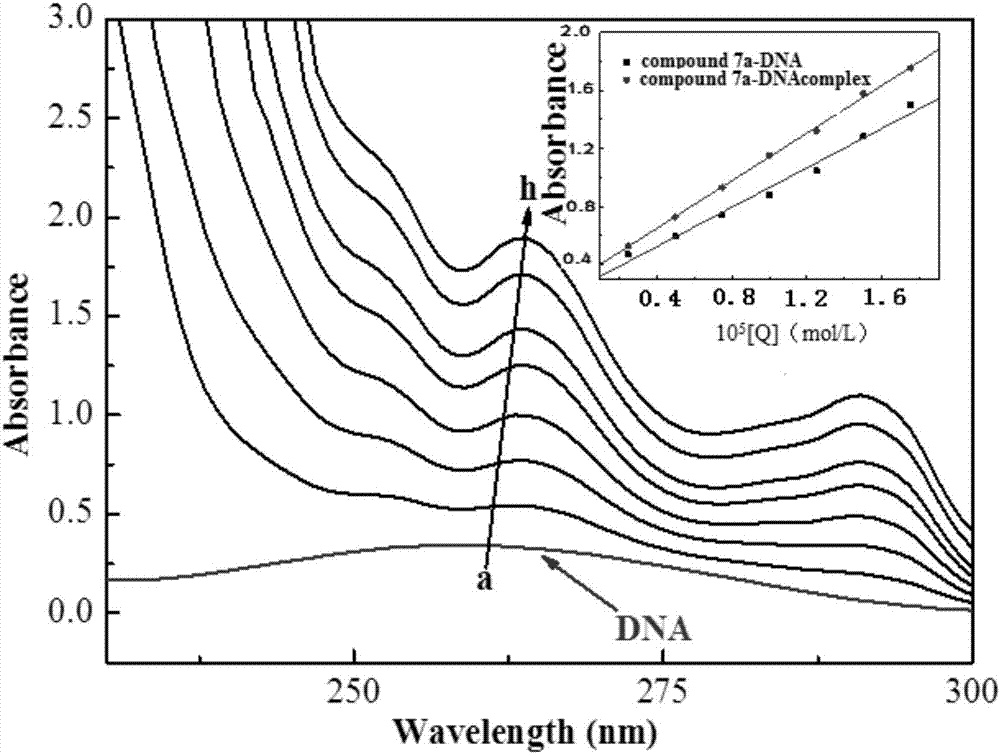
图1为化合物v-1与dna的相互作用(dna为5.0×10-5mol/l,化合物v-1的浓度从0至2.0×10-5mol/l)。
图2为化合物v-1与中性红分别与dna之间的竞争作用(dna与中性红的浓度分别5.0×10-5mol/l与2×10-5mol/l,化合物v-1的浓度从0至2.0×10-5mol/l)。
具体实施方式
下面将结合附图,对本发明的优选实施例进行详细的描述。
实施例1、化合物vii的制备
在250ml圆底烧瓶中加入氢化钠(1.20g,51mmol)和靛红(5.00g,34mmol),以n,n-二甲基甲酰胺(100ml)作溶剂,在0℃下搅拌5分钟,缓慢滴加1,2-二溴乙烷(4.30ml,51mmol),氮气保护60℃下反应,薄层色谱跟踪至反应结束。加入冰水析出橘黄色固体,再经干燥、纯化等后处理即得化合物vii(6.10g),产率70.9%。
实施例2、化合物i-1的制备
在50ml圆底烧瓶中加入2-甲基-5-硝基咪唑(1.27g,10mmol)、碳酸钾(0.75g,5.5mmol),用20ml乙腈作溶剂60℃下搅拌1小时后,加入靛红衍生物vii(1.27g,5mmol),继续在60℃下搅拌反应,薄层色谱跟踪至反应结束。减压蒸馏除去乙腈,再用水和乙酸乙酯萃取,再经浓缩、重结晶、干燥等后处理即得化合物i-1(0.86g),产率57.3%;黄色固体;熔点:196–198℃。1hnmr(600mhz,dmso-d6,ppm):δ8.40(s,1h,im-h-4),7.61(t,j=7.7hz,1h,isatin-h-6),7.56(d,j=7.3hz,1h,isatin-h-4),7.12(t,j=7.4hz,1h,isatin-h-5),7.02(d,j=7.9hz,1h,isatin-h-7),4.28(t,j=5.8hz,2h,im-ch2),4.07(t,j=5.8hz,2h,im-ch2ch2),2.34(s,3h,im-ch3)。
实施例3、化合物i-2的制备
在50ml圆底烧瓶中加入4-硝基咪唑(1.13g,10mmol)、碳酸钾(0.75g,5.5mmol),用20ml乙腈作溶剂60℃下搅拌1小时后,加入靛红衍生物vii(1.27g,5mmol),继续在60℃下搅拌反应,薄层色谱跟踪至反应结束。减压蒸馏除去乙腈,再用水和乙酸乙酯萃取,再经浓缩、重结晶、干燥等后处理即得化合物i-2(0.77g),产率53.8%;黄色固体;熔点:190–192℃。1hnmr(600mhz,dmso-d6,ppm):δ8.54(s,1h,im-h-5),7.90(s,1h,im-h-3),7.57-7.53(m,2h,isatin-h-4,isatin-h-6),7.11(t,j=7.5hz,1h,isatin-h-5),6.92(d,j=7.9hz,1h,isatin-h-7),4.35(t,j=5.5hz,2h,im-ch2),4.10(t,j=5.5hz,2h,im-ch2ch2)。
实施例4、化合物i-3的制备
在50ml圆底烧瓶中加入2-甲基咪唑(0.82g,10mmol)、碳酸钾(0.75g,5.5mmol),用20ml乙腈作溶剂60℃下搅拌1小时后,加入靛红衍生物vii(1.27g,5mmol),继续在60℃下搅拌反应,薄层色谱跟踪至反应结束。减压蒸馏除去乙腈,再用水和乙酸乙酯萃取,再经浓缩、重结晶、干燥等后处理即得化合物i-3(0.76g),产率59.6%;黄色固体;熔点:165–167℃。1hnmr(600mhz,cdcl3,ppm):δ7.59(d,j=7.4hz,1h,isatin-h-4),7.49(t,j=7.8hz,1h,isatin-h-6),7.10(t,j=7.5hz,1h,isatin-h-5),6.83(brs,1h,im-h-4),6.80(brs,1h,im-h-5),6.42(d,j=7.9hz,1h,isatin-h-7),4.20(t,j=6.0hz,2h,im-ch2),4.00(t,j=5.8hz,2h,im-ch2ch2),2.31(s,3h,ch3)。
实施例5、化合物i-4的制备
在50ml圆底烧瓶中加入2-丙基咪唑(1.10g,10mmol)、碳酸钾(0.75g,5.5mmol),用20ml乙腈作溶剂60℃下搅拌1小时后,加入靛红衍生物vii(1.27g,5mmol),继续在60℃下搅拌反应,薄层色谱跟踪至反应结束。减压蒸馏除去乙腈,再用水和乙酸乙酯萃取,再经浓缩、重结晶、干燥等后处理即得化合物i-4(0.91g),产率64.3%;红色固体;熔点:173–175℃。1hnmr(600mhz,cdcl3,ppm):δ7.49(t,j=7.8hz,1h,h-6),7.10(t,j=7.4hz,1h,isatin-h-5),7.06(d,j=8.4hz,1h,isatin-h-4),6.90(brs,1h,im-h-4),6.82(brs,1h,im-h-5),6.41(d,j=7.9hz,1h,isatin-h-7),4.21(t,j=6.0hz,2h,im-ch2),4.00(t,j=6.0hz,2h,im-ch2ch2),2.55(t,j=7.6hz,2h,ch2ch2ch3),1.75-1.69(m,2h,ch2ch2ch3),0.92(t,j=7.3hz,3h,ch2ch2ch3)。
实施例6、化合物ii-1的制备
在50ml圆底烧瓶中加入苯并咪唑(1.18g,10mmol)、碳酸钾(0.75g,5.5mmol),用20ml乙腈作溶剂60℃下搅拌1小时后,加入靛红衍生物vii(1.27g,5mmol),继续在60℃下搅拌反应,薄层色谱跟踪至反应结束。减压蒸馏除去乙腈,再用水和乙酸乙酯萃取,再经浓缩、重结晶、干燥等后处理即得化合物ii-1(0.91g),产率62.5%;黄色固体;熔点:181–183℃。1hnmr(600mhz,dmso-d6,ppm):δ8.22(s,1h,bim-h-2),7.65(t,j=7.7hz,1h,isatin-h-6),7.60(d,j=7.7hz,1h,isatin-h-4),7.55–7.47(m,2h,bim-h),7.23-7.17(m,1h,bim-h),7.11(t,j=7.5hz,1h,isatin-h-5),7.07(t,j=7.4hz,1h,bim-h),6.77(d,j=7.9hz,1h,isatin-h-7),4.55(t,j=5.8hz,2h,bim-ch2),4.10(t,j=5.8hz,2h,bim-ch2ch2)。
实施例7、化合物ii-2的制备
在50ml圆底烧瓶中加入5,6-二甲基苯并咪唑(1.46g,10mmol)、碳酸钾(1.75g,5.5mmol),用20ml乙腈作溶剂60℃下搅拌1小时后,加入靛红衍生物vii(1.27g,5mmol),继续在60℃下搅拌反应,薄层色谱跟踪至反应结束。减压蒸馏除去乙腈,再用水和乙酸乙酯萃取,再经浓缩、重结晶、干燥等后处理即得化合物ii-2(1.06g),产率66.5%;黄色固体;熔点:186–188℃。1hnmr(600mhz,dmso-d6,ppm):δ8.05(s,1h,bim-h-2),7.65(t,j=7.7hz,1h,isatin-h-6),7.54(d,7.6hz,1h,isatin-h-4),7.35(s,1h,bim-h),7.21(s,1h,bim-h),7.13-7.07(m,1h,isatin-h-5),6.78(d,j=8.2hz,1h,isatin-h-7),4.48(t,j=5.7hz,2h,bim-ch2),4.07(t,j=5.7hz,2h,bim-ch2ch2),2.28(s,3h,bim-ch3),2.25(s,3h,bim-ch3)。
实施例8、化合物ii-3的制备
在50ml圆底烧瓶中加入苯并三唑(1.19g,10mmol)、碳酸钾(0.75g,5.5mmol),用20ml乙腈作溶剂60℃下搅拌1小时后,加入靛红衍生物vii(1.27g,5mmol),继续在60℃下搅拌反应,薄层色谱跟踪至反应结束。减压蒸馏除去乙腈,再用水和乙酸乙酯萃取,再经浓缩、重结晶、干燥等后处理即得化合物ii-3(1.03g),产率70.5%;红色固体;熔点:143–145℃。1hnmr(600mhz,cdcl3,ppm):δ7.94(d,j=8.4hz,1h,btri-h),7.46-7.37(m,3h,isatin-h-4,isatin-h-6,btri-h),7.30(dd,j=16.6,7.9hz,2h,btri-h),6.94(t,j=7.5hz,1h,isatin-h-5),6.39(d,j=8.0hz,1h,isatin-h-7),5.00(t,j=6.0hz,2h,btri-ch2),4.31(t,j=5.9hz,2h,btri-ch2ch2)。
实施例9、化合物iii-1的制备
在50ml圆底烧瓶中加入三唑(0.69g,5mmol)、碳酸钾(0.75g,5.5mmol),用20ml乙腈作溶剂60℃下搅拌1小时后,加入靛红衍生物vii(1.27g,5mmol),继续在60℃下搅拌反应,薄层色谱跟踪至反应结束。减压蒸馏除去乙腈,再用水和乙酸乙酯萃取,再经浓缩、重结晶、干燥等后处理即得化合物iii-1(0.90g),产率74.3%;橘黄色固体;熔点:106–108℃。1hnmr(600mhz,dmso-d6,ppm):δ8.51(s,1h,tri-h-3),7.93(s,1h,tri-h-5),7.58-7.53(m,2h,isatin-h-4,isatin-h-6),7.09(t,j=7.5hz,1h,isatin-h-5),6.82(d,j=7.9hz,1h,isatin-h-7),4.47(t,j=5.6hz,2h,tri-ch2),4.07(t,j=5.6hz,2h,tri-ch2ch2)。
实施例10、化合物iii-2的制备
在50ml圆底烧瓶中加入1,2,3-三唑(0.69g,10mmol)、碳酸钾(0.75g,5.5mmol),用20ml乙腈作溶剂60℃下搅拌1小时后,加入靛红衍生物vii(1.27g,5mmol),继续在60℃下搅拌反应,薄层色谱跟踪至反应结束。减压蒸馏除去乙腈,再用水和乙酸乙酯萃取,再经浓缩、重结晶、干燥等后处理即得化合物iii-2(0.94g),产率77.6%;橘黄色固体;熔点:128–130℃。1hnmr(600mhz,dmso-d6,ppm):δ8.19(s,1h,tri-h-4),7.63(s,1h,tri-h-5),7.58(t,j=7.8hz,1h,isatin-h-6),7.54(d,j=7.3hz,1h,isatin-h-4),7.11(t,j=7.5hz,1h,isatin-h-5),6.89(d,j=8.0hz,1h,isatin-h-7),4.68(t,j=5.7hz,2h,tri-ch2),4.13(t,j=5.7hz,2h,tri-ch2ch2)。
实施例11、化合物iv-1的制备
在50ml圆底烧瓶中加入化合物iii-1(1.21g,5mmol)与丙酮(0.37ml,5mmol),10ml甲醇作溶剂,加入二乙胺(0.52ml,5mmol),室温下反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物iv-1(1.21g),产率80.6%;白色固体;熔点:153–155℃;1hnmr(600mhz,dmso-d6,ppm):δ8.44(s,1h,tri-h-3),8.01(s,1h,tri-h-5),7.30(d,j=7.2hz,1h,isatin-h-4),7.17(t,j=7.6hz,1h,isatin-h-6),6.96(t,j=7.4hz,1h,isatin-h-5),6.64(d,j=7.8hz,1h,isatin-h-7),6.08(s,1h,isatin-oh),4.44(t,j=5.9hz,2h,tri-ch2),4.11-4.08(m,1h,tri-ch2ch1a),4.02-3.98(m,1h,tri-ch2ch1b),3.40(d,j=17.1hz,1h,c(oh)ch1aco),3.10(d,j=17.1hz,1h,c(oh)ch1bco),2.02(s,3h,ch3)。
实施例12、化合物iv-2的制备
在50ml圆底烧瓶中加入化合物iii-1(1.21g,5mmol)与苯乙酮(0.6g,5mmol),10ml甲醇作溶剂,加入二乙胺(0.52ml,5mmol),室温下反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物iv-2(1.61g),产率88.9%;白色固体;熔点:80–82℃;1hnmr(600mhz,dmso-d6,ppm):δ8.51(s,1h,tri-h-3),8.02(s,1h,tri-h-5),7.90(d,j=7.6hz,2h,ar-h),7.63(t,j=7.3hz,1h,ar-h),7.50(t,j=7.6hz,2h,ar-h),7.33(d,j=7.2hz,1h,isatin-h-4),7.15(t,j=7.6hz,1h,isatin-h-6),6.90(t,j=7.4hz,1h,isatin-h-5),6.66(d,j=7.8hz,1h,isatin-h-7),6.18(s,1h,isatin-oh),4.51-4.56(m,2h,tri-ch2),4.18(d,j=17.8hz,1h,c(oh)ch1aco),4.14-4.04(m,2h,tri-ch2ch2),3.65(d,j=17.7hz,1h,c(oh)ch1bco)。
实施例13、化合物iv-3的制备
在50ml圆底烧瓶中加入化合物iii-1(1.21g,5mmol)与4-甲基苯乙酮(0.67g,5mmol),10ml甲醇作溶剂,加入二乙胺(0.52ml,5mmol),室温下反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物iv-3(1.59g),产率84.5%;白色固体;熔点:85–87℃;1hnmr(600mhz,dmso-d6,ppm):δ8.50(s,1h,tri-h-3),8.02(s,1h,tri-h-5),7.80(d,j=8.0hz,2h,ar-h),7.33-7.29(m,3h,h-4,ar-h),7.14(t,j=7.7hz,1h,isatin-h-6),6.90(t,j=7.4hz,1h,isatin-h-5),6.65(d,j=7.8hz,1h,isatin-h-7),6.16(s,1h,isatin-oh),4.53-4.44(m,2h,tri-ch2),4.14(d,j=18.0hz,2h,tri-ch2ch1a,c(oh)ch1aco),4.08-4.02(m,1h,tri-ch2ch1b),3.61(d,j=17.7hz,1h,c(oh)ch1bco),2.36(s,3h,ar-ch3)。
实施例14、化合物iv-4的制备
在50ml圆底烧瓶中加入化合物iii-1(1.21g,5mmol)与4-氯苯乙酮(0.64ml,5mmol),10ml甲醇作溶剂,加入二乙胺(0.52ml,5mmol),室温下反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物iv-4(1.76g),产率88.8%;白色固体;熔点:95–97℃;1hnmr(600mhz,dmso-d6,ppm):δ8.51(s,1h,tri-h-3),8.02(s,1h,tri-h-5),7.92(d,j=8.4hz,2h,ar-h),7.56(d,j=8.4hz,2h,ar-h),7.34(d,j=7.1hz,1h,isatin-h-4),7.16(t,j=7.6hz,1h,isatin-h-6),6.91(t,j=7.4hz,1h,isatin-h-5),6.67(d,j=7.8hz,1h,isatin-h-7),6.21(s,1h,isatin-oh),4.52-4.46(m,2h,tri-ch2),4.17(d,j=17.5hz,1h,c(oh)ch1aco),4.09-4.04(m,2h,tri-ch2ch2),3.64(d,j=17.7hz,1h,c(oh)ch1bco)。
实施例15、化合物iv-5的制备
在50ml圆底烧瓶中加入化合物iii-1(1.21g,5mmol)与4-羟基苯乙酮(0.68g,5mmol),10ml甲醇作溶剂,加入二乙胺(0.52ml,5mmol),室温下反应,薄层色谱跟踪至反应结束,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物iv-5(1.71g),产率90.4%;白色固体;熔点:123–125℃;1hnmr(600mhz,dmso-d6,ppm):δ10.39(s,1h,ar-oh),8.50(s,1h,tri-h-3),8.02(s,1h,tri-h-5),7.77(d,j=8.6hz,2h,ar-h),7.30(d,j=7.2hz,1h,isatin-h-4),7.13(t,j=7.6hz,1h,isatin-h-6),6.89(t,j=7.4hz,1h,isatin-h-5),6.81(d,j=8.5hz,2h,ar-h),6.61(d,j=7.8hz,1h,isatin-h-7),6.11(s,1h,isatin-oh),4.50-4.45(m,2h,tri-ch2),4.14-4.10(m,1h,tri-ch2ch2),4.06(d,j=17.3hz,1h,c(oh)ch1aco),3.54(d,j=17.5hz,1h,c(oh)ch1bco)。
实施例16、化合物v-1的制备
在50ml圆底烧瓶中加入化合物iv-1(1.50g,5mmol),10ml乙醇做溶剂,室温下加入37%盐酸(2.5ml)与冰醋酸(7.5ml),控温120℃反应,薄层色谱跟踪至反应结束,加入饱和碳酸氢钠溶液中和,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物v-1(0.94g),产率66.6%;黄色固体;熔点:162–164℃;1hnmr(600mhz,dmso-d6,ppm):δ8.29(s,1h,tri-h-3),7.96(s,1h,tri-h-5),7.30(dd,j=15.9,7.5hz,2h,isatin-h-4,isatin-h-7),7.07-7.02(m,2h,isatin-h-5,isatin-h-6),6.70(s,1h,c=ch),5.21-5.12(m,2h,tri-ch2),4.33(t,j=7.6hz,2h,tri-ch2ch2),2.19(s,3h,ch3)。
实施例17、化合物v-2的制备
在50ml圆底烧瓶中加入化合物iv-2(1.81g,5mmol),10ml乙醇做溶剂,室温下加入37%盐酸(2.5ml)与冰醋酸(7.5ml),控温120℃反应,薄层色谱跟踪至反应结束,加入饱和碳酸氢钠溶液中和,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物v-2(,1.34g),产率77.9%;黄色固体;熔点:97–99℃;1hnmr(600mhz,dmso-d6,ppm):8.35(s,1h,tri-h-3),8.01(s,3h,tri-h-5,ar-h),7.63(s,1h,c=ch),7.60-7.58(m,1h,ar-h),7.55(d,j=2.8hz,1h,isatin-h-4),7.46(s,2h,ar-h),7.22(d,j=4.9hz,1h,isatin-h-7),7.04-7.02(m,2h,isatin-h-5,isatin-h-6),5.15-5.13(m,1h,tri-ch1a),4.99-4.96(m,1h,tri-ch1b),4.29-4.19(m,2h,tri-ch2ch2)。
实施例18、化合物v-3的制备
在50ml圆底烧瓶中加入化合物iv-3(1.88g,5mmol),10ml乙醇做溶剂,室温下加入37%盐酸(2.5ml)与冰醋酸(7.5ml),控温120℃反应,薄层色谱跟踪至反应结束,加入饱和碳酸氢钠溶液中和,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物v-3(1.37g),产率76.5%;黄色固体;熔点:196–198℃;1hnmr(600mhz,dmso-d6,ppm):δ8.32(s,1h,tri-h-3),7.99(s,1h,tri-h-5),7.89(d,j=8.1hz,2h,ar-h),7.57(s,1h,c=ch),7.52(d,j=8.5hz,1h,isatin-h-4),7.26(d,j=8.0hz,2h,ar-h),7.22(d,j=8.7hz,1h,isatin-h-7),7.06-7.00(m,2h,isatin-h-5,isatin-h-6),5.14(dd,j=15.5,8.2hz,1h,tri-ch1a),4.98(dd,j=15.5,8.1hz,1h,tri-ch1b),4.28-4.20(m,2h,tri-ch2ch2),2.31(s,3h,ar-ch3)。
实施例19、化合物v-4的制备
在50ml圆底烧瓶中加入化合物iv-4(1.98g,5mmol),10ml乙醇做溶剂,室温下加入37%盐酸(2.5ml)与冰醋酸(7.5ml),控温120℃反应,薄层色谱跟踪至反应结束,加入饱和碳酸氢钠溶液中和,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物v-4(1.41g),产率74.6%;黄色固体;熔点:193–195℃;1hnmr(600mhz,dmso-d6,ppm):δ8.35(s,1h,tri-h-3),8.01(d,j=9.4hz,3h,ar-h,tri-h-5),7.67(s,1h,c=ch),7.55(d,j=8.5hz,2h,ar-h),7.53-7.51(m,1h,isatin-h-4),7.25-7.22(m,1h,isatin-h-7),7.05-7.03(m,2h,isatin-h-5,isatin-h-6),5.15(dd,1h,j=15.5,8.2hz,1h,tri-ch1a),4.98(dd,j=15.5,8.1hz,1h,tri-ch1b),4.29-4.22(m,2h,tri-ch2ch2)。
实施例20、化合物v-5的制备
在50ml圆底烧瓶中加入化合物iv-5(1.89g,5mmol),10ml乙醇做溶剂,室温下加入37%盐酸(2.5ml)与冰醋酸(7.5ml),控温120℃反应,薄层色谱跟踪至反应结束,加入饱和碳酸氢钠溶液中和,再经浓缩、萃取、柱层析分离、重结晶、干燥等后处理即得化合物v-5(1.45g),产率80.5%;黄色固体;熔点:156–158℃;1hnmr(600mhz,dmso-d6,ppm):δ10.45(s,1h,aroh),8.29(s,1h,tri-h-3),7.97(s,1h,tri-h-5),7.86(d,j=8.6hz,2h,ar-h),7.49(dd,j=5.6,3.1hz,1h,isatin-h-4),7.46(s,1h,c=ch),7.23(dd,j=5.6,3.1hz,1h,isatin-h-6),7.03(dd,j=5.7,3.1hz,2h,isatin-h-5,isatin-h-7),6.78(d,j=8.6hz,2h,ar-h),5.15(dd,j=15.5,8.1hz,1h,tri-ch1a),5.00(dd,j=15.4,8.1hz,1h,tri-ch1b),4.30-4.22(m,2h,tri-ch2ch2)。
实施例21、化合物vi-1的制备
在50ml圆底烧瓶中加入化合物iii-1(0.50g,2.06mmol),用2ml二氯甲烷/乙醇(v/v=1/1)混合溶剂溶解,硼氢化钠(0.22g,3.09mmol)溶于二氯甲烷/乙醇(12ml)后于0℃滴加至反应瓶中,该温度下继续反应,薄层色谱跟踪至反应结束,再经萃取、柱层析分离、重结晶、干燥等后处理即得化合物vi-1(0.30g),产率59.5%;白色固体;熔点:129–131℃;1hnmr(600mhz,dmso-d6,ppm):δ8.43(s,1h,tri-h-3),7.93(s,1h,tri-h-5),7.31(d,j=6.1hz,1h,isatin-h-4),7.21(t,j=6.5hz,1h,isatin-h-6),7.01(t,j=6.8hz,1h,isatin-h-5),6.73(d,j=7.3hz,1h,isatin-h-7),6.25(d,j=4.2hz,1h,isatin-oh),4.88(brs,1h,choh),4.46-4.37(brm,2h,tri-ch2),4.08-4.06(m,1h,tri-ch2ch1a),3.96-3.94(m,1h,tri-ch2ch1b)。
注:im为咪唑,bim为苯并咪唑,btri为苯并三唑,tri为三唑,ar为苯环。
实施例22、靛红唑类化合物的体外抗微生物活性
采用符合美国国家委员会制定的临床实验标准(clinicalandlaboratorystandardsinstitute,clsi)的96孔微量稀释法,检查实施例2–21制得的靛红唑类化合物对对革兰氏阳性菌(耐甲氧西林金黄色葡萄球菌、粪肠球菌、金黄色葡萄球菌、金黄色葡萄球菌atcc25923、金黄色葡萄球菌atcc29213)、革兰氏阴性菌(克雷白氏肺炎杆菌、大肠杆菌、铜绿假单胞菌、铜绿假单胞菌atcc27853、大肠杆菌atcc25922、鲍曼不动杆菌)和真菌(白色念珠菌、热带假丝酵母菌、烟曲霉菌、白色念珠菌atcc90023、近平滑假丝酵母菌atcc20019)的最低抑制浓度(mic),将待测化合物用少量二甲亚砜溶解,再加水稀释制成浓度为1.28mg/ml的溶液,再用培养液稀释至128μg/ml,35℃培养24–72小时,将培养板至振荡器上充分摇匀后,在波长490nm处测定mic,结果见表1–2。
表1、靛红唑类化合物i-1–vi-1的体外抗细菌活性数据(mic,μg/ml)
从表1可以看出,本发明实施例2–21制得的化合物i-1–vi-1,对所测试的细菌表现出一定的抑制作用,更重要的是,部分化合物的抗细菌活性可与参考药物诺氟沙星相媲美,甚至更强。
表2、靛红唑类化合物i-1–vi-1的体外抗真菌活性数据(mic,μg/ml)
从表2可以看出,本发明实施例2–21制得的化合物i-1–vi-1,对所测试的真菌表现出一定的抑制作用,更重要的是,部分化合物的抗细菌活性可与参考药物氟康唑相媲美,甚至更强。
实施例22、靛红唑类化合物作为dna嵌入剂
本发明实施例16制得的化合物v-1能作为人工嵌入剂有效的嵌入dna。利用紫外吸收光谱与dna探针中性红(neutralred)检测其嵌入效果见图1和图2所示。
实施例23、靛红唑类化合物的制药用途
根据上述抗微生物活性检测结果,本发明的靛红唑类化合物具有较好的抗细菌、抗真菌活性,可以制成抗细菌、抗真菌药物供临床使用。这些药物既可以是单方制剂,例如由一种结构的靛红唑类化合物与药学上可接受的辅料制成;也可以是复方制剂,例如由一种结构的靛红唑类化合物与已有抗细菌、抗真菌活性成分(如诺氟沙星、环丙沙星、磺胺甲噁唑、氟康唑、磷氟康唑、伊曲康唑等)以及药学上可接受的辅料制成,或者由不同结构的几种靛红唑类化合物与药学上可接受的辅料制成。所述制剂类型包括但不限于片剂、胶囊剂、散剂、颗粒剂、滴丸剂、注射剂、粉针剂、溶液剂、混悬剂、乳剂、栓剂、软膏剂、凝胶剂、膜剂、气雾剂、透皮吸收贴剂等剂型,以及各种缓释、控释制剂和纳米制剂。
1、化合物i-1片剂的制备
处方:化合物i-110g,乳糖187g,玉米淀粉50g,硬脂酸镁3.0g,体积百分浓度为70%的乙醇溶液适量,共制成1000片。
制法:将玉米淀粉与105℃干燥5小时备用;将化合物i-1与乳糖、玉米淀粉混合均匀,用70%的乙醇溶液制软材,过筛制湿颗粒,再加入硬脂酸镁,压片,即得;每片重250mg,活性成分含量为10mg。
2、化合物ii-2胶囊剂的制备
处方:化合物ii-225g,改性淀粉(120目)12.5g,微晶纤维素(100目)7.5g,低取代羟丙纤维素(100目)2.5g,滑石粉(100目)2g,甜味剂1.25g,橘子香精0.25g,色素适量,水适量,制成1000粒。
制法:将处方量的化合物ii-2微粉化粉碎成极细粉末后,与处方量的改性淀粉、微晶纤维素、低取代羟丙纤维素、滑石粉、甜味剂、橘子香精和色素混匀,用水制软材,12–14目筛制粒,40–50℃干燥,过筛整粒,装入空胶囊,即得;每片重50mg,活性成分含量为25mg。
3、化合物iii-1颗粒剂的制备
处方:化合物iii-126g,糊精120g,蔗糖280g。
制法:将化合物iii-1、糊精、蔗糖混合均匀,湿法制粒,60℃干燥,分装,即得。
4、化合物iv-2注射剂的制备
处方:化合物iv-210g,丙二醇500ml,注射用水500ml,共制成1000ml。
制法:称取化合物iv-2、加入丙二醇和注射水,搅拌溶解,再加入1g活性炭,充分搅拌后静置15分钟,用5μm钛棒过滤脱炭,再依次用孔径为0.45μm和0.22μm的微孔滤膜精滤,最后灌封于10ml安瓿中,100℃流通蒸气灭菌45分钟,即得。
5、化合物v-1粉针剂的制备
制法:化合物v-1无菌粉末在无菌条件下分装,即得。
6、化合物v-2滴眼剂的制备
处方:化合物v-23.78g,氯化钠0.9g,苯乙醇3g,硼酸缓冲溶液适量,蒸馏水加至1000ml。
制法:称取化合物v-2、氯化钠加至500ml蒸馏水中,溶解完全后用硼酸缓冲溶液调节ph至6.5,加蒸馏水至1000ml,搅拌均匀,微孔滤膜过滤,灌装,密封,100℃流通蒸气灭菌1小时,即得。
7、化合物v-3搽剂的制备
处方:化合物v-34g,钾肥皂7.5g,樟脑5g,蒸馏水加至100ml。
制法:将樟脑用体积百分浓度为95%的乙醇溶液溶解,备用;将钾肥皂加热液化,备用,称取化合物v-3,在不断搅拌下加入钾肥皂液和樟脑乙醇溶液,再逐渐加入蒸馏水,乳化完全后再加入蒸馏水至全量,即得。
8、化合物v-4栓剂的制备
处方:化合物v-44g,明胶14g,甘油70g,蒸馏水加至100ml,公制100枚。
制法:称取明胶和甘油,加蒸馏水至100ml,水浴60℃加热熔化呈糊状时加入化合物v-4,搅拌均匀,近凝固时倒入阴道栓模具中,冷却凝固,即得。
9、化合物v-5软膏剂的制备
处方:化合物v-50.5–2g,十六醇6–8g,白凡士林8–10g,液体石蜡8–19g,单甘脂2–5g,聚氧乙烯(40)硬脂酸脂2–5g,甘油5–10g,尼泊金乙酯0.1g,蒸馏水加至100g。
制法:将十六醇、白凡士林、液体石蜡、单甘脂和聚氧乙烯(40)硬脂酸脂加热完全溶化后混匀,保温80℃,作为油相备用;将尼泊金乙酯加入甘油和蒸馏水中,加热至85℃溶解,再在不断搅拌下加入油相,乳化后加入化合物v-5,搅拌冷却,即得。
10、化合物vi-1与氟康唑复方粉针剂的制备
处方:化合物vi-150g,氟康唑50g,苯甲酸钠1g,共制成100瓶。
制法:取处方量的化合物vi-2、氟康唑和苯甲酸钠,在无菌状态下混合均匀,分装100瓶,即得。
11、化合物i-4气雾剂的制备
处方:化合物i-42.5g,span203g,滑石粉(100目)4g,三氯一氟甲烷加至适量。
制法:将化合物i-4、span20和滑石粉分别置真空干燥箱内干燥数小时,置干燥器内冷却至室温,用气流粉碎机粉碎成微粉,再按处方量混匀,灌入密闭容器内,加入三氯一氟甲烷至规定量,即得。
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种紫外线吸收剂uv-234的制备方法
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑5-甲基间苯二甲酸锰配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑镉混配配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑间苯二甲酸镉配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑锌混配配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑三维锌配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑对苯二甲酸铜配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-双三唑均苯四酸铜配合物单晶与应用
- 一种4-苯基-3-((4,6-二甲基嘧啶-2-基硫代)甲基)-5-苄硫基三唑类化合物及其应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑二维铜配合物单晶与应用