一种MCM3AP‑AS1基因的靶向抑制剂及其用途的制作方法
本发明属于医药技术领域,具体涉及一种mcm3ap-as1基因的靶向抑制剂及其用途。
背景技术:
脑胶质瘤是人类最常见的、恶性程度最高的中枢神经系统肿瘤。胶质瘤也是一种血管依赖性实体肿瘤,当肿瘤体积大于2cm2,新生血管供血就成为了肿瘤生长的必需条件。肿瘤的血管内皮细胞在胶质瘤微环境中受到刺激而促进其增殖、迁移,进而形成新生血管,所以胶质瘤最大的特点是新生血管丰富、侵袭性高以及预后不良。尽管近些年应用手术治疗,放疗和化疗的综合性多模式治疗已经有了很大进展,但由于胶质瘤的血管内皮细胞增殖、迁移和侵袭的能力强,经治疗后高级别胶质瘤仍易于转移和复发,治疗效果不理想,复发率较高,两年生存率只有15%-26%,平均中位生存期仅有12-18个月。
在胶质瘤的研究中发现,胶质瘤的恶性程度和进展情况与其血管新生有关,胶质瘤的新生血管会影响它的形态结构和功能,研究表明,多种促进血管新生的影响因子通过作用于胶质瘤血管内皮细胞从而参与调控胶质瘤的血管新生,并且胶质瘤内皮细胞调控的血管新生过程与其胶质瘤微环境的形成密切相关。同时胶质瘤的血管新生过程主要表现为胶质瘤内皮细胞的增殖、迁移以及管形成的能力。
微小染色体维持蛋白3(mcm3)在dna的复制中起到重要的作用,而mcm3ap是乙酰化的mcm3,通过染色质结合,过表达的mcm3ap能抑制dna的复制,主要在细胞周期的s期起作用,同时对于细胞增殖的抑制作用主要取决于mcm3ap的乙酰化酶的活性。mcm3ap位于人类染色体21q22.3,在许多人类疾病中参与调控蛋白质的表达,起到重要的作用。mcm3ap-as1是具有mcm3ap基因反向序列的rna分子,是一种长链非编码rna(longnon-codingrna)。lncrna是一种缺少了一段开放阅读框而不具有蛋白质编码功能的长度大于200个核苷酸的rna,在细胞生物学行为的结构和功能活动中起到很重要的作用。研究发现多个lncrna与多种恶性肿瘤的发生和发展都有直接的联系,例如,lncrna可作为癌基因,在人体多种恶性肿瘤例如乳腺癌、食管鳞状细胞癌、胃癌、结直肠癌中起关键作用。
rna干扰技术的原理是利用dicer酶切割rna分子,形成rna沉默复合体,靶向结合目标rna分子进而降解rna分子的过程。本发明希望利用rna干扰技术研制mcm3ap-as1基因的抑制剂,在胶质瘤基因治疗领域发挥作用。
目前,mcm3ap-as1在胶质瘤发生发展中的作用以及相关机制还未见报道,关于mcm3ap-as1在胶质瘤基因治疗方面的应用目前还一片空白。因此,研制一种mcm3ap-as1相关的药物成为目前亟待解决的问题。
技术实现要素:
本发明人经实验证明mcm3ap-as1基因在胶质瘤在组织中高表达,抑制mcm3ap-as1的表达能够抑制胶质瘤的血管内皮细胞增殖、迁移和管形成能力。
本发明的目的在于利用rna干扰技术,设计并提供一种mcm3ap-as1基因靶向抑制剂及其用途,该抑制剂可与mcm3ap-as1基因特异性结合,使mcm3ap-as1基因沉默,从而抑制mcm3ap-as1对胶质瘤的血管内皮细胞增殖、迁移和管形成能力的影响,达到治疗胶质瘤的目的。
为了实现上述目的,本发明采用以下技术方案:本发明提供了一种mcm3ap-as1基因的靶向抑制剂,该靶向抑制剂的基因序列为:
5’-gctgtacctagtatggtatgc-3’(seqidno.1)
本发明进一步提供了该靶向抑制剂能够抑制mcm3ap-as1基因表达的shrna序列,所述shrna模板序列包括正义链和反义链,所述正义链和反义链分别为:
正义链:
5’-caccgctgtacctagtatggtatgcttcaagagagcataccatactaggtacagcttttttg-3’(seqidno.2)。
反义链:
5’-gatccaaaaaagctgtacctagtatggtatgctctcttgaagcataccatactaggtacagc-3’(seqidno.3)。
进一步地,本发明提供了一种转录上述的shrna的转录产物,序列为:
5’-gctgtacctagtatggtatgcttcaagagagcataccatactaggtacagctt-3’(seqidno.4)。
优选的,该抑制剂为任何药物治疗学上可接受的的剂型。
优选的,该抑制剂的剂型为注射制剂。
优选的,该抑制剂为任何药物治疗学上可接受的的剂量。
一种mcm3ap-as1基因抑制剂作为制备用于治疗人脑胶质瘤药物中的应用。
本发明涉及通过mcm3ap-as1基因抑制剂抑制人mcm3ap-as1基因的表达,从而抑制胶质瘤的血管内皮细胞增殖、迁移和管形成能力,为胶质瘤的基因治疗提供了新的思路和治疗方法。
与现有技术相比,本发明具有如下技术效果。
1.本发明靶向抑制剂特异性强,抑制mcm3ap-as1基因的表达。
2.mcm3ap-as1基因抑制剂靶向治疗,能显著降低传统治疗药物的耐药问题。
3.实验已证明在体外细胞学水平上应用,治疗效果确切,无不良反应发生。
附图说明
图1为应用realtimepcr检测mcm3ap-as1基因在胶质瘤的血管内皮细胞和胶质瘤组织中的表达水平显著增高的柱状图。
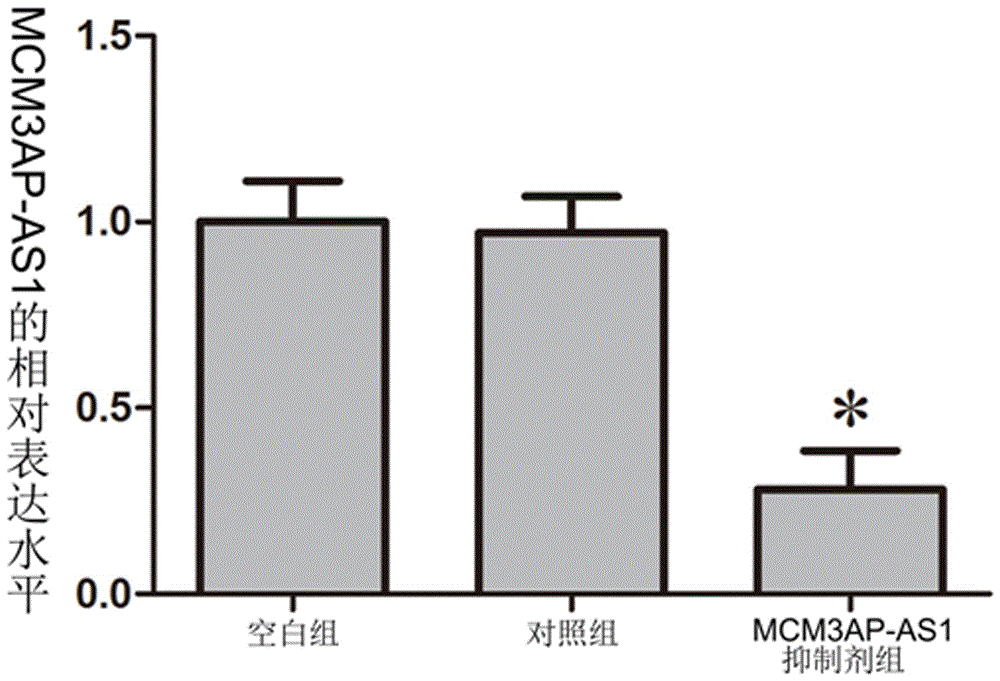
图2为应用realtimepcr检测应用mcm3ap-as1基因抑制剂后,胶质瘤的血管内皮细胞中的mcm3ap-as1表达水平显著下调的柱状图。
图3为cck-8细胞活力法检测应用mcm3ap-as1基因抑制剂后,抑制胶质瘤的血管内皮细胞增殖的柱状图。
图4为transwell细胞迁移实验检测应用mcm3ap-as1基因抑制剂后,抑制胶质瘤的血管内皮细胞迁移的照片和统计图。
图5为matrigel体外三维管形成实验检测应用mcm3ap-as1基因抑制剂后,抑制胶质瘤的血管内皮细胞体外成管能力的照片和统计图。
具体实施方式
本发明主要技术方案是。
1.shrna的设计和干扰载体的制备。
2.干扰效率的验证。
3.cck-8细胞活力法检测mcm3ap-as1基因抑制剂对胶质瘤的血管内皮细胞增殖的影响。
4.transwell细胞迁移实验检测mcm3ap-as1基因抑制剂对胶质瘤的血管内皮细胞迁移的影响。
5.matrigel体外三维管形成实验检测mcm3ap-as1基因抑制剂对胶质瘤的血管内皮细胞形成能力的影响。
实施例1。
一、胶质瘤的血管内皮细胞培养和条件培养基的制备。
人脑微血管内皮细胞系由pierre-oliviercouraud(rnsermu567,paris,france)教授惠赠,人胶质母细胞瘤细胞系u87和u251以及人胚胎肾细胞系hek293购自上海研究院生命科学细胞资源中心。胶质瘤的血管内皮细胞培养于内皮细胞专用ebm-2培养液(按照说明书加入ebm-2添加物,包括vegf、egf、bfgf、氢化可的松、抗坏血酸、庆大霉素、胎牛血清),每2天更换一次培养液,约5-7天内皮细胞可长至单层。u87胶质瘤的血管内皮细胞培养于含10%胎牛血清的dmem高糖培养液,每2天更换一次培养液,约2-3天细胞可长至单层。将u87胶质瘤的血管内皮细胞接种于100mm细胞培养皿中,每个培养皿接种100,000个细胞,每天更换一次培养液,待细胞密度达到80%左右,弃去原瓶中的培养液,pbs洗2遍,以除去残留的血清。然后,加入含5%胎牛血清的ebm-2培养液,培养肿瘤细胞24小时候,收集细胞培养液于15ml离心管,800g低速离心3min,取上清,重新按照说明书加入ebm-2添加物,包括vegf、egf、bfgf、氢化可的松、抗坏血酸、庆大霉素以及使终浓度为5%的fbs后,4°c保存备用。
二、实时定量pcr
1.实时定量pcr检测mcm3ap-as1的表达。
(1)trizol法提取细胞中的总rna。
(2)一步染料法qrt-pcr检测mcm3ap-as1的表达。
测定ct值,以gapdh为内参照,以2-△△ct表示mcm3ap-as1的相对表达量。
检测mcm3ap-as1基因在胶质瘤的血管内皮细胞和胶质瘤组织中的表达水平显著增高的柱状图(如图1所示)。
三、mcm3ap-as1基因抑制剂的制备和应用
设计mcm3ap-as1基因的干扰序列,选定靶向人mcm3ap-as1基因并特异性抑制mcm3ap-as1基因表达的靶基因序列如下:
5’-gctgtacctagtatggtatgc-3’。
在ncbi的同原序列比对分析nucleotideblast中输入gctgtacctagtatggtatgc序列进行比对分析,结果表明该序列和人的其它mrna基因没有高度同源性,可作特异性干扰mcm3ap-as1基因的特异性序列。
针对以上靶序列设计靶向人mcm3ap-as1基因而抑制mcm3ap-as1基因表达的shrna序列如下,包括正义链和反义链,此shrna序列为:
正义链:
5’-caccgctgtacctagtatggtatgcttcaagagagcataccatactaggtacagcttttttg-3’。
反义链:
5’-gatccaaaaaagctgtacctagtatggtatgctctcttgaagcataccatactaggtacagc-3’。
转录上述的shrna的转录产物,序列为:
5’-gctgtacctagtatggtatgcttcaagagagcataccatactaggtacagctt-3’。
将以上序列信息设计并合成相应质粒,作为mcm3ap-as1基因抑制剂。mcm3ap-as1基因抑制剂转染:sh-nc、sh-mcm3ap-as1的质粒u6/gfp/neo,使mcm3ap-as1表达沉默,不含有mcm3ap-as1序列或shrna的空质粒为实验阴性对照;应用24孔培养板培养胶质瘤的血管内皮细胞,当细胞生长达到80%左右时进行转染;配置转染需要的质粒、opti-mem®ⅰ和ltxandplusreagent(lifetechnologies)转染试剂。a管:一个孔按照1μg质粒dna溶解于50μlopti-mem®ⅰ+1μlp3000,放置5min,b管:孔按照1μlltxandplus溶解于50μlopti-mem®ⅰ中;将a、b两管混匀后静置5min;吸出培养液,每孔加入转染混合液100µl,再加入ebm-2培养液400µl;48h后用含有浓度为0.4mg/ml抗生素g418的培养基进行筛选,不断增加g418的浓度,大约4周后得到能够稳定沉默mcm3ap-as1的细胞系。在后续实验中分为3组,分别是:不加任何处理的空白对照组(control);转染mcm3ap-as1沉默空质粒的阴性对照组(sh-nc);转染mcm3ap-as1沉默质粒的实验组(sh-mcm3ap-as1)。
检测应用mcm3ap-as1基因抑制剂后,胶质瘤的血管内皮细胞中的mcm3ap-as1表达水平显著下调的柱状图(如图2所示)。
四、胶质瘤的血管内皮细胞增殖实验。
胶质瘤的血管内皮细胞用胰蛋白酶消化,分别用正常内皮培养液和胶质瘤条件培养液制成单细胞悬液。计数细胞,以2000个/孔的浓度接种于96孔细胞培养板。每组设5个复孔,每孔共计200ul。24h后加入10ulcck-8。2小时后用酶标仪测定波长450nm时各孔光吸收值。
cck-8细胞活力法检测应用mcm3ap-as1基因抑制剂后,抑制胶质瘤的血管内皮细胞增殖的柱状图(如图3所示)。
五、胶质瘤的血管内皮细胞迁移实验。
检测细胞迁移能力:在24孔板中各孔添加600µl含有血清的ebm-2培养液,之后放上聚碳酸酯小室;将不同组的胶质瘤的血管内皮细胞用胰酶消化后轻轻吹散后离心,加入不含血清的ebm-2培养液将细胞进行重悬,各个小室里添加100μl细胞悬液,均匀地铺在上室,大概有104个细胞。放置于37℃细胞培养箱中培养24h;24h后拿出小室,使用棉签轻轻把上室里面擦干净,使用pbs清洗小室并晾干。之后配置固定液,根据甲醇∶冰乙酸=3∶1的配比进行配置,即750ml的甲醇+250ml的冰乙酸吹打混匀;把小室浸没到固定液中固定细胞30min;使用pbs清洗小室并晾干,把吉姆约200µl萨染料铺于倒置小室底部,染色至少30min;使用pbs清洗小室两次,放于倒置显微镜下,在400×镜下观察,随机选择5个视野进行细胞个数统计,体现细胞迁移能力。
transwell细胞迁移实验检测应用mcm3ap-as1基因抑制剂后,抑制胶质瘤的血管内皮细胞迁移数目显著减少(如图4所示)。
六、体外血管形成实验。
matrigel胶原液融化后,96孔细胞培养板每孔加入50ul,取内皮细胞,0.25%的胰蛋白酶消化,分别用正常内皮培养液和胶质瘤条件培养液制成单细胞悬液。计数细胞,以1500个/孔的浓度接种于96孔细胞培养板。培养24h后显微镜观察,5个高倍镜视野下拍照,计数形成的微血管分支数长度。
matrigel体外三维管形成实验检测应用mcm3ap-as1基因抑制剂后,抑制胶质瘤的血管内皮细胞体外成管能力显著降低(如图5所示)。
七、统计学方法。
以上所有的实验都单独重复三次,数据都用平均值±标准差来表示。多组数据间利用统计软件spss19.0,使用单因素方差分析(anova)法进行分析是否有组间差异,当p值<0.05则认为有统计学意义。ic50应用graphpad软件进行计算。
sequencelisting
<110>中国医科大学附属盛京医院
<120>一种mcm3ap-as1基因的靶向抑制剂及其用途
<130>4
<160>4
<170>patentinversion3.3
<210>1
<211>21
<212>dna
<213>人工序列
<400>1
gctgtacctagtatggtatgc21
<210>2
<211>62
<212>dna
<213>人工序列
<400>2
caccgctgtacctagtatggtatgcttcaagagagcataccatactaggtacagcttttt60
tg62
<210>3
<211>62
<212>dna
<213>人工序列
<400>3
gatccaaaaaagctgtacctagtatggtatgctctcttgaagcataccatactaggtaca60
gc62
<210>4
<211>53
<212>dna
<213>人工序列
<400>4
gctgtacctagtatggtatgcttcaagagagcataccatactaggtacagctt53
- 还没有人留言评论。精彩留言会获得点赞!