本发明涉及属于纳米生物检测技术领域,尤其涉及一种用于检测胰腺癌标记物reg1a的生物素化脂质体及其制备方法和应用。
背景技术:
脂质体(liposomes)是磷脂分散在水中形成的一个类似球状的、包封一部分水相的封闭囊泡。其通常含有一层或者多层磷脂膜,大小可由20nm到几十微米。脂质体的应用多体现在药物传递、体外转染等等。随着脂质体技术的发展,脂质体可以包封大量标记物的同时可结合各种类型的生物识别分子,且具有比较高的表面积,内水相体积也比较大,可将脂质体应用于免疫分析方法,即脂质体免疫分析。在操作中,可以通过表面活性剂促使脂质体破膜或表面偶联的抗体启动补体系统等等,免疫分析一旦完成,脂质体膜立即破裂,释放标记物,从而可大大的显著降低分析物的检测线,而且脂质体可以把信号分子包裹,此可减少非特异性吸附。
肿瘤标志物特征性存在于恶性肿瘤细胞,或者由恶性肿瘤细胞异常产生,其反映肿瘤发生、发展、转归,监测肿瘤对反应治疗的标志性分子,对临床的诊疗有着重要的作用。早期诊断、早期治疗,可降低筛查人群中癌症死亡率,改善预后,提高生活治疗。因此,发现合适并高灵敏度、特异性检测肿瘤标志物是目前首要任务。随着多种肿瘤标志物的不断发现和越来越多的低丰度蛋白质的检出,对于新的蛋白质检测方法的灵敏度及特异性提出了更高的要求。
环介导等温扩增技术(lamp技术)是一种新的核酸扩增技术,其在分子生物学检测领域具有非常广泛的应用,具有快速、高效、高灵敏度和高特异性等特点。lamp具有许多独特的优点:(1)灵敏度高:lamp反应能在1个小时内将几个拷贝的目的基因扩增到109倍;(2)特异性强:lamp技术使用四个引物,可以识别目的序列上6个不同的区域,对目标序列具有高度的选择性,减少了非靶标序列的影响;(3)无需温度热循环:lamp全过程在恒温(63℃)条件下就可以实现扩增;(4)不需要特殊设备:lamp方法操作简单,在应用阶段对仪器要求很低,简单廉价的恒温装置就能实现(例如恒温水浴锅),可以直接用肉眼观察白色沉淀或绿色荧光,可应用与poct诊断,恶劣环境等下的应用。因此,将lamp与免疫技术相结合,利用核酸扩增技术放大信号,对体液中低含量的蛋白类肿瘤标志物进行高灵敏度、无创、快速、早期诊断提供新的方法及思路。
胰腺癌是临床常见且恶性程度较高的疾病。据2014年最新数据统计,其死亡病例数占恶性肿瘤的第4位,到2030年可能跃居第二位。而且,由于胰腺解剖位置特殊,相关肿瘤标记物特异性差且早期症状不明显,80%以上的胰腺癌发现时即为晚期,预后极差,被称为“癌中之王”。早期胰腺癌的手术机会在50%以上,术后5年生存率可达80%。而中晚期胰腺癌接受手术的机会小于20%,术后5年生存率仅为5%。因此,胰腺癌的“早期诊断”是疾病治疗及提高病人生存率的关键所在。
胰腺相关的肿瘤标志物包括糖抗原(ca199)、糖抗原(ca242)、癌胚抗原(cea)、胰腺肿瘤胎儿抗原(poa)、胰腺特异抗原(paa)等。ca199为糖类蛋白,诊断胰腺癌的敏感性为79%-81%,特异性为82%-90%。但非肿瘤疾病如慢性胰腺炎、胆石症、糖尿病等常常伴随低浓度增高,预警阈值高、特异性低等缺点。2016年,crnogorac-jurcevic等报道通过检测尿液中三种生物标志蛋白reg1a、lyve1和tff1含量,对胰腺癌进行联合早期诊断,准确率可高达90%,为临床的诊断及治疗提供了新思路。reg1a蛋白是一类胰岛细胞的内源性生长因子,主要在胰腺中表达,与胃肠系统炎性疾病及肿瘤形成相关。因此,发掘高灵敏和特异性的检测尿液中此标志物reg1a蛋白的新方法,对胰管腺癌的早期诊断具有重要意义。
技术实现要素:
本发明的目的在于克服现有技术中的缺陷,基于脂质体包封dna超高灵敏度检测低丰度蛋白的构建,本发明提出了一种用于检测胰腺癌标记物reg1a的生物素化脂质体及其制备方法,并提出一种针对胰腺癌尿液特异性标志物reg1a高灵敏检测方法,以用于检测reg1a蛋白的浓度,从而间接进行胰腺癌的早期检测、复发及转移检测。
为实现上述目的,本发明采用如下技术方案:
本发明的第一个目的是提供一种用于检测胰腺癌标记物reg1a的生物素化脂质体,所述生物素化脂质体包封报告dna片段,其表面修饰peg2000-生物素。
进一步地,所述生物素化脂质体尺寸为150±30nm。
本发明的第二个目的是提供一种上述生物素化脂质体的制备方法,该方法采用dppc、胆固醇、dspe-peg2000、dspe-peg2000-biotin薄膜分散法制备包封报告dna片段的生物素化脂质体。
为了进一步优化上述生物素化脂质体的制备方法,本发明所采取的技术措施还包括:
进一步地,上述生物素化脂质体的制备方法包括如下具体步骤:
a)称取预定量的dppc、胆固醇、dspe-peg2000、dspe-peg2000-biotin放置于离心管中,加入预定量的氯仿和甲醇溶剂,超声溶解;
b)将步骤a)超声后的溶液移入烧瓶进行减压蒸发,在烧瓶的内壁形成脂质膜;
c)将预先配置的报告dna片段溶液滴加入步骤b)中内壁形成脂质膜的烧瓶中,同时水浴并摇晃烧瓶,使内壁上的脂质膜溶解脱离,获得多层脂质体;
d)将步骤c)中包封报告dna片段的多层脂质体放入水浴超声仪中同时进行冰水浴和超声;
e)将步骤d)超声后的溶液离心,去除未分散、较大的脂质体;吸取上清液透析,去除未包埋的dna分子,获得生物素化脂质体;
f)将步骤e)获得的生物素化脂质体低温保存。
进一步地,所述步骤a)中,dppc、胆固醇、dspe-peg2000、dspe-peg2000-biotin的摩尔量之比为(80~120):(80~120):(5~15):(0.5~2),氯仿和甲醇的体积比为(3~9):(0.5~2);更进一步地,dppc、胆固醇、dspe-peg2000、dspe-peg2000-biotin的摩尔量之比为95:95:9:1,氯仿和甲醇的体积比为6:1。
进一步地,所述步骤a)中超声溶解5~30min;更进一步地为10min。
进一步地,减压蒸发操作的温度为25~45℃,更进一步地为35℃。
进一步地,所述步骤e)中离心操作为3000rpm15min,透析采用300kd透析袋。
进一步地,所述步骤e)获得的生物素化脂质体尺寸为150±30nm。
进一步地,所述步骤f)获得的低温保存温度为0~10℃;更进一步地为4℃。
本发明的第三个目的是提供一种基于上述生物素化脂质体的检测胰腺癌标记物reg1a的方法,该方法用于非诊断和非治疗的目的,其包括如下步骤:
1)生物素化脂质体的制备;
2)reg1a鼠源单克隆抗体包被酶标板,将待检测的reg1a蛋白样本加入,再分别与reg1a兔源多克隆抗体、生物素化羊抗兔抗体、亲和素反应;
3)加入步骤1)制备的预定浓度的生物素化脂质体,破膜后进行荧光定量lamp扩增反应;
4)根据步骤3)的扩增反应结果分析reg1a蛋白的浓度。
为了进一步优化上述检测胰腺癌标记物reg1a的方法,本发明所采取的技术措施还包括:
进一步地,所述步骤1)生物素化脂质体的制备采用本文上述已提及的制备方法。
进一步地,所述生物素脂质体的浓度为0.12-0.24mglipid/ml。
进一步地,步骤3)的破膜步骤采用破膜液,所述破膜液包括tritonx-100;更进一步地,所述破膜液为10mm硼酸中的10mmtritonx-100,ph=9.0。
进一步地,上述检测方法中,reg1a单克隆大鼠源抗体包被浓度为1μg/ml、reg1a兔源多克隆抗体检测浓度为1μg/ml,生物素化羊抗兔抗体使用浓度为1:1000,亲和素使用浓度为2μg/ml,生物素化脂质体的使用浓度为0.20mglipid/ml。
进一步地,上述检测方法中,reg1a单克隆大鼠源抗体为0.2mg/ml的abcamab201643、reg1a兔源多克隆抗体为1mg/ml的abcamab47099。
进一步地,该方法中reg1a蛋白的最低检测值为1fg/ml。
进一步地,所述步骤3)中分析方法具体如下:采用reg1a标准品浓度值对应的扩增ct值绘制标准曲线,对待检测的reg1a蛋白样本检测得到的ct值依据标准曲线进行分析,从而获得reg1a蛋白的浓度。
本发明提供了一种无创高灵敏度检测尿液中reg1a蛋白,可以(间接)实现胰腺癌的早期诊断,为临床诊疗提供新思路。该方法设计主要包括以下几个部分:(1)报告dna片段合成及内引物、外引物(引物在最后的反应体系中添加,与反应液等一起添加)设计;(2)脂质体的合成及报告dna包裹,同时测定包封率、粒径大小、包封量、磷脂浓度及电镜表征等等;(3)三明治夹心免疫反应;(4)脂质体破膜后lamp扩增,通过荧光信号ct值的变化来表征捕获蛋白的浓度,从而精确超灵敏的分析尿液中reg1a蛋白的浓度。
本发明基于如下原理设计了胰腺癌的肿瘤标志物reg1a的检测方法:三代脂质体包封dna为报告分子,表面为peg2000-生物素,与reg1a抗原抗体的三明治夹心系统通过生物素-亲和素-生物素相连。破膜后,通过荧光定量lamp进行dna报告分子的信号放大,ct值的变化可以间接反应reg1a的抗原含量,并以此做标准曲线检测尿液中的reg1a蛋白。此外,对比其他蛋白分子分析结果表明该方法具备优越的特异性和选择性,同时对复杂的尿液样本进行分析时该方法也显示较好的稳定性,可以超早期进行胰腺癌的诊断,因而具备较好的应用前景。
本发明采用上述技术方案,与现有技术相比,本发明具有以下有益效果:
本发明基于lamp技术构建脂质体包裹dna报告分子的荧光分析平台,可以高灵敏度、超低丰度的检测胰腺癌标志物reg1a蛋白,该方法操作简便,在原有的elisa进出上进行三次信号的放大,通过荧光lamp定量分析蛋白含量,其能实现胰腺癌标志物reg1a的高灵敏度检测,并具有稳定性好、成本低、高特异性的优点。
本发明采用免疫lamp反应与免疫脂质体纳米颗粒相结合,对报告核酸片段进行双重信号的扩增,进一步提高灵敏度及特异性。联合诊断检测早期胰腺癌尿液生物标志蛋白reg1a含量,为临床的诊断及治疗提供了新思路。
其优点及特点具体如下:(1)从核酸分子水平出发,利用核酸扩增技术高灵敏的研究尿液中生物标志物蛋白含量,利用核酸扩增技术高灵敏度检测生物标志物蛋白质,针对胰腺癌早期、超灵敏、高特异性的生物标志物蛋白诊断检测;(2)创新性地结合了dna包裹脂质体,可以放大检测信号,还可以与核酸扩增技术相结合,从而间接检测生物标志物蛋白质;(3)本发明整合免疫lamp核酸扩增技术和dna包裹脂质体技术,构建尿液中三种生物标志物蛋白质的特异高灵敏度检测新体系、研究早期胰腺癌诊断新系统,在临床应用上具极大的前瞻性和创新性。
附图说明
图1是基于脂质体包封dna超高灵敏度检测reg1a蛋白测定的流程示意图;
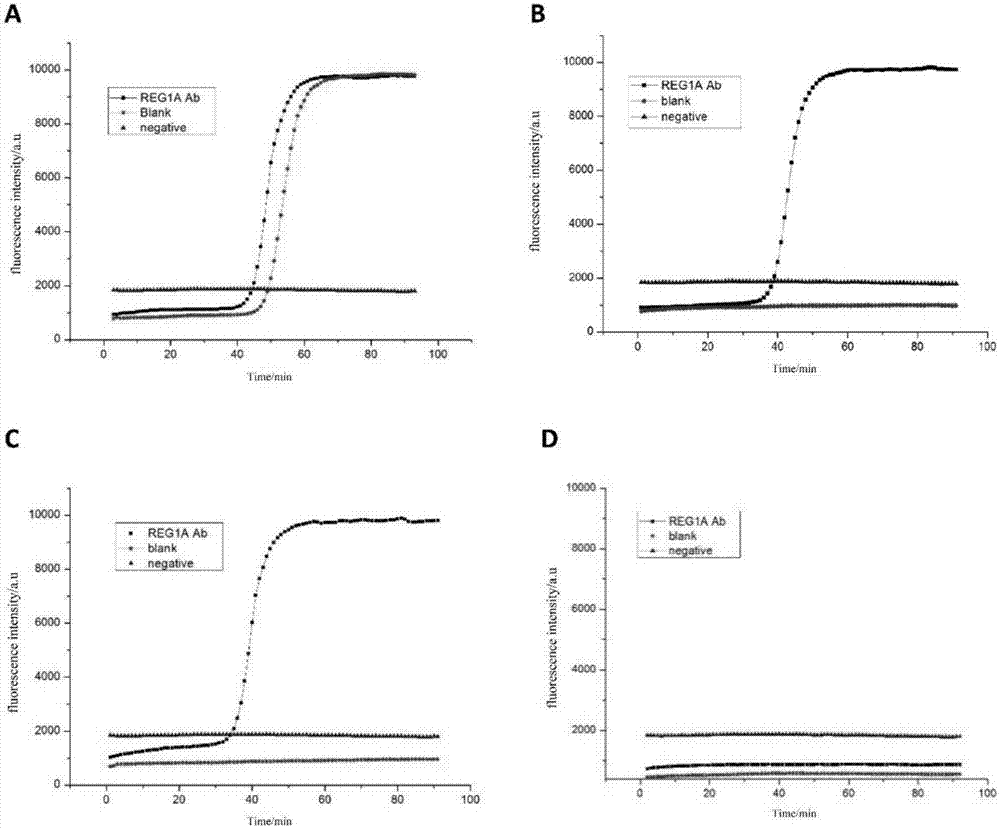
图2是生物素化脂质体的使用浓度优化的扩增结果示意图;其中a部分生物素化脂质体的使用浓度为1.2mg/ml,b部分生物素化脂质体的使用浓度为0.24mg/ml,c部分生物素化脂质体的使用浓度为0.12mg/ml,d部分生物素化脂质体的使用浓度为0.06mg/ml;
图3是基于生物素化脂质体对不同浓度重组蛋白检测的扩增结果图及溶液中reg1a浓度及荧光lampct数值之间的线性关系图。
图4是以5种不同蛋白(p-gp,muc1,il-6,cattlemucins,bsa)作为对照,检测reg1a蛋白的特异性的结果图。
具体实施方式
本发明提供了一种用于检测胰腺癌标记物reg1a的生物素化脂质体,其包封报告dna片段,其表面修饰peg2000-生物素;本发明还提供一种上述生物素化脂质体的制备方法,并提供一种基于上述生物素化脂质体的检测胰腺癌标记物reg1a的方法。
下面结合附图和实施例,对本发明的具体实施方式作进一步描述。以下实施例仅用于更加清楚地说明本发明的技术方案,而不能以此来限制本发明的保护范围。
实施例1
本实施例为用于检测胰腺癌标记物reg1a的生物素化脂质体的制备方法,其包括如下步骤:
a)分析天平称量dppc、胆固醇、dspe-peg2000、dspe-peg2000-biotin(四者之间摩尔量之比为95:95:9:1,总质量为36.5mg),放置10ml离心管中,加入3.43ml氯仿和571μl甲醇溶剂(二者体积比为6:1,总体积为4ml),超声10min加速溶解。
b)超声后的上述液体加入50ml茄形瓶,放入搭建好的旋转蒸发仪器,减压下蒸发有机溶剂(35℃),在烧瓶内壁形成一层薄的脂质膜。
c)将预先配置好的2mlpbs含1μgdna溶液滴加入烧瓶中,同时在45℃度水浴中摇晃烧瓶,使内壁上脂膜溶解脱离,此时获得多层脂质体。
d)将包封dna的脂质体放入水浴超声仪中冰水浴,4min超声-1min停(20w)循环10次。
e)溶液离心3000rpm15min去除为分散、较大的脂质体,吸取上清液后用300kd透析袋,去除未包埋的dna分子。
f)脂质体置4℃保存。
上述生物素化脂质体包封报告dna片段,其表面修饰peg2000-生物素,该生物素化脂质体的尺寸为150±30nm。
实施例2
本实施例为基于上述生物素化脂质体的用于非诊断和非治疗目的的检测胰腺癌标记物reg1a的方法,基于脂质体包封dna超高灵敏度检测reg1a蛋白测定流程示意图如图1所示。
具体步骤如下:
1)reg1a单克隆大鼠源抗体1μg/ml包被康宁coast9018酶标板,4℃过夜。
2)pbst(0.05%tween20ph7.4)洗板2次,将检测板23%bsa250μl封闭1h。重复洗板4次。
3)将重组蛋白10倍稀释后加入到检测板中,37℃孵育1h。重复洗板4次。
4)加入reg1a多克隆鼠源抗体1μg/ml,37℃孵育1h。重复洗板4次。
5)加入1:1000的生物素化羊抗兔抗体各100μl,37℃孵育1h。重复洗板4次。
6)加入100μl亲和素2μg/ml,37℃孵育1h。重复洗板4次。
7)加入300μl空白suv(0.2mglipid/ml)封闭,37℃孵育1h。重复洗板4次。
8)将制备好的脂质体(采用实施例1所述的方法制备)稀释加入到已包被的孔内(0.2mglipid/ml),37℃孵育1h。重复洗板4次。
9)将100μldnasei(100iu)(10mmcacl2,10mmmgcl2,20mmhepes,ph7.8)加入微孔中,37℃30min,80℃10min。pbs洗涤5次。
10)加入100μl破膜液(在10mm硼酸中的10mmtritonx-100,ph9.0)25摄氏度孵育15min。
11)荧光定量lamp测定(25μl)并进行reg1a蛋白的浓度分析。
该实施例中,所使用的抗体及重组蛋白如下:reg1a单克隆大鼠源抗体为0.2mg/mlabcamab201643,reg1a多克隆兔源抗体为1mg/mlabcamab47099,reg1a重组蛋白为10μgabcamab73778。
实施例3
本实施例为生物素化脂质体的使用浓度的优化,其步骤与实施例2相同,本实施例采用的生物素化脂质体的使用浓度分别为1.2mg/ml、0.24mg/ml、0.12mg/ml、0.06mg/ml(分别对应于图2中的a部分、b部分、c部分、d部分),由图2的扩增结果可知,当生物素化脂质体的使用浓度为1.2mg/ml时,reg1a蛋白组和空白对照组均出现“s”型扩增曲线;当生物素化脂质体的使用浓度为0.24或0.12mg/ml时,仅reg1a蛋白组出现“s”型扩增曲线;当生物素化脂质体的使用浓度为0.06mg/ml时,各实验组均未出现“s”型扩增曲线。
由上述实验结果可知,在本发明所述的检测胰腺癌标记物reg1a的方法中,生物素化脂质体的较佳的使用浓度为0.12-0.24mglipid/ml。
实施例4
本实施例基于生物素化脂质体对不同浓度重组蛋白进行检测,以确定最低检测限值,并采用reg1a标准品浓度值对应的扩增ct值绘制标准曲线。
本实施例采用的重组蛋白的浓度包括1μg/ml、100ng/ml、1ng/ml、10pg/ml、100fg/ml、1fg/ml、10ag/ml。其操作步骤与实施例2相同。其最终结果如图3所示,随着浓度的增加,ct值增加。从上述结果中可以证实本发明所述的检测方法最低可实现对1fg/ml灵敏检测,且该结果也显示出了reg1a浓度及荧光lampct数值之间的良好线性关系,以上结果表明这一系列检测手段可以实现reg1a蛋白超高灵敏的的检测。
实施例5
本实施例验证了检测reg1a蛋白的特异性。
为检测该实验方法对胰腺癌标志物reg1a的特异性,收集临床正常体检人群尿液,排除器质性病变。分别加入reg1a特异性重组蛋白500ng/ml、100ng/ml、1ng/ml。采用上述生物素化脂质体-lamp方法检测,将检测值及加入标准量进行对比。其结果见表1
表1尿液中加入重组蛋白的检测
另外,本实施例采用用其他5中不同蛋白(p-gp,muc1,il-6,cattlemucins,bsa)作为对照,按照实施例2所述的操作方法,分别对浓度为100ng/ml干扰蛋白和reg1a蛋白进行比色检测。其结果如图4所示,当溶液中含有100ng/mlreg1a蛋白时,最终荧光强度最高。而含其他干扰蛋白时结果都比较接近且与reg1a蛋白结果差异很大,说明该方法对于reg1a蛋白具有较好的选择性。
由上述实施例可知,本发明所述的基于上述生物素化脂质体的用于非诊断和非治疗目的的检测胰腺癌标记物reg1a的方法,对于检测reg1a蛋白具有很好的选择性和特异性,设计和操作过程简便、成本低廉、超高灵敏度,因而未来在对胰腺癌早期诊断及低丰度蛋白检测有着很大的潜在应用价值。
以上对本发明的具体实施例进行了详细描述,但其只作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对该实用进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。