用于抑制HSV-1复制和/或靶标序列表达的CRISPR/Cas9系统、方法、试剂盒及其应用与流程
本发明涉及基因治疗领域,涉及一种用于抑制hsv-1复制和/或靶标序列表达的crispr/cas9系统、方法、试剂盒及其应用。
背景技术:
单纯疱疹病毒(herpessimplexviruses,hsv)是具有包膜的双链dna病毒,病毒基因组包含74个与病毒增殖感染相关的基因,可分为两种血清型hsv-1和hsv-2。hsv-1可在人群中传染,其中三分之一感染人口会发生复发感染。单纯疱疹病毒性角膜炎是导致角膜盲的最主要原因,每年全球大约有一百五十万人口患单纯疱疹性角膜炎。
hsv-1原发感染后病毒可能潜伏于体内神经细胞中,病毒受刺激再次激活会发生单纯疱疹病毒继发感染。在继发感染中,潜伏病毒通过神经轴运输至皮肤,病毒复制使上皮细胞死亡脱落,形成新的发病灶。单纯疱疹病毒性角膜炎是由hsv-1在角膜上继发感染引起的其中一种疾病,是临床上最为常见的病毒性角膜炎之一,同时是引起角膜盲的最主要因素。潜伏感染的hsv-1将自身基因组藏匿于神经细胞内,只表达潜伏期相关rna(latencyassociatedtranscript,lat)。病毒增殖和感染相关的蛋白在潜伏期不表达,一方面对机体产生免疫逃逸,另一方面主流抗病毒药物也失去作用靶点,不能清除潜伏的hsv-1。这导致了病毒性角膜炎难以根治的问题。
规律成簇间隔短回文重复系统(clusteredregularlyinterspacedshortpalindromicrepeat;crispr-associated,crispr-cas)是古菌和细菌的抵抗病毒和质粒侵染的重要免疫防御系统,用来抵抗外源遗传物质的入侵,比如噬菌体病毒和外源质粒。同时,它为细菌提供了获得性免疫:这与哺乳动物的获得性免疫类似,当细菌遭受病毒或者外源质粒入侵时,会产生相应的“记忆”,从而可以抵抗它们的再次入侵。crispr/cas系统可以识别出外源dna或rna,并将它们切断,沉默外源基因的表达。
crispr-cas系统划分为两大类,第一大类crispr-cas系统由多亚基组成的效应复合物发挥功能;第二大类是由单个效应蛋白(如cas9,cpf1,c2c1等)来发挥功能。其中,cas9,cpf1,c2c1均具有rna介导的dna核酸内切酶活性。
在自然界中,crispr/cas系统拥有多种类别,其中crispr/cas9系统是研究最深入,应用最成熟的一种类别。crispr-cas9是一种具有核酸内切酶活性的复合体,识别特定的dna序列,进行特定位点切割造成双链dna断裂(double-strandbreaks,dsb),在没有模板的条件下,发生非同源重组末端连接(non-homologousendjoining,nhej),造成移码突变(frameshiftmutation),导致基因敲除。crispr/cas9是继“锌指核酸内切酶(zfn)”、“类转录激活因子效应物核酸酶(talen)”之后出现的第三代“基因组定点编辑技术”。凭借着成本低廉,操作方便,效率高等优点,crispr/cas9迅速风靡全球的实验室,成为了生物科研的有力帮手。
近两年,研究界开始尝试将cas9crispr/cas9系统应用于抑制hsv-1复制和/或靶标序列表达,但是由于grna的实际应用效果受多种因素影响,能有效从病毒基因组层面抑制hsv-1增殖和复制的grna报道并不多。
因此,有必要提供一种用于抑制hsv-1复制和/或靶标序列表达的crispr/cas9系统、方法、试剂盒及其应用。
在本文中提及或通过引用结合在本文中的任何文献中的任何产品的任何制造商的说明书、说明、产品规格、和产品表,通过引用并入本文,并且可以在本发明的实践中采用。更具体地说,所有参考的文献均通过引用并入本文,其程度如同每个单独的文献被确切地并单独地指明通过引用而并入本文。
技术实现要素:
为解决上述问题,本发明提供了一种用于抑制hsv-1复制和/或靶标序列表达的crispr/cas9系统、方法、试剂盒及其应用。
本发明第一方面提供了一种grna,所述grna的编码序列包括seqidno.1-seqidno.6所示核苷酸序列中的一种或多种。
本发明第二方面提供了用于抑制hsv-1复制和/或靶标序列表达的crispr/cas9系统,包含cas9蛋白和grna,所述grna的编码序列包括seqidno.1-seqidno.6所示核苷酸序列中的一种或多种。
优选地,在第一方面或第二方面中,所述的grna为如下1)或2)中的一种:
1)包括crrna和tracrrna,其中,crrna的部分序列与tracrrna的部分序列互补、并组成二聚体,其中,crrna包括引导序列,所述引导序列的编码序列包括seqidno.1-seqidno.6所示核苷酸序列中的一种或多种;
2)嵌合型单链sgrna,其中sgrna由crrna与tracrrna融合而成,sgrna包括引导序列,所述引导序列的编码序列包括seqidno.1-seqidno.6所示核苷酸序列中的一种或多种。
本领域技术人员可以理解的是,grna除包含与靶dna序列互补的引导序列外,还包含骨架序列。grna的形式可以是由crrna和tracrrna组成的二聚体,也可以是人工改造的由crrna和tracrrna融合而成的嵌合型单链sgrna。
本领域技术人员可以理解的是,crisprrna(crrna)的rna分子利用它的一部分序列(3’端)与被称作tracrrna(trans-activatingcrrna)的rna分子通过碱基配对结合在一起,形成嵌合rna(即tracrrna/crrna二聚体),然后,借助crrna的另一部分序列(5’端)与靶dna位点进行碱基配对,以这种方式,这种嵌合rna就能够引导所述的cas9蛋白结合到靶dna序列上,进行特定位点切割。
本领域技术人员可以理解的是,在实际应用时,还可以将tracrrna和crrna融合在一起形成单向导rna(singleguiderna,sgrna),即本发明所述的嵌合型单链sgrna,所述的嵌合型单链sgrna能够引导所述的cas9蛋白结合到靶dna序列上并进行剪辑编辑。
crispr系统已经从很多不同的细菌鉴定和表征,并且这些cas9酶的任一种可以用于本文中描述的方法中。例如可以使用来自以下任一种的cas9蛋白:棒状杆菌属(corynebacter)、萨特氏菌属(sutterella)、军团杆菌属(legionella)、密螺旋体(treponema)、产线菌属(filifactor)、真细菌属(eubacterium)、链球菌属(streptococcus)、乳杆菌属(lactobacillus)、支原体(mycoplasma)、拟杆菌属(bacteroides)、flaviivola、黄杆菌属(flavobacterium)、sphaerochaeta、固氮螺菌属(azospirillum)、葡糖醋杆菌属(gluconacetobacter)、奈瑟氏菌属(neisseria)、罗斯氏菌属(roseburia)、parvibaculum、葡萄球菌属(staphylococcus)、nitratifractor、支原体(mycoplasma)和弯曲菌属(campylobacter)。几种cas9表达载体可获自addgene。
本发明一实施方式中,使用来自化脓性链球菌cas9(streptococcuspyogenescas9,spcas9),金黄色葡萄球菌cas9(staphylococcusaureuscas9,sacas9),空肠弯曲杆菌cas9(campylobacterjejunicas9,cjcas9),嗜热链球菌cas9(streptococcusthermophiluscas9,stcas9),脑膜炎双球菌cas9(neisseriameningitidiscas9,nmcas9),毛螺菌科cpf1(lachnospiraceaecpf1,lbcpf1),氨基酸球菌cpf1(acidaminococcuscpf1,ascpf1)的crispr系统和cas9蛋白或其他本领域技术人员常规理解的cas9蛋白。
这些蛋白的每种依赖于不同的识别位点或pam。比如,spycas9的pam是5’-ngg-3’,nme的是5’-nnnngatt-3’。spy使用13至15个核苷酸靶标序列。nme和sau使用18至24个核苷酸靶标序列。
本领域技术人员在不脱离本发明实施例原理的前提下,可以对cas9蛋白的编码序列做出合适的选择。
本发明一优选实施方式中,所述cas9蛋白的氨基酸序列包含但不限于与seqidno.
本发明一实施方式中,由引导序列和骨架序列组成的grna,可采用将grna对应的编码dna序列克隆到载体中或在体外转录。
本发明一实施例中,grna可通过完全互补或基本互补、或以一定互补百分比,特异性地识别所述hsv-1的sa基因(本发明实施例中,“hsv-1的sa基因”与“靶核苷酸序列”可以互换)。
本发明所提供的grna与所述靶核苷酸序列具有足够互补性以便与该靶核苷酸序列杂交并且指导cas9蛋白与该靶核苷酸序列的特异性结合。在一些实施例中,grna与其相应的靶核苷酸序列之间的互补程度是约或多于约50%、60%、75%、80%、85%、90%、95%、97.5%、99%或更多。
本发明实施例中,“互补”是指核酸与另一个核酸序列借助于传统的沃森-克里克碱基配对或其他非传统类型形成一个或多个氢键。“互补百分比”表示一个核酸分子中可与一个第二核酸序列形成氢键(例如,沃森-克里克碱基配对)的残基的百分比(例如,10个之中有5、6、7、8、9、10个即为50%、60%、70%、80%、90%、和100%互补)。“完全互补”表示一个核酸序列的所有连续残基与一个第二核酸序列中的相同数目的连续残基形成氢键。如本文使用的“基本上互补”是指在一个具有8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50个或更多个核苷酸的区域上至少为60%、65%、70%、75%、80%、85%、90%、95%、97%、98%、99%、或100%的互补程度。
本发明一实施方式中,所述grna是引导序列与骨架序列组成的成熟的grna序列。
本发明一实施方式中,所述引导序列的编码序列为表1中seqidno.1-seqidno.6所示核苷酸序列中的一条或多条。
本发明实施方式中,所述grna骨架序列为本领域技术人员常规选用的,该骨架序列可以是由crrna和tracrrna(trans-activatingcrrna)组成的二聚体,也可以是人工改造的由crrna和tracrrna融合而成的嵌合型单链sgrna。grna的骨架序列可以是目前常规使用的序列,如下为一种常规的骨架序列的编码序列gttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgc,也可以是在此基础上构建的一些突变体,这些突变体与目前常规使用的序列有50%、60%、75%、80%、85%、90%、95%、97.5%、99%或更高的相似度。
本发明实施方式中,所述grna序列可特异性识别的靶核苷酸可以包括与hsv-1疾病相关基因或多核苷酸。
“疾病相关”基因或多核苷酸是指与非疾病对照的组织或细胞相比,在来源于疾病影响的组织的细胞中以异常水平或以异常形式产生转录或翻译产物的任何基因或多核苷酸。在改变的表达与疾病的出现和/或进展相关的情况下,它可以是一个以异常高的水平被表达的基因;它可以是一个以异常低的水平被表达的基因。疾病相关基因还指具有一个或多个突变或直接负责或与一个或多个负责疾病的病因学的基因连锁不平衡的遗传变异的基因。转录的或翻译的产物可以是已知的或未知的,并且可以处于正常或异常水平。
在本发明实施方式中,术语“靶核苷酸”是指核糖核苷酸或其类似物。“靶核苷酸”可以包含一个或多个经修饰的核苷酸,如甲基化的核苷酸和核苷酸类似物。
在本发明一实施方式中,所述的cas9蛋白还包括其他任选地的连接肽段,所述连接肽段具体地,包括但不限于表位标签、报告基因序列、以及具有下列活性的一者或多者的蛋白质结构域:甲基酶活性、脱甲基酶活性、转录激活活性、转录阻遏活性、转录释放因子活性、组蛋白修饰活性、核定位信号、rna切割活性和核酸结合活性。表位标签的非限制性实例包括组氨酸(his)标签、v5标签、flag标签、流感病毒血凝素(ha)标签、myc标签、vsv-g标签、和硫氧还蛋白(trx)标签。报告基因的实例包括,但不限于,谷胱甘肽-s-转移酶(gst)、辣根过氧化物酶(hrp)、氯霉素乙酰转移酶(cat)、β-半乳糖苷酶、β-葡糖醛酸糖苷酶、萤光素酶、绿色荧光蛋白(gfp)、hcred、dsred、青荧光蛋白(cfp)、黄色荧光蛋白(yfp)、以包括蓝色荧光蛋白(bfp)的自发荧光蛋白。
在本发明一实施方式中,所述的cas9蛋白融合蛋白中还可以融合一种蛋白质或蛋白质片段,所述蛋白质或蛋白质片段结合dna分子或结合其他细胞分子,其包括,但不限于,麦芽糖结合蛋白(mbp)、s-tag、lexadna结合结构域(dbd)融合物、gal4dna结合结构域融合物、以及单纯疱疹病毒(hsv)bp16蛋白融合物。在本发明一些实施例中,所述融合蛋白质为分子标记,使用标记的cas9蛋白融合蛋白可用来鉴定靶序列的位置。
术语“多肽”、“肽”和“蛋白质”在本文可互换地使用,是指具有任何长度的氨基酸的聚合物。该聚合物可以是可以是直链或支链的,它可以包含修饰的氨基酸,并且它可以被非氨基酸中断。这些术语还涵盖已经被修饰的氨基酸聚合物;这些修饰例如二硫键形成、糖基化、脂化(lipidation)、乙酰化、磷酸化、或任何其他修饰,如与检测分子标记组分的结合。
本发明第二方面提供了一种非天然存在的或工程化的组合物,所述组合物包含一种或多种载体,该一种或多种载体包含组分i和组分ii:
所述组分i包括第一调节元件,以及与所述第一调节元件可操作地连接的编码如第二方面所述的cas9蛋白的编码序列;所述组分ii包括第二调节元件,以及与所述第二调节元件可操作地连接的编码如第二方面所述的grna的编码序列;其中,组分i和ii位于相同或不同载体上。
在本发明实施方式中,术语“载体”优选是病毒载体,例如,逆转录病毒、复制缺陷型逆转录病毒、腺病毒、复制缺陷型腺病毒、以及腺相关病毒载体。
在本发明一优选实施方式中,所述载体选自逆转录病毒、慢病毒、腺病毒或腺相关病毒。
在本发明一优选实施方式中,所述载体为plenticrisprv2载体。
通常,在载体内,“可操作地连接”旨在表示核苷酸序列以一种允许该核苷酸序列的表达的方式被连接至一个或多个调节元件(可选地,载体处于一种体外转录/翻译系统中可以表达该核苷酸序列;可选地,当该载体被引入到宿主细胞中时可以表达该核苷酸序列)。
在本发明实施方式中,术语“表达”是指从dna模板转录成多核苷酸(如转录成mrna或其他rna转录物)的过程和/或转录的mrna随后翻译成肽、多肽或蛋白质的过程。转录物和编码的多肽可以总称为“基因产物”。如果多核苷酸来源于基因组dna,表达可以包括真核细胞中mrna的剪接。
本文使用的术语“非天然存在的”或“工程化的”可互换地使用,当指核酸分子或多肽时,表示该核酸分子或多肽至少基本上从它们在自然界中或如发现于自然界中的与其结合的至少另一种组分游离出来。
在本发明优选实施方式中,所述的第一调节元件(在本发明一实施例中,本发明所述的“调节元件”可以理解为“基因表达盒”)包括一个或多个poliii启动子(例如1、2、3、4、5、或更多个poliii启动子)、一个或多个polii启动子(例如1、2、3、4、5、或更多个polii启动子)、一个或多个poli启动子(例如1、2、3、4、5、或更多个poli启动子)、或其组合。此外,第一调节元件还可以是t7启动子,sp6启动子等。poliii启动子的实例包括但不限于u6和h1启动子。polii启动子的实例包括但不限于逆转录劳斯肉瘤病毒(rsv)ltr启动子(任选地具有rsv增强子)、巨细胞病毒(cmv)启动子(任选地具有cmv增强子)[参见,例如,波沙特(boshart)等人,《细胞》(cell)41:521-530(1985)]、sv40启动子、二氢叶酸还原酶启动子、β-肌动蛋白启动子、磷酸甘油激酶(pgk)启动子、和ef1α启动子。
在本发明一些实施方式中,蛋白编码序列经密码子优化,以便在特定的细胞如真核细胞中表达。这些真核细胞可以是特定生物的那些或来源于特定生物,如哺乳动物,包括但不限于人、小鼠、大鼠、兔、狗、或非人类灵长动物。一般而言,密码子优化是指通过用在宿主细胞的基因中更频繁地或者最频繁地使用的密码子代替天然序列的至少一个密码子(例如约或多于约1、2、3、4、5、10、15、20、25、50个、或更多个密码子同时维持该天然氨基酸序列而修饰一个核酸序列以便增强在感兴趣宿主细胞中的表达的方法。不同的物种对于具有特定氨基酸的某些密码子展示出特定的偏好。密码子偏好性(在生物之间的密码子使用的差异)经常与信使rna(mrna)的翻译效率相关,而该翻译效率则被认为依赖于(除其他之外)被翻译的密码子的性质和特定的转运rna(trna)分子的可用性。细胞内选定的trna的优势一般反映了最频繁用于肽合成的密码子。因此,可以将基因定制为基于密码子优化在给定生物中的最佳基因表达。密码子利用率表可以容易地获得,例如在密码子使用数据库(“codonusagedatabase”)中,并且这些表可以通过不同的方式调整适用。参见,中村y.(nakamuray.)等人,“从国际dna序列数据库中制表的密码子使用:2000年的状态”(codonusagetabulatedfromtheinternationaldnasequencedatabases:statusfortheyear2000)《核酸研究》(nucl.acidsres.)28:292(2000年)。用于密码子优化特定的数列以便在特定的宿主细胞中表达的计算机算法也是可得的,如基因制造(geneforge)(aptagen公司;雅各布斯(jacobus),pa),也是可得的。在一些实施例中,在编码crispr酶的序列中的一个或多个密码子(例如1、2、3、4、5、10、15、20、25、50个、或更多个、或所有密码子)相应于对于特定氨基酸最频繁使用的密码子。
在本发明优选实施方式中,所述的第二调节元件包括但不限定于一个或多个polii启动子(例如1、2、3、4、5、或更多个polii启动子)、一个或多个poli启动子(例如1、2、3、4、5、或更多个poli启动子)、或其组合,poliii启动子(包括但不限定于u6,h1启动子),t7启动子,sp6启动子等。
在本发明优选实施方式中,所述的第一或二调节元件还包括增强子、内部核糖体进入位点(ires)、和其他表达控制元件(例如转录终止信号,如多聚腺苷酸化信号和多聚u序列)。这样的调节序列例如描述于戈德尔(goeddel),《基因表达技术:酶学方法》(geneexpressiontechnology:methodsinenzymology)185,学术出版社(academicpress),圣地亚哥(sandiego),加利福尼亚州(1990)中。调节元件包括指导一个核苷酸序列在许多类型的宿主细胞中的组成型表达的那些序列以及指导该核苷酸序列只在某些宿主细胞中表达的那些序列(例如,组织特异型调节序列)。组织特异型启动子可主要指导在感兴趣的期望组织中的表达,所述组织例如肌肉、神经元、骨、皮肤、血液、特定的器官(例如肝脏、胰腺)、或特殊的细胞类型(例如淋巴细胞)。调节元件还可以时序依赖性方式(如以细胞周期依赖性或发育阶段依赖性方式)指导表达,该方式可以是或者可以不是组织或细胞类型特异性的。
进一步地,所述组合物还包括药学上的载体。
药物组合物含有药学上可接受的成分,比如赋形剂、载体和/或稳定剂。这种成分包括本身不诱导对接受组合物的个体有害的免疫反应的任何药物试剂,并且其没有不适当毒性而被施用。药学上可接受的成分包括但不限于液体,比如水、生理盐水、甘油和乙醇。药学上可接受的盐包括在其中,例如无机酸盐,比如盐酸盐、氢溴酸盐、磷酸盐、硫酸盐等;以及有机酸盐,比如乙酸盐、丙酸盐、丙二酸盐、苯酸盐等。此外,辅助物质比如润湿或乳化剂、ph缓冲物质等也可以存在于这种载体中。其它示例性的成分包括乳糖、蔗糖、磷酸钙、明胶、右旋糖酐、琼脂、果胶、花生油、芝麻油和水。载体的选择不是本发明的限制。任选地,本公开的组合物除raav载体和其它成分以外,可以包含其它常规药物组分,比如防腐剂、化学稳定剂等。合适的示例性组分包括微晶纤维素、羧甲基纤维素钠、聚山梨醇酯80、苯乙醇、氯丁醇、山梨酸钾、山梨酸、二氧化硫、没食子酸丙酯、对羟苯甲酸酯、乙基香草醛、甘油、苯酚、对氯苯酚、明胶和白蛋白。药学上可接受的赋形剂的深入讨论在remington'spharmaceuticalsciences(mackpub.co.,n.j.1991)中可获得。
本发明第四方面提供了一种用于在体细胞或人体内抑制hsv-1复制和/或靶标序列表达的方法,所述方法包括:以允许在细胞中递送和/或生成有效量的grna和/或cas9蛋白为前提,递送第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的组合物,使所述的crispr/cas9系统或组合物与人hbb突变基因相关的序列接近和/或接触。
术语“有效量”或“治疗有效量”指足以产生有益的或期望的生物和/或临床结果的量。治疗有效量将变化,这取决于化合物、制剂或组合物、疾病和其严重性以及年龄、体重、生理状态和待治疗受试者的反应性。用于向人或非人哺乳动物患者施用时,重组载体优选悬浮在药学上可接受的递送载体中(即生理上兼容的载体)。本领域技术人员很容易选择合适的载体,并且可以取决于所选择的施用途径。
本发明一实施例中,本发明提供了一种治疗受试者病毒感染的方法,其包括向受试者施用有效量的第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的组合物,以治疗病毒感染。
本发明一优选实施例中,施用有效量为降低在受试者中dna病毒的复制的数量。
本发明一优选实施例中,施用有效量为降低在受试者中靶标序列所编码的基因产物的表达的数量。
在其它因素中,合适的剂量(有效量)将取决于选择的载体的种类(例如血清型等)、施用的途径、待治疗的哺乳动物(例如人或非人灵长类或其它哺乳动物)、年龄、体重、性别和待治疗受试者的一般状态以及施用的模式。因此,患者间合适的剂量可以不同。本领域技术人员可以很容易确定合适的有效量。
剂量治疗可以是单剂量方案或多剂量方案。此外,可以向受试者施用合适的很多剂量。本领域技术人员很容易确定剂量的合适的数量。然而,考虑到可选的施用途径、或平衡治疗的益处和任何副作用,可能需要调整剂量。取决于所采用的重组载体的治疗应用,这种剂量可以变化。
以足够的量施用重组载体以进入期望的细胞,并保证经转移的核酸组合物的功能性的足够水平,以提供无不适当的不利的治疗益处,或者医学领域的技术人员可以确定的医学上可接受的生理效应。
在本发明实施方式中,术语“使所述的crispr/cas9系统或组合物与hsv-1的sa基因相关的序列接近和/或接触”是指将组分递送到体内离体(invitro)或(invivo)环境中,离体环境如本领域技术人员根据具体实验需求配置的反应溶液,体内环境比如细胞内;所述的术语“接近和/或接触”是指在离体(invitro)或体内(invivo)环境中,各组分可以与人hbb突变基因相关的序列接触,并在一定的条件下发生本领域技术人员可以预料的反应。
在本发明一实施方式中,本发明提供了以下方法,包括向体细胞或人体内递送一个或多个多核苷酸、一个或多个载体、一个或多个转录本、和/或一个或多个转录的蛋白。
在本发明一实施方式中,将与grna组合的crispr/cas9系统复合物递送至体细胞或人体内。可以使用常规的病毒和非病毒基的基因转移方法将第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的组合物引入人的体细胞或个体中。
可以使用这样的方法向细胞培养物或个体中的细胞给予第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的组合物。非病毒载体递送系统包括dna质粒、rna(例如在此描述的载体的转录本)、蛋白、裸核酸以及与递送赋形剂(如脂质体)复合的核酸。病毒载体递送系统包括dna和rna病毒,在被递送至细胞后它们具有游离型或整合型基因组。关于基因递送系统的综述,参见安德(anderson),《科学》(science)256:808-813(1992);纳贝尔(nabel)&费尔格纳(felgner),tibtech11:211-217(1993);三谷(mitani)&卡斯基(caskey),tibtech11:162-166(1993);狄龙(dillon),tibtech11:167-175(1993);米勒(miller),《自然》(nature)357:455-460(1992);范·布朗特(vanbrunt),《生物技术》(biotechnology)6(10):1149-1154(1988);维涅(vigne),《恢复神经学和神经科学》(restorativeneurologyandneurosciece)8:35-36(1995);克雷默(kremer)&佩里科德特(perricaudet),《英国医学公报》(britishmedicalbulletin)51(1):31-44(1995);哈嗒嗒(haddada)等人,在《微生物学和免疫学当前主题》(currenttopicsinmicrobiologyandimmunology)中多尔夫勒(doerfler)和博姆(编辑)(1995);以及余(yu)等人,《基因疗法》(genetherapy)1:13-26(1994)。
核酸的非病毒递送方法包括脂转染、核转染、显微注射、电转、基因枪、病毒颗粒、脂质体、免疫脂质体、聚阳离子或脂质:核酸共轭物、裸dna、人工病毒体以及dna的试剂增强性摄取。脂转染描述于例如美国专利号5,049,386、4,946,787和4,897,355中并且脂转染试剂是市售的(例如,transfectamtm和lipofectintm)。适于多核苷酸的有效的受体识别脂转染的阳离子和中性脂质包括felgner(费尔格纳),wo91/17424;wo91/16024的那些。递送可以针对细胞(例如体外或离体给予)或靶组织(例如体内给予)。
脂质:核酸复合物(包括靶向的脂质体,如免疫脂质复合物)的制备是本领域的技术人员熟知的(参见例如,克丽丝特尔(crystal),《科学》(science)270:404-410(1995);布莱泽(blaese)等人,《癌症基因疗法》(cancergenether.)2:291-297(1995);贝尔(behr)等人,《生物共轭化学》(bioconjugatechem.)5:382-389(1994);雷米(remy)等人,《生物共轭化学》5:647-654(1994);高(gao)等人,《基因疗法》(genetherapy)2:710-722(1995);艾哈迈德(ahmad)等人,《癌症研究》(cancerres.)52:4817-4820(1992);美国专利号4,186,183、4,217,344、4,235,871、4,261,975、4,485,054、4,501,728、4,774,085、4,837,028以及4,946,787)。
在本发明一优选实施方式中,先制备第一方面所述的grna、第二方面所述的crispr/cas9系统的真核表达载体、原核表达载体或者体外转录载体;然后将真核表达载体扩增,并制备无内毒素的转染级的真核表达载体(或将原核表达载体转入到大肠杆菌中诱导表达cas9蛋白),制备cas9蛋白的蛋白。还可以将cas9蛋白的编码dna克隆到包含t7或者sp6启动子的体外转录载体中,通过体外转录,制备cas9蛋白的mrna。
在本发明一优选实施方式中,制备第一方面所述的grna,可以直接合成grna,或者将grna的编码序列克隆到包含t7或sp6启动子的转录载体(如pdr274,来自addgene),或通过pcr、退火、合成等方式直接在grna对应的编码dna的前端加上t7或sp6启动子,再通过体外转录的方法制备grna;或者将所述的grna的编码序列克隆到真核表达载体pgem-t-u6-grna载体中,所述的pgem-t-u6-grna载体为通过pcr的方式从px330载体(addgene)上扩增u6启动子以及grna的骨架序列,将pcr产物通过ta克隆的方式连入到pgem-t载体(promega)中所制得。
在本发明一优选实施方式中,将第二方面所述的cas9蛋白的dna(转录mrna或者翻译的蛋白)与grna的表达载体(或者转录的grna,或者合成的grna)通过包括但不限于脂质体转染、病毒感染、电转和显微注射等方式导入到人的体细胞或人体中。
进一步地,所述病毒感染采用的病毒载体包括但不限定于逆转录病毒载体、慢病毒载体、腺病毒载体和腺病毒先关病毒载体等。
在本发明一实施方式中,细胞包括但不限定于骨髓细胞,造血干细胞(hsc),胚胎干细胞(esc),诱导多能性干细胞(ipsc)和造血祖细胞。
在本发明一实施方式中,细胞为293t细胞或vero细胞。
在本发明一实施方式中,所述的grna、crispr/cas9系统和/或组合物与细胞接近和/或接触后,发生如下效果中的一种或多种:
1)所述grna和cas9蛋白切割靶标序列;
2)grna的靶标序列所编码的基因产物的表达降低;
3)grna的靶标序列被改变;
4)所述hsv-1不能复制;
5)所述hsv-1从细胞中消除。
在本发明一实施方式中,递送两种或更多种grna,并且多于一种靶标序列被切割。
在本发明一实施方式中,所述的grna、crispr/cas9系统和/或组合物与细胞的接近和/或接触发生在体外或体内。
本发明第五方面提供了一种真核宿主细胞,包含第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的组合物。
本发明第六方面提供了一种试剂盒,包含第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的组合物、第五方面提供的真核宿主细胞中的一种或多种。
本发明一实施方式中,所述试剂盒还包括常规配套的反应试剂和/或反应设备。例如,试剂盒可以提供一种或多种反应或存储缓冲液。可以按在具体测定中可用的形式或按在使用之前需要添加一种或多种其他组分的形式(例如按浓缩或冻干形式)提供试剂。缓冲液可以是任何缓冲液,包括但不限于碳酸钠缓冲液、碳酸氢钠缓冲液、硼酸盐缓冲液、tris缓冲液、mops缓冲液、hepes缓冲液及其组合。在一些实施例中,该缓冲液是碱性的。在一些实施例中,该缓冲液具有从约7至约10的ph。在一些实施例中,该试剂盒包括一个或多个寡核苷酸,该一种或多种核酸包含至少一种如第一方面所述的grna序列。
本发明所述试剂盒中的各组分可以单独地或组合地提供,并且可以被提供于任何适合的容器中,如小瓶、瓶子、管或纸板。
本发明第七方面提供了一种如第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的组合物、第五方面提供的真核宿主细胞中的一种或多种、第六方面提供的一种试剂盒在预防、改善、和/或治疗hsv-1相关疾病中的应用。
在本发明一优选实施方式中,本发明第七方面提供了一种如第一方面提供的grna序列或crispr/cas9系统、第二方面提供的非天然存在的或工程化的组合物、第四方面提供的真核宿主细胞中的一种或多种、第五方面提供的一种试剂盒在抑制hsv-1复制和/或靶标序列表达中的应用。
本发明第八方面提供了一种如第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的非天然存在的或工程化的组合物、第五方面提供的真核宿主细胞按下述一种或多种方法进行应用:
1)将第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的非天然存在的或工程化的组合物、第五方面提供的真核宿主细胞单独进行应用;
2)将第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的非天然存在的或工程化的组合物、第五方面提供的真核宿主细胞与手术、生物治疗、免疫治疗中的一种或几种联合应用;
3)采用体内投递的方式将所述第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的非天然存在的或工程化的组合物、第五方面提供的真核宿主细胞直接投递到患者体内进行治疗;
4)先通过体外转染技术将第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的非天然存在的或工程化的组合物与宿主细胞混合,然后将含有第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的组合物的宿主细胞输回患者体内实施治疗;
5)将第五方面提供的真核宿主细胞输入患者体内实施治。
本发明第九方面提供了一种hsv-1疾病的治疗方法,包括:
1)将第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的非天然存在的或工程化的组合物、第五方面提供的真核宿主细胞单独对患者进行治疗;
2)将第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的非天然存在的或工程化的组合物、第五方面提供的真核宿主细胞与手术、生物治疗、免疫治疗中的一种或几种联合对患者进行治疗;
3)采用体内投递的方式将所述第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的非天然存在的或工程化的组合物、第五方面提供的真核宿主细胞直接投递到患者体内进行治疗;
4)先通过体外转染技术将第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的非天然存在的或工程化的组合物与宿主细胞混合,然后将含有第一方面所述的grna、第二方面所述的crispr/cas9系统或第三方面所述的组合物的宿主细胞输回患者体内实施治疗;
5)将第五方面提供的真核宿主细胞输入患者体内实施治疗。
有益效果:
在研究过程中,发明人经过大量的研究和探索发现,对于抑制hsv-1增殖和复制的grna序列和切割靶点需要慎重地选择和筛选。靶点和具体grna序列的不同,会导致抑制hsv-1的能力存在差异。本发明采用cas9crispr/cas9系统可有效抑制病毒复制、抑制来自病毒的靶标序列的表达、有应用于治疗病毒感染或病毒诱导的癌症。
hsv-1感染潜伏后往往难以根治,本发明提供了的从病毒基因组层面抑制hsv-1增殖和复制的手段,通过细胞模型我们发现:我们发明中提及的grna序列能有效抑制hsv-1增殖和复制,有希望被应用于临床治疗hsv-1感染。
特别地,在本发明一优选实施例中,本发明将靶向hsv-1的grna序列插入plenticrisprv2载体,通过向hek293t细胞系共转上述载体和慢病毒包装载体,生产、收集并浓缩即得到可抑制hsv-1复制和增殖的慢病毒。本发明经体外细胞模型验证该慢病毒对hsv-1的毒性有抑制作用,可抵抗hsv-1侵染和抑制hsv-1增殖。
附图说明
图1为本发明实施例提供的稳定表达cas9和grna细胞系rt-pcr检测cas9表达结果(1%琼脂糖凝胶,gelred染色),g1-g3:三条不同grna;
图2为本发明实施例提供的以moi=0.01hsv-1感染对应vero细胞后的细胞形态;
图3为本发明实施例提供的以tcid50法以野生型hsv-1感染对应vero细胞测得滴度,dpi表示感染后天数。
图4为本发明实施例提供的以荧光定量pcr法测定野生型hsv-1感染对应vero细胞后,培养基中hsv-1相对含量。
图5为本发明实施例提供的以对应vero细胞产生的次生hsv-1感染野生型vero细胞测得滴度。
具体实施方式
以下所述是本发明实施例的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明实施例原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明实施例的保护范围。
本公开不限于本文中阐述的重组慢病毒载体或其他成分的构建方法或步骤的具体细节。在公开的启示下,本领域技术人员将显而易见本文中公开的组合物和方法能够以不同的方式被制备、实践、使用、实施和/或形成。
本文所使用的措辞和术语仅用于描述的目的,不应被视为对权利要求的范围的限制。如在说明书中和权利要求中所使用的,指不同的结构或方法步骤的序数指示,比如第一、第二和第三,不应该被解释为指示任何具体的结构或步骤、或者这种结构或步骤的任何特定顺序或构型。
在本文中描述的所有方法可以以任何合适的顺序进行,除本文中另有指示,或者明显与上下文矛盾。本文中提供了使用的任何和全部实施例、或示例性语言(例如“比如”)仅旨在促进公开,并不意味着任何对本公开的范围的限制,除非另有要求。说明书中的语言以及附图中显示的结构不应理解为指示任何未要求的元件是实践本公开的主题所必需的。本文中所使用的术语“包括”、“包含”、或“具有”以及其变体指包括列于其后的元件或其等价物,以及额外的元件。实施方案中所述的如“包括”、“包含”、或“具有”某些元件还被理解为“基本上由那些某些元件组成”和“由那些某些元件组成”。
除非另有说明,本发明的实践采用免疫学、生物化学、化学、分子生物学、微生物学、细胞生物学、基因组学和重组dna的常规技术,这些在本领域的技能之内。参见萨姆布鲁克(sambrook)、弗里奇(fritsch)和马尼亚蒂斯(maniatis),《分子克隆:实验室手册》(molecularcloning:alaboratorymanual),第2次编辑(1989);《当代分子生物学实验手册》(currentprotocolsinmolecularbiology)(f.m.奥苏贝尔(f.m.ausubel)等人编辑,(1987));《酶学方法》(methodsinenzymology)系列(学术出版公司):《pcr2:实用方法》(pcr2:apracticalapproach)(m.j.麦克弗森(m.j.macpherson)、b.d.黑姆斯(b.d.hames)和g.r.泰勒(g.r.taylor)编辑(1995))、哈洛(harlow)和拉内(lane)编辑(1988)《抗体:实验室手册》(antibodies,alaboratorymanual),以及《动物细胞培养》(animalcellculture)(r.i.弗雷谢尼(r.i.freshney)编辑(1987))。
若无特别说明,除非特别说明,以下实施例所用试剂和材料均为市购。如下述实施例中所用的dmemhighglucose培养基购自thermo公司。胎牛血清购买自gibico公司。pei、polybrene购买自sigma公司。fastdigestesp3i、t4连接酶、t4pnk和fastap购买自thermo公司。pcrcleanup、凝胶回收试剂盒和质粒小提试剂盒均购买自qiagen公司。
本发明一具体实施方式中,本发明实施例提供了一种用于抑制hsv-1复制和/或靶标序列表达的grna、碱基编辑系统、方法、试剂盒及其应用。
本发明提供的用于抑制hsv-1复制和/或靶标序列表达的方法,采用了本发明提供的用于抑制hsv-1复制和/或靶标序列表达的grna、碱基编辑系统或试剂盒,所述方法包括但不限于如下步骤的一个或多个步骤:
一、设计grna:
1)从ncbi数据库上获取hsv-1基因组序列(humanherpesvirus1strain17,completegenome.nc_001806.2,gi:820945227),取icp0和icp4基因dna序列;
2)以步骤1)获取dna序列为靶标,
3)使用http://crispr.mit.edu/
和http://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-designgrna设计工具获得可能的grna
序列,取两种设计工具打分最高grna序列。
所设计的grna序列为:
icp0-1:gccccccctcgagaggacgg;(seqidno.1)
icp0-2:aggcggagtcgtcgtcatgg;(seqidno.2)
icp0-3:accagcttggcgttgcacag;(seqidno.3)
icp4-1:cggccctcatgtttgacccg;(seqidno.4)
icp4-2:gggggtcttcgcgcgcgtgg;(seqidno.5)
icp4-3:gaaggagctgctgttgcgcg。(seqidno.6)
二、构建重组质粒plv2hsv
(1)连接模版合成:
icp0-1:gccccccctcgagaggacgg;
icp0-2:aggcggagtcgtcgtcatgg;
icp0-3:accagcttggcgttgcacag;
icp4-1:cggccctcatgtttgacccg;
icp4-2:gggggtcttcgcgcgcgtgg;
icp4-3:gaaggagctgctgttgcgcg。
于广州艾基生物合成针对如上grna的引物:
fp:caccgnnnnnnnnnnnnnnnnnnnn(seqidno.8);
rp:caaannnnnnnnnnnnnnnnnnnn(seqidno.9)。
其中fp中的n为seqidno.1-6的序列,rp中的n为对应序列的反向互补序列。
(2)引物磷酸激酶处理和梯度退火:磷酸激酶处理参考thermopnk方案实行,其中fp和rp终浓度各0.5μm,梯度退火程序为:95℃5min,随后以-1℃/s进行梯度退火,终点温度25℃;梯度退火产物连接至经过esp3i酶切处理的plenticrisprv2载体上,得到重组质粒plv2hsv;
其中,所用plenticrisprv2载体为从addgene购买。
2、重组质粒plenticrisprv2的鉴定
为鉴定plenticrisprv2重组载体正确与否,我们对重组质粒plv2hsv进行测序鉴定。测序结果也表明退火模版序列被正确地克隆至plenticrisprv2载体。
在plenticrisprv2载体中,spcas9基因序列编码的氨基酸序列为seqidno.7所示:
mdkkysigldigtnsvgwavitdeykvpskkfkvlgntdrhsikknligallfdsgetaeatrlkrtarrrytrrknricylqeifsnemakvddsffhrleesflveedkkherhpifgnivdevayhekyptiyhlrkklvdstdkadlrliylalahmikfrghfliegdlnpdnsdvdklfiqlvqtynqlfeenpinasgvdakailsarlsksrrlenliaqlpgekknglfgnlialslgltpnfksnfdlaedaklqlskdtydddldnllaqigdqyadlflaaknlsdaillsdilrvnteitkaplsasmikrydehhqdltllkalvrqqlpekykeiffdqskngyagyidggasqeefykfikpilekmdgteellvklnredllrkqrtfdngsiphqihlgelhailrrqedfypflkdnrekiekiltfripyyvgplargnsrfawmtrkseetitpwnfeevvdkgasaqsfiermtnfdknlpnekvlpkhsllyeyftvyneltkvkyvtegmrkpaflsgeqkkaivdllfktnrkvtvkqlkedyfkkiecfdsveisgvedrfnaslgtyhdllkiikdkdfldneenediledivltltlfedremieerlktyahlfddkvmkqlkrrrytgwgrlsrklingirdkqsgktildflksdgfanrnfmqlihddsltfkediqkaqvsgqgdslhehianlagspaikkgilqtvkvvdelvkvmgrhkpeniviemarenqttqkgqknsrermkrieegikelgsqilkehpventqlqneklylyylqngrdmyvdqeldinrlsdydvdhivpqsflkddsidnkvltrsdknrgksdnvpseevvkkmknywrqllnaklitqrkfdnltkaergglseldkagfikrqlvetrqitkhvaqildsrmntkydendklirevkvitlksklvsdfrkdfqfykvreinnyhhahdaylnavvgtalikkypklesefvygdykvydvrkmiakseqeigkatakyffysnimnffkteitlangeirkrplietngetgeivwdkgrdfatvrkvlsmpqvnivkktevqtggfskesilpkrnsdkliarkkdwdpkkyggfdsptvaysvlvvakvekgkskklksvkellgitimerssfeknpidfleakgykevkkdliiklpkyslfelengrkrmlasagelqkgnelalpskyvnflylashyeklkgspedneqkqlfveqhkhyldeiieqisefskrviladanldkvlsaynkhrdkpireqaeniihlftltnlgapaafkyfdttidrkrytstkevldatlihqsitglyetridlsqlggdkrpaatkkagqakkkk。
3、cas9蛋白、grna稳定表达细胞系构建
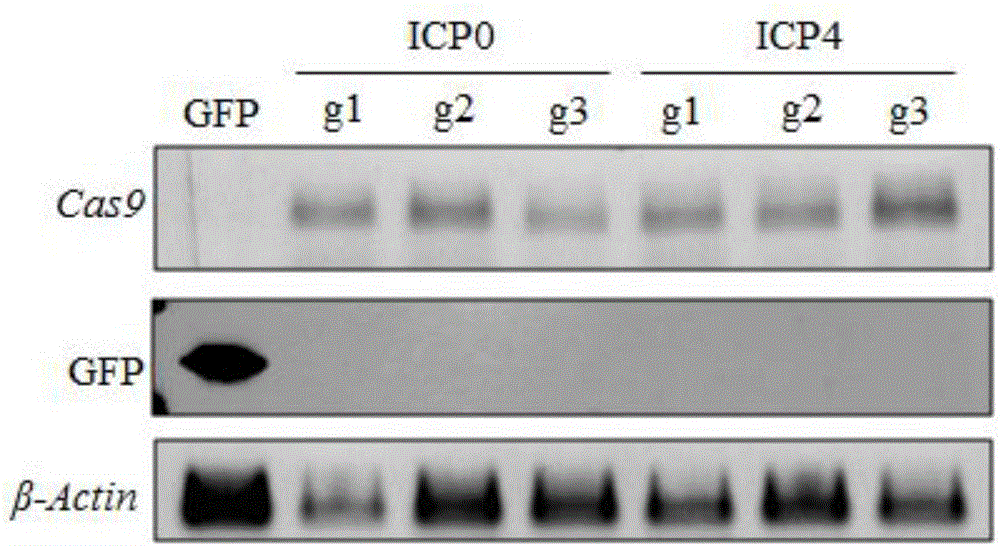
(1)将1.5μg步骤2中构建的重组plenticrisprv2、1.5μgpspax2、0.5μgpmd2.g和7.5μlpei于200μlopti-mem中,室温放置20min后加入到293t细胞培养基中,转染后6h换液成新鲜培养基。收集转染后48h的培养基,用0.45μm注射器过滤器除去细胞碎片。将过滤后病毒加入vero细胞中,并添加终浓度为8μg/ml的polybrene,培养24h。弃含病毒液培养基,添加新鲜的含有2.5μg/mlpuromycin的完全培养基,连续筛选3天,抗性细胞为稳定表达cas9蛋白、grna细胞。以westernblot和rt-pcr验证,可见cas9蛋白表达(图1)。
图1为本发明实施例提供的稳定表达cas9和grna细胞系rt-pcr检测cas9表达结果(1%琼脂糖凝胶,gelred染色),g1-g3:三条不同grna。
4、检测稳定表达细胞系对hsv-1抗性和对hsv-1增殖的影响
(1)检测稳定表达细胞系对hsv-1感染抗性
以tcid50方法梯度稀释病毒,将一系列稀释比的野生型hsv-1加入至对照和表达不同grna的vero细胞中,在这些细胞系中测定病毒滴度,对照组显示病毒实际滴度,实验组测量的病毒滴度变化,表示细胞对hsv-1敏感性发生改变。可见,稳定表达icp4-3的细胞对野生型hsv-1有最高的抗性,可抵御hsv-1侵染(图2、图3)。
图2为本发明实施例提供的以moi=0.01hsv-1感染对应vero细胞后的细胞形态;
图3为本发明实施例提供的以tcid50法以野生型hsv-1感染对应vero细胞测得滴度,dpi表示感染后天数。
(2)检测稳定表达细胞系对hsv-1增殖的影响
为探究表达icp4-3的细胞系对hsv-1增殖的影响,我们以moi=0.001的hsv-1侵染对照和实验组细胞3天。由于hsv-1在体外条件下是裂殖生长的,若病毒增殖,会继发感染其他细胞,并释放更多的病毒,因而在培养基上清中会产生越来越多病毒。通过荧光定量pcr的方法,我们可以测量培养基上清中hsv-1的含量,这反映了hsv-1的增殖能力。从我们的实验可见,稳定表达icp4-3的细胞可明显降低培养基中hsv-1的含量,因而其具有能抑制hsv-1增殖的能力(图4)。
图4为本发明实施例提供的以荧光定量pcr法测定野生型hsv-1感染对应vero细胞后,培养基中hsv-1相对含量。
(3)检测次生hsv-1对野生型细胞的侵袭能力
由于cas9和grna形成的复合体可对hsv-1基因组进行切割,因而很有可能该切割会进一步影响hsv-1的侵袭能力。我们以moi=0.01的野生型hsv-1分别侵染对照和实验组细胞,2天后收集培养基上清。此后通过野生型vero细胞以tcid50法分别测定这一系列培养基上清中hsv-1滴度。该指标指示继发产生的hsv-1对野生型细胞的侵袭能力。从我们实验可见,从表达icp4-3的细胞产生的次生hsv-1失去感染野生型细胞的能力(图5),因而icp4-3可抑制hsv-1继发感染。
图5为本发明实施例提供的以对应vero细胞产生的次生hsv-1感染野生型vero细胞测得滴度。
为进一步说明本发明技术效果,seqidno.1-5均按照icp4-3的步骤重复本发明实施例,效果如图2-4。在检测次生hsv-1对野生型细胞的侵袭能力方面,表达seqidno.1-5的细胞产生的次生hsv-1感染野生型细胞的能力均有受到不同程度的抑制,因而,seqidno.1-5亦可在一定程度上抑制hsv-1继发感染。
序列表
<110>中山大学
<120>用于抑制hsv-1复制和/或靶标序列表达的crispr/sacas9系统、方法、试剂盒及其应用
<130>2017
<160>7
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(人工合成)
<400>1
ggctgctggggccgcagggc20
<210>2
<211>20
<212>dna
<213>人工序列(人工合成)
<400>2
gatagtgggcgtgacgccca20
<210>3
<211>20
<212>dna
<213>人工序列(人工合成)
<400>3
cacgtccccggggaccacgc20
<210>4
<211>20
<212>dna
<213>人工序列(人工合成)
<400>4
caccccggacgcggaggcca20
<210>5
<211>1052
<212>prt
<213>人工序列(人工设计)
<400>5
lysargasntyrileleuglyleuaspileglyilethrservalgly
151015
tyrglyileileasptyrgluthrargaspvalileaspalaglyval
202530
argleuphelysglualaasnvalgluasnasngluglyargargser
354045
lysargglyalaargargleulysargargargarghisargilegln
505560
argvallyslysleuleupheasptyrasnleuleuthrasphisser
65707580
gluleuserglyileasnprotyrglualaargvallysglyleuser
859095
glnlysleuserglugluglupheseralaalaleuleuhisleuala
100105110
lysargargglyvalhisasnvalasngluvalglugluaspthrgly
115120125
asngluleuserthrlysgluglnileserargasnserlysalaleu
130135140
gluglulystyrvalalagluleuglnleugluargleulyslysasp
145150155160
glygluvalargglyserileasnargphelysthrserasptyrval
165170175
lysglualalysglnleuleulysvalglnlysalatyrhisglnleu
180185190
aspglnserpheileaspthrtyrileaspleuleugluthrargarg
195200205
thrtyrtyrgluglyproglygluglyserpropheglytrplysasp
210215220
ilelysglutrptyrglumetleumetglyhiscysthrtyrphepro
225230235240
glugluleuargservallystyralatyrasnalaaspleutyrasn
245250255
alaleuasnaspleuasnasnleuvalilethrargaspgluasnglu
260265270
lysleuglutyrtyrglulyspheglnileilegluasnvalphelys
275280285
glnlyslyslysprothrleulysglnilealalysgluileleuval
290295300
asnglugluaspilelysglytyrargvalthrserthrglylyspro
305310315320
gluphethrasnleulysvaltyrhisaspilelysaspilethrala
325330335
arglysgluileilegluasnalagluleuleuaspglnilealalys
340345350
ileleuthriletyrglnsersergluaspileglnglugluleuthr
355360365
asnleuasnsergluleuthrglnglugluilegluglnileserasn
370375380
leulysglytyrthrglythrhisasnleuserleulysalaileasn
385390395400
leuileleuaspgluleutrphisthrasnaspasnglnilealaile
405410415
pheasnargleulysleuvalprolyslysvalaspleuserglngln
420425430
lysgluileprothrthrleuvalaspasppheileleuserproval
435440445
vallysargserpheileglnserilelysvalileasnalaileile
450455460
lyslystyrglyleuproasnaspileileilegluleualaargglu
465470475480
lysasnserlysaspalaglnlysmetileasnglumetglnlysarg
485490495
asnargglnthrasngluargileglugluileileargthrthrgly
500505510
lysgluasnalalystyrleuileglulysilelysleuhisaspmet
515520525
glngluglylyscysleutyrserleuglualaileproleugluasp
530535540
leuleuasnasnpropheasntyrgluvalasphisileileproarg
545550555560
servalserpheaspasnserpheasnasnlysvalleuvallysgln
565570575
glugluasnserlyslysglyasnargthrpropheglntyrleuser
580585590
serseraspserlysilesertyrgluthrphelyslyshisileleu
595600605
asnleualalysglylysglyargileserlysthrlyslysglutyr
610615620
leuleuglugluargaspileasnargpheservalglnlysaspphe
625630635640
ileasnargasnleuvalaspthrargtyralathrargglyleumet
645650655
asnleuleuargsertyrpheargvalasnasnleuaspvallysval
660665670
lysserileasnglyglyphethrserpheleuargarglystrplys
675680685
phelyslysgluargasnlysglytyrlyshishisalagluaspala
690695700
leuileilealaasnalaasppheilephelysglutrplyslysleu
705710715720
asplysalalyslysvalmetgluasnglnmetphegluglulysgln
725730735
alaglusermetprogluilegluthrgluglnglutyrlysgluile
740745750
pheilethrprohisglnilelyshisilelysaspphelysasptyr
755760765
lystyrserhisargvalasplyslysproasnarggluleuileasn
770775780
aspthrleutyrserthrarglysaspasplysglyasnthrleuile
785790795800
valasnasnleuasnglyleutyrasplysaspasnasplysleulys
805810815
lysleuileasnlysserproglulysleuleumettyrhishisasp
820825830
proglnthrtyrglnlysleulysleuilemetgluglntyrglyasp
835840845
glulysasnproleutyrlystyrtyrglugluthrglyasntyrleu
850855860
thrlystyrserlyslysaspasnglyprovalilelyslysilelys
865870875880
tyrtyrglyasnlysleuasnalahisleuaspilethraspasptyr
885890895
proasnserargasnlysvalvallysleuserleulysprotyrarg
900905910
pheaspvaltyrleuaspasnglyvaltyrlysphevalthrvallys
915920925
asnleuaspvalilelyslysgluasntyrtyrgluvalasnserlys
930935940
cystyrgluglualalyslysleulyslysileserasnglnalaglu
945950955960
pheilealaserphetyrasnasnaspleuilelysileasnglyglu
965970975
leutyrargvalileglyvalasnasnaspleuleuasnargileglu
980985990
valasnmetileaspilethrtyrargglutyrleugluasnmetasn
99510001005
asplysargproproargileilelysthrilealaserlysthrgln
101010151020
serilelyslystyrserthraspileleuglyasnleutyrgluval
1025103010351040
lysserlyslyshisproglnileilelyslysgly
10451050
<210>6
<211>25
<212>dna
<213>人工序列(人工设计)
<220>
<221>misc_feature
<222>(6)..(25)
<223>nisa,c,g,ort
<400>6
caccgnnnnnnnnnnnnnnnnnnnn25
<210>7
<211>24
<212>dna
<213>人工序列(人工设计)
<220>
<221>misc_feature
<222>(5)..(24)
<223>nisa,c,g,ort
<400>7
caaannnnnnnnnnnnnnnnnnnn24
- 还没有人留言评论。精彩留言会获得点赞!