细胞联合培养的培养芯片及药物筛选装置的制作方法
本发明涉及细胞培养以及药物研发技术领域,尤其涉及一种细胞联合培养的培养芯片及药物筛选装置。
背景技术:
随着生物医药技术的蓬勃发展,在药物研发的初期都不可避免地使用细胞进行生理活动的研究和毒理学测试。如何模拟人体或其他生物体内系统之间、器官之间的相互作用,使体外的细胞培养能够尽可能地模拟体内的自然生理状态是药物研发、测试中的核心问题。
现有技术一般采用细胞混合培养,即将不同器官、组织等的细胞置于同一培养器皿中进行培养,以观察和检测细胞之间的相互作用,模拟生物体内的自然生理状态。但是,细胞一旦脱离组织、器官等有组织调控的系统后,将转化为相对独立的个体,不同种细胞之间将会出现接触抑制、处于原有生物体内的正常生理状态无法恢复或受到限制,代谢产物相互影响等不利情况。混合培养的技术手段还会出现药物直接作用于不同的细胞而不能模拟体内有一定次序的代谢过程、所产生的代谢产物相互影响等情况,使研究两种以上细胞的相互作用或者模拟药物对两种以上细胞在体内的代谢过程和产物等研究目的不能实现。
本发明基于上述技术问题以及现有技术的缺陷,有针对性地提出涉及细胞联合培养的培养芯片,还提出了能够模拟体内代谢过程的药物筛选装置。
技术实现要素:
本发明的目的在于提供一种能实现细胞联合培养的培养芯片,还在于提供一种能够模拟体内药物代谢的药物筛选装置。
为实现该目的,本发明采用如下技术方案:
一种细胞联合培养的培养芯片,包括相互对合以形成腔室结构的第一芯板和第二芯板。所述第一芯板和第二芯板上分别设有相互对应并且相对于对合面凹陷的极性培养槽和非极性培养槽。所述极性培养槽包括主通道和沿所述主通道两侧分布的槽腔。所述主通道还包括分别从该主通道的两个末端延伸出的第一接驳口,各个所述第一接驳口交错布置。任一所述非极性培养槽延伸出第二接驳口。所述培养芯片还包括从任一所述第一接驳口引出与至少一个所述非极性培养槽连通的腔间通道。
优选地,所述极性培养槽的槽底向所述对合面设置凸起的定位结构。所述第一芯板的极性培养槽和第二芯板的极性培养槽之间以所述定位结构夹持承托结构。
更优选地,所述承托结构由第一半透膜制成。
进一步优选地,所述第一半透膜的孔径为8μm。
更优选地,所述第一芯板的极性培养槽和第二芯板的极性培养槽基于所述对合面镜像对称。位于所述主通道同一末端方向的且不属于同一个芯板的两个所述第一接驳口交错布置。
进一步优选地,所述第一接驳口分别与所述主通道轴线形成夹角。
更进一步优选地,所述夹角为锐角,角度为30°。
更优选地,所述定位结构沿所述主通道两侧设置。
进一步优选地,所述定位结构延伸至靠近两端的所述第一接驳口。
优选地,所述腔间通道包括设置在所述第一芯板的前通道和设置在第二芯板上的后通道,所述前通道和后通道在交接处相互嵌套以进行接驳。
更优选地,所述前通道和后通道在交接处以第二半透膜分隔,所述第二半透膜的孔径为500μm。
进一步优选地,所述交接处靠近所述对合面。
优选地,所述第一芯板的非极性培养槽和第二芯板的非极性培养槽基于所述对合面镜像对称。
优选地,所述培养芯片采用3d打印技术、灌注揭模技术、光刻技术的至少一项制造而成。
优选地,所述培养芯片采用单晶硅、无定形硅、玻璃、石英、有机高分子聚合物的至少一种制成。
更优选地,所述培养芯片的采用聚二甲基硅氧烷制成。
一种药物筛选装置,包括细胞培养芯片、浓度控制芯片以及连通所述细胞培养芯片和浓度控制芯片的导管和微量注射泵,其中,所述细胞培养芯片采用上述任意一项所述的细胞联合培养的培养芯片。
优选地,所述浓度控制芯片包括第一进样口、第二进样口和分别由所述第一进样口和第二进样口引出的多级分流层,每级所述分流层包括以分流入口与上一级分流层连通的混合通道,以及以分流出口由所述混合通道引出的缓冲通道,所述缓冲通道与下一级的分流层的混合通道的分流入口连通。
更优选地,同一个所述混合通道上的分流入口和分流出口交错设置。
更优选地,同一个所述混合通道上的分流入口和分流出口等间距分布。
更优选地,同一个所述混合通道上分流入口比分流出口少一个。
更优选地,所述混合通道和缓冲通道的横截面直径相同。
进一步优选地,所述横截面直径为400μm。
更优选地,所述缓冲通道的形状为回折型、直线型、曲线型、之字型的任意一种。
更优选地,所述浓度控制芯片采用3d打印技术、灌注揭模技术、光刻技术的至少一项制造而成。和/或所述浓度控制芯片采用单晶硅、无定形硅、玻璃、石英、有机高分子聚合物的至少一种制成。
进一步优选地,所述浓度控制芯片的采用聚二甲基硅氧烷制成。
更优选地,所述细胞培养芯片的数量与所述浓度控制芯片最后一级分流层的分流出口的数量相同。
优选地,所述药物筛选装置还包括与所述细胞培养芯片连通的细胞悬液灌入器。
上述任意一项的所述药物筛选装置,在模拟口服药物代谢的研究中的应用。
上述任意一项的所述药物筛选装置,在两种及两种以上的细胞联合培养的研究中的应用。
与现有技术相比,本发明至少具有如下优点:
1.本发明所涉及的所述培养芯片,能够在体外模拟生物体内细胞、组织、器官的分布与代谢,在体外模拟生物体内细胞、组织、器官、环境之间的正常物质交换和相互作用;
2.本发明所涉及所述培养芯片,能够在细胞、组织、器官、环境之间存在物质交换的前提下,模拟不同功能的组织与器官之间的联系和影响,特别是有次序关系的联系和影响;
3.本发明所涉及所述培养芯片,能够用于研究不同的组织、器官、系统的细胞之间的代谢关系和经过细胞代谢后的产物;
4.本发明所涉及所述培养芯片,一方面能够利用极性培养室的结构使细胞产生的代谢产物能自由离开所述极性培养室而细胞将停留在所述极性培养室中;另一方面,所述极性培养室有利于辅助具有极性的细胞(如肠细胞)的极性恢复,使细胞生长代谢的情况更接近体内状态;
5.本发明所涉及的所述药物筛选装置,能够同时研究与检测多个不同浓度的药物分别作用于所述培养芯片中细胞的生理作用和毒理作用;
6.本发明所涉及的所述药物筛选装置,能够模拟体内实际细胞的分布与代谢,药物靶向影响特定细胞以形成一定方向的代谢,研究不同组织、器官、系统的细胞对于药物的响应;
7.本发明所涉及的所述药物筛选装置,能够模拟包括但不限于口服药物代谢的吸收和/或代谢途径;
8.本发明所涉及的所述药物筛选装置,能够节约实验资源,更高速高效地开展不同浓度、不同细胞组合的实验,有效推进实验进度。
附图说明
本发明上述的和/或附加的方面和优点从下面结合附图对实施例的描述中将变得明显和容易理解,其中:
图1为本发明一种细胞联合培养的培养芯片的结构示意图;
图2为图1所示本发明一种细胞联合培养的培养芯片覆膜后的结构示意图;
图3为图1所示本发明一种细胞联合培养的培养芯片的第一芯板结构示意图;
图4为图1所示本发明一种细胞联合培养的培养芯片的第二芯板结构示意图;
图5为图1所示本发明一种细胞联合培养的培养芯片的极性培养槽的剖视图;
图6本发明一种药物筛选装置的浓度控制芯片的结构示意图;
图7为图6所示本发明一种药物筛选装置的浓度控制芯片的a处局部放大图。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,仅用于解释本发明,而不能解释为对本发明的限制。
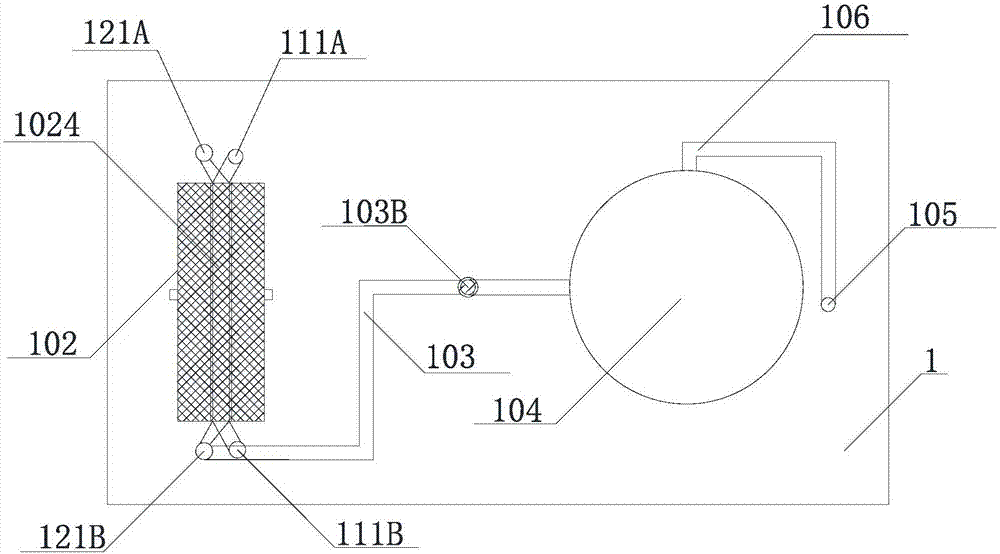
请参考附图1,本发明提供了一种细胞联合培养的培养芯片1。所述培养芯片1包括相互对合以形成极性培养腔102和非极性培养腔104等腔室结构的第一芯板11和第一芯板12。所述第一芯板11上设有相互对应并且相对于对合面13凹陷的极性培养槽112和极性培养槽122;所述第一芯板12设有相互对应并且相对于对合面13凹陷的非极性培养槽114和非极性培养槽124。位于所述第一芯板11的极性培养槽112和位于所述第二芯板12的极性培养槽122对合形成所述极性培养腔102;位于所述第一芯板11的非极性培养槽114和位于所述第二芯板12的非极性培养槽124对合形成所述非培养腔104。
由于所述第一芯板11和第二芯板12基于所述对合面13镜像对合,为缩减篇幅、便于描述,下文将以第一芯板11作为主要描述对象。
请具体参考图3,第一芯板11包括联接第一极性培养槽112的第一接驳口(接驳口111a和接驳口111b),所述接驳口联接第一极性培养槽112的主通道1121。所述主通道1121的两侧分别设置有定位结构,所述定位结构为从所述第一极性培养槽112的槽底向所述对合面13凸起的第一左壁112a和第一右壁112b,优选地,所述第一左壁112a和第一右壁112b的高度不超过所述对合面13。在本实施例中,所述第一左壁112a和第一右壁112b相夹形成的区域与所述主通道1121重合。所述第一左壁112a的左侧区域为第一左槽1122;所述第一右壁112b右侧区域为第一右槽1123。第一芯板11还包括延伸至第一非极性培养槽114的后通道113。仅在本实施例中,所述第一非极性培养槽114为圆形,在其他可能的实施方式中,第一非极性培养槽可为椭圆形、方形、半球形等形状;仅在本实施例中,由第一非极性培养槽114引出的所述后通道113布设于第一芯板11上,在其他可能的实施方式中,后通道既可以与所述第一非极性培养槽114布设在同一芯板上,也可以布设在不同的芯板上;可以由第一非极性培养槽114引出或从第二芯板上12的第二非极性培养槽引出。
请具体参考图4,与第一芯板11镜像对称的第二芯板12包括:与所述第一极性培养槽112沿对合面13镜像对称的第二极性培养槽122;与所述第一非极性培养槽114沿对合面13镜像对称的第二非极性培养槽124。其中所述第二极性培养槽122中:第二左槽1222与所述第一左槽镜像对称;第二左壁122a与所述第一左壁112a镜像对称;第二右壁122b与所述第一右壁112b镜像对称;第二右槽1223与所述第一右槽1123镜像对称。所述第二芯板还包括交错设置的第一接驳口(包括接驳口111a、接驳口111b、接驳口121a、接驳口121b),其中所述接驳口121a与接驳口111a形成夹角为α的v型结构,所述接驳口121b与所述接驳口111b形成夹角为γ的v型结构。仅在本实施例中,所述夹角α与夹角γ相等,在其他可能实施的方式中,夹角α与夹角γ可以不相等;仅在本实施例中,所述v型结构形成60°夹角,优选地,所述第一接驳口分别与所述主通道1121的轴线形成30°的锐角。所述接驳口121b联接所述第二极性培养槽122,并且由所述接驳口121b延伸出前通道123。仅在本实施例中,所述前通道123布设于第二芯板12,在其他可能的实施方式中,前通道既可以布设在同一芯板上,也可以布设在不同的芯板上,仅需保证所述前通道和后通道所组成的通道能够联通即可。仅在本实施例中,所述第二非极性培养槽124为圆形,在其他可能的实施方式中,第二非极性培养槽可为椭圆形、方形、半球形等形状,但其形状以能够与所述第一非极性培养槽配合形成非极性培养腔为准。
请具体参考图1和图2,所述第一芯片11与第二芯片12以对合面13对合形成所述培养芯片。所述第一极性培养槽112和第二极性培养槽122对合形成极性培养腔102;所述第一非极性培养槽114和第二非极性培养槽124对合形成非极性培养腔104;所述前通道113与所述后通道123在所述对合面13所在平面处嵌套接驳形成腔间通道103。仅在本实施例中,形成所述腔间通道103的所述前通道113由极性培养腔102引出,所述后通道123由非极性培养腔104引出,在其它可能的实施方式中,前通道与后通道以能联通极性培养腔和非极性培养腔为准,并不限制于本实施例所列举的联通方式。
更优选地,结合图2,所述前通道113与所述后通道123在对接面处以设置有用以隔绝如凋亡细胞、细胞碎片、过大沉淀物等杂质的间隔结构103a由第二半透膜组成,所述第二半透膜103a的孔径为500μm。
具体地结合图5,所述定位结构中,所述第一左壁112a与第二左壁122a对合形成左壁102a并夹持承托结构1024,所述第一右壁112b与第二右壁122b对合形成右壁102b并夹持所述承托结构1024。更具体地,所述承托结构1240由第一半透膜制成。进一步具体地,所述第一半透膜的孔径为8μm。仅在本实施例中,所述承托结构1024有采用孔径为8μm的聚碳酸酯膜。在本发明基本思路的指导下,承托结构可以选择其他材质如玻璃纤维膜、滤纸等无机有孔膜材料或如树脂膜、聚酯膜等有孔高分子有机膜材料。
所述主通道1121与主通道1221对合形成主通道1021;所述第一左槽1122与所述第二左槽1222对合形成左腔1022;所述第一右槽1123与第二右槽1223对合形成右腔1023。仅在本实施例中,所述左壁102a与右壁102b相夹所形成的区域与所述主通道1021重合。值得注意的是,在其他可能的实施方式中,所述供流体通行的主通道不限于由实体的定位结构限定形成,所述定位结构不限于直壁,可以为波浪壁、回折壁、凸点、凸台、齿状等其他定位形状或其他定位方式。
请参考图1,仅在本实施例中,所述非极性培养腔104延伸出第二接驳口105与外界联通。在其他可能的实施方式中,在设置有两个以上的非极性培养腔时,允许从任一非极性培养腔中引出接驳口用以与外界联通。更优选地,仅在本实施例中,所述非极性培养腔104延伸出通道106与所述第二接驳口105联接,通向外界。
具体优选地,请参考图1和图2,所述接驳口121a、接驳口111a、接驳口121b、接驳口111b分别与所述主通道1021纵向轴线所成锐角为30°。
具体地,所述培养芯片1的第一芯板11和第二芯板12采用单晶硅、无定形硅、玻璃、石英、有机高分子聚合物的至少一种材质,利用3d打印技术、灌注揭模技术、光刻技术的至少一项技术制造而成。具体到本实施例中,所述培养芯片1的第一芯板11和第二芯板12采用高分子聚合物利用灌注揭模技术制造。所述灌注揭模技术,即将流体物料灌入模具中,待物料固化后,将产品从模具脱离的一种方法。更具体地,所述培养芯片1采用聚二甲基硅氧烷制成。将所述培养芯片1第一芯板11和第一芯板12对合后需要密封处理,增强盖合后的稳定性和保证密封性。
本发明还提供一种药物筛选装置,包括培养芯片1、浓度控制芯片2(请具体参考图6)以及连通所述培养芯片1和浓度控制芯片2的导管(附图未出示)和微量注射泵(附图未出示),其中,所述培养芯片1采用上述用于的细胞联合培养的培养芯片1。仅在本具体实施例的药物筛选装置中,第一微量注射泵和第二微量注射泵的输出端接驳导管,导管的另一端联接至所述浓度控制芯片2的第一进样口21和第二进样口22。所述浓度控制芯片2的若干直通道24连接有导管联通外界。在其它可能的实施方式中,所述微量注射泵可以设置在所述浓度控制芯片2和培养芯片1之间并由导管连接。
具体地,请参考附图6,所述浓度控制芯片2包括第一进样口21、第二进样口22和分别由所述第一进样口21和第二进样口22引出的多级分流层23。具体地,本实施例中所述多级分流层23共有7层,每级所述分流层23包括若干分流入口231、分流出口232以及缓冲通道233、混合通道234。其中,仅以本实施例为例,在第一分流层23-1中的混合通道234上设置有:分别与第一进样口21和第二进样口22联接的两个分流入口231,混合通道234上还设置有三个分流出口232,任一所述分流出口232分别与缓冲通道233联接,所述第一分流层23-1设置有3条混合通道233分别与下一层分流层,即第二分流层23-2的分流入口231联接。所述第二分流层23-2设置有对应上一分流层——第一分流层23-1分流出口232或混合通道233数量的两个分流入口231。所述第二分流层23-2设置有比对应上一分流层——第一分流层23-1分流出口232或混合通道233数量增加至少一个,仅在本实施例中,第一分流层23-1分流出口232或混合通道233数量增加一个。在实际使用时,流体在所述微量注射泵的推动下,分别经由第一进样口21、第二进样口22并通过设置于第一分流层23-1的缓冲通道234上的分流入口231,在所述缓冲通道234中接触,流体进一步通过设置于缓冲通道234上的分流出口232离开缓冲通道234,进入混合通道233,并且在所述混合通道233中,在湍流的作用下混合成为均一流体,随后再混合通道233的引导下,经由下一层分流层的分流入口231进入下一分流层的缓冲通道234。经过数层稀释混合,最后经由最后一层分流层的直通道24排出所述浓度控制芯片2,在导管引导下,经由任一第一接驳口(接驳口111a、接驳口111b、接驳口121a、接驳口121b)进入所述培养芯片1中。
具体参考图6,所述第一进样口21和第二进样口22分别布置于所述缓冲通道的两轴向最远端。
更具体地,为更好地形成具有等差的浓度梯度,同一个所述缓冲通道234上的分流入口231和分流出口232交错设置。以第二分流层23-2为例,所述第二分流层23-2的缓冲通道234上布设有2个分流入口231和3个分流出口232,所述缓冲通道的轴向最远两端和最远两端之间分别开设分流出口232,在最靠近的任两个分流出口232之间的连线上开设一个分流入口231。因此,同一分流层或者说同一缓冲通道上的分流入口231与分流出口232交错排列。不限于所用于示例的第二分流层23-2,也不限于本实施例,在其他分流层23和其他可能实施的方式中,所述分流入口和分流出口的开设遵循交错布置的原则。
进一步具体地,为使所述浓度控制芯片2产生的浓度梯度之间的浓度差距相等,同一个所述缓冲通道234上的分流入口231和分流出口232等间距交错分布。详情参考图6,进一步以所述第二分流层23-1为例,在所述缓冲通道234上,任意两个相邻的所述分流入口231的距离与任意两个相邻的所述分流出口232的距离相等,3个所述分流出口232分别开设在缓冲通道234的两个端点和中点上,2个所述分流入口开设在任意两相邻的分流出口连线的中点上。对于分流入口231和分流出口232来说,所举例子体现的交错等距分布原则,不仅适用于第二分流层和本实施例其他分流层,还适用于其他可能实施的方式中。
更具体地,为使所述浓度控制芯片2产生的浓度梯度即流体浓度在缓冲通道中被稀释,同一个所述缓冲通道234上分流入口231比分流出口232少一个。
进一步具体地,为使所述控制芯片2产生的各个浓度之间产生等差变化,所述缓冲通道234和混合通道233的横截面直径相同。在本实施例中,所述缓冲通道234和混合通道233的横截面直径均选用400μm。在其他可能实施的方式中,根据流体的流速、粘度等可能影响流体形成浓度梯度的因素,选择其他横截面直径。
进一步具体地,为使所述混合通道233产生湍流以更好地混合流体,使流出所述分流出口232的流体成为均一的流体,所述混合通道233的形状可选回折型、直线型、曲线型、之字型的任意一种。仅在本实施例中,所述混合通道233采用之字型(或称s型)的混合通道。在不脱离本发明基本思路的前提下,技术人员还可以采用螺旋型等其他用以产生湍流、混合流体的其他形状。
更具体地,为适应所述浓度控制芯片2应用领域的仪器精密性和生物相容性、生物惰性、化学惰性等特点,所述浓度控制芯片2采用单晶硅、无定形硅、玻璃、石英、有机高分子聚合物的至少一种材质,利用3d打印技术、灌注揭模技术、光刻技术的至少一项制造而成。仅在本实施例中,所述浓度控制芯片2采用有机高分子聚合物并利用灌注揭模技术制造而成。进一步具体地,仅在本实施例,所述浓度控制芯片的采用聚二甲基硅氧烷制成。
具体地,出于利用率最大化的考虑,所述培养芯片1的数量与所述浓度控制芯片2最后一级分流层的分流出口232的数量相同。仅在本实施例中优选地,所述最后一级分流层的分流出口232接有便于导管联接的直通道24,经由所述导管与所述浓度控制芯片2分别联接。在不脱离本发明基本设计思路的前提下,可以采用少于所述浓度控制芯片2最后一级分流层的分流出口232的数量的所述培养芯片1,以节省耗材人力成本。
更具体地,所述药物筛选装置还包括与所述培养芯片1连通的细胞悬液灌入器(图中未出示)。仅在本实施例中,所述细胞悬液灌入器可以通过所述培养芯片1的第一接驳口(接驳口111a、接驳口121a、接驳口111b、接驳口121b)和/或所述第二接驳口105灌入细胞悬液。
上述任意一项的所述药物筛选装置,可以用于模拟口服药物代谢的研究中的应用。
上述任意一项的所述药物筛选装置,可以用于在两种及两种以上的细胞联合培养的研究中的应用。
具体地,利用所述培养芯片的培养方法,结合本实施例,具体为:
1)组装所述培养装置并对所述培养装置进行灭菌消毒处理;
2)在所述非极性培养腔104的非极性培养槽114和/或非极性培养槽124表面,即所述非极性培养腔104的表面,按照接种细胞浓度50μl/cm2的生长面积铺设细胞外基质,37℃下静置30min或以上;
3)采用所述细胞悬液灌入器将第一细胞悬液通过任一所述第一接驳口(接驳口111a、接驳口121a、接驳口111b、接驳口121b)接种于形成所述承托结构1240的聚碳酸酯膜上;
4)采用所述细胞悬液灌入器将第二细胞悬液通过所述第二接驳口105接种于所述已铺设细胞外基质的非极性培养腔104上;
5)接种细胞完成后,通过所述任一第一接驳口(接驳口111a、接驳口121a、接驳口111b、接驳口121b)通入培养基。仅在本实施例中,优选通过接驳口111a通入培养基;
对所述极性培养腔102与所述非极性培养腔104中已接种的第一细胞和第二细胞进行灌流式培养;
所述灌流式培养持续时间为2-3天,直至所述第一细胞和第二细胞恢复正常生理状态;
仅在本实施例中,优选地,所述第一细胞为肠细胞,所述第二细胞为肝细胞。具体地,所述细胞恢复正常生理状态时,所述肠细胞生长于形成所述承托结构1024的所述聚碳酸酯膜上,所述肝细胞贴壁生长于非极性培养腔104的内壁。
具体地,不限于本实施例的应用,所述培养基以dmem高糖型培养基作为基底,混合包括10%胎牛血清、100u/ml青霉素钠、0.085%氯化钠溶液溶解配置成100mg/ml的硫酸链霉素配制而成。
具体地,利用所述药物筛选装置的筛选方法,结合本实施例,具体为:
1)组装所述药物筛选装置,检查密封性,并对所述药物筛选装置进行灭菌或消毒处理;
2)在所述非极性培养腔104的非极性培养槽114和/或非极性培养槽124表面,即所述非极性培养腔104的表面,按照接种细胞浓度50μl/cm2的生长面积铺设细胞外基质,37℃下静置30min或以上;
3)采用所述细胞悬液灌入器将第一细胞悬液通过任一所述第一接驳口(接驳口111a、接驳口121a、接驳口111b、接驳口121b)接种于形成所述承托结构1240的聚碳酸酯膜上;
4)采用所述细胞悬液灌入器将第二细胞悬液通过所述第二接驳口105接种于所述已铺设细胞外基质的非极性培养腔104上;
5)接种细胞完成后,通过所述任一第一接驳口(接驳口111a、接驳口121a、接驳口111b、接驳口121b)通入所述培养基。仅在本实施例中,优选通过接驳口111a通入所述培养基;
对所述极性培养腔102与所述非极性培养腔104中已接种的第一细胞和第二细胞进行灌流式培养;
所述灌流式培养持续时间为2-3天,直至所述第一细胞和第二细胞恢复正常生理状态;
6)待细胞恢复正常生理状态2天后,将第二进样口22通入培养基的导管切换为通入药液的导管,所述第二进样口22通入药液,药液经由所述浓度控制芯片2形成等浓度差的含药培养基,所述含药培养基经由的任一所述第一接驳口(接驳口111a、接驳口121a、接驳口111b、接驳口121b)灌入所述培养芯片1。如附图6所示,经由直通道24引出的含药培养基,其浓度从左侧向右侧呈现药液浓度上升的等浓度梯度分布;
7)分别收集经由各个第二接驳口105排出的流体,保藏备用;
8)经过所述含药培养基流动式或非流动式培养48h-72h后,通过测定细胞活率的测试盒或者其他测试方法测定细胞活率。
值得注意的是,仅在本实施例中,药液经由第二进样口22进入所述浓度控制芯片2。在其它可能的实施方式中,可以选择由第一进样口21导入药液,其效果是产生的浓度梯度方向有所不同,请参考附图6,若从第一进样口21倒入药液,则从直通道24排出的含药培养基的药液浓度将从左侧向右侧呈现下降的等浓度梯度。
仅在本实施例中,含药培养基的培养时间为48h-72h,在其他可能的实施方式中,培养时间可以根据培养细胞、作用时间等其他实验条件做出调整,适当地缩短或者延长。
仅在本实施例中,测定细胞活率的试剂盒可以选择cck-8测定细胞活率试剂盒,在其它可能的实施方式中,可以选择其他的试剂盒或者其他测定的手段,测定细胞活率。
本发明所提供的所述培养芯片1配合实施例中的培养方法能够克服现有技术的单纯混合培养时细胞之间相互干扰抑制的缺陷,本发明所提供的所述培养芯片1采用的联合培养方案,能够模拟人体内不同系统之间的相互作用,在体外模拟体内实际细胞分布与代谢,特别是不同功能的组织与器官之间的联系与影响,能够用以研究不同组织与器官的细胞之间代谢产物有次序的影响,形成类似于人体系统的代谢产物流动方向。本发明提供的所述培养芯片所起的作用包括但不限于如实施例中实现的肝肠细胞联合培养所产生的肠细胞代谢物对于肝细胞影响的研究,基于实验装置的功能,还可以用于模拟其他的不同细胞代谢途径,不同器官、组织的细胞之间对于某些物质的响应。
本发明所提供的所述药物筛选装置结合实施例中的筛选方法,能够克服现有技术的缺陷,准确模拟体内实际细胞分布与代谢,药物靶向影响特定细胞以形成一定方向的代谢,进一步研究人体自然生理状态下,不同种细胞之间对于药物的响应。同时避免了动物实验的种属差异和高昂成本,节约实验时间。本发明所述药物筛选装置,还能提供不同的浓度梯度控制,能够产生不同的浓度梯度,以研究不同浓度的药物对于细胞的影响,本发明能够使研究浓度的实验批量地试验,节约实验资源,更高速有效。本发明提供的所述药物筛选装置所起的作用包括但不限于如实施例中实现的肝肠细胞联合培养的药物筛选所模拟的口服药物代谢,基于实验装置的功能,还可以用于模拟其他的药物代谢途径、其他的药物吸收途径,其他的吸收-代谢途径,不同器官、组织之间对于药物的响应。
值得注意的是,所述培养芯片可以培养多种不同细胞的组合,并不限于实施例所选择的两种细胞,其布置次序根据实验内容,在不偏离本发明原理的前提下,可作其他选择。所述药物包括一般意义的药物,也包括化学意义上的广义的药剂,即凡会对细胞产生影响的物质,均可利用本发明的药物筛选装置进行研究。
以上所述仅是本发明的部分实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!