新的单克隆抗体以及D二聚体的免疫学测定方法与流程
本申请是原案申请日为2011年3月31日、原案申请号201180017910.5
(国际申请号为pct/jp2011/058286)、发明名称为“新的单克隆抗体以及d二聚体的免疫学测定方法”的专利申请的分案申请。
本发明涉及用于准确测定稳定化血纤蛋白(特别是人稳定化血纤蛋白)的纤溶酶分解产物(d二聚体)的新的单克隆抗体以及使用该单克隆抗体的免疫学分析方法。
本说明书中的术语“分析”包括判定分析对象物质是否存在的“检测”和对分析对象物质的量或活性进行定量或半定量确定的“测定”。
背景技术:
稳定化血纤蛋白的各种蛋白酶分解产物作为临床诊断方法中的诊断标记物有用。例如如图1所示,稳定化血纤蛋白(交联血纤蛋白(cross-linkedfibrin))的纤溶酶分解产物(作为别称,例如可总称为“d二聚体”、“d-d二聚体”、“dd/e复合物”、“xdp”)、即,基本单元dd/e单体及其聚合物(dd/e聚合物,例如dxd/yy、yxy/dxxd、dxxy/yxxd)作为弥散性血管内凝血综合征(dic)的诊断标记物而被广泛使用。
另外,各种蛋白酶也可以分解存在于血液中的血纤蛋白原,例如,通过纤溶酶生成包含d二聚体的构成要素—d结构域、e结构域的片段x、片段y、片段d1、片段e3等血纤蛋白原分解产物(可总称为fgdp)。
因此,血栓形成患者的血液中可混合存在由于蛋白酶使稳定化血纤蛋白分解而生成的d二聚体、和由于蛋白酶使血纤蛋白原分解而生成的血纤蛋白原分解产物(fgdp)。可将此两者总称为fdp(以上参照图1)。
另外,以往认为血栓形成患者血浆中的d二聚体是分子量约23万的dd/e组分为主成分,但近年来实际了解到:dxd/yy组分、yxy/dxxd组分、dxxy/yxxd组分等的更高分子量的多聚体为主成分(参照非专利文献1)。
近年来,因血栓形成和/或栓塞死亡的基础疾病显示增加倾向,用于检测血栓形成的临床检查日益进步。最初是将使用血纤蛋白原(fbg)的多克隆抗体来测定血清中血纤蛋白/血纤蛋白原分解产物的fdp测定用于诊断,但在进行脱血纤蛋白原处理时,该操作仍不足够,所以存在显示假高值的问题。
后来,为了解决该问题,人们寻求与fdp的测定平行、不与血纤蛋白原反应、而只测定作为dd/e复合物的稳定化血纤蛋白分解产物(d二聚体)的d二聚体试剂。
例如,d二聚体的测定方法已知有将识别d二聚体的单克隆抗体固定于胶乳颗粒、塑料板等固相上,基于与d二聚体结合的抗原抗体反应的方法,即胶乳凝集法或elisa法等(专利文献1)。
但是,在基于抗原抗体反应的方法中,目前所使用的与固相结合的单克隆抗体与d二聚体具有反应性,同时对于与d二聚体具有类似结构的片段x和/或片段y和/或片段d1和/或片段e3也可能具有反应性。如果使用上述单克隆抗体,则与固相结合的单克隆抗体在测定时也与d二聚体以外的片段结合,可能无法准确测定。
另外,人们也公开了用于解决上述问题的以下的方法。但是,以下试剂中所使用的单克隆抗体仍不能说是d二聚体特异性的。例如专利文献2中报道了一种d二聚体测定试剂,该d二聚体测定试剂与dd/e组分的多聚体和dd/e组分的单体反应,但不与x组分、y组分、d组分、e组分反应,并且对于dd/e组分的四聚体的反应性至少具有10%的对于dd/e组分的反应性。但是专利文献2中具体给出的dd-m1653(保藏号fermp-19687号)在专利文献3中已经明确是与dd/e组分的多聚体和dd/e组分的单体以及x组分和y组分反应,但不与d组分和e组分反应,仍不能说是d二聚体特异性的。
另外,专利文献2中并未显示可特异性且准确地测定检样中的d二聚体。专利文献3公开:即使使用上述对d二聚体反应特异性较低的单克隆抗体,通过将含有对d二聚体具有反应性的单克隆抗体的液状试剂、与固定有对d二聚体具有反应性的单克隆抗体的载体或含有该载体的溶液组合而成的d二聚体测定用试剂盒,可更为准确地测定实际的d二聚体的量,但仍无法简便、特异性且准确地测定检样中的d二聚体。
近年来,由于医学的进步、治疗和治疗药物的进步,例如对血栓形成患者等的治疗使用了溶栓剂,如上所述,以被认为在生理环境下不会发生的状态发生纤溶,这样就无法忽视含有片段d的血纤蛋白原分解产物的存在。因此,专利文献4中公开:在检样中存在片段d时,片段d会干扰胶乳凝集反应,使原本的凝集受到抑制,为了避免获得比原本的值更低的值的结果,是预先人为地使过量的片段d共存,以不受来自检样的不确定的片段d的影响,由此可以准确测定d二聚体。但是,只通过1种抗体的反应特异性并不能特异性且准确地测定检样中的d二聚体。
如上所述,人们需求稳定化血纤蛋白分解产物(d二聚体)特异性的d二聚体试剂,但是,使用1种单克隆抗体、可特异性且准确地测定d二聚体的抗体或含有该抗体的试剂尚未见报道。
并且,目前的主流是使用血浆检样测定fdp、d二聚体,但也偶有fdp和d二聚体显示假高值的问题。非专利文献2中显示,由于采集患者血浆时的操作技术使得凝固、纤溶亢进,可能显示fdp、d二聚体为伪高值。
现有技术文献
专利文献
专利文献1:日本特开昭63-79900号公报
专利文献2:日本特开2006-105633公报
专利文献3:日本特开2006-234676公报
专利文献4:日本特开2001-21557公报
非专利文献
非专利文献1:charlesw.francis,victorj.marder和granth.barlow;plasmicdegradationofcrosslinkedfibrin:characterizationofnewmacromolecularsolublecomplexesandamodeloftheirstructure(交联血纤蛋白的降解:新的大分子可溶性复合物及其结构模型的表征).j.clin.invest.(1980)66(5):1033~1043.
非专利文献2:高田章美、前川芳明、山本庆和、松尾收二;血漿検体を用いて測定したfdpおよびdダイマー偽高値の原因(使用血浆检样测定的fdp及d二聚体假高值的原因).jjcla.(2005)30(5):721-726。
技术实现要素:
发明所要解决的课题
本发明鉴于上述问题而完成,其目的在于:通过使用至少1种不受存在于检样中的血纤蛋白原及其分解产物—片段x、片段y、片段d1和片段e3的影响、且不与使dd/e单体解离而成的片段dd、以及片段e1和片段e2反应的抗体,提供可特异性且准确地测定稳定化血纤蛋白分解产物(d二聚体)的方法和测定试剂。
用于解决课题的手段
本发明人针对上述现状进行了深入的研究,结果发现:通过使用至少1种不与存在于检样中的血纤蛋白原及其分解产物—片段x、片段y、片段d1和片段e3、和使dd/e单体解离而成的片段dd、以及片段e1和片段e2反应的抗体,则不会与d二聚体以外的分子反应,不会显示比实际的d二聚体值低的值或假高值。根据该认识,本发明完成了特异性且准确地测定稳定化血纤蛋白分解产物(d二聚体)的方法以及测定试剂。
因此,本发明涉及
[1]抗d二聚体抗体,其特征在于:与稳定化血纤蛋白的纤溶酶分解产物d二聚体特异性反应,但不与血纤蛋白原及其纤溶酶分解产物片段x、片段y、片段d1和片段e3、和使dd/e单体解离而成的片段dd以及片段e1和片段e2反应。
[2][1]的抗体的片段;
[3]杂交瘤,该杂交瘤生成[1]的抗体。
[4]免疫学测定生物体试样中的d二聚体的方法,该方法是使用[1]的抗体或[2]的抗体片段。
[5]d二聚体的免疫学测定试剂,该试剂含有[1]的抗体或[2]的抗体片段。
发明效果
通过使用本发明的抗体,即使在纤溶强烈亢进、推测大量存在血纤蛋白原分解产物(fgdp)的检样中,也可以特异性且准确地测定稳定化血纤蛋白分解产物(d二聚体)。另外,在使用本发明的抗体制备的胶乳试剂中,可以避免dd/e单体对胶乳反应的抑制,可进行更准确的稳定化血纤蛋白分解产物(d二聚体)的测定。
通过本发明的抗体,可以特异性地只测定由于疾病引起的纤溶亢进所形成的d二聚体,因此,可以避免可能人为生成的分子(例如dd/e单体解离形成的dd、后述实施例7所示的改性的d二聚体等)的影响。
附图说明
[图1]是模式表示血纤蛋白原的纤溶酶分解产物(fgdp)和稳定化血纤蛋白的纤溶酶分解产物(d二聚体)的结构的说明图。
[图2]是在使用各种抗d二聚体抗体的胶乳凝集法中,表示存在于检样中的dd/e单体的影响的图表。
[图3]是在使用各种抗d二聚体抗体的胶乳凝集法中,表示存在于检样中的片段d1影响的图表。
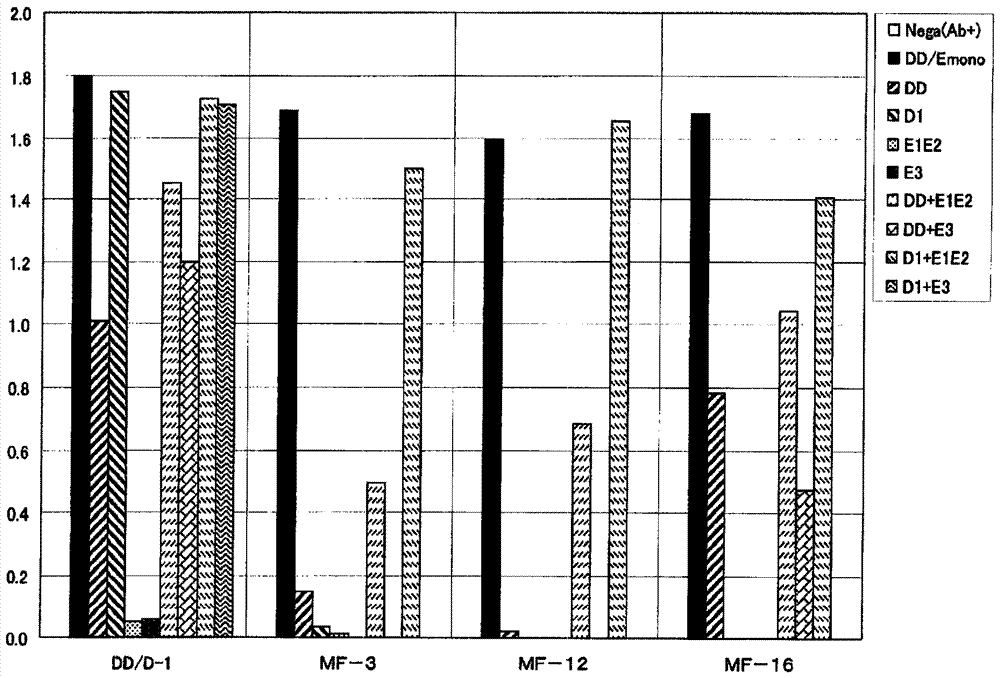
[图4]是在使用各种抗d二聚体抗体的elisa法中,表示与dd/e单体或其各构成片段、血纤蛋白原分解产物(fgdp)—片段d1或片段e3、或这些片段的混合物的反应性的图表。
[图5]是在使用各抗d二聚体抗体的胶乳凝集法中,表示存在于检样中的dd/e单体的影响的图表。
[图6]是在使用各种抗d二聚体抗体的胶乳凝集法中,表示存在于检样中的片段d1的影响的图表。
[图7]是在使用本发明的抗d二聚体抗体的胶乳试剂、和以往的市售d二聚体试剂中,表示存在于检样中的片段d1的影响的图表。
[图8]是将冷冻溶解的血浆检样用本发明的抗体(比较是使用以往的抗体)进行吸收操作,将所得的上清(s)、抗体结合物(b)[对照使用未处理血浆(p)]进行电泳,表示蛋白质印迹(用抗fbg抗体检测)的结果的图像。
具体实施方式
对于本发明的特异性测定d二聚体(包含dd/e单体和dd/e聚合物)的方法,可通过至少不与血纤蛋白原及其纤溶酶分解产物片段x、片段y、片段d1、片段e3、和使dd/e单体解离而成的片段dd、以及片段e1和片段e2反应,只与d二聚体特异性反应的抗体实施。
(1)抗体
本发明的抗体可通过公知的方法获得。只要具有上述反应性,可以是单克隆抗体(moab),也可以是多克隆抗体(poab),优选单克隆抗体。抗体并不限于来自小鼠,还可例举:大鼠、仓鼠、兔、山羊、马等,优选小鼠。抗体并不限于igg,还可以是igm、iga、ige、igd等。
本发明的抗体例如可通过将生成所需moab的杂交瘤在培养基或哺乳动物的腹腔内培养来制造。这里所使用的杂交瘤通常可按照kohler和milstein的细胞融合的基本方法[参照nature,256,495(1975)],使免疫了d二聚体的小鼠的脾细胞与小鼠骨髓瘤细胞进行细胞融合获得。
培养上述杂交瘤的培养基只要是适合杂交瘤培养的培养基即可,优选使用erdf(极东制药制造)中含有牛血清(gibco制造)、d-葡萄糖(和光纯药制造)、碳酸氢钠(和光纯药制造)、培养基添加剂rd-1(极东制药制造)的培养基。
上述杂交瘤的培养在培养基中进行时,可在5%二氧化碳浓度且37℃的条件下进行约3天。在小鼠的腹腔内培养时,可以进行约14天。
可以按照蛋白质的分离和纯化中常规使用的方法,由上述得到的培养液或哺乳动物的腹水中分离和纯化上述单克隆抗体。上述方法可举出:硫酸铵盐析、使用离子交换纤维素的离子交换柱层析、使用分子筛凝胶的分子筛柱层析、使用结合a蛋白的多糖类的亲和柱层析、透析、冷冻干燥等。
作为本发明的抗体片段、即本发明moab的片段、含有与d二聚体特异性反应的抗原结合部位的抗体片段中例如含有fab、fab’、f(ab’)2或fv等。这些片段例如可通过常规方法、用蛋白质分解酶对本发明的单克隆抗体进行消化,接着,按照蛋白质的分离、纯化的常规方法获得。
用于制作本发明的抗体的抗原例如可使用dd/e单体或dd/e聚合物。dd/e聚合物可举出2-5聚体,如果为6聚体以上则难以溶于水。该抗原还可按照公知的方法,由血纤蛋白原制备。还可以由人等纯化获得,还可以通过基因工程的方法获得。并且可使用市售商品。
对于本发明的抗体,可通过确认所制作的抗体至少不与血纤蛋白原及其纤溶酶分解产物—片段x、片段y、片段d1、片段e3、和使dd/e单体解离而成的片段dd、以及片段e1和片段e2反应,只与d二聚体特异性反应来获得。上述确认方法可采用实施例所示的公知的免疫学测定方法。
并且认为,d二聚体根据为dd/e单体或为dd/e聚合物,其分子大小或结构不同,因此,由于空间位阻等会对抗体的反应性有影响。因此,d二聚体的各分子种类的存在比例对于测定值是否有影响,这例如可如实施例所示,通过对一定量的dd/e聚合物添加各种量的dd/e单体来确认。
(2)测定方法和试剂
本发明的测定方法和试剂可通过至少不与血纤蛋白原及其纤溶酶分解产物—片段x、片段y、片段d1、片段e3、和使dd/e单体解离而成的片段dd、以及片段e1和片段e2反应,只与d二聚体特异性反应的抗体来实施。
另外,本发明的抗体即使单独使用也可以特异性且准确地测定d二聚体,但还可以将多种抗体例如识别部位不同的抗体适当组合使用。
本发明的测定方法除了使用本发明抗体之外,还可以使用公知的免疫学测定方法。具体来说,可举出免疫比浊法(tia)、酶免疫测定法(eia)、放射免疫测定法(ria)、胶乳凝集反应法、荧光免疫测定法、免疫色谱法等。对于本发明的抗体,也可以利用将2种以上本发明的抗体与除此以外的与d二聚体反应的抗体组合使用的上述免疫学测定方法,不过,只用本发明的抗体也可以特异性测定d二聚体,因此可以将2种以上本发明的抗体组合使用,更优选可利用只使用1种本发明的抗体的该免疫学的测定方法。
使用不溶性载体的免疫学凝集法更具体如下记述。
根据原理,如果该免疫学凝集法含有非特异性反应的抗体,则容易发生非特异性凝集,不能进行准确的测定,因此,优选只利用本发明的抗体。
不溶性载体可举出:有机高分子颗粒、无机物颗粒、红细胞等。有机高分子颗粒例如可举出:不溶性琼脂糖、不溶性葡聚糖、纤维素、胶乳颗粒。可优选举出胶乳颗粒,可举出:聚苯乙烯、苯乙烯/甲基丙烯酸共聚物、苯乙烯/(甲基)丙烯酸缩水甘油基酯共聚物、苯乙烯/苯乙烯磺酸盐共聚物、甲基丙烯酸聚合物、丙烯酸聚合物、丙烯腈丁二烯苯乙烯共聚物、氯乙烯/丙烯酸酯共聚物、聚乙酸乙烯基酯丙烯酸酯等颗粒。无机物颗粒可举出:二氧化硅、氧化铝等。颗粒的平均粒径可根据测定仪器等适当选择,可举出0.05-0.50μm。
将抗体担载于不溶性载体上的方法有物理吸附法和化学结合法,从担载操作简便性考虑,优选使用物理吸附法。
可适当添加缓冲液、增敏剂、表面活性剂、无机盐。缓冲液优选在ph5-10、特别是ph6-9下具有缓冲作用,可举出:磷酸缓冲液、tris缓冲液、咪唑缓冲液、三乙醇胺•盐酸、good缓冲液等,good缓冲液可举出:mes缓冲液、bis-tris缓冲液、ada缓冲液、pipes缓冲液、bis-tris-丙烷缓冲液、aces缓冲液、mops缓冲液、bes缓冲液、tes缓冲液、hepes缓冲液、hepps缓冲液、tricine缓冲液、bicine缓冲液、taps缓冲液。
为了促进凝集速度等,可添加增敏剂。增敏剂没有特别限定,可举出:聚乙烯基吡咯烷酮、聚阴离子、聚乙二醇、多糖类等。
表面活性剂可举出非离子性表面活性剂、阴离子性表面活性剂、阳离子性表面活性剂、两性表面活性剂。
为了抑制检样中盐浓度的影响等,可以添加无机盐。无机盐可举出:氯化钠、氯化钙等。
测定检样中的d二聚体浓度时,测定试剂除了含有第1试剂和第2试剂的双试剂体系的试剂形态之外,也可以是含有一种试剂的试剂形态。从测定精度的观点等考虑,优选含有第1试剂和第2试剂的双试剂体系,以下例举。
第1试剂含有缓冲液,第2试剂含有抗体致敏胶乳颗粒,可适当添加增敏剂、表面活性剂、无机盐等。优选的例子可举出:第1试剂含有缓冲液、增敏剂和无机盐,第2试剂为含有抗体致敏胶乳颗粒的试剂。
使用上述测定试剂测定时,可采用将第1试剂和检样在反应池中混合,然后添加第2试剂,光学测定抗体致敏胶乳颗粒的凝集程度的方法;或者是将第1试剂和第2试剂在反应池中混合,然后添加检样,光学测定抗体致敏胶乳颗粒的凝集程度的方法等。
可用本发明进行分析的检样例如可举出:液体生物体试样,例如血液、血浆、血清或尿液等。
例如使用上述例举形式的试剂进行凝集反应,分别光学观察已知浓度的d二聚体溶液和检样分别发生的凝集程度,进行比较,由此可测定检样中的d二聚体浓度。具体来说,首先测定两个浓度(优选包含d二聚体浓度为0μg/ml的溶液)以上的已知浓度的d二聚体溶液,由所得光学密度变化量和d二聚体浓度的关系制作校正曲线。接着,测定检样,利用校正曲线、由其光学密度变化量求出浓度,以该值作为d二聚体浓度。光学检测抗体致敏胶乳颗粒的凝集程度的方法中,测定是用测定散射光强度、吸光度或透射光强度的光学仪器进行。测定波长可由300-2400nm、优选300-1000nm、更优选300-800nm的范围选择适当的波长。测定方法是按照公知的方法,通过所使用的抗体致敏胶乳颗粒的大小或浓度选择、反应时间的设定来测定散射光强度、吸光度或透射光强度的增加或减少来进行。也可以将这些方法结合使用。
免疫反应的条件可采用公知的条件,反应时的温度为10-50℃,特别优选20-40℃。可适当确定反应时间。
实施例
以下通过实施例具体说明本发明,但它们并不限定本发明的范围。
《实施例1:抗原和各种分子的制备》
(1)d二聚体的制备
d二聚体的制备主要是按照stephaniea.olexa和andreiz.budzynski的方法(1978)、circulation,suppl.58,119,olexa等人的方法(1979)、以及biochim.biophys.acta576,39-50进行。在人血纤蛋白原(enzymeresearchlaboratories制造)中加入牛凝血酶(持田制药制造)和氯化钙,在37℃下反应2小时,使血纤蛋白原变成血纤蛋白。将其离心,从非凝固性物质中分离血纤蛋白。将血纤蛋白悬浮于含有氯化钙的tris盐酸缓冲液ph7.8中。在37℃环境下,在悬浮液中添加人纤溶酶(chromogenix制造)。加入抑酶肽,使分解反应终止,然后过赖氨酸琼脂糖柱,除去纤溶酶。该通过液为分子量不同的d二聚体的混合物。
接着,通过用含有氯化钙的tris盐酸缓冲液ph7.5(溶液a)展开的分子筛色谱,将之前所得的通过液用溶液a平衡的sephacryl(セファクリル)s-300(s-300)柱进行分级。将该组分通过sds-page的电泳法、蛋白质印迹法,鉴定并分离d二聚体组分。上述制备的各d二聚体组分作为免疫原、或作为用于筛选抗d二聚体单克隆抗体生成性杂交瘤的酶联免疫测定(elisa)或胶乳(ltx)用抗原使用。
(2)片段dd、片段e1和片段e2的制备
将上述得到的分子量最小的d二聚体组分(dd/e单体)在3mol/l尿素-50mmol/l柠檬酸(ph5.5)溶液中、在37℃下保温4小时。接着,填充于用50mmol/ltris-盐酸缓冲液(ph7.4)-28mmol/l柠檬酸钠-0.1mol/l氯化钠溶液平衡的琼脂糖cl-6b柱中,用上述溶液展开。将分级得到的片段dd和片段e1和片段e2通过sds-page的电泳法、蛋白质印迹法鉴定、分离。
(3)人血纤蛋白原的纤溶酶分解产物的制备
在人血纤蛋白原(enzymeresearchlaboratories制造)中加入氯化钙,然后添加人纤溶酶(chromogenix制造),在37℃下反应2小时。反应终止是通过加入抑酶肽(pentapharm制造)进行。将反应终止后的产物填充于用tris盐酸缓冲液(ph7.5)平衡的sephacryl(セファクリル)s-300(s-300)柱中,通过凝胶过滤法分级为片段x、片段y、片段d1、片段e3。这些片段作为用于筛选抗d二聚体单克隆抗体生成性杂交瘤的elisa或ltx用抗原使用。
《实施例2:单克隆抗体的制备》
(1)免疫的脾细胞的制备
将实施例1中制备的dd/e单体溶液与等量的弗氏完全佐剂混合,直至乳化(免疫原混合液),通过小鼠皮内给予进行免疫(第1次免疫)。经过2周后,按照上述与小鼠同样的方法将免疫原混合液进行小鼠皮内给予(第2次免疫)。以后每隔2周对小鼠皮内给予免疫原混合液,共计进行4次免疫。第4次免疫开始经过2周后,将实施例1中制备的dd/e单体溶液与等量的氢氧化铝凝胶混合,将该混合液给予上述小鼠的脾脏内(最终免疫)。最终免疫开始经过3天后,由小鼠取出脾脏,用于细胞融合。
(2)细胞融合
将脾细胞由上述无菌摘取的上述脾脏中回收至erdf培养基中。将该脾细胞收集于离心管内进行离心,将所得沉淀用erdf培养基悬浮,计测存活的脾细胞数。
另一方面,将预培养的小鼠骨髓瘤细胞(骨髓瘤细胞)p3u1与上述脾细胞混合,离心。将该沉淀在peg1500、接着在erdf培养基中依次悬浮,使细胞融合。将沉淀在含有牛血清、次黄嘌呤、氨基蝶呤、胸苷、rd-1的erdf培养基中悬浮。将该细胞悬浮液在96孔细胞培养板上、在37℃下、在含有5%二氧化碳的二氧化碳培养容器中培养。
(3)杂交瘤的构建
培养约13天后,收集培养上清,使用elisa法确认有否目标抗体。在96孔elisa板上分注用磷酸缓冲液(pbs)稀释的抗小鼠免疫球蛋白抗体,在4℃下放置过夜。将其用含0.05%tween-20的磷酸缓冲液(t-pbs)洗涤4次。洗涤后分注培养上清,在4℃下放置过夜。接着,分注用t-pbs洗涤4次的、用t-pbs稀释的实施例1中制备的dd/e单体组分,在室温下反应2小时。用t-pbs洗涤4次后,分注用t-pbs稀释的过氧化物酶(hrp)标记抗人血纤蛋白原多克隆抗体,在室温下反应1小时。将其用t-pbs洗涤4次,然后分注tmb试剂(kirkegaard&perrylaboratories,inc.制造),在室温下反应10分钟。向其中分注1mol/l磷酸溶液,终止反应,测定450nm的吸光度。同样也对血纤蛋白原、片段d1确认反应性,对于生成了虽然与dd/e单体组分反应、但不与血纤蛋白原、片段d1反应的抗体的杂交瘤,通过极限稀释法进行克隆,进行克隆的构建。采用该方法进行3次细胞融合,免疫3只小鼠,共构建18个克隆。
(4)单克隆抗体的制造
接着,对腹腔内预先给予了降植烷的balb/c小鼠腹腔内给予上述得到的杂交瘤。约2周后收集腹水。将腹水离心,然后向上清中缓慢加入固体硫酸铵,将混合物在冰冷却下搅拌30分钟,然后放置60分钟,进行离心。将所得沉淀溶解于少量的tris盐酸缓冲液ph7.5(溶液b)中。将其填充于用溶液b平衡的q琼脂糖柱。将抗体用含有0.16mol/lnacl的溶液b溶出,得到纯化的抗d二聚体抗体。
(5)抗d二聚体抗体的elisa法筛选
对于所得纯化抗体,使用elisa来确认与血纤蛋白原相关片段的反应性,进行杂交瘤的选择。抗原使用血纤蛋白原(fbg)、dd/e单体(dd/emono)、dd/e聚合物(dd/epoly)、片段x、片段y、片段d1、片段e3。
结果如表1所示。另外,表示吸光度值的、表1中使用的符号的定义如表2所示。可确认所得的18个克隆的抗体不与血纤蛋白原和血纤蛋白原分解产物(片段x、y、d1、e3)反应
[表1]
[表2]
《实施例3:通过胶乳凝集法制备d二聚体测定试剂和对抗d二聚体抗体进行评价》
(1)抗d二聚体抗体致敏聚苯乙烯胶乳颗粒的制备
将实施例2中纯化的抗体溶解于tris盐酸缓冲液(ph8.0),在制备的抗体液中添加5ml聚苯乙烯胶乳(jsr制造),在室温下搅拌60分钟。向上述混合物中添加含有牛血清白蛋白(bsa)的tris盐酸缓冲液(ph8.0),在室温下搅拌60分钟,然后将上述混合物离心。将所得沉淀物用tris盐酸缓冲液(ph8.0)悬浮,制备抗d二聚体抗体致敏胶乳液。
(2)抗d二聚体抗体的胶乳凝集法筛选
确认检样中dd/e单体、片段d1的存在对于实施例2中所得的抗d二聚体抗体的影响。
(2-1)标准液和样品的制备
将纯化d二聚体用含有bsa的tris盐酸缓冲液(ph8.0)制备,使其浓度为0、2、8、32、48、60μg/ml,制成标准液。
另外,将纯化d二聚体(dd/e聚合物)用含bsa的tris盐酸缓冲液(ph8.0)制备,使其浓度为10μg/ml,制备添加的dd/e聚合物的浓度固定、dd/e单体的浓度为0-20μg/ml(各0、4、8、12、16、20μg/ml),的样品,和添加的片段d1的浓度为0-100μg/ml(各0、20、40、60、80、100μg/ml)的样品。
(2-2)测定方法
首先,将在各5μl上述标准液中添加160μl含bsa的tris盐酸缓冲液(ph8.0),混合,在37℃下保持约5分钟,然后添加80μl上述抗d二聚体抗体致敏胶乳液,搅拌,以波长800nm测定经过约10分钟的期间吸光度的变化,制作校正曲线。接着,与标准溶液同样地测定上述样品试样,通过上述作成的校正曲线求出测定值。上述吸光度测定是使用全自动分析仪日立7170进行。
其结果的一部分如下所示。如图2所示,mf-17抗体通过dd/e单体使胶乳凝集反应受到抑制,其它三种抗体(mf-3、mf-9、mf-11)的测定值依赖于添加浓度地升高。另外如图3所示,随着片段d1浓度的增加,包括上述4种抗体,在全部18种抗体中均未见对胶乳凝集反应的影响。
由于dd/e单体的存在而受到影响的抗体除了mf-17以外,还有mf-13、mf-14、mf-15、mf-16、mf-18。这些抗体不与片段x、片段y、片段d1、片段e3反应,对胶乳凝集也没有影响。dd/e单体是d二聚体的一部分,由于dd/e单体的增加而使反应受到抑制的抗体并不适合胶乳凝集测定,因此,除去与mf-17显示同一反应的6个克隆,选择了12个克隆。
(3)单克隆抗体的免疫球蛋白类型及特异性的确认
通过同种型分析试剂盒(アイソタイピングキット)(大日本制药制造)进行所选择的12个抗体的免疫球蛋白类型的鉴定。结果如表3所示
[表3]
以下作为代表性克隆,给出mf-3和mf-12的结果。
《实施例4:单克隆抗体的识别部位的鉴定》
(1)通过蛋白质印迹确认
蛋白质印迹是通过newpage/westernbleeze(invitrogen制造)进行。试验操作的概要如下。
在二硫苏糖醇存在和不存在下,将血纤蛋白原(fbg)、d二聚体和血纤蛋白原分解产物(fgdp)进行sds聚丙烯酰胺电泳(sds-page)和native-page。对于page后的凝胶进行蛋白质印迹,使用抗fbg抗体、mf-3抗体、mf-12抗体进行免疫染色。相对于作为对照的抗fbg抗体,在单克隆抗体mf-3、mf-12的样品中均未检测条带。
(2)通过elisa法确认
由电泳结果可以认为,通过施加电负荷,e-d结合发生脱离,另外,抗体所识别的部位的结构发生变化,因此,为了确认d-e结合的有无对于抗体反应的影响,与实施例2同样地进行了elisa法的分析。
d二聚体是以dd/e作为构成单元存在,d结构域之间通过共价键强烈结合,但是d和e是识别立体结构,进行电结合。因此,可以通过尿素、sds等容易地分离为片段dd和片段e1以及片段e2。已知该分离的片段dd和片段e1和片段e2可通过除去尿素来进行重构,形成与原有分子相同的结构。另外,为fgdp的片段e3具有与片段e1和片段e2类似的结构,但没有与d结构域的结合部位,因此无法形成e-d结合。另外,生物体内不存在使dd/e单体解离的环境,因此,来自dd/e的片段e1和片段e2不与作为fgdp的片段d1缔合。
制备下述分子作为elisa的抗原。
(1)dd/e单体(d二聚体的一部分),
(2)片段dd(对dd/e单体进行尿素处理来制备),
(3)片段d1(fgdp的一部分),
(4)片段e1和片段e2(对dd/e单体进行尿素处理来制备),
(5)片段e3(fgdp的一部分),
(6)片段dd+片段e1和片段e2[使(2)和(4)在体外反应一定时间所得],
(7)片段dd+片段e3[使(2)和(5)在体外反应一定时间所得],
(8)片段d1+片段e1和e2[使(3)和(4)在体外反应一定时间所得],
(9)片段d1+片段e3[使(3)和(5)在体外反应一定时间所得]。
上述elisa的结果如图4所示。mf-3抗体与mf-12抗体未能与将dd/e单体用尿素处理使其解离得到的片段dd(2)和片段e1和片段e2(4)反应,但可见对于将片段dd和片段e1以及片段e2混合所得(6)、或者将片段d1和片段e1和片段e2混合所得(8)的反应性。对于片段dd与片段e3的混合物(7)、片段d1与片段e3的混合物(9)也未得到反应性。由此证明:mf-3抗体和mf-12抗体对于d结构域和e结构域相结合的物质显示反应性。
作为对照的dd/d-1抗体(日本特开昭63-79900号公报)在d结构域具有识别部位,因此与dd/e单体(1)、通过尿素处理得到的片段dd(2)、片段d1(3)反应,不与片段e1和片段e2(4)、片段e3(5)反应。另外,对于片段dd和片段e1以及片段e2的混合物(6)、或者片段dd和片段e3混合物(7)、片段d1和片段e1以及片段e2的混合物(8)、或者片段d1和片段e3的混合物(9)也可见反应性。片段e3未与片段dd或片段d1形成e-d结合,但存在d结构域,因此,是以elisa上的信号呈现。
另外,在通过elisa确认dd/e单体抑制了胶乳反应的mf-16抗体的反应性时,与片段dd(2)反应,不与片段e1和片段e2(4)反应。对于片段d1和片段e1以及片段e2的混合物(8)也未见反应性,因此可以认为,两个分子的片段d1与片段e1和片段e2结合,两个d结构域接近,因此发生抗体反应。对于mf-16抗体以外的dd/e单体抑制胶乳反应的5个抗体(mf-13、mf-14、mf-15、mf-17、mf-18),也可见与片段dd(2)的反应性。该结果显示,这5个与片段dd具有反应性的抗体由于dd/e单体对胶乳凝集的抑制,因此,不适合用单一抗体的d二聚体胶乳试剂。
由以上证明,mf-3抗体和mf-12抗体不与来自fgdp的片段反应,只与为血纤蛋白分解产物且有e-d结合的d二聚体特异性反应。
另外,由蛋白质印迹和elisa的结果可以认为,抗体的识别部位是e-d结合的d二聚体的d结构域和/或e结构域。
《实施例5:本发明的抗体与以往的抗体的胶乳凝集法试剂的特异性和准确性的确认》
与实施例3同样,确认mf-12抗体和dd/d-1抗体的、dd/e聚合物中的dd/e单体和片段d1的反应性。如图5、图6所示,mf-12抗体的测定值是依赖于dd/e单体的添加浓度地升高,片段d1未抑制胶乳凝集反应。而dd/d-1抗体是依赖于dd/e单体、片段d1的添加浓度地抑制了胶乳凝集反应。
《实施例6:本发明的d二聚体测定试剂的特异性和准确性的确认》
使用添加了实施例3中制备的纯化d二聚体(dd/e聚合物)和片段d1的样品,进行mf-12抗体和以往的d二聚体试剂、商品a、商品b和商品c的比较。测定方法按照所附文件,使用全自动分析仪日立7170进行。mf-12抗体是通过实施例3的胶乳凝集法测定。
结果如图7所示。以往方法的d二聚体3试剂是随着样品中片段d1量的增加,d二聚体的测定值降低,与此相对,可确认在使用mf-12抗体的试剂中,在片段d1的浓度达到100μg/ml之前,对d二聚体的测定值没有影响。
由此可以确认,使用mf-12抗体的d二聚体测定试剂相对于以往的d二聚体试剂,不受血纤蛋白原分解产物—片段d1的影响,是可准确测定d二聚体的抗体。
《实施例7:本发明的d二聚体测定试剂对血浆检样的特异性的确认和验证》
为了确认实施例6中使用的本发明的d二聚体测定试剂和以往方法的d二聚体测定试剂的特异性差异,测定加有柠檬酸的血浆检样。使用商品a作为以往方法的d二聚体测定试剂。测定方法等与实施例6同样进行。
在研究中,将制备作为加有柠檬酸的血浆检样的冷冻检样在37℃下加温30分钟,使其融解,然后用于测定。在12个例子中,给出代表性的2个例子的结果。检样1中,无关检样的冷冻融解次数,以往的试剂、本发明试剂(mf-12抗体)的d二聚体值均没有变动。但是,检样2中,由于检样的冷冻融解使得用以往的试剂测定的d二聚体值升高约3倍。而使用mf-12抗体的本发明的d二聚体试剂中,测定值没有上述大的变动(表4)。
非专利文献2中也报道,在血浆检样中偶见血纤蛋白块的形成。可以认为,通过检样的冷冻融解,原有的d二聚体没有变化,人为形成的血纤蛋白块受到改性,生成d二聚体,因此以往方法的测定值升高
[表4]
接着,为了调查检样2的冷冻融解导致的测定值变动的原因,用本发明的抗体(mf-12抗体)和以往的抗体(dd/d-1抗体)进行检样的吸收操作,将吸收后的上清(s)和抗体结合物(b)以及未处理血浆(p)通过蛋白质印迹进行分析。具体来说,在非还原条件下,将(s)组分、(b)组分、(p)组分进行3-8%的sds-page电泳,转印在聚偏氟乙烯(pvdf)膜上,然后用抗fbg抗体检测。结果如图8所示。s1、b1泳道是dd/d-1抗体的结果,s2、b2泳道是mf-12抗体的结果。另外,左边所示箭头分别为fbg、稳定化血纤蛋白的纤溶酶分解产物(xdp、yd、dd、e1e2)和血纤蛋白原分解产物(x、y、d1)。
检样1中,将dd/d-1抗体的结合物(b1)与mf-12抗体结合物(b2)进行比较,除了b1中检测了片段d1的条带之外,未见差异。这是由于dd/d-1抗体识别d结构域。但是,在冷冻融解使得d二聚体值升高的检样2中,除片段d1的条带以外,只在b1中确认比片段e2更低分子的条带(中央的星号箭头)。而该条带未用mf-12抗体检测。该条带无法用识别d结构域的抗体的蛋白质印迹检测,由此可认为是来自片段e。
可认为比片段e2更低分子的e组分的存在是血纤蛋白原分解生成的片段e3,但由于dd/d-1抗体是识别d结构域的抗体,因此,难以认为片段e3单独存在于b1中。并且如实施例4所述,片段e3不具有与d结构域的结合能力,因此,与d结构域结合,而不是与dd/d/1抗体结合。
由这些结果教导,由于冷冻融解而升高的d二聚体人为生成的可能性高,该d二聚体是dd/e被改性、含有不进行通常的e-d结合的低分子e组分的分子。
以上显示,使用mf-12抗体的本发明的d二聚体试剂不受人为生成的d二聚体的影响,是可以更准确地测定生物体内的d二聚体值的试剂。
产业实用性
本发明的抗体例如可以用于可用作弥散性血管内凝固综合征(dic)的诊断标记物的稳定化血纤蛋白的纤溶酶分解产物(d二聚体)的测定。
以上,是按照特定的方案说明本发明,本领域技术人员自明的变形或改良均包含在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!