一个花椰菜器官发育调控miRNA序列及其应用的制作方法
本发明属于现代分子生物转基因植物技术领域,涉及生物技术中一个在花椰菜器官发育中发挥关键调控作用的mirna序列及其在培育高植株、少分支转基因植物中的应用。
背景技术:
microrna(mirna)是真核生物中内源性、非编码、并具有调控作用的一类小分子rna。其作为转录后水平上的一种调控因子广泛存在于动植物中。在植物体中,mirna基因转录出前体mirna(pri-mirnas),pri-mirnas在dcl1作用下被切割成成熟茎环结构前体(pre-mirna),pre-mirnas继续被dcl1切割产生mirna/mirna*双链分子。随后mirna*链被降解,mirna与ago1(argonaute1)蛋白等一起形成rna诱导的沉默复合体(rna-inducedsilencingcomplex,risc),risc通过与靶基因mrna结合进而对其进行切割或抑制其翻译,造成靶基因表达的沉默或抑制。mirna的这种调控方式在植物生长发育及逆境应答等多个过程中均发挥重要作用。
花椰菜(brassicaoleraceal.var.botrytis)是十字花科芸薹属甘蓝种的一个变种,是重要的蔬菜作物,当前我国是世界上花椰菜种植面积最大的国家。但对花椰菜器官发育调控,特别是由mirna介导的调控机制认识十分有限。借助现代分子生物技术和手段,可以对花椰菜器官发育中发挥重要调控作用的mirna鉴定、分离。相关mirna的获得及功能阐释对于揭示花椰菜器官发育过程中mirna的调控机制及采用基因工程手段干预植物器官发育进程,培育符合育种目标的高植株、少分支作物或经济植物具有重要价值。
技术实现要素:
本发明的目的是公开一个在花椰菜器官发育中发挥关键调控作用的mirna前体(命名为mirna-1)序列,并提供一种利用该前体序列,采用基因工程手段获得高植株、少分支转基因植物的方法和应用。为实现此述目的,本发明公开了如下的技术方案:
一个在花椰菜器官发育中发挥关键调控作用mirna-1前体序列,它由序列5’atttcaggtgatgtagttgagaagtagctgtaaagctcaggagggatagcgccatgtctcaccggtactataaaatgtttgtatatctatattggcgctatccatcctgagttctatggcttcttcttgcttttatcctgagat3’组成(seqidno:1)。
本发明进一步公开了一种利用上述mirna前体序列培养高植株、少分支转基因植物的方法,它包括如下步骤:
(1)花椰菜总dna提取;
(2)花椰菜mirna-1前体的扩增
首先利用生物学软件设计带ncoⅰ和bsteⅱ酶切位点的引物:
上游引物:5’ccatgggtagagaagaatctgtaaagctcag3’(seqidno:2)
下游引物:5’ggtcaccgtagtaagaagagccaatgaaact3’(seqidno:3)
引物序列由上海生物工程公司合成。以花椰菜基因组dna为模板进行pcr扩增。将此pcr产物与peasy-t1载体连接后,转化dh5α大肠杆菌感受态细胞,将菌液涂到筛选培养基上,37℃培养6-8h,根据蓝白斑筛选原理,挑取白色菌落培养,对阳性克隆进行pcr鉴定并测序验证。
(3)花椰菜mirna-1植物过表达载体的构建及鉴定
提取测序正确的阳性克隆以及pcambia3301质粒,然后分别进行ncoⅰ、bsteⅱ双酶切,对目的条带进行胶回收,使用t4dna连接酶对两目的片段连接,将连接产物转化dh5α感受态细胞,筛选培养基筛选培养,挑取白色菌落培养,并进行pcr和双酶切鉴定。提取测序正确的阳性重组质粒,转化农杆菌lba4404,并对得到的阳性菌株进行pcr鉴定。
ncoⅰ、bsteⅱ双酶切体系如下:质粒1μg、10×tbuffer2μl、0.1%bsa(牛血清白蛋白)2μl、ncoⅰ(15u/μl)0.5μl、bsteⅱ(10u/μl)0.5μl,无菌水补至20μl。将上述混合液置于0.2ml的离心管中,37度孵育3h;将带有相同酶切位点目的基因片段及pcambia3301质粒的回收并进行连接,连接体系如下:pcambia3301质粒5μl、目的片段5μl、10×ligasebuffer(连接缓冲液)1μl、ligase(连接酶)1μl、无菌水补至10μl,将上述连接混合物置于0.2ml的离心管中轻轻混匀后,16℃水浴保温24h;重组质粒的转化:加5μl连接产物于50μl大肠杆菌感受态细胞中,轻弹混匀,冰浴30min;42℃热激30s,立即置于冰上2min;加500μl平衡至室温的lb,180rpm37℃孵育1h;4000rpm离心1min后,弃掉部分上清,剩余150μl重悬菌体,涂于lb平板(含160mg/lkan);37℃培养过夜。挑取白色克隆于1mllb培养基(含160mg/lkan)37℃,180rpm培养8h。取1μl菌液作为模板进行pcr鉴定,筛选获得阳性重组质粒;重组质粒转化农杆菌lba4404:取1μg重组质粒加入150μl农杆菌感受态中,轻轻混匀;冰浴30min;液氮速冻5min;37℃热击5min;加入800μlyeb液体培养基(不含抗生素),28℃180rpm复苏4h;4000rpm离心1min后,弃掉部分上清,剩余150μl重悬菌体,涂于yeb平板(含90mg/lrif、120mg/lstr和150mg/lkan);28℃倒置培养2-3d。挑取白色克隆于1mlyeb培养基(含90mg/lrif、120mg/lstr和150mg/lkan),28℃,220rpm培养2d。取1μl菌液作为模板进行pcr鉴定;同时提取农杆菌阳性质粒进行双酶切鉴定;取经鉴定的阳性菌株菌液500μl加入500μl40%甘油yeb培养基,正当混匀后于-20℃保存备用;
(4)遗传转化:拟南芥盛花时期,剪去已结果的果荚备用。取出保存的含有mirna-1重组质粒的农杆菌活化、扩大培养,5000rpm离心10min,菌体重悬于silwetl-77终浓度为0.05%的500ml5%的蔗糖溶液中(此配好的的溶液即为转化液);将拟南芥的整个花序放入转化液中,浸染50s后移出,用保鲜膜将整个植株包好,侧置于托盘中,避光培养24h,然后直立培养,5d后进行第二次转化。种子成熟后,收集全部种子,记为t0代。
(5)mirna-1转基因拟南芥的抗性筛选及分子鉴定
收集的t0代种子4℃春化3-4d,播种到土壤中。待长出前两片真叶时喷basta(原液10万倍稀释)筛选,每天喷两次,连续七天。将筛选出的阳性苗移栽到新的土壤中,ctab法提取抗性苗的dna进行pcr分子鉴定。
(6)mirna-1过表达转基因拟南芥表型分析
将确定的mirna转基因拟南芥t2代种子和野生型种子同时播种到土壤中。等长出前两片真叶后喷basta(原液10万倍稀释)筛选,每天喷两次连续七天。将筛选出的阳性苗移栽,对野生型和转基因拟南芥阳性苗表型进行对比观察。实验的结果发现:
(1)转基因植物植株高度显著高于野生型;
(2)转基因植物植株茎分支数显著少于野生型。
本发明重点解决了在作物或能源植物新品种育种中对高植株、少分支作物或能源植物新品种的需求。
本发明所述的yeb培养基指的是含90mg/lrif(利福平)、100mg/l120mg/lstr(链霉素)和150mg/lkan(卡那霉素)的培养基。
本发明同时也公开了mirna-1序列(seqidno:1)在干预花椰菜及其他植物器官发育中的应用。实验结果显示:转基因植物植株高度显著高于野生型;同时转基因植物植株茎分支数显著少于野生型。这对高植株、少分支适合密植的转基因作物或经济植物起到了关键的作用。
本发明公开的利用mirna-1序列,采用基因工程手段获得高植株、少分支转基因植物的方法与现有技术相比所具有的积极效果在于:
(1)操作过程更加简单,对操作环境的要求更低;
(2)费用低廉,广谱性高,可在绝大多数双子叶植物中开展;
(3)转化效率高,可以实现短时间内获得大量具有高植株、少分支的转基因植株。
附图说明
图1为显示本案花椰菜器官发育调控mirna-1序列转基因拟南芥植株抗性筛选(左)及分子鉴定(右);
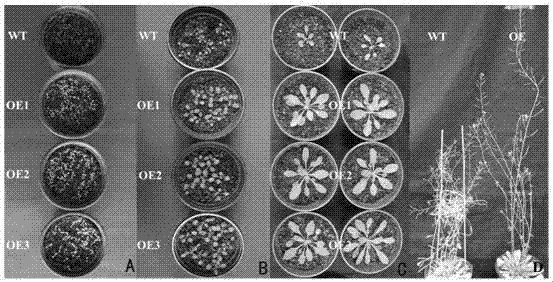
图2为显示本案花椰菜器官发育调控mirna-1转化拟南芥后转基因拟南芥及野生型各个发育期的比较(a,b,c,d分别指示7d,15d,30d,60d大小的拟南芥;wt显示同一生长期野生型表现,oe、oe1、oe2、oe3显示同一生长期mirna-1转基因植株表型)。
具体实施方式
下面结合说明书附图和具体实施例,进一步阐述本发明。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件。本发明所有生化试剂、酶、载体、菌株均可在各种生化试剂公司中购买,引物序列由上海生物工程公司合成。
本发明所需生化试剂及酶等来源见下表:
实施例1
一个在花椰菜器官发育中发挥关键调控作用mirna-1前体序列,它由序列5’atttcaggtgatgtagttgagaagtagctgtaaagctcaggagggatagcgccatgtctcaccggtactataaaatgtttgtatatctatattggcgctatccatcctgagttctatggcttcttcttgcttttatcctgagat3’组成(seqidno:1)。
利用上述mirna前体序列培养高植株、少分支转基因植物的方法,它包括如下步骤:
(1)花椰菜总dna提取:
采用上海生物工程公司代售的植物dna提取试剂盒进行花椰菜总dna提取。具体过程如下:①称取50mg左右的花椰菜放入已用液氮预冷过的研钵内,于液氮中充分研磨成粉末状(研磨过程中不断加入液氮),将碾碎的材料移至试剂盒提供的裂解液中,震荡混匀,65℃水浴30min,期间每隔10min颠倒混匀1次;②加入相同体积的酚/氯仿,轻轻震荡混匀,放入4℃离心机中,选择12,000rpm离心10min;③吸取上清液,加入相同体积的氯仿,轻轻震荡混匀,放入4℃离心机中,选择12,000rpm离心10min;④吸取上清液,加入两倍体积的预冷的无水乙醇,轻轻震荡混匀,于-20℃冰箱中沉淀30min以上;⑤放入4℃离心机中,选择12,000rpm离心10min,弃上清液,然后加入1ml预冷的75%的乙醇,轻轻将沉淀吹起,漂洗两次,倒掉漂洗液;⑥瞬时离心后,用枪吸干残余的乙醇,室温放置晾干沉淀,加入50μl双蒸水溶解沉淀;⑦加入1μl的rnasea(10mg/ml),置于37℃水浴中反应30min;⑧用nanodrop(nd-1000)测定dna浓度和质量,琼脂糖凝胶电泳检测dna的质量,-20℃保存。
(2)花椰菜mirna-1前体的扩增
首先利用生物学软件设计带ncoⅰ和bsteⅱ酶切位点的引物:
上游引物:5’ccatgggtagagaagaatctgtaaagctcag3’;
下游引物:5’ggtcaccgtagtaagaagagccaatgaaact3’。
引物序列由上海生物工程公司合成。以花椰菜基因组dna为模板进行pcr扩增。将此pcr产物与peasy-t1载体连接后,转化dh5α大肠杆菌感受态细胞,将菌液涂到筛选培养基上,37℃培养6-8h,根据蓝白斑筛选原理,挑取白色菌落培养,对阳性克隆进行pcr鉴定并测序验证。
(3)花椰菜mirna-1植物过表达载体的构建及鉴定
提取测序正确的阳性克隆以及pcambia3301质粒,然后分别进行ncoⅰ、bsteⅱ双酶切,对目的条带进行胶回收,使用t4dna连接酶对两目的片段连接,将连接产物转化dh5α感受态细胞,筛选培养基筛选培养,挑取白色菌落培养,并进行pcr和双酶切鉴定。提取测序正确的阳性重组质粒,转化农杆菌lba4404,并对得到的阳性菌株进行pcr鉴定。
ncoⅰ、bsteⅱ双酶切体系如下:质粒1μg、10×tbuffer2μl、0.1%bsa(牛血清白蛋白)2μl、ncoⅰ(15u/μl)0.5μl、bsteⅱ(10u/μl)0.5μl,无菌水补至20μl。将上述混合液置于0.2ml的离心管中,37度孵育3h;将带有相同酶切位点目的基因片段及pcambia3301质粒的回收并进行连接,连接体系如下:pcambia3301质粒5μl、目的片段5μl、10×ligasebuffer(连接缓冲液)1μl、ligase(连接酶)1μl、无菌水补至10μl,将上述连接混合物置于0.2ml的离心管中轻轻混匀后,16℃水浴保温24h;重组质粒的转化:加5μl连接产物于50μl大肠杆菌感受态细胞中,轻弹混匀,冰浴30min;42℃热激30s,立即置于冰上2min;加500μl平衡至室温的lb,180rpm37℃孵育1h;4000rpm离心1min后,弃掉部分上清,剩余150μl重悬菌体,涂于lb平板(含160mg/lkan);37℃培养过夜。挑取白色克隆于1mllb培养基(含160mg/lkan)37℃,180rpm培养8h。取1μl菌液作为模板进行pcr鉴定,筛选获得阳性重组质粒;重组质粒转化农杆菌lba4404:取1μg重组质粒加入150μl农杆菌感受态中,轻轻混匀;冰浴30min;液氮速冻5min;37℃热击5min;加入800μlyeb液体培养基(不含抗生素),28℃180rpm复苏4h;4000rpm离心1min后,弃掉部分上清,剩余150μl重悬菌体,涂于yeb平板(含90mg/lrif、120mg/lstr和150mg/lkan);28℃倒置培养2-3d。挑取白色克隆于1mlyeb培养基(含90mg/lrif、120mg/lstr和150mg/lkan),28℃,220rpm培养2d。取1μl菌液作为模板进行pcr鉴定;同时提取农杆菌阳性质粒进行双酶切鉴定;取经鉴定的阳性菌株菌液500μl加入500μl40%甘油yeb培养基,正当混匀后于-20℃保存备用;
(4)遗传转化:拟南芥盛花时期,剪去已结果的果荚备用。取出保存的含有mirna-1重组质粒的农杆菌活化、扩大培养,5000rpm离心10min,菌体重悬于silwetl-77终浓度为0.05%的500ml5%的蔗糖溶液中(此配好的的溶液即为转化液);将拟南芥的整个花序放入转化液中,浸染50s后移出,用保鲜膜将整个植株包好,侧置于托盘中,避光培养24h,然后直立培养,5d后进行第二次转化。种子成熟后,收集全部种子,记为t0代。
(5)mirna-1转基因拟南芥的抗性筛选及分子鉴定
收集的t0代种子4℃春化3-4d,播种到土壤中。待长出前两片真叶时喷basta(原液10万倍稀释)筛选,每天喷两次,连续七天。将筛选出的阳性苗移栽到新的土壤中,ctab法提取抗性苗的dna进行pcr分子鉴定。图1为显示本案花椰菜器官发育调控mirna-1序列转基因拟南芥植株抗性筛选(左)及分子鉴定(右);
(6)mirna-1过表达转基因拟南芥表型分析
将确定的mirna转基因拟南芥t2代种子和野生型种子同时播种到土壤中。等长出前两片真叶后喷basta(原液10万倍稀释)筛选,每天喷两次连续七天。将筛选出的阳性苗移栽,对野生型和转基因拟南芥阳性苗表型进行对比观察。实验的结果发现:转基因植物植株高度显著高于野生型;转基因植物植株茎分支数显著少于野生型;图2为显示本案花椰菜器官发育调控mirna-1转化拟南芥后转基因拟南芥及野生型各个发育期的比较(a,b,c,d分别指示7d,15d,30d,60d大小的拟南芥;wt显示同一生长期野生型表现,oe、oe1、oe2、oe3显示同一生长期mirna-1转基因植株表型)。
sequencelisting
<110>南开大学
<120>一个花椰菜器官发育调控mirna序列及其应用
<160>3
<170>patentinversion3.5
<210>1
<211>144
<212>dna
<213>人工序列
<400>1
atttcaggtgatgtagttgagaagtagctgtaaagctcaggagggatagcgccatgtctc60
accggtactataaaatgtttgtatatctatattggcgctatccatcctgagttctatggc120
ttcttcttgcttttatcctgagat144
<210>2
<211>31
<212>dna
<213>人工序列
<400>2
ccatgggtagagaagaatctgtaaagctcag31
<210>3
<211>31
<212>dna
<213>人工序列
<400>3
ggtcaccgtagtaagaagagccaatgaaact31
- 还没有人留言评论。精彩留言会获得点赞!