一种用于培养人脐带间充质干细胞的高效预处理装置及其相关应用的制作方法
本发明属于人的细胞培养
技术领域:
,具体涉及一种用于培养人脐带间充质干细胞的高效预处理装置及其相应关用
背景技术:
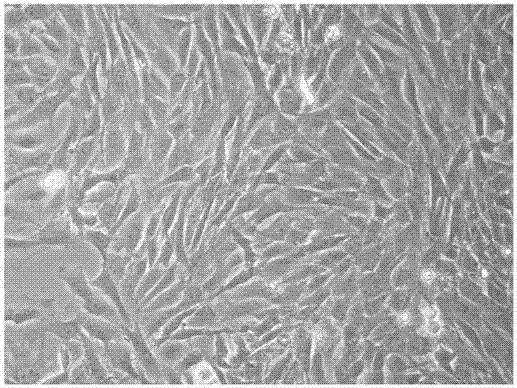
:间充质干细胞是一类很有特性的成体干细胞。这种细胞具有分化成各种成熟细胞的潜能,包括:脂肪细胞、软骨细胞、骨细胞、肌腱细胞和肌细胞。这些特性以及它们的发育可塑性引起了科研界的广泛关注,因为其可被用于再生医学研究。在体外,从脐带华通氏胶分离出的间充质干细胞,经过神经定向诱导培养基、shh和fgf8的诱导,可以分化成神经元和神经胶质细胞。间充质干细胞还可以被分化为成脂肪细胞和成骨细胞。另外,在心肌诱导培养基中,间充质干细胞可以被分化为心肌细胞。人脐带间充质干细胞表达基质受体cd44和cd105以及间充质干细胞标志物sh2和sh3,但不表达造血细胞系标志物cd34。目前,国内外已经有大量的研究人员进行了人脐带间充质干细胞的培养和药理学特性方面的研究,既往的研究多采用组织块培养法或者胰酶消化法。其缺点在于组织块培养方法的原代细胞培养时间长,且并非每一块都有细胞爬出,故细胞传代次数和最终获取的细胞数较少,细胞种类不纯,使进一步持续深入的研究受到限制。而胰酶消化法对细胞的损害比较大,尤其是在37度水浴的条件下,胰酶可以最大程度地发挥其消化效力,故对消化时间和消化次数的掌控较难。过度消化会导致细胞损伤,细胞膜破损,dna溢出。所以,以往的研究人员会发现,消化之后的单细胞悬液非常粘稠,有时需要在消化液中加入dna酶来打断溢出的dna。这样导致的结果往往是,细胞数量非常少、得率低且活力差。近年来,尤其是近两年以来,将人脐带间充质干细胞作为生物药品管理的趋势越来越明显,但由于缺乏规范且有效的分离方案,使得生产脐带干细胞的效率无法量产达到临床应用的需求。此外,传统脐带干细胞的培养,一般先对人脐带组织进行前处理获得较为纯净的人脐带间充质干细胞后,再采用培养皿进行培养。而对人脐带组织进行前处理时,人脐带组织需要在不同的处理设备或容器中进行预处理,人脐带组织在这种空间大转移过冲中很容易受到空气中的细菌病毒等微生物的污染,因此,目前人脐带间充质干细胞培养在这种开放式的前处理方式下手续繁琐、效率低下,人力物力消耗较大,成才较高,无法大规模的推广应用。技术实现要素:本发明为解决现有技术中所存在的上述问题,提出的一种用于培养人脐带间充质干细胞的高效预处理装置及其相关应用。与传统培养法相比,基于本发明高效预处理装置的培养人脐带间充质干细胞的方法,使人脐带间充质干细胞的培养简单易行,培养获得的人脐带间充质干细胞较纯,生长良好,细胞增殖快,可多次传代,且细胞得率和存活率均大大提高。一根脐带大约可以分离扩增出100亿个干细胞,为脐带干细胞成为生物药品进行大量库存提供了可能。为实现上述目的,本发明采用以下技术方案:本发明的第一个方面是提供一种人脐带间充质干细胞的高效预处理装置,具体包括:一可翻转的上盖,所述上盖上设置有刀槽,所述刀槽由至少两组不同深度且相互的网格状的子刀槽组成;与所述上盖铰链连接的壳体;位于所述壳体开口处的切割组件,所述切割组件与所述上盖相配合设置,以将洗涤后的脐带段剪切为大小一致的组织小块;所述切割组件由网格状刀片和弹性密封圈组成,所述网格状刀片由至少两组上、下错列设置的的子刀片组成,且所述网格状刀片与所述刀槽相对应设置;位于所述壳体中部的消化组件,所述消化组件用于接收所述切割组件剪切后的人脐带组织小块并进行酶消化处理;以及位于所述壳体下部的清洗离心组件,用于接收经酶消化处理后的细胞液并对所述细胞液进行清洗、纯化处理。进一步地,所述切割组件由网格状刀片和弹性密封圈组成,所述网格状刀片装设于所述壳体开口处的卡槽内,且所述弹性密封圈套设于所述网格状刀片的外周并与所述壳体的上端面接触连接。进一步优选地,所述弹性密封圈的水平高度大于所述网格状刀片的水平高度;所述网格状刀片的水平高度大于所述卡槽的水平高度。进一步地,所述刀槽分别由深度相同且相互交错连通的第一子刀槽、第二子刀槽、第三子刀槽组成;所述网格状刀片分别由上、下依次错列设置的第一子刀片、第二子刀片、第三子刀片组成,且所述第一子刀槽、第二子刀槽、第三子刀槽分别与所述第一子刀槽、第二子刀槽、第三子刀槽对应设置。进一步地,所述消化组件包括:一具有筛网的消化仓体,和一活动安装在所述消化仓底部并与所述筛网相对应的挡板,所述挡板可左右移动与所述筛网重叠或错位设置,使得所述筛网底部封闭或连通。进一步优选地,所述消化仓为抽屉式可拆卸安装在所述壳体侧壁上。进一步地,所述清洗离心组件包u型仓体和位于所述u型仓体内的搅拌桨,所述搅拌桨穿过所述u型仓体底部连接微电机。进一步优选地,所述u型仓体侧壁上设有进液口和排液口,所述进液口的水平高度大于所述排液口的水平高度。本发明的第二个方面是提供一种基于所述高效预处理装置的人脐带间充质干细胞的预处理方法,具体包括如下步骤:步骤1)人脐带组织的获取将脐带段用冰的生理盐水充分洗涤干净后,将脐带段反复折叠成5-8层厚的的组织块,将该组织块放入切割组件上,按下上盖将组织块剪切为大小一致的人脐带组织碎块,落入消化仓体内;步骤2)酶消化处理向装有人脐带组织碎块的消化仓体内加入初始浓度均为1mg/ml的复合酶;将消化组件整体抽出放入4℃冰箱内过夜;第2天,将消化组件从冰箱中取出,对组织液稍微吹打几次,整体放入37℃水浴15分钟,再次轻微吹打不超过5次,然后整体插入处理装置中,滑动挡板打通筛网,使组织液经筛网过滤后进入u型仓体内;步骤3)离心纯化处理向u型仓体内加入pbs缓冲液400g,低速搅拌2分钟后,将预处理装置整体放入离心机离心5分钟,去除上清液,沉淀重悬,加入pbs缓冲液洗2遍,即得较纯的人脐带间充质干细胞,然后用0.2%台盼兰计数活细胞数。进一步地,所述步骤2)中复合酶由i型胶原酶、ii型胶原酶、iv型胶原酶和dispase酶按重量比1:1:1:1配制而成,且4种酶的初始浓度均为1mg/ml。本发明的三个方面是提供一种人脐带间充质干细胞的培养方法,具体包括如下步骤:步骤1)培养基配制分别配制含20%胎牛血清、1%青链霉素的dmem/f12培养基,和含10%胎牛血清、1%青链霉素的dmem/f12培养基;在原代培养、传代和复苏的第一天,用含20%胎牛血清、1%青链霉素的dmem/f12培养基进行培养;其它时间,用含10%胎牛血清、1%青链霉素的dmem/f12培养基进行培养;步骤2)二维培养采用上述预处理方法制得人脐带间充质干细胞,并将纯化的人脐带间充质干细胞用上述培养基重悬,制得脐带间充质干细胞重悬液,加入到t175培养瓶中进行培养,接种密度为10×106/瓶;置于37度,5%co2的培养箱中进行培养;为了充分去除杂质细胞,接种48小时后,将悬浮于培养液中的细胞吸除,更换新的培养液,以在培养瓶中获得纯化的人脐带间充质干细胞;每3天更换新的培养基,每天于显微镜下观察细胞生长情况,至细胞融合度达70%〜80%,进行传代培养;步骤3)传代培养当细胞融合度达70%〜80%时,每瓶细胞加0.25%胰酶-edta5ml,在37度培养箱中孵育消化3〜5分钟;显微镜下观察,当细胞变圆、间隙增大时,用含血清的培养基终止消化,并将细胞吹打下来;400g离心5分钟,获得的细胞再加入新的培养基,接种于t175培养瓶中,接种密度为10×106/瓶;每3天更换新的培养基,每天于显微镜下观察细胞生长情况。在本发明人脐带间充质干细胞的预处理及其细胞培养中,所采用的预处理装置、人脐带组织、复合酶、细胞培养基、胰酶和胎牛血清等,均应符合无菌要求。本发明采用上述技术方案,与现有技术相比,具有如下技术效果:1)本发明提供的高效预处理装置,将人脐带剪切、酶消化以及清洗纯化等操作集中于该装置中进行一体化处理,通过在全封闭体系内进行培养,能够降低环境污染风险,得到较纯的人脐带间充质干细胞用于细胞培养;2)该高效预处理装置的结构简单、紧凑,设计新颖,简化了操作过程,使用灵活方便,造价成本低,可适用于不同细胞组织的纯化处理,有利于推广使用;3)本发明所提供的细胞预处理及其培养方法,制备方法简便,技术稳定,重复性好;4)采用复合酶消化法获得了单个的人脐带间充质干细胞,避免了既往的组织块法获得的细胞量少,细胞不纯的缺点,且使用复合酶代替胰酶,避免了对组织过度消化过度吹打所导致的细胞活性低、得率差的问题;5)采用原代、传代第1天和复苏第1天增加血清浓度的方式,可以极大地提高细胞的贴壁率,进一步提高细胞活性和得率;6)采用切割组件对组织块进行切碎,避免了剪刀剪碎过程中的大量人力以及时间延长对细胞活力的影响,为大批量标准化生产脐带干细胞提供了可能。附图说明图1为本发明的高效预处理装置的立体结构示意图;图2-a为本发明高效预处理装置中网格状刀片的结构示意图;图2-b为本发明高效预处理装置中弹性密封圈的结构示意图;图3为图1不具有图2-a所示网格状刀片和图2-b所示弹性密封圈的高效预处理装置立体结构示意图;图4为本发明高效预处理装置的剖视结构示意图;图5-a为本发明高效预处理装置中网格状刀片的俯视结构示意图;图5-b为图5-a所示高效预处理装置中网格状刀片的截面结构示意图;图6-a为本发明高效预处理装置中具有刀槽的上盖的俯视结构示意图;图6-b为图6-a所示高效预处理装置中上盖的截面结构示意图;图7为本发明高效预处理装置中消化组件的主视结构示意图;图8-a为图7所示消化组件中消化仓体的俯视结构示意图;图8-b为图7所示消化组件中挡板的俯视结构示意图;图9-a为图8-a和8-b所示消化仓体和挡板叠合设置的结构示意图;图9-b为图8-a和8-b所示消化仓体和挡板错位设置的结构示意图;图10为图4所示高效预处理装置中移除切割组件和消化组件的俯视结构示意图;图11-12为采用本发明方法培养的人脐带间充质干细胞的细胞图片。具体实施方式下面通过具体实施例对本发明进行详细和具体的介绍,以使更好的理解本发明,但是下述实施例并不限制本发明范围。在本发明的描述中,需要理解的是,术语“中心”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。实施例1如图1所示,本实施例提供了一种人脐带间充质干细胞的高效预处理装置,具体包括:一可翻转的上盖100,上盖100上设置有刀槽101,刀槽101由至少两组不同深度且相互的网格状的子刀槽组成;与上盖100铰链连接的壳体200;位于壳体200开口处的切割组件300,切割组件300与上盖100相配合设置,以将洗涤后的脐带段剪切为大小一致的组织小块;切割组件300由网格状刀片301和弹性密封圈302组成,网格状刀片301由至少两组上、下错列设置的子刀片组成,且网格状刀片301与刀槽101相对应设置;位于壳体200中部的消化组件400,即消化组件400位于切割组件300下方位置,下方的消化组件400用于接收上方切割组件300剪切后的人脐带组织小块,并在消化组件400内对人脐带组织小块进行酶消化处理;以及位于壳体200下部的清洗离心组件500,即该清洗离心组件500位于消化组件400下方,用于接收消化组件400内经酶消化处理后的细胞液,并在清洗离心组件500内对细胞液进行清洗、纯化处理。在该高效预处理装置中,上盖100、壳体200以及自上而下依次设置于壳体200内的切割组件300、消化组件400和清洗离心组件500组成本实例的人脐带间充质干细胞的高效预处理装置,人脐带组织细胞的纯化步骤自上而下依次完成,简化了操作步骤,有效提高了纯化效率;且壳体200采用透明材质,如聚乙烯、聚丙烯、聚氯乙烯或聚苯乙烯材质;优选聚苯乙烯材质,聚苯乙烯材质的透光性仅于次亚克力材料,且其适于制作绝缘透明件及化学仪器等,因此用于制作壳体200。透明的壳体200能够使得该高效预处理装置的每一步操作外部可见,便于操作人员从外部实时了解高效预处理装置内对人脐带细胞组织的处理进度。于上述技术方案的基础上,切割组件300由网格状刀片301和弹性密封圈302组成,如图2-a所示为网格状刀片的结构示意图,图2-b为弹性密封圈的结构示意图;网格状刀片301采用不锈钢材质制成,其顶部为锋利的刀刃,用于将脐带段切割为若干均匀的组织小块,网格状刀片301每个小网格的大小为(2-10)mm×(2-10)mm,根据所待处理的人脐带的组织大小,网格状刀片301每个小网格的大小设为(2-5)mm×(2-5)mm,使得经网格状刀片301切割粉碎后人脐带组织足够小,以满足人脐带组织在进行酶消化时能够与酶充分结合,使组织松散,细胞容易剥离;弹性密封圈302采用可挤压伸缩的弹性材质制成,弹性密封圈302的可变形性及其弹性足够好。如图3所示,为不具有图2-a网格状刀片和图2-b弹性密封圈的高效预处理装置立体结构示意图,网格状刀片301装设于壳体200开口处的卡槽201内,该卡槽201形成于壳体200开口内侧壁,图3示出了卡槽201,且弹性密封圈302套设于网格状刀片301的外周并与壳体200的上端面接触连接,以及弹性密封圈302与网格状刀片301过盈配合。当需要对清洗干净的脐带段进行切割时,先将脐带段反复折叠成5-8层厚的组织块,再将该组织块放入切割组件300上,用力按下上盖100将组织块剪切为大小一致的人脐带组织碎块,最终落入消化仓体401内,从而获取符合培养需求的人脐带组织小块。此外,作为本实施例的一个优选技术方案,在该切割组件300中,当下压上盖100对脐带段进行切割时,为避免因上盖100对网格状刀片301产生局部受力过大,造成上盖100和网格状刀片301损伤影响其受用寿命的问题。因此,设计弹性密封圈302的水平高度大于网格状刀片301的水平高度,即当上盖100翻转至壳体200上端时,在没有外力的作用下,弹性密封圈302顶住上盖100,而网格状刀片301与上盖100不接触,不产生切割力;而当在上盖100上施加一个足够大的向下作用力时,上盖100向下挤压弹性密封圈302,使弹性密封圈302收缩,直至上盖100与网格状刀片301接触,并相互之间产生一定程度的能够切割脐带段的切割力;此外,网格状刀片301的水平高度大于卡槽201的水平高度,这样能够使得弹性密封圈302套设在网格状刀片301的上端外周,且弹性密封圈302与网格状刀片301过盈配合,保证网格状刀片301的稳定性。在该高效预处理装置中,切割组件300上的网格状刀片301,与上盖刀槽101相对应设置,构成刀槽101的子刀槽也相应的分别对应于网格状刀片301中的子刀片,且子刀槽的深度略大于其对应的子刀片的最大高度,优选地,子刀片的高度以及子刀槽的深度约为2.0-10mm。在切割人脐带段时,较大深度的刀槽100使得在完成脐带段切割动作后,继续向下施加压力,高度渐小的子刀片依次嵌入刀槽101内,从而形成多次切割,以将人脐带切割的更为细小;加大所施加的压力,使弹性密封圈302再次压缩,网格状刀片301深入刀槽100内,此时刀槽101之间的凸面102向下挤压切割后的滞留于网格状刀片301内的人脐带组织小块,使得人脐带组织小块全部向下落入消化组件400内。在该高效预处理装置的切割组件300上,如图5-a为网格状刀片的俯视结构示意图,图5-b为网格状刀片的截面结构示意图,网格状刀片301分别由上、下依次错列设置的第一子刀片3011、第二子刀片3012、第三子刀片3013组成,网格状刀片301最底部。第一子刀片3011、第二子刀片3012、第三子刀片3013所形成的网格密度逐渐增大,即最底层的第三子刀片3013所形成网格密度最大,中间层的第二子刀片3012所形成网格密度次之,中最上层的第一子刀片3011所形成网格密度最小,这种结构的网格状刀片设计,能够有效将脐带段逐次切割为符合酶消化用的人脐带小块,且操作方便快捷,工作强度低。与网格状刀片相对应的上盖,具有如图6-a的俯视结构以及图6-b所示的截面结构。该刀槽101分别由深度不同且相互交错连通的第一子刀槽1011、第二子刀槽1012、第三子刀槽1013组成,且第一子刀槽1011、第二子刀槽1012、第三子刀槽1013分别与第一子刀槽1011、第二子刀槽1012、第三子刀槽1013对应设置。如图7-9所示,在本实施例的高效预处理装置上,所采用的消化组件400包括:一具有筛网403的消化仓体401,和一活动安装在消化仓401底部并与筛网403相对应的挡板402。筛网403为50-100um筛网,优选地,筛网403的网孔为60-80um。具体地,如图7所示,消化仓401下端开设有容置槽405,该容置槽405的宽度大于挡板402的宽度,使得挡板402可左右活动设置在容置槽405内,且该挡板402与消化仓体401底部紧密贴合在一起。如图8-a所示为具有网筛403的消化仓体的结构,筛网403并排位设置于消化仓401底部的开口处;如图8-b为挡板的结构示意图,挡板402上开设有若干与筛网403相对应的过滤通孔404。此外,如图7所示,挡板402还设有滑动块407,手动推动该滑动块407,可使挡板402左右移动与筛网403重叠或错位设置,使得筛网403底部封闭或连通,。在该高效预处理装置上,消化组件400的工作原理如下:当筛网403与过滤通孔404上下重合时,开启酶消化细胞液的过滤功能,如图9-a所示消化仓体和挡板叠合设置;当筛网403与过滤通孔404上下错位设置时,挡板402完全堵住了筛网403,如图9-b所示消化仓体和挡板错位设置。优选地,筛网403和挡板402的形状均为并排设置的长方形结构,挡板402间的过滤通孔404也为长方形结构,且挡板402宽度大于筛网403的宽度,使得挡板402能够从筛网403底部对筛网403完全封闭,防止泄露。此外,为便于清理消化仓体401内经酶消化且过滤后的组织残渣,避免在离心纯化操作过程中组织残渣落入u型仓体501内,对人脐带间充质干细胞的提纯效果造成影响,因此,需及时清理消化仓体401内人脐带组织残渣。为解决上述问题,将消化仓401设置成为抽屉式可拆卸结构安装在壳体200侧壁上,通过消化仓401外壁上的把手406整体拉出消化组件400,人工清理消化仓体401内的人脐带组织残渣,然后再通过把手406推入壳体200内进行下一步的酶消化操作。作为本实施例的一个优选技术方案,如图4所示,清洗离心组件500由u型仓体501和位于u型仓体501内的搅拌桨506组成,u型仓体501用于接收酶消化处理后的细胞液并对细胞液进行清洗、纯化处理,u型仓体501底部的u型结构设计有利于细胞液的离心提纯处理。搅拌桨506可用于加快清洗缓冲液与细胞液的混合速度,提高清洗效率。搅拌桨506穿过u型仓体501底部连接微电机507,且在搅拌桨506上与u型仓体501底部接触部位套设有密封轴套508,该密封轴套508的设置可在有效保障搅拌桨506正常旋转的同时,保障u型仓体501底部不漏水;且该微电机507通过内部设置于壳体200底部的电池(未示出)供电。u型仓体501的上边缘与壳体内壁密封连接,使得u型仓体501与壳体200底部形成一个独立的空间,以与u型仓体501内及其以上的空间隔离开来,保证动力组件微电机507和电池的运行的稳定性。继续参阅如图4所示的高效预处理装置,u型仓体501侧壁上还设有与外部清洗液装置连接的进液口502和与外部废液收集装置连接的排液口504,且进液口502的水平高度大于排液口504的水平高度,使得外部清洗液装置内的清洗液在流体自身的作用下,自动注入u型仓体501内与细胞组织充分混合后,再在在流体自身的作用下从排液口504自动排出至外部废液收集装置,整个清洗过程中清洗液的加入与排出均自动完成,无需提供额外的动力,只要同时保证外部清洗液装置的水平高度大于外部废液收集装置的水平高度即可,同时简化了操作步骤,降低了劳动强度。请继续参阅图4所示的人脐带间充质干细胞的高效预处理装置,在壳体200的右侧壁上还开设有与u型仓体501相连通的通气孔202,保证u型仓体501内的氧气浓度。以及在进液口502处设有进液塞503,当需要加入清洗液时,拔掉该进液塞503,从进液口502向u型仓体501添加清洗液,当不需要加入清洗液时,将该进液塞503插入进液口502,防止环境污染物自进液口502进入u型仓体501,避免污染风险;同理,在排液口504处设有排液塞505,当需要排除u型仓体501内的清洗液时,拔掉该排液塞505,从排液口504向外部废液收集排出清洗液,或者在排液口504接负压,以加快u型仓体501内上清液的排放;当不需要排除清洗液时,将该排液塞504插入排液口504处,防止环境污染物自排液口504进入u型仓体501,避免污染风险。图10为移除切割组件300和消化组件400后,该高效预处理装置的俯视图,当人脐带组织经离心纯化,较纯的人脐带间充质干细胞沉积在u型仓体501底部,并通过排液口504排出上清液后,采用吸管从壳体200的顶部伸入u型仓体501底部沉积的人脐带细胞中取样,进行下一步的培养。实施例2本实施例提供了一种采用实施例1的高效预处理装置对人脐带间充质干细胞进行预处理的方法,包括如下步骤:步骤1)人脐带组织的获取获得新生儿人脐带组织,尽量采用剖宫产的新生儿脐带,以避免污染;将脐带段放在冰的生理盐水里,保持在低温4度左右的条件下快速带回细胞实验室,在生物安全柜中,将脐带段用冰的生理盐水充分洗涤,以去除血液和杂质,去除脐动脉和脐静脉之后,将脐带段反复折叠成5-8层厚的5cm×5cm的组织块,将该组织块放入切割组件300上,根据需要选择网格状刀片301和刀槽101的剪切规格大小,按下上盖100将组织块经多次剪切成1mm×1mm×1mm左右的组织碎块,并落入消化仓体401内;步骤2)酶消化处理向装有人脐带组织碎块的消化仓体401内加入初始浓度均为1mg/ml的复合酶;将消化组件400整体抽出放入4℃冰箱内过夜,便于酶与组织充分结合,使组织松散,细胞容易剥离,这样可以避免消化过程中,对组织的吹打过于频繁和过于粗暴,对细胞造成极大的伤害,第2天,将消化组件400从冰箱中取出,采用吸管对组织液稍微吹打几次,整体放入37℃水浴15分钟,再次轻微吹打不超过5次,然后整体插入预处理装置中,滑动挡板402打通筛网403,使组织液经过70um的筛网403过滤后进入u型仓体501内;步骤3)离心纯化处理向u型仓体501内加入pbs缓冲液400g,低速搅拌2分钟后,将预处理装置整体放入离心机离心5分钟,去除上清液,沉淀重悬,加入pbs缓冲液洗2遍,即得较纯的人脐带间充质干细胞,然后用0.2%台盼兰计数活细胞数。实施例3本实例提供了一种对上述实施例2预处理后的人脐带间充质干细胞进行培养的方法,包括如下步骤:步骤1)培养基配制分别配制含20%胎牛血清、1%青链霉素的dmem/f12培养基,和含10%胎牛血清、1%青链霉素的dmem/f12培养基;为了提高人脐带间充质干细胞的贴壁存活率,在原代培养、传代和复苏的第一天,用含20%胎牛血清、1%青链霉素的dmem/f12培养基进行培养;其它时间,用含10%胎牛血清、1%青链霉素的dmem/f12培养基进行培养;步骤2)二维培养采取实施例2预处理后的较纯的人脐带间充质干细胞,并将较纯的人脐带间充质干细胞用上述培养基重悬,制得人脐带间充质干细胞重悬液,加入到t175培养瓶中进行培养,接种密度为10×106/瓶;置于37度,5%co2的培养箱中进行培养;为了充分去除杂质细胞,接种48小时后,将悬浮于培养液中的细胞吸除,更换新的培养液,以在培养瓶中获得纯化的人脐带间充质干细胞;每3天更换新的培养基,每天于显微镜下观察细胞生长情况,至细胞融合度达70%〜80%,进行传代培养;步骤3)传代培养当细胞融合度达70%〜80%时,每瓶细胞加0.25%胰酶-edta5ml,在37度培养箱中孵育消化3〜5分钟;显微镜下观察,当细胞变圆、间隙增大时,用含血清的培养基终止消化,并将细胞吹打下来;400g离心5分钟,获得的细胞再加入新的培养基,接种于t175培养瓶中,接种密度为10×106/瓶;每3天更换新的培养基,每天于显微镜下观察细胞生长情况,该人脐带间充质干细胞的细胞图片的如图11-12所示。在实施例2-3所述的人脐带间充质干细胞的预处理及其细胞培养中,所采用的预处理装置、人脐带组织、复合酶、细胞培养基、胰酶和胎牛血清等,均应符合无菌要求。检测报告:以上述实施例3培养的人脐带间充质干细胞悬浮液为检测项,送上海金域医学检验所进行流式细胞术检测,检索结果如下表一:表一流式细胞术检测结果检测项检测方法检测结果(%)指标范围cd90流式细胞术93.32准阳性标准cd123流式细胞术3.70可选阳性标准cd117流式细胞术0.00阴性标准cd34流式细胞术0.00阴性标准cd45流式细胞术0.00阴性标准hla-dr流式细胞术0.00阴性标准cd73流式细胞术98.64准阳性标准cd105流式细胞术95.56准阳性标准根据以往研究表明,人脐带间充质干细胞稳定且高表达cd29、cd44、cd90、cd105等膜表面标记分子,不表达或较低表达cd14、cd34、cd45、cd117和cd123等内皮细胞和造血细胞特异性分子。由上述表一的检测结果显示,采用本发明细胞方法培养的方法人脐带间充质干细胞,细胞阳性表达cd73、cd90和cd105等膜表面标记分子,阴性表达cd117、cd34和cd45等内皮细胞和造血细胞特异性分子,与以往研究结果一致,因此,确定本发明方法培养的细胞具有人脐带间充质干细胞的多向分化能力,表明所培养的细胞复合间充质干细胞的多向化特性。本发明所提供的人脐带间充质干细胞培养方法,首先,制备方法简便,技术稳定,重复性好;其次,采用复合酶消化法获得了单个的人脐带间充质干细胞,避免了既往的组织块法获得的细胞量少,细胞不纯的缺点,且使用复合酶代替胰酶,避免了对组织过度消化过度吹打所导致的细胞活性低、得率差的问题;最后,采用原代、传代第1天和复苏第1天增加血清浓度的方式,可以极大地提高细胞的贴壁率,进一步提高细胞活性和得率。以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1