本发明涉及生物药物活性检测领域,针对il-5或il-5rα单克隆抗体药物生物学活性测定建立了更加快速、准确的转基因细胞测活方法。
背景技术:
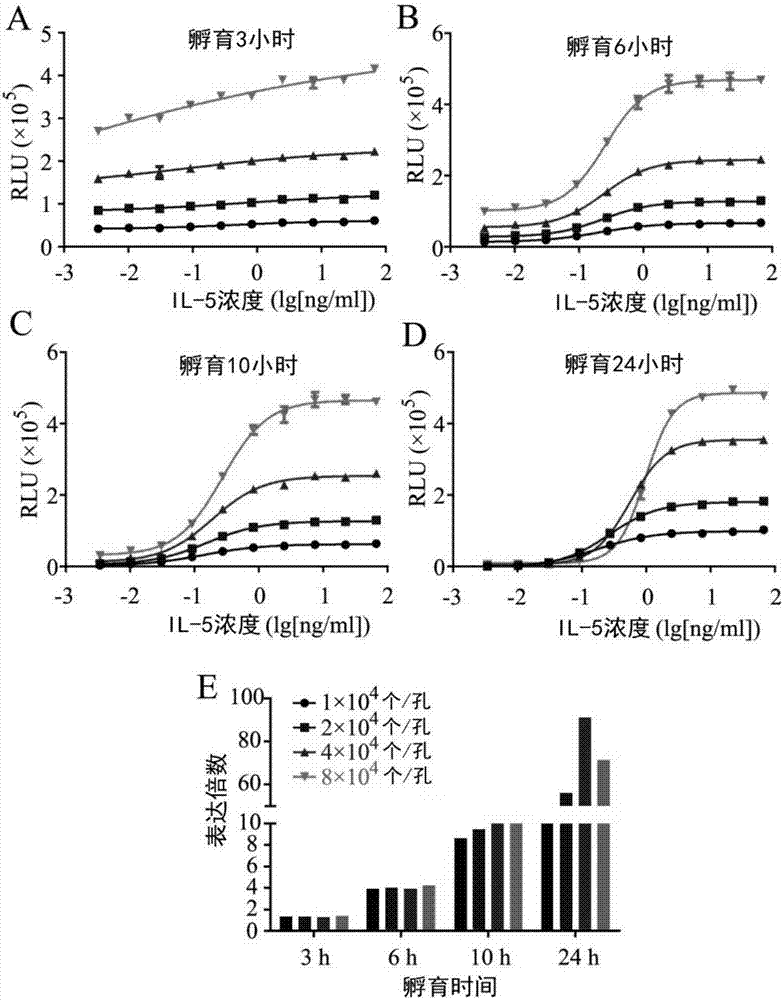
:il-5是一种细胞因子,能够调节嗜酸性粒细胞(白细胞)的生长、活化、存活,并能够为嗜酸性粒细胞从骨髓迁移至肺部及其他器官提供重要的信号。美泊利单抗(mepolizumab,商品名nucala)是一种il-5拮抗剂,于2015年11月4日获fda批准上市,用于12岁及以上年龄的患者,并与其它哮喘药物一起用于哮喘的维持性治疗。美泊利单抗与il-5结合,阻断其与il-5r的结合,使il-5信号通路不能被激活,从而减少血液和组织中嗜酸细胞性细胞的增殖和分化,可以有效减少严重哮喘病人的恶化并改善肺功能。目前美泊利单抗的生物学活性测定方法是细胞增殖抑制的方法,该方法利用对il-5有生长依赖性的人红白血病细胞系tf-1-il-5作为靶细胞,加入mepolizumab单抗和il-5,孵育43-45小时后,通过测定细胞的数量来反应美泊利单抗的生物学活性。该方法实验周期长(美泊利单抗作用时间43-45小时,加入底物后孵育时间6小时),变异较大。单克隆抗体已经成为全球医药市场的重要组成部分,并贡献了主要的市场扩容力量,2016年全球畅销药排名前十的重磅药中以阿达木单抗为首的单克隆抗体药物占据半壁江山。面对抗体类药物的快速发展,迫切需要建立相应的抗体药物质量评价技术体系,而活性测定是对药物的有效成分和含量以及药物效价的测定,是确保抗体类药物有效性的重要质控指标。目前活性检测方法多采用基于细胞的生物活性测定方法,包括细胞增殖抑制法、细胞毒性法、补体依赖的细胞毒法、抗体依赖性细胞介导的细胞毒性法和细胞elisa法等。本发明建立了快速、准确、定量的转基因细胞测活方法用以测定il-5或il-5rα抗体活性,实验周期短,避免了长时间孵育所带来的细胞污染等实践难题,并且操作简便,具有很好的应用前景和应用价值。技术实现要素:本发明提供了一种快速测定il-5/il-5rα抗体药物生物学活性的方法,所述方法包括构建得到稳定表达stat5反应元件(responseelement,re)报告基因的效应细胞,用il-5刺激激活报告基因表达,并用il-5/il-5rα抗体药物阻断il-5信号通路,根据测定的报告基因信号值拟合四参数曲线确定抗体生物学活性。本发明的目的在于提供一种快速测定il-5/il-5rα抗体药物生物学活性的方法,所述方法包括:(1)构建得到稳定表达stat5re报告基因的效应细胞;(2)将il-5/il-5rα抗体药物样品及参比品等比例稀释,将稀释后的抗体分别加入细胞板,然后加入il-5混合;(3)将(1)所述细胞加入(2)所述细胞板中,在37℃培养箱中进行孵育;(4)加入荧光素酶底物,根据测定的报告基因信号值拟合四参数曲线确定抗体生物学活性。tf-1-il-5细胞属于il-5依赖人红白血病细胞,其表面表达有il-5r(由配体结合链α链和信号转导链β链组成),il-5与il-5rα结合,活化jak/stat5、mek/mapk和pi-3k/akt信号通路,从而维持tf-1-il-5细胞的存活和增殖。将stat5反应元件序列导入tf-1-il-5细胞内,il-5与il-5r结合后激活jak2-stat5信号通路,并启动与stat5re序列连接的荧光素酶报告基因的表达。il-5/il-5rα抗体均可阻断il-5信号通路,因此抗体浓度与效应细胞中的荧光素酶表达量成反比。在本发明的实施方案中,稳定表达stat5re报告基因的效应细胞选自tf-1细胞、293细胞、中国仓鼠卵巢(cho)细胞、nso、sp2细胞、hela细胞、幼仓鼠肾(bhk)细胞、猴肾细胞(cos)、人肝癌细胞、549a细胞、3t3细胞中的任一种,优选为稳定表达stat5re报告基因的tf-1细胞。在本发明的实施方案中,报告基因为luciferase荧光素酶报告基因。在本发明的实施方案中,所述步骤(1)包括:用包含stat5re序列的报告基因载体转染tf-1细胞、293细胞、中国仓鼠卵巢(cho)细胞、nso、sp2细胞、hela细胞、幼仓鼠肾(bhk)细胞、猴肾细胞(cos)、人肝癌细胞、549a细胞或3t3细胞,并加入相应抗生素筛选得到稳定表达报告基因的单克隆细胞株。在本发明的实施方案中,稳定表达stat5re-luciferase的tf-1/stat5re-luc细胞的制备方法为,将含有stat5re-luciferase序列的载体导入tf-1细胞内。更优选的,有stat5re-luciferase序列的载体为市售的pgl4.52[luc2p/stat5re/hygro]质粒。在本发明的实施方案中,制备效应细胞悬液,按照1×104-8×104个/孔,优选2×104个/孔的细胞密度。在本发明的实施方案中,加入il-5激活报告基因表达,il-5浓度为15pg/ml-15ng/ml,优选il-5浓度为0.25ng/ml。在本发明的实施方案中,il-5/il-5rα抗体药物为市售及在研的针对il-5或il-5rα的单克隆抗体,更优选的,为mepolizumab、reslizumab、benralizumab。在本发明的实施方案中,mepolizumab单抗样品及参比品稀释起始浓度为6pg/ml-10mg/ml,优选为10μg/ml。在本发明的实施方案中,mepolizumab单抗样品及参比品系列稀释的比例为1:2-1:5,优选为1:3。在本发明的实施方案中,培养时间为6-24小时,优选为10-18小时。在本发明的实施方案中,使用荧光素酶试剂盒检测化学发光值,优选为,使用promega公司的bright-glo荧光素酶试剂盒(产品货号e2620)、biovision公司的luciferase荧光素酶报告基因检测试剂盒(产品货号k801-200)、碧云天公司的荧光素酶报告基因检测试剂盒等检测化学发光值。荧光素酶(luciferase)来自于自然界能够发光的生物,是在生物体内能够催化荧光素(luciferin)或脂肪醛氧化发光的一类酶的总称。根据来源生物种类的不同,可将荧光素酶分为萤火虫荧光素酶(fl)和细菌荧光素酶(bl)。目前,以北美萤火虫来源的荧光素酶基因应用的最为广泛,该基因可编码产生550个氨基酸的荧光素酶蛋白。fl基因来自萤火虫,在mg2+、atp、o2的参与下,催化d-荧光素(d-luciferin)氧化脱羧,产生激活态的氧化荧光素,并放出光子,产生550-580nm的荧光。荧光素酶报告基因检测是现代分子生物学研究领域中分析结构基因旁侧区域潜在的顺式元件(如启动子、增强子和沉默子等)和反式作用因子相互作用关系的一种重要工具。荧光素酶报告基因系统是以荧光素(luciferin)为底物,来检测萤火虫荧光素酶(fireflyluciferase)活性的一种报告系统。荧光素酶可以催化luciferin氧化成oxyluciferin,在luciferin氧化的过程中,会发出生物荧光(bioluminescence)然后通过化学发光仪或液闪测定仪测定。在本发明的实施方案中,在酶标仪上使用化学发光读取相对化学发光单位值(relativelightunit,rlu)通过数据处理拟合倒s型四参数曲线。倒s型四参数曲线,可反映出上下渐近线、ic50值和斜率等指标。优选的,使用softmaxpro5.4进行数据处理拟合倒s型四参数曲线。在本发明的实施方案中,通过比较样品与参比品四参数曲线的半抑制浓度(halfmaximalinhibitoryconcentration,ic50)值,得出样品的相对效价。计算公式为:相对效价=参比品ic50/样品ic50×100%。附图说明图1是不同克隆的效应细胞荧光素酶活性测定结果图2是tf-1/stat5re-luc细胞不同孵育时间和细胞密度下四参数曲线图及信噪比图图3是tf-1/stat5re-luc细胞不同il-5中和浓度和不同抗体稀释倍数下四参数曲线图图4是tf-1/stat5re-luc细胞对变性il-5抗体及其它抗体的四参数曲线图图5是本发明检测方法和增殖抑制法比较图具体实施方式下面结合具体实施例,进一步阐述本发明,仅用于解释本发明,而不能理解为对本发明的限制。本领域的普通技术人员可以理解:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商所建议的条件实施检测。实施例1稳定表达stat5re-luciferase的tf-1-il-5细胞株筛选1.1实验材料tf-1细胞来源于atcc;pgl4.52[luc2p/stat5re/hygro]质粒购买于promega公司;重组人白介素-5(il-5)购买于primegene公司;bright-glo荧光素酶试剂盒购买于promega公司。1.2质粒转染采用neontm电穿孔转染系统(invitrogen)对tf-1细胞进行pgl4.52[luc2p/stat5re/hygro]质粒转染。转染24小时后,加入100ug/mlhygromycinb进行加压筛选。待细胞密度和活力恢复后,通过有限稀释法,按照0.5个/孔的密度,铺96孔板筛选单克隆。在细胞生长期间,观察并标记哪些孔是单克隆,当单克隆孔内tf-1-il-5细胞汇合度达到30%以上时,将此孔内细胞转移至24孔板,逐步扩大培养。1.3tf-1-il-5/stat5re-luc细胞株筛选将加压筛选得到的5株tf-1-il-5/stat5re单克隆细胞按照2×104个/孔铺至384孔板,20μl/孔;il-5稀释至初始浓度33ng/ml,然后按照3倍倍比稀释11个点,加入到上述384孔内,20μl/孔;37℃,5%co2培养过夜。第二天加入steady-glo,40μl/孔,检测化学发光值。表1不同tf-1-il-5/stat5re-luc单克隆细胞对il-5的反应性参数克隆4克隆9克隆12克隆27克隆35bottom1137744296154137101183962top170500059170181400011532544119hillslope1.2310.98491.0411.0421.043ec50(ng/ml)0.42180.49120.33960.2660.2024s/b14.9913.7711.7711.4011.14结果表明,tf-1-il-5/stat5re克隆4细胞在il-5的刺激下,具有较好的反应性(见图1和表1),信号值和信噪比高,选取tf-1-il-5/stat5re克隆4细胞为实验用细胞,并命名为tf-1-il-5/stat5re-luc细胞。实施例2检测方法优化2.1孵育时间和细胞密度优化由于tf-1-il-5/stat5re-luc细胞在il-5刺激下表达荧光素酶,孵育时间的长短会影响荧光素酶的表达和分解,导致信噪比的变化,因此要探索一个较为合适的孵育时间获得较好的信噪比。设置1×104个/孔、2×104个/孔、4×104个/孔、8×104个/孔四个不同的细胞密度,分别进行il-5的刺激实验,根据测定的化学发光值拟合的四参数曲线确定最优细胞密度。方法:将tf-1-il-5/stat5re-luc细胞按1×104个/孔、2×104个/孔、4×104个/孔、8×104个/孔加入到96孔白板中;il-5初始浓度100μg/ml,1:3稀释12个浓度梯度;37℃,5%co2培养。分别在3h、6h、10h和24h加入bright-glo,检测化学发光值,根据测定的化学发光值拟合的四参数曲线以及信噪比,确定一个较为合适的孵育时间和细胞密度。结果:随着孵育时间的增长,信号值四参数曲线下平台逐渐降低(见图2),推测是因为il-5缺少,细胞死亡,因此我们选择10-18h作为孵育时间,既能保证信噪比,也能避免细胞死亡导致的信噪比虚高。细胞密度在1×104个/孔至8×104个/孔内均能得到良好的剂量反应曲线和信噪比(见图2),综合考虑信噪比和细胞用量,确定细胞密度为2×104个/孔。2.2il-5工作浓度的优化和抗体工作浓度的确定根据实施例2.1的il-5激活实验结果,il-5设置10ng/ml、1ng/ml两个不同的浓度,将抗il-5单抗自较高的浓度3倍比稀释20个浓度点。分别进行抗il-5单抗的抑制实验,根据测定的化学发光值拟合的四参数曲线确定il-5的工作浓度和抗il-5抗体工作浓度。方法:将tf-1-il-5/stat5re-luc细胞按2×104个/孔加入到96孔白板中;美泊利单抗(由中国食品药品检定研究院单克隆抗体产品室留存)初始浓度为10mg/ml,1:3梯度稀释20个浓度点,加入上述细胞板中;il-5分别稀释至10ng/ml、1ng/ml,分别转移到上述细胞板中;37℃,5%co2培养。10h-18h后加入bright-glo,检测化学发光值。结果显示,il-5浓度选择1ng/ml(终浓度为0.25ng/ml),此时能够达到很好的信噪比(见图3a),也能节省il-5用量;美泊利单抗确定起始点终浓度为40μg/ml(终浓度为10μg/ml),1:3稀释,设12个浓度点,能够保证上下平台至少各有两个浓度点,线性部分至少三个点。2.3抗体稀释倍比的优化根据2.2确定的il-5和抗体的工作浓度,分别将美泊利抗体按照1:2、1:3、1:4、1:5稀释12个浓度点,根据测定的化学发光值拟合的四参数曲线确定最优抗体稀释倍比。方法:将tf-1-il-5/stat5re-luc细胞分别按2×104个/孔加入到96孔白板中;加入1ng/ml的il-5;美泊利单抗初始浓度为40μg/ml,分别按照1:2、1:3、1:4、1:5稀释12个浓度点,转移至上述细胞板中;37℃,5%co2培养。10-18h后加入bright-glo,检测化学发光值。结果:根据四参数曲线上下平台及线性部分浓度点的分布,1:2和1:5稀释均不能得到较好的曲线,1:3、1:4稀释线性拟合均较好(见图3b),考虑的实验的操作的简易性,最终确定1:3稀释用于后续实验。实施例3检测方法的验证3.1专属性验证本方法是针对抗il-5/il-5r抗体的生物学活性方法,因此,对其专属性的验证采用了不同靶点的单抗药物:mepolizumab(靶点为il-5)、变性处理的mepolizumab、dupilumab(靶点为il-4r)、tocilizumab(靶点为il-6r)、ixekizumab(靶点为il17a)、infliximab(靶点为tnf-α)、basiliximab(靶点为cd25)、ustekinumab(靶点为il12/23)。在相同的实验条件下,利用tf-1-il-5/stat5re-luc报告基因测活体系,测定这八种单抗药物的活性。方法:将tf-1-il-5/stat5re-luc细胞按2×104个/孔加入到96孔白板中;加入1ng/ml的il-5;将八种单抗分别稀释至初始浓度40μg/ml,1:3稀释12个浓度梯度,分别转移至上述细胞板中;37℃,5%co2培养。10-18h后加入bright-glo,检测化学发光值。结果见图4:本方法对il-4r、il-6r、il-17a、il-12/23、cd25、tnf-α靶点的抗体药物(见图4b)以及变性失活的美泊利抗体(见图4a)均没有剂量效应曲线,说明本方法不适于除了il-5/il-5r靶点以外的其他药物,证明本方法专属性较好。3.2与传统方法的方法学比较目前美泊利单抗的生物学活性测定方法是细胞增殖抑制的方法,该方法依据对il-5有生长依赖性的人红白血病细胞系tf-1-il-5,加入美泊利单抗和il-5,孵育43-45小时后,通过测定细胞的数量来反应美泊利单抗的生物学活性。我们分别使用传统方法和tf-1-il-5/stat5re-luc报告基因法测定三批样品的相对效价,每个实验重复3次。转基因细胞法:将tf-1-il-5/stat5re-luc细胞按2×104个/孔加入到96孔白板中;加入1ng/ml的il-5;美泊利单抗初始浓度为40μg/ml,1:3稀释12个浓度梯度,转移至细胞板中;37℃,5%co2培养。10-18h后加入bright-glo,检测化学发光值。增殖抑制法:将tf-1-il-5细胞按5×103个/孔接种于96孔板中;加入7.5ng/ml的il-5;美泊利单抗初始浓度为2μg/ml,1:2稀释10个浓度梯度,转移至细胞板中;37℃,5%co2培养43-45小时。将alamarblue显色液以10μl/孔加入细胞板,继续培养5小时,读取激发波长为530nm,发射波长为580nm的荧光值。结果显示(见图5):转基因细胞法测定结果与传统方法增殖抑制法测定结果具有很好的一致性,且转基因细胞法的相对变异系数要低于传统方法。转基因细胞法大大减少了实验时长,能够极大的提高工作效率。当前第1页12