一种新型细胞提取液的制备方法与流程
本发明涉及细胞提取领域,具体地,涉及一种新型细胞提取液的制备方法。
背景技术:
传统的蛋白表达系统是指通过模式生物细菌、真菌、植物细胞或动物细胞等表达外源基因的一种分子生物学技术。随着科学技术的发展,无细胞表达体系也称为体外蛋白合成系统应运而生,其是以外源目的mrna或dna为蛋白质合成模板,通过人工控制补加蛋白质合成所需的底物和转录、翻译相关蛋白因子等物质,能实现目的蛋白质的合成。体外翻译系统中表达蛋白质无需进行质粒构建,转化,细胞培养,细胞收集和破碎步骤,是一种快速的,省时省力的蛋白质表达系统。
现有体外蛋白表达系统的细胞制备方法在很多方面还存在技术上的缺陷与不足:
1.细胞预处理过于简单,现有方法仅仅停留在简单的洗细胞操作,未对为对清洗细胞以及这一步的关键点有充分优化和阐释说明;另外,现有方法也没有专门涉及“冷激”、“温度控制”或其他可以增强体外翻译活性的处理步骤。
2.制备过程繁琐。
3.破碎步骤实用的仪器效率低,无法很难实现大规模制备。
4.高压均质器破碎法,仪器设备的投入和维护的费用较高(10万–100万元/台),通量小(50-500ml),要求稀释细胞浓度(100-300g/l),进而增加了后续处理工艺难度,并需要增加脱盐、浓缩等步骤,才能获得适当的反应活性。
5.含细胞壁的细胞制备时,现有方法需要较剧烈的条件破碎细胞(如高压均质器在较高的压力下破碎)或者用酶解法如破碎烟草by-2时用罗氏的液体细胞壁裂解酶对细胞进行处理,无法对温度进行有效的控制,制备工序繁琐且耗时长;
6.最后,现有方法中对制备细胞提取物的制备细节、温度偏差、处理时间、方式等均未有详尽的研究和发展。
以上的缺陷与不足造成现有的制备方法产量低,成本高,进一步造成相关的体外合成系统成本较高、目前仅限于极少数实验室内使用,严重的制约了体外蛋白制造的商业应用和工业化产业拓展。
因此,本领域迫切需要开发一种能够大规模、高效率、低成本的制备细胞提取物的方法。
技术实现要素:
本发明提供了一种能够大规模、高效率、低成本的制备细胞提取物的方法。
本发明第一方面提供了一种细胞提取物的制备方法,包括步骤:
(i)提供一细胞原料;
(ii)将所述细胞原料经低温液氮机械破碎处理,获得细胞粉;
(iii)将步骤(ii)获得的细胞粉经低温溶解、离心,从而获得所述的细胞提取物。
在另一优选例中,步骤(i)中所述的细胞原料为经冷激处理的细胞原料。
在另一优选例中,所述冷激处理的温度为0-115℃,较佳地,0-10℃,更佳地,2-8℃。
在另一优选例中,所述冷激处理时间为5min-12h,较佳地,10min-6h,更佳地,20min-1h。
在另一优选例中,所述细胞原料为细胞泥。
在另一优选例中,所述细胞原料为酵母细胞原料。
在另一优选例中,所述酵母细胞选自下组的一种或多种来源的酵母:酿酒酵母、毕氏酵母、克鲁维酵母、或其组合;较佳地,所述的酵母细胞包括:克鲁维酵母,更佳地为乳酸克鲁维酵母。
在另一优选例中,所述细胞原料由以下方法制得:
(a1)将细胞单菌落接种于培养基中进行培养,从而获得种子液;
(a2)将步骤(a1)获得的种子液接种到培养基中进行培养,离心获得细胞;
(a3)用低温洗涤液重悬所述细胞,冷激处理后获得所述的细胞原料。
在另一优选例中,所述步骤(a1)的培养基包括ypd培养基。
在另一优选例中,所述步骤(a2)的培养基包括ypd培养基。
在另一优选例中,所述步骤(a2)的培养基中含有磷酸根离子。
在另一优选例中,所述磷酸根离子的含量为5-100mm,较佳地,10-80mm,更佳地,20-70mm。
在另一优选例中,所述步骤(a2)还包括在细胞生长对数期的中后期(14-16h)离心获得细胞的步骤。
在另一优选例中,步骤(a3)中,所述低温为0-10℃,较佳地,1-8℃,更佳地,2-6℃。
在另一优选例中,所述洗涤液选自下组:4-羟乙基哌嗪乙磺酸钾(hepes),醋酸钾(koac)、醋酸镁(mgoac)、三羟甲基氨基甲烷(tris)、或其组合。
在另一优选例中,所述洗涤液中,4-羟乙基哌嗪乙磺酸钾(hepes)的浓度为5-100mm,较佳地,8-80mm,更佳地,9-60mm。
在另一优选例中,所述洗涤液中,醋酸钾的浓度为5-500mm,较佳地,10-300mm,更佳地,20-200mm。
在另一优选例中,所述洗涤液中,醋酸镁的浓度为0.1-40mm,较佳地,0.5-30mm,更佳地,0.8-10mm。
在另一优选例中,所述洗涤液的ph为6-9,较佳地,7-9。
在另一优选例中,所述步骤(i)和步骤(ii)之间还包括步骤(i’):用低温洗涤液重悬所述细胞原料,离心、清洗后,经液氮速冻,低温保存。
在另一优选例中,所述步骤(i’)中,所述低温为0-10℃,较佳地,1-8℃,更佳地,2-6℃。
在另一优选例中,所述步骤(i’)中,在-196-0℃,较佳地,-196--20℃,更佳地,-100℃--50℃的温度下进行低温保存。
在另一优选例中,所述步骤(ii)中,用液氮低温搅拌破碎机(lncryo-blender)或液氮低温粉碎机(lncryo-grinder)破碎细胞。
在另一优选例中,步骤(ii)中,破碎时间为1-30min,较佳地,2-20min,更佳地,3-10min。
在另一优选例中,步骤(ii)中,破碎细胞所用的转速为3000-45000rpm,较佳地,10000-40000rpm,更佳地,20000-30000rpm。
在另一优选例中,步骤(ii)中,破碎细胞时所用的筛网为80-1000目。
在另一优选例中,所述步骤(iii)中,用低温缓冲液溶解细胞粉5min-12h,较佳地,8min-6h,更佳地,10min-2h,更佳地,30min-2h。
在另一优选例中,所述步骤(iii)中,用低温缓冲液溶解细胞粉5-50min,较佳地,8-40min,更佳地,10-30min。
在另一优选例中,所述缓冲液包括裂解液。
在另一优选例中,所述裂解液选自下组:4-羟乙基哌嗪乙磺酸钾(hepes-k)、三羟甲基氨基甲烷(tris-na)、醋酸钾、醋酸镁、二硫苏糖醇(dtt)、苯甲基磺酰氟(pmsf)、或其组合。
在另一优选例中,所述缓冲液的ph为6-9,较佳地,7-9。
在另一优选例中,所述细胞粉与缓冲液的比例为1g:0.02-20ml,较佳地,1g:0.08-10ml,更佳地,1g:0.1-5ml。
在另一优选例中,所述缓冲液中,4-羟乙基哌嗪乙磺酸钾(hepes-k)的浓度为5-100mm,较佳地,8-80mm,更佳地,9-60mm。
在另一优选例中,所述缓冲液中,三羟甲基氨基甲烷(tris-na)的浓度为1-200mm,较佳地,5-80mm,更佳地,8-60mm。
在另一优选例中,所述缓冲液中,醋酸钾的浓度为5-300mm,较佳地,10-250mm,更佳地,30-200m。
在另一优选例中,所述缓冲液中,醋酸镁的浓度为0.1-40mm,较佳地,0.5-20mm,更佳地,0.8-10mm。
在另一优选例中,所述缓冲液中,二硫苏糖醇(dtt)的浓度为0.2-50mm,较佳地,0.5-20mm,更佳地,0.8-10mm。
在另一优选例中,所述缓冲液中,苯甲基磺酰氟(pmsf)的浓度为0.05-20mm,较佳地,0.1-10mm,更佳地,0.2-5mm。
在另一优选例中,步骤(iii)中,在低温(如0-10℃,较佳地,2-8℃,更佳地,2-4℃)下进行离心。
在另一优选例中,所述步骤(iii)中,在1-10℃(较佳地,2-6℃),5000-100000×g(较佳地,8000-30000×g)的条件下离心1-5次(优选1-3次)。
在另一优选例中,步骤(iii)中,所述离心时间为0.5min-2h,较佳地,20min-90min,更佳地,25min-80min。
在另一优选例中,所述方法还包括步骤(iv),用液氮对步骤(iii)获得的细胞提取物进行速冻,并在(-100℃--30℃,优选-80℃)下保存。
在另一优选例中,所述方法还包括步骤(v),在体外无细胞的蛋白合成体系下,用获得的所述细胞提取物进行体外活性检测。
在另一优选例中,所述体外活性检测包括体外蛋白生物合成的活性检测。
本发明第二方面提供了一种细胞提取物,所述细胞提取物用本发明第一方面所述的方法进行制备。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1是在培养基中添加50mm磷酸根对体外蛋白质合成体系的影响示意图。
图2是对收获的细胞培养液进行冷激处理对体外蛋白质合成体系的影响示意图。
图3是对常温(20-25℃)离心收获的细胞进行冷激处理对体外蛋白质合成体影响示意图。
图4是lysisbuffer比例对由生物发酵罐发酵的细胞制备的体外蛋白质合成体系的影响示意图。
图5是lysisbuffer比例对由摇瓶发酵的细胞制备的体外蛋白质生物合成体系的影响示意图。
图6是lysisbuffer成分dtt和pmsf对体外蛋白质生物合成体系的影响示意图。
图7是lysisbuffer的缓冲成分和ph值对体外蛋白质生物合成体系的影响示意图。
图8是不同溶液作为washbuffer对体外蛋白质生物合成体系的影响示意图。
图9是经典buffera中成分对体外蛋白质生物合成体系的影响示意图。
图10是washbuffer洗涤次数对体外蛋白质生物合成体系的影响示意图。
图11是在低温条件下用lysisbuffer溶解破碎后的细胞粉末时所需时间对体外蛋白质生物合成体系的影响示意图。
图12是在室温条件下用lysisbuffer溶解破碎后的细胞粉末时所需时间对体外蛋白质生物合成体系的影响示意图。
图13是提取细胞提取物时离心次数对体外蛋白质生物合成体系的影响示意图。
图14是提取细胞提取物时低速离心时离心时间对体外蛋白质生物合成体系的影响示意图。
图15是不同细胞破碎设备对体外蛋白质生物合成体系的影响示意图。
具体实施方式
经过广泛而深入的研究,通过大量筛选和摸索,首次意外地发现了一种能够大规模、高效率、低成本的制备细胞提取物的方法。本发明通过对冷激处理过的细胞原料(优选酵母细胞原料)进行低温液氮机械破碎处理,并对所获得的细胞提取物进行体外活性检测(优选体外蛋白生物合成的活性检测)。结果表明,用本发明的制备方法所获得的细胞提取物具有非常高的体外蛋白合成能力,具体地,本发明获得的细胞提取物的体外蛋白质合成体系的相对光单位值可高达1×10e8rlu-3×10e9rlu。在此基础上,本发明人完成了本发明。
细胞提取物的制备
本发明提供了一种能够大规模、高效率、低成本的制备细胞提取物的方法,具体地,本发明的细胞提取物的制备方法包括如下步骤:
(i)提供一细胞原料;
(ii)将所述细胞原料经低温液氮机械破碎处理,获得细胞粉;
(iii)将步骤(ii)获得的细胞粉经低温溶解、离心,从而获得所述的细胞提取物。
在一优选实施方式中,本发明的细胞提取物的方法具体包括以下几个步骤:
a)细胞种子的制备:挑取细胞单菌落,接种于ypd培养基中培养所得到的培养物即为种子液;
b)细胞培养:将种子液接种到ypd培养基(含20-70mm(优选50mm)po33+)中进行大规模培养,在细胞生长对数期的中后期(如14-16h),室温离心收获细胞。
c)细胞培养液收获后采用4℃预冷的洗涤液(washbuffer)(如10-40mm,ph为8.0的4-羟乙基哌嗪乙磺酸钾(hepes)、50-150mm醋酸钾、1-4mm醋酸镁)进行重悬,并进行冷激(0-8℃)处理30min,之后离心收获固态的细胞泥。
d)细胞泥收获后采用4℃预冷的洗涤液(washbuffer)(如10-40mm,ph为8.0的4-羟乙基哌嗪乙磺酸钾(hepes)、50-150mm醋酸钾、1-4mm醋酸镁)进行重悬,并进行离心,重复此步2-4次;
e)收获的清洗后细胞泥用液氮速冻后超低温(如-196℃--10℃)保存;
f)用液氮机械破碎法(比如,用液氮低温搅拌破碎机(lncryo-blender)或液氮低温粉碎机(lncryo-grinder))破碎细胞,得到的细胞粉进行分装后超低温(如-196℃--20℃)保存;
g)用4℃预冷裂解液(lysisbuffer)(如10-40mm,ph为8.0的4-羟乙基哌嗪乙磺酸钾(hepes)、50-150mm醋酸钾、1-4mm醋酸镁)去溶解细胞破碎粉,时间:20min,得到细胞粗提物;
h)把步骤f中收获的细胞粗提物在低温下进行离心1次,离心力在8000-30000g,4℃;
i)离心后,取中间层的细胞提取物,并将所得溶液速冻后,-80℃保存。
在本发明中,所述细胞的类型没有特别限制,一种优选的细胞类型为酵母细胞。
在本发明中,所述酵母细胞的类型没有特别限制,包括(但并不限于):酿酒酵母、毕氏酵母、和/或克鲁维酵母,较佳地,所述的酵母细胞包括:克鲁维酵母,更佳地为乳酸克鲁维酵母。
在本发明中,液氮机械破碎的时间和转速没有特别限制,一种优选的破碎时间1-30min,较佳地,2-20min,更佳地,3-10min;破碎细胞所用的转速为3000-45000rpm,较佳地,10000-40000rpm,更佳地,20000-30000rpm。
在本发明中,可采用任何的低温液氮机械方式破碎细胞,一种优选的破碎细胞方式为采用液氮低温搅拌破碎机(lncryo-blender)破碎细胞(专利申请号为201710310756x)。
在本发明中,采用液氮低温粉碎机(lncryo-grinder)破碎细胞时,筛网采用80-1000目。
在本发明中,所述细胞提取物的制法还包括步骤(iv),在体外无细胞的蛋白合成体系下,用获得的所述细胞提取物进行体外活性检测(优选体外蛋白生物合成的活性检测)。
用本发明的制备方法所获得的细胞提取物具有非常高的体外蛋白合成能力,具体地,本发明获得的细胞提取物的体外蛋白质合成体系的相对光单位值可高达1×10e8rlu-3×10e9rlu。
体外无细胞的蛋白质生物合成体系(优选酵母体外蛋白质生物合成体系)
本发明的细胞提取物可用于的体外活性检测包括但不限于,体外蛋白质生物合成、rna生物合成、酶反应的活性;其中体外蛋白质合成体系包括但不限于,真核细胞(如酵母),原核细胞。在本发明中,以酵母细胞体外蛋白质合成体系为例进行详细说明。
酵母细胞(yeast)兼具培养简单、高效蛋白质折叠、和翻译后修饰的优势。其中酿酒酵母(saccharomycescerevisiae)、毕氏酵母(pichiapastoris)和克鲁维酵母(kluyveromyces)是表达复杂、真核蛋白质和膜蛋白的模式生物,酵母也可作为制备体外翻译系统的原料。
克鲁维酵母(kluyveromyces)是一种子囊孢子酵母,其中的马克斯克鲁维酵母(kluyveromycesmarxianus)和乳酸克鲁维酵母(kluyveromyceslactis)是工业上广泛使用的酵母。与其他酵母相比,乳酸克鲁维酵母具有许多优点,如超强的分泌能力,更好的大规模发酵特性、食品安全的级别、以及同时具有蛋白翻译后修饰的能力等。
在本发明中,体外蛋白质生物合成体系不受特别限制,一种优选的体外蛋白质生物合成体系为酵母体外蛋白质合成体系,更佳地为克鲁维酵母表达系统,更佳地为乳酸克鲁维酵母表达系统。
在一优选实施方式中,本发明提供了一种体外的无细胞的酵母蛋白合成体系,所述合成体系包括:
(a)酵母细胞提取物;
(b)聚乙二醇;
(c)任选的外源蔗糖;和
(d)任选的溶剂,所述溶剂为水或水性溶剂。
在一特别优选的实施方式中,本发明提供的体外蛋白合成体系包括选自下组的一种或多种或全部成分:酵母细胞提取物,4-羟乙基哌嗪乙磺酸,醋酸钾,醋酸镁,腺嘌呤核苷三磷酸(atp),鸟嘌呤核苷三磷酸(gtp),胞嘧啶核苷三磷酸(ctp),胸腺嘧啶核苷三磷酸(ttp),氨基酸混合物,磷酸肌酸,二硫苏糖醇(dtt),磷酸肌酸激酶,rna酶抑制剂,荧光素,萤光素酶dna,rna聚合酶,亚精胺,血红素。
在本发明中,rna聚合酶没有特别限制,可以选自一种或多种rna聚合酶,典型的rna聚合酶为t7rna聚合酶。
在本发明中,所述酵母细胞提取物在体外蛋白合成体系中的比例不受特别限制,通常所述酵母细胞提取物在体外蛋白质合成蛋白合成体系中所占体系为20-70%,较佳地,30-60%,更佳地,40-50%。
在本发明中,所述的酵母细胞提取物不含完整的细胞,典型的酵母细胞提取物包括用于蛋白翻译的核糖体、转运rna、氨酰trna合成酶、蛋白质合成需要的起始因子和延伸因子以及终止释放因子。此外,酵母提取物中还含有一些源自酵母细胞的细胞质中的其他蛋白,尤其是可溶性蛋白。
在本发明中,所述的酵母细胞提取物所含蛋白含量为20-100mg/ml,较佳为50-100mg/ml。所述的测定蛋白含量方法为考马斯亮蓝测定方法。
在本发明中,所述的酵母细胞提取物的制备方法包括以下步骤:
(i)提供一细胞原料;
(ii)将所述细胞原料经低温液氮机械破碎处理,获得细胞粉;
(iii)将步骤(ii)获得的细胞粉经低温溶解、离心,从而获得所述的细胞提取物。
在一优选实施方式中,所述酵母细胞提取物的制备方法包括以下步骤:
a)细胞种子的制备:挑取细胞单菌落,接种于ypd培养基中培养所得到的培养物即为种子液;
b)细胞培养:将种子液接种到ypd培养基(含50mmpo33+)中进行大规模培养,在细胞生长对数期的中后期(如14-16h),室温离心收获细胞。
c)细胞培养液收获后采用4℃预冷的洗涤液进行重悬,并进行冷激(0-8℃)处理30min,之后离心收获固态的细胞泥。
d)细胞泥收获后采用4℃预冷的洗涤液进行重悬,并进行离心,重复此步2-4次;
e)收获的清洗后细胞泥用液氮速冻后超低温保存;
f)用液氮机械破碎法(比如,用液氮低温搅拌破碎机(lncryo-blender)或液氮低温粉碎机(lncryo-grinder))破碎细胞,得到的细胞粉进行分装后超低温保存;
g)用4℃预冷裂解液去溶解细胞破碎粉,时间:20min,得到细胞粗提物;
h)把步骤f中收获的细胞粗提物在低温下进行离心1次;
i)离心后,取中间层的细胞提取物,并将所得溶液速冻后,-80℃保存。
在本发明中,所述离心条件不受特别限制,一种优选的离心条件为5000-100000×g,较佳地,8000-30000×g。
在本发明中,所述离心时间不受特别限制,一种优选的离心时间为0.5min-2h,较佳地,20min-90min,更佳地,25min-80min。在本发明中,所述离心的温度不受特别限制,优选的,所述离心在1-10℃下进行,较佳地,在2-6℃下进行。在本发明中,所述的洗涤液不受特别限制,典型的所述洗涤液为具有一定渗透压的溶液,包括:10-40mm,ph为8.0的4-羟乙基哌嗪乙磺酸钾(hepes)、50-150mm醋酸钾、1-4mm醋酸镁、10-40mm三羟甲基氨基甲烷(tris)。在本发明中,所述的裂解液不受特别限制,典型的所述裂解液选自下组:10-40mmph为8.0的4-羟乙基哌嗪乙磺酸钾(hepes-k)、10-40mm三羟甲基氨基甲烷(tris-na)、50-150mm醋酸钾、1-4mm醋酸镁、2-7mm二硫苏糖醇、0.5-2mm苯甲基磺酰氟、或其组合。在本发明中,所述裂解液与细胞破碎粉的比例没有特别限制。在一优选实施方式中,所述细胞破碎粉与裂解液的比例为1g:0.02-20ml,较佳地,1g:0.08-10ml,更佳地,1g:0.1-5ml。
在本发明中,所述低温通常指温度为0-15℃,较佳地,2-10℃,更佳地,4-8℃。
所述体外蛋白质合成体系中的核苷三磷酸混合物为腺嘌呤核苷三磷酸、鸟嘌呤核苷三磷酸、胞嘧啶核苷三磷酸和尿嘧啶核苷三磷酸。在本发明中,各种单核苷酸的浓度没有特别限制,通常每种单核苷酸的浓度为0.5-5mm,较佳地为1.0-2.0mm。
所述体外蛋白质合成体系中的氨基酸混合物可包括天然或非天然氨基酸,可包括d型或l型氨基酸。代表性的氨基酸包括(但并不限于)20种天然氨基酸:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸、色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸。每种氨基酸的浓度通常为0.01-0.5mm,较佳地0.02-0.2mm,如0.05、0.06、0.07、0.08mm。
在优选例中,所述体外蛋白质合成体系还含有聚乙二醇或其类似物。聚乙二醇或其类似物的浓度没有特别限制,通常,聚乙二醇或其类似物的浓度(w/v)为0.1-8%,较佳地,0.5-4%,更佳地,1-2%,以所述蛋白合成体系的总重量计。代表性的peg例子包括(但并不限于):peg3000,peg8000,peg6000和peg3350。应理解,本发明的体系还可包括其他各种分子量的聚乙二醇(如peg200、400、1500、2000、4000、6000、8000、10000等)。
在优选例中,所述体外蛋白质合成体系还含有蔗糖。蔗糖的浓度没有特别限制,通常,蔗糖的浓度(w/v)为0.2-4%,较佳地,0.5-4%,更佳地,0.5-1%,以所述蛋白合成体系的总体积计。
在优选例中,所述体外蛋白质合成体系还含有血红素。血红素的浓度没有特别限制,通常,血红素的浓度为0.01-0.1mm,较佳地,0.02-0.08mm,更佳地,0.03-0.05mm,最佳地,0.04mm。
在优选例中,所述体外蛋白质合成体系还含有亚精胺。亚精胺的浓度没有特别限制,通常,亚精胺的浓度为0.05-1mm,较佳地,0.1-0.8mm,更佳地,更佳地,0.2-0.5mm,更佳地,0.3-0.4mm,最佳地,0.4mm。
在优选例中,所述体外蛋白质合成体系还含有缓冲剂,所述缓冲剂的成分不受特别限制,一种优选的缓冲剂含有4-羟乙基哌嗪乙磺酸、和/或tris缓冲液。在本发明中,所述缓冲剂还可含有其他缓冲成分,如醋酸钾、醋酸镁,从而形成ph为6.5-8.5(优选7.0-8.0)的反应液或反应缓冲液。在本发明中,缓冲剂的类型和含量不受特别限制。通常,缓冲剂的浓度为1-200mm或1-100mm,较佳地,5-50mm。
一种特别优选的体外蛋白质合成体系,除了酵母提取物之外,还含有选自下组的一种或多种或全部成分:22mm,ph为7.4的4-羟乙基哌嗪乙磺酸,30-150mm醋酸钾,1.0-5.0mm醋酸镁,1.5-4mm核苷三磷酸混合物,0.08-0.24mm的氨基酸混合物,25mm磷酸肌酸,1.7mm二硫苏糖醇,0.27mg/ml磷酸肌酸激酶,1%-4%聚乙二醇,0.5%-2%蔗糖,8-20ng/µl萤火虫荧光素酶的dna,0.027-0.054mg/mlt7rna聚合酶,0.03-0.04mm的血红素,0.3-0.4mm的亚精胺。
本发明的主要优点包括:
(1)本发明的细胞提取液的制备方法在细胞的预处理,破碎方法以及提取方法方面较现有技术的制备方法具有更简易,更高效,能进行大规模制备的特点。
(2)本发明的方法在细胞预处理方面,明确了低温对细胞的刺激(冷激、温度及时间长短)能明显提高细胞提取物活性的作用,进一步揭示了可能其他外界刺激对细胞处理也能达到相同或更好的效果。
(3)本发明的方法在细胞破碎方面采用了液氮机械破碎法(如,液氮低温搅拌破碎机(专利申请号201710310756x)或参数优化的液氮低温粉碎机(lncryo-grinder))破碎细胞,在细胞破碎效率和处理量上均具有明显的优势,通过简单的机器放大就很容易实现工业化生产(吨级-百吨级)。
(4)本发明的方法在细胞提取物方面通过更换裂解液成分和ph值,明显的降低了制备成本,增加了细胞提取物的活性。
(5)由于在提取之前采用先破碎细胞再与裂解液混匀提取细胞提取物的方法,较现有方法先将细胞与裂解液混匀在破碎提取细胞提取物的方法具有明显的优势:通过控制裂解液的用量即可得到适宜浓度的提取物,操作简单,无需浓缩除盐等操作。
(6)本发明通过优化低速离心的时间,能用较低的离心力在不影响活性的情况下实现大规模制备。
(7)本发明首次明确了在制备过程中温度对细胞提取物的活性的影响,大大简化了制备过程。
(8)较现有方法(1-5天)相比,采用本发明的制备方法只需4个小时即可完成细胞提取物的全部制备。
(9)采用生物发酵罐获得的细胞能明显提高单位细胞的细胞提取物的得率,说明本方面的方法在工业级制备细胞提取物具有明显的优势。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
如无特别说明,则本发明实施例中所用的材料和试剂均为市售产品。
实施例1用液氮低温搅拌破碎机破碎经摇瓶培养的细胞制备细胞提取物
1.1种子液的制备:从平板上挑取乳酸克鲁维酵母的单菌落,接种于含50mlypd培养基(ypd培养基的成分为:1%酵母提取物,2%蛋白胨,2%葡萄糖,ph5.5)的250ml的三角烧瓶中(装液量为20%,下同),并将接种好的三角烧瓶放置于摇床中培养,培养条件:温度为30℃,转速为200rpm。培养24h后得到的即为种子液;
1.2细胞的培养:按0.1-1%的接种量把1.1中制备好的种子液接种到含有400mlypd培养基的2l三角烧瓶中,并放置于摇床中培养,培养条件:温度为30℃,转速为200rpm。在细胞生长对数期的中后期(od600=3.0-6.9),结束培养,得到细胞培养液;
1.3将1.2中培养好的细胞培养物在离心机中进行离心,离心条件:3000g、10min、rt(室温20-25℃),得到细胞泥。
1.4将1.3中获得的细胞泥用100ml/l初始细胞培养液的washbuffer重悬,并在在低温(0-10摄氏度)进行冷激处理,处理时间为30min。细胞冷激过后,将细胞重悬液在低温离心机中进行离心,离心条件:3000g、5min、4℃,得到细胞泥。
1.5用预冷的washbuffer对1.4中得到的细胞泥进行重悬,washbuffer用量为100ml/l初始细胞培养液。重悬液在低温离心机中进行离心,离心条件:3000g、5min、4℃,得到细胞泥。washbuffer组成为:10-40mmph为8.0的三羟甲基氨基甲烷(tris),50-150mm醋酸钾,1-4mm醋酸镁;
1.6重复1.5步骤2-3次。
1.7将1.6步中获得的清洗后细胞泥直接进行后续操作或者采用液氮进行速冻后-80℃保存。
1.8采用液氮低温搅拌破碎机(专利申请号:201710310756x)对细胞进行破碎:在液氮低温机械破碎机,再加入离心得到的细胞泥或1.7中-80℃保存的细胞块,转速:45000rpm,破碎3-10min;将破碎好的低温粉末分装到合适的容器中,称重并储存于-80℃待用。
1.9将1.8中得到的细胞破碎粉在室温下升温至4℃,每克细胞破碎粉用0.2ml4℃预冷的lysisbuffer进行溶解,得到细胞粗提物。
1.10把步骤1.9中收获的细胞粗提物进行离心1次,离心力为8000-30000g,时间为30min,温度为4℃;
1.11离心后,取上层澄清液体即为细胞提取物。
1.12将制备好的细胞提取物分装,在液氮中速冻后于-80℃保存。
实施例2用液氮低温搅拌破碎机破碎经发酵培养的细胞制备细胞提取物
2.1一级种子培养:用-80℃冻存菌种接种于摇瓶培养基中,30℃,200rpm培养至对数生长期。
2.2二级种子培养:取适量一级种子菌液接种到二级种子,30℃,200rpm培养至对数生长期。
2.3批培养阶段:将二级种子菌液接种到发酵罐中,温度控制在30℃培养10-12h,进入补料培养阶段,当od600值为50-55时,收集细胞培养物。
2.4将2.3中培养好的细胞培养物在离心机中进行离心,离心条件:4000g、10min、rt(室温,20-25℃),得到细胞泥。
2.5将2.4中获得的细胞用100ml/l初始细胞培养液的washbuffer重悬,并在在低温(0-10摄氏度)进行冷激处理,处理时间为30min。细胞冷激过后,将细胞重悬液在低温离心机中进行离心,离心条件:4000g、5min、4℃,得到细胞泥。
2.6用预冷的washbuffer对2.5中得到的细胞泥进行重悬,washbuffer用量为100ml/l初始细胞培养液。重悬液在低温离心机中进行离心,离心条件:3000g、5min、4℃,得到细胞泥。washbuffer组成为:10-40mmph为8.0的三羟甲基氨基甲烷,50-150mm醋酸钾,1-4mm醋酸镁;
2.7重复2.6步2-3次。
2.8将2.7步中获得清洗细胞泥直接进行后续操作或者采用液氮进行速冻后-80℃保存。
2.9采用液氮低温搅拌破碎机(专利申请号:201710310756x)进行破碎:在匀浆器中加入适量液氮,再加入离心得到的细胞泥或2.8中-80℃保存的细胞块,转速:45000rpm,破碎3-10min;将破碎好的低温粉末分装到50ml离心管中,称重并储存于-80℃待用。
2.10将2.9中得到的细胞破碎粉在室温下降温至4℃,每克细胞破碎粉用0.2-1ml4℃预冷的lysisbuffer进行溶解,得到细胞粗提物。
2.11把步骤2.10中收获的酵母细胞粗提物进行离心1次,离心力为8000-30000g时间为30min,温度为4℃;
2.12离心后,取上层澄清液体即为细胞提取物。
2.13将制备好的细胞提取物分装,并在液氮中速冻后于-80℃保存。
实施例3用优化的液氮低温粉碎机破碎经发酵培养的细胞制备细胞提取物
3.1一级种子培养:用-80℃冻存菌种接种于摇瓶培养基中,30℃,200rpm培养至对数生长期。
3.2二级种子培养:取适量一级种子菌液接种到二级种子,30℃,200rpm培养至对数生长期。
3.3批培养阶段:将二级种子菌液接种到发酵罐中,温度控制在30℃培养10-12h,进入补料培养阶段,当od600值为50-55时,收集细胞培养物。
3.4将3.3中培养好的细胞培养物在离心机中进行离心,离心条件:4000g、10min、rt(室温,20-25℃),得到细胞泥。
3.5将3.4中获得的细胞用100ml/l初始细胞培养液的washbuffer重悬,并在在低温(0-10摄氏度)进行冷激处理,处理时间为30min。细胞冷激过后,将细胞重悬液在低温离心机中进行离心,离心条件:4000g、5min、4℃,得到酵母细胞。
3.6用预冷的washbuffer对1.4中得到的细胞进行重悬,washbuffer用量为100ml/l初始细胞培养液。重悬液在低温离心机中进行离心,离心条件:3000g、5min、4℃,得到细胞。washbuffer组成为:10-40mmph为8.0的三羟甲基氨基甲烷(tris),50-150mm醋酸钾,1-4mm醋酸镁;
3.7重复3.5步2-3次。
3.8将3.6步中获得的酵母细胞直接进行后续操作或者采用液氮进行速冻后-80℃保存。
3.9采用优化的液氮低温粉碎机进行破碎:用液氮对液氮低温粉碎机进行充分预冷,再加入离心得到的酵母细胞或3.7中-80℃保存的酵母细胞,筛网目数为300,转速为4800rpm;将破碎好的低温粉末分装到合适的容器中,称重并储存于-80℃待用。
3.10将3.9中得到的酵母细胞破碎粉在室温下降温至4℃,每克细胞破碎粉用0.8ml4℃预冷的lysisbuffer进行溶解,得到酵母细胞粗提物。
3.11把步骤3.10中收获的酵母细胞粗提物进行离心1次,离心力为8000-30000g时间为30min,温度为4℃;
3.12离心后,取上层澄清液体即为细胞提取物。
3.13将制备好的细胞提取物分装,并在液氮中速冻后于-80℃保存。
实验结果
1.在培养基中添加50mm磷酸根对体外蛋白质生物合成体系的影响
从图1可以看出,在相同的制备条件和体外蛋白质合成体系的情况下,利用含有50mm磷酸根的培养基培养的酵母细胞制备得到的酵母提取液的体外蛋白质合成体系的相对光单位值(relativelightunit,rlu)为5.708×10e7rlu,而利用不含有磷酸根的培养基培养酵母细胞制备得到的酵母提取液的体外蛋白质合成体系的相对光单位值为4.89×10e7rlu,无dna本身阴性对照的活性分别为1183rlu。由此可见,在培养基中添加50mm磷酸根能明显增强酵母提取液的体外蛋白合成能力。
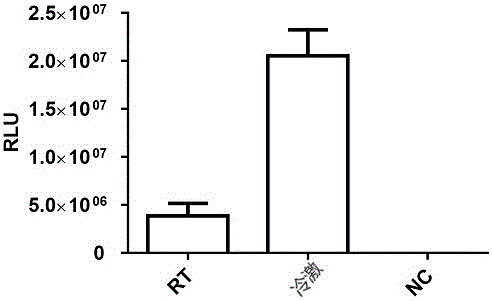
2.对收获的发酵菌液进行冷激处理对体外蛋白质合成体系的影响
从图2可以看出,在相同的制备条件和体外蛋白质合成体系的情况下,当收获发酵液后在室温(rt,20-25℃)处理时制备得到的酵母提取液的体外蛋白质合成体系的相对光单位值为3.87×10e6rlu,而当收获发酵液后在0-10摄氏度处理时制备得到的酵母提取液的体外蛋白质合成体系的相对光单位值为2.055×10e7rlu,无dna本身阴性对照的活性分别为1183rlu。由此可见,对收获的发酵菌液进行冷激处理能非常明显地增强酵母提取液的体外蛋白合成能力。
3.对常温离心收获的细胞进行冷激处理对体外蛋白质生物合成体系的影响
从图3可以看出,在相同的制备条件和体外蛋白质生物合成体系的情况下,在离心收获细胞之前对细胞进行冷激处理30min(a),在室温收获细胞之后进行冷激处理30min(b),在室温收获细胞之后进行冷激处理8h(c)和在室温收获细胞之后进行冷激处理24h(d)制备得到的酵母提取液的体外蛋白质合成体系的相对光单位值分别为1.7686×10e8rlu,1.9033×10e8rlu,2.1267×10e8rlu和1.6800×10e8rlu,均没有较大差异活性,无dna本身阴性对照的活性分别为1183rlu。由此可见,采用室温收获细胞后冷激的工艺能获得与发酵液进行冷激后低温收获细胞的工艺一样,甚至更好的效果。
4.裂解液(lysisbuffer)比例对由生物发酵罐发酵的细胞制备的体外蛋白质合成体系的影响
从图4可以看出,在相同的制备条件和体外蛋白质合成体系的情况下,对于发酵罐发酵的酵母细胞破碎后用0.6ml和0.8ml的lysisbuffer/每克细胞破碎物的比例制备出的酵母提取液的活性最高,活性分别是1.4455×10e8rlu和1.3148×10e8rlu。
5.lysisbuffer比例对由摇瓶发酵的细胞制备的体外蛋白质合成体系的影响
从图5可以看出,在相同的制备条件和体外蛋白质合成体系的情况下,对于摇瓶发酵的酵母细胞破碎后用0.2mllysisbuffer/每克细胞破碎物的比例制备出的酵母提取液的活性最高,为2.8699×10e8rlu。
6.lysisbuffer中的成分dtt和pmsf对体外蛋白质合成体系的影响
从图6可以看出,在相同的制备条件和体外蛋白质合成体系的情况下,在lysisbuffer含有dtt、pmsf(a),lysisbuffer只含有dtt(b),lysisbuffer只含有pmsf,lysisbuffer不含dtt和pmsf(d)这几种条件下,制备得到的酵母提取液的体外蛋白质合成体系的相对光单位值分别为:2.2610×10e8rlu,2.5167×10e8rlu,2.2500×10e8rlu和2.2500×10e8rlu,没有较大差异。
7.lysisbuffer的缓冲成分和ph值对由体外蛋白质合成体系的影响
从图7可以看出,在相同的制备条件和体外蛋白质合成体系的情况下,用ph为8.0的lysisbuffer制备处理的酵母提取物的的体外蛋白质合成体系的相对光单位值为2.0467×10e8rlu,而用ph为7.4的lysisbuffer制备处理的酵母提取物的的体外蛋白质合成体系的相对光单位值为1.2403×10e8rlu,用ph为8.0的lysisbuffer制备出来的酵母提取液能显著的提高其体外蛋白质合成体系的活性。同时分别用以hepes和tris为缓冲成分的lysisbuffer制备的制备处理的酵母提取物的的体外蛋白质合成体系的相对光单位值均无显著差异。由此可见,用ph值为8.0的lysisbuffer制备酵母提取物能非常明显地增强酵母提取液的体外蛋白合成能力。
8.不同溶液作为洗涤液(washbuffer)对体外蛋白质合成体系的影响
从图8可以看出,在相同的制备条件和体外蛋白质合成体系的情况下,分别用缓冲液a(buffera:koac,hepes,mgoac),超纯水(ultrapurewater,h2o),新鲜的ypd培养基(ypd)作为洗涤液(washbuffer)。用buffera为washbuffer制备处理的酵母提取物的的体外蛋白质合成体系的相对光单位值为1.4467×10e8rlu,用h2o为washbuffer制备处理的酵母提取物的体外蛋白质合成体系的相对光单位值为1.032×10e7rlu,用ypd为washbuffer制备处理的酵母提取物的的体外蛋白质合成体系的相对光单位值为1.2500×10e8rlu。同时用buffera和h2o作为washbuffer制备处理的酵母提取物的活性具有显著的差异,而用ypd作为washbuffer制备处理的酵母提取物的活性较buffera的稍低。由此可见,对收获的细胞进行洗涤处理时用具有一定渗透压的缓冲液能非常明显地增强细胞提取液的体外蛋白合成能力。
9.经典buffera中成分对体外蛋白质合成体系的影响
从图9可以看出,在相同的制备条件和体外蛋白质合成体系的情况下,缓冲液的成分分别为:koac+hepes+mgoac;koac+mgoac;koac+tris+mgoac。同时分别用以上三种缓冲液所制备的酵母提取物的体外蛋白质合成体系的相对光单位值无显著差异分别为1.5567×10e8rlu,1.5000×10e8rlu和1.7133×10e8rlu,无显著差异。
10.washbuffer洗涤次数对体外蛋白质合成体系的影响
从图10可以看出,在相同的制备条件和体外蛋白质合成体系的情况下,洗涤细胞的次数分别为:0、1、2、3。用washbuffer洗涤0次所制备的酵母提取物的体外蛋白质合成体系的相对光单位值为,,3.31×10e6rlu。用washbuffer洗涤1、2、3次所制备的酵母提取物的体外蛋白质合成体系的相对光单位值无显著差异分别为9.22×10e6rlu,8.04×10e6rlu和8.91×10e6rlu。由此可见,对收获的细胞进行洗涤处理能非常明显地增强酵母提取液的体外蛋白合成能力。
11.在低温条件下用lysisbuffer溶解破碎后的细胞粉末时所需时间对体外蛋白质合成体系的影响
从图11可以看出,在相同的制备条件和体外蛋白质合成体系的情况下,在低温条件下(0-10摄氏度)细胞破碎物和lysisbuffer混合时间为0.5h,1h,2h,6h和12h。从图可知混合时间在1-2h时酵母提取物的活性达到最高,其体外蛋白质合成体系的相对光单位值最高为3.660×10e7rlu,随着时间长酵母提取物的活性降低但在12h依然能保持较高的活性。
12.在室温条件下用lysisbuffer溶解破碎后的细胞粉末时所需时间对体外蛋白质合成体系的影响
从图12可以看出,在相同的制备条件和体外蛋白质合成体系的情况下,在室温条件下细胞破碎物和lysisbuffer混合时间为0.5h,1h,2h,6h和12h。从图可知混合时间在1h时酵母提取物的活性达到最高,其体外蛋白质合成体系的相对光单位值均为6.24×10e6rlu,随着时间长酵母提取物的活性迅速降低。
对比图11和图12,在室温下混合所制备的酵母提取物的活性明显比在低温混匀制备的酵母提取物的活性低,且在2h后基本失去活性,由此可见在制备酵母提取物的过程中保持低温是很重要的。
13.提取酵母细胞提取物时离心次数对体外蛋白质合成体系的影响
从图13可以看出,在相同的制备条件和体外蛋白质合成体系的情况下,在提取酵母细胞提取时离心1次和2次的条件下获得的酵母细胞提取物的体外蛋白质合成体系的相对光单位值分别为2.58×10e6rlu和2.62×10e6rlu,无显著差异。
14.提取酵母细胞提取物时低速离心时离心时间对体外蛋白质合成体系的影响
从图14可以看出,在相同的制备条件和体外蛋白质合成体系的情况下,在提取酵母细胞提取时离心力采用12,000g、时间为75min的条件下制备得到的酵母提取物的体外蛋白质合成体系的相对光单位值与在离心力为30,000g、时间为30min的条件下制备得到的酵母提取物的体外蛋白质合成体系的相对光单位值分别为8.705×10e7rlu和8.714×10e7rlu,达到了相同的效果。由此可见,在低速一定的时间也能达到较好的提取效果,提高了单批次的产量,为较大规模的生产奠定基础。
15.不同细胞破碎设备对体外蛋白质合成体系的影响
从图15可以看出,在相同的制备条件和体外蛋白质合成体系的情况下,在提取酵母细胞提取时细胞破碎采用液氮低温搅拌破碎机(lncryo-blender)、时间为5min的条件下制备得到的酵母提取物的体外蛋白质合成体系的相对光单位值为9.5172×10e8rlu与采用液氮低温粉碎机(lncryo-grinder)、300目筛网的条件下制备得到的酵母提取物的体外蛋白质合成体系的相对光单位为9.9329×10e8rlu,无显著差异。由此可见,液氮低温搅拌破碎机(lncryo-blender)与液氮低温破碎机(lncryo-grinder)能达到相同的破碎效果。
对比例1
采用实施例1的方法制备细胞提取物,区别在于,采用高压破碎法破碎细胞,结果显示,采用高压破碎法所制备得到的酵母提取物的体外蛋白质合成体系的相对光单位值仅为2×10e4rlu。
对比例2
采用实施例1的方法制备细胞提取物,区别在于,采用液氮钢珠方法破碎细胞,结果显示,采用液氮钢珠方法所制备得到的酵母提取物的体外蛋白质合成体系的相对光单位值仅为1×10e4-10e5rlu。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!