应用于肝细胞癌的一组实时定量PCR相对定量的内参基因及其筛选方法与流程
本发明涉及基因技术领域,特别涉及应用于肝细胞癌的一组实时定量pcr相对定量的内参基因及其筛选方法。
背景技术:
基因表达检测是分子生物学研究的重要手段,实时定量pcr(qrt-pcr)作为一种可以精确定量基因表达水平的研究策略,近年来得到广泛应用。qrt-pcr可分为绝对和相对定量,相对定量法由于具有灵敏度高、重复性好、易于操作和结果可靠等特点,应用更为广泛。基于2-δδct的计算策略是目前用来获取两个转录本间表达水平差异最常见的相对定量方法。该方法需要以在表达体系中基本恒定不变的内参基因作为对照,且待研究基因与内参基因具有基本一致的扩增效率前提下进行检测和计算。我们首先通过在10种人肝细胞癌(hcc)细胞系的48张全基因组表达谱芯片数据中初筛到19个表达最稳定的候选内参基因,再加上4个目前公认的内参基因actb、gapdh、hprt1和tubb,一起在9种hcc细胞系中进行其表达量稳定性的qrt-pcr评估。将测量到的ct值用迭代排除法进行reffinder整合分析,评估出tfg和sfrs4以其最佳的表达稳定性,可作为hcc细胞系qrt-pcr新的内参基因。常用的actb稳定性表现位居第三,可作为传统的备选内参,而gapdh、hprt1和tubb则在表达稳定性上不能达到在hcc细胞系中作为内参基因使用的要求。
技术实现要素:
本发明公开一种实时定量pcr相对定量的内参基因及其筛选方法,本发明得到tfg和sfrs4可作为肝细胞癌细胞株研究中较稳定的内参基因。
为解决上述技术问题,本发明通过如下技术方案实现:
一种实时定量pcr相对定量的内参基因,其特征在于:所述的内参基因为tfg和sfrs4中的一种,所述内参基因作用于肝细胞癌细胞系。
一种内参基因的筛选方法,包括如下步骤:
(1)全基因表达谱芯片数据收集以及候选内参基因初步筛选;
(2)选取细胞株进行传代培养,提取细胞株rna并进行cdna合成;
(3)定量pcr引物设计及引物扩增效率检验;
(4)定量pcr后对候选基因表达稳定性评估。
所述步骤(1)中采用以细胞种类为单元进行数据筛选,基因在10种肝癌细胞系中的表达量均以平行测量mas5.0信号值的算术平均为代表。筛选标准主要依据基因在10种肝癌细胞中表达量的变异系数cv<0.11,且基因具有一定的表达水平
所述步骤(2)选取细胞株为肝细胞癌细胞株:huh-7、hep3b、plc/prf/5、mhcc-97l、mhcc-97h、hcclm3、snu-398、snu-449、snu-475。除huh-7来自hcv感染的肝癌病人外,其余细胞株均来自于hbv感染的肝癌病人。
所述huh-7、hep3b、plc/prf/5、mhcc-97l、mhcc-97h、hcclm3在10%胎牛血清的dmem培养基中进行传代和培养,所述snu-398、snu-449、snu-475在10%胎牛血清的rpmi1640培养基中进行传代、培养,所述细胞均在5%二氧化碳培养箱中于37℃孵育培养。
所述步骤(2)中提取细胞株rna并进行cdna合成步骤包括每种细胞系收集5×106细胞,按照说明书操作方法利用trizol试剂提取细胞内总rna,随后进行dna酶i处理和cdna反转录。
所述步骤(3)中定量pcr引物设计通过perlprimerv1.1.16、ncbiprimerblast、ncbiprimerblast、文献和引物库进行基因引物设计,所引物扩增效率检验采用标准曲线法检验候选基因扩增引物的扩增效率,取一定量的模板cdna,进行5个梯度稀释后,建立各个候选基因的标准曲线,根据斜率通过公式e=10-1/slope计算出特定引物的扩增效率,选取扩增效率1.8~2.1之间的候选基因引物进行下一步定量复验。
所述步骤(4)中定量pcr在肝癌细胞株中开展3次生物学重复的qrt-pcr复验,获取到不同细胞株中候选基因的ct值,所述候选基因表达稳定性评估采用了四种不同的算法genorm、normfinder、deltact和bestkeeper及其稳定性指数整合工具reffinder对候选内参基因稳定性进行打分,并最终的整合结果。由于一些算法是全局依赖性的,即某个基因的稳定性得分会随着参与计算的其它基因的不同而改变,我们采用了迭代排除法逐次去掉最不稳定的一个基因,直至候选列表缩减到只剩最后两个基因为止。
本发明的有益效果是:
1、本发明得到tfg和sfrs4可作为hcc细胞株研究中更稳定的内参基因。
2.本发明筛选出的内参基因是用于不同hcc细胞系之间,而不是不同扰动胁迫状态之间的。
附图说明
图1:是本发明分别在基因和探针水平筛选出的基因列表。
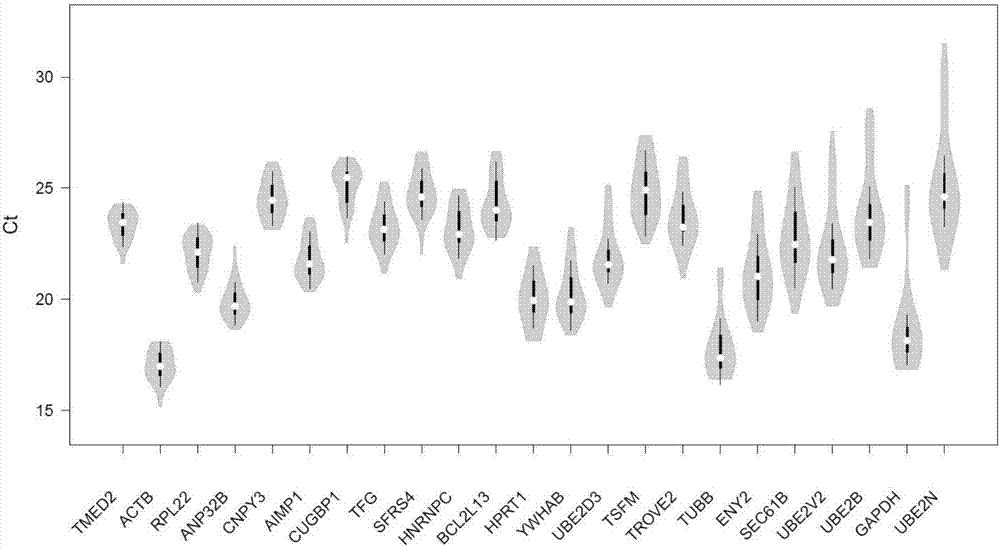
图2:是本发明23个候选内参基因ct值的小提琴图,基因从左至右按ct值标准差升序排列(白色圈显示中位数,方框上下限分别显示上下四分位数)。
图3:本发明候选内参基因通过reffinder软件进行循环评估结果,每轮循环去掉上一轮评估中最不稳定的基因直至最后剩下两个稳定基因。
图4:本发明候选内参基因通过reffinder(列2)以及其整合的四种算法(列3-5)计算出的最终不稳定性得分(越小越稳定)。
具体实施方式
下面结合实施例,对本发明作进一步说明:
实施例1
收集了10种hcc细胞株(系)共48张affymetrixhgu133plus2.0array全基因组表达谱芯片的数据如表1、2所示。其中mhcc-97l、mhcc-97h、hcclm3、hcclm6和hep3b的两张芯片数据集是由自主研发产出,huh-7、plc/prf/5、snu-398、snu-449、snu-475和hep3b的3张芯片数据来自于公共数据集arrayexpess和geo。由于每种细胞内部平行测量芯片数目不同,为避免权重差异,采用以细胞种类为单元进行数据筛选。基因在10种肝癌细胞系中的表达量均以平行测量mas5.0信号值的算术平均为代表。筛选标准主要依据基因在10种肝癌细胞中表达量的变异系数cv<0.11,且基因具有一定的表达水平
表1.筛选候选内参基因的全基因组表达谱芯片数据集
表2.候选内参基因的全基因组表达谱芯片基因表达强度数值。粗体显示满足筛选条件(cv<0.11,
评估结果:上表中所列基因即为通过全基因组表达谱芯片分析,初筛满足条件的候选内参基因(另加上四个经典内参actb、gapdh、hprt1和tubb)。
实施例2
包括如下9株肝细胞癌细胞株huh-7、hep3b、plc/prf/5、mhcc-97l、mhcc-97h、hcclm3、snu-398、snu-449、snu-475。huh-7、hep3b、plc/prf/5、mhcc-97l、mhcc-97h、hcclm3在10%胎牛血清的dmem培养基中进行传代和培养。snu-398、snu-449、snu-475在10%胎牛血清的rpmi1640培养基中进行传代、培养。每种细胞系收集5×106细胞,按照说明书操作方法利用trizol试剂提取细胞内总rna,随后进行dna酶i处理和cdna逆转录。
16种基因的引物通过perlprimerv1.1.16设计,包括aimp1、anp32b、bcl2l13、cnpy3、cugbp1、eny2、hnrnpc、rpl22、sec61b、sfrs4、tfg、tmed2、trove2、ube2d3、ube2v2和ywhab。tsfm和ube2b的引物通过ncbiprimerblast设计。ube2n和gapdh的引物通过primerpremier5.0设计。actb的扩增引物取自文献。hprt1(164518913c1)和tubb(34222261c1)的引物选自primerbank。采用标准曲线法检验候选基因扩增引物的扩增效率,取一定量的模板cdna,进行5个梯度稀释后,建立各个候选基因的标准曲线,根据斜率通过公式e=10-1/slope计算出特定引物的扩增效率,选取扩增效率1.8~2.1之间的候选基因引物(表3)进行下一步定量复验。
表3.qrt-pcr验证基因稳定性的引物列表
实施例3
通过对10个细胞株的48张全基因组表达谱芯片数据分别进行基因和探针水平的基因表达稳定性和表达强度分析,从中筛选出19个候选基因进行后续验证具体结果如图1所示。
实施例4
通过对9个细胞株进行qrt-pcr检测23个候选内参基因的ct值,并进行3次生物学重复。所得到的ct值利用整合了四种基础算法的reffinder在线软件进行表达稳定性评估。具体结果如图2、3、4所示。
筛选结果:得出tfg和sfrs4可作为hcc细胞株研究中较稳定的内参基因。常用的内参基因的表达稳定性经过评估后发现actb可作为表达内参进行应用,而gapdh、hprt1和tubb则不适合作为hcc研究相关的内参基因。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等同物界定。
- 还没有人留言评论。精彩留言会获得点赞!