蜜环菌筛选标记及构建转基因菌株的方法与流程
本发明涉及蜜环菌的筛选标记和农杆菌介导的蜜环菌转基因方法,本发明属于真菌分子基因工程领域。
背景技术:
蜜环菌属(armillaria(fr.:fr.)staude.),又名榛蘑、蜜环蕈、青冈蕈,是一类重要的药食兼用真菌,与天麻共生,是天麻赖以生存的支柱。蜜环菌生长的好坏直接影响到天麻接菌状况以及产量和品质。除了为天麻的生长提供营养外,蜜环菌及其发酵产物还具有与天麻相似的药理作用,包括催眠镇静、调节血液循环、增强免疫能力、清除自由基、延缓衰老,抑制肿瘤等生物活性,而且蜜环菌含有多种类型次生代谢产物,具有良好的经济价值。因此,蜜环菌成为科学工作者最为关注。
到目前为此,随着基因工程的迅速发展和转基因技术体系的日益完善,基因工程为培育出高产、优质、抗病虫、抗逆境的优良品种开辟了新途径,其中研究最为清楚和应用最成功的是农杆菌介导的遗传转化,在已获得近200种转基因植物中约80%是农杆菌介导完成的。农杆菌转化法是利用农杆菌在自然条件下趋化性地感染大多数双子叶植物和裸子植物的受伤部位,把目的基因转入到宿主细胞中而获得转基因植物。针对植物细胞特性,在农杆菌转化时切出受伤的切口进行转化。
目前,有关天麻蜜环菌的研究主要集中在蜜环菌筛选、天麻蜜环菌的培养条件优化、蜜环菌对天麻产量的影响以及蜜环菌天麻共生关系等生理生化方面,而对蜜环菌的基因表达、活性物质的生物合成及与天麻营养物质交流等的分子机理研究较少。
技术实现要素:
本发明的目的在于提供一种潮霉素的新用途,即潮霉素在作为蜜环菌筛选标记中的应用。
本发明另一目的是提供一种构建转基因蜜环菌菌株的方法,菌丝的生长是通过在菌丝尖端凝集新的质膜、通过分泌囊包胞吐作用合成新细胞壁。菌丝生长极性仅发生在菌丝顶端,新形成的细胞壁仅在菌丝顶端1µm以内的区域合成,这与植物的受伤部位生长过程相似,而且如果将真菌菌丝打断,菌丝又可以继续生长,农杆菌将可对蜜环菌菌丝进行转化。将带有egfp基因的真核表达载体ph2gw7-35s-egfp通过农杆菌介导法转入到蜜环菌体内,将转染后的菌丝体在含有筛选标记潮霉素的pda固体培养中培养,得到抗潮霉素的转基因蜜环菌。
为了实现本发明的目的,本发明提供如下的技术方法:
1、不同浓度不同种类的抗生素处理蜜环菌
培养基为pda:马铃薯200g、葡萄糖20g、琼脂20g、加水定容到1000ml。
在pda平板中分别加入氨苄青霉素(amp)、卡那霉素(km)、状观霉素(spe)和潮霉素(hyg),每种抗生素浓度梯度为:0µg/ml(ck)、50µg/ml、100µg/ml150µg/ml、200µg/ml、250µg/ml;培养5天后观察蜜环菌的生长情况;蜜环菌能够在所有梯度浓度amp,km和spe抗生素上生长,但不能在含有潮霉素的培养基上生长;潮霉素完全能够抑制蜜环菌的生长。
2、蜜环菌培养
将蜜环菌株接种于斜面培养基pda中,待菌丝体布满斜面后,转接于液体培养基中,摇床中培养出菌丝体。
3、表达载体转化农杆菌及转基因蜜环菌筛选
构建真核表达载体ph2gw7-35s-egfp,通过电转化法将表达载体转入农杆菌pmp105菌中,经壮观酶素(spe)筛选得到阳性克隆,经菌液pcr检测阳性克隆中是否含有外源基因egfp表达载体ph2gw7-35s-egfp质粒;然后通过农杆菌介导的遗传转化法转染蜜环菌菌丝体,将转染后的菌丝体在含有筛选标记潮霉素(hyg)的pda固体培养中培养,得到的能够抗hyg的转基因蜜环菌菌丝。
4、转基因蜜环菌的检测
经hyg筛选能够抗hyg在平板中长成的菌丝在显微镜下观察报告基因gfp表达情况;提取转化子的基因组dna,pcr鉴定转化子;发现野生对照组发绿色的荧光,而转基因实验组在绿色荧光的中间出现了青白色的荧光,而且提取其菌丝体的基因组进行pcr扩增,能够扩增出目的大小相同的条带,拿到公司去测序与原目的基因100%相似。
本发明相对于现有技术的优点和技术效果如下:
本发明蜜环菌筛选标记为进一步研究蜜环菌转基因方法提供了更好的研究手段,为通过基因工程方法对蜜环菌和天麻深入分子机理的研究奠定了理论和实验基础。与此同时,本发明中所获得的结果能够为我们通过基因工程手段来改造蜜环菌奠定理论基础以及提供了实验方法。
附图说明
图1为本发明amp、km、spe、hyg抗生素筛选及浓度梯度变化示意图;
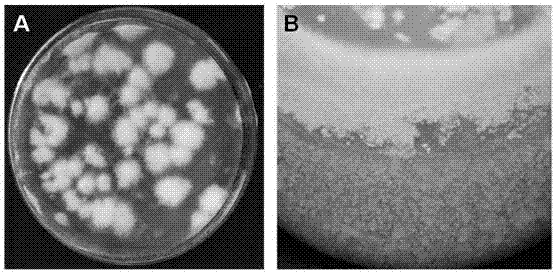
图2为本发明蜜环菌培养;其中;图a-固体基上培养的蜜环菌;图b-液体培养基培养出蜜环菌;
图3真核表达载体ph2gw7-35s-egfp双酶切检测图;m为dl10000dnamarker;1-2为pentr*-t-egfp重组质粒;3为ph2gw7质粒;4-6,8-9为ph2gw7-35s-egfp重组质粒bamhi和xhoi双酶切;7为未加质粒的阴性对照;
图4为本发明转基因蜜环菌显微镜检测图;a:40倍显微镜观察的蜜环菌菌丝图;b:40倍显微镜下转基因蜜环菌菌丝图;
图5为本发明转化子pcr鉴定电泳示意图;m:dl2000dnamarker;1:野生型对照;2-3:转化子基因组pcr。
具体实施方式
本实施中采用的试剂主要为分子生物学实验试剂。各种限制性内切酶、taqdna聚合酶、dntp等为日本宝生物工程有限公司(大连)产品,质粒的提取试剂盒购自博大泰克生物技术有限工程。其余试剂均为国产分析纯。
仪器均为分子生物学以及基因工程实验室常用仪器。所有引物序列均由擎科生工公司合成。本发明实施例中所用方法如无特别说明均为常规方法。
实施例1:蜜环菌抗生素筛选
培养基为pda:马铃薯200g、葡萄糖20g、琼脂20g、加水定容到1000ml。在pda平板中分别加入氨苄霉素amp、卡那霉素km、状观霉素spe、潮霉素hyg,浓度分别为:0µg/ml(ck)、50µg/ml、100µg/ml150µg/ml、200µg/ml、250µg/ml培养5天后拍照观察蜜环菌的生长情况如图1,结果显示蜜环菌能够在所有梯度浓度amp,km和spe抗生素上生长,但不能在含有潮霉素的培养基上生长。
实施例2:蜜环菌的固体培养基和液体培养基上的培养
将蜜环菌株接种于斜面培养基pda中,在26-27℃下培养10天左右,待菌丝体布满斜面后(图2a),转接于液体培养基中,静置2天,在摇床振荡培养5天,菌球长好后(图2b)4℃保存备用。从固体培养基中看到单菌落菌丝,挑取菌丝到液体培养基后出现了菌球布满液体培养基。
实施例3:表达载体ph2gw7-35s-egfp转化农杆菌
目的基因序列egfp(如seqidno:1);分别用xhoi和bamhi酶将纯化的pentr*-2b和pmd18-t-egfp质粒切开,通过琼脂糖凝胶电泳分离已切开的载体和插入片段,回收pentr*-2b被切割后产生的载体片断pentr*(3.8kb)及pmd18-t-egfp被切割产生的dna片断egfp(0.717kb),然后用宝生物(takara)的连接酶试剂盒连接pentr*和egfp产生中间载体pentr*-t-egfp;用连接反应混合物转化高效率(108)的大肠杆菌感受态细胞(dh5α天根生化科技),把转化好的大肠杆菌涂于加有卡那霉素(km,50μg/ml)的平板上,于37℃过夜培养,筛选km抗性重组子菌落,从km抗性重组子菌落中提取质粒,用xhoi和bamhi双酶切检测。为了检测选出的重组质粒是否连接有正确的目的条带egfp,以egfp序列为模板,根据egfp基因序列设计一对(egfp-f5'-ggatccatggtgagcaagggcgagg-3'和egfp-r5'-ctcgagttacttgtacagctcgtccatgcc-3')特异性引物(由擎科生工公司合成)。用egfp上下游的特异性引物进行pcr(扩增条件:反应条件为:94℃预变性3min,94℃变性30s,57℃解链30s,72℃延伸45s;20个循环;72℃再延伸10min);再电泳检测,同时拿到擎科生工公司测序。筛选出带有目的条带的载体质粒通过gateway技术的lr反应把pentr*-t-gfp亚克隆到植物表达载体ph2gw7,0(gateway的目的载体,比利时vib/gent公司)上。把转化好的大肠杆菌涂于加有状观霉素(spe,100μg/ml)的平板上,于37℃过夜培养,筛选spe抗性重组子菌落,从抗性重组子菌落中提取质粒,用xhoi和bamhi双酶切检测;然后拿到擎科生工去测序。
取少量(0.2-0.3μl)已经构建成功的载体质粒加入农杆菌感受态细胞clc58(ppmp90)中,轻轻混匀;将混合物加入到冰上预冷的电转杯中,轻轻敲击杯身使混和液至杯底;将电转化杯置于电转化仪滑槽中,按“pulse”电击后,立即取出电转化杯,迅速加入0.5mlsoc培养基,混匀,转移到1.5ml的离心管中;28℃、200rpm摇床培养3-5h;室温下,7500rpm离心1min,弃其上清至100μl将细胞悬浮;将细菌涂布带有抗生素(spe)的lb固体培养基上,28℃培养1.5-2天即可见菌落。挑取单菌落到液体lb培养中培养过夜提取质粒(酶切检测如图3)并保存菌种。图3可以说明4-6,8-9质粒酶切后与1和2同时出现了750bp左右的条带,而与阴性对照则不同,可能成功连接了gfp基因。拿到公司去测序发现连接的目的条带与egfp序列完全相同。因此说明带有目的基因的表达载体已经成功的转入了农杆菌中。
实施例4:用含有ph2gw7-t-egfp表达载体的农杆菌介导蜜环菌遗传转化及检测
将菌丝培养物用均质仪打碎,分装,静置避光培养4d;将培养好的菌丝再次用均质仪打碎,4000rmp、离心10min,去上清。沉淀悬浮后4℃放置一夜。将农杆菌接种于lb固体培养基中(含hyg,100μg/ml),28℃培养2d;挑取携带ph2gw7-35s-egfp质粒的农杆菌单菌落接种于50ml的lb培养基中,180rpm,28℃培养24h,待菌液od600至1.0左右,离心10min(3000rpm),沉淀菌体,重悬于5ml诱导培养基(添加as200μmol/l)中,28℃,200r/min培养至od600=1.0~1.2;活化的农杆菌要立即用于转化;将打碎的菌丝悬浮液与农杆菌菌液(1:1)混匀,低速离心去上清,剩余的部分涂布在含有pda(含潮霉素100μg/ml)培养基上;28℃,避光培养13d;取平板中长成的菌丝在显微镜紫外观察(如图4);提取转化子的基因组dna,pcr鉴定转化子(如图5)。提取野生对照组与转基因蜜环菌的基因组dna,用egfp的上下游特异性引物进行pcr扩增,对照组没有条带出现,而转基因实验组只有一条750bp大小的条带出现。而且显微镜观察抗潮霉素的蜜环菌菌丝发现有一条青白色的荧光出现,因此可以认为转化子已经成功转入到蜜环菌细胞中。
序列表
<110>昆明理工大学
<120>蜜环菌筛选标记及构建转基因菌株的方法
<160>3
<170>siposequencelisting1.0
<210>1
<211>717
<212>dna
<213>人工序列(artificial)
<400>1
atggtgagcaagggcgaggagctgttcaccggggtggtgcccatcctggtcgagctggac60
ggcgacgtaaacggccacaagttcagcgtgtccggcgagggcgagggcgatgccacctac120
ggcaagctgaccctgaagttcatctgcaccaccggcaagctgcccgtgccctggcccacc180
ctcgtgaccaccctgacctacggcgtgcagtgcttcagccgctaccccgaccacatgaag240
cagcacgacttcttcaagtccgccatgcccgaaggctacgtccaggagcgcaccatcttc300
ttcaaggacgacggcaactacaagacccgcgccgaggtgaagttcgagggcgacaccctg360
gtgaaccgcatcgagctgaagggcatcgacttcaaggaggacggcaacatcctggggcac420
aagctggagtacaactacaacagccacaacgtctatatcatggccgacaagcagaagaac480
ggcatcaaggtgaacttcaagatccgccacaacatcgaggacggcagcgtgcagctcgcc540
gaccactaccagcagaacacccccatcggcgacggccccgtgctgctgcccgacaaccac600
tacctgagcacccagtccgccctgagcaaagaccccaacgagaagcgcgatcacatggtc660
ctgctggagttcgtgaccgccgccgggatcactctcggcatggacgagctgtacaag717
<210>2
<211>25
<212>dna
<213>人工序列(artificial)
<400>2
ggatccatggtgagcaagggcgagg25
<210>3
<211>30
<212>dna
<213>人工序列(artificial)
<400>3
ctcgagttacttgtacagctcgtccatgcc30
- 还没有人留言评论。精彩留言会获得点赞!