一种利用大肠杆菌合成反式‑4‑羟基‑L‑脯氨酸的方法与流程
本发明属于医药化学、合成生物学、微生物基因工程领域;涉及反式-4-羟基-l-脯氨酸的合成方法,具体涉及利用基因工程改造的大肠杆菌,在不外源添加l-脯氨酸的条件下,高效生物合成反式-4-羟基-l-脯氨酸的方法。
背景技术:
反式-4-羟基-l-脯氨酸(trans-4-hydroxy-l-proline,简称hyp,中文简称:羟脯氨酸,是l-脯氨酸的4-羟基化产物,是胶原蛋白的主要组成性氨基酸,广泛应用于医药、化工、饲料、食品营养和美容等行业:是重要的手性合成子,如作为药物合成中间体用于合成碳青霉烯类抗生素、血管紧张素转化酶抑制剂等;是合成多肽药物的重要原料,还是用于氢化、聚合、水解等反应的手性催化剂;其n-乙酰化衍生物能抑制炎症,被用于治疗结缔组织疾病,如风湿性关节炎;可防止因甘氨酸合成不足而造成的家畜营养不良;具有独特的甜香味,常被作为饮料添加剂改善果汁饮料风味;用来补充甘氨酸、丙酮酸和葡萄糖供给不足导致的营养缺陷;其衍生物具有抗氧化、抗辐射作用,可调整细胞的氧化还原状态,具有重要的应用价值;还有减肥作用,可望开发为比较理想的减肥药物。
目前,获取hyp的主要方法是酸水解法:以胶原蛋白为原料,通过酸水解、亚硝酸氧化和离子交换等过程获得。但存在原料消耗量大、三废排放量大、能耗高、终产物纯度低、生产成本高等缺点。化学合成能实现,但合成路线较长,成本太高,难以产业化。
近年来应用的微生物发酵法,直接发酵,原料成本低,反应条件温和,易大规模生产,这对于为研发hyp的新型制备方法,提高产率,降低成本具有重要的参考意义。
一些微生物也能产生反式-4-羟基-l-脯氨酸。到目前为止,反式-4-羟基-l-脯氨酸的生物合成过程已基本清楚:l-脯氨酸的合成是生物体本身具备的,微生物自身tca循环产生α-酮戊二酸,α-酮戊二酸在谷氨酸脱氢酶的催化作用下生成l-谷氨酸,l-谷氨酸在谷氨酸激酶催化作用下转化为γ-谷氨酰磷酸酯,后者在γ-谷氨酰磷酸还原酶的作用下,消耗电子供体nadph,还原为谷氨酰-γ-半醛,该醛经非酶催化的自发反应生成δ1-吡咯啉-5-羧酸,在δ1-吡咯啉-5-羧酸还原酶的催化下δ1-吡咯啉-5-羧酸被还原为l-脯氨酸,在l-脯氨酸-4-羟化酶(p4h)的催化作用下,l-脯氨酸4-位被羟化生成反式-4-羟基-l-脯氨酸。在植物和哺乳动物中则由双功能的δ1-吡咯啉-5-羧酸合成酶催化完成从l-谷氨酸到谷氨酰-γ-半醛的合成,随后的合成l-脯氨酸的步骤相同。因此,在脯氨酸-4-羟化酶活性确定的情况下,增强底物l-脯氨酸的生物合成途径,可以有效地增加底物的供应量,从而最终提高hyp的产量。
yulanyi等(bmcbiotechnol.2014.14:44)将来源于不同物种的p4h基因构建到大肠杆菌或者谷氨酸棒杆菌表达载体上,直接转化大肠杆菌bl21(de3)或者谷氨酸棒杆菌,在mec培养基中进行摇瓶发酵。结果发现,来源于指孢囊菌rh1的p4h活性最好,其在大肠杆菌中生成的hyp的量最高--在不添加脯氨酸的情况下,od600nm为6.5左右时,hyp的产量可以达到470mg/l;当添加浓度为4mm的脯氨酸时,同等水平摇瓶发酵,hyp的产量可以达到6.72g/l。脯氨酸的含量是大肠杆菌中限制hyp生物合成的重要因素。
francescofalcioni等(biotechnol.bioeng.2015.112(2):322-330)将来源于指孢囊菌rh1的p4h转化异亮氨酸营养缺陷型的谷氨酸棒杆菌,在该菌中限制异亮氨酸的加入量可以诱导脯氨酸的产生。在标准的cg12培养基中,不添加底物脯氨酸,通过调整葡萄糖与异亮氨酸的加入比例,高密度补料发酵后hyp产量可达到7.1g/l。
elenitheodosiou等(microb.cell.fact.2015.14:108)将来源于指孢囊菌rh1的p4h转化e.colibl21(de3,δputa)(plyss),并将该工程菌在m9培养基中进行发酵培养,对该过程进行13c-标记的代谢流分析,不添加底物脯氨酸,hyp产量能达到2.20u/gcdw-1;在添加脯氨酸的情况下,该产量能到12.6u/gcdw-1。该研究认为,在e.colibl21(de3)(plyss)中,puta基因的敲除可以使hyp的生成速度加倍,并且当puta基因被敲除后,tca循环通过共底物α-酮戊二酸与l-脯氨酸羟化间的偶联是α-酮戊二酸依赖的生物转化的一个关键限制因素。
tong-xinzhao等(j.biosci.bioeng.2017.123(1):109-115)将来源于vitreoscilla的透明颤氧血红蛋白基因(vgb)整合到e.coliwd3[f-,λ-,in(rrnd-rrne)1,rph-1δaceakδsucabδputa]的基因组,并将质粒ptrc99a-p4h(来源于指孢囊菌rh1)转化该遗传改造的大肠杆菌。对该工程菌进行补料发酵显示,在添加23g/l的脯氨酸以及2.38g/l的苏氨酸的情况下,hyp的最终产量能达到14.4g/l。
国内的盛花开等(biotechnol.2016.26(1):81-86)将不同来源的prob、proa、proc、p4h基因,通过重叠延伸pcr串联基因并连接pet-28a载体,在大肠杆菌bl21(de3)中表达,培养基不添加l-脯氨酸时,摇瓶水平发酵24小时,e.colibl21/pet-28a-bamg中hyp的产量达到0.29g/l,添加4mm的l-脯氨酸时,产量可以达到0.74g/l。
上述文献虽然已实现了不添加底物生产目标产物,但hyp的产量不太高。还亟需对反式-4-羟基-l-脯氨酸的合成方法进一步优化,才能大幅度提高目标产物hyp的产量,实现工业化生产。
技术实现要素:
本发明的目的是提供一种利用大肠杆菌合成反式-4-羟基-l-脯氨酸的方法。
为实现上述发明目的,本发明所采用的技术方案是:
一种用于反式-4-羟基-l-脯氨酸合成的大肠杆菌,通过如下步骤获得:
(1)敲除大肠杆菌的puta基因获得宿主菌mg1655(δputa);
(2)将proc、proa、prob、rocg按顺序串联到pbba5c载体上,构建成pbba5c-cabg质粒;
(3)对脯氨酸羟化酶基因进行密码子优化,进行全基因合成,获得的基因序列如seqidno.1所示,将其构建到ptrchisb载体上,获得ptrchisb-p4h质粒;
(4)制备宿主菌mg1655(δputa)的感受态细胞,将(2)获得的pbba5c-cabg质粒和(3)获得的ptrchisb-p4h质粒共转到宿主菌mg1655(δputa)的感受态细胞中,筛选阳性克隆,培养过夜,得到含有所述大肠杆菌的种子培养液。
优选的,上述大肠杆菌的获得方法,其所述步骤(2)中的pbba5c-cabg质粒构建方法是:
设计相应的带有酶切位点的引物,以枯草芽孢杆菌和大肠杆菌的基因组为模板,对rocg、prob、proa和proc进行pcr扩增,得到对应的基因片段;其中prob额外设计引物以重叠延伸pcr的形式引入点突变i69e,所述的额外设计引物为:
prob-i69e-f:gaactgccagcgaccgaagcctcgaaacaa;
prob-i69e-r:cagttgtttcgaggcttcggtcgctggcag;
分别将各基因片段与pbba5c-mevt(co)-mbis(co,ispa)质粒进行酶切;先将proc连入酶切后的pbba5c载体,获得阳性克隆,测序确定正确后,再分别以相同的方法,将proa、prob(i69e)、rocg基因依次分别连到pbba5c载体上,最终构建成pbba5c-cabg质粒。
优选的,上述的大肠杆菌的获得方法,其所述(4)的具体步骤是:制备(1)中得到的宿主菌mg1655(δputa)的感受态细胞,并将质粒ptrchisb-p4h和pbba5c-cabg一起共转到mg1655(δputa)的感受态细胞中,以氨苄青霉素:amp、氯霉素:chl双抗平板筛选,鉴定阳性克隆;将阳性克隆接种于含amp和chl的lb培养基中,过夜培养得到。
相应的,利用上述的大肠杆菌合成反式-4-羟基-l-脯氨酸的方法,步骤是:将获得的种子培养液转接lb培养基,待菌长到od600nm=0.5~1.0,以iptg诱导蛋白表达,收集菌体,转入改良的mcg培养基中发酵;所述改良的mcg培养基为:葡萄糖10g/l,甘油10ml/l,尿素10g/l,玉米浆15g/l,kh2po41.5g/l,k2hpo41g/l,mgso4·7h2o0.2g/l,feso4·7h2o1mm,mnso4·4h2o10mg/l,znso4·7h2o10mg/l,vb1200mg/l。
优选的,上述的合成反式-4-羟基-l-脯氨酸的方法,需在改良的mcg培养基中的发酵时间大于等于48小时。
相应的,脯氨酸羟化酶基因序列如seqidno.1所示,ptrchisb-p4h质粒、pbba5c-cabg质粒也都具有独立的使用和保护价值,体现本发明的技术改进性。
本发明具有以下有益效果:
1).大肠杆菌是常用的细胞工厂,因其遗传背景清晰、遗传操作容易、生长迅速等原因,其工业应用价值极高。考虑到上述原因,以及大肠杆菌自身能生成羟脯氨酸的合成底物——l-脯氨酸和α-酮戊二酸的特点,本发明以大肠杆菌作为基础菌。
2).利用宿主菌自身tca循环能产生α-酮戊二酸,而α-酮戊二酸是生成l-脯氨酸的前体的特点,通过过表达催化α-酮戊二酸生成l-脯氨酸的基因以提高l-脯氨酸的供应。
3).将rocg、prob(i69e)、proa、proc四个基因串联到一个质粒上进行过表达,以提高细胞内l-脯氨酸的供应量;引入脯氨酸羟化酶并将其催化l-脯氨酸转化为反式-4-羟基-l-脯氨酸的反应与α-酮戊二酸生成琥珀酸的反应进行偶联;在采用摇瓶发酵、低密度发酵(od600nm=2.0)以及在培养基中不外源添加l-脯氨酸的情况下,实现了反式-4-羟基-l-脯氨酸的高产率合成,降低了发酵成本。
4).优化了p4h基因,使得密码子适应指数(cai)由0.77调整到0.94;最优密码子使用频率(fop)使用频次在90-100的比例达到80%以上,使用频次在80-100的比例达到90%以上;gc%含量由0.74调整为0.59,影响核糖体结合的二级结构被去除。p4h基因转录出的rna稳定性增加,p4h蛋白的翻译水平得到提高。
5).采用改良的mcg培养基,显著提高了反式-4-羟基-l-脯氨酸的产量。
附图说明
图1是本发明的实验设计路线图。
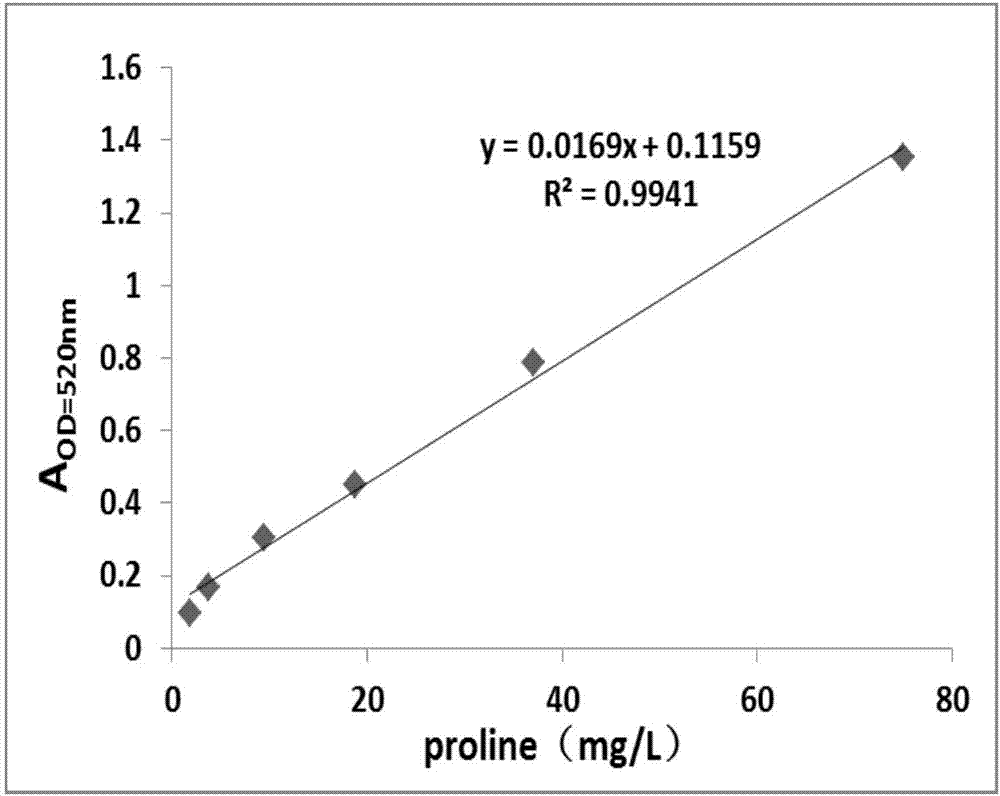
图2是以茚三酮法测定l-脯氨酸浓度的标准曲线。
图3是氯胺t法测定反式-4-羟基-l-脯氨酸浓度的标准曲线。
图4是本发明构建的pbba5c-cabg质粒。
图5是本发明构建的ptrchisb-p4h质粒。
具体实施方式
下面结合附图对本发明的实施方式进行详细说明。
如图1所示的,本发明的设计路线为:
首先,敲除puta基因以降低细胞内l-脯氨酸的分支代谢;另外,利用宿主菌自身tca循环能产生α-酮戊二酸,而α-酮戊二酸是生成l-脯氨酸的前体的特点,以合成生物学模块化理论为基础,将催化从α-酮戊二酸到l-脯氨酸的生物合成途径的基因串联到一个质粒上,进行过表达,以提高细胞内l-脯氨酸的供应量;引入脯氨酸羟化酶,将l-脯氨酸转化为反式-4-羟基-l-脯氨酸的反应与α-酮戊二酸转化为琥珀酸的反应进行偶联。在采用摇瓶发酵和低密度发酵(od600nm=2.0)的条件下,实现了在培养基中不外源添加l-脯氨酸情况下,高产率的合成反式-4-羟基-l-脯氨酸,降低了发酵成本。
本发明实施例中所用培养基、平板成份、部分溶液及测定方法如下:
lb培养基:1%(w/v)胰蛋白胨,0.5%(w/v)酵母提取物,1%(w/v)nacl,ph7.0-7.2。
tb培养基:每升培养基中,在900ml去离子水中加入胰蛋白胨12g/l,酵母提取物24g/l,甘油4ml,高压蒸汽灭菌后,待溶液冷至60℃或60℃以下加入100ml无菌的0.17mkh2po4,0.72mk2hpo4。
m9培养基:先配制1m的mgso4和cacl2高压灭菌备用;再配制5×m9盐溶液:na2hpo4·7h2o12.8g,kh2po43.0g,nacl0.5g,nh4cl1.0g,加双蒸水200ml溶解,121℃灭菌15分钟;配制20%的葡萄糖溶液:4g葡萄糖加双蒸水20ml溶解,0.22m滤器过滤除菌;无菌操作配制m9培养基:5×m9盐溶液200ml,1mmgso42ml,20%的葡萄糖溶液20ml,1m的cacl20.1ml,加灭菌双蒸水至1000ml。
med7培养基:葡萄糖20g/l,(nh4)2so410g/l,k2hpo41g/l,nacl2g/l,mgso40.5g/l,feso4·7h2o0.278g/l,cacl20.015g/l,peptone8g/l,ph8.0。
改良的med7培养基:葡萄糖8g/l,甘油10ml/l,玉米浆8g/l,(nh4)2so413g/l,k2hpo41.5g/l,nacl2g/l,feso44mm,mgso40.3g/l,cacl20.015g/l,ph8.0。
改良的mcg培养基:葡萄糖10g/l,甘油10ml/l,尿素10g/l,玉米浆15g/l,kh2po41.5g/l,k2hpo41g/l,mgso4·7h2o0.2g/l,feso4·7h2o1mm,mnso4·4h2o10mg/l,znso4·7h2o10mg/l,vb1200μg/l。
amp-chl单或者双抗性平板:1%(w/v)胰蛋白酶,0.5%(w/v)酵母提取物,1%(w/v)nacl,1.5%(w/v)琼脂,ph7.0-7.2,50μg/l的氨苄青霉素和/或34μg/l的氯霉素。
茚三酮溶液:将1g茚三酮溶于16ml浓度为6m的磷酸溶液,再加入24ml冰乙酸,混合均匀,储存于4℃冰箱备用。
柠檬酸缓冲液:将50g柠檬酸,26.3gnaoh和146.1g乙酸钠溶于水中至1l,然后与200ml水以及300ml正丙醇混合。
l-脯氨酸的定量测定(茚三酮法):将发酵液离心后,取上清,稀释20倍,取2ml加于10ml试管中(或直接加入一定浓度的l-脯氨酸标准品),之后加入2ml茚三酮溶液以及2ml冰乙酸,摇匀后在沸水中煮沸1小时,立即置冰上冷却。5分钟后加入20ml甲苯,涡旋混匀并静置萃取,10分钟后,取上层萃取液用紫外分光光度计在520nm波长处测定吸光值。
氯胺t溶液:将1.41g氯胺t溶于10ml水中,依次加入10ml正丙醇和80ml柠檬酸缓冲液。
显色剂溶液:将10g对二甲氨基苯甲醛用35ml高氯酸溶解,缓慢加入65ml异丙醇,现配现用。
反式-4-羟基-l-脯氨酸的定量测定(氯胺t法):将发酵液离心后,取上清,稀释至2.5ml后加于10ml试管中(或直接加入一定浓度的反式-4-羟基-l-脯氨酸标准品),之后加入1ml氯胺t溶液,摇匀后在室温放置20分钟,然后加入1ml显色剂,摇匀后迅速60℃孵育20分钟,冷水冷却1分钟,最后用紫外分光光度计在560nm波长处测定吸光值。
实施例1:l-脯氨酸标准曲线的绘制
将浓度为1g/l的l-脯氨酸标准品进行梯度稀释,分别成250mg/l、125mg/l、75mg/l、37.5mg/l、18.75mg/l、9.375mg/l、4.687mg/l、2.344mg/l和1.172mg/l的浓度,以h2o作为空白对照,按照茚三酮法测定出不同浓度的l-脯氨酸相对应的520nm的吸光度值。绘制标准曲线,计算标准曲线公式以及r2值。如图2所示,以标准曲线拟合出来的公式计算脯氨酸的含量。
实施例2:反式-4-羟基-l-脯氨酸标准曲线的绘制
将浓度为1g/l的反式-4-羟基-l-脯氨酸标准品进行梯度稀释,分别成0.2mg/l、0.5mg/l、1mg/l、2mg/l、3mg/l、4mg/l、5mg/l的浓度,以h2o作为空白对照,按照氯胺t法测定出不同浓度的反式-4-羟基-l-脯氨酸相对应的560nm的吸光度值。绘制标准曲线,计算标准曲线公式以及r2值。如图3所示,以标准曲线拟合出来的公式计算反式-4-羟基-l-脯氨酸的含量。
实施例3:大肠杆菌mg1655(δputa)宿主菌的构建
以10%甘油制备大肠杆菌mg1655的感受态细胞,转入pkd46质粒,以氨苄青霉素平板在30℃培养过夜,筛选阳性克隆。再以阳性克隆制备感受态细胞:在菌长到od600nm=0.2~0.3时,加入l-阿拉伯糖(30mm),30℃诱导1小时,使λ-red重组蛋白(exo,bet,gram)表达,收菌制成mg1655(pkd46)感受态细胞。设计带有puta基因(geneid:945600)编码区上下游~50bp同源臂的引物,所述引物为:
puta-ecoli-h1p1:gaccacgttaaagatgccggaggaggttgtaacatcctccggctacctgtagcgattgtgtaggctggag;
puta-ecoli-h2p2:acgataacgttaagttgcacctttctgaacaacaggagtaatggcatgggaattagccatggtcc。
用于扩增pkd4上primingsite1和2间的序列,回收扩增的dna片段,并转化mg1655(pkd46)感受态细胞,在卡那霉素平板上以30℃条件培养过夜,以鉴定引物通过菌落pcr筛选puta基因敲除的mg1655菌株的阳性克隆:
所述鉴定引物为:
puta-ecoli-ko-idf-fgcggattattattgaggggattcga;
puta-ecoli-ko-idf-rcgcatgtcacatttaacatggttgc.
敲除成功的菌pcr出来的片段长度为1.6kb;敲除不成功的菌pcr出来的片段长度为4.1kb。将pcr产物测序,以确定菌落pcr鉴定出来的成功敲除菌确实为正确敲除。将puta基因敲除的mg1655的阳性克隆接带有卡那霉素抗性的lb平板,39℃培养过夜,以去除pkd46质粒。挑取阳性克隆获得mg1655(δputa)宿主菌。
上述mg1655菌株、pkd46、pkd4和pcp20的敲除系统均来源于文献scientificreports.2014.4:6640.doi:10.1038/srep06640,为作者惠赠。氨苄青霉素购自生工生物科技有限公司,使用终浓度为100μg/ml,在配置固体琼脂培养基时,待培养基冷却到55℃及以下,加入后倒板即可。卡那霉素购自生工生物科技有限公司,使用终浓度为50μg/ml,在配置固体琼脂培养基时,待培养基冷却到55℃及以下,加入后倒板即可。
实施例4:pbba5c-cabg质粒的构建
设计引物用于对枯草芽孢杆菌的nad特异性的谷氨酸脱氢酶基因(rocg,geneid:937066)进行pcr扩增,得到一个1275bp的片段,所述引物为:
rocg-f:
gaagatctttaactttaatgaggagagatacatatgtcagcaaagcaagtctc;
rocg-r:ccctcgagtttggatccttagacccatccgcggaaacgcgat。
分别设计相应的引物用于大肠杆菌催化谷氨酸转化成脯氨酸的三个酶基因(prob,geneid:946425;proa,geneid:946680;proc,geneid:945034)的pcr扩增,三个酶基因的引物分别为:
prob-f:gaagatctttaactttaatgaggagagatacatatgagtgacagccag;
prob-r:ccctcgagtttggatccttaacgggtaatcatgtcatc;
proa-f:gaagatctttaactttaatgaggagagatacatatgctggaacaaatggg;
proa-r:ccctcgagtttggatccttacgcacgaatggtgtaatc;
proc-f:gaagatctttaactttaatgaggagagatacatatggaaaagaaaatcggt;
proc-r:ccctcgagtttggatcctcaggatttgctgagtttttc.
对prob基因进行扩增后,得到一个1104bp的片段;对proa基因进行扩增后,得到一个1254bp的片段;对proc基因进行扩增后,得到一个810bp的片段。
扩增后的rocg、prob、proa和proc的每个基因序列的5’和3’端通过引物引入酶切位点,其中prob额外设计引物以重叠延伸pcr的形式引入单位点突变(i69e),所述引物为:
prob-i69e-f:gaactgccagcgaccgaagcctcgaaacaa;
prob-i69e-r:cagttgtttcgaggcttcggtcgctggcag;
分别以枯草芽孢杆菌和大肠杆菌的基因组为模板进行相应的pcr反应。
分别以内切酶酶切pcr反应后的rocg、prob(i69e)、proa和proc的基因片段以及pbba5c-mevt(co)-mbis(co,ispa)质粒,将pbba5c-mevt(co)-mbis(co,ispa)质粒酶切后留取pbba5c载体片段待用;先将proc连入酶切后的pbba5c载体,获得阳性克隆,测序确定正确后,再分别以相同的方法,将proa、prob(i69e)、rocg基因依次分别连到酶切后的pbba5c载体上,最终构建成pbba5c-cabg质粒,如图4所示,测序确定序列正确后,提取质粒待用。
上述枯草芽孢杆菌、大肠杆菌购买自武汉淼灵生物科技有限公司。载体pbba5c-mevt(co)-mbis(co,ispa)来源于scientificreports.2014.4:6640.doi:10.1038/srep06640,为作者惠赠。
实施例5:ptrchisb-p4h质粒的构建
对来源于指孢囊菌属(dactylosporangium.sp.rh1)的l-脯氨酸-反式-4-羟化酶基因(p4h)进行密码子优化以利于在大肠杆菌中表达,并进行全基因合成。根据本发明设计的优化路线,由金唯智生物科技(北京)有限公司采用optimwiz软件完成对来源于指孢囊菌属(dactylosporangium.sp.rh1)的l-脯氨酸-反式-4-羟化酶基因(p4h)的序列优化,密码子优化后的p4h的dna序列如seqidno.1所示,氨基酸序列未变。本发明设计的优化路线如下:
将密码子适应指数(cai)由0.77调整到0.94;使得最优密码子使用频率(fop)使用频次在90-100的比例达到80%以上,使用频次在80-100的比例达到90%以上;将gc%含量由0.74调整为0.59,去除影响核糖体结合的二级结构。最终,使p4h基因转录的mrna的稳定性增加,蛋白的翻译水平得到提高。
以密码子优化后全基因合成的dna作为模板,用5’端带有saci酶切位点,3’端带有bamhi酶切位点的一对引物进行pcr扩增,将pcr扩增产物和ptrchisb载体分别以saci和bglii进行酶切,回收后连接转化,最终构建成ptrchisb-p4h质粒,如图5所示,鉴定阳性克隆,测序确定p4h序列正确性,并进行质粒提取待用。
实施例6:ptrchisb-p4h和pbba5c-cabg质粒的共转化
制备mg1655(δputa)的感受态细胞,通过化学转化法(42℃热激90秒,迅速冰上放置3分钟,后加入lb培养基37℃低速摇菌培养)将质粒ptrchisb-p4h和pbba5c-cabg一起共转到mg1655(δputa)的感受态细胞中,以氨苄青霉素(amp)和氯霉素(chl)双抗平板筛选阳性克隆。挑阳性克隆到加入amp+chl的lb培养基中37℃,220rpm培养过夜,作为种子培养液。
上述氨苄青霉素购自生工生物科技有限公司,使用终浓度为100μg/ml;上述氯霉素购自生工生物科技有限公司,使用终浓度为34μg/ml;在配置固体琼脂培养基时,待培养基冷却到55℃及以下,同时加入两种抗生素后倒板即可。
实施例7:ptrchisb-p4h和pbba5c-cabg质粒共转化菌株的发酵
以5%的浓度将种子培养液转接lb培养基(加入实施例6所述终浓度的氨苄青霉素和氯霉素),37℃、220rpm培养,待菌生长至吸光度值为od600nm=0.5~1.0时加入异丙基-β-d-硫代半乳糖苷(iptg)(0.5mm),立即转入30℃、180rpm的摇床中诱导6小时以利于蛋白表达,后将摇床转速调为230rpm进行发酵,发酵22小时后以4000rpm的转速离心10分钟收集菌体,将菌体全部分别转入新鲜的发酵培养基(每个250ml三角瓶中装入30ml培养基)中,继续在30℃摇床以230rpm的转速进行发酵培养,分别取不同发酵时间的发酵液用于后续菌od600nm、l-脯氨酸以及反式-4-羟基-l-脯氨酸产量的检测。本实验以ptrchisb空载体作为ptrchisb-p4h的对应对照。
实施例8:检测ptrchisb空载体和pbba5c-cabg质粒共转化菌株发酵产物中l-脯氨酸的含量
以茚三酮法检测发酵产物中的l-脯氨酸的含量--用测定的吸光度值与l-脯氨酸标准曲线进行对照,最终确定l-脯氨酸的产量。分别检测发酵24小时、48小时和72小时的l-脯氨酸的含量,在改良的mcg培养基中发酵24小时,l-脯氨酸的含量最高,达到1.15g/l,如表1所示。
表1l-脯氨酸的产量
实施例9:检测ptrchisb-p4h和pbba5c-cabg质粒共转化菌株发酵产物中反式-4-羟基-l-脯氨酸的含量
以氯胺t法检测发酵产物中反式-4-羟基-l-脯氨酸的含量--用测定的吸光度值与反式-4-羟基-l-脯氨酸标准曲线进行对照,最终确定反式-4-羟基-l-脯氨酸的含量。相关结果见实施例11。
实施例10:筛选ptrchisb-p4h和pbba5c-cabg质粒共转化菌株产反式-4-羟基-l-脯氨酸的发酵培养基
选取m9、tb、med7、改良的med7以及改良的mcg培养基作为待筛选培养基,根据实施例7进行发酵培养,检测不同时间的反式-4-羟基-l-脯氨酸的含量。结果如表2所示,工程菌在改良的mcg培养基中反式-4-羟基-l-脯氨酸的产量明显优于其他培养基,最终工程菌的od600nm达到2.0左右。
表2发酵培养基、发酵时间对反式-4-羟基-l-脯氨酸产量(mg/l)的影响
实施例11:ptrchisb-p4h和pbba5c-cabg质粒共转化菌株发酵产反式-4-羟基-l-脯氨酸的时间优化
根据实施例9和实施例10,将ptrchisb-p4h和pbba5c-cabg质粒共转化菌株在改良的mcg培养基中进行发酵,分别在发酵24小时、48小时、72小时时进行取样,测定反式-4-羟基-l-脯氨酸的产量。结果显示,工程菌在改造的mcg培养基中发酵24小时,反式-4-羟基-l-脯氨酸的产量可以达到270mg/l左右;至48小时,反式-4-羟基-l-脯氨酸产量最高可以达到580mg/l;继续发酵至72小时反式-4-羟基-l-脯氨酸的产量变化不大,可到596mg/l。最终工程菌的od600nm达到2.0左右。
序列表
<110>中国科学院成都生物研究所
<120>一种利用大肠杆菌合成反式-4-羟基-l-脯氨酸的方法
<160>1
<170>siposequencelisting1.0
<210>1
<211>819
<212>dna
<213>人工序列()
<400>1
atgctgaccccgaccgaactgaaacagtaccgcgaagccggctatttactgattgaggat60
ggcctgggtccgcgcgaagttgattgcttacgccgtgcagccgcagcactgtatgcccag120
gatagcccggatcgtaccctggaaaaagatggtcgtaccgttcgcgcagtgcatggctgt180
catcgtcgtgatccggtgtgccgcgatctggttcgccatccgcgtctgctgggtccggca240
atgcagattctgagcggcgatgtttacgtgcatcagttcaagatcaatgccaaggccccg300
atgaccggtgatgtgtggccgtggcatcaggattacatcttctgggcacgcgaagatggc360
atggatcgcccgcacgtggtgaatgtggccgtgctgctggatgaagccacccatttaaat420
ggcccgctgctgtttgttccgggcacccatgaactgggtctgatcgatgtggaacgtcgt480
gcaccggcaggcgatggtgatgcccagtggctgcctcagctgagcgctgatttagattac540
gccattgatgccgatctgctggcccgtctgacagccggtcgcggtattgaaagcgccaca600
ggtcctgccggcagcattctgctgttcgatagccgcatcgtgcatggcagcggcacaaat660
atgagcccgcatccgcgtggcgtggttctggtgacctataaccgcaccgataatgcactg720
ccggcacaggcagcaccgcgtccggaatttctggcagcccgtgatgcaaccccgctggtt780
ccgctgccggcaggctttgcactggcacaaccggtttaa819
- 还没有人留言评论。精彩留言会获得点赞!