靶向wls基因RNA干扰重组慢病毒载体的构建方法与流程
本发明涉及一种靶向wls基因rna干扰重组慢病毒载体的构建方法与生物应用,属于生物技术领域。
背景技术:
目前研究wnt通路中至关重要的wnt分泌蛋白的作用的研究主要集中在某种wnt蛋白或b-catenin分子上,然而目前发现哺乳动物中19种wnt配体蛋白的表达谱不尽相同,在其部位发挥的功能也不尽相同而又有所冗余代偿。wnt通路可通过经典与非经典通路等发挥作用,对b-catenin的靶向敲除等技术并不能完全阻断wnt通路。然而靶向敲除wls基因的优势在于:1.敲除wls可以阻断几乎所有wnt蛋白的分泌,可避免众多wnt蛋白的功能代偿。2.利用wls敲除技术可以研究经典和非经典的wnt信号通路的总体作用。3.敲除wls技术可以研究wnt蛋白的自分泌和旁分泌作用。
技术实现要素:
针对现有技术中的缺陷,本发明的目的是提供一种靶向wls基因rna干扰重组慢病毒载体的构建方法;并进一步公开其在研究骨组织wnt配体具体来源,及其对骨发育、骨矿化、骨代谢调控方面的应用。
本发明是通过以下技术方案实现的:
本发明提供了一种靶向wls基因rna干扰重组慢病毒载体的构建方法,其包括如下步骤:
分别构建v#wls-shrna重组载体质粒、病毒包装辅助质粒helper1.0和病毒包装辅助质粒helper2.0;
将所述v#wls-shrna重组载体质粒、病毒包装辅助质粒helper1.0和病毒包装辅助质粒helper2.0共同对293t细胞进行转染,得到所述靶向wls基因rna干扰重组慢病毒载体。
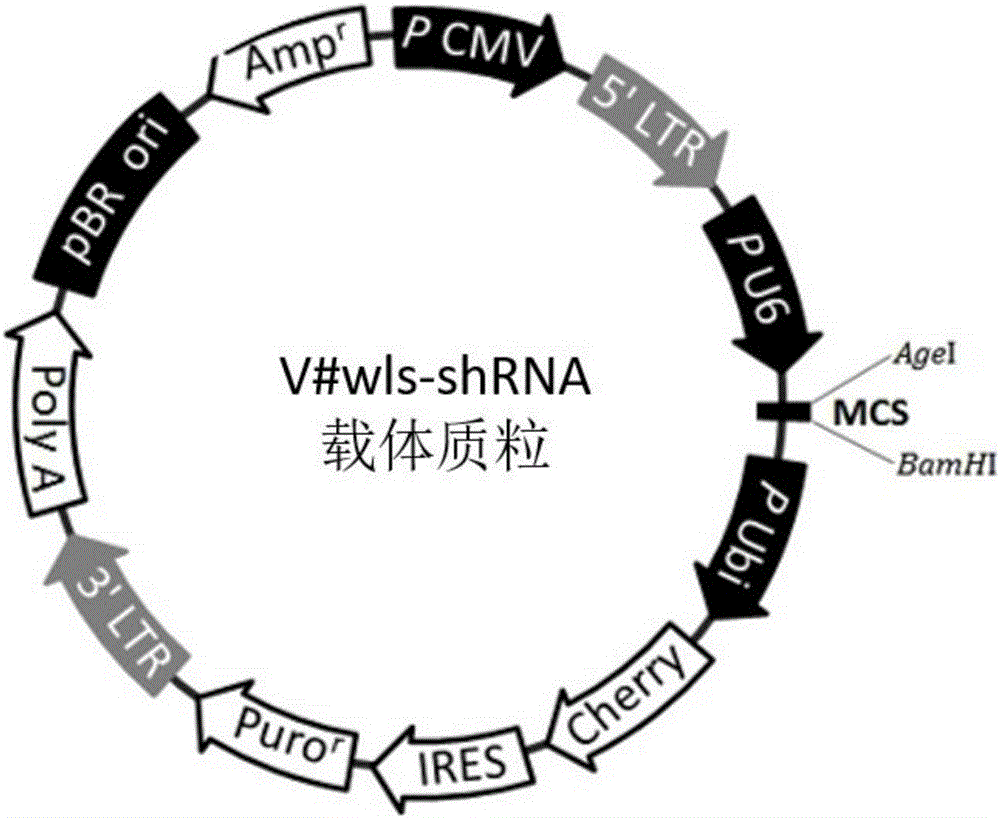
作为优选方案,所述构建v#wls-shrna重组载体质粒的构建方法是在v#shrna载体的多克隆位点中连接双链dna片段,元件顺序为u6-mcs-ubiquitin-cherry-ires-puromycin,酶切位点为克隆位点:agei、ecori。
作为优选方案,所述的双链dna片段为以下序列:
wls-rnai-v寡核苷酸序列:
正义链的序列如seqidno.1所示:
ccggtccaagggaaattgaagcaaactcgagtttgcttcaatttcccttggatttttg,
正义链的序列如seqidno.2所示:
gatccaaaaatccaagggaaattgaagcaaactcgagtttgcttcaatttcccttgga;
作为优选方案,所述病毒包装辅助质粒helper1.0的构建方法为:helper1.0载体质粒总长10703bp,含有hiv病毒的gag基因,编码病毒主要的结构蛋白;pol基因,编码病毒特异性的酶;rev基因,编码调节gag和pol基因表达的调节因子。cagpromoter:79-1670.gag:1780-3282.pol:3348-6086.tat:6180-6398.rre:6660-6893.rev:7272-7544.beta-globinpolya:7724-8164.pucori:8920-9563.ampicillin:10572-9712.
作为优选方案,所述病毒包装辅助质粒helper2.0的构建方法为:helper2.0载体质粒总长6503bp,含有单纯疱疹病毒来源的vsv-g基因,提供病毒包装所需要的包膜蛋白。cmvpromoter:114-701.β-globinintron:812-1386.vsv-g:1472-3007.beta-globinpolya:3151-3673.ampicillin:5727-4867.
作为优选方案,所述转染的操作方法为:接种细胞后,按照预实验合适的moi值=50进行目的病毒转染,8-12小时后换回普通培养液继续培养,48h后利用荧光显微镜拍照观察转染效率,72h后提取rna与蛋白检测目的基因wls干扰效率。
作为优选方案,一种靶向wls基因rna干扰重组慢病毒载体在研究骨组织生长发育过程中wnt配体来源方面的应用,靶向干扰骨细胞系mlo-y4中wls基因表达,干扰wnt配体的分泌,矿化诱导4天、7天后分别行碱性磷酸酶染色与茜素红染色检测其矿化能力。
与现有技术相比,本发明具有如下的有益效果:
本发明靶向wls基因rna干扰重组慢病毒载体能更高效且特异地抑制wls基因表达,可为研究相关组织的wnt配体具体来源、wls对wnt信号通路活性的影响、wls和相关wnt信号通路对细胞生物学行为以及组织生长发育的调控、wnt信号通路在组织再生方面的应用等,提供一种有效的工具。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
图1为v#wls-shrna重组载体质粒图;
图2为病毒包装辅助质粒helper1.0图;
图3为病毒包装辅助质粒helper2.0图;
图4为转染48h后普通光镜与荧光显微镜拍照示转染效率图;
图5为q-pcr验证目的基因干扰效果图;
图6为westernblot验证目的基因干扰效率图。
图7为转染目的病毒后细胞wnt信号通路活性降低图。
图8为转染目的病毒后骨细胞矿化能力降低图。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
实施例1
本实施例涉及靶向wls基因rna干扰重组慢病毒载体的构建和筛选的具体实验操作。
1、靶向wls基因rna干扰重组慢病毒克隆的制备
1、1利用限制性内切酶对工具载体进行消化。
1、2针对wls基因序列,根据rnai序列设计原则,设计多个rnai靶点序列,
合成单链引物,退火形成双链dna,并与载体进行连接后转化感受态细胞,经菌落pcr鉴定后进行扩大培养、质粒抽提。
2、靶向wls基因rna干扰重组慢病毒包装与检测
2、1将携带目的基因的工具载体质粒与辅助包装质粒helper1.0、helper2.0共转染293t细胞,48h后进行收获纯化得到高滴度保存液完成质量检测后进行后期转染实验。
实施例2
本实施例涉及一种特定骨组织细胞mlo-y4细胞系的靶向wls基因rna干扰实验
1.接种细胞用完全培养基稀释细胞mlo-y4至5x104~8x104个/ml,分别加入4ml细胞悬液接种相应的细胞数到两个6cm直径的培养皿中。
2.感染病毒每个小皿更换为含有终浓度5μg/mlpolybrene2ml完全培养液,按照预实验结果(moi=40-60为合适),或按公式计算:病毒体积=(moix细胞数目)/病毒滴度即每小皿加入适量的该病毒。按照预实验感染后12h换液时间,更换为常规培养基,继续培养。适当选择筛选方法:转染72h后加入2ug/ml的嘌呤霉素药筛48h后换成普通培养液培养。
3.观察感染效率
转染病毒48h后拍照,如图4所示,对照病毒与目的病毒转染效率达70%-90%
转染病毒72h后荧光定量pcr验证与westernblot验证结果分别如图5和图6所示:
图5示转染对照病毒与目的病毒72小时后,进行总rna的提取后逆转录获得cdna,再通过荧光定量pcr验证得到转染目的病毒后,目的基因的表达相比于对照组降低69.14±3.03%。
图6示转染对照病毒与目的病毒72小时后,进行总蛋白的提取测定浓度后进行电泳转膜,免疫反应显色,验证得到转染目的病毒后,目的基因的表达相比于对照组降低75.36±4.20%。
4.比较转染目的病毒后细胞wnt信号通路活性。
转染对照病毒与目的病毒72小时后,进行总rna的提取后逆转录获得cdna,再通过荧光定量pcr验证得到转染目的病毒后,如图7,wnt通路的转录因子及靶基因的基因表达活性明显降低(**p<0.01,*p<0.05)。
4.比较转染目的病毒后矿化能力的改变
矿化诱导4天、7天后分别行碱性磷酸酶染色与茜素红染色检测其矿化能力。
图8示转染对照病毒与目的病毒后进行矿化诱导4天、7天后分别行碱性磷酸酶染色与茜素红染色结果。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。
- 还没有人留言评论。精彩留言会获得点赞!