对叶大戟果实中的大环二萜类化合物及制备方法和多药耐药逆转用途与流程
本发明涉及医药技术领域,具体涉及三个新的大环二萜类化合物及其在制备多药耐药逆转药物或与抗肿瘤药物组合药物中的用途。
背景技术:
对叶大戟(euphorbiasororiaa.schrenk)是大戟科(euphorbiaceae)大戟属(euphorbia)一年生草本植物,原产于中亚,现主要分布于中亚与新疆和田等地。目前从对叶大戟中分离得到了共57个化合物,包括黄酮及其苷、甾醇、香豆素、大环二萜、三萜、嘧啶、腺苷、神经鞘脂、鞣花酸等。目前从对叶大戟中分离得到的大环二萜类化合物共有17个,均为假白榄烷型大环二萜,其中一些化合物具有一定的肿瘤多药耐药逆转活性。
大环二萜类化合物,即分子中含有六元以上环状结构的二萜类化合物,骨架结构丰富多变,生物活性多种多样,以假白榄烷(jatrophane)二萜的数量最多,假白榄烷二萜的结构特点是骨架由一个五元环和一个十二元环稠合而成,即5/12环系。经本课题组前期研究发现,假白榄烷二萜通常是高氧化态并普遍具有分子量700以上的较大分子结构,2013年本课题组申请专利“对叶大戟果实中的大环二萜类化合物及其制备方法和用途”中的六个化合物分别与本次研究中的三个新型假白榄烷型大环二萜的骨架上2、3、5、7、8、9、14、15位碳的取代基完全不同,包括乙酰氧基、丙酰氧基、苯甲酰氧基、异丁酰氧基等,这些取代基在骨架上的位置不同,数目不同,构型不同,使得化合物空间位阻发生特别变化,使得这些化合物结构完全不同,而这类化合物的丰富多变性,对生物活性有较大影响。文献调研发现,部分假白榄烷型二萜因其骨架碳上确定的取代基呈现出较强的多药耐药逆转活性,因此不能通过现有活性研究结果推测新化合物的生物活性。
肿瘤多药耐药(multidrugresistance,mdr),即一种药物作用于肿瘤使之产生耐药性后,该肿瘤对从未接触、结构无关、靶点不同、机制各异的多种抗肿瘤药也具有交叉耐药性的现象。mdr有多种形成机制,其中最主要的机制之一是abc家族转运蛋白(目前研究最广泛、最深入的为abcb1基因编码的p-糖蛋白,p-gp)的过表达,导致药物外排增加,形成耐药性。2013年本课题组申请的专利“对叶大戟果实中的大环二萜类化合物及其制备方法和用途”中进行了“抗耐药逆转活性”测定,该活性旨在考察肿瘤耐药细胞对专利中所指化合物的耐药指数,用于评价耐药性,而本研究在前期基础上检测了新化合物的“耐药逆转活性”,旨在考察新化合物与传统抗肿瘤药物联用后,能否通过竞争性结合耐药细胞膜上的转运蛋白,充当其底物,达到逆转耐药细胞耐药性的目的,使得传统抗肿瘤药物能够在细胞内发挥杀伤肿瘤细胞的作用,用于评价新化合物的有效性。
发现有生物活性的先导化合物,是创新药物研究的前提,也是影响创新药物周期的决定性因素。先导化合物的来源有多种途径,从天然产物中寻找有活性的化合物作先导物创制新药是世界药学工作者公认的有效途径之一。本研究旨在对对叶大戟中的大环二萜类成分进行进一步的挖掘研究,以期发现结构新颖且多药耐药逆转活性突出的大环二萜类化合物,为以天然产物丰富的分子结构为基础,构建以天然产物为模板的化合物库,为高通量药物筛选提供大量含有丰富结构多样性的化合物。以化合物库所提供的大量的构效关系信息为基础,研究人员可以对药物的药理活性和药代动力学性质进行研究,对结构进行修饰或优化,提供简便有效的合成方法,从而得到药物先导化合物甚至药物本身,进而为肿瘤多药耐药逆转药物的开发提供参考。
技术实现要素:
本发明目的在于,提供对叶大戟果实中的大环二萜类化合物及制备方法和多药耐药逆转用途。所述从对叶大戟(euphorbiasororiaa.schrenk)的果实中分离得到三个新的大环二萜类化合物,并对这些新的大环二萜类化合物进行了多药耐药逆转活性测定,结果表明:所述化合物(ⅰ)-(ⅲ)大环二萜类化合物均具有不同程度的多药耐药逆转活性,与抗肿瘤药物组合使用可不同程度地逆转耐药细胞对抗肿瘤药物的耐药性,可用于制备多药耐药逆转药物。
本发明所述的一种对叶大戟中的大环二萜类化合物,该化合物的结构式为:
其中:式(ⅰ)化合物为(2s*,3s*,4r*,5r*,13r*,15r*)-5-苯甲酰氧基-3-羟基-15-乙酰氧基假白榄烷-6(17),11e-二烯-9,14-二酮;
式(ⅱ)化合物为(2r*,3r*,4s*,5r*,7s*,8s*,9s*,13s*,14s*,15r*)-5-苯甲酰氧基-14,15-二羟基-2,7-二异丁酰氧基-3,8,9-三乙酰氧基假白榄烷-6(17),11e-二烯;
式(ⅲ)化合物为(2r,3r,4s,5r,7s,8s,9s,13s,14s,15r)-14-苯甲酰氧基-15-羟基-5-(2′-甲基-丁酰氧基)-7-异丁酰氧基-2,3,8,9-四乙酰氧基假白榄烷-6(17),11e-二烯。
所述对叶大戟的果实中的大环二萜类化合物的制备方法,按下列步骤进行:
a、以对叶大戟的果实为原料,粉碎后用5-10倍量体积浓度为50-99%的乙醇水溶液、无水乙醇、纯丙酮、体积浓度为50-99%的甲醇水溶液、无水甲醇进行室温下的渗漉或冷浸提取,或加热回流提取,浓缩得到对叶大戟的粗提物;
b、将步骤a得到的粗提物用乙醇分散,加入石油醚、正己烷或环己烷萃取,或将粗提物用石油醚、正己烷或环己烷分散,再加入乙醇萃取3-5次,将乙醇萃取液浓缩,得到乙醇萃取物浸膏;
c、将步骤b得到的乙醇萃取物浸膏经正相硅胶柱层析、反相硅胶柱层析、sephadexlh-20凝胶柱层析法中的两种或三种进行分离,即得到式(ⅰ)为(2s*,3s*,4r*,5r*,13r*,15r*)-5-苯甲酰氧基-3-羟基-15-乙酰氧基假白榄烷-6(17),11e-二烯-9,14-二酮;式(ⅱ)化合物为(2r*,3r*,4s*,5r*,7s*,8s*,9s*,13s*,14s*,15r*)-5-苯甲酰氧基-14,15-二羟基-2,7-二异丁酰氧基-3,8,9-三乙酰氧基假白榄烷-6(17),11e-二烯;式(ⅲ)化合物为(2r,3r,4s,5r,7s,8s,9s,13s,14s,15r)-14-苯甲酰氧基-15-羟基-5-(2′-甲基-丁酰氧基)-7-异丁酰氧基-2,3,8,9-四乙酰氧基假白榄烷-6(17),11e-二烯。
步骤c中所用正相硅胶柱层析法为常压或加压柱层析,所用填料为硅胶,所用洗脱剂为石油醚、环己烷、正己烷、丙酮、三氯甲烷、二氯甲烷、乙酸乙酯、甲醇中至少两种溶剂的混合物,采用等度洗脱或梯度洗脱。
步骤c中所用反相硅胶柱层析法为常压或加压柱层析,洗脱剂为体积浓度为60-99%的甲醇水溶液或40-99%的乙腈水溶液,采用等度洗脱或梯度洗脱。
步骤c中所用sephadexlh-20凝胶柱层析法为常压柱层析,洗脱剂为甲醇、二氯甲烷或它们中至少两种溶剂的混合物,采用等度洗脱或梯度洗脱。
本发明所述的一种从对叶大戟果实中分离的大环二萜类化合物,对所述三个新的大环二萜类化合物进行了体外细胞毒活性测定及耐药逆转活性测定,实验结果表明:所述新的大环二萜类化合物对人乳腺癌细胞株mcf-7及人乳腺癌阿霉素耐药细胞株mcf-7/adr有较弱的细胞毒活性,并且化合物(ⅰ)-(ⅲ)具有不同程度的多药耐药逆转活性。
本发明所述的对叶大戟的果实中的大环二萜类化合物,可通过从植物中分离纯化得到,也可以经本领域技术人员熟知的化学修饰方法合成获得。
本发明所述的对叶大戟的果实中的大环二萜类化合物,采用高分辨质谱、一维和二维核磁共振谱等现代波谱手段确定其结构,结构鉴定过程如下:
式(ⅰ)化合物为无色油状,
式(ⅱ)化合物为无色油状,[α]d20-27.7(c0.1,meoh);uv(meoh)λmax(logε)200(3.14),229(2.78),282(1.67)nm;ecd(meoh)204(δε-2.09),209(δε-1.72),224(δε-2.58),281(δε+0.11)nm。根据hresi(+)ms(m/z795.3568[m+na]+,计算值为c41h56o14na795.3568)确定其分子式为c41h56o14;根据1h,13cnmr以及二维核磁共振数据确定其结构,骨架类型为假白榄烷(jatrophane)型,命名为(2r*,3r*,4s*,5r*,7s*,8s*,9s*,13s*,14s*,15r*)-5-苯甲酰氧基-14,15-二羟基-2,7-二异丁酰氧基-3,8,9-三乙酰氧基假白榄烷-6(17),11e-二烯。其1h和13cnmr数据归属见表1[400mhz(1h),100mhz(13c),溶剂:cdcl3]。
式(ⅲ)化合物为白色无定型粉末,
表1.式(ⅰ)、式(ⅱ)、式(ⅲ)化合物的1h和13cnmr数据[δ(ppm),j(hz)]
*nd为未检测到该信号。
附图说明
图1为本发明式(ⅰ)化合物的1hnmr(400mhz,cdcl3)谱图;
图2为本发明式(ⅰ)化合物的13cnmr(100mhz,cdcl3)谱图;
图3为本发明式(ⅱ)化合物的1hnmr(400mhz,cdcl3)谱图;
图4为本发明式(ⅱ)化合物的13cnmr(100mhz,cdcl3)谱图;
图5为本发明式(ⅲ)化合物的1hnmr(400mhz,cdcl3)谱图;
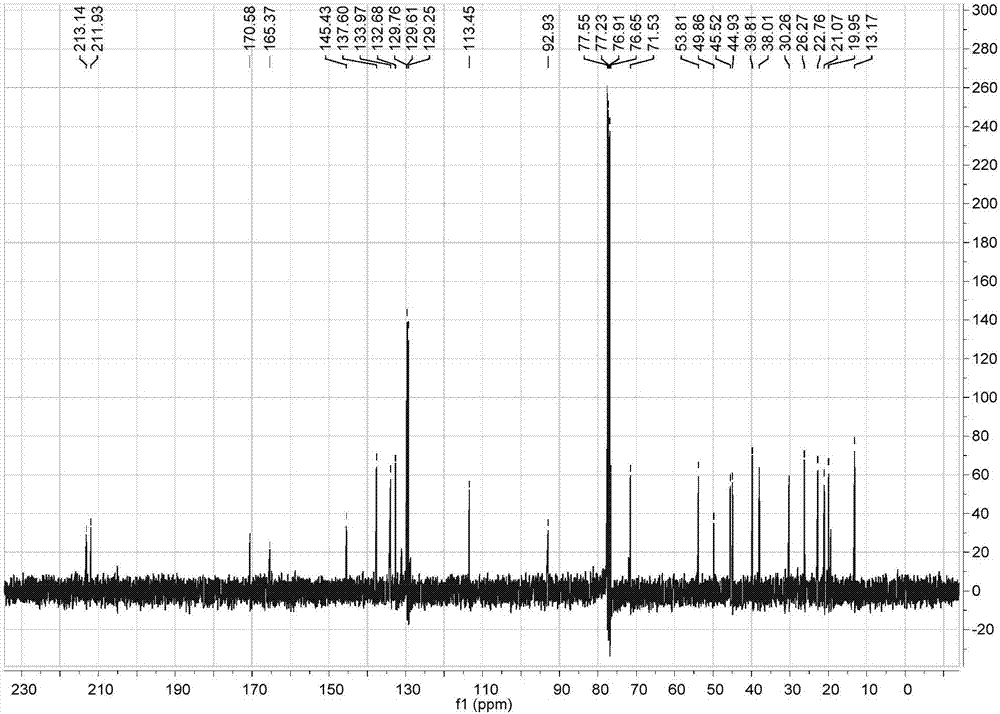
图6为本发明式(ⅲ)化合物的13cnmr(100mhz,cdcl3)谱图。
具体实施方式
实施例1
a、取对叶大戟的果实10kg,粉碎后用50l的浓度为50%的乙醇-水溶液室温下冷浸提取,减压蒸干溶剂得到对叶大戟粗提物;
b、将步骤a得到的粗提物用乙醇分散,加入石油醚进行萃取,合并乙醇层并减压蒸干得到乙醇萃取物浸膏;
c、将步骤b得到的乙醇萃取物浸膏用正相硅胶柱分离,用体积比10:1-0:1的石油醚-乙酸乙酯进行梯度洗脱,流分经硅胶薄层层析(tlc)分析,合并相同流分,得到6个组分(f1-f6);将组分f4进行正相硅胶柱分离,以体积比为100:0-0:100的氯仿-丙酮进行梯度洗脱,得到组分f4a-f4d;将组分f4b经rp-18反相柱分离,以浓度为65%-100%的甲醇-水溶液梯度洗脱,收集65%甲醇-水溶液(f4b1)和80%甲醇-水溶液(f4b3),减压蒸干,f4b1段采用正相硅胶柱分离,采用体积比为20:1-0:1的正己烷-丙酮进行梯度洗脱,得到组分f4b1a-f4b1k,f4b1b采用制备反相柱(c185μm10×250mm)分离,以浓度为68%的甲醇-水溶液等度洗脱,得到式(ⅰ)化合物为(2s*,3s*,4r*,5r*,13r*,15r*)-5-苯甲酰氧基-3-羟基-15-乙酰氧基假白榄烷-6(17),11e-二烯-9,14-二酮;f4b1g段采用制备反相柱(c185μm10×250mm)分离,以浓度为60%的乙腈-水溶液等度洗脱,得到式(ⅱ)化合物为(2r*,3r*,4s*,5r*,7s*,8s*,9s*,13s*,14s*,15r*)-5-苯甲酰氧基-14,15-二羟基-2,7-二异丁酰氧基-3,8,9-三乙酰氧基假白榄烷-6(17),11e-二烯;f4b3段采用制备反相柱(c185μm10×250mm)分离,以浓度为80%的乙腈-水溶液等度洗脱,得到式(ⅲ)化合物为(2r,3r,4s,5r,7s,8s,9s,13s,14s,15r)-14-苯甲酰氧基-15-羟基-5-(2′-甲基-丁酰氧基)-7-异丁酰氧基-2,3,8,9-四乙酰氧基假白榄烷-6(17),11e-二烯。
实施例2
a、取对叶大戟的果实10kg,粉碎后用60l的浓度为99%的乙醇-水溶液温度80℃下回流提取,减压蒸干溶剂得到对叶大戟粗提物;
b、将步骤a得到的粗提物用乙醇分散,加入正己烷进行萃取,合并乙醇层并减压蒸干得到乙醇萃取物浸膏;
c、将步骤b得到的乙醇萃取物浸膏用正相硅胶柱分离,用体积比10:1-0:1的正己烷-乙酸乙酯进行梯度洗脱,流分经硅胶薄层层析(tlc)分析,合并相同流分,得到6个组分(f1-f6);将组分f4进行正相硅胶柱分离,以体积比为100:0-0:100的氯仿-甲醇进行梯度洗脱,得到组分f4a-f4d;将组分f4b经rp-18反相柱分离,以浓度为80%-100%的乙腈-水溶液梯度洗脱,收集80%乙腈-水溶液(f4b1)和90%乙腈-水溶液(f4b3),减压蒸干,f4b1段采用正相硅胶柱分离,采用体积比为20:1-0:1的正己烷-乙酸乙酯进行梯度洗脱,得到组分f4b1a-f4b1k,f4b1b采用制备反相柱(c185μm10×250mm)分离,以浓度为48%的乙腈-水溶液等度洗脱,得到式(ⅰ)化合物为(2s*,3s*,4r*,5r*,13r*,15r*)-5-苯甲酰氧基-3-羟基-15-乙酰氧基假白榄烷-6(17),11e-二烯-9,14-二酮;f4b1g段采用制备反相柱(c185μm10×250mm)分离,以浓度为85%的甲醇-水溶液等度洗脱,得到式(ⅱ)化合物为(2r*,3r*,4s*,5r*,7s*,8s*,9s*,13s*,14s*,15r*)-5-苯甲酰氧基-14,15-二羟基-2,7-二异丁酰氧基-3,8,9-三乙酰氧基假白榄烷-6(17),11e-二烯;f4b3段经sephadexlh-20凝胶柱分离,用无水甲醇洗脱,得到式(ⅲ)化合物为(2r,3r,4s,5r,7s,8s,9s,13s,14s,15r)-14-苯甲酰氧基-15-羟基-5-(2′-甲基-丁酰氧基)-7-异丁酰氧基-2,3,8,9-四乙酰氧基假白榄烷-6(17),11e-二烯。
实施例3
a、取对叶大戟的果实10kg,粉碎后用70l的无水乙醇室温下冷浸提取,减压蒸干溶剂得到对叶大戟粗提物;
b、将步骤a得到的粗提物用乙醇分散,加入环己烷进行萃取,合并乙醇层并减压蒸干得到乙醇萃取物浸膏;
c、将步骤b得到的乙醇萃取物浸膏用正相硅胶柱分离,用体积比10:1-0:1的环己烷-乙酸乙酯进行梯度洗脱,流分经硅胶薄层层析(tlc)分析,合并相同流分,得到6个组分(f1-f6);将组分f4进行正相硅胶柱分离,以体积比为100:0-0:100的二氯甲烷-丙酮进行梯度洗脱,得到组分f4a-f4d;将组分f4b经rp-18反相柱分离,以浓度为65%-100%的甲醇-水溶液梯度洗脱,收集65%甲醇-水溶液(f4b1)和80%甲醇-水溶液(f4b3),减压蒸干,f4b1段采用正相硅胶柱分离,采用体积比为20:1-0:1的石油醚-乙酸乙酯进行梯度洗脱,得到组分f4b1a-f4b1k,f4b1b采用制备反相柱(c185μm10×250mm)分离,以浓度为60%的甲醇-水溶液等度洗脱,得到式(ⅰ)化合物为(2s*,3s*,4r*,5r*,13r*,15r*)-5-苯甲酰氧基-3-羟基-15-乙酰氧基假白榄烷-6(17),11e-二烯-9,14-二酮;f4b1g段采用制备反相柱(c185μm10×250mm)分离,以浓度为60%的乙腈-水溶液等度洗脱,得到式(ⅱ)化合物为(2r*,3r*,4s*,5r*,7s*,8s*,9s*,13s*,14s*,15r*)-5-苯甲酰氧基-14,15-二羟基-2,7-二异丁酰氧基-3,8,9-三乙酰氧基假白榄烷-6(17),11e-二烯;f4b3段经sephadexlh-20凝胶柱分离,用体积比为1:1的二氯甲烷-甲醇洗脱,得到式(ⅲ)化合物为(2r,3r,4s,5r,7s,8s,9s,13s,14s,15r)-14-苯甲酰氧基-15-羟基-5-(2′-甲基-丁酰氧基)-7-异丁酰氧基-2,3,8,9-四乙酰氧基假白榄烷-6(17),11e-二烯。
实施例4
a、取对叶大戟的果实10kg,粉碎后用80l纯丙酮室温下渗漉提取,减压蒸干溶剂得到对叶大戟粗提物;
b、将步骤a得到的粗提物用石油醚分散,加入乙醇萃取3次,合并乙醇层并减压蒸干得到乙醇萃取物浸膏;
c、将步骤b得到的乙醇萃取物浸膏用正相硅胶柱分离,用体积比10:1-0:1的石油醚-乙酸乙酯进行梯度洗脱,流分经硅胶薄层层析(tlc)分析,合并相同流分,得到6个组分(f1-f6);将组分f4进行正相硅胶柱分离,以体积比为100:0-0:100的氯仿-丙酮进行梯度洗脱,得到组分f4a-f4d;将组分f4b经rp-18反相柱分离,以浓度为80%-100%的乙腈-水溶液梯度洗脱,收集80%乙腈-水溶液(f4b1)和90%乙腈-水溶液(f4b3),减压蒸干,f4b1段采用正相硅胶柱分离,采用体积比为20:1-0:1的正己烷-丙酮进行梯度洗脱,得到组分f4b1a-f4b1k,f4b1b采用制备反相柱(c185μm10×250mm)分离,以浓度为40%的乙腈-水溶液等度洗脱,得到式(ⅰ)化合物为(2s*,3s*,4r*,5r*,13r*,15r*)-5-苯甲酰氧基-3-羟基-15-乙酰氧基假白榄烷-6(17),11e-二烯-9,14-二酮;f4b1g段采用制备反相柱(c185μm10×250mm)分离,以浓度为85%的甲醇-水溶液等度洗脱,得到式(ⅱ)化合物为(2r*,3r*,4s*,5r*,7s*,8s*,9s*,13s*,14s*,15r*)-5-苯甲酰氧基-14,15-二羟基-2,7-二异丁酰氧基-3,8,9-三乙酰氧基假白榄烷-6(17),11e-二烯;f4b3段采用制备反相柱(c185μm10×250mm)分离,以浓度为80%的乙腈-水溶液等度洗脱,得到式(ⅲ)化合物为(2r,3r,4s,5r,7s,8s,9s,13s,14s,15r)-14-苯甲酰氧基-15-羟基-5-(2′-甲基-丁酰氧基)-7-异丁酰氧基-2,3,8,9-四乙酰氧基假白榄烷-6(17),11e-二烯。
实施例5
a、取对叶大戟的果实10kg,粉碎后用90l的浓度为50%的甲醇-水溶液温度80℃下回流提取,减压蒸干溶剂得到对叶大戟粗提物;
b、将步骤a得到的粗提物用正己烷分散,加入乙醇进行萃取4次,合并乙醇层并减压蒸干得到乙醇萃取物浸膏;
c、将步骤b得到的乙醇萃取物浸膏用正相硅胶柱分离,用体积比10:1-0:1的正己烷-乙酸乙酯进行梯度洗脱,流分经硅胶薄层层析(tlc)分析,合并相同流分,得到6个组分(f1-f6);将组分f4进行正相硅胶柱分离,以体积比为100:0-0:100的氯仿-甲醇进行梯度洗脱,得到组分f4a-f4d;将组分f4b经rp-18反相柱分离,以浓度为65%-100%的甲醇-水溶液梯度洗脱,收集65%的甲醇-水溶液(f4b1)和80%的甲醇-水溶液(f4b3),减压蒸干,f4b1段采用正相硅胶柱分离,采用体积比为20:1-0:1的正己烷-乙酸乙酯进行梯度洗脱,得到组分f4b1a-f4b1k,f4b1b采用制备反相柱(c185μm10×250mm)分离,以浓度为68%的甲醇-水溶液等度洗脱,得到式(ⅰ)化合物为(2s*,3s*,4r*,5r*,13r*,15r*)-5-苯甲酰氧基-3-羟基-15-乙酰氧基假白榄烷-6(17),11e-二烯-9,14-二酮;f4b1g段采用制备反相柱(c185μm10×250mm)分离,以浓度为60%的乙腈-水溶液等度洗脱,得到式(ⅱ)化合物为(2r*,3r*,4s*,5r*,7s*,8s*,9s*,13s*,14s*,15r*)-5-苯甲酰氧基-14,15-二羟基-2,7-二异丁酰氧基-3,8,9-三乙酰氧基假白榄烷-6(17),11e-二烯;f4b3段经sephadexlh-20凝胶柱分离,用无水甲醇洗脱,得到式(ⅲ)化合物为(2r,3r,4s,5r,7s,8s,9s,13s,14s,15r)-14-苯甲酰氧基-15-羟基-5-(2′-甲基-丁酰氧基)-7-异丁酰氧基-2,3,8,9-四乙酰氧基假白榄烷-6(17),11e-二烯。
实施例6
a、取对叶大戟的果实10kg,粉碎后用100l的无水甲醇室温下渗漉提取,减压蒸干溶剂得到对叶大戟粗提物;
b、将步骤a得到的粗提物用环己烷分散,加入乙醇进行萃取5次,合并乙醇层并减压蒸干得到乙醇萃取物浸膏;
c、将步骤b得到的乙醇萃取物浸膏用正相硅胶柱分离,用体积比10:1-0:1的环己烷-乙酸乙酯进行梯度洗脱,流分经硅胶薄层层析(tlc)分析,合并相同流分,得到6个组分(f1-f6);将组分f4进行正相硅胶柱分离,以体积比为100:0-0:100的二氯甲烷-丙酮进行梯度洗脱,得到组分f4a-f4d;将组分f4b经rp-18反相柱分离,以浓度为80%-100%的乙腈-水溶液梯度洗脱,收集80%乙腈-水溶液(f4b1)和90%乙腈-水溶液(f4b3),减压蒸干,f4b1段采用正相硅胶柱分离,采用体积比为20:1-0:1的石油醚-乙酸乙酯进行梯度洗脱,得到组分f4b1a-f4b1k,f4b1b采用制备反相柱(c185μm10×250mm)分离,以浓度为48%的乙腈-水溶液等度洗脱,得到式(ⅰ)化合物为(2s*,3s*,4r*,5r*,13r*,15r*)-5-苯甲酰氧基-3-羟基-15-乙酰氧基假白榄烷-6(17),11e-二烯-9,14-二酮;f4b1g段采用制备反相柱(c185μm10×250mm)分离,以浓度为60%的乙腈-水溶液等度洗脱,得到式(ⅱ)化合物为(2r*,3r*,4s*,5r*,7s*,8s*,9s*,13s*,14s*,15r*)-5-苯甲酰氧基-14,15-二羟基-2,7-二异丁酰氧基-3,8,9-三乙酰氧基假白榄烷-6(17),11e-二烯;f4b3段经sephadexlh-20凝胶柱分离,用体积比为1:1的二氯甲烷-甲醇洗脱,得到式(ⅲ)化合物为(2r,3r,4s,5r,7s,8s,9s,13s,14s,15r)-14-苯甲酰氧基-15-羟基-5-(2′-甲基-丁酰氧基)-7-异丁酰氧基-2,3,8,9-四乙酰氧基假白榄烷-6(17),11e-二烯。
实施例7
本发明所述的从对叶大戟果实中分离的大环二萜类化合物在制备多药耐药逆转药物或与抗肿瘤药物组合制备抗肿瘤药物中的用途,以人乳腺癌细胞株及其阿霉素耐药株为例;
式(ⅰ)—式(ⅲ)化合物的细胞毒和耐药指数测试:
材料与试剂:rpmi1640培养基购自hyclone公司;双抗和胎牛血清购自hyclone公司;胰蛋白酶购自gibco公司;噻唑蓝(mtt)购自biosharp公司;二甲基亚砜(dmso)购自amresco公司;罗丹明123购于sigma公司;盐酸维拉帕米购自sigma公司;盐酸阿霉素购自上海生工有限公司;
细胞株:人乳腺癌细胞株mcf-7(购自中国科学院上海细胞库)及人乳腺癌阿霉素耐药细胞株mcf-7/adr(购自上海桥杜生物科技有限公司);
细胞培养:人乳腺癌细胞株mcf-7及其阿霉素耐药细胞株mcf-7/adr在rpmi1640完全培养基(rpmi1640培养基+10%fbs+1%双抗)中培养;所有细胞均置于co2培养箱(温度37℃,5%co2)维持传代培养,耐药株(mcf-7/adr细胞)在阿霉素终浓度为500ng/ml的完全培养基中耐药培养一周,再在1000ng/ml的完全培养基中耐药培养一周后,于无抗肿瘤药的完全培养基中培养两周后用于实验;
实验方法:mtt法,以5000个/孔的密度将处于对数生长期的mcf-7或mcf-7/adr细胞接种于96孔微量培养板内,在温度37℃培养箱孵育24h后加入供试单体化合物,每孔100μl,设6个浓度梯度,设6个复孔;另设无细胞调零组,溶剂(dmso)对照组及阳性药物对照组;肿瘤细胞在温度37℃、5%co2条件下培养48h后弃去上清液,加入mtt液(5mg/ml,用生理盐水配制,以1:9的比例与完全培养基混匀,每孔100μl),在温度37℃、5%co2条件下继续培养4h;弃去上清液,每孔加入150μldmso,待甲臜溶解后,用酶标仪检测各孔570nm的吸光度值(a);按下列公式计算供试单体化合物对肿瘤细胞生长的抑制率(ic10值和半数抑制量ic50值采用graphpadprism5.0软件计算)和耐药指数:抑制率(%)=(a对照组-a给药组)/a对照组×100%;抗肿瘤药阿霉素耐药指数(ri)=ic50(mcf-7)/ic50(mcf-7/adr);
实验结果:对叶大戟果实中分得的式(ⅰ)-式(ⅲ)化合物的半数生长抑制率,见表2:
表2对叶大戟果实中式(ⅰ)-式(ⅲ)化合物对人乳腺癌细胞株mcf-7和人乳腺癌阿霉素耐药细胞株mcf-7/adr的半数生长抑制率
由表2可知,式(ⅰ)-式(ⅲ)化合物对人乳腺癌细胞株mcf-7和人乳腺癌阿霉素耐药细胞株mcf-7/adr均未表现出细胞毒性(ic50>70μm),对mcf-7/adr细胞的抗肿瘤药阿霉素的耐药指数经计算得39.83;
式(ⅰ)-式(ⅲ)化合物逆转肿瘤多药耐药活性测试:
本实验选择对叶大戟果实中分得的大环二萜类化合物(ⅰ)-(ⅲ)与抗肿瘤药阿霉素(dox)联用,检测联用前后对耐药细胞的生长抑制,进行多药耐药逆转活性测试。
实验方法:将处于对数生长期的人乳腺癌阿霉素耐药细胞株mcf-7/adr细胞以5000个/孔的密度接种于96孔微量培养板(每孔100μl),在37℃培养箱中孵育24h后加入阿霉素和供试单体化合物或阳性对照药维拉帕米,每孔100μl,设7个浓度梯度,设6个复孔,并设空白对照组和溶剂(dmso)对照组;肿瘤细胞在温度37℃、5%co2条件下培养48h后弃去上清液,加入mtt液(5mg/ml,用生理盐水配制,以1:9的比例与完全培养基混匀,每孔100μl),在温度37℃、5%co2条件下继续培养4h后弃去上清液,每孔加入150μldmso,待甲臜溶解后,用酶标仪检测各孔570nm的吸光度值(a),按下列公式计算供试单体化合物对肿瘤细胞生长的抑制率:抑制率(%)=(a对照组-a给药组)/a对照组×100%;抗肿瘤药阿霉素耐药指数(ri)=ic50(mcf-7)/ic50(mcf-7/adr)。并按下列公式计算逆转倍数;
逆转倍数(rf)=ic50(阿霉素)/ic50(阿霉素+化合物)
实验结果:式(ⅰ)-式(ⅲ)化合物与阿霉素联用对mcf-7/adr细胞的半数生长抑制率及其逆转倍数见表3-表5:
表3式(ⅰ)化合物与阿霉素联用对mcf-7/adr细胞的半数生长抑制率
如表3所示,式(ⅰ)化合物与阿霉素联用后与阿霉素单独作用相比,ic50值降低,降低程度以逆转倍数表示,也即显示出一定程度的多药耐药逆转活性;
表4式(ⅱ)化合物与阿霉素联用对mcf-7/adr细胞的半数生长抑制率
由表4可知,阿霉素与式(ⅱ)化合物联用后与阿霉素单独作用相比,ic50值显著降低,降低程度以逆转倍数表示,5μm的式(ⅱ)化合物的逆转倍数(14.27倍)即与10μm阳性对照药维拉帕米相当(10.35倍),即式(ⅱ)化合物具有较强的逆转肿瘤多药耐药的活性;
表5式(ⅲ)化合物与阿霉素联用对mcf-7/adr细胞的半数生长抑制率
由表5可知,阿霉素与式(ⅲ)化合物联用后与阿霉素单独作用相比,ic50值显著降低,降低程度以逆转倍数表示,2.5μm的式(ⅲ)化合物的逆转倍数(10.60倍)即与10μm阳性对照药维拉帕米相当(10.35倍),即式(ⅲ)化合物具有较强的逆转肿瘤多药耐药的活性。
- 还没有人留言评论。精彩留言会获得点赞!