用于蛋白纯化的缓冲液体系的制作方法
本申请是申请号为201280024938.6、发明名称为“用于蛋白纯化的缓冲液体系”且申请日为2012年3月29日的中国专利申请(pct申请号为pct/us2012/031076)的分案申请。发明领域本发明涉及使用一系列色谱单元操作从细胞培养液或发酵培养液中纯化重组蛋白的领域。更具体地,本发明涉及不含氯化钠的缓冲液体系,该体系贯穿在蛋白纯化的一系列单元操作中使用,其中,酸碱组分连同第三种钠盐缓冲液组分以设定的比例组合,为稳健的色谱操作提供充分的对ph值和电导率的控制。
背景技术:
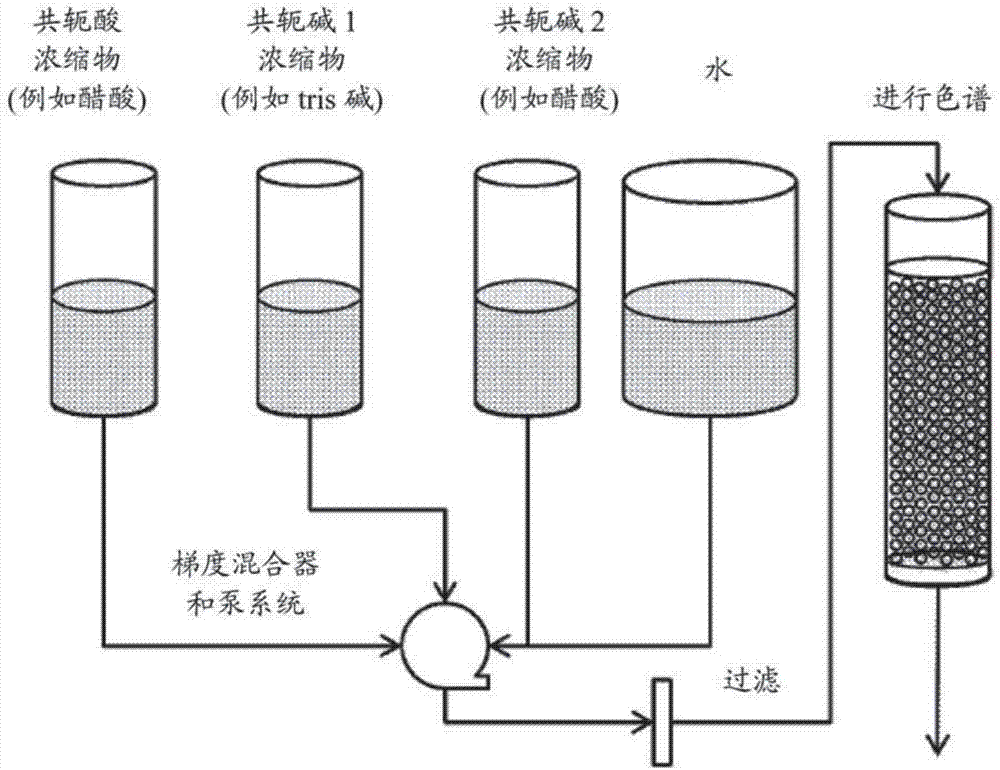
:在生物处理工业中已良好地建立用于回收重组蛋白的正交纯化工艺并且其继续发展以提高产量、清除杂质、降低产品成本、缩短开发时间,扩大规模等。近年来,平台(platform)方法已明显成熟,其中需要最低限度的开发工作的通用模板工艺可用于回收多种亚类的重组蛋白,尤其是单克隆抗体。在这种情况下,用于单克隆抗体和其它蛋白的平台工艺开发的核心理念是识别和执行适用于多类靶分子的常见的普通单元操作,其能产生一个可以快速设计可扩大规模的、稳健的工艺的纯化步骤的框架。由于开发针对色谱顺序和膜/过滤步骤的操作条件,一个重要的考虑因素是慎重选择产生稳健性和工艺性能提高的缓冲液组分。不用系统化的方法,通过传统的实验室规模的试验,缓冲液的选择过程常可产生大量的在单元操作到单元操作中并不一定被整合的并且在大规模生产的实行中可能是麻烦的组分。为了克服这些问题并且限定缓冲液组分的数量,需要一种整合工艺;此处,我们提出了不含氯化钠的双组分缓冲液体系。技术实现要素:一方面,本发明涉及通过一系列色谱步骤来纯化蛋白的多组分缓冲液体系,其中色谱模式选自蛋白a色谱(proteinachromatography)、阴离子交换色谱,阳离子交换色谱和混合模式色谱,其中所述色谱模式或者在结合洗脱模式下或者在流通模式下操作,其中所述多组分缓冲液体系包含有机酸、该有机酸的共轭碱的碱金属盐或铵盐以及有机碱,并且其中使用不添加nacl的缓冲液进行所述色谱模式。另一方面,本发明涉及通过蛋白a色谱法从受污染的溶液中纯化蛋白的方法,其包括:(a)用含55mmtris碱和45mm醋酸的ph约为7.5的蛋白a平衡缓冲液平衡固定在固相上的蛋白a;(b)从受污染的溶液中吸附蛋白至固定在固相上的蛋白a;(c)通过用含55mmtris碱、45mm醋酸和300mm醋酸钠的ph约为7.5的第一蛋白a冲洗缓冲液冲洗固相来去除污染物;以及(d)用含1.8mm醋酸钠和28.2mm醋酸的ph约为3.6的蛋白a洗脱缓冲液来从固相上回收蛋白,其中所有的缓冲液都不添加nacl。另一方面,本发明涉及通过流通阴离子交换色谱法从受污染的溶液中纯化蛋白的方法,其包括:(a)用含55mmtris碱和45mm醋酸的ph约为7.5的阴离子平衡缓冲液平衡阴离子交换基质;(b)向阴离子交换基质上样受污染的溶液并且收集第一流通液;以及(c)向阴离子交换基质使用含55mmtris碱、45mm醋酸和300mm醋酸钠的阴离子冲洗缓冲液并且收集第二流通液,其中所有的缓冲液都不添加nacl。另一方面,本发明涉及通过阳离子交换色谱法从受污染的溶液中纯化蛋白的方法,其包括:(a)用含25mm醋酸钠和12.1mm醋酸的ph约为5.0的阳离子平衡缓冲液平衡阳离子交换基质;(b)从受污染的溶液中吸附蛋白至阳离子交换基质;(c)通过用含25mm醋酸钠和12.1mm醋酸的ph约为5.0的第一阳离子冲洗缓冲液冲洗固相来去除污染物;以及(d)用含175mm醋酸钠和75mm醋酸的ph约为5.0的阳离子洗脱缓冲液来从固相上回收蛋白,其中所有的缓冲液都不添加nacl。从这个过程中排除氯化钠确保同时控制和避免高浓度的氯化物溶液对不锈钢加工设备的腐蚀影响。附图说明图1示出了单克隆抗体(mab)平台的下游工艺流程图和用于控制色谱工艺的关键的ph和离子强度范围。图2示出了为最小化对原料和储罐的需求,从浓缩物制备理想的大规模缓冲液的制备图。图3示出了对于醋酸和tris碱缓冲液体系的计算和实验的ph值、离子强度以及缓冲能力的曲线。图4示出了对于柠檬酸和tris碱缓冲液体系的计算和实验的ph值、离子强度以及缓冲能力的曲线。图5示出了醋酸和磷酸钠缓冲液体系的计算和实验的ph值、离子强度以及缓冲能力的曲线。图6示出了柠檬酸和磷酸钠缓冲液体系的计算和实验的ph值、离子强度以及缓冲能力的曲线。具体实施方式应当理解,本发明不限于具体的方法、试剂、化合物、组合物或生物系统,其当然可以变化。还应当理解,本文所用的术语仅为描述具体的实施方案,而不是为了限制。如本说明书及所附权利要求书中使用的,除非内容明确另有所指,单数形式“一个”、“一种”和“该”包括所指事物的复数形式。因此,例如,提及“多肽”包括两种或多种多肽的组合等。当涉及可测量值如量、持续时间等时,本文所用的“约”是指涵盖从特定数值的±20%或±10%的变体(包括±5%、±1%和±0.1%),这样的变体适于实施所公开的方法。除非另有所指,否则本文所用的所有技术和科学术语具有与本发明所属领域的技术人员通常所理解的相同的含义。尽管任何与本文所述的方法和材料相似或相当的方法和材料可用于本发明测试的实践中,但优选的材料和方法如本文所述。在描述和请求保护的本发明中,将用到以下术语。不含氯化钠的双组分缓冲液体系的优势是可以由适合于生物加工的各种各样的缓冲液组分(例如,醋酸和tris碱)来实现。然而,这一对特定的组分,以及第三钠盐共轭碱(即醋酸钠),为特别是结合了阴离子交换色谱和阳离子交换色谱作为捕获后的精炼步骤的单克隆抗体平台提供了优势。这类缓冲液物质特别适合于蛋白a色谱;其中通常在中性的ph的条件下进行平衡、装样和清洗并且洗脱需要变为低ph值的步骤。此处可以设计ph值7.0-8.0的醋酸/tris碱混合物为平衡进行缓冲,相同ph值的醋酸/醋酸钠/tris碱混合物用于清洗,后者使用高浓度的醋酸钠增加离子强度以优化工艺和清除与产品相关的杂质,以及低ph值(3.6~3.8)的醋酸/醋酸钠混合物用于洗脱。另一个优势简单地涉及在相关的离子交换色谱操作中醋酸盐和tris碱缓冲液物质的最小静电吸附或交换。更具体地,因为tris碱离子在中性ph条件下具有一个正电荷(其中,阴离子交换色谱常用于典型的具有高等电点的抗体),其大部分留在溶液中,在整个阴离子交换(aex)的流通步骤中于低的离子强度条件下提供充足的液相缓冲作用。相反,醋酸根离子具有负电荷并且通过阳离子交换色谱保留在溶液中,再次避免了缓冲液的伴离子(co-ions)交换并且在酸性ph的条件下(例如ph5.0)提供缓冲作用。这种方法有助于在温和的缓冲液浓度下通过步骤的改变保持恒定的ph值,避免了可导致在杂质清除和步骤效率丧失的ph值瞬变[1]、[2]、[3]。另一个重要优势涉及这种物质的单一pka值和在平台工艺中对于各个步骤最相关的ph值条件下的缓冲能力(见图1)。醋酸盐缓冲液的单一pka值,例如,可让强酸和强碱的量减少,便可达到降低ph值或在病毒灭活步骤中中和的目的,使通过添加导致的离子强度的增加最小化。在此步骤中,离子强度的最小化是获得以下阴离子交换色谱的流通步骤的最佳性能的关键。然后,阴离子交换产物的低离子强度使得在阳离子交换色谱步骤中结合能力变高,完全地整和了在此过程中所有的四个步骤(从缓冲液选择的角度来看),并避免了在各个步骤之间tfuf或稀释的需要。最后,从过程中排除氯化钠确保控制并避免高浓度的氯化物溶液对不锈钢加工设备的腐蚀影响。高浓度的氯化物溶液与腐蚀是有关联的,特别是在酸性ph值的水平下(例如在阳离子交换色谱中所需),并且已被报告成制造设备的问题[4]。本发明具体涉及在平台工艺的背景下,使用简化的酸/碱缓冲液体系结合钠盐缓冲液组分作为氯化钠、高浓度的tris碱或用于调节离子强度的其它组分的替代品。这种方法会导致跨越3.4~7.7的ph范围的对ph值和电导率更稳健的控制,转而,相对于更传统的采用了大量缓冲液组分的工艺,提高了各色谱步骤的性能。本文替换使用的“多肽”、“肽”和“蛋白”是指氨基酸残基的聚合物。多肽可以是天然(组织衍生的)起源的、重组的或由原核或真核细胞制品天然表达的,或者是经由合成方法化学生产的。该术语适用于氨基酸聚合物(其中一个或多个氨基酸残基为相应的天然存在的氨基酸的人工化学模拟物),也适用于天然存在的氨基酸聚合物和非天然存在的氨基酸聚合物。氨基酸模拟物是指具有与氨基酸的一般的化学结构不同的结构,但作用的方式与天然存在的氨基酸类似的化学化合物。科学和专利文献充分地描述了非天然残基。一些示例性的用作天然氨基酸残基模拟物的非天然组合物和指导如下所述。芳香族氨基酸的模拟物可通过由以下替代而生成:例如d-或l-萘基丙氨酸(naphylalanine);d-或l-苯基甘氨酸;d-或l-2噻吩基丙氨酸(thieneylalanine);d-或l-1,-2,3-,或4-芘基丙氨酸(pyreneylalanine);d-或l-3噻吩基丙氨酸(thieneylalanine);d-或l-(2-吡啶基)-丙氨酸;d-或l-(3-吡啶基)-丙氨酸;d-或l-(2-吡嗪基)-丙氨酸;d-或l-(4-异丙基)-苯基甘氨酸:d-(三氟甲基)-苯基甘氨酸;d-(三氟甲基)-苯丙氨酸:d-对-氟-苯丙氨酸;d-或l-对-联苯基苯丙氨酸;k-或l-对-甲氧基-联苯基苯丙氨酸:d-或l-2-吲哚(烷基)丙氨酸;和d-或l-烷基丙氨酸,其中烷基可以为取代或未取代的甲基、乙基、丙基、己基、丁基、戊基、异丙基、异丁基、sec-isotyl、异戊基,或非酸性氨基酸。非天然氨基酸的芳香族环包括,例如噻唑基、噻吩基(thiophenyl)、吡唑基、苯并咪唑基、萘基、呋喃基、吡咯基,和吡啶基芳香族环。本文所用的“肽”包括作为本文具体举例说明的那些肽的保守变体的肽。本文所用的“保守变体”表示使用另一生物学上相似的残基替代氨基酸残基。保守变体的实例包括但不限于,一个疏水性残基如异亮氨酸、缬氨酸、亮氨酸、丙氨酸、半胱氨酸、甘氨酸、苯丙氨酸、脯氨酸、色氨酸、酪氨酸、正亮氨酸或甲硫氨酸取代另一个疏水残基,或一个极性残基取代另一个极性残基,如精氨酸取代赖氨酸、谷氨酸取代天冬氨酸、或谷氨酰胺取代天冬酰胺等。可互相取代的中性亲水性氨基酸包括天冬酰胺、谷氨酰胺、丝氨酸和苏氨酸。“保守变体”还包括使用取代的氨基酸代替未取代的母体氨基酸,条件是取代的多肽的抗体也与未取代的多肽起免疫反应。这样的保守取代在本发明的肽的种类的定义之内。本文所用的“阳离子的”是指在ph7.4时具有净正电荷的任何肽。肽的生物活性可通过本领域技术人员已知的和本文所述的标准方法测定。当关于蛋白使用“重组”时,表示该蛋白已通过异源核酸或蛋白的引入或者天然核酸或蛋白的改造进行修饰。本文所用的“治疗性蛋白”指的是(例如)研究者或临床医生所寻找的、可向哺乳动物给药以引出组织、系统、动物或人类的生物学或医学应答的任何蛋白和/或多肽。治疗性蛋白可引出多于一种生物学或医学应答。而术语“治疗有效量”是指与未接受该量的相应的受试者相比,导致(但不限于)疾病、病症或副作用痊愈、预防或减轻,或者疾病或病症进展速率降低的任何量。该术语在其范围内还包括有效增强正常生理功能的量以及在患者中有效地引起增强或有助于第二种药物的治疗作用的生理功能的量。本文所鉴定的所有“氨基酸”残基为天然的l-构型。与标准多肽命名一致,氨基酸残基的缩写如下表所示。表1:氨基酸的缩写1个字母3个字母氨基酸ytyrl-酪氨酸gglyl-甘氨酸fphel-苯丙氨酸mmetl-甲硫氨酸aalal-丙氨酸sserl-丝氨酸iilel-异亮氨酸lleu亮氨酸tthrl-苏氨酸vvall-缬氨酸pprol-脯氨酸klysl-赖氨酸hhisl-组氨酸qginl-谷氨酰胺eglul-谷氨酸wtrpl-色氨酸rargl-精氨酸daspl-天冬氨酸nasnl-天冬酰胺ccysl-半胱氨酸应当注意所有的氨基酸残基序列在本文通过从左至右的方向为从氨基端至羧基端的常规方向的式子表示。在另一项实施方案中,该多肽为抗原结合多肽。在一项实施方案中,该抗原结合多肽选自可溶性受体、抗体、抗体片段、免疫球蛋白单一可变域、fab、f(ab’)2、fv、二硫键(disulphide)连接的fv、scfv、闭合构象的多特异性抗体、二硫键连接的scfv或双特异抗体。本文所用的术语“抗原结合多肽”指的是能够结合至抗原的抗体、抗体片段和其它蛋白构造。术语fv、fc、fd、fab,或f(ab)2使用其标准含义(参见,例如harlow等人,antibodiesalaboratorymanual,coldspringharborlaboratory,(1988))。“嵌合抗体”指的是一种工程抗体,其含有来自供体抗体的天然存在的可变区(轻链和重量)以及来自受体抗体的轻链和重链恒定区。“人源化抗体”指的是一种工程抗体,其cdr源自非人供体免疫球蛋白,而该分子的剩余的源自免疫球蛋白的部分来自一种(或多种)人免疫球蛋白。此外,可改变框架支持残基(frameworksupportresidues)以保持结合亲和力(见例如queen等人,proc.natl.acadsciusa,86:10029-10032(1989),hodgson等人,bio/technology,9:421(1991))。适合的人受体抗体可以通过与供体抗体的核苷酸和氨基酸序列的同源性选自常规数据库,例如kabat.rtm.数据库、losalamos数据库和瑞士蛋白数据库。由与供体抗体的框架区的同源性(在氨基酸基础上)表征的人抗体可能适于为供体cdrs的插入提供重链恒定区和/或重链可变框架区。能够提供轻链恒定或可变框架区的适合的受体抗体可以类似的方式选择。应当注意,受体抗体的重链和轻链不要求源自同一受体抗体。现有技术描述了生产这样的人源化抗体的若干种方法—见例如ep-a-0239400和ep-a-054951。术语“供体抗体”指的是一种抗体(单克隆和/或重组的),其将其可变区、cdrs或其它功能片段或其类似物的氨基酸序列贡献给第一免疫球蛋白配偶体,从而提供改变的免疫球蛋白编码区并生成表达的改变的抗体,该抗体具有抗原特异性和该供体抗体的中和活性特征。术语“受体抗体”指的是与该供体抗体异源的抗体(单克隆和/或重组的),其将编码其重链和/或轻链框架区和/或其重链和/或轻链恒定区的全部(或任何部分,但在一些实施方案中全部)氨基酸序列贡献给第一免疫球蛋白配偶体。在某些实施方案中,人抗体为受体抗体。“cdr”定义为抗体的互补决定区的氨基酸序列,其为免疫球蛋白重链和轻链的高变区。参见,例如kabat等人,sequencesofproteinsofimmunologicalinterest,4thed.,u.s.departmentofhealthandhumanservices,nationalinstitutesofhealth(1987)。在免疫球蛋白的可变部分有三个重链和三个轻链cdr(或cdr区)。因此,本文所用的“cdr”指的是所有三个重链cdr或所有三个轻链cdr(或如果适宜,所有的重链和所有的轻链cdr二者)。抗体的结构和蛋白折叠可能意味着其它残基被认为是抗原结合区的部分,且这可被技术人员理解。参见,例如chothia等人,(1989)conformationsofimmunoglobulinhypervariableregions;nature342,p877-883。本文所用的术语“域”指的是一种折叠的蛋白结构,其具有独立于该蛋白其它部分的三级结构。通常,域是蛋白离散功能特性形成的原因,且在很多情况中,域可以被添加、除去或转移至其它蛋白而无该蛋白剩余部分和/或域的功能缺失。“抗体单一可变域”是折叠的多肽域,其包含抗体可变域的序列特征。因此,它包括完全的抗体可变域和修饰的可变域,例如,其中一个或多个环被以下所代替:不是抗体可变域特征的序列,或已被平截的抗体可变域或者包含n-端或c-端延伸的抗体可变域,以及保留至少全长域的结合活性和特异性的可变域的折叠的片段。短语“免疫球蛋白单一可变域”指的是不依赖不同的v区或域而特异结合抗原或表位的抗体可变域(vh、vhh、vl)。免疫球蛋白单一可变域可与其它不同的可变区或可变域以一种形式(例如同型多体或异型多体)存在,其中其它区或域不是该单一免疫球蛋白可变域抗原结合所必需的(例如,其中该免疫球蛋白单一可变域结合抗原不依赖于另外的可变域)。本文所用的术语“域抗体”或“dab”与能够结合至抗原的“免疫球蛋白单一可变域”是相同的。免疫球蛋白单一可变域可以是人抗体可变域,但也包括来自其它物种如啮齿动物(例如,wo00/29004所公开的)、铰口鲨和骆驼科的vhhdab(纳米体)的单一抗体可变域。骆驼科vhh是来自包括普通骆驼、美洲驼、羊驼、单峰骆驼和原驼物种的免疫球蛋白单一可变域多肽,其产生天然缺乏轻链的重链抗体。这样的vhh域可根据本领域可用的标准技术人源化,而且根据本发明这样的域仍被认为是“域抗体”。本文所用的"vh包括骆驼科vhh域。narv是另一种类型的免疫球蛋白单一可变域,其在包括铰口鲨的软骨鱼中被鉴定。这些域也被称为新型抗原受体可变区(通常简写成v(nar)或narv)。更多详情参见mol.immunol.44,656-665(2006)和us20050043519a。术语“表位结合域”指的是不依赖于不同的v区或域特异地结合抗原或表位的域,这可以是域抗体(dab),例如人、骆驼科或鲨鱼免疫球蛋白单一可变域。如本文所用,术语“抗原结合位点”指的是能够特异地结合至抗原的蛋白上的位点,这可以是单一域,例如表位结合域,或者它可以是可在标准抗体上找到的成对的vh/vl域。在本发明的一些方面中,单链fv(scfv)域可提供抗原结合位点。本文所用的术语“mabdab”和“dabmab”指的是本发明的抗原结合蛋白。这两个术语可替换使用,并具有本文所用的相同含义。一方面,本发明涉及通过一系列色谱步骤来纯化蛋白的多组分缓冲液体系,其中色谱模式选自包括亲和色谱、阴离子交换色谱、阳离子交换色谱和混合模式色谱,其中所述色谱模式或者在结合洗脱模式下或者在流通模式下操作,其中所述多组分缓冲液体系包含有机酸、该有机酸的共轭碱的碱金属盐或铵盐以及有机碱,并且其中使用不添加nacl的缓冲液进行所述色谱模式。在一项实施方案中,使用超抗原来进行亲和色谱。“超抗原”指的是与免疫球蛋白超家族成员在不同于这些蛋白的靶配体结合位置的位置上互相作用的通用配体。葡萄球菌肠毒素就是一个与t细胞受体互相作用的超抗原的例子。结合抗体的超抗原包括,但不限于:结合igg恒定区的蛋白g(bjorckandkronvall,j.immunol.,133:969(1984));结合igg恒定区和vh域的蛋白a(forsgrenandsjoquist,j.immunol.,97:822(1966));以及结合vl域的蛋白l(bjorck,j.immunol.,140:1194(1988))。在一项实施方案中所述超抗原为蛋白a。在许多情况下,实际选择所需蛋白将流通但污染物会结合的条件可能会更有利。这种结合模式通常称为“流通”模式。在本申请的解决方案中,在色谱过程中流通的是“流通液”。本文所用的术语“蛋白a”包括:从天然来源回收的蛋白a、合成的蛋白a(即通过多肽合成或通过重组技术)以及保持与具有ch2/ch3域的蛋白结合的能力的变体。可以从repligen、pharmacia和fermatech购买蛋白a。超抗原在固相上被固定。"固相"是指超抗原可附着的非水性基质。本文中所考虑的固相一般包括玻璃、二氧化硅、琼脂糖或聚苯乙烯表面。固相可以是纯化柱或分散颗粒的非连续相。在优选的实施方案中,所述固相是可控的多孔玻璃柱或硅酸柱。在一些实施方案中,用一种试剂(如甘油)涂布在固相上,这是为了防止污染物非特异性地附着到固相上。"缓冲液"是指通过酸碱共轭组分的作用来阻止ph值变化的缓冲溶液。本文中的“平衡缓冲液”用来为色谱准备固相。“上样缓冲液”用于将蛋白和(多种)污染物的混合物上样到色谱基质上。平衡缓冲液和上样缓冲液可以相同。“洗脱缓冲液”用于从色谱基质中洗脱蛋白。“盐”是由酸和碱相互作用而形成的化合物。在一项实施方案中,所述有机酸包括,但不仅限于:甲酸、乙酸、乳酸、柠檬酸、苹果酸、马来酸、甘氨酸、磷酸、甘氨酰甘氨酸(glycylclycine)、琥珀酸、tes(2-{[三(羟甲基)甲基]氨基}乙磺酸)、mops(3-(n-吗啉代)丙磺酸)、pipes(哌嗪-n,n′-双(2-乙磺酸))以及mes(2-(n-吗啉代)乙磺酸)。在一项实施方案中,所述有机碱包括,但不仅限于,包括以下物质的组:tris碱、精氨酸、bis-tris、bis-tris-丙烷、bicine(n,n-双(2-羟乙基)甘氨酸)、hepes(4-2-羟乙基-1-哌嗪乙磺酸)、taps(3-{[三(羟甲基)甲基]氨基}丙磺酸)以及tricine(n-三(羟甲基)甲基甘氨酸)。在一项实施方案中,所述有机酸的共轭碱为该有机酸的共轭碱的钠盐、钾盐或铵盐。在一项实施方案中,所述有机酸是醋酸以及所述醋酸的共轭碱为钠盐。在一项实施方案中,所述蛋白是抗原结合蛋白。在一项实施方案中,所述抗原结合蛋白是抗体。在一项实施方案中,所述抗体为igg类。在一项实施方案中,所述抗原结合蛋白是免疫球蛋白单一可变域。在一项实施方案中,色谱步骤的顺序包括蛋白a色谱和流通阴离子交换色谱。在一项实施方案中,色谱步骤的顺序包括蛋白a色谱、流通阴离子交换色谱和阳离子交换色谱。在一项实施方案中,色谱步骤的顺序包括在ph约为7.5的约55mmtris碱、约45mm醋酸的存在下进行的蛋白a色谱。在一项实施方案中,色谱步骤的顺序包括在ph约为7.5的约55mmtris碱、约45mm醋酸的存在下进行的流通阴离子交换色谱。在一项实施方案中,色谱步骤的顺序包括在ph约为5.0的约25mm醋酸钠、约12.1mm醋酸的存在下进行的阳离子交换色谱。一方面,本发明涉及通过蛋白a色谱法从受污染的溶液中纯化蛋白的方法,其包括:(a)用含约55mmtris碱和约45mm醋酸的ph约为7.5的蛋白a平衡缓冲液平衡固定在固相上的蛋白a;(b)从受污染的溶液中吸附蛋白至固定在固相上的蛋白a;(c)通过用含约55mmtris碱、约45mm醋酸和300mm醋酸钠的ph约为7.5的第一蛋白a冲洗缓冲液冲洗固相来去除污染物;以及(d)用含约1.8mm醋酸钠和约28.2mm醋酸的ph约为3.6的蛋白a洗脱缓冲液来从固相上回收蛋白,其中所有的缓冲液都不添加nacl。在一项实施方案中,所述方法进一步包括在步骤(c)之后并且在步骤(d)之前的以下步骤:通过用含约55mmtris碱和约45mm醋酸的ph约为7.5的第二蛋白a冲洗缓冲液冲洗固相来去除污染物,其中所述第二蛋白a冲洗缓冲液不添加nacl。在一项实施方案中,所述方法进一步包括在步骤(d)之后的以下步骤:(e)用约30mm醋酸、约100mmhcl将含有回收蛋白的溶液滴定至ph约3.0;(f)使步骤(e)的溶液在约3.0的ph值维持约30至约60分钟;和(g)用约1mtris将步骤(f)的溶液的ph调节至约7.5。在一项实施方案中,所述方法进一步包括过滤由权利要求18所述的步骤(g)制备的溶液。一方面,本发明涉及通过流通阴离子交换色谱法从受污染的溶液中纯化蛋白的方法,其包括:(a)用含约55mmtris碱和约45mm醋酸的ph约为7.5的阴离子平衡缓冲液平衡阴离子交换基质;(b)向阴离子交换基质上样受污染的溶液并且收集第一流通液;以及(c)向阴离子交换基质使用含55mmtris碱、约45mm醋酸和约300mm醋酸钠的阴离子冲洗缓冲液并且收集第二流通液,其中所有的缓冲液都不添加nacl。在一项实施方案中,所述受污染的溶液为通过权利要求18所述的步骤(g)制备的溶液或权利要求19所述的经过滤的溶液。在一项实施方案中,第一流通液和第二流通液合并成单个合并的流通液。在一项实施方案中,用30mm醋酸、100mmhcl将第一流通液、第二流通液和单个合并的流通液的ph调节至约5.0。一方面,本发明涉及通过阳离子交换色谱法从受污染的溶液中纯化蛋白的方法,其包括:(a)用含约25mm醋酸钠和约12.1mm醋酸的ph约为5.0的阳离子平衡缓冲液平衡阳离子交换基质;(b)从受污染的溶液中吸附蛋白至阳离子交换基质;(c)通过用含约25mm醋酸钠和约12.1mm醋酸的ph约为5.0的第一阳离子冲洗缓冲液冲洗固相来去除污染物;以及(d)用含175mm醋酸钠和75mm醋酸的ph约为5.0的阳离子洗脱缓冲液来从固相上回收蛋白,其中所有的缓冲液都不添加nacl。在一项实施方案中,受污染的溶液选自权利要求20或21所述的第一流通液、权利要求20或21所述的第二流通液、权利要求22所述的单个合并的流通液和由根据权利要求23所制备的ph经调节的流通液。实施例1已经通过用于纯化抗体的平台工艺评价了一些可用于双组分的缓冲液体系中的可能的缓冲液组分,以及用于调节离子强度的第三组分(特意不包括氯化钠)。表2列出了这些通常被认为与生物处理兼容的组分。在这些实验中,图2中示出的具有梯度递送能力的液相色谱系统用于以不同比例混合浓缩的缓冲液,并测量ph值和电导率。图3、4、5、6示出了醋酸/tris碱、柠檬酸/tris碱、醋酸/磷酸钠和柠檬酸/磷酸钠各自的示例结果。在这些图中,空心圆圈的数据点代表了实验测得的作为缓冲溶液摩尔浓度的函数的ph值,而实线和虚线代表计算的ph值、电导率(一般与溶液的电导率成正比)、以及通过解析用于预测水溶液中离子行为的有效的戴维斯数学模型(daviesmathematicalmodel)[5]所确定的缓冲能力值。这些曲线可以确定所需的缓冲液比例,以制备产生于特定的ph和离子强度水平下的离子物质的混合物,并且该曲线因此成为评估用于具体的色谱步骤的缓冲液的适当性的工具。表2:双组分混合研究所考虑的缓冲液例如,图3显示了醋酸和tris碱混合物的这些结果,其证明,例如,为在ph7.5缓冲,需要55mmtris碱和45mm醋酸的组合物,并且该组合物提供了19mm的容量。一般来说,缓冲容量接近20mm时的缓冲液被认为是"充分"的缓冲液。表2中所示的各个组分的其它组合可以以这种方式评定并且然后在色谱实验中进行测试。采用这种方法以进一步确定,可能需要醋酸和tris碱的组合物以达到对于图1所示的整体平台工艺所需的ph值和电导率范围。对于在平台中各色谱单元操作具体地需要的ph值的范围为从3.6~7.5ph单位,伴随电导率水平的范围从低到高。后一种要求(电导率控制)可以用各个组分来实现。在这个实施例中,选定醋酸钠为醋酸的共轭碱,用于增加缓冲液的离子强度,其中钠离子提供了直接增加的离子强度。表3总结了用于纯化实验的该双组分缓冲液体系的最终缓冲液组合物。在此表中,注意在蛋白a冲洗和阳离子交换色谱的洗脱步骤中使用高浓度的醋酸钠,以及不存在氯化钠。表3:醋酸、醋酸钠和tris碱的缓冲液体系以及用在抗体平台的各个步骤中的其它溶液实施例2使用gehealthcare公司(piscataway,nj,usa)的aktaexplorer100系统来进行所有的色谱工艺。mabselectsure蛋白a和captoq色谱介质获自healthcare公司(piscataway,nj,usa)。gigacaps650m阳离子交换树脂获自tosohbioscience公司(montgomeryville,pa,usa)。根据制造商的建议,将色谱介质装填至1.1cm直径的vantage柱达25cm的柱床高度,所述vantage柱获自milliporecorporation公司(bedford,ma,usa)。使用glaxosmithklineuppermerion公司分部(kingofprussia,pa,usa)的哺乳动物细胞培养物来重组表达用于这项工作的igg单克隆抗体。所有的化学药品获自jtbaker公司(phillipsburg,nj,usa)或sigmaaldrich公司(stlouis,mo,usa)并且都是usp级别。蛋白a色谱根据表2,通过蛋白a色谱,利用mabselectsure来进行单克隆抗体的纯化。首先用ph7.5、55mmtris碱、45mm醋酸平衡色谱柱。然后,将澄清的哺乳动物细胞培养液上样至色谱柱,直到色谱柱上有足够的上样量。之后,用ph7.5的55mmtris碱、45mm醋酸、300mm醋酸钠冲洗色谱柱。在洗脱前用ph7.5的55mmtris碱、45mm醋酸再次平衡色谱柱。然后用ph3.6的1.8mm醋酸钠、28.2mm醋酸逐步洗脱色谱柱。低ph病毒灭活处理用30mm醋酸、100mmhcl将前一步骤的蛋白a洗脱液调节至ph3.5。将经调整的低ph的材料保持30到60分钟,然后用1mtris碱中和至ph7.5。然后过滤经中和的母液(pool)为制品用于随后的纯化步骤。阴离子交换流通色谱在用wfi(注射用水)冲洗预平衡之后,通过用ph7.5的55mmtris碱、45mm醋酸平衡captoq色谱柱来实现进一步的纯化。要注意的是,与用于蛋白a平衡的相同的缓冲液被再次用于此步骤中,其提供的优点是最大限度地减少需要制备的缓冲溶液数量。然后,将中和的母液上样于色谱柱,其中目标蛋白流动通过色谱柱并且被收集,而污染物仍然被结合在色谱柱上。分离蛋白之后,用适当的平衡缓冲液冲洗色谱柱,使得剩余的蛋白从柱中被冲洗出来并且能被收集。阳离子交换色谱用30mm醋酸、100mmhcl将从阴离子交换流通色谱步骤中收集的蛋白滴定至ph5.0。再次留意,在此步骤中再利用用于调节ph的低ph处理液。用ph5.0的25mm醋酸钠、12.1mm醋酸平衡gigacaps650m柱。然后,将滴定过的上样样品上样至色谱柱,直到实现所需的上样量。之后,用ph5.0的25mm醋酸钠、12.1mm醋酸再次平衡色谱柱。接着,通过将ph5.0的175mm醋酸钠、75mm醋酸使用于色谱柱来逐步洗脱色谱柱。收集和保留色谱柱的洗脱液以作进一步处理。综上,本发明涉及以下方面:1.通过一系列色谱步骤来纯化蛋白的多组分缓冲液体系,其中色谱模式选自亲和色谱、阴离子交换色谱,阳离子交换色谱和混合模式色谱,其中所述色谱模式在结合洗脱模式下或者在流通模式下操作,其中所述多组分缓冲液体系包含有机酸、该有机酸的共轭碱的碱金属盐或铵盐以及有机碱,并且其中使用不添加nacl的缓冲液进行所述色谱模式。2.项1所述的体系,其中使用固定在固相上的超抗原来进行所述亲和色谱。3.项2所述的体系,其中超抗原选自蛋白a、蛋白g和蛋白l。4.上述项中任一项所述的体系,其中所述有机酸选自甲酸、乙酸、乳酸、柠檬酸、苹果酸、马来酸、甘氨酸、甘氨酰甘氨酸、琥珀酸、tes(2-{[三(羟甲基)甲基]氨基}乙磺酸)、mops(3-(n-吗啉代)丙磺酸)、pipes(哌嗪-n,n′-双(2-乙磺酸))以及mes(2-(n-吗啉代)乙磺酸)。5.上述项中任一项所述的体系,其中所述有机碱选自tris碱、bis-tris、bis-tris-丙烷、bicine(n,n-双(2-羟乙基)甘氨酸)、hepes(4-2-羟乙基-1-哌嗪乙磺酸)、taps(3-{[三(羟甲基)甲基]氨基}丙磺酸)以及tricine(n-三(羟甲基)甲基甘氨酸)。6.上述项中任一项所述的体系,其中所述有机酸的共轭碱为该有机酸的共轭碱的钠盐、钾盐或铵盐。7.上述项中任一项所述的体系,其中所述有机酸为醋酸。8.上述项中任一项所述的体系,其中所述有机碱为tris碱。9.上述项中任一项所述的体系,其中所述有机酸为醋酸以及所述有机酸的共轭碱为钠盐。10.上述项中任一项所述的体系,其中所述蛋白为抗原结合蛋白。11.项10所述的体系,其中所述抗原结合蛋白为igg类的抗体。12.项10所述的体系,其中所述抗原结合蛋白为免疫球蛋白单一可变域。13.上述项中任一项所述的体系,其中所述色谱步骤的顺序包括蛋白a色谱和流通阴离子交换色谱。14.上述项中任一项所述的体系,其中所述色谱步骤的顺序包括蛋白a色谱、流通阴离子交换色谱和阳离子交换色谱。15.上述项中任一项所述的体系,其中所述色谱步骤的顺序包括在ph约为7.5的55mmtris碱、45mm醋酸的存在下进行的蛋白a色谱。16.上述项中任一项所述的体系,其中所述色谱步骤的顺序包括在ph约为7.5的55mmtris碱、45mm醋酸的存在下进行的流通阴离子交换色谱。17.上述项中任一项所述的体系,其中所述色谱步骤的顺序包括在ph约为5.0的25mm醋酸钠、12.1mm醋酸的存在下进行的阳离子交换色谱。18.通过蛋白a色谱法从受污染的溶液中纯化蛋白的方法,其包括:(a)用含55mmtris碱和45mm醋酸的ph约为7.5的蛋白a平衡缓冲液平衡固定在固相上的蛋白a;(b)从受污染的溶液中吸附蛋白至固定在固相上的蛋白a;(c)通过用含55mmtris碱、45mm醋酸和300mm醋酸钠的ph约为7.5的第一蛋白a冲洗缓冲液冲洗固相来去除污染物;以及(d)用含1.8mm醋酸钠和28.2mm醋酸的ph约为3.6的蛋白a洗脱缓冲液从固相上回收蛋白,其中所有的缓冲液都不添加nacl。19.项18所述的方法,进一步包括在步骤(c)之后并且在步骤(d)之前的以下步骤:通过用含55mmtris碱和45mm醋酸的ph约为7.5的第二蛋白a冲洗缓冲液冲洗固相以去除污染物,其中所述第二蛋白a冲洗缓冲液不添加nacl。20.项18或19所述的方法,进一步包括在步骤(d)之后的以下步骤:(e)用30mm醋酸、100mmhcl将含有回收蛋白的溶液滴定至ph约3.0;(f)使步骤(e)的溶液在约3.0的ph值维持约30至约60分钟;和(g)用约1mtris将步骤(f)的溶液的ph调节至约7.5。21.项20所述的方法,进一步包括过滤由项18所述的步骤(g)制备的溶液。22.通过流通阴离子交换色谱法从受污染的溶液中纯化蛋白的方法,其包括:(a)用含55mmtris碱和45mm醋酸的ph约为7.5的阴离子平衡缓冲液平衡阴离子交换基质;(b)向阴离子交换基质上样受污染的溶液并且收集第一流通液;以及(c)向阴离子交换基质使用含55mmtris碱、45mm醋酸和300mm醋酸钠的ph约为7.5的阴离子冲洗缓冲液并且收集第二流通液,其中所有的缓冲液都不添加nacl。23.项22所述的方法,其中所述受污染的溶液为通过项18所述的步骤(g)制备的溶液或项19所述的经过滤的溶液。24.项22或23所述的方法,其中第一流通液和第二流通液合并成单个合并的流通液。25.项22、23或24所述的方法,其中用30mm醋酸、100mmhcl将第一流通液、第二流通液和单个合并的流通液的ph调节至约5.0。26.通过阳离子交换色谱法从受污染的溶液中纯化蛋白的方法,其包括:(a)用含25mm醋酸钠和12.1mm醋酸的ph约为5.0的阳离子平衡缓冲液平衡阳离子交换基质;(b)从受污染的溶液中吸附蛋白至阳离子交换基质;(c)通过用含25mm醋酸钠和12.1mm醋酸的ph约为5.0的第一阳离子冲洗缓冲液冲洗固相来去除污染物;以及(d)用含175mm醋酸钠和75mm醋酸的ph约为5.0的阳离子洗脱缓冲液来从固相上回收蛋白,其中所有的缓冲液都不添加nacl。27.项26所述的方法,其中受污染的溶液选自项20或21所述的第一流通液、项20或21所述的第二流通液、项22所述的单个合并的流通液和由根据项23所制备的ph经调节的流通液。参考文献1.ghose,s.;mcnerney,t.m.hubbard,b.phtransitionsinion-exchangesystems:roleinthedevelopmentofacationexchangeprocessforarecombinantprotein.biotechnol.prog.2002,18,530-537.2.sotoperez,j.andfrey,d.d.behavioroftheinadvertentphtransientformedbyasaltgradientintheion-exchangechromatographyofproteins,biotechnol.prog.2005,21,902-910.3.pabst,t.m.,carta,g.phtransitionsincationexchangechromatographiccolumnscontainingweakacidgroups.(2007)journalofchromatographya,1142,pp.19-31.4.zhou,j.x.,etal.ph–conductivityhybridgradientcation-exchangechromatographyforprocess-scalemonoclonalantibodypurification.journalofchromatographya,1175(2007)69–80.5.butler,j.n.,ionicequilibrium:solubilityandphcalculations.johnwileyandsons(1998)。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1