一种稳定表达猪源NOD2受体基因的NF‑κB双荧光素酶报告细胞及构建方法与流程
本发明属于生物技术领域。具体涉及稳定表达猪源nod2(pnod2)受体基因的nf-κb双荧光素酶报告细胞系及其构建方法。更具体地说,本发明提供能够用于研究pnod2活化激活下游nf-κb启动子报告基因检测稳定细胞系。本发明也为rna-seq技术高通量筛选pnod2静默和活化状态下稳定细胞内差异表达基因提供了生物材料,并为进一步研究nod2的种属特异性奠定了基础和平台。
背景技术:
nod样受体(nlr)nlrc2(nod2),nlr是位于细胞胞浆内的受体家族。人有22个成员,而鼠有34个成员。所有成员具有相似的结构域:n端的活性区域(effectordomain),中间的核苷酸结合和聚合区(nucleotide-bindingandoligomerizationdomain,nod)和c端的lrr(leucinerichrepeats)基序。根据n端活性区的不同,分成五个亚类:nlra(acidactivationdomain),nlrb(baculovirusinhibitorofapoptosisrepeats),nlrc(caspaseactivationandrecruitmentdomain,card),nlrp(pyrin)和nlrx(unknowndomain)[1]。nlrc2和nlrc1(也分别称为nod2和nod1)相类似,但与其它nlr不同:其它nlr活化后都没有基因转录而是形成炎症小体(inflammasome),而nod2和nod1活化后激活转录因子nf-κb及相应基因转录。nod2和nod1识别细菌成分糖肽(分别为mdp和ie-dap)活化后,活性区域card与下游接头分子rip2同源区结合形成信号复合体,最终激活转录因子nf-κb和炎症因子表达[1]。另外研究表明nod2能识别来自呼吸道合胞体病毒(rsv)、流感病毒(influenzavirus)和人巨细胞病毒(cmv)的rna并诱导抗病毒因子ifn[1]。与rlr(rig-i和mda5)类似,nod2n端有2cards活性区,很可能在识别rna后形成2cards四聚体活化下游接头蛋白mavs从而诱导产生ifn。
有报道分离了猪的nod2并转染hek293细胞,nod2在转染细胞的胞浆和胞膜内侧表达,并发现nod2能介导mdp刺激激活下游nf-κb[2]。之后有研究发现猪nod2的基因多态性与nod2的信号功能紧密相关[3]。
家畜nlr信号研究内容匮乏,有必要建立研究猪nod2信号通路的细胞体系。
参考文献:
1.bryant,c.e.,etal.,internationalunionofbasicandclinicalpharmacology.xcvi.patternrecognitionreceptorsinhealthanddisease.pharmacolrev,2015.67(2):p.462-504.
2.tohnom1,uedaw,azumay,shimazut,katohs,wangjm,asoh,takadah,kawaiy,saitot,kitazawah.molecularcloningandfunctionalcharacterizationofporcinenucleotide-bindingoligomerizationdomain-2(nod2).molimmunol.2008jan;45(1):194-203.
3.jozakik1,shinkaih,tanaka-matsudam,morozumit,matsumotot,tokid,okumuran,eguchi-ogawat,kojima-shibatac,kadowakih,suzukie,waday,uenishih.influenceofpolymorphismsinporcinenod2onligandrecognition.molimmunol.2009dec;47(2-3):247-52。
技术实现要素:
本发明的目的是提供一种稳定表达猪源nod2受体(pnod2)基因的nf-κb双荧光素酶报告细胞系及其构建方法。本发明建立在自主获得的pnod2基因和hek293-nf-κb双荧光素酶稳定报告细胞系的基础上,构建能够稳定表达猪源nod2受体基因的nf-κb双荧光素酶报告稳定细胞系。该细胞系既可以用于筛选验证pnod2与rna分子的识别和结合,也可以用于后续rna-seq技术研究nod2静默和活化状态下稳定细胞内差异表达基因分析研究。
本发明所采用的技术方案是:
一种稳定表达猪源nod2受体基因的nf-κb双荧光素酶报告细胞系,是指转入了猪源nod2的hek293-nf-κb细胞,所述hek293-nf-κb细胞是引入了nf-κb虫荧光素酶和内参海肾荧光素酶的hek293细胞。
本发明所述的稳定表达猪源nod2受体基因的nf-κb双荧光素酶报告细胞系的构建方法如下:
(1)含pnod2基因编码区的pcdna真核表达载体的构建
pnod2基因编码区的扩增和克隆。设计pcr引物,从猪pk15细胞rna中rt-pcr扩增pnod2基因编码区,扩增pcr片段经双酶切后和带有c-端ha表达标签的gatewaypentr4中间入门载体连接,经菌落pcr和酶切鉴定后获得阳性重组克隆。
lr位点特异重组反应。将鉴定的含pnod2的pentr4重组质粒(含attl位点)和目的pcdna表达载体pdest47(含attr位点)进行位点特异重组反应,经菌落pcr鉴定获得重组pcdnapnod2克隆。
重组pcdnapnod2的表达。重组pcdnapnod2转染293t细胞,48小时后细胞裂解物进行sds-page,蛋白转印膜进行抗ha抗体免疫印迹,结果表明pnod2在细胞中表达125kd的特异蛋白条带(图1)。
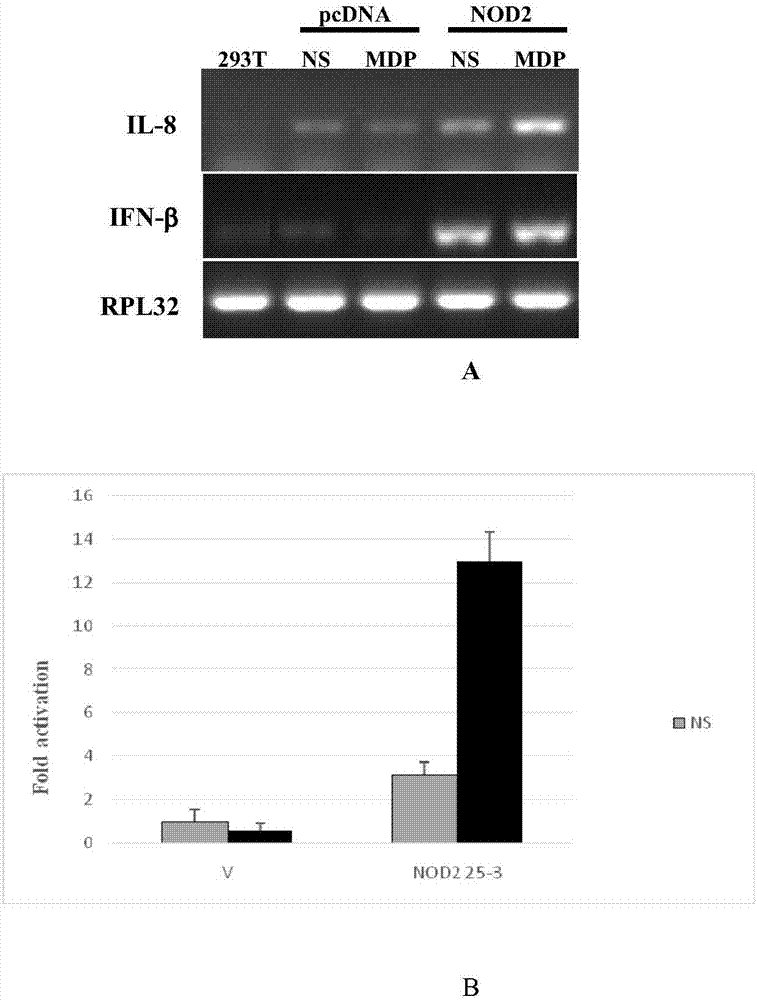
pnod2信号功能的鉴定。质粒pcdnapnod2转染293t细胞,24小时后用胞壁酰二肽(mdp)刺激12小时。提取所有细胞总rna,rt-pcr检测细胞下游细胞因子基因和相关基因表达(il-8和ifn-β)。结果表明pnod2转染组和和对照相比,pnod2表达自身就可以诱导il-8和ifn-β基因转录,同时可以介导mdp诱导il-8进一步表达(图2a)。nf-κb启动子试验也同样清楚表明pnod2不仅具有组成型活性,而且具备诱导性活性(图2b)。
(2)hek293-nf-κb双荧光素酶稳定报告细胞的构建:
培养人胚肾细胞(hek293)至融合度70%-80%,利用表达nf-κb虫荧光素(fluc)的慢病毒(blasticidin)感染hek293细胞,感染细胞用10μg/ml杀稻瘟菌素(blasticidin)筛选获得稳定表达nf-κb报告基因的hek293细胞系。经两次有限稀释法亚克隆,细胞克隆用tnf-α刺激细胞6-8小时,筛选对tnf-α刺激诱导产生高水平nf-κb活化,高表达fluc的单细胞克隆。上述细胞克隆用质粒tk海肾荧光素酶(rluc)和pbabehygro共转染,细胞经100μg/ml的潮霉素b(hygromycinb)筛选后获得稳定表达细胞。细胞再经过有限稀释法亚克隆,单个细胞克隆用不同浓度tnf-α刺激,选取对tnf-α刺激具有高水平fluc应答同时稳定高表达rluc的细胞克隆。
(3)pnod2-hek293-nf-κb稳定报告细胞系的构建:
培养hek293-nf-κb双荧光素酶报告细胞至融合度70%-80%,利用脂质体转染试剂lipofectin2000将含有pnod2基因的质粒pcdnapnod2转染入hek293-nf-κb细胞,经800μg/ml的g418筛选后获得表达pnod2编码基因的hek293-nf-κb细胞,经三轮细胞刺激鉴定筛选及扩大培养、获得稳定表达pnod2基因的hek293-nf-κb双荧光素酶稳定报告细胞系。
本发明公开了稳定表达猪源nod2(pnod2)受体基因的nf-κb荧光素酶稳定报告细胞系的制备方法。在获得hek293-nf-κb稳定表达双荧光素酶报告细胞系基础上,转染pnod2基因的真核表达质粒,经过g418筛选获得稳定表达猪源nod2(pnod2)受体基因的nf-κb双荧光素酶报告稳定细胞系。结果显示pnod2稳定报告细胞系能对对细菌mdp做出特异性应答(图3-4)。pnod2稳定报告细胞系的构建为进一步研究pnod2的功能奠定了生物材料基础,有利于进一步丰富有关pnod2的研究。双荧光素酶报告稳定细胞系含有内参荧光素报告基因,可以校正和避免实验中由于细胞毒性等差异造成的误差,使结果更为可信。
附图说明
图1:pnod2在转染细胞中的表达。
图2:pnod2信号功能的鉴定。
a,rt-pcr鉴定pnod2活化后引起下游细胞因子的转录。
b,nf-κb启动子双荧光素酶报告试验检测pnod2信号活性。
图3:nf-κb双荧光素酶报告实验验证pnod2-293-nf-κb稳定细胞系对多种刺激剂的应答。
图4:nf-κb双荧光素酶报告实验检验多次传代pnod2-293-nf-κb稳定细胞对mdp的特异应答。
具体实施方式
(1)含pnod2编码基因的pcdna真核表达载体的构建
pnod2基因编码区的扩增和克隆。
设计一对克隆pcr引物,上游引物为ttcgcggatccatgtgtgcccagggggctttccaggc(seqidno.1);下游引物为ttcgcgatatcaagcaggagtctcgtgtccctctggctgagc(seqidno.2)。从猪pk15细胞提取总rna,反转录(rt)生成cdna,以cdna为模板,pcr扩增pnod2基因编码区,扩增得到大小为3.0kb的dna片段。扩增pcr片段经bamhi和ecorv双酶切后和带有c-端2xha表达标签的gatewaypentr4中间入门载体经t4连接酶连接,连接产物转化感受态top10,转化细菌top10涂布卡那霉素抗性(kanamycin)细菌琼脂平板,重组克隆经菌落pcr和酶切鉴定,阳性中间质粒进一步dna测序进行验证。
所述带有c-端2xha表达标签的gatewaypentr4中间入门载体的构建方法如下:
入门空载体pentr4-n-flag(优宝生物,www.youbio.cn产品编号:vt2038)质粒扩增后,用ncoi酶切,琼脂糖胶回收酶切大片段,t4连接酶连接,转化top10感受态细胞,涂布卡那霉素(kanamycin)琼脂培养板。从转化菌落中提取质粒,dna测序确定得到去除n-端flag标签的质粒pentr4。
合成序列atcaccagctacccatacgatgttcctgactatgcgggctatccctatgacgtcccggactatgcatag(seqidno.3)及其互补序列,变性退火形成双链平端dna(dsdna)。质粒pentr4用ecorv酶切,碱性磷酸酶(ap)去磷酸化处理,和上述平端dna用t4连接酶连接,连接产物转化top10感受态细胞,涂布卡那霉素琼脂培养板。从转化菌落中提取质粒,ecorv酶切并dna测序鉴定。所合成的dna序列为2xha标签编码序列,5端加atcaccagc,3端加终止密码子tag。正确连接的ha标签序列上游保留了ecorv,下游是合成的终止密码子tag。
lr位点特异重组反应。
将经鉴定并序列正确的重组中间质粒pentr4-pnod2-2xha(含attl位点)和目的pcdna表达载体pdest47(含attr位;addgene,货号#36139)在lrclonsae(thermofisher,货号12538120)作用下进行位点特异lr重组反应,反应产物转化感受态dh5α并涂布氨苄青霉素(ampicillin)琼脂培养板,菌落pcr鉴定转化菌落,从阳性菌落培养物中提取质粒,获得重组目的表达质粒pcdnapnod2。
重组pcdnapnod2的表达。
分0.3x106细胞/孔于24-孔培养板,第二天用脂质体转染试剂lipofectamine2000(thermofisher)转染1μg重组pcdnapnod2到24-孔培养板中293t细胞。48小时后细胞裂解物进行sds-page,蛋白转印膜进行抗ha抗体免疫印迹,结果表明pnod2在细胞中表达125kd的特异蛋白条带(图1)。
pnod2信号功能的鉴定。
rt-pcr功能鉴定:质粒pcdnapnod2用lipofectamine2000转染293t细胞,24小时后用细菌胞壁酰二肽mdp(invivogen,货号:tlrl-mdp)1μg/ml刺激12小时。提取所有细胞总rna,rt-pcr检测细胞下游细胞因子基因il-8和ifnβ的表达。结果表明pnod2转染组和和对照相比,pnod2表达自身就可以诱导il-8和ifnβ转录尤其是ifnβ转录,同时可以介导mdp诱导il-8进一步表达(图2a)。nf-κb启动子报告基因鉴定:pcdnapnod2和nf-κbelam启动子驱动的虫荧光素酶报告基因(fluc)以及海肾荧光素酶报告基因(rluc)共转染293t细胞,转染24小时后,细胞用于mdp刺激12小时。收获细胞并裂解细胞,细胞裂解液用transdetectdouble-luciferasereporterassaykit(transgenbiotech)检测nf-κb报告基因表达活性。试验结果也同样清楚表明pnod2不仅具有组成型活性,而且具备mdp诱导性活性(图2b)。
(2)hek293-nf-κb双荧光素酶稳定报告细胞的构建:
培养人胚肾细胞(hek293)至融合度70%-80%,利用表达nf-κb虫荧光素(fluc)的慢病毒(blasticidin)感染hek293细胞,感染细胞用10μg/ml杀稻瘟菌素(blasticidin)筛选获得稳定表达nf-κb报告基因的hek293细胞系。两次有限稀释法亚克隆,细胞克隆用tnf-α刺激细胞6-8小时,筛选对tnf-α刺激诱导产生高水平nf-κb活化,高表达fluc的单细胞克隆。上述细胞克隆用质粒tk海肾荧光素酶(rluc)和pbabehygro共转染,细胞经100μg/ml的潮霉素b(hygromycinb)筛选后获得稳定表达细胞。细胞再经过有限稀释法亚克隆单个细胞克隆用不同浓度tnf-α刺激,选取对tnf-α刺激具有高水平fluc应答同时稳定高表达rluc的细胞克隆。
(3)pnod2-hek293-nf-κb稳定表达细胞系的构建:
培养hek293-nf-κb双荧光素酶报告细胞至融合度70%-80%,利用脂质体转染试剂lipofectin2000将含有pnod2基因的质粒pcdnapnod2转染入hek293-nf-κb报告细胞,经800μg/ml的g418筛选1-2周后获得表达pnod2编码基因的hek293-nf-κb细胞,经三轮细胞刺激鉴定筛选及扩大培养、获得稳定表达pnod2基因的hek293-nf-κb双荧光素酶稳定报告细胞系。
(4)pnod2-hek293-nf-κb稳定表达细胞的刺激试验:
分0.3x105pnod2-hek293-nf-κb细胞/孔于96-孔培养板过夜培养,第二天用7种刺激剂包括mdp(1μg/ml)(invivogen,货号:tlrl-mdp),ie-dap(10μg/ml)(invivogen,货号:tlrl-dap),lps(1μg/ml)(invivogen,货号:tlrl-b5lps),cpg2007(10μg/ml)(人工合成寡核苷酸,序列为seqidno.4:tccatgacgttcctgacgtt),fsl-1(10μg/ml)(invivogen,货号:tlrl-fsl),lwmpic(1μg/ml)(invivogen,货号:tlrl-picw)和hmwpic(1μg/ml)(invivogen,货号:tlrl-pic)刺激pnod2-hek293-nf-κb稳定表达细胞,刺激12小时后,双重荧光素酶报告试验检测下游报告基因的活性(transdetectdouble-luciferasereporterassaykit,transbiotech,货号,fr201-02)。具体如下:弃营养液,每孔加50μl细胞裂解液裂解10分钟左右,取20μl于96孔分析板中,先加入15μlluciferasereactionreagenti轻轻混匀放入化学发光仪中读出萤火虫荧光素酶报告基因(fluc)的活性,再加入15μlluciferasereactionreagentⅱ混匀后读出海肾荧光素酶报告基因(rluc)的活性,fluc经rluc校正后,各刺激样品的fluc/rluc数值和不刺激(ns)对照数值比对,计算各刺激样品刺激倍数(图3)。
将pnod2-hek293-nf-κb稳定表达细胞多次传代后,分0.3x105细胞/孔于96-孔培养板过夜培养,第二天用特异性刺激剂mdp(1μg/ml)刺激稳定细胞。刺激12小时后双重荧光素酶报告试验检测下游报告基因的活性(transdetectdouble-luciferasereporterassaykit,transbiotech,货号,fr201-02)。弃营养液,每孔加50μl细胞裂解液裂解10分钟左右,取20μl于96孔分析板中,先加入15μlluciferasereactionreagenti轻轻混匀放入化学发光仪中读出fluc的活性,再加入15μlluciferasereactionreagentⅱ混匀后读出rluc的活性,fluc经rluc校正后,刺激样品的fluc/rluc数值和不刺激(ns)对照数值比对,计算刺激样品刺激倍数(图4)。
sequencelisting
<110>扬州大学
<120>一种稳定表达猪源nod2受体基因的nf-κb双荧光素酶报告细胞及构建方法
<130>
<160>4
<170>patentinversion3.3
<210>1
<211>37
<212>dna
<213>人工序列
<400>1
ttcgcggatccatgtgtgcccagggggctttccaggc37
<210>2
<211>42
<212>dna
<213>人工序列
<400>2
ttcgcgatatcaagcaggagtctcgtgtccctctggctgagc42
<210>3
<211>69
<212>dna
<213>人工序列
<400>3
atcaccagctacccatacgatgttcctgactatgcgggctatccctatgacgtcccggac60
tatgcatag69
<210>4
<211>20
<212>dna
<213>人工序列
<400>4
tccatgacgttcctgacgtt20
- 还没有人留言评论。精彩留言会获得点赞!
- 一种二化螟Bt蛋白受体ALP4基因及其应用
- 一种二化螟Bt蛋白受体ALP5基因及其应用
- 水稻ABA受体OsPYL3基因、其编码蛋白及其应用
- 用于在原代免疫细胞中表征糖皮质激素受体配体的反式激活和反式阻抑活性的方法
- 检测表皮生长因子受体基因位点突变的荧光定量pcr试剂盒的制作方法
- 糖链识别受体的新用途的制作方法
- T1r味觉受体及其编码基因的制作方法
- 放射性配基N<sub>2</sub>S<sub>2</sub>-Memantine和脑受体显像剂<sup>99m</sup>Tc-Memantine的油水分配系数测定方法
- 作为黑皮质素受体配体用于治疗肥胖症的2-烷基-(2-氨基-3-芳基-丙酰基)哌嗪 ...的制作方法
- 猕猴雌二醇受体β基因片段及其应用的制作方法
- 一种二化螟Bt蛋白受体ALP4基因及其应用
- 一种二化螟Bt蛋白受体ALP5基因及其应用
- 水稻ABA受体OsPYL3基因、其编码蛋白及其应用
- 检测表皮生长因子受体基因位点突变的荧光定量pcr试剂盒的制作方法
- 抗人雌激素受体单克隆抗体及抗人孕激素受体单克隆抗体的制备及应用的制作方法
- 子宫癌遗传检测试剂盒的制作方法
- 一种利用雌激素受体α基因预测优秀冰雪运动员身高的细胞生物学方法
- T1r味觉受体及其编码基因的制作方法
- 放射性配基N<sub>2</sub>S<sub>2</sub>-Memantine和脑受体显像剂<sup>99m</sup>Tc-Memantine的油水分配系数测定方法
- 猕猴雌二醇受体β基因片段及其应用的制作方法
- 水稻ABA受体OsPYL3基因、其编码蛋白及其应用
- 一株胞内表达枯草芽孢杆菌漆酶的基因工程菌株及实现该菌株分泌表达漆酶的诱导方法
- 检测表皮生长因子受体基因位点突变的荧光定量pcr试剂盒的制作方法
- T1r味觉受体及其编码基因的制作方法
- 放射性配基N<sub>2</sub>S<sub>2</sub>-Memantine和脑受体显像剂<sup>99m</sup>Tc-Memantine的油水分配系数测定方法
- 猕猴雌二醇受体β基因片段及其应用的制作方法
- 一种受体蛋白及其编码基因与应用的制作方法
- 一种水稻乙烯受体类蛋白及其编码基因与应用的制作方法
- 栉孔扇贝TGF-β I型受体基因及其SNP位点的制作方法
- 双峰驼褪黑素受体、编码基因及其获取方法