一种吡喃葡萄糖基取代的EGCG化合物及其制备方法和用途与流程
本发明属于药物治疗领域,具体涉及一种吡喃葡萄糖基取代的化合物egcg及其制备方法和用途。
背景技术:
茶叶中含有大量的多酚类化合物,这些化合物统称为茶多酚(teapolyphenol,tp),约占茶叶干重的18%-36%,同时大量研究表明茶多酚具有很强的抗氧化能力,一直作为天然的食品抗氧化添加剂(葛建等,安徽农业大学学报,2011,38(2):156-163.)。通过对茶多酚的化学成分研究表明,茶多酚的主要成分是儿茶素(c)、表儿茶素(ec)、表儿茶素没食子酸酯(ecg)、表没食子酸儿茶素(egc)及表没食子儿茶素没食子酸酯(egcg)等多种活性物质。其中,egcg含量最高,约占儿茶素总量的50%-60%。目前大量研究表明egcg具有抗癌、抗突变、抗衰老、降血脂、降血压、降血糖、抗辐射、预防和治疗心脑血管系统疾病以及调理内分泌、免疫系统等生物活性(毛小强等,中国实验诊断学,2010,14(2):170-173.傅颖等,中国卫生检验杂志,2009,19(11):2506-2508.陈悦等,中国药学杂志,2010,45(3):190-192.)。
抗氧化作用一直是egcg等茶多酚类物质所具有的重要功能,并作为食品添加剂在广泛使用。除此之外,茶多酚中的主要成分还可以消除体内自由基、延缓机体衰老。有研究发现egcg能够降低肝脏中ccl4诱导的肝炎、氧化应激及纤维化作用,其作用机制是降低了致炎因子及纤维化调节因子的转录表达(zhenmc,etal.journalofnutritionalbiochemistry,2007,18:795-805.tipoegl,etal.toxicology,2010,273(1/3):45-52.)。另外,较多的研究发现egcg在治疗和干预神经系统疾病上具有良好的效果。单胺氧化酶b作为脑组织中一种重要酶类,能够引起脑组织脂质过氧化加剧,而egcg能够组织特异性的抑制该酶的活性(xiej,etal.neuroscienceletter,2010,497(1):26-30.)。有大量研究表明egcg能够保护神经退行性疾病(阿尔茨海默病、帕金森等)中神经元免受损伤。egcg对多种肿瘤细胞均具有显著效果,通过干扰细胞内不同的细胞信号途径从而诱导肿瘤细胞凋亡。近几年对egcg抗结肠癌的研究较多,在人结肠癌细胞hct-116中,肝细胞生长因子能够诱导met受体酪氨酸激酶磷酸化,从而使得肿瘤组织血管再生以及肿瘤细胞在体内发生转移,而egcg却浓度依赖性的抑制这一磷酸化过程(larsenca,etal.archivesofbiochemistryandbiophysics,2010,501(1):52-30.)。同时有研究表明,egcg还能降低胆固醇的溶解性及改变乳糜粒,从而抑制机体对脂质的吸收来降低血浆中脂质水平,从而保护心脑血管(raederstorffdg,etal.journalofnutritionalbiochemistry,2003,14:326-332.)。作为预防疾病和调节机体稳态的重要系统,机体免疫和内分泌系统已成为研究热点。就egcg对免疫和内分泌系统的作用而言,目前已有部分文献进行了报道。众所周知,单核细胞趋化蛋白-1(mcp-1)是机体发生炎症过程中一种重要的介导因子,egcg能够抑制由佛波酯诱导的mcp-1表达升高,从而对机体的抗炎作用产生重要影响(hongmh,etal.lifesciences,2007,80(1):1957-1965.)。终上所述,egcg除具有上述各种生物活性作用外,目前也有部分研究表明egcg还具有抗菌、生发及促进骨细胞生长等多种活性。egcg是一个极具研究价值的化合物实体。
egcg分子具有多羟基化学结构,水溶性较好,然而,egcg在进入小鼠、大鼠、人等生物体内后,却由于脂溶性差(huocd,etal.tetrahedronletter,2011,52(42):5478-5483.celizg,etal.processbiochemistry,2011,46(1):94-100.),存在生物体生理环境下不稳定(chiouys,etal.carcinogenesis,2013,34(6):1315-1322.)、体内吸收慢(zhongy,etal.foodchemistry,2012,1342):742-748.)、生物利用度低(gomezlg,etal.foodhydrocolloids,2016,61:128-138.koutela,etal.clinicalnutritionespen,2016,13:55-56.)等诸多问题,限制了egcg的进一步应用。
因此,采用分子修饰手段,改变egcg分子结构成为目前亟待解决的问题。
技术实现要素:
本发明涉及吡喃葡萄糖基取代的表没食子儿茶素没食子酸酯化合物及其药学上可接受的盐及用途和制备方法,增强该化合物的抗老年痴呆的活性的同时,使其更具稳定性,体内吸收更迅速,生物利用度更高。
为了实现上述目的,本发明是这样实现的:一种吡喃葡萄糖基取代的表没食子儿茶素没食子酸酯(egcg)化合物,其特征在于该化合物的通式i如下:
r1为下列基团中的任意一个基团:未取代或各种取代的氨基,c1-6烷基,c1-6羟基烷基,c1-6氨基烷基,c1-6氰基烷基,c1-6烷氧基烷基,c2-6链烯基,c2-6链炔基,c1-6烷基磺酰基,c2-6链烯基磺酰基,c2-6链炔基磺酰基,c1-6烷基羰基,c2-6链烯基羰基,c2-6链炔基羰基。
优选的,该化合物的通式i中,r1为下列基团中的任意一个基团:氨基、甲氨基、丙氨基、环丙氨基、2-羟基乙氨基、2-氰基乙氨基、苯磺酰氨基、对甲氧基苯磺酰氨基、乙酰氨基、苯甲酰氨基、对甲氧基苯甲酰氨基、丙烯酰氨基。上述化合物的化学式为:
优选的,该化合物为任何药学上可接受的盐类。
优选的,该化合物为任何药物治疗学上可接受的的剂型。
优选的,该化合物为任何药物治疗学上可接受的的剂量。
一种吡喃葡萄糖基取代的表没食子儿茶素没食子酸酯(egcg)化合物的制备方法,该制备方法包括如下步骤:
是以表没食子儿茶素没食子酸酯(egcg)为起始原料,以4-二甲氨基吡啶(dmap)为催化剂,用乙酸酐进行乙酰化保护,得到中间体a-1,a-1的化学式为
将中间体a-1溶解于n-甲基吡咯烷酮(nmp)中,加入咪唑和苯硫酚,选择性脱掉7位的乙酰基保护基,得到中间体a-2,a-2的化学式为
中间体a-2和端基溴代的氯甲酸三氯乙酯保护的全乙酰氨基葡萄糖进行反应,得到中间体a-3,a-3的化学式为
中间体a-3在锌粉和醋酸作用下,脱掉氯甲酸三氯乙酯(troc)保护得到中间体a-4,a-4的化学式为
中间体a-4可以在甲醇钠的存在下进行脱酰基保护,得到g-1,或者中间体a-4先经过反应链接上取代基r1,得到中间体a-5,
g-1的化学式为
a-5的化学式为
然后再在甲醇钠的存在下进行脱酰基保护,得到通式ⅰ化合物。
与现有技术相比,本发明的优点与积极效果如下:
1、实验表明,本发明提供的吡喃葡萄糖基取代的表没食子儿茶素没食子酸酯化合物具有比egcg更强的抑制aβ1-42刺激的sh-sy5y细胞毒性的作用,为该类化合物在抗老年痴呆症的作用方面提供可靠依据。提示这类化合物比egcg更具有潜在优势。
2、egcg的多酚羟基结构特点,导致其在常温下容易变质,限制了其应用,实验表明本发明提供吡喃葡萄糖基取代的egcg类化合物具有较高的稳定性,进一步提高了生物利用度,增强了疗效。
附图说明
图1为本发明通式ⅰ化合物制备流程图。
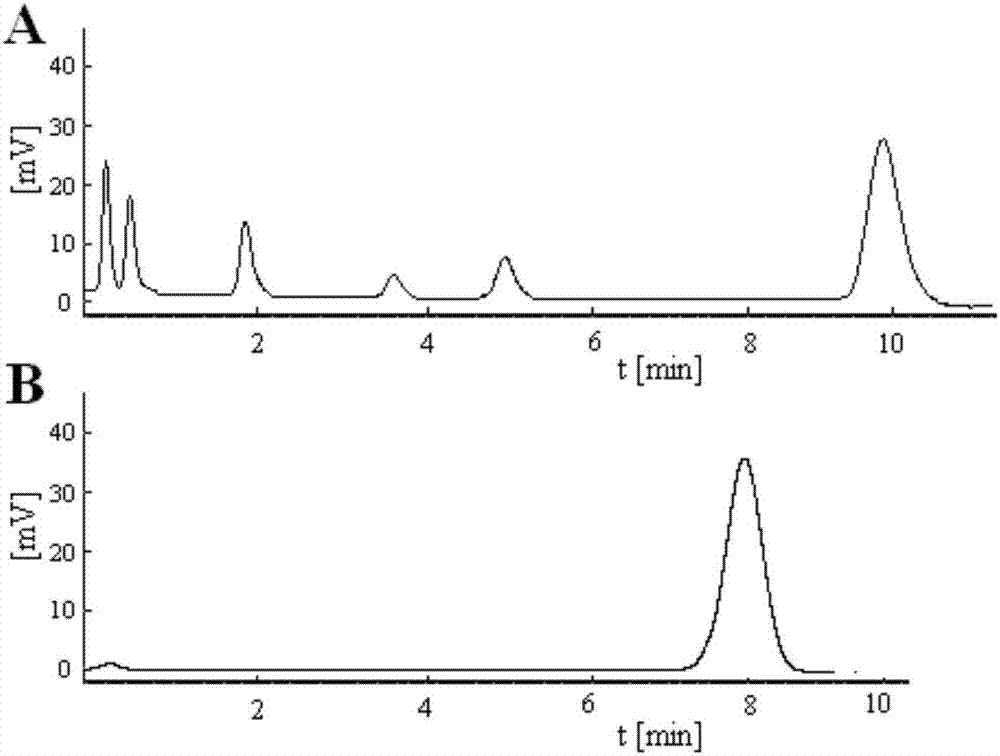
图2为实施例13色谱图,其中a:egcg;b:本发明化合物g1。
具体实施方式:
联系如下实施例,将更好地理解本发明的化合物和它们的制备,这些实施例旨在阐述而不是限制本发明的范围。
实施例1,7-[o-(2-氨基)-葡萄糖苷]-表没食子儿茶素没食子酸酯(g1)
室温条件下,依次将表没食子儿茶素没食子酸酯(0.44g,1mmol),4-二甲氨基吡啶(1.22g,1mmol),三乙胺(0.15g,1.5mmol)加入到15ml二氯甲烷中,室温条件下搅拌4小时,反应结束后,蒸干溶剂,得油状物。该油状物用乙酸乙酯溶解,进行柱层析分离(展开剂条件为:石油醚:丙酮=2:1),分离得到中间体a-1(0.68g),收率为93%。
将中间体a-1(0.68g,0.93mmol),加入到10ml的甲基吡咯烷酮中,冰浴下反应1小时,之后用20ml的乙酸乙酯进行稀释,并用1m的盐酸水溶液和饱和nacl水溶液洗有机相。有机相用无水硫酸钠进行干燥过夜。次日,加入冷的30ml无水乙醚溶液,产生白色沉淀,抽滤后得到白色固体中间体a-2(0.47g),收率72%。
依次将中间体a-3(0.47g,0.67mmol)、troc保护的端基溴代全乙酰氨基葡萄糖(0.73g,1.34mmol)、碳酸钾(0.93g,6.7mmol)加入到30ml的dmf中,室温反应10小时,将反应液倒入100ml水中,用乙酸乙酯进行萃取(20ml×3),合并有机相,用无水硫酸钠进行干燥过夜。次日,蒸干乙酸乙酯得到油状物,该油状物进行柱层析分离(展开剂条件为:石油醚:丙酮=2:1),分离得到中间体a-3(0.48g),收率为62%。
将中间体a-3(0.48g,0.42mmol)加入到10ml的乙酸中,再加入催化量锌粉,室温搅拌5小时,将反应液蒸干,得到油状物,该油状物进行柱层析分离(展开剂条件为:石油醚:丙酮=3:1),分离得到中间体a-4(0.35g),收率为85%。
将中间体a-4(0.35g,0.36mmol)加入到10ml无水甲醇中,再加入甲醇钠(0.02g,0.36mmol),室温搅拌5小时,加入少量水并蒸干溶剂。再加入水30ml,用乙酸乙酯进行萃取(15ml×3),合并有机相,用无水硫酸钠进行干燥过夜。次日,蒸干乙酸乙酯得到油状物,该油状物进行柱层析分离(展开剂条件为:石油醚:丙酮=3:1),分离得到中间体g-1(0.18g),收率为85%。esi-ms:602.2[m+h]+;1hnmr(300mhz,dmso-d6)δ6.97(s,2h),6.93(s,1h),6.75(d,j=8.1hz,1h),6.71(d,j=8.1hz,1h),6.20(d,j=1.2hz,1h),6.05(d,j=1.2hz,1h),5.56(d,j=6.1hz,1h),5.35(s,6h),5.23(m,1h),5.11(s,2h),3.65(dd,j=11.5,6.5hz,1h),3.62(d,j=13hz,1h),3.58(m,2h),3.49(m,1h),3.45(m,1h),3.37(d,j=13hz,1h),3.10(dd,j=12.0,6.5hz,1h),3.05(m,1h),2.85(dd,j=12.0,6.5hz,1h),2.47(dd,j=5.2,6.0hz,1h),1.82(dd,j=11.5,6.5hz,1h),1.38(d,j=3.3hz,1h),0.86(d,j=3.3hz,1h)。
实施例2,7-[o-(2-甲氨基)-葡萄糖苷]-表没食子儿茶素没食子酸酯(g2)
制备方法同上,总收率为28%。esi-ms:616.2[m+h]+;1hnmr(300mhz,dmso-d6)δ6.97(s,2h),6.93(s,1h),6.75(d,j=7.5hz,1h),6.71(d,j=7.5hz,1h),6.20(d,j=1.2hz,1h),6.05(d,j=1.2hz,1h),5.56(d,j=6.1hz,1h),5.35(s,6h),5.23(m,1h),3.65(dd,j=11.5,6.5hz,1h),3.62(dd,j=13.0hz,1h),3.58(m,2h),3.49(m,1h),3.45(m,1h),3.37(dd,j=13.0,7.5hz,1h),3.26(s,3h),3.10(dd,j=12.0,6.5hz,1h),3.05(m,1h),2.85(dd,j=12.0,6.5hz,1h),2.03(d,1h),2.0(q,1h),1.82(m,1h),1.38(t,j=7.5hz,1h),0.86(m,1h)。
实施例3,7-[o-(2-丙氨基)-葡萄糖苷]-表没食子儿茶素没食子酸酯(g3)
制备方法同上,总收率为22%。esi-ms:644.2[m+h]+;1hnmr(300mhz,dmso-d6)δ6.97(s,2h),6.93(s,1h),6.75(d,j=7.5hz,1h),6.71(d,j=7.5hz,1h),6.20(d,j=1.2hz,1h),6.05(d,j=1.2hz,1h),5.56(d,j=6.1hz,1h),5.35(s,6h),5.23(m,1h),3.65(dd,j=11.5,6.5hz,1h),3.62(dd,j=13.0hz,1h),3.58(m,2h),3.49(m,1h),3.45(m,1h),3.37(dd,j=13.0,7.5hz,1h),3.10(dd,j=12.0,6.5hz,1h),3.05(m,1h),2.85(dd,j=12.0,6.5hz,1h),2.55(m,2h),2.03(d,1h),2.0(q,1h),1.82(m,1h),1.45(m,2h),1.38(t,j=7.5hz,1h),0.90(m,3h),0.86(m,1h)。
实施例4,7-[o-(2-环丙氨基)-葡萄糖苷]-表没食子儿茶素没食子酸酯(g4)
制备方法同上,总收率为32%。esi-ms:642.2[m+h]+;1hnmr(300mhz,dmso-d6)δ6.97(s,2h),6.93(s,1h),6.75(d,j=7.5hz,1h),6.71(d,j=7.5hz,1h),6.20(d,j=1.2hz,1h),6.05(d,j=1.2hz,1h),5.56(d,j=6.1hz,1h),5.35(s,6h),5.23(m,1h),3.65(dd,j=11.5,6.5hz,1h),3.62(dd,j=13.0hz,1h),3.58(m,2h),3.49(m,1h),3.45(m,1h),3.37(dd,j=13.0,7.5hz,1h),3.10(dd,j=12.0,6.5hz,1h),3.05(m,1h),2.85(dd,j=12.0,6.5hz,1h),2.03(d,1h),2.0(q,1h),1.82(m,1h),1.38(t,j=7.5hz,1h),1.35(m,1h),0.69(m,2h),0.44(m,2h),0.86(m,1h)。
实施例5,7-[o-(2-羟基乙氨基)-葡萄糖苷]-表没食子儿茶素没食子酸酯(g5)
制备方法同上,总收率为19%。esi-ms:646.2[m+h]+;1hnmr(300mhz,dmso-d6)δ6.97(s,2h),6.93(s,1h),6.75(d,j=7.5hz,1h),6.71(d,j=7.5hz,1h),6.20(d,j=1.2hz,1h),6.05(d,j=1.2hz,1h),5.56(d,j=6.1hz,1h),5.35(s,6h),5.23(m,1h),3.65(dd,j=11.5,6.5hz,1h),3.65(m,2h),3.65(t,1h),3.62(dd,j=13.0hz,1h),3.58(m,2h),3.49(m,1h),3.45(m,1h),3.37(dd,j=13.0,7.5hz,1h),3.10(dd,j=12.0,6.5hz,1h),3.05(m,1h),2.85(dd,j=12.0,6.5hz,1h),2.74(m,2h),2.03(d,1h),2.0(q,1h),1.82(m,1h),1.38(t,j=7.5hz,1h),0.86(m,1h)。
实施例6,7-[o-(2-氰基乙氨基)-葡萄糖苷]-表没食子儿茶素没食子酸酯(g6)
制备方法同上,总收率为24%。esi-ms:655.2[m+h]+;1hnmr(300mhz,dmso-d6)δ6.97(s,2h),6.93(s,1h),6.75(d,j=7.5hz,1h),6.71(d,j=7.5hz,1h),6.20(d,j=1.2hz,1h),6.05(d,j=1.2hz,1h),5.56(d,j=6.1hz,1h),5.35(s,6h),5.23(m,1h),3.65(dd,j=11.5,6.5hz,1h),3.62(dd,j=13.0hz,1h),3.58(m,2h),3.49(m,1h),3.45(m,1h),3.37(dd,j=13.0,7.5hz,1h),3.10(dd,j=12.0,6.5hz,1h),3.05(m,1h),2.92(t,j=7.5hz,2h),2.85(dd,j=12.0,6.5hz,1h),2.53(t,j=7.5hz,2h),2.03(d,1h),2.0(q,1h),1.82(m,1h),1.38(t,j=7.5hz,1h),0.86(m,1h)。
实施例7,7-[o-(2-苯磺酰氨基)-葡萄糖苷]-表没食子儿茶素没食子酸酯(g7)
制备方法同上,总收率为34%。esi-ms:742.2[m+h]+;1hnmr(300mhz,dmso-d6)δ7.86(dd,j=7.1,2.5hz,2h),7.74(dd,j=6.6,6.3hz,1h),7.71(m,1h),7.62(dd,j=7.1,7.5hz,2h),6.97(s,2h),6.93(s,1h),6.75(d,j=7.5hz,1h),6.71(d,j=7.5hz,1h),6.20(d,j=1.2hz,1h),6.05(d,j=1.2hz,1h),5.56(d,j=6.1hz,1h),5.35(s,6h),5.23(m,1h),3.65(dd,j=11.5,6.5hz,1h),3.62(dd,j=13.0hz,1h),3.58(m,2h),3.49(m,1h),3.45(m,1h),3.37(dd,j=13.0,7.5hz,1h),3.10(dd,j=12.0,6.5hz,1h),3.05(m,1h),2.85(dd,j=12.0,6.5hz,1h),2.47(dd,j=6.3,5.8hz,1h),1.82(m,1h),1.38(t,j=7.5hz,1h),0.86(m,1h)。
实施例8,7-[o-(2-对甲氧基苯磺酰氨基)-葡萄糖苷]-表没食子儿茶素没食子酸酯(g8)
制备方法同上,总收率为24%。esi-ms:772.2[m+h]+;1hnmr(300mhz,dmso-d6)δ7.74(dd,j=6.6,6.3hz,1h),7.64(dd,j=7.1,2.5hz,2h),7.12(dd,j=7.1,7.5hz,2h),6.97(s,2h),6.93(s,1h),6.75(d,j=7.5hz,1h),6.71(d,j=7.5hz,1h),6.20(d,j=1.2hz,1h),6.05(d,j=1.2hz,1h),5.56(d,j=6.1hz,1h),5.35(s,6h),5.23(m,1h),3.83(s,3h),3.65(dd,j=11.5,6.5hz,1h),3.62(dd,j=13.0hz,1h),3.58(m,2h),3.49(m,1h),3.45(m,1h),3.37(dd,j=13.0,7.5hz,1h),3.10(dd,j=12.0,6.5hz,1h),3.05(m,1h),2.85(dd,j=12.0,6.5hz,1h),2.47(dd,j=6.3,5.8hz,1h),1.82(m,1h),1.38(t,j=7.5hz,1h),0.86(m,1h)。
实施例9,7-[o-(2-乙酰氨基)-葡萄糖苷]-表没食子儿茶素没食子酸酯(g9)
制备方法同上,总收率为29%。esi-ms:644.2[m+h]+;1hnmr(300mhz,dmso-d6)8.03(dd,j=6.6,6.3hz,1h),6.97(s,2h),6.93(s,1h),6.75(d,j=7.5hz,1h),6.71(d,j=7.5hz,1h),6.20(d,j=1.2hz,1h),6.05(d,j=1.2hz,1h),5.56(d,j=6.1hz,1h),5.35(s,6h),5.23(m,1h),3.65(dd,j=11.5,6.5hz,1h),3.62(dd,j=13.0hz,1h),3.58(m,2h),3.49(m,1h),3.45(m,1h),3.37(dd,j=13.0,7.5hz,1h),3.10(dd,j=12.0,6.5hz,1h),3.05(m,1h),2.85(dd,j=12.0,6.5hz,1h),2.47(dd,j=6.3,5.8hz,1h),1.84(s,3h),1.82(m,1h),1.38(t,j=7.5hz,1h),0.86(m,1h)。
实施例10,7-[o-(2-苯甲酰氨基)-葡萄糖苷]-表没食子儿茶素没食子酸酯(g10)
制备方法同上,总收率为19%。esi-ms:706.2[m+h]+;1hnmr(300mhz,dmso-d6)8.03(dd,j=6.6,6.3hz,1h),8.03(dd,j=7.1,2.5hz,2h),7.63(dd,j=7.1,7.5hz,2h),7.70(dd,j=7.5,2.4hz,1h),6.97(s,2h),6.93(s,1h),6.75(d,j=7.5hz,1h),6.71(d,j=7.5hz,1h),6.20(d,j=1.2hz,1h),6.05(d,j=1.2hz,1h),5.56(d,j=6.1hz,1h),5.35(s,6h),5.23(m,1h),3.65(dd,j=11.5,6.5hz,1h),3.62(dd,j=13.0hz,1h),3.58(m,2h),3.49(m,1h),3.45(m,1h),3.37(dd,j=13.0,7.5hz,1h),3.10(dd,j=12.0,6.5hz,1h),3.05(m,1h),2.85(dd,j=12.0,6.5hz,1h),2.47(dd,j=6.3,5.8hz,1h),1.82(m,1h),1.38(t,j=7.5hz,1h),0.86(m,1h)。
实施例11,7-[o-(2-对甲氧基苯甲酰氨基)-葡萄糖苷]-表没食子儿茶素没食子酸酯(g11)
制备方法同上,总收率为24%。esi-ms:736.2[m+h]+;1hnmr(300mhz,dmso-d6)8.03(dd,j=6.6,6.3hz,1h),7.92(dd,j=7.4,2.8hz,2h),7.17(dd,j=7.4,2.8hz,2h),6.97(s,2h),6.93(s,1h),6.75(d,j=7.5hz,1h),6.71(d,j=7.5hz,1h),6.20(d,j=1.2hz,1h),6.05(d,j=1.2hz,1h),5.56(d,j=6.1hz,1h),5.35(s,6h),5.23(m,1h),3.83(s,3h),3.65(dd,j=11.5,6.5hz,1h),3.62(dd,j=13.0hz,1h),3.58(m,2h),3.49(m,1h),3.45(m,1h),3.37(dd,j=13.0,7.5hz,1h),3.10(dd,j=12.0,6.5hz,1h),3.05(m,1h),2.85(dd,j=12.0,6.5hz,1h),2.47(dd,j=6.3,5.8hz,1h),1.82(m,1h),1.38(t,j=7.5hz,1h),0.86(m,1h)。
实施例12,7-[o-(2-丙烯氨基)-葡萄糖苷]-表没食子儿茶素没食子酸酯(g12)
制备方法同上,总收率为21%。esi-ms:642.2[m+h]+;1hnmr(300mhz,dmso-d6)δ6.97(s,2h),6.93(s,1h),6.75(d,j=7.5hz,1h),6.71(d,j=7.5hz,1h),6.20(d,j=1.2hz,1h),6.05(d,j=1.2hz,1h),5.87(m,1h),5.56(d,j=6.1hz,1h),5.35(s,6h),5.23(m,1h),5.22(m,1h),5.19(m,1h),3.65(dd,j=11.5,6.5hz,1h),3.62(dd,j=13.0hz,1h),3.58(m,2h),3.49(m,1h),3.45(m,1h),3.37(dd,j=13.0,7.5hz,1h),3.22(m,2h),3.10(dd,j=12.0,6.5hz,1h),3.05(m,1h),2.85(dd,j=12.0,6.5hz,1h),2.03(d,1h),2.0(q,1h),1.82(m,1h),1.38(t,j=7.5hz,1h),0.86(m,1h)。
实施例13化合物稳定性试验。
吡喃葡萄糖基取代的表没食子儿茶素没食子酸酯(egcg)类化合物除了体现了一定的抗氧化应激活性,同时发现,该类化合物的稳定性显著提高。egcg由于多酚羟基结构特点,导致在常温下,随着时间的延长,容易变质,而且氧化产物比较复杂,杂质峰较多。而吡喃葡萄糖基取代的egcg类化合物g1-g12进行检测发现只有少量杂质产生,含量明显提高。
色谱条件如下:
色谱柱:shimpakc18(4.6mm×150mm,5μm);流动相:甲醇:水:冰醋酸(20:80:0.2);检测波长:280nm;流速:1.0ml/min;柱温:30℃;进样量5μl,色谱图如图2表示。
结果显示,常温下放置第三天时,观察egcg粉末的颜色已经明显由白色变为粉红色,而吡喃葡萄糖基取代的egcg类化合物g1-g12的颜色则无明显改变;另外,高效液相的结果也表明与常温放置后egcg容易变质,出现很多杂峰(如图2a),而吡喃葡萄糖基取代的egcg类化合物g1-g12均稳定性更优,其中g1含量高达99.35%(如图2b)。
实施例14化合物药理活性测试。
模型细胞:人神经母细胞瘤sh-sy5y细胞
培养条件:dmem(hyclone)+10%胎牛血清(clark),37℃,5%co2培养。研究表明患者脑内淀粉样蛋白aβ的异常堆积是造成阿尔兹海默病(ad)发病的重要原因,因此,我们用aβ刺激神经细胞作为体外模拟ad状态的细胞模型。试验药物:浓度:低浓度,中浓度,高浓度分别为1、5、10微摩尔/升;
用量:200μl/孔,常规每板设三复孔,进行至少三次试验,通常进行五次。
试验方法:mtt法
实验流程:
1、消化细胞,铺于96孔板中,每孔约4000-5000个细胞,培养约24h。
2向培养液中加入适当浓度的无菌药物egcg,g1-g12或空白对照,预先作用2h。
3、向每孔加入aβ1-42,10μm进行造模,作用24h。
4、完全吸出造模液,每孔加入完全培养液及mtt,作用4-6h。
5、进行检测,结果如下表。
其中,低浓度,中浓度,高浓度分别为1、5、10微摩尔/升。
神经保护率(%)=[od值(加药组)-od值(aβ组)]/od值(空白组)×100%。
结果显示,与egcg相比,吡喃葡萄糖基取代的egcg类化合物具有更好的抗ad活性。
- 还没有人留言评论。精彩留言会获得点赞!