表达草鱼呼肠孤病毒刺突蛋白VP56的重组杆状病毒及应用的制作方法
本发明涉及生物技术领域,特别涉及表达草鱼呼肠孤病毒刺突蛋白vp56的重组杆状病毒及应用。
背景技术:
草鱼呼肠孤病毒为无囊膜,具有双链rna结构的能够引起草鱼病毒性出血病的病毒。现有研究显示,中国草鱼养殖区基因ⅱ型草鱼呼肠孤病毒检出率高达50%,与基因ⅰ型草鱼呼肠孤病毒相比具有明显的病毒刺突蛋白(vp56蛋白),而基因ⅰ型草鱼呼肠孤病毒不具有此蛋白。刺突蛋白在病毒吸附和侵入宿主过程中具有重要的作用,因此,建立能够高效表达可溶性vp56蛋白的表达系统对草鱼呼肠孤病毒科研工作和疫苗等的开发具有现实的意义。然而,vp56蛋白因为其基因结构特征,现有技术构建的原核表达系统表达的vp56蛋白均为不可溶蛋白,很难应用于分子病毒学的相关研究如不能进行pulldown,co-ip等实验操作。
技术实现要素:
本发明公开一种表达草鱼呼肠孤病毒刺突蛋白vp56的重组杆状病毒及应用,本发明通过构建pfast-hta-vp56质粒,利用杆状病毒表达系统,重组表达了带有his标签蛋白的草鱼呼肠孤病毒刺突蛋白vp56可溶蛋白的杆状病毒,利用此杆状病毒可以感染sf9(昆虫细胞)大量的表达可溶性的vp56蛋白,并应用于分子病毒学的相关操作。
为解决上述技术问题,本发明通过如下技术方案实现:
表达草鱼呼肠孤病毒刺突蛋白的重组杆状病毒,所述重组杆状病毒为构建pfast-hta-vp56重组质粒并转化至bacmid-x病毒中所产生。
所述的pfast-hta-vp56重组质粒的构建方法为以基因ii型草鱼呼肠孤病毒刺突蛋白基因为模板pcr扩增vp56基因片段,将vp56基因片段通过salⅰ和xhoⅰ酶切位点克隆到供体质粒pfastbactmhta载体中,获得pfast-hta-vp56重组质粒。
一种表达草鱼呼肠孤病毒刺突蛋白的重组杆状病毒的应用,所述的重组杆状病毒用于感染昆虫细胞从而大量表达可溶性的vp56蛋白。
所述的重组杆状病毒应用于分子病毒学。例如:重组杆状病毒用于感染昆虫细胞从而大量表达可溶性的vp56蛋白,可溶性的vp56蛋白可进行pulldown,co-ip等实验操作。
本发明的有益效果是:
1、本发明通过构建pfast-hta-vp56质粒,利用杆状病毒表达系统,重组表达了带有his标签蛋白的草鱼呼肠孤病毒刺突蛋白vp56可溶蛋白的杆状病毒。
2、此杆状病毒可以感染sf9(昆虫细胞)大量的表达可溶性的vp56蛋白,并应用于分子病毒学的相关操作。
附图说明
图1:重组杆状病毒感染细胞与正常细胞对比。
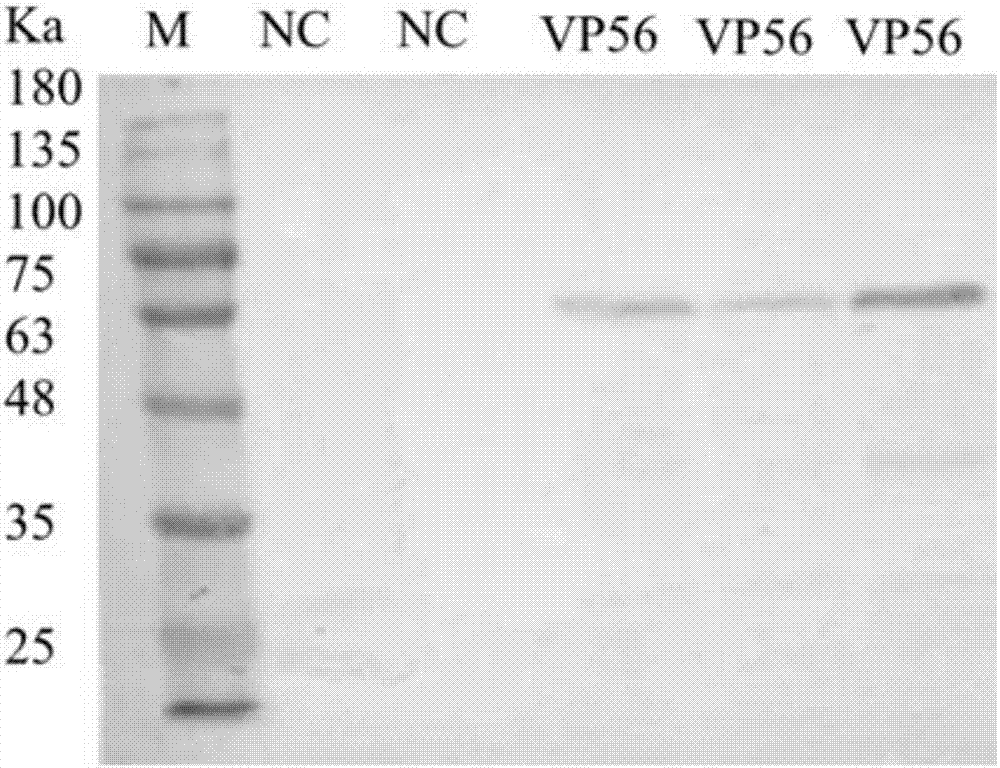
图2:重组杆状病毒表达的vp56蛋白westernblot分析图。
图3:对比例sds-page结果分析图(重组蛋白rvp56的诱导表达及可溶性分析;m.蛋白质标准物质;1,3未诱导细菌沉淀;2.诱导细菌沉淀;4.诱导细菌超声破碎后的上清;5.诱导细菌超声破碎后的沉淀)。
图4:对比例westernblot结果图(1.rvp56诱导沉淀;2.rvp56诱导上清)。
具体实施方式
下面结合实施例,对本发明作进一步说明:
实施例1
1、pcr扩增:
以本实验室保存的基因ii型草鱼呼肠孤病毒刺突蛋白(vp56)基因为模板扩增vp56基因片段,扩增条件为:
94℃变性1min后进入循环;循环参数为:98℃10sec,55℃15sec,68℃30sec;30个循环后72℃延伸10min。反应结束后用0.6%琼脂糖凝胶电泳检测扩增结果。
2、重组转移质粒pfastbachta-vp56的构建
回收pcr阳性产物,通过salⅰ和xhoⅰ酶切位点,设计引物,具体引物如下表,将扩增到的vp56基因克隆到供体质粒pfastbactmhta载体(invitrogen,美国)中,经酶切和测序鉴定证实构建正确,获得阳性重组质粒pfastbachta-vp56。重组质粒pfastbachta-vp56经测序验证。
重组穿梭质粒rbacmid-vp56的筛选纯化
表1引物
3、感受态细胞的制备
(1)在含有50μg/mlkan+和10μg/mltet+抗性的lb平板或无抗平板上,使用dh10bac菌液划线,37℃培养箱过夜,培养12~20小时。
(2)从平板上挑取一个单菌落,接种到一个含有50μg/mlkan+和10μg/mltet+抗性的100mllb液体培养基中,于37℃,250rpm培养3-6小时,至od600值为0.4左右。或者从平板上挑取一个单菌落,接种到一个含有50μg/mlkan+和10μg/mltet+抗性的5mllb液体培养基中,于37℃,250rpm培养12小时,然后再将菌液按照1:100的比列接种于含有50μg/mlkan+和10μg/mltet+抗性的100mllb液体培养基中,于37℃,250rpm培养3小时,至od600值为0.4左右。
(3)将dh10bac细菌培养烧瓶在冰上孵育10min,使培养物冷却至0℃,转入无菌的预先用冰预冷的50ml离心管中,然后于4℃下5000rpm离心8分钟收集细胞。
(4)倒出培养液,尽量使上清弃尽。每50ml初始培养物加入30ml预先用冰预冷的0.1mol/lcacl2溶液,轻轻悬浮细胞,冰上放置30分钟。
(5)于4℃,5000rpm离心8分钟收集细胞,弃尽上清。加入4ml预先用冰遇冷的0.1mol/lcacl2。轻轻吹打悬浮细胞,加入1ml灭菌的预先用冰遇冷的80%甘油,吹打混匀。
(6)将dh10bac感受态细胞按照毎管100μl分装。可以直接使用新鲜制备的dh10bac感受态细胞进行质粒转化,也可以放在-80℃冰箱保存备用。
4.重组杆粒的制备
溶液配方溶液ⅰ:1mol/ltris-hcl(ph8.0)12.5ml,0.5mol/ledta水溶液(ph8.0)10ml,葡萄糖4.730g,加ddh2o至500ml;溶液ⅱ:终浓度为naoh0.2mol/l,sds1%的混合水溶液;溶液ⅲ:5mol/l醋酸钾300ml,冰醋酸57.5ml,加ddh2o至500ml,ph5.5的te溶液:
参照bac-to-bac表达系统说明书将构建正确的15μl重组转移载体pfastbac-hta-vp56转化至含有杆状病毒骨架质粒bacmid的dh10bac感受态细胞中。混合均匀后置于冰上30min。42℃水浴45s,冰浴2min。加入900μllb培养基于37℃,225rpm振摇4-6小时。按10-1、10-2、10-3稀释感受态细胞后,分别取100μl稀释复苏菌液涂布于含有卡那霉素,庆大霉素,四环素,iptg和x-gal的高盐lb平板上,37℃培养48小时,在helper质粒的辅助作用下,重组转移载体pfastbachta-vp56与杆状病毒骨架质粒bacmid发生同源重组,将外源目的基因整合到杆状病毒骨架质粒中形成重组bacmid质粒。经过两轮蓝白斑,筛选纯化白色阳性菌落。
(1)挑取白色克隆于2mllb培养基(含50ug/ml卡那霉素、7ug/ml庆大霉素、10ug/ml四环素),37℃摇床250-300rpm培养24h以上。
(2)取1.5ml培养物于1.5mlep管中,14000×g离心1min。
(3)倒去上清夜,倒立于吸水纸上。然后加入0.3ml的溶液ⅰ用枪头轻轻吹打重悬细胞。
(4)加入0.3ml溶液ⅱ,轻轻混匀,室温放置5min(溶液变清)。
缓缓加入0.3ml溶液ⅲ,轻轻混匀,形成蛋白及dna沉淀,冰上放置5-10min。
(5)14000g室温离心10min,期间另取一2ml离心管,加入800ul异丙醇。
(6)轻轻把上清液转入含异丙醇的离心管,避免把白色沉淀带入。轻轻倒转离心管数次。冰上放置5min(该过程可放在-20℃过夜)。
(7)室温离心15min。
(8)去上清,倒置离心管于吸水纸上,然后加入70%乙醇洗涤沉淀数次,14000g室温离心5min。
(9)尽可能弃去上清,小心操作,勿使沉淀弃去。
(10)使沉淀在空气中自然挥干,5-10min。加40ulte溶液,轻敲管底,使溶液位于管底部。
5.重组杆状病毒的获得
(1)在六孔板中接种9×105个细胞/2ml/孔。其中培养基grace’smedium中含有青霉素50u/ml,链霉素50ug/ml,10%fbs。
(2)27℃培养1h,使细胞贴壁。
(3)在这期间制备bacmid-x与cellfectinreagent复合物:
a.用100ul不完全grace’smedium(不含双抗、fbs)稀释1ugbacmid-x(约5ul).
b.在使用前将cellfectinreagent倒置5-10次,使其充分混匀,取6ulcellfectinreagent用100ul不完全grace’smedium(不含双抗、fbs)稀释。
c.将上述两种稀释液合并(总体积约210ul),轻轻混匀,室温孵育15-45min。
(4)在制备bacmid-x与cellfectinreagent复合物期间,将六孔板中的培养基吸掉,用2ml不完全grace’smedium(不含双抗、fbs)洗涤一次,去掉培养基。
(5)在含有210ul的复合物的管内加入800ul的不完全grace’smedium(不含双抗、fbs),轻轻混匀,加到每个孔中。
(6)将六孔板内的细胞孵育5h,27℃.
(7)去掉复合物混合液,然后在每个孔中加2ml完全培养基(grace’smedium含双抗、10%fbs).
(8)在37℃湿度培养箱中孵育72h或者直到细胞出现病毒感染迹象。
实施例2
重组的杆状病毒感染sf9昆虫细胞后进行ifa实验分析
重组的杆状病毒感染sf9昆虫细胞实验
1.将爬片放入24孔板,sf9细胞传至孔板,铺板3hr待细胞长至80%;
2.移去上清,加入1mlpbs洗1次;
3.移去pbs,加入纯化后的杆状病毒moi=10与sf9细胞共同孵育4℃,1hr;
4.移去病毒,加入1mlpbs洗去残留病毒粒子,重复3次;
5.另设置条件相同但为加入杆状病毒的正常组;
6.培养5d观察比较记录结果。
结果显示,如图1所示,经重组杆状病毒感染的sf9细胞皱缩裂解,经his单抗孵育标记后具有特异性的绿色荧光,显示该重组病毒能够高效的感染sf9细胞并生产vp56蛋白。
如图2所示,通过重组杆状病毒表达的vp56蛋白westernblot分析,可以看出然后病毒后的sf9细胞可大量表达vp56蛋白。
对比例
用trizol法提取感染jx02w毒株的cik总rna,用primescripttmⅱ1ststrandcdnasynthesiskit试剂盒将所提取的总rna反转录成cdna以此为模板,以pgex-4t-3-vp56f与pgex-4t-3-vp56r为引物为引物扩增,pcr条件如下:94℃预变性3min,(94℃30s,61.1℃30s,72℃2min)35cycles,72℃10min,用wizard@svgelandpcrclean-upsystem试剂盒对pcr产物目的片段纯化回收。
用bamhi和xhol限制性内切酶将pgex-4t-3和回收的s7片段进行双酶切处理,用t4dna连接酶将纯化的目的片段分别与酶切好的pgex-4t-3空质粒进行连接(t4liqase1μl,t4liqasebuffer2.5μl,空质粒100ng,目的片段300ng(400ng),加灭菌水到25μl),16℃,连接12h。取连接产物各10μl分别转化dh5α,各挑取10个单菌落进行pcr验证并测序,取阳性单菌落扩增并提取质粒,标记为pgex-4t-3-vp56及pfastbachta-vp56。
将测序正确的pgex-4t-3-vp56质粒转化bl21(de3),挑取平板上菌落接种到含amp+lb培养基37℃过夜活化。将活化的过夜培养物转移到新鲜的含amp+lb培养基,37℃,190r/min,恒温振荡培养3h。加入iptg进行诱导,设置0、0.1、0.3、0.5、0.7mmol/lol/l五个梯度,比较不同浓度的诱导效果,诱导4h后收集表达细菌,4℃,8000r/min离心20min;沉淀用蒸馏水洗涤两次,用1×pbs重悬沉淀,超声波破碎至溶液澄清。4℃,8500r/min离心20min后收集上清和沉淀,利用sds-page和westernblot分析原核表达gst-vp56蛋白的可溶性。具体结果如图3、图4所示。
结果:
sds-page和westernblot结果显示,经iptg诱导的菌体沉淀相比未经iptg诱导的对照菌在83kda有一条明显的目的条带。目的蛋白全部存在于沉淀中。
序列表
<110>上海海洋大学
<120>表达草鱼呼肠孤病毒刺突蛋白vp56的重组杆状病毒及应用
<130>2017
<141>2017-11-21
<160>2
<170>siposequencelisting1.0
<210>1
<211>23
<212>dna
<213>artificialsequence
<400>1
gtcgacatggccactcgtgacag23
<210>2
<211>26
<212>dna
<213>artificialsequence
<400>2
ctcgagtacttacagcaaactaccgt26
- 还没有人留言评论。精彩留言会获得点赞!
- 调控家蚕质型多角体病毒编码的NS5基因的miRNA及其应用
- 检测水稻黑条矮缩病毒的qRT-PCR及其应用
- 一种用于呼肠孤灭活疫苗的佐剂及其制备方法
- 一种猪流行性腹泻病毒的多重rt-pcr检测试剂盒的制作方法
- 一种控制草鱼出血病的中草药饲料添加剂及制备方法
- 抗蓝舌病病毒ns3蛋白的单克隆抗体btv-ns3-3d8及其识别的b细胞表位和应用
- 利用小麦绿矮病植株为毒源建立的一种玉米粗缩病品种抗性接种鉴定方法
- 抗蓝舌病病毒ns1蛋白的群特异性单克隆抗体btv-ns1-1f11及其识别的b细胞表位和应用
- 一种西江病毒SYBR GreenⅠ荧光定量PCR检测方法
- 抗蓝舌病病毒12型ns1蛋白的单克隆抗体btv12-ns1-1f8及其识别的b细胞表位和应用