一种用于提高微藻固碳效率的方法及转基因衣藻和应用与流程
本发明属于生物基因工程技术领域,涉及将目的基因转入莱茵衣藻基因组中并加快了莱茵衣藻的生长速率的方法,尤其涉及一种用于提高莱茵衣藻固碳作用的转基因衣藻、构建方法及其用途。
背景技术:
随着人类社会的发展,工业化进程的推进和人口的增多,co2的排放日益增多,温室效应日益严重;因此,减少co2的排放和积累是解决全球气候变暖的重点。而生物体生命过程中的光合作用完成生物固碳,是自然界实现碳循环的途径。然而,树木、植物只能缓慢吸收大气中的co2,受土地面积的限制,其消纳co2的总量与人类生产活动的排放量比,十分有限。而与农作物相比,微藻的光合速率高、繁殖快、环境适应性强、可实现高效、立体、高密度的培养,是地球上分布最广、种类最多、结构简单的一类形态微小的单细胞或多细胞光合自养生物,目前,地球上存活的微藻已超过20万种,藻类(包括大型海藻和微藻)每年可固定co2约0.95×1011t,占全球净光合作用产量的47.5%;其产量远高于大豆和麻风树籽,含油率可达50%以上,被公认为是最具发展潜力的第三代生物能源原料。
世界各国已积极的就co2处理工作展开研究,方法主要包括两类:①物化法,如溶液吸收法、膜分离法、分子筛吸附法、碳封存法及电化学处理法等;②生物法,主要利用林业和农业的吸收大气中的co2及利用微生物固定co2,其中微藻固碳技术已经得到越来越多的关注。
微藻固定co2技术,是世界上最主要和最有效的固碳方式之一,从长远角度考虑,其是一种经济可行、环境友好和可持续性发展的co2固定技术。微藻作为一种高效固定co2的微小细胞工厂,具有以下独特的优点:(1)能直接利用太阳能,与物理化学法相比节省了大量的能源;(2)光合作用效率高,微藻利用太阳能固定co2的效率是其他陆生植物的10~50倍;(3)生长速率快,微藻繁殖快速(几个小时繁殖一次),远远高于高等植物;(4)能够循环利用co2,co2可以通过微藻的光合作用转化为生物能源,生物能源使用时产生的co2又可被微藻固定转化,因此该方法具可持续性发展;(5)环境适应性强,微藻能忍耐和适应多种极端环境,能够在沿海滩涂、盐碱地和沙漠等地培养,不占用可耕地;(6)能利用发电厂烟道废气和其他工业尾气为无机碳源,并利用市政废水和工农业生产废水为营养源(n、p等)低成本培养微藻;(7)能同时生产具有高附加值的微藻产品,用于制备食品、动物及水产养殖饲料、化妆品、医药品、肥料、有特殊用途的生物活性物质及生物燃料(包括生物柴油、生物氢、航空用油、甲烷)等。
一般来说,提高微藻固定co2的能力可以从生物和工程两方面着手,生物方面主要包括高效固定co2优良藻种的筛选和驯化以及应用现代基因工程手段从分子水平上改造微藻细胞,从而从根本上提高微藻固碳效率;工程方面主要包括微藻培养基配方的改良、最佳培养条件的优化和高效微藻培养反应器的设计等。
然而通过基因工程方法重新构建高效固定co2的工程微藻是进一步提高筛选的野生微藻藻株固定co2能力的最有效途径之一。通过考虑卡尔文循环来考虑构建高效固碳的工程微藻,卡尔文循环由核酮糖-1,5-二磷酸羧化酶/加氧酶(rubisco)催化co2与核酮糖1,5-二磷酸(rubp)羧化形成3-磷酸甘油酸(3-pg);在3-磷酸甘油酸激酶(pgk)催化下合成bpg,再通过甘油醛-3-磷酸脱氢酶的催化下,将bpg转化为甘油醛-3-磷酸(g3p);g3p利用atp提供能量,经过一系列的转变再生rubp,以供循环固碳使用的过程。而在此循环过程中的这些关键酶成为了众多研究学者的研究对象,通过对这些关键酶进行基因工程水平上的改造微藻,从而希望能够得到固碳效率更高的转基因微藻。
最近几十年对不同模式微藻,如莱茵衣藻分子水平的研究表明,通过改良微藻体内与co2固定转化代谢途径有关的关键代谢酶基因或引入相关新的代谢途径,可以显著提高微藻固定co2的效率。目前,微藻固定co2的基因工程研究主要集中于基因的结构、序列分析以及基因克隆与表达方面。有研究人员从耐受co2浓度高达60%的单细胞海洋绿藻chlorococcumlittorale中分离出编码rubisco活化酶(rca)相应的dna区域,结果显示:高浓度的co2诱导了rca,而非表面上的环境因素影响。还有研究者在鱼腥藻anabaenasp.7120细胞内成功表达了编码果糖1,6-二磷酸酯醛缩酶(ald)和丙糖磷酸酯异构酶(tpi)的基因。进一步研究发现:这两种酶的转基因细胞活性比野生型细胞的活性强,且这两个基因转入后,微藻细胞吸收和转化co2的能力明显提高。以上研究结果充分说明,调控微藻co2固定代谢途径中相关关键酶对提高co2固定能力的显著作用。也有学者提出并尝试通过基因工程技术过表达光合作用卡尔文循环中的关键酶基因来实质性的提高普通小球藻光合固碳的能力,从而达到碳减排的目的。首先利用增强型绿色荧光蛋白报告基因(egfp)建立了一套稳定有效的普通小球藻遗传转化体系,在此基础上,将集胞藻(synechocystissp.pcc6803)卡尔文循环中的关键酶—果糖-1,6-二磷酸醛缩酶基因(fba)导入到普通小球藻基因组中,成功地将其定位到叶绿体中进行了表达有效地提高了普通小球藻的生长速率和光合效率(co2固定速率)。
对于最近研究学者的研究结果,我们通过考虑了卡尔文循环的特点,以及工程微藻实用化的具体需求(大部分情况下,生物量/固碳是下游产物的基础),选择了叶绿体型的gap3,它在胞质内参与糖酵解的关键酶,叶绿体中和胞质中存在同工酶,其产物也是叶绿体固碳的关键产物gap3,但是很少有报道将其作为增强固碳的靶标。所以,我们在这里采用了一种增强型的表达载体,对其进行表达。1、hsp70a-rbcs2融合启动子被证明是能够在莱茵衣藻中高效表达的启动子系统【王潮岗,胡章立.hsp70a-rbcs2融合启动子调控phb合成酶基因在莱茵衣藻中的表达.中国科学c辑:生命科学,2009,39(s):775-782】,如能够有效调控聚β-羟基丁酸合成酶基因(phbc)基因在莱茵衣藻中的转录和翻译,得到的蛋白产物具有phb合成酶活性,40℃热激诱导可使phb合成酶的酶活性提高到1.8倍。因此我们选择使用hsp70和rubisco杂合启动子。2、选择叶绿体型的gap3本身并保留了进入叶绿体的信号肽;这样可以将我们的目的基因很好的定位到叶绿体;3、以生长速率作为转化子初筛指标,常规转化子在转化后4-5天出现克隆,而转化gap3的藻株因其固碳能力增加,阳性克隆出现早且克隆较大,所以选择转化后2-3天出现,且藻落大于1mm藻落,进行后续筛选评价,并最终筛选获得了一株甘油醛-3-磷酸脱氢酶转基因衣藻,具有显著高的光能利用效率。
技术实现要素:
本方法的目的就是一种提高微藻固碳效率的方法,通过转化过表达gap3基因,而提供一种转基因衣藻,能够高效的生产微藻生物质。该藻株是通过将含有hsp70-rbsc2启动子的叶绿体型gap3过表达质粒,电转导入到野生型莱茵衣藻cc-137中而获得。由于强化了莱茵衣藻的光合固碳能力,因此,该藻株具有更高的生长效率,将有望应用于微藻生物质能源的生产,或者作为一个高产宿主细胞用于进一步的转基因操作。
为实现上述目的,本发明提供一种用于加快生长速率的转基因衣藻的构建方法,步骤如下:
获得甘油醛-3-磷酸脱氢酶基因;
构建甘油醛-3-磷酸脱氢酶基因重组表达载体;
将所述的甘油醛-3-磷酸脱氢酶基因重组表达载体转化至莱茵衣藻细胞中,得到转甘油醛-3-磷酸脱氢酶基因莱茵衣藻。
所述甘油醛-3-磷酸脱氢酶基因为莱茵衣藻基因,其碱基序列如seqidno.2所示。
所述获得甘油醛-3-磷酸脱氢酶基因采用人工合成。
所述甘油醛-3-磷酸脱氢酶基因重组表达载体构建为合成带有kpni和bglii限制性内切酶酶切位点的甘油醛-3-磷酸脱氢酶基因连接至经过kpni和bglii限制性内切酶双酶切后的pchlamy载体,得到最终重组载体。
所述转化方法采用电转法。
本发明还保护所述方法制备的转基因衣藻。所述转基因衣藻包括甘油醛-3-磷酸脱氢酶基因。
本发明还保护所述转基因衣藻在加快生长速率中的应用。
本发明克服基因沉默技术或者其他物理化学技术中的不稳定因素,提供了一张通过基因优化改造来加快莱茵衣藻生长速率的方法。本方法将甘油醛-3-磷酸脱氢酶外源基因根据莱茵衣藻密码子偏爱性进行优化改造,得到适用于莱茵衣藻表达的甘油醛-3-磷酸脱氢酶基因,命名为c-gap3,转化入莱茵衣藻基因组中,获得生长速率提高的藻株,而且转入基因未影响莱茵衣藻的生长。
本发明包括以下内容:
根据莱茵衣藻密码子和大肠杆菌密码子偏爱性将gap3基因进行密码子改造,然后插入带有抗性基因和高效启动子的表达载体,转化入莱茵衣藻基因组中,通过筛选获得的转基因衣藻,经过传代证明其遗传稳定性。将筛选出的转基因衣藻进行培养,测定藻细胞密度、叶绿素荧光、干重及脂肪酸含量指标进行分析。
本发明技术方案如下:
(1)转基因受体藻株的筛选和培养
在温度为22~25℃,光照为50μmolphotonsm-2s-1条件下,用tap培养基培养莱茵衣藻,选择野生型的莱茵衣藻cc-137作为目的基因的受体。
(2)目的基因的优化改造和人工合成
从ncbi搜索获得目的基因,将目的基因根据莱茵衣藻和大肠杆菌的密码子偏爱性进行优化,进而得到新的适合莱茵衣藻表达的基因c-gap3,两端设计不同的酶切位点kpni和bglii,送去基因公司合成,所合成的基因片段连接在pchlamy载体上。合成的基因序列见seqidno.2。
(1)seqidno:2的信息(参见序列表)
(a)序列特征:
*长度:1162bp
*类型:核酸
*链型:双链
*拓扑结构:线性
(b)分子类型:cdna
(c)假设:否
(d)反义:否
(e)最初来源:人工合成
seqidno.2:c-gap3
ggtacccttcaccatggccgccatgatgcagaagagcgccttcaccggcagcgccgtgtcctccaagtctggcgtccgcgccaaggctgcccgcgccgtcgtcgacgtgcgcgcggagaagaagatccgcgtggccatcaacggcttcggtcgcattggccgcaacttcctgcgctgctggcacggtcgccagaacaccctgctggacgtggttgccatcaacgacagcggcggtgtcaagcaggccagccacctgctgaagtacgactccaccctgggcacgttcgccgccgatgttaagatcgtcgacgacagccacatcagcgtggacggcaagcagatcaagattgtgtccagccgcgacccgctgcagctgccgtggaaggagatgaacatcgacctggtcattgagggcactggtgtcttcattgacaaggttggcgctggcaagcacatccaggccggtgcctccaaggtgctgatcaccgccccggccaaggacaaggacatcccgaccttcgtggtcggtgtgaacgagggcgactacaagcacgagtacccgatcatctccaacgccagctgcaccaccaactgcctggccccgttcgtcaaggtgctggagcagaagttcggcattgtcaagggcacgatgaccaccacccactcctacaccggtgaccagcgcctgctggacgcgtcccaccgcgacctgcgccgcgcccgcgccgccgccctgaacattgtgccgaccaccaccggtgccgccaaggccgtgagcctggtgctgccgagcctgaagggcaagctgaacggcattgccctgcgcgtgccgaccccgaccgtgagcgtcgtcgacctggtcgtccaggttgagaagaagaccttcgccgaggaggtgaacgccgccttccgcgaggccgccaacggcccgatgaagggcgtgctgcacgtcgaggacgccccgctggtgtccattgacttcaagtgcaccgaccagagcacctccatcgacgcctccctgaccatggtcatgggcgacgacatggtcaaggtcgtggcctggtacgacaacgagtggggctactcccagcgcgtggtcgacctggctgaggtcaccgccaagaagtgggtggcgcaccaccaccaccaccactgaagatct
其中下划线为酶切位点kpni和bglii。
(3)构建目的基因表达载体
合成的目的基因c-gap3,通过限制性内切酶kpni和bglii进行双酶切,连接到经kpni和bglii双酶切处理的莱茵衣藻表达载体pchlamy上,获得pchlamy-c-gap3。pchlamy载体中含有hsp70a-rbcs2promoter,intron-1rbcs2以及hygromycinresistancegene(aph7),具有潮霉素抗性;(载体中含有的部分序列见序列表)。
(4)将构建好的表达载体转入莱茵衣藻中,使之整合到核基因组
用电转法将构建好的质粒进行线性化,转化到野生型莱茵衣藻cc-137(chlamydomonasresourcecentercc-137)中,在有潮霉素抗性的平板上进行筛选,挑选阳性藻落,进行单藻落pcr检测,westernbloting检测,确定得到目的片段插入成功的藻落。
(5)转化株和野生株生长测定
在正常光照和温度下培养(4)中筛选得到的转基因莱茵衣藻,每株藻设三个平行,每天测定一次细胞的光密度值,同时培养野生型莱茵衣藻cc-137,观察它们的生长曲线,结果表明转入c-gap3基因的转基因藻生长比野生型衣藻快。同时测定叶绿素荧光值,制作叶绿素荧光曲线,结果表明转入基因未影响衣藻的活力。
微藻通过光合固碳可以合成油脂、蛋白质、淀粉和类胡萝卜素等生物质,而加快微藻生物质生产效率对下游产业有着重要作用。本发明将目的基因转入莱茵衣藻,加快固碳效率,提升其生长速率,在微藻生物工程领域具有显著的应用前景。
本发明的有益效果为:
本发明与现有技术相比,具有以下优点和效果:
1、本发明证明在野生型莱茵衣藻中过表达叶绿体的甘油醛-3-磷酸脱氢酶基因,得到在一定条件下可以加快生长速率的转基因衣藻,同时也不影响衣藻的正常生长。
2、获得的转基因衣藻在和野生株同样条件培养下,不仅在生长速率有所提高,而且在脂肪酸的含量上略有提高,但是脂肪酸成分的并未发生改变3、这种转基因衣藻加快了其生物量的积累,也就有助于微藻的下游产业的发展。
4、在微藻的开发应用中,提高微藻的固碳效率是对于减缓温室效应一个解决方向,同时这种转基因的微藻也可以考虑应用在污水处理上。
附图说明
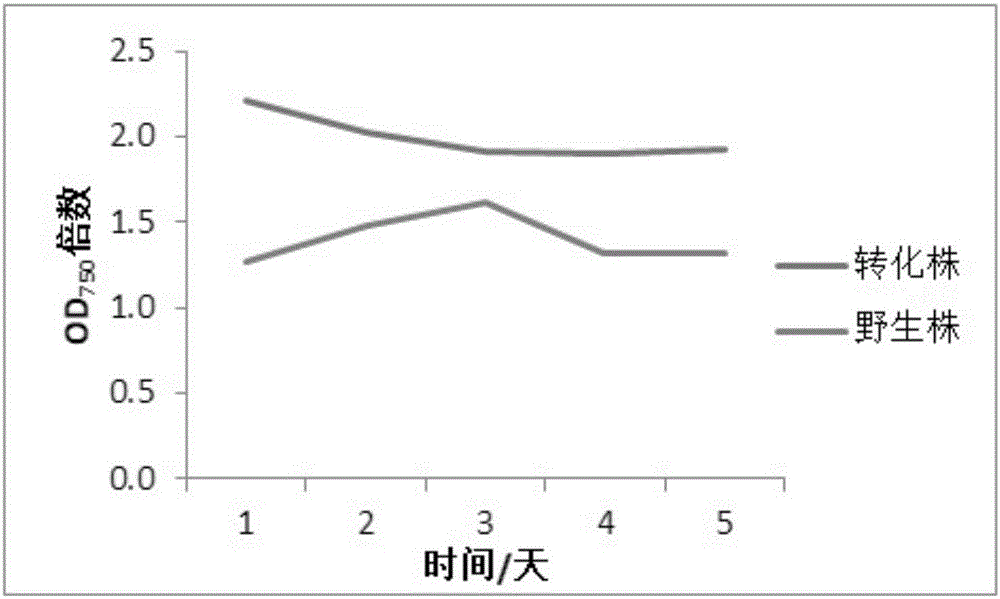
图1:转基因衣藻与野生株生长指标倍数变化图;
图2:转基因衣藻与野生株培养叶绿素荧光值变化图;
图3:实施例3利用引物pc-f/r的pcr结果图;
图4:实施例3利用特异性引物gap3-f/r的pcr结果图;
图5:实施例3westernbloting结果图。
具体实施方式
实施例1:莱茵衣藻中gap3基因相应的外源基因的改造和表达载体的构建
本实施例选用的藻株为莱茵衣藻cc-137(购自美国衣藻中心)作为转基因操作的受体,该藻株为野生型莱茵衣藻品系。
莱茵衣藻培养时使用的培养基为tap培养基,tap培养基配方如下:
母液1(盐溶液):将20gnh4cl,5gmgso4·7h2o,2.5gcacl2·2h2o定容于500ml去离子水;
母液2(磷酸盐溶液):将10.8gk2hpo4,5.6gkh2po4定容于500ml去离子水;
母液3(hutner’s微量金属盐溶液):将50.0gna2-edta·2h2o,22gznso4·7h2o,5.06gmncl2·4h2o,1.61gcocl2·6h2o,1.57gcuso4·5h2o,1.10g(nh4)6mo7o24·4h2o,4.99gfeso4·7h2o定容于500ml去离子水;
nitrilotriaceticacid溶解,用大约7.3gkoh将ph调至7.0,将其他盐分别溶解,合并,用naoh或h2so4将ph调至6.8
配置1ltap,需要加入:20ml的1mtris(sigma),10ml盐溶液(母液1),1ml磷酸盐溶液(母液2),1mlhutner’s微量元素(母液3),1ml冰乙酸,定容于1l。
莱茵衣藻培养条件如下:在温度为22~25℃,光照为50μmolphotonsm-2s-1条件下连续光照培养,其生长周期为6天,最大的藻细胞浓度od750为1.5。
(1)目的基因的改造:
从ncbi中查找gap3(见seqidno.1),参考莱茵衣藻和大肠杆菌密码子的偏爱性,更改部分密码子,不改变氨基酸种类(合成的目的基因的氨基酸序列见序列表),同时在目的基因后面加上6个组氨酸序列,以便作为后续蛋白验证的标签;而且两端设计酶切位点,分别是kpni和bglii,同时考虑到使用的酶切位点,跟目的片段中存在的相同酶切位点序列,得到适合在莱茵衣藻和大肠杆菌中表达的片段,送去基因公司合成并测序。c-gap3基因序列如seqidno.2所示。
seqidno.1:gap3
atggccgccatgatgcagaagagcgccttcaccggcagcgccgtgtcctccaagtctggcgtccgcgccaaggctgcccgcgccgtcgtcgacgtgcgcgcggagaagaagatccgcgtggccatcaacggcttcggtcgcattggccgcaacttcctgcgctgctggcacggtcgccagaacaccctgctggacgtggttgccatcaacgacagcggcggtgtcaagcaggccagccacctgctgaagtacgactccaccctgggcacgttcgccgccgatgttaagatcgtcgacgacagccacatctcggtggacggcaagcagatcaagattgtgtccagccgcgaccccctgcagctgccctggaaggagatgaacatcgacctggtcattgagggcactggtgtcttcattgacaaggttggcgctggcaagcacatccaggccggtgcctccaaggtgctgatcaccgcccccgccaaggacaaggacatccccaccttcgtggtcggtgtgaacgagggcgactacaagcacgagtaccccatcatctccaacgcctcgtgcaccaccaactgcctggcccccttcgtcaaggtgctggagcagaagttcggcattgtcaagggcacgatgaccaccacccactcctacaccggtgaccagcgcctgctggacgcgtcccaccgcgacctgcgccgcgcccgcgccgccgccctgaacattgtgcccaccaccaccggtgccgccaaggccgtgtcgctggtgctgcccagcctgaagggcaagctgaacggcattgccctgcgcgtgcccacccccaccgtgtcggtcgtcgacctggtcgtccaggttgagaagaagaccttcgccgaggaggtgaacgccgccttccgcgaggccgccaacggccccatgaagggcgtgctgcacgtcgaggacgcccccctggtgtccattgacttcaagtgcaccgaccagtcgacctccatcgacgcctccctgaccatggtcatgggcgacgacatggtcaaggtcgtggcctggtacgacaacgagtggggctactcccagcgcgtggtcgacctggctgaggtcaccgccaagaagtgggtggcgtga
(2)目的基因表达载体的构建
莱茵衣藻表达载体pchlamy,克隆有
使用限制性内切酶kpni和bglii消化载体质粒pchlamy,将人工合成改造后的目的基因也经相同限制性内切酶消化,将目的基因和载体片段连接,得到重组质粒,并经过了测序验证。
实施例2:莱茵衣藻的遗传转化
采用常规的sds碱裂解法提提重组质粒pchlamy-c-gap3
“电转法”具体步骤如下:
(1)将野生型莱茵衣藻cc-137(chlamydomonasresourcecentercc-137)在连续光照和tap培养液中培养至od=0.4~0.6,细胞稀释到od=0.05~0.08,培养24h后,藻液浓度达到0.3~0.6,取15ml藻细胞2500rpm,室温离心10min,弃上清。
(2)用250μl的40mm蔗糖tap溶液重悬藻细胞,加入电击杯中,再向杯中加入1~2μg的线性化pchlamy-c-gap3质粒,进行电击(600v,50uf,电阻无限大)。
(3)电击结束后,将电击杯中藻细胞和外源dna混合物加入40mm蔗糖tap培养基中,放在光照培养箱培养24h。
(4)取六孔板中藻液5ml放在15ml离心管中,2500rpm,离心10min,弃上清,用150μl的40mm蔗糖tap培养基重悬藻细胞,均匀涂布在50mm的潮霉素平板上,放置在温度为22~25℃,光照强度为50μmolphotonsm-2s-1条件下24h连续光照,倒置培养,待平板长出单藻落。
(5)常规藻落需要培养5-7天长出单藻落,而转化株需要2-3天即可张出单藻落,挑选在这个时间内单藻落大小在1~2mm左右的,再进行后面的验证。
实施例3:转基因莱茵衣藻的筛选与鉴定
莱茵衣藻表达载体上含有hygromycinresistancegene,因此具有潮霉素抗性,转化成功的藻株可以在含有潮霉素抗性的平板上生长。转基因藻的检测包括基因水平的单藻落pcr验证和蛋白水平的westernbloting验证。
(1)转化株的单藻落在基因水平上双重pcr验证
挑取平板上的单藻落到pcr管中,加入10μl的无菌水重悬藻细胞,98℃煮20~30min,离心取上清,用pc-f/r引物,(使用primestarmaxdnapolymerase,takara,大连市,codeno.r045q),利用pcr技术从藻体中扩增出目的基因片段,再用合成的载体上gap3特异性引物(gap3-f/r),利用pcr技术,确定目的基因片段gap3已经转入到莱茵衣藻中。
实施例中,载体本身的引物pc-f:5’gattcgaggtacccttcacc3’
载体上gap3的特异性引物gap3-f:5’aaacatatgcttcaccatggccgc3’
pcr的条件如下:
利用引物pc-f/r的pcr结果如图3所示。利用特异性引物gap3-f/r的pcr结果如图4所示。
(2)转化株的单藻落在蛋白水平上westernbloting验证
在插入的目的基因gap3序列的末端有组氨酸的标签,因此转化株的莱茵衣藻表达gap3蛋白,可以通过westernbloting技术进行验证。
准备样品:低浓度接种chlamy-gap3转化株藻细胞,将其培养至od=0.15~0.35左右,24h全光照,光强50μmolphotonsm-2s-1,收藻,将藻液放在冰上,冷冻离心,4000rpm,10min,收取200ml藻液,收集的藻泥迅速放入液氮中猝灭,-80度保存。
样品处理:将藻液冰上解冻,加入适量无水乙醇,脱去色素,用去离子水洗净,离心去上清,加入裂解液ripa,同时加入蛋白酶抑制剂,加入磁力小球,放在组织破碎仪上,完成破碎,具体的操作参数:频率20hz,转速600n,电流0.01a,取出后在冰上放置1-2h充分裂解,冷冻离心20min,每个样品取上清液200μl,加入变性剂100μl,煮20min-30min。
sds电泳:样品上样20μl,85v跑浓缩胶,95v跑分离胶。
转膜:转膜采用恒流250ma,用tbst溶液洗膜,小心切下目的蛋白位置的膜。
封闭:用tbst溶液配制5%的脱脂奶粉溶液作为封闭液,将pvdf膜在摇床震荡封闭1~2h。
抗体孵育:将his-taq一抗(beyotime,ah367)溶于用tbst溶液配制5%的脱脂奶粉溶液中,将pvdf膜放入抗体溶液中,在4℃冰箱的摇床上过夜;用tbst溶液洗膜,再加入二抗(beyotime,山羊抗小鼠lgg(h+l),a0216),常温摇床孵育,再用tbst溶液洗膜。
曝光:每张膜自动曝光5次
westernbloting结果图如5所示。
(3)莱茵衣藻gap3转化株的培养表型特征
生长指标测定:
在温度为22~25℃,光照强度为50μmolphotonsm-2s-1,进行24h连续光照的培养条件下,使用标准tap培养基进行培养,100ml培养液接种于250ml锥形瓶中,通过对生长指标的测定,转化株要比野生株更早的达到最大生物量,具体数据如下:gap3转化藻株的最大比生长速率为2.2d-1,最大产率为0.6g/l/d;同等条件下,野生株最大的比生长速率为2.0d-1,最大产率为0.4g/l/d;在产率上,转化株相比于野生株提升了约40%左右。当使用5xtap进行培养时,gap3转化藻株的最大比生长速率为1.4d-1,最大产率为1.0g/l/d。
od750倍数图如图1所示。
fv/fm:
在进行转化株和野生株进行培养的过程中,为了监测衣藻的生长活力,测定了叶绿素荧光值,由图2我们可以看出转化株和野生株基本保持一致,转化株的总体生长情况并未收到影响。也可以看出转化株的叶绿素荧光值随着培养时间的变化,先升高再略微降低的趋势,这和转化株在第二天得到最大产率这个事实结果相对应。
序列表
<110>中国科学院大连化学物理研究所
<120>一种用于提高微藻固碳效率的方法及转基因衣藻和应用
<160>1
<170>siposequencelisting1.0
<210>2
<211>1162
<212>dna
<213>人工序列(artificialsequence)
<400>2
ggtacccttcaccatggccgccatgatgcagaagagcgccttcaccggcagcgccgtgtc60
ctccaagtctggcgtccgcgccaaggctgcccgcgccgtcgtcgacgtgcgcgcggagaa120
gaagatccgcgtggccatcaacggcttcggtcgcattggccgcaacttcctgcgctgctg180
gcacggtcgccagaacaccctgctggacgtggttgccatcaacgacagcggcggtgtcaa240
gcaggccagccacctgctgaagtacgactccaccctgggcacgttcgccgccgatgttaa300
gatcgtcgacgacagccacatcagcgtggacggcaagcagatcaagattgtgtccagccg360
cgacccgctgcagctgccgtggaaggagatgaacatcgacctggtcattgagggcactgg420
tgtcttcattgacaaggttggcgctggcaagcacatccaggccggtgcctccaaggtgct480
gatcaccgccccggccaaggacaaggacatcccgaccttcgtggtcggtgtgaacgaggg540
cgactacaagcacgagtacccgatcatctccaacgccagctgcaccaccaactgcctggc600
cccgttcgtcaaggtgctggagcagaagttcggcattgtcaagggcacgatgaccaccac660
ccactcctacaccggtgaccagcgcctgctggacgcgtcccaccgcgacctgcgccgcgc720
ccgcgccgccgccctgaacattgtgccgaccaccaccggtgccgccaaggccgtgagcct780
ggtgctgccgagcctgaagggcaagctgaacggcattgccctgcgcgtgccgaccccgac840
cgtgagcgtcgtcgacctggtcgtccaggttgagaagaagaccttcgccgaggaggtgaa900
cgccgccttccgcgaggccgccaacggcccgatgaagggcgtgctgcacgtcgaggacgc960
cccgctggtgtccattgacttcaagtgcaccgaccagagcacctccatcgacgcctccct1020
gaccatggtcatgggcgacgacatggtcaaggtcgtggcctggtacgacaacgagtgggg1080
ctactcccagcgcgtggtcgacctggctgaggtcaccgccaagaagtgggtggcgcacca1140
ccaccaccaccactgaagatct1162
- 还没有人留言评论。精彩留言会获得点赞!