一种咔唑衍生物、其制备方法及在抗肿瘤中的应用与流程
本发明涉及药物及化工领域,尤其涉及一种咔唑衍生物、其制备方及在抗肿瘤中的应用。
背景技术:
肿瘤是21世纪人类面临严重的健康问题。在过去的几十年,人们一直在寻找有效治疗肿瘤的方法。除了外科手术和放疗外,化疗一直是治疗肿瘤的重要策略。许多药物如依托泊苷、喜树碱、紫杉醇等广泛用于临床抗癌治疗。在所有临床使用的抗癌药物中,约有50%的药物作用于人dna拓扑异构酶。拓扑异构酶重要作为抗肿瘤药物研究的靶点有多个原因。首先,肿瘤细胞快速无限的增值,其dna也处于快速的复制、转录和翻译,在这个过程中产生的dna拓扑结构需要拓扑异构酶来解决;其次,拓扑异构酶其中的一个亚型拓扑异构酶iiα在肿瘤细胞中过表达;最后,拓扑异构酶是能引起dna断裂,这也是抗癌药物作用于拓扑异构酶发挥细胞毒性的原因。因此,基于拓扑异构酶抑制发展抗肿瘤药物具有重要的意义。
技术实现要素:
有鉴于此,本发明的目的在于提供一种咔唑衍生物、其制备方法及在抗肿瘤中的应用,该咔唑衍生物显著抑制拓扑异构酶ⅱ的活性,有效地抑制肿瘤细胞的增殖,具有潜在的抗肿瘤价值。
本发明提供了一种咔唑衍生物,具有式i结构:
所述r1和r2独立地选自氢、卤素、烷氧基、c1~c4烷基、卤代烷基、硝基和腈基中的一种或多种;
所述r3选自羧基、甲基、苯基或氰基;
所述x为ch2或羰基;
m=0~3;n=0~3。
优选地,所述r1选自氢、氟、氯、溴、碘、甲氧基、甲基和三氟甲基中的一种或多种;
所述r2选自氢、氟、氯、溴、甲氧基、甲基、乙基、三氟甲基、硝基和腈基中的一种或多种;
所述r3选自羧基或甲基。
优选地,所述m=0或1;
所述n=0,1或2。
优选地,所述咔唑衍生物选自式(1)~式(29)中的一种:
本发明提供了一种上述技术方案所述咔唑衍生物的制备方法,包括以下步骤:
将罗丹宁或其衍生物与具有式ii结构的化合物进行缩合反应,得到具有式ⅰ结构的咔唑衍生物:
其中,所述r1和r2独立地选自氢、卤素、烷氧基、c1~c4烷基、卤代烷基、硝基和腈基中的一种或多种;
所述r3选自羧基、甲基、苯基或氰基;
所述x为ch2或羰基;
m=0~3;n=0~3。
优选地,所述具有式ii结构的化合物按照以下步骤制备:
将具有式iii结构的化合物与n,n-二甲基甲酰胺、三氯氧磷反应,得到具有式ii结构的化合物;
其中,所述r1和r2独立地选自氢、卤素、烷氧基、c1~c4烷基、卤代烷基、硝基和腈基中的一种或多种;
所述x为ch2或羰基;
m=0~3。
优选地,所述具有式iii结构的化合物按照以下步骤制备:
将咔唑与卤化苄在碱的催化下取代反应,得到具有式iii结构的化合物;
其中,所述r1和r2独立地选自氢、卤素、烷氧基、c1~c4烷基、卤代烷基、硝基和腈基中的一种或多种;
所述x为ch2或羰基;
m=0~3。
优选地,所述咔唑与苄溴的物质的量比为1:0.9~1.1。
优选地,所述咔唑与苄溴在碳酸钾催化下反应的时间为7~9h。
优选地,所述式iii结构的化合物与n,n-二甲基甲酰胺、三氯氧磷反应具体包括:
0℃下,n,n-二甲基甲酰胺与三氯氧磷反应27~33min后,加入溶于二氯甲烷的式iii结构的化合物,85~95℃下反应5.5~6.5h。
优选地,所述式ii结构的化合物与罗丹宁缩合反应的温度为78~83℃;式ii结构的化合物与罗丹宁缩合反应的时间为3.5~4.5h。
优选地,所述式ii结构的化合物与罗丹宁的物质的量比为1:1~1.2。
本发明提供了一种上述技术方案所述咔唑衍生物或上述技术方案所述制备方法制备的咔唑衍生物在制备抗肿瘤药物中的应用。
本发明提供了一种咔唑衍生物,具有式i结构,所述r1和r2独立地选自氢、卤素、烷氧基、c1~c4烷基、卤代烷基、硝基和腈基中的一种或多种;所述r3选自羧基、甲基、苯基或氰基;所述x为ch2或羰基;m=0~3;n=0~3。该化合物显著的抑制拓扑异构酶ⅱ的活性,因而,可以作为拓扑异构酶ⅱ抑制剂(topoii抑制剂)。该化合物是非嵌入型的topoii的催化抑制剂。因此,可用于制备以拓扑异构酶ⅱ为靶点的抗肿瘤药物。同时,该化合物能够抑制多株肿瘤细胞株的增殖,因此,其可用于制备抗癌的药物。实验结果表明:具有式i结构的咔唑衍生物在2.5~20μmol/l下对人拓扑异构酶ⅱ有较强的抑制作用;对子宫颈癌细胞、人肺癌细胞、人白血病细胞和人前列腺癌细胞4株肿瘤细胞株均具有较强的抑制作用。
本发明还提供了一种咔唑衍生物的制备方法,方法简单易行,制得的咔唑衍生物的产率较高,同时,制得的咔唑衍生物对拓扑异构酶活性有很强的抑制作用,对多株肿瘤细胞具有良好的抗增殖活性,因此本发明所述的咔唑衍生物可用于制备抗癌的药物。
附图说明
图1为样品d、t、e、k1~k26中的部分样品的拓扑异构酶ⅱ活性抑制情况图;
图2为topoii介导的dna断裂情况和topoi介导的dna解旋情况图。
具体实施方式
本发明提供了一种咔唑衍生物,具有式i结构:
所述r1和r2独立地选自氢、卤素、烷氧基、c1~c4烷基、卤代烷基、硝基和腈基中的一种或多种;
所述r3选自羧基、甲基、苯基或氰基;
所述x为ch2碳或羰基;
m=0~3;n=0~3。
在本发明中,所述r1优选选自氢、氟、氯、溴、碘、甲氧基、甲基和三氟甲基中的一种或多种。在本发明的具体实施例中,r1具体为氢、溴、甲基或甲氧基。
所述r2优选选自氢、氟、氯、溴、碘、甲氧基、甲基、乙基、三氟甲基、硝基和腈基中的一种或多种;在本发明的具体实施例中,r2具体为氢、氟、氯、溴、甲氧基、甲基、三氟甲基、硝基或腈基。r2所选择的基团可以取代邻、间、对任意位置。
所述r3优选选自羧基、甲基或氰基。
m为ch2的个数,优选地,所述m=0、1、2或3;更优选地,m=0或1;
n为ch2的个数,优选地,所述n=0、1、2或3;更优选地,n=0或1。
在本发明的某些实施例中,所述咔唑衍生物选自式(1)~式(29)中的一种:
本发明提供了一种上述技术方案所述咔唑衍生物的制备方法,包括以下步骤:
将罗丹宁或其衍生物与具有式ii结构的化合物进行缩合反应,得到具有式ⅰ结构的咔唑衍生物:
其中,所述r1和r2独立地选自氢、卤素、烷氧基、c1~c4烷基、卤代烷基、硝基和腈基中的一种或多种;
所述r3选自羧基、甲基、苯基或氰基;
所述x为ch2或羰基;
m=0~3;
n=0~3。
在本发明中,所述r1优选选自氢、氟、氯、溴、碘、甲氧基、甲基和三氟甲基中的一种或多种。在本发明的具体实施例中,r1具体为氢、溴、甲基或甲氧基。
所述r2优选选自氢、氟、氯、溴、碘、甲氧基、甲基、乙基、三氟甲基、硝基和腈基中的一种或多种;在本发明的具体实施例中,r2具体为氢、氟、氯、溴、甲氧基、甲基、三氟甲基、硝基或腈基。r2所选择的基团可以取代邻、间、对任意位置。
所述r3优选选自羧基、甲基或氰基。
m为ch2的个数,优选地,所述m=0、1、2或3;更优选地,m=0或1;
n为ch2的个数,优选地,所述n=0、1、2或3;更优选地,n=0、1或2。
在本发明中,所述具有式ii结构的化合物优选按照以下步骤制备:
将具有式iii结构的化合物与n,n-二甲基甲酰胺、三氯氧磷反应,得到具有式ii结构的化合物;
其中,所述r1和r2独立地选自氢、卤素、烷氧基、c1~c4烷基、卤代烷基、硝基和腈基中的一种或多种。所述r1优选选自氢、氟、氯、溴、碘、甲氧基、甲基和三氟甲基中的一种或多种。所述r2优选选自氢、氟、氯、溴、碘、甲氧基、甲基、乙基、三氟甲基、硝基和腈基中的一种或多种。
所述x为ch2或羰基;
m=0~3,优选为m=0、1、2或3,更优选为m=0或1。
在本发明中,所述具有式iii结构的化合物按照以下步骤制备:
将咔唑与卤化苄在碱的催化下取代反应,得到具有式iii结构的化合物;
其中,所述r1和r2独立地选自氢、卤素、烷氧基、c1~c4烷基、卤代烷基、硝基和腈基中的一种或多种;所述r1优选选自氢、氟、氯、溴、碘、甲氧基、甲基和三氟甲基中的一种或多种。所述r2优选选自氢、氟、氯、溴、碘、甲氧基、甲基、乙基、三氟甲基、硝基和腈基中的一种或多种。
所述x为ch2或羰基;
m=0~3,优选为m=0、1、2或3,更优选为m=0或1。
所述卤化苄优选为苄溴。所述咔唑与卤化苄的物质的量比优选为1:0.9~1.1,更优选为1:1。所述碱优选为固体碱,在本发明的某些实施例中,所述碱为碳酸钾固体。所述碱与卤化苄的摩尔比优选为1:1~5;更优选为1:4~5。在本发明的某些实施例中,所述碱与卤化苄的摩尔比为1:5。
所述咔唑与卤化苄优选以二甲基甲酰胺(dmf)为溶剂进行反应;本发明对所述溶剂的用量并无特殊的限制。在本发明中,所述咔唑与卤化苄在碱的催化下反应的时间优选为7~9h,更优选为7.5~8.5h,最优选为8h。咔唑与卤化苄在碱的催化下反应的温度优选为10~40℃,更优选为15~30℃。咔唑与卤化苄反应结束后,优选将反应产物重结晶;更优选采用无水乙醇进行重结晶。重结晶得到的白色固体为具有式iii结构的化合物。
得到具有式iii结构的化合物后,本发明将具有式iii结构的化合物与n,n-二甲基甲酰胺、三氯氧磷反应,得到具有式ii结构的化合物。
在本发明中,所述式iii结构的化合物与n,n-二甲基甲酰胺、三氯氧磷反应具体优选包括:
0℃下,n,n-二甲基甲酰胺与三氯氧磷反应27~33min后,加入溶于二氯甲烷的式ii结构的化合物,85~95℃下反应5.5~6.5h。
更具体优选包括:
0℃冰浴下,等体积的n,n-二甲基甲酰胺与三氯氧磷反应30min后,加入溶于二氯甲烷的式ii结构的化合物,90℃下反应6h。
式iii结构的化合物与n,n-二甲基甲酰胺、三氯氧磷反应结束后,本发明优选用水淬灭,然后氢氧化钠中和至ph=7,萃取。本发明优选用乙酸乙酯和水进行萃取。所述萃取后,优选还包括提纯。具体的,优选为:收集有机相,硅胶柱提纯。提纯得到的白色固体为具有式ii结构的化合物。
得到具有式ii结构的化合物后,本发明将罗丹宁或其衍生物与具有式ii结构的化合物进行缩合反应,得到具有式ⅰ结构的咔唑衍生物。
在本发明中,所述罗丹宁或其衍生物优选为罗丹宁、罗丹宁-3-苄基、罗丹宁-3-乙基、罗丹宁-3-乙腈、罗丹宁-3-丙酸、罗丹宁-3-乙酸。在本发明中,所述式ii结构的化合物与罗丹宁的物质的量比优选为1:1~1.2,更优选为1:1.1。
所述缩合反应优选在溶剂和催化剂的作用下进行。所述溶剂优选为乙醇。所述催化剂优选为吡啶。本发明对所述溶剂的用量并无特殊的限制。所述催化剂与具有式ⅱ结构的化合物的摩尔比优选为1~5:1;更优选为1~3:1。在本发明的某些实施例中,所述催化剂与所述具有式ⅱ结构的化合物的摩尔比为1∶1。
在本发明中,所述式ii结构的化合物与罗丹宁缩合反应的温度优选为78~83℃,更优选为80℃;式ii结构的化合物与罗丹宁缩合反应的时间优选为3.5~4.5h,更优选为4h。在本发明的某些实施例中,所述式ii结构的化合物与罗丹宁缩合反应的温度为80℃,所述式ii结构的化合物与罗丹宁缩合反应的时间为4h。
缩合反应结束后,本发明优选还包括提纯。在本发明中,所述提纯的方式优选为重结晶。所述重结晶的试剂优选为乙醇。所述重结晶前,优选还包括:冷却、析出固体、除水、洗涤和烘干。本发明对所述冷却的方式并无特殊的限制,采用本领域技术人员熟知的冷却方式,冷却至室温即可。本发明对所述析出固体的方式并无特殊的限制,采用本领域技术人员熟知的析出固体的方式即可。在本发明中,析出的固体为黄色固体。本发明对所述除水的方式并无特殊的限制,采用本领域技术人员熟知的除水的方式即可,本发明优选为抽滤。所述抽滤后,本发明将所述抽滤得到的滤饼进行洗涤,本发明对所述洗涤的方式并无特殊的限制,采用本领域技术人员熟知的洗涤方式即可,本发明优选为先用盐酸洗涤,再用清水洗涤。本发明对所述烘干的方式并无特殊的限制采用本领域技术人员熟知的烘干的方式即可,本发明优选为红外烘干。
本发明对上述所采用的原料的来源并无特殊的限制,可以为一般市售商品。
本发明还提供了上述咔唑衍生物或者上述制备方法制备的咔唑衍生物在制备抗肿瘤药物中的应用。该化合物显著的抑制拓扑异构酶ⅱ的活性,因而,可以作为拓扑异构酶ⅱ抑制剂(topoii抑制剂)。该化合物是非嵌入型的topoii的催化抑制剂。因此,可用于制备以拓扑异构酶ⅱ为靶点的抗肿瘤药物。同时,该化合物能够抑制多株肿瘤细胞株的增殖,因此,其可用于制备抗癌的药物。实验结果表明:具有式i结构的咔唑衍生物在2.5~20μmol/l下对人拓扑异构酶ⅱ有较强的抑制作用;对子宫颈癌细胞、人肺癌细胞、人白血病细胞和人前列腺癌细胞4株肿瘤细胞株均具有较强的抑制作用。
本发明提供了一种咔唑衍生物,具有式i结构,所述r1和r2独立地选自氢、卤素、烷氧基、c1~c4烷基、卤代烷基、硝基和腈基中的一种或多种;所述r3选自羧基、甲基、苯基或氰基;所述x为ch2或羰基;m=0~3;n=0~3。该化合物显著的抑制拓扑异构酶ⅱ的活性,因而,可以作为拓扑异构酶ⅱ抑制剂(topoii抑制剂)。该化合物是非嵌入型的topoii的催化抑制剂。因此,可用于制备以拓扑异构酶ⅱ为靶点的抗肿瘤药物。同时,该化合物能够抑制多株肿瘤细胞株的增殖,因此,其可用于制备抗癌的药物。实验结果表明:具有式i结构的咔唑衍生物在2.5~20μmol/l下对人拓扑异构酶ⅱ有较强的抑制作用;对子宫颈癌细胞、人肺癌细胞、人白血病细胞和人前列腺癌细胞4株肿瘤细胞株均具有较强的抑制作用。
本发明还提供了一种咔唑衍生物的制备方法,方法简单易行,制得的咔唑衍生物的产率较高,同时,制得的咔唑衍生物对拓扑异构酶活性有很强的抑制作用,对多株肿瘤细胞具有良好的抗增殖活性,因此本发明所述的咔唑衍生物可用于制备抗癌的药物。
实验结果表明,本发明制得的咔唑衍生物的产率较高,均不低于77%。采用pbr322dna质粒松散法进行无细胞体系的人dna拓扑异构酶ⅱ抑制活性测试测试结果表明,本发明提供的咔唑衍生物对拓扑异构酶ⅱ有较强的抑制作用,其中化合物k4在5微摩尔的浓度下能完全抑制酶的活性,k7和k22在10微摩尔的浓度下能完全抑制酶的活性,化合物k10和化合物k23在20微摩尔的浓度下能完全抑制酶的活性。因此,本发明的咔唑衍生物可用于制备以拓扑异构酶ii为靶点的抗肿瘤药物。以4株肿瘤细胞株hela(子宫颈癌细胞),a549(人肺癌细胞),hl-60(人白血病细胞),和ca46(人前列腺癌细胞)。采用mtt法进行体外细胞毒测定。结果表明,本发明提供的咔唑衍生物在体外对这4种肿瘤细胞株均具有较强的抑制作用。因此本发明所述的咔唑衍生物可用于制备抗癌的药物。
为了进一步说明本发明,下面结合实施例对本发明提供的一种咔唑衍生物、其制备方法及在抗肿瘤中的应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
实施例1
化合物a1~a24的合成:
1:1当量的咔唑或咔唑衍生物与苄溴,dmf做溶剂,加入5当量的碳酸钾,室温反应8h。反应结束后,用无水乙醇重结晶,得到白色固体,产率70~85%。
实施例2
化合物a25~a48的合成:
0℃冰浴下,等体积的n,n-二甲基甲酰胺与三氯氧磷反应30min后,加入溶于二氯甲烷的化合物a1~a24,90℃反应6h。反应结束后,用水淬灭,氢氧化钠中和到ph=7,用乙酸乙酯和水萃取,收集有机相,硅胶柱提纯得白色固体,产率77~89%。
实施例3:化合物k1的合成
上述制备的原料化合物a25与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率81%。
对黄色固体进行核磁共振氢谱测试,结果如下:
1hnmr(400mhz,dmso-d6)δ13.46(s,1h),8.54(s,1h),8.34(d,j=7.7hz,1h),8.07(s,1h),7.83(d,j=8.7hz,1h),7.76(dd,j=8.7,1.4hz,1h),7.68(d,j=8.3hz,1h),7.61(dd,j=9.8,1.7hz,1h),7.53(t,j=7.6hz,1h),7.34(t,j=7.5hz,1h),7.30(dd,j=8.3,1.4hz,1h),6.86(t,j=8.2hz,1h),5.78(s,2h),4.77(s,2h).13cnmr(101mhz,dmso-d6)δ193.72,167.86,166.97,160.49(d,j=250.4hz),141.99,141.16,136.09,130.78(d,j=4.6hz),129.37,128.36,128.32,127.57,124.79(d,j=9.1hz),123.98(d,j=15.0hz),123.78,122.58,121.51,121.43,121.06,119.53(d,j=24.7hz),118.29,111.33,110.71,45.50,40.73(d,j=1.9hz)。
结果表明:制得的黄色固体为化合物k1,具有如下结构:
实施例4:化合物k2的合成
上述制备的化合物a26与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率84%。
对黄色固体进行核磁共振氢谱测试,结果如下:
1hnmr(400mhz,dmso-d6)δ13.44(s,1h),8.53(s,1h),8.33(d,j=7.7hz,1h),8.07(s,1h),7.85(d,j=8.7hz,1h),7.75(dd,j=8.6,0.8hz,1h),7.70(d,j=8.2hz,1h),7.52(t,j=7.6hz,1h),7.34(dd,j=14.7,7.9hz,3h),7.20(d,j=8.4hz,2h),5.75(s,2h),4.77(s,2h).13cnmr(101mhz,dmso-d6)δ193.70,167.87,166.96,142.02,141.24,136.71,136.14,132.55,129.39,129.17,129.13,127.57,124.91,124.63,123.75,122.57,121.52,120.97,118.16,111.28,110.76,45.67,45.49。
结果表明:制得的黄色固体为化合物k2,具有如下结构:
实施例5:化合物k3的合成
上述制备的化合物a27与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率84%。
对黄色固体进行核磁共振氢谱测试,结果如下:
1hnmr(400mhz,dmso-d6)δ13.44(s,1h),8.53(s,1h),8.33(d,j=7.7hz,1h),8.07(s,1h),7.85(d,j=8.7hz,1h),7.75(dd,j=8.6,0.8hz,1h),7.70(d,j=8.2hz,1h),7.52(t,j=7.6hz,1h),7.34(dd,j=14.7,7.9hz,3h),7.20(d,j=8.4hz,2h),5.75(s,2h),4.77(s,2h).13cnmr(101mhz,dmso-d6)δ193.70,167.87,166.96,142.02,141.24,136.71,136.14,132.55,129.39,129.17,129.13,127.57,124.91,124.63,123.75,122.57,121.52,120.97,118.16,111.28,110.76,45.67,45.49。
结果表明:制得的黄色固体为化合物k3,具有如下结构:
实施例6:化合物k4的合成
上述制备的化合物a28与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率83%。
对黄色固体进行核磁共振氢谱测试,结果如下:
1hnmr(400mhz,dmso-d6)δ13.46(s,1h),8.54(s,1h),8.34(d,j=7.7hz,1h),8.07(s,1h),7.85(d,j=8.7hz,1h),7.76(d,j=8.8hz,1h),7.70(d,j=8.2hz,1h),7.54(d,j=7.5hz,1h),7.49(d,j=8.4hz,2h),7.33(t,j=7.4hz,1h),7.14(d,j=8.3hz,2h),5.74(s,2h),4.77(s,2h).13cnmr(101mhz,dmso-d6)δ193.68,167.88,166.95,142.01,141.23,137.13,136.12,132.08,129.46,129.38,127.56,124.90,124.62,124.41,123.74,122.56,121.51,121.04,118.14,111.26,110.74,45.73,45.48。
结果表明:制得的黄色固体为化合物k4,具有如下结构:
实施例7:化合物k5的合成
上述制备的化合物a29与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率82%。
对黄色固体进行核磁共振氢谱测试,结果如下:
1hnmr(400mhz,dmso-d6)δ13.46(s,1h),8.53(d,j=1.1hz,1h),8.32(d,j=7.8hz,1h),8.07(s,1h),7.86(d,j=8.7hz,1h),7.75(dd,j=8.7,1.5hz,1h),7.71(d,j=8.3hz,1h),7.52(t,j=7.7hz,1h),7.32(t,j=7.4hz,1h),7.12–7.07(m,4h),5.69(s,2h),4.77(s,2h),2.22(s,3h).13cnmr(101mhz,dmso-d6)δ193.71,167.86,166.97,142.11,141.35,137.16,136.22,134.61,129.69,129.29,127.47,127.27,124.90,124.45,123.69,122.52,121.44,120.82,118.01,111.35,110.85,46.16,45.48,21.08。
结果表明:制得的黄色固体为化合物k5,具有如下结构:
实施例8:化合物k6的合成
上述制备的化合物a30与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率78%。
对黄色固体进行核磁共振氢谱测试,结果如下:
1hnmr(400mhz,dmso-d6)δ13.44(s,1h),8.55(d,j=1.2hz,1h),8.35(d,j=7.7hz,1h),8.17(d,j=8.8hz,2h),8.07(s,1h),7.84(d,j=8.7hz,1h),7.76(dd,j=8.7,1.5hz,1h),7.69(d,j=8.2hz,1h),7.53(dd,j=11.4,4.0hz,1h),7.39(d,j=8.7hz,2h),7.35(t,j=7.5hz,1h),5.93(s,2h),4.77(s,2h).13cnmr(101mhz,dmso-d6)δ193.67,167.87,166.95,147.35,145.52,142.00,141.20,136.05,129.48,128.31,127.66,124.90,124.81,124.41,123.81,122.62,121.59,121.13,118.30,111.21,110.66,45.85,45.47。
结果表明:制得的黄色固体为化合物k6,具有如下结构:
实施例9:化合物k7的合成
上述制备的化合物a31与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率82%。
对黄色固体进行核磁共振氢谱测试,结果如下:
1hnmr(400mhz,dmso-d6)δ13.46(s,1h),8.50(d,j=0.5hz,1h),8.31(d,j=7.7hz,1h),8.04(s,1h),7.82(d,j=8.7hz,1h),7.73(dd,j=8.7,1.2hz,1h),7.67(d,j=8.2hz,1h),7.52(t,j=7.7hz,1h),7.31(dd,j=12.9,5.7hz,2h),7.27–7.19(m,1h),7.06(t,j=7.5hz,1h),6.94(t,j=7.2hz,1h),5.78(s,2h),4.76(s,2h).13cnmr(101mhz,dmso-d6)δ193.71,167.84,166.96,160.59(d,j=245.4hz),142.09,141.27,136.12,130.20(d,j=8.0hz),129.32,129.28,127.51,125.17(d,j=3.4hz),124.83,124.64,124.23(d,j=14.8hz),123.75,122.57,121.45,120.96,118.20,116.09(d,j=20.9hz),111.32,110.73,45.50,40.94(d,j=3.9hz).
结果表明:制得的黄色固体为化合物k7,具有如下结构:
实施例10:化合物k8的合成
上述制备的化合物a32与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率81%。
对黄色固体进行核磁共振氢谱测试,结果如下:
1hnmr(400mhz,dmso-d6)δ13.46(s,1h),8.52(d,j=1.4hz,1h),8.33(d,j=7.7hz,1h),8.06(s,1h),7.85(d,j=8.7hz,1h),7.75(dd,j=8.7,1.6hz,1h),7.69(d,j=8.2hz,1h),7.55–7.50(m,1h),7.31(ddd,j=11.5,10.7,4.9hz,2h),7.08–7.02(m,1h),6.97(td,j=8.5,2.3hz,1h),5.77(s,2h),4.77(s,2h).13cnmr(101mhz,dmso-d6)δ193.71,167.86,166.96,162.23(dd,j=246.3,12.1hz),160.66(dd,j=247.1,13.7hz),141.99,141.16,136.11,130.63(dd,j=10.0,5.9hz),129.34,127.54,124.82,124.68,123.76,122.57,121.48,121.01,120.67(dd,j=15.4,3.7hz),118.24,112.20(dd,j=21.5,3.6hz),111.34,110.73,104.75(t,j=25.8hz),45.48,40.62.
结果表明:制得的黄色固体为化合物k8,具有如下结构:
实施例11:化合物k9的合成
上述制备的化合物a33与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率80%。
对黄色固体进行核磁共振氢谱测试,结果如下:
1hnmr(400mhz,dmso-d6)δ13.48(s,1h),8.52(s,1h),8.33(d,j=7.8hz,1h),8.06(d,j=2.2hz,1h),7.88(d,j=8.5hz,1h),7.77–7.72(m,2h),7.54(t,j=7.7hz,1h),7.38–7.32(m,3h),6.97–6.93(m,1h),5.74(s,2h),4.76(s,2h).13cnmr(101mhz,dmso-d6)δ193.67,167.87,166.94,149.81(dd,j=246.5,12.9hz),149.20(dd,j=245.5,12.3hz),141.93,141.15,136.08,135.45(dd,j=5.1,3.8hz),129.44,127.61,124.88,124.70,124.00(dd,j=6.7,3.5hz),123.76,122.58,121.53,121.03,118.34(d,j=17.2hz),118.19,116.63(d,j=17.4hz),111.24,110.71,45.46,45.34.
结果表明:制得的黄色固体为化合物k9,具有如下结构:
实施例12:化合物k10的合成
上述制备的化合物a34与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率80%。
对黄色固体进行核磁共振氢谱测试,结果如下:
1hnmr(400mhz,dmso-d6)δ8.48(d,j=0.7hz,1h),8.30(d,j=7.7hz,1h),8.03(s,1h),7.83(d,j=8.7hz,1h),7.71(dd,j=10.3,4.6hz,2h),7.51(t,j=7.7hz,1h),7.34–7.25(m,3h),7.24(d,j=6.9hz,1h),7.20(d,j=7.1hz,2h),5.72(s,2h),4.75(s,2h).13cnmr(101mhz,dmso-d6)δ193.68,167.87,166.95,142.13,141.36,137.66,136.17,129.32,129.16,127.94,127.49,127.25,124.90,124.49,123.69,122.53,121.45,120.86,118.01,111.31,110.81,46.36,45.47.
结果表明:制得的黄色固体为化合物k10,具有如下结构:
实施例13:化合物k11的合成
上述制备的化合物a35与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率81%。
对黄色固体进行核磁共振氢谱测试,结果如下:
1hnmr(400mhz,dmso-d6)δ13.44(s,1h),8.55(d,j=1.5hz,1h),8.35(d,j=7.7hz,1h),8.07(s,1h),7.85(d,j=8.7hz,1h),7.76(dd,j=8.7,1.6hz,1h),7.68(t,j=8.4hz,3h),7.55–7.51(m,1h),7.36(dd,j=7.9,3.1hz,3h),5.87(s,2h),4.77(s,2h).13cnmr(101mhz,dmso-d6)δ193.68,167.87,166.95,142.51,142.49,142.04,141.25,136.10,129.42,128.57(d,j=31.8hz),127.87,127.64,126.12(q,j=3.7hz),124.92,124.72,124.59(q,j=272.1hz),123.77,122.57,121.55,121.06,118.23,111.23,110.68,45.90,45.47.
结果表明:制得的黄色固体为化合物k11,具有如下结构:
实施例14:化合物k12的合成
上述制备的化合物a36与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率82%。
对黄色固体进行核磁共振氢谱测试,结果如下:
1hnmr(400mhz,dmso-d6)δ13.46(s,1h),8.54(s,1h),8.34(d,j=7.7hz,1h),8.07(s,1h),7.87(d,j=8.7hz,1h),7.76(dd,j=8.7,1.6hz,1h),7.72(d,j=8.3hz,1h),7.54(t,j=7.6hz,1h),7.37–7.31(m,2h),7.08(t,j=8.8hz,2h),6.96(d,j=7.7hz,1h),5.77(s,2h),4.77(s,2h).13cnmr(101mhz,dmso-d6)δ193.68,167.88,166.95,162.70(d,j=244.3hz),142.04,141.26,140.62(d,j=7.0hz),136.11,131.28(d,j=8.3hz),129.41,127.59,124.91,124.64,123.73,123.18(d,j=2.7hz),122.54,121.52,120.99,118.15,114.80(d,j=20.8hz),114.17(d,j=21.8hz),111.26,110.74,45.83,45.47.
结果表明:制得的黄色固体为化合物k12,具有如下结构:
实施例15:化合物k13的合成
上述制备的化合物a37与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率80%。
对黄色固体进行核磁共振氢谱测试,结果如下:
1hnmr(400mhz,dmso-d6)δ13.45(s,1h),8.54(d,j=1.1hz,1h),8.34(d,j=7.7hz,1h),8.07(s,1h),7.83(d,j=8.7hz,1h),7.77(d,j=8.1hz,3h),7.68(d,j=8.2hz,1h),7.52(t,j=7.7hz,1h),7.33(dd,j=12.7,7.9hz,3h),5.87(s,2h),4.77(s,2h).13cnmr(101mhz,dmso-d6)δ193.68,167.88,166.95,143.47,142.02,141.22,136.07,133.17,129.47,128.05,127.64,124.91,124.78,123.78,122.59,121.57,121.09,119.07,118.27,111.23,110.75,110.68,46.00,45.47.
结果表明:制得的黄色固体为化合物k13,具有如下结构:
实施例16:化合物k14的合成
上述制备的化合物a38与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率78%。
实施例17:化合物k15的合成
上述制备的化合物a39与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率77%。
实施例18:化合物k16的合成
上述制备的化合物a40与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率79%。
实施例19:化合物k17的合成
上述制备的化合物a41与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率80%。
实施例20:化合物k18的合成
上述制备的化合物a42与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率81%。
实施例21:化合物k19的合成
上述制备的化合物a43与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率79%。
实施例22:化合物k20的合成
上述制备的化合物a44与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率80%。
实施例23:化合物k21的合成
上述制备的化合物a45与1.1当量的罗丹宁3-乙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率81%。
实施例24:化合物k22的合成
上述制备的化合物a29与1.1当量的罗丹宁溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率82%。
实施例25:化合物k23的合成
上述制备的化合物a29与1.1当量的罗丹宁3-丙酸溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率81%。
实施例26:化合物k24的合成
上述制备的化合物a26与1.1当量的罗丹宁3-乙基溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率80%。
实施例27:化合物k25的合成
上述制备的化合物a29与1.1当量的罗丹宁3-乙腈溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率78%。
实施例28:化合物k26的合成
上述制备的化合物a29与1.1当量的罗丹宁3-苄基溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率80%。
实施例29:化合物k27的合成
上述制备的化合物a46与1.1当量的罗丹宁3-苄基溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率77%。
实施例30:化合物k28的合成
上述制备的化合物a47与1.1当量的罗丹宁3-苄基溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率79%。
实施例31:化合物k29的合成
上述制备的化合物a48与1.1当量的罗丹宁3-苄基溶于乙醇中,加入1当量的吡啶,80℃下反应4h,反应结束后,冷至室温,析出黄色固体,抽滤,滤饼用稀盐酸洗涤后用水洗涤,红外烘干,然后用乙醇重结晶,得黄色固体,产率80%。
实施例32:所述咔唑生物对人拓扑异构酶ii的抑制作用
将得到的化合物k1~k26采用pbr322dna质粒松散法进行无细胞体系的人dna拓扑异构酶ⅱ抑制活性测试。其中,pbr322dna质粒购于takara试剂公司,人dna拓扑异构酶ⅱ购于topogen公司。按照试剂使用说明书进行实验,将1u的酶与pbr322dna质粒(200ng)加入到人dna拓扑异构酶ⅱ缓冲液(50mmtris-hcl,ph8.0,150mmnacl,10mmmgcl2,2mmatp,0.5mmdtt和30μg·ml-1bsa)中,重复配制,得到28份相同的样品,其中,一个样品无添加为样品t;另一个样品添加浓度为100μm的依托泊苷(依托泊苷是市场上购买的细胞周期特异性抗肿瘤药物,作为对照)为样品e;其余的26份样品中,每份样品中各加入k1~k26所对应的化合物中的一个化合物,得到26份试样,为样品k1~k26。除此之外,再配制一份样品为样品d,其中只含有pbr322dna质粒(200ng)。然后,将上述29个样品在37℃水浴中,孵育30分钟后,进行琼脂糖凝胶电泳,gelred染色后,利用凝胶成像仪进行检测。其中,样品d、t、e和k1~k26的凝胶成像仪检测结果如图1所示。图1为样品d、t、e、化合物k1~k26中的部分样品的拓扑异构酶ⅱ活性抑制情况图。其中,图1中的ⅰ、ⅱ和ⅲ为样品d、t、e和k1~k26的拓扑异构酶ⅱ活性抑制情况图,其中,k1~k26的浓度为50μm;图1中的ⅳ为样品d、t、e和k1~k26中的部分样品的拓扑异构酶ⅱ活性抑制情况图,其中,k1~k26中的部分样品的浓度为20μm;图1中的ⅴ为样品d、t、e、化合物k4、化合物k7、化合物k10、化合物k22和化合物k23的拓扑异构酶ⅱ活性抑制情况图,其中,k4、k7、k10、k22和k23样品的浓度为2.5μm、5μm、10μm和20μm各浓度对应的拓扑异构酶ⅱ活性抑制情况。
从图1可以看出,本发明提供的咔唑类衍生物对人拓扑异构酶ⅱ有较强的抑制作用,其中化合物k4在5微摩尔的浓度下能完全抑制酶的活性,k7和k22在10微摩尔的浓度下能完全抑制酶的活性,k10和k23在20微摩尔的浓度下能完全抑制酶的活性。因此本发明的咔唑类衍生物可用于制备以拓扑异构酶ⅱ为靶点的抗肿瘤药物。
实施例33:所述咔唑类衍生物对人拓扑异构酶ii的作用机制
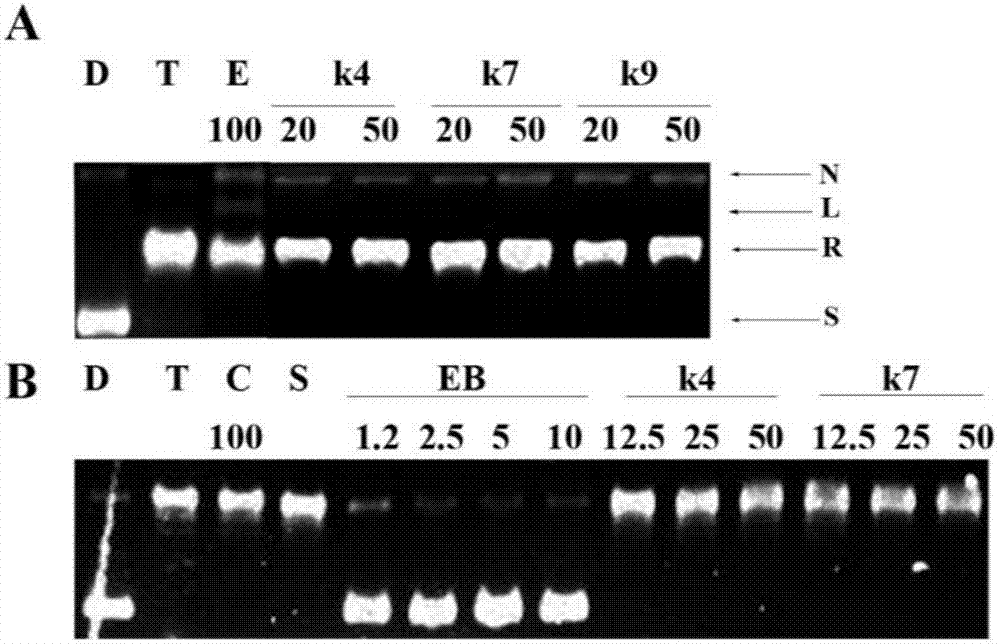
选用化合物k4和k7研究化合物抑制人dna拓扑异构酶ⅱ的作用机制,采用依托泊苷作阳性对照,按照试剂使用说明书进行topoii介导的dna断裂实验和topoi介导的dna解旋实验,如图2所示。图2为topoii介导的dna断裂情况和topoi介导的dna解旋情况图。其中,图2中的a为topoⅱ介导的dna断裂情况图;d为dna空白组;t为添加topoⅱ和dna的对照组;e为加入了依托泊苷的阳性对照组;n为缺口dna;l为线性dna;r为松散dna;s为超螺旋dna。图2中的b为topoi介导的dna解旋情况图;d为dna空白组;t为添加topoi和dna的对照组;eb为溴乙锭。
从图2中的a可以看出,与对照的dna空白组(d)和只加酶和dna的对照组(t)相比,加入了依托泊苷的阳性对照组(e)电泳图中间出现了明显的线性dna条带,表明依托泊苷能显著促进断裂复合物的形成。相比之下,化合物k4和k7在20μμ浓度下不仅不产生线性dna,而且还能减少topoⅱ毒剂线性dna的产生,说明k4和k7是topoⅱ的催化抑制剂。因此,本发明的咔唑类衍生物可用于制备以拓扑异构酶ⅱ为靶点的催化型抑制剂。从图2中的b可知,溴乙锭能够明显的嵌入到dna中使得松散型的dna转化为超螺旋型的dna,而化合物k4和k7在高浓度下也没有明显的嵌入作用,说明此类化合物是非嵌入型的topoii催化抑制剂。
选用化合物k4和k7研究化合物抑制人dna拓扑异构酶π的作用机制,同样采用依托泊苷作阳性对照,按照试剂使用说明书进行topoii介导的dna断裂实验,结果如图2中a所示。图2中a说明如下:(d:dna对照;t:dna+topoii;e:依托泊苷;n:缺口dna;l:线性dna;r:松散dna;s:超螺旋dna)。从图2可以看出,与对照的dna空白组和只加酶和dna的对照组相比,加入了依托泊苷的阳性对照组电泳图中间出现了明显的线性dna条带,表明依托泊苷能显著促进断裂复合物的形成。相比,化合物k4和k7在50μμ浓度下不仅不产生线性dna,说明k4和k7是topoii的催化抑制剂。因此,本发明的咔唑类衍生物可用于制备以topoii为靶点的催化型抑制剂。此外,为了进一步研究化合物的作用机制,进行了topoi介导的dna解旋实验,实验结果如图2中b所示。溴乙锭能够明显的嵌入到dna中使得松散型的dna转化为超螺旋型的dna,而化合物在高浓度下也没有明显的嵌入作用,说明此类化合物是非嵌入型的topoii催化抑制剂。图2b中说明如下(d:dna对照;t:dna+topoi;eb:溴乙锭)。
实施例34:所述咔唑类衍生物对肿瘤细胞的抑制活性
以4株肿瘤细胞株hela(子宫颈癌细胞),a549(人肺癌细胞),hl-60(人白血病细胞),和ca46(人前列腺癌细胞)。采用mtt法进行体外细胞毒测定。对数生长期细胞加入不同浓度的咔唑衍生物,作用48小时后,加mtt,四小时后,测定其吸光度。分别计算抑制细胞生长达50%时的化合物浓度,以ic50值表示,结果如表1所示。
表1化合物对肿瘤细胞株的抑制活性
结果表明,本发明提供的咔唑衍生物在体外对这4株肿瘤细胞株均具有较强的抑制作用。因此本发明所述的咔唑类衍生物可用于制备抗癌的药物。
由以上实施例可知,本发明提供了一种咔唑衍生物,具有式i结构,所述r1和r2独立地选自氢、卤素、烷氧基、c1~c4烷基、卤代烷基、硝基和腈基中的一种或多种;所述r3选自羧基、甲基、苯基或氰基;所述x为ch2或羰基;m=0~3;n=0~3。该化合物显著的抑制拓扑异构酶ⅱ的活性,因而,可以作为拓扑异构酶ⅱ抑制剂(topoii抑制剂)。该化合物是非嵌入型的topoii的催化抑制剂。因此,可用于制备以拓扑异构酶ⅱ为靶点的抗肿瘤药物。同时,该化合物能够抑制多株肿瘤细胞株的增殖,因此,其可用于制备抗癌的药物。实验结果表明:具有式i结构的咔唑衍生物在2.5~20μmol/l下对人拓扑异构酶ⅱ有较强的抑制作用;对子宫颈癌细胞、人肺癌细胞、人白血病细胞和人前列腺癌细胞4株肿瘤细胞株均具有较强的抑制作用。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于生产化学品及其衍生物的组合物和方法与制造工艺
- 7‑OH‑8‑[(1‑胺基‑1‑苯基衍生物)‑次甲基]‑黄酮化合物及其制备方法及其应用与制造工艺
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 含D型非天然氨基酸的抗菌肽类似物及其合成与应用的制造方法与工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 一种白杨素氨基酸衍生物的制备方法与制造工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺
- 水生态处理中淤泥及衍生物的再利用处理系统的制造方法与工艺
- 一种新型罗汉果醇衍生物单体的制作方法
- Schiglautone A衍生物的组合物用于制备抗鼻炎药物的制作方法
- Schiglautone A衍生物的组合物用于制备防治肾纤维化药物的制作方法
- Artalbic acid衍生物的组合物用于制备抗心衰药物的制作方法
- Artalbic acid衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Schiglautone A 衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Artalbic acid的衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Artalbic acid的衍生物的组合物用于制备防治胰腺纤维化药物的制作方法