敲除乳腺上皮细胞NLRP3炎性体接头蛋白ASC基因的方法与流程
本发明涉及基因工程技术领域,具体地说,涉及一种基于crispr/cas9技术敲除牛乳腺上皮细胞nlrp3炎性体接头蛋白asc基因的方法。
背景技术:
乳房炎是危害奶牛业的最重要疾病,每年造成巨大的经济损失及严重的食品卫生安全问题,其中大肠杆菌是引起奶牛乳房炎的主要致病菌。奶牛乳腺上皮细胞是研究大肠杆菌性乳房炎发病机制的模型,大肠杆菌能够诱导剧烈的奶牛炎症,但具体的作用机制仍不清楚。炎性体最初于2002年在人的单核细胞提取物中发现,是由包浆内模式识别受体(prrs)参与组装的多蛋白复合物,是先天免疫系统中的重要组成部分。炎性体在感染、炎症和自身免疫性疾病的发生发展过程中发挥着极为重要的作用。炎性体主要由受体、接头蛋白及效应蛋白组成。目前已经鉴定出nlrp3、nlrp1、nlrc4和aim2等多种炎性体受体。asc是炎性体的接头蛋白,nlrp3受体等激活后可以招募asc接头蛋白,进一步激活caspase-1效应蛋白,促进il-1β及il-18的成熟释放,调节炎症反应。除了依赖于asc的nlrp3受体外,nlrp1及nlrc4受体可以不依赖于asc直接激活caspase-1。大肠杆菌某些配体的炎性体已经确定,但仍有大量的受体不明确的配体能够促进caspase-1的激活。通过敲除炎性体接头蛋白asc,不仅有利于确定大肠杆菌携带配体的炎性体受体,更为研究其他致病菌的作用机制提供了可行性。
目前,基因编辑技术飞速发展。近些年来,由crispr/cas9系统介导的基因编辑技术成为生物界获得基因敲除突变体的主流技术。该系统来源于细菌的免疫系统,其工作原理是crrna(crispr-derivedrna)通过碱基配对与tracrrna(trans-activatingrna)结合形成tracrrna/crrna复合物,此复合物引导核酸酶cas9蛋白在与crrna配对的序列靶位点剪切双链rna。而通过人工设计这两种rna,可以改造形成具有引导作用的sgrna(shortguiderna),引导cas9对dna定点切割。通过人工合成与靶基因序列同源的sgrna,可以直接实现对目标基因的编辑,并且这种基因的被编辑状态可以稳定遗传到下一代,无需crispr/cas9外源t-dna的持续存在。
技术实现要素:
本发明的目的是提供一种基于crispr/cas9技术敲除牛乳腺上皮细胞nlrp3炎性体接头蛋白asc基因的方法。
为了实现本发明目的,本发明首先提供一种牛乳腺上皮细胞nlrp3炎性体接头蛋白asc基因打靶载体,所述打靶载体是基于crispr/cas9系统的sgrna表达载体,sgrna作用位点位于牛乳腺上皮细胞nlrp3炎性体接头蛋白asc基因第一号外显子上,sgrna作用位点的碱基序列为5′-cgatgccatcctggatgcgc-3′。asc基因cas9结合区域示意图见图5。
用于构建所述打靶载体的出发载体为pcrispr-sg5质粒(图6),由中国农业大学生命学院吴森老师馈赠,pcrispr-sg5质粒可参见文献xuc,qix,dux,etal.piggybacmediatesefficientinvivocrisprlibraryscreeningfortumorigenesisinmice[j].proceedingsofthenationalacademyofsciences,2017,114(4):722-727.
所述打靶载体可以按以下方法构建得到:根据sgrna作用位点的碱基序列,设计并合成编码所述sgrna的oligo片段,并人工合成其互补序列,将两条互补序列形成的双链dna插入载体sg5的bbsi酶切位点上,即得。
其中,所述双链dna的序列如下:
f5’-caccgcgatgccatcctggatgcgc-3’
r5’-aaacgcgcatccaggatggcatcgc-3’
本发明还提供所述打靶载体在制备nlrp3炎性体接头蛋白asc基因敲除的牛乳腺上皮细胞中的应用。
本发明还提供一种基于crispr/cas9技术敲除牛乳腺上皮细胞nlrp3炎性体接头蛋白asc基因的方法,其是根据牛乳腺上皮细胞nlrp3炎性体接头蛋白asc基因序列,构建基于crispr/cas9系统的sgrna表达载体,以此作为asc基因打靶载体,同时与质粒pcrispr-w9和pcag-pbase共同转入牛乳腺上皮细胞中,获得asc基因敲除的牛乳腺上皮细胞。质粒pcrispr-w9和pcag-pbase的结构分别如图7和图8所示,由中国农业大学生命学院吴森老师馈赠,质粒pcrispr-w9和pcag-pbase可参见文献xuc,qix,dux,etal.piggybacmediatesefficientinvivocrisprlibraryscreeningfortumorigenesisinmice[j].proceedingsofthenationalacademyofsciences,2017,114(4):722-727.
其中,sgrna作用位点位于牛乳腺上皮细胞nlrp3炎性体接头蛋白asc基因第一外显子上,sgrna作用位点的dna序列为5′-cgatgccatcctggatgcgc-3′。所述打靶载体的出发载体为pcrispr-sg5质粒。将打靶载体与质粒pcrispr-w9和pcag-pbase共同电转化至牛乳腺上皮细胞中。
优选地,用lonza电转仪t020程序进行电转。转化后的牛乳腺上皮细胞采用含有表皮生长因子10μg/ml,胰岛素5μg/ml和10%胎牛血清的dmemf12培养基进行培养及传代。
本发明还提供一种nlrp3炎性体接头蛋白asc基因敲除的牛乳腺上皮细胞系,用本发明的打靶载体,同时与质粒pcrispr-w9和pcag-pbase共同转化牛乳腺上皮细胞,获得的中靶阳性细胞克隆,即为nlrp3炎性体接头蛋白asc基因敲除的牛乳腺上皮细胞系。
用于鉴定中靶阳性细胞克隆的特异性pcr引物包括:
引物f5’-ccaggttcctgatttggctagcta-3’
引物r5’-gaagtctcggtccggaggccaagg-3’
本发明还提供所述细胞系在奶牛乳腺炎病理机制研究中的应用。
本发明进一步提供所述细胞系在奶牛乳腺炎的诊断试剂和药物筛选中的应用。
与现有技术相比,本发明具有以下优点:
(一)利用crispr/cas9系统首次从牛乳腺上皮细胞中敲除nlrp3炎性体接头蛋白asc基因,简便、快速,可作为理想的用于研究奶牛乳腺炎性损伤以及奶牛乳腺炎的细胞模型。
(二)基于crispr/cas9系统敲除asc基因的方法,与沉默、干扰、敲低等手段相比,能够更有效地敲除asc基因,有利于研究asc蛋白的功能。
(三)通过建立能够稳定敲除nlrp3炎性体接头蛋白asc的奶牛乳腺上皮细胞,给对奶牛乳腺疾病及模型建立提供更多的研究基础,为临床深入研究提供有效手段;asc基因稳定缺失的奶牛乳腺上皮细胞可以为奶牛乳腺炎性损伤及奶牛乳腺炎的防治机制及临床研究提供技术平台和理论支持。
附图说明
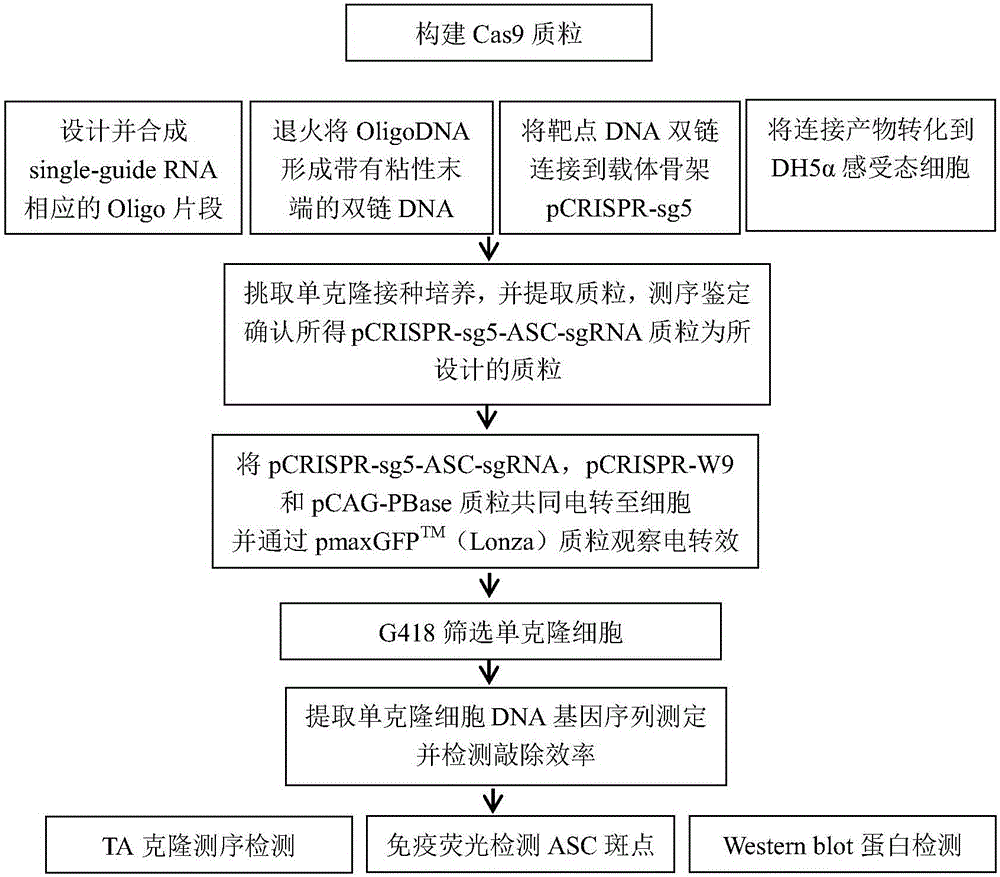
图1为本发明实施例1中基于crispr/cas9技术敲除牛乳腺上皮细胞nlrp3炎性体接头蛋白asc基因的技术路线图。
图2为本发明实施例1中细胞在不同电转条件电转后显微镜下观察的结果;其中,a、c和e分别为i013,y001和t020电转程序白光观察电转后细胞形态,b、d和f分别为i013,y001和t020电转程序荧光观察电转成功的细胞,呈绿色荧光。
图3为本发明实施例1中中靶单克隆细胞基因组dna片段测序结果。
图4为本发明实施例1中中靶细胞的westernblot检测结果。
图5为本发明实施例1中asc基因cas9结合区域示意图。
图6为本发明中使用的pcrispr-sg5质粒图谱。
图7为本发明中使用的pcrispr-w9质粒结构。
图8为本发明中使用的pcag-pbase质粒结构。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如sambrook等分子克隆实验手册(sambrookj&russelldw,molecularcloning:alaboratorymanual,2001),或按照制造厂商说明书建议的条件。
实施例1基于crispr/cas9技术敲除牛乳腺上皮细胞nlrp3炎性体接头蛋白asc基因的方法
通过crispr/cas9系统敲除奶牛乳腺上皮细胞接头蛋白asc,从而构建能稳定缺失asc基因的奶牛乳腺上皮细胞株。测定转化效率并通过基因测序及westernblot等分子生物学手段进一步检测,即检测并确定敲除细胞的稳定性。技术路线如图1所示。
1、使用的sgrna载体为pcrispr-sg5质粒,设计作用靶位点,并合成sgrna相应的oligo片段。
针对asc基因正链靶位点的位置(图5)及相应的oligo序列:
f5’-caccgcgatgccatcctggatgcgc-3’
r5’-aaacgcgcatccaggatggcatcgc-3’
2、人工合成双链dna。
将合成的oligo片段稀释到10μm。按以下反应体系和反应条件进行退火,得到双链dna。
退火体系:
退火条件:
3、将退火产物与pcrispr-sg5骨架载体按以下体系混合进行连接,构建打靶载体。
其中,pcrispr-sg5骨架含有bbsi酶切位点,可与目的序列进行末端连接。
奶牛乳腺上皮细胞电转效率差,本发明通过lonza电转仪筛选最适电转条件,最终选择t020条件进行电转,确定pcrispr-sg5质粒电转进入乳腺上皮细胞的效率最高,且能够稳定遗传表达。
4、将连接产物进行转化:转化至感受dh5α态细胞中,37℃过夜扩增培养,得到含有完整pcrispr-sg5-asc-sgrna质粒的转化子。提取质粒经测序正确,确认得到的pcrispr-sg5-asc-sgrna质粒为所设计的质粒。
将奶牛乳腺上皮细胞(1×106)与1.5μgpcrispr-w9(图7),1.5μgpcrispr-sg5-asc-sgrna以及1μgpcag-pbase(图8)质粒共同电转。
5、奶牛乳腺上皮细胞的培养及纯化:通过在dmemf12基础培养基中添加表皮生长因子10μg/ml,胰岛素5μg/ml及10%胎牛血清,培养并传代奶牛乳腺上皮细胞。
奶牛乳腺上皮细胞生长周期较长,在细胞转化过程中不容易获得单克隆细胞系,本发明通过筛选不同组合的促进细胞生长的化合物组合,最终通过添加表皮生长因子、胰岛素及胎牛血清,促进细胞快速生长,缩短了乳腺上皮细胞的生长周期(使生长周期缩短了1/2左右),加速了细胞生长。
6、用lonza电转仪t020程序进行电转。电转前一天将细胞接种至六孔板内,细胞接种数量为6×105个细胞,电转时要求细胞汇合度为80-90%。电转效率通过pmaxgfptm(lonza)质粒进行绿色荧光观察。
7、电转4小时后细胞换成含有抗生素的完全培养基进行培养。培养48h后分散为细胞悬液,分入细胞碟中分离单克隆细胞同时进行g418药筛。
与肠上皮细胞等细胞系相比,奶牛乳腺上皮细胞脆弱,对外界刺激敏感,对g418筛选、电转等耐受差,转化过程容易大量死亡,本发明精确筛选乳腺上皮细胞对g418的最小耐受浓度350μg/ml,筛选电转条件等,最大程度地避免细胞死亡,保证能够筛选到单克隆细胞。
8、用克隆环挑取单克隆细胞接种培养,并提取质粒,测序鉴定。
9、crispr/cas9敲除asc基因有效性的检测
针对cas9特异敲除位点上下游设计引物其序列为:
引物f5’-ccaggttcctgatttggctagcta-3’
引物r5’-gaagtctcggtccggaggccaagg-3’
收集转化48h的奶牛乳腺上皮细胞,提取细胞基因组dna,使用引物f和r进行pcr,其扩增条件为94℃5min,94℃30s,56℃30s,72℃45s(30-35个循环),72℃5min。1%琼脂糖凝胶电泳后经凝胶成像系统检测,pcr扩增cas9作用靶点片段约为630bp,经琼脂糖凝胶dna回收试剂盒回收目的片段连接t载体,转化感受态细胞dh5α,12h后测定靶序列以统计pcr产物片段中的突变比例和突变类型。通过免疫荧光检测asc蛋白斑点以及应用westernblot进行检测目的蛋白的表达。
10、结果:
①用lonza电转仪i013,y001和t020电转程序进行电转细胞,细胞电转结果观察如图2所示,电转成功的细胞发出绿色荧光,筛选出最佳电转条件为t020。
②测序检测cas9表达载体对asc基因的敲除的有效性:碱基序列对比图可见在靶位点后缺失8个碱基,峰值图观察可见在靶位点后出现套峰,说明cas9在此过程中对靶基因产生切割作用,说明在靶向敲除区域存在着敲除后的移码突变。中靶单克隆细胞基因组dna片段测序结果见图3。
③westernblot检测cas9敲除后的asc蛋白表达情况,结果如图4所示,可见,asc基因敲除细胞中目的条带位置无蛋白表达,可证明本发明敲除细胞模型成功构建。
④细胞经传代及冻存后敲除效果均稳定,可以为奶牛乳房炎的病理机制研究提供模型。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
序列表
<110>中国农业大学
<120>敲除乳腺上皮细胞nlrp3炎性体接头蛋白asc基因的方法
<130>khp171116723.9
<160>5
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
cgatgccatcctggatgcgc20
<210>2
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>2
caccgcgatgccatcctggatgcgc25
<210>3
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>3
aaacgcgcatccaggatggcatcgc25
<210>4
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>4
ccaggttcctgatttggctagcta24
<210>5
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>5
gaagtctcggtccggaggccaagg24
- 还没有人留言评论。精彩留言会获得点赞!