甾体皂苷类化合物及其制备方法与应用与流程
本发明属于生物医药、保健品或食品添加剂的制备
技术领域:
,尤其涉及一种玉竹甾体皂苷类化合物及其制备方法与应用。
背景技术:
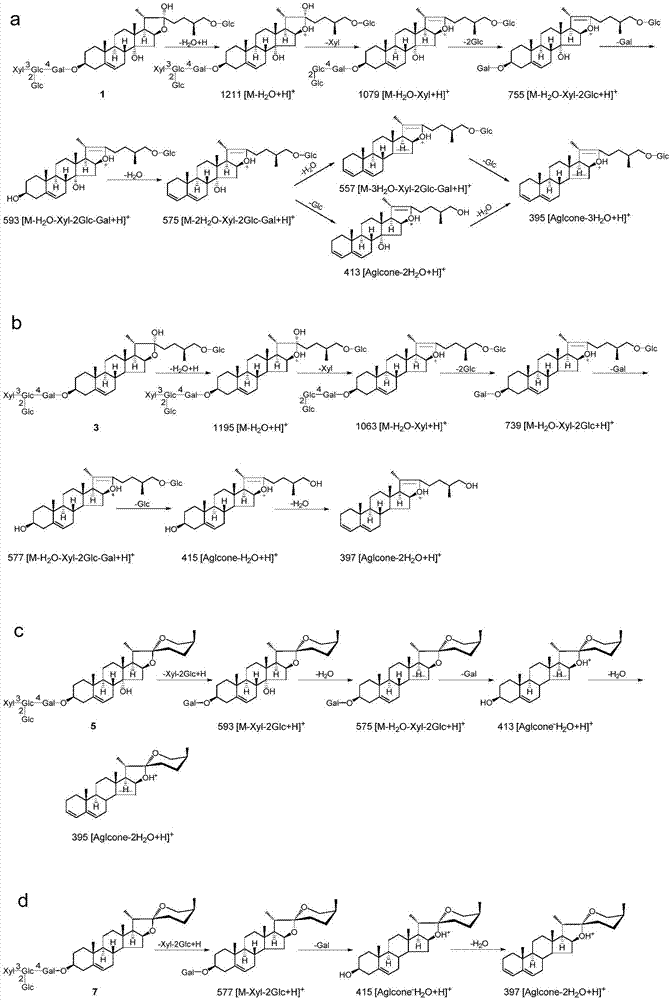
:现代医学认为糖尿病是一种由于体内胰岛素分泌相对或绝对不足而引起的糖代谢紊乱为主要特征的内分泌代谢性疾病。其特征表现为高血糖和糖尿,同时包括脂肪、蛋白质、水电解质的紊乱,常导致严重并发症,如肾病病变、眼及神经病变、冠心病、脑血管病变等。据统计,2013年全世界约有3.86亿糖尿病患者,我国约有1.13亿糖尿病患者,还有更多的人处于糖尿病前期。因此,糖尿病防治已经成为全球医学界研究的热点。目前临床上治疗糖尿病的主要药物为西药,虽然疗效肯定,但是由于化学药物的毒副作用和高昂的医疗费用,且无法从根本上驱除病因及防止并发症的发生。因此,研究开发既能调控血糖又能防治并发症发生的低毒副作用的药物,成为目前糖尿病药物开发的重要方向和热点。糖尿病属中医学消渴范畴,传统观念认为阴虚燥热为其基本病机。玉竹(polygonatumodoratum)是百合科黄精属多年生草本植物玉竹的干燥根茎,是我国常见的药食两用药材,具有养阴润燥、生津止渴之功效,在我国用于治疗糖尿病已有悠久的历史。王世伟研究发现中、高剂量玉竹多糖可以显著降低stz诱导的2型糖尿病大鼠的空腹血糖(fbg)、甘油三酯(tg)、总胆固醇(tc)、低密度脂蛋白胆固醇(ldl-c)水平(王世伟,徐宁,玉竹多糖对糖尿病大鼠降糖作用及机制研究,辽宁中医杂志,2017,44(8),1739-1741。)。目前虽有玉竹多糖的降糖研究报道,但对于所述甾体皂苷类化合物用于治疗与改善糖尿病或肝癌的研究、所述甾体皂苷类化合物的含量测定方法及以它们为评价指标的甾体皂苷的含量测定方法均没有报道。技术实现要素:本发明的目的在于针对现有技术的不足,提供一种甾体皂苷类化合物及其制备方法与应用。本发明的目的是通过以下技术方案来实现的:一种甾体皂苷类化合物,它具有下述结构式(1)—结构式(8)中任一结构式:其中,结构式(1)—结构式(4)具有以下结构式(a):且结构式(1)中,r1为结构式(d),r2为oh;结构式(2)中,r1为h,r2为oh;结构式(3)中,r1为结构式(d),r2为h;结构式(4)中,r1为h,r2为h;结构式(5)—结构式(7)具有以下结构式(b):且结构式(5)中,r1为结构式(d),r2为oh;结构式(6)中,r1为结构式(e),r2为oh;结构式(7)中,r1为结构式(d),r2为h;结构式(8)具有以下结构式(c):。本发明还提供一种上述甾体皂苷类化合物的制备方法,该方法具体为:玉竹在-40℃~60℃的温度下干燥、粉碎后,采用体积浓度为50~70%的乙醇的水溶液为混合溶媒,按玉竹与混合溶媒的质量体积比为1:2~20(g/ml)混合,进行超声提取、15℃~60℃低温搅拌提取或回流提取;提取液经超滤膜、纳滤膜设备进行过滤、浓缩:膜浓缩设备中膜的截留分子量为100~5000,浓缩至提取液体积的1/10~1/2;浓缩液用大孔树脂柱吸附,依次用水,体积浓度为10~40%的乙醇的水溶液洗脱除杂,再用体积浓度为50~90%的乙醇的水溶液洗脱,收集合并洗脱液;洗脱液采用浓缩设备回收乙醇,经冷冻干燥或喷雾干燥得甾体皂苷提取物。甾体皂苷提取物使用配备osd柱的中低压液相色谱进行分离,采用体积浓度为10%~100%的甲醇的水溶液进行梯度洗脱:体积浓度为10%的甲醇的水溶液的洗脱部分为亚组分fr.1,体积浓度为20%的甲醇的水溶液的洗脱部分为亚组分fr.2,体积浓度为30%的甲醇的水溶液的洗脱部分为亚组分fr.3,以此类推,体积浓度为100%的甲醇的洗脱部分为亚组分fr.10,共得到10个亚组分(fr.1~fr.10)。10个亚组分分别采用配备了示差折光检测器、紫外检测器和/或蒸发光散射检测器的制备型反相高效液相色谱仪进一步分离。采用体积浓度为40%的甲醇的水溶液进行洗脱得到亚组分fr.4,采用体积浓度为50%的甲醇的水溶液进行洗脱得到亚组分fr.5,采用体积浓度为70%的甲醇的水溶液进行洗脱得到亚组分fr.7,经第一制备型反相高效液相色谱纯化得到结构式(1)、结构式(2)、结构式(3)、结构式(5)、结构式(6)、结构式(8)所示的甾体皂苷类化合物,所述第一制备型反相高效液相色谱的流动相为dioxane-h2o(30:70~70:30,v/v);采用体积浓度为80%的甲醇的水溶液进行洗脱得到亚组分fr.8,经第二制备型反相高效液相色谱纯化得到结构式(4)和结构式(7)所示的甾体皂苷类化合物,所述第二制备型反相高效液相色谱的流动相为mecn-h2o(30:70~60:40,v/v)。进一步地,所述大孔树脂柱选用ab-8、d101、d201、d301、hdp100、hdp400、xda-1、xda-5、xda-6、xda-8、lsa-20、lsa-30、lsa-40、hp-10、hp-20、hp-30、hp-40或hp-50。本发明还提供了一种上述甾体皂苷类化合物的含量测定方法,该方法采用lc-ms法:该含量测定方法如下:色谱条件:色谱柱采用c18柱;以体积浓度为0.1~0.2%的甲酸的水溶液或体积浓度为1%~3%的乙酸的水溶液为流动相a,乙腈为流动相b,进行梯度洗脱,洗脱梯度为:0~40分钟,10%→100%b,40~50分钟,100%b;流速为0.1~1ml/min,柱温10~45℃。质谱条件:采用电喷雾离子源(esi);esi参数设置如下:接口电压:+1~+5kv(正离子模式),-1~-5kv(负离子模式);干燥气流速:1~15l/min;干燥气温度:100~500℃,雾化器温度:100~500℃,正负离子模式同时检测,采集数据范围是m/z100~1600da。本发明还提供了一种上述甾体皂苷类化合物在制备治疗、改善和/或预防糖或脂的代谢综合症、代谢病或代谢紊乱的药物、食品功能添加剂和/或保健食品的应用。进一步地,所述应用具体为在制备治疗改善和/或预防糖尿病、糖尿病肾病、高脂血症、高胆固醇血症、高甘油三酯血症的药物、食品功能添加剂和/或保健食品的应用。本发明还提供了一种上述甾体皂苷类化合物在制备治疗、改善和/或预防肿瘤的药物、食品功能添加剂和/或保健食品的应用。进一步地,所述肿瘤为肝癌。进一步地,所述剂型选自片剂、胶囊剂、颗粒剂、口服液、滴丸、微丸、注射剂、粉剂、茶剂、冲剂、酒剂、滴剂、膏剂、糖浆、饮料、饼干类、糖果类或糕点类。本发明的有益效果是,实验证明,应用本发明的方法提取纯化的玉竹甾体皂苷类化合物能够治疗、改善和/或预防糖和/或脂的代谢综合症、代谢病或代谢紊乱,能够用于制备治疗这些疾病的药物、食品功能添加剂和/或保健食品。且本发明的提取方法操作简单,便于工业化推广。附图说明图1为结构式(1)—结构式(8)中所述甾体皂苷类化合物在正离子模式下的质谱图(msn),其中,(a)为结构式(1)化合物的(+)esi-ms质谱图;(b)为结构式(2)化合物的(+)esi-ms质谱图;(c)为结构式(3)化合物的(+)esi-ms质谱图;(d)为结构式(4)化合物的(+)esi-ms质谱图;(e)为结构式(5)化合物的(+)esi-ms质谱图;(f)为结构式(6)化合物的(+)esi-ms质谱图;(g)为结构式(7)化合物的(+)esi-ms质谱图;(h)为结构式(8)化合物的(+)esi-ms质谱图;图2为结构式(1)、(3)、(5)和(7)化合物的裂解途径图,其中,(a)为结构式(1)化合物的裂解途径图;(b)为结构式(3)化合物的裂解途径图;(c)为结构式(5)化合物的裂解途径图;(d)为结构式(7)化合物的裂解途径图;图3为玉竹甾体皂苷类化合物的总离子流色谱图,其中,(a)为(+)esi-ms的监测色谱图;(b)为(-)esi-ms的监测色谱图,(c-g)分别为m/z575,m/z395,m/z577、m/z415和m/z399的选择离子监测色谱图;图4为不同的采摘时间的玉竹甾体皂苷含量图。具体实施方式本发明提供了一种甾体皂苷类化合物,它具有下述结构式(1)—结构式(8)中任一结构式:其中,结构式(1)—结构式(4)具有以下结构式(a):且结构式(1)中,r1为结构式(d),r2为oh;结构式(2)中,r1为h,r2为oh;结构式(3)中,r1为结构式(d),r2为h;结构式(4)中,r1为h,r2为h;结构式(5)—结构式(7)具有以下结构式(b):且结构式(5)中,r1为结构式(d),r2为oh;结构式(6)中,r1为结构式(e),r2为oh;结构式(7)中,r1为结构式(d),r2为h;结构式(8)具有以下结构式(c):所述化合物的制备方法如下:玉竹在-40℃~60℃的温度下干燥、粉碎后,采用体积浓度为50~70%的乙醇的水溶液为混合溶媒,按玉竹与混合溶媒的质量体积比为1:2~20(g/ml)混合,进行超声提取、15℃~60℃低温搅拌提取或回流提取;提取液经超滤膜和纳滤膜设备进行过滤、浓缩:膜浓缩设备中膜的截留分子量为100~5000,浓缩至提取液体积的1/10~1/2;浓缩液用大孔树脂柱吸附:大孔树脂柱选用:ab-8、d101、d201、d301、hdp100、hdp400、xda-1、xda-5、xda-6、xda-8、lsa-20、lsa-30、lsa-40、hp-10、hp-20、hp-30、hp-40或hp-50,依次用水,体积浓度为10~40%的乙醇的水溶液洗脱除杂,再用体积浓度为50~90%的乙醇的水溶液洗脱,收集合并洗脱液;洗脱液采用浓缩设备回收乙醇,经冷冻干燥或喷雾干燥得甾体皂苷提取物。甾体皂苷提取物使用配备osd柱的中低压液相色谱进行分离,采用体积浓度为10%~100%的甲醇的水溶液进行梯度洗脱:体积浓度为10%的甲醇的水溶液的洗脱部分为亚组分fr.1,体积浓度为20%的甲醇的水溶液的洗脱部分为亚组分fr.2,体积浓度为30%的甲醇的水溶液的洗脱部分为亚组分fr.3,以此类推,体积浓度为100%的甲醇的洗脱部分为亚组分fr.10,共得到10个亚组分(fr.1~fr.10)。10个亚组分分别采用配备了示差折光检测器、紫外检测器和/或蒸发光散射检测器的制备型反相高效液相色谱仪进一步分离。采用体积浓度为40%的甲醇的水溶液进行洗脱得到亚组分fr.4,采用体积浓度为50%的甲醇的水溶液进行洗脱得到亚组分fr.5,采用体积浓度为70%的甲醇的水溶液进行洗脱得到亚组分fr.7,经第一制备型反相高效液相色谱纯化得到结构式(1)、结构式(2)、结构式(3)、结构式(5)、结构式(6)、结构式(8)所示的甾体皂苷类化合物,所述第一制备型反相高效液相色谱的流动相为dioxane-h2o(30:70~70:30,v/v);采用体积浓度为80%的甲醇的水溶液进行洗脱得到亚组分fr.8经第二制备型反相高效液相色谱纯化得到结构式(4)和结构式(7)所示的甾体皂苷类化合物,所述第二制备型反相高效液相色谱的流动相为mecn-h2o(30:70~60:40,v/v)。本发明公开了所述甾体皂苷类化合物的含量测定方法,该方法采用lc-ms法:其特征在于,该含量测定方法如下:色谱条件:色谱柱采用c18柱;以体积浓度为0.1~0.2%的甲酸的水溶液或体积浓度为1%~3%的乙酸的水溶液为流动相a,乙腈为流动相b,进行梯度洗脱,洗脱梯度为:0~40分钟,10%→100%b,40~50分钟,100%b;流速为0.1~1ml/min,柱温10~45℃。质谱条件:采用电喷雾离子源(esi);esi参数设置如下:接口电压:+1~+5kv(正离子模式),-1~-5kv(负离子模式);干燥气流速:1~15l/min;干燥气温度:100~500℃,雾化器温度:100~500℃,正负离子模式同时检测,采集数据范围是m/z100~1600da。供试品溶液的制备:分别准确称量1g玉竹粉末、甾体皂苷提取物1g置于50毫升的离心管中,用20ml70%乙醇超声提取1小时,在12000rpm的速度下离心10min,上清液通过0.22μm一次性针头过滤器,2μl体积进样进行lc-ms分析。混合对照品溶液的制备:取所述化合物依次精密称定,加甲醇溶剂制成化合物1~8的质量浓度分别为500、50、200、5、200、50、1000、50μg/ml的混合对照品溶液。本发明所述甾体皂苷类化合物在制备治疗、改善和/或预防糖或脂的代谢综合症、代谢病或代谢紊乱的药物、食品功能添加剂和/或保健食品的应用。所述的应用,其特征在于,所述应用具体为在制备治疗改善和/或预防糖尿病、糖尿病肾病、高脂血症、高胆固醇血症、高甘油三酯血症的药物、食品功能添加剂和/或保健食品的应用。本发明所述甾体皂苷类化合物在制备治疗、改善和/或预防肿瘤的药物、食品功能添加剂和/或保健食品的应用,所述的应用,其特征在于,所述肿瘤为肝癌。本发明所述甾体皂苷类化合物所述应用剂型选自片剂、胶囊剂、颗粒剂、口服液、滴丸、微丸、注射剂、粉剂、茶剂、冲剂、酒剂、滴剂、膏剂、糖浆、饮料、饼干类、糖果类或糕点类。本发明所述甾体皂苷类化合物以及常规药物载体、赋形剂或辅剂的药物组合物、保健食品或功能食品添加剂组合物。通常所述的甾体皂苷类化合物或甾体皂苷提取物占组合物总重量的0.1~95%。所述化合物或甾体皂苷提取物一般含量为0.1~100mg。上述药物组合物可根据本领域公知的方法制备。用于此目的时,如果需要,可将本发明所述的甾体皂苷类化合物与一种或多种固体或液体药物赋形剂和/或辅剂结合,制成可作为人药或兽药使用的适当的施用形式或剂量形式。上述的保健食品或功能食品添加剂组合物可根据本领域公知的方法制备。用于此目的时,如果需要,可将本发明所述的甾体皂苷类化合物与一种或多种固体或液体药物赋形剂和/或辅剂结合,制成可作为人的保健食品或功能食品添加剂使用的适当的施用形式或剂量形式。本发明所述的甾体皂苷类化合物、甾体皂苷提取物或其组合物可以单位剂量形式给药,给药途径可为肠道或非肠道,如口服、肌肉、皮下、鼻腔、口腔粘膜、眼、肺、皮肤、阴道、腹膜、直肠等,优选口服给药。本发明所述的甾体皂苷类化合物、甾体皂苷提取物或组合物的给药途径可为注射给药。注射包括静脉注射、肌肉注射、皮下注射、皮内注射、腹腔注射和穴位注射等。给药剂型可以是液体剂型、固体剂型或半固体剂型。液体剂型可以是溶液剂(包括真溶液和胶体溶液)、乳剂(包括水包油型、油包水型和复乳)、混悬剂、注射剂(包括水针剂、粉针剂和输液)、滴眼剂、滴鼻剂、洗剂和搽剂等。固体剂型可以是片剂(包括普通片、肠溶片、含片、分散片、咀嚼片、泡腾片、口腔崩解片)、胶囊剂(包括硬胶囊、软胶囊、肠溶胶囊)、颗粒剂、散剂、微丸、滴丸、栓剂、膜剂、贴片、气(粉)雾剂、喷雾剂等;半固体剂型可以是软膏剂、凝胶剂、糊剂等。本发明所述的甾体皂苷类化合物或甾体皂苷提取物可以制成普通制剂、也可以是缓释制剂、控释制剂、靶向制剂及各种微粒给药系统。为了将单位给药剂型制成片剂,可以广泛使用本领域公知的各种赋形剂,包括稀释剂、黏合剂、润湿剂、崩解剂、润滑剂、助流剂。稀释剂可以是淀粉、糊精、蔗糖、葡萄糖、乳糖、甘露醇、山梨醇、木糖醇、微晶纤维素、硫酸钙、磷酸氢钙、碳酸钙等;湿润剂可以是水、乙醇、异丙醇等;粘合剂可以是淀粉浆、糊精、糖浆、蜂蜜、葡萄糖溶液、微晶纤维素、阿拉伯胶浆、明胶浆、羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、乙基纤维素、丙烯酸树脂、卡波姆、聚乙烯毗咯烷酮、聚乙二丙醇等;崩解剂可以是干淀粉、微晶纤维素、低取代羟丙基纤维素、交联聚乙烯毗咯烷酮、交联羧甲基纤维素钠、羧甲基淀粉钠、碳酸氢钠与构椽酸、碳酸钙、聚氧乙烯山梨糖醇脂肪酸酯、十二烷基磺酸钠;润滑剂和助流剂可以是滑石粉、二氧化硅、硬脂酸盐、酒石酸、液体石蜡、聚乙二醇等。还可以将片剂进一步制成包衣片,例如糖包衣片、薄膜包衣片、肠溶包衣片,或双层片和多层片。为了将给药单元制成丸剂,可以广泛使用本领域公知的各种载体。关于载体的例子是,例如稀释剂与吸收剂,如葡萄糖、乳糖、淀粉、可可脂、氢化植物油、聚乙烯吡咯烷酮、月桂酸聚乙二醇甘油酯、高岭土、滑石粉等;粘合剂,如阿拉伯胶、黄菩胶、明胶、乙醇、蜂蜜、液糖、米糊或面糊等;崩解剂,如琼脂粉、干燥淀粉、海藻酸盐、十二烷基磺酸钠、甲基纤维素、乙基纤维素等。为了将给药单元制成栓剂,可以广泛使用本领域公知的各种载体。关于载体的例子是,例如聚乙二醇、卵磷脂、可可脂、高级醇、高级醇的酯、明胶、半合成甘油酯等。为了将给药单元制成胶囊,将本发明所述的甾体皂苷类化合物或甾体皂苷提取物与上述的各种载体混合,并将由此得到的混合物置于硬的明胶胶囊或软胶囊中。也可将所述的甾体皂苷类化合物制成微囊剂,混悬于水性介质中形成混悬剂,亦可装入硬胶囊中或制成注射剂应用。例如,将本发明所述的甾体皂苷类化合物或甾体皂苷提取物制成注射用制剂,如溶液剂、混悬剂溶液剂、乳剂、冻干粉针剂,这种制剂可以是含水或非水的,可含一种和/或多种药效学上可接受的载体、稀释剂、粘合剂、润滑剂、防腐剂、表面活性剂或分散剂。如稀释剂可选自水、乙醇、聚乙二醇、l,3-丙二醇、乙氧基化的异硬脂醇、多氧化的异硬脂醇、聚氧乙烯山梨醇脂肪酸酯等。另外,为了制备等渗注射液,可以向注射用制剂中添加适量的氯化钠、葡萄糖或甘油,此外,还可以添加常规的助溶剂、缓冲剂、ph调节剂等。这些辅料是本领域常用的。本发明所述的保健食品或功能食品添加剂组合物还可以添加相关领域公开的载体、赋形剂或辅剂制成粉剂、茶剂、冲剂、酒剂、滴剂、膏剂、糖浆、饮料、饼干类、糖果类或糕点类。此外,如需要,也可以向药物制剂或保健食品制剂中添加着色剂、防腐剂、香料、矫味剂、甜味剂或其它材料。为达到用药目的,增强治疗效果,本发明所述的甾体皂苷类化合物、甾体皂苷提取物或其组合物可用任何公知的给药方法给药。本发明的组合物的给药剂量取决于许多因素,例如所要预防或治疗疾病的性质和严重程度,患者或动物的性别、年龄、体重、性格及个体反应,给药途径、给药次数、治疗目的,因此本发明的治疗剂量可以有大范围的变化。一般来讲,本发明中药学成分的使用剂量是本领域技术人员公知的。可以根据本发明药物组合物中最后的制剂中所含有的实际药物数量,加以适当的调整,以达到其治疗有效量的要求,完成本发明的预防或治疗目的。本发明所述的甾体皂苷类化合物或甾体皂苷提取物的每天的合适剂量范围:本发明所述的甾体皂苷类化合物或甾体皂苷提取物的用量为0.001~100mg/kg体重,上述剂量可以单一剂量形式或分成几个,例如二、三或四个剂量形式给药,这取决于给药医生的临床经验以及包括运用其它治疗手段的给药方案。每一种治疗所需总剂量可分成多次按一次剂量给药。本发明所述的甾体皂苷类化合物、甾体皂苷提取物或其组合物可单独服用,或与其他治疗药物或对症药物合并使用并调整剂量。下面用本发明的实施例来进一步说明本发明的实质性内容,但并不以此来限定本发明。根据本发明的实质对本发明进行的简单改进都属于本发明的范围。实施例1结构式(1)—结构式(8)化合物的纯化制备玉竹在30℃的温度下干燥、粉碎后,称重150kg,采用体积浓度为70%的乙醇的水溶液为混合溶媒,30℃下低温搅拌提取(3次×1000l×2h),提取液经膜浓缩设备进行浓缩:先通过截留分子量为3000的膜系统中超滤,通过液再通过截留分子量为500的膜系统中纳滤,得到浓缩液200l;浓缩液用大孔树脂柱hp-20吸附,依次用水,30%的乙醇的水溶液洗脱除杂后,70%的乙醇的水溶液洗脱,收集合并洗脱液;洗脱液采用浓缩设备回收乙醇,经喷雾干燥得甾体皂苷提取物3.48kg。甾体皂苷提取物使用配备osd柱的中低压液相色谱进行分离,采用体积浓度为10%~100%的甲醇的水溶液进行梯度洗脱:体积浓度为10%的甲醇的水溶液的洗脱部分为亚组分fr.1,体积浓度为20%的甲醇的水溶液的洗脱部分为亚组分fr.2,体积浓度为30%的甲醇的水溶液的洗脱部分为亚组分fr.3,以此类推,体积浓度为100%的甲醇的洗脱部分为亚组分fr.10,共得到10个亚组分(fr.1~fr.10)。10个亚组分分别采用配备了示差折光检测器、紫外检测器和/或蒸发光散射检测器的制备型反相高效液相色谱仪进一步分离。采用体积浓度为40%的甲醇的水溶液进行洗脱得到亚组分fr.4,经制备型反相高效液相色谱纯化得到结构式(1)(383g)和结构式(8)(21g)所示的甾体皂苷类化合物,所述制备型反相高效液相色谱的流动相为dioxane-h2o(42:58,v/v);采用体积浓度为50%的甲醇的水溶液进行洗脱得到亚组分fr.5,经制备型反相高效液相色谱纯化得到结构式(2)(13.8g)和和结构式(3)(81g)所示的甾体皂苷类化合物,所述制备型反相高效液相色谱的流动相为dioxane-h2o(44:56,v/v);采用体积浓度为70%的甲醇的水溶液进行洗脱得到亚组分fr.7,经制备型反相高效液相色谱纯化得到结构式(5)(112.5g)和结构式(6)(12g)所示的甾体皂苷类化合物,所述制备型反相高效液相色谱的流动相为dioxane-h2o(57:43,v/v);采用体积浓度为80%的甲醇的水溶液进行洗脱得到亚组分fr.8经制备型反相高效液相色谱纯化得到结构式(4)(1.05g)和结构式(7)(597g)所示的甾体皂苷类化合物,所述制备型反相高效液相色谱的流动相为mecn-h2o(45:55,v/v)。实施例2结构式(1)—结构式(8)化合物的纯化制备玉竹在-20℃的温度下冷冻干燥、粉碎后,称重150kg,采用体积浓度为70%的乙醇的水溶液为混合溶媒,回流提取(3次×1500l×2h),提取液经膜浓缩设备进行浓缩:先通过截留分子量为2500的膜系统中超滤,通过液再通过截留分子量为600的膜系统中纳滤,得到浓缩液180l;浓缩液用大孔树脂柱d101吸附,依次用水,35%的乙醇的水溶液洗脱除杂后,70%的乙醇的水溶液洗脱,收集合并洗脱液;洗脱液采用浓缩设备回收乙醇,经喷雾干燥得甾体皂苷提取物3.98kg。甾体皂苷提取物使用配备osd柱的中低压液相色谱进行分离,采用体积浓度为10%~100%的甲醇的水溶液进行梯度洗脱:体积浓度为10%的甲醇的水溶液的洗脱部分为亚组分fr.1,体积浓度为20%的甲醇的水溶液的洗脱部分为亚组分fr.2,体积浓度为30%的甲醇的水溶液的洗脱部分为亚组分fr.3,以此类推,体积浓度为100%的甲醇的洗脱部分为亚组分fr.10,共得到10个亚组分(fr.1~fr.10)。10个亚组分分别采用配备了示差折光检测器、紫外检测器和/或蒸发光散射检测器的制备型反相高效液相色谱仪进一步分离。采用体积浓度为40%的甲醇的水溶液进行洗脱得到亚组分fr.4,经制备型反相高效液相色谱纯化得到结构式(1)(392g)和结构式(8)(22.5g)所示的甾体皂苷类化合物,所述制备型反相高效液相色谱的流动相为dioxane-h2o(43:57,v/v);采用体积浓度为50%的甲醇的水溶液进行洗脱得到亚组分fr.5,经制备型反相高效液相色谱纯化得到结构式(2)(12.5g)和和结构式(3)(83g)所示的甾体皂苷类化合物,所述制备型反相高效液相色谱的流动相为dioxane-h2o(45:55,v/v);采用体积浓度为70%的甲醇的水溶液进行洗脱得到亚组分fr.7,经制备型反相高效液相色谱纯化得到结构式(5)(114g)和结构式(6)(11.9g)所示的甾体皂苷类化合物,所述制备型反相高效液相色谱的流动相为dioxane-h2o(55:45,v/v);采用体积浓度为80%的甲醇的水溶液进行洗脱得到亚组分fr.8经制备型反相高效液相色谱纯化得到结构式(4)(1.02g)和结构式(7)(620g)所示的甾体皂苷类化合物,所述制备型反相高效液相色谱的流动相为mecn-h2o(43:57,v/v)。实施例3结构式(1)—结构式(8)化合物的结构鉴定结构式(1)化合物:为无定型粉末,[α]2d1-52.0(c0.3,pyridine);ir(kbr)max:3408,2930,1717,1371,1256,1159,1077,1038,870cm-1;1hnmr(pyridine-d5,500mhz)和13cnmr(pyridine-d5,125mhz)见表1;高分辨质谱[hrfabmsm/z1211.5695[m-h2o+h]+,(calcdforc56h91o28,1211.5697)]给出化合物1的分子式为c56h92o29,其化学结构被鉴定为(25s)-26-o-(β-d-glucopyranosyl)-furost-5-ene-3β,14α,22α,26-tetrol3-o-β-d-glucopyranosyl-(1→2)-[β-d-xylopyranosyl-(1→3)]-β-d-glucopyranosyl-(1→4)-β-d-galactopyranoside,命名为polygonatumosidef。结构式(2)化合物:为无定型粉末,[α]2d1-45.4(c0.2,pyridine);ir(kbr)max:3392,2931,1717,1456,1379,1270,1159,1098,1032,908cm-1;1hnmr(pyridine-d5,500mhz)和13cnmr(pyridine-d5,125mhz)见表1;高分辨质谱[hrfabmsm/z593.3690[m-h2o+h]+(calcdforc33h53o9,593.3690)]给出结构式(2)化合物的分子式为c33h54o10,与结构式(1)化合物的氢谱和碳谱比较,发现结构式(2)化合物少了4组糖信号,且c-3信号化学位移在δc71.3ppm,与结构式(1)化合物在δc78.3ppm不同,确定c-3被羟基取代。因此,结构式(2)化合物的结构被鉴定为(25s)-furost-5-ene-3β,14α,22α,26-tetrol26-o-β-d-glucopyranoside,命名为polygonatumosideg。结构式(3)化合物:为无定型粉末,esi-ms确定其分子式为c56h92o28。碳谱给出56个碳信号,其中27个碳信号归属于苷元部分。与结构式(1)化合物的碳谱比较发现,结构式(3)化合物的c-14的化学位移变化较大,且通过质谱分析,结构式(3)化合物比结构式(1)化合物少了一个氧原子。因此,结构式(3)化合物的结构鉴定为(25s)-26-o-(β-d-glucopyranosyl)-furost-5-ene-3β,22α,26-triol3-o-β-d-glucopyranosyl-(1→2)-[β-d-xylopyranosyl-(1→3)]-β-d-glucopyranosyl-(1→4)-β-d-galactopyranoside,命名为timosaponinh1。结构式(4)化合物:为无定型粉末,esi-ms确定其分子式为c33h54o9,碳谱给出33个碳信号,其中27个碳信号归属于苷元部分。与结构式(2)化合物的碳谱比较发现,结构式(4)化合物少了一个氧原子且c-14的化学位移变化较大,综合分析质谱与核磁数据,结构式(4)化合物的结构鉴定为(25s)-furost-5-ene-3β,22α,26-triol26-o-β-d-glucopyranoside,命名为(25s)-funkiosideb。结构式(6)化合物:为无定型粉末,高分辨质谱[hrfabmsm/z939.4578[m+na]+(calcdfor939.4560)]给出化合物2的分子式为c45h72o19。碳谱给出45个碳信号,其中18个碳信号为3组糖信号,其余27个碳信号为苷元碳信号,其中包括一个季碳信号δc110.1,为螺甾烷类螺甾缩酮c-22的特征信号,两个烯碳信号δc140.5,122.3和4个位于高场的信号δc20.1,19.4,15.3和16.4,结合氢谱信号δh1.09(s),0.99(s),1.21(d,j=6.6hz)和1.10(d,j=4.8hz),得出其为螺甾烷类18-ch3、19-ch3、21-ch3和27-ch3的四个甲基信号,确定结构式(6)化合物为螺甾烷类皂苷化合物。通过氢谱分析,确定结构式(6)化合物为25s构型。与结构式(1)化合物相比,结构式(6)化合物少了一组木糖信号,综合分析,结构式(6)化合物的化学结构鉴定为(25s)-(3β,14α)-dihydroxy-spirost-5-en-3-o-β-d-glucopyranosyl-(1→2)-β-d-glucopyranosyl-(1→4)-β-d-galactopyranoside。结构式(5)化合物:为无定型粉末,esi-ms确定其分子式为c50h80o23。碳谱给出50个碳信号,其中23个碳信号为4组糖信号,其余27个碳信号为苷元碳信号。与结构式(6)化合物比较发现,结构式(5)化合物的氢谱和碳谱多了一组木糖信号,与结构式(1)化合物比较,发现结构式(5)化合物的糖种类和连接顺序与结构式(1)化合物相同,因此,化合物5的结构鉴定为(25s)-(3β,14α)-dihydroxy-spirost-5-ene-3-o-β-d-glucopyranosyl-(1→2)-[β-d-xylopyranosyl-(1→3)]-β-d-glucopyranosyl-(1→4)-β-d-galacopyranoside。结构式(7)化合物:为无定型粉末,esi-ms确定其分子式为c50h80o22。碳谱给出50个碳信号,其中23个碳信号为4组糖信号,其余27个碳信号为苷元碳信号。与结构式(5)化合物相比较,结构式(7)化合物的c-14的化学位移变化较大,与结构式(5)化合物的质谱数据与分子量相比较,发现结构式(7)化合物比其缺少一个氧原子。因此,结构式(7)化合物的结构鉴定为(25s)-3-o-β-d-glucopyranosyl-(1→2)-[β-d-xylopyranosyl-(1→3)]-β-d-glucopyranosyl-(1→4)-β-d-galacopyranosyl-yamogenin。结构式(8)化合物:为无定型粉末,esi-ms确定其分子式为c39h66o13。碳谱给出39个碳信号,其中12个碳信号为2组糖信号,分别为为葡萄糖和鼠李糖信号,其余27个碳信号为苷元碳信号。从化合物氢谱和碳谱分析,结构式(8)化合物是胆甾皂苷,且鼠李糖连接在1位,葡萄糖连接在16位。因此,结构式(8)化合物的结构鉴定为(22s)-cholest-5-ene-1β,3β,16β,22-tetrol-1-o-α-l-rhamnopyranosyl-16-o-β-d-glucopyranoside(8)。表1:化合物1和2的核磁共振光谱数据(500mhzfor1hand125mhzfor13c,inpyridine-d5)结构式(1)—结构式(8)化合物的糖的绝对构型的确定结构式(1)—结构式(8)化合物分别称重1mg,分别溶解在1mhcl(dioxane-h2o,1:1,25ml)中,100℃加热2小时,减压旋蒸除去二氧六环溶剂,水溶液分散在乙酸乙酯和水中,水层被减压浓缩干燥得到相应的糖组分。分别将其溶于水(1ml)中,加入溶解在1ml乙醇中的(s)-(-)-1-苯乙胺(3μl)和氰基硼氢化钠(2mg)混合溶液。40℃反应过夜后,加入冰醋酸(0.2ml),减压旋蒸干燥得到反应混合物。固态反应混合物溶解在吡啶(2ml)中,加入乙酸酐(50μl)和4-二甲氨基吡啶(2.0mg),在室温下反应24h,通过添加水反复旋蒸除去吡啶,水溶液经sep-pakc18柱(waters,usa)分离,乙腈-水为洗脱溶剂(1:4and1:1,v/v,每次10ml)。将包含单糖的1-[(s)-n-acetyl-methylbenzylamino]-1-deoxy-alditolacetate衍生物的乙腈-水(1:1,v/v)洗脱部分,采用lc-ms分析:色谱柱为ymctriartc18(3.0μm,150mm×20mm);流动相为ch3cn-h2o(35:65,v/v);流速0.2ml/min;柱温为35℃,检测到d-木糖、d-半乳糖、d-葡萄糖衍生物,其保留时间分别为18.2min、21.4min和26.8min。结构式(1)—结构式(8)化合物的质谱裂解规律分析lc-esi-ms正负离子模式同时监测。由于在正离子模式下有更高的灵敏度和更多的离子碎片信息,结构式(1)—结构式(8)化合物的质谱裂解行为在正离子模式下进行分析和总结。如图1所示,结构式(1)—结构式(8)化合物为呋甾皂苷化合物,其通过在c-22位的羟基发生分裂容易产生[m-h2o+h]+,这与结构式(5)—结构式(7)螺甾皂苷化合物的裂解方式不同。当呋甾皂苷和螺甾皂苷化合物,即结构式(1)、结构式(2)、结构式(5)和结构式(6)化合物在c-14位被羟基取代,主要产生m/z593和/或395的碎片离子峰。另一方面,如果检测到m/z577和/或415的碎片离子,应该是在苷元的c-14位无羟基取代,即结构式(3)、结构式(4)和结构式(7)化合物。此外,结构式(1)、结构式(3)、结构式(5)和结构式(7)化合物被选为合适的有代表性的样品进行了呋甾皂苷和螺甾皂苷的裂解途径分析,见图2。对于胆甾皂苷,即结构式(8)化合物,它容易裂解产生m/z399碎片离子,即[苷元-2h2o+h]+。实施例4结构式(1)—结构式(8)化合物的含量测定及以它们为评价指标的甾体皂苷的含量测定色谱条件:使用配备二元溶剂输送系统和自动采样器的岛津8040系统进行高效液相色谱。色谱柱采用ymc-triartc18(3.0μm,150mm×20mm),柱温35℃;以0.1%甲酸水溶液为流动相a,乙腈为流动相b,进行梯度洗脱,洗脱梯度为:0~40分钟,10%→100%b,40-50分钟,100%b;流速为0.2ml/min;色谱柱在初始条件下平衡20min。质谱条件:质谱分析采用岛津lcms-8040三重四极杆质谱仪(lc/ms/ms)进行。氮气作为干燥、雾化和辅助加热气体,氦气作为碰撞气体。质谱条件为电喷雾离子源(esi);esi参数设置如下:接口电压:+4.5kv(正离子模式),-3.5kv(负离子模式)碰撞电压:15v;干燥器流速:15升/分钟;干燥气温度:350℃,雾化器温度:350℃,正负离子模式同时检测,采集数据范围是m/z100~1600da。lc-ms中正离子和负离子模式的质谱扫描为确证甾体皂苷及其碎片离子的分子量提供了有价值的信息。采用全扫描结合正sim选择性离子扫描(m/z593,395,577,415和399)定性分析玉竹中甾体皂苷,同时,负sim选择性离子扫描被选为结构式(1)—结构式(8)化合物的定量分析,见图3。供试品溶液的制备:分别准确称量1g玉竹粉末、甾体皂苷提取物1g置于50毫升的离心管中,用20ml70%乙醇超声提取1小时,在12000rpm的速度下离心10min,上清液通过0.22μm一次性针头过滤器,2μl体积进样进行lc-ms分析。混合对照品溶液的制备:取所述化合物依次精密称定,加甲醇溶剂制成结构式(1)—结构式(8)化合物的质量浓度分别为500、50、200、5、200、50、1000、50μg/ml的混合对照品溶液。测定结果:以标准曲线法计算含量。得到结构式(1)—结构式(8)化合物的线性回归方程如下:化合物1:y=19735x+26991(r2=0.9979),.化合物2:y=44721x-3278.2(r2=0.9982),化合物3:y=23129x-25567(r2=0.9975),化合物4:y=60790x-2045.1(r2=0.9960),化合物5:y=13131x+29235(r2=0.9991),化合物6:y=27453x-6310.5(r2=0.9993),化合物7:y=24869x+81535(r2=0.9987),化合物8:y=43819x–3542.7(r2=0.9981)。玉竹干药材中结构式(1)—结构式(8)化合物的含量分别为4.24、0.043、0.87、0.005、1.06、0.051、5.80、0.045mg/g干玉竹,测得实施例1中的甾体皂苷的含量为52.4%,实施例2中的甾体皂苷含量为62.5%。玉竹不同采摘时间对结构式(1)—结构式(8)化合物和甾体皂苷含量的影响从2015年4月至2017年6月(2016年1月、2月、10月除外),每月收集玉竹样品。收集后,将玉竹药材冻干、粉粹。按照上述供试品溶液制备方法制备。测得结果为不同的采摘时间的玉竹甾体皂苷含量在6.6-15.2mg/g之间,结构式(1)—结构式(8)化合物的含量见图4。结构式(1)—结构式(8)化合物可以在玉竹药材及其甾体皂苷的品质与功效评价中使用,可以用作含量评价指标,尤其是结构式(1)化合物和结构式(7)化合物为主要成分,2个化合物约占甾体皂苷含量的63-90%,在lc-ms色谱中很容易观察到,因此可以优选这2个化合物作为玉竹药材及其甾体皂苷的品质与含量的评价指标。实施例5结构式(1)—结构式(8)化合物及甾体皂苷对大鼠糖代谢和脂代谢的影响大鼠模型的制备:健康清洁级雄性sd大鼠150只,体质量120~150g,普通饲料适应性喂养1周后,检测血糖及尿蛋白,均为阴性者进入实验。随机选取对照组10只,给予普通饲料喂养。其余140只大鼠为造模组,给予高脂高糖饲料(15%白砂糖,15%猪油,4.5%胆固醇,65.5%基础饲料)喂养4周,禁食不禁水12h后,45mg/kg剂量腹腔注射链脲佐菌素(stz-柠檬酸缓冲溶液(ph4.5),对照组给予注射相应体积的枸橼酸缓冲液。给药48h后,用快速血糖仪检测空腹血糖,要求以三次尾静脉空腹测血糖值均≥16.7mmol/l为造模成功的判定标准。本次实验注射stz48h内没有大鼠死亡,但2只大鼠血糖未达到标准,予以剔除。分组及给药:选取造模成功大鼠148只,随机分别为11组,分别为模型组、治疗组包括所述结构式(1)—结构式(8)化合物的给药组(灌胃,50mg/kg)、甾体皂苷给药组(灌胃,250mg/kg)及阳性对照组(腹腔注射,5mg/kg格列苯脲),模型组及对照组给予同等体积生理盐水,给药期间全部大鼠给予基础饲料连续喂养16周,整个实验不应用胰岛素干预,不定期检测尾静脉血糖,血糖缓解者剔除实验。检测指标和方法空腹血糖(randombloodglucose,rbg):各组大鼠给药第0w、第4w末、第8w末、第12w末、第16w末,尾静脉快速取血测各组大鼠的空腹血糖。糖化血红蛋白(hemoglobina1c,hba1c):采用离子交换层析法检测糖化血红蛋白。计算血清中空腹胰岛素(fastinginsulin,fins):在16w用全自动化学发光免疫分析法测定血浆胰岛素。24h尿蛋白定量(urinaryalbumin,mg/24h):尿总蛋白定量采用邻苯三酚红比色测定法测定。24h尿蛋白定量=尿总蛋白定量×24h尿量。血生化指标检测:尿酸(uricacid,ua)、肌酐(serumcreatinine,scr)、尿素氮(bloodureanitrogen,bun)、总胆固醇(totalcholesterol,tc)、甘油三酯(triglyceride,tg)、高密度脂蛋白(highdensitylipoprotein,hdl)、极低密度脂蛋白(verylowdensitylipoprotein,vldl)用自动生化分析仪检测。结果实验中观察到各组大鼠肾脏肥大情况:模型组肾脏体积严重变大,与模型组相比,各治疗组肾脏体积有不同程度的减小。各组大鼠不同时间点空腹血糖的比较(见表2):与对照组相比,各组空腹血糖均明显升高,而各治疗组较模型组有不同程度的降低。表2:不同时间点各组大鼠空腹血糖(mmol/l)比较group剂量(mg/kg)0w4w8w12w16w对照组4.955.015.095.225.39模型组21.2620.9820.9922.1423.35格列苯脲组56.376.216.065.995.27总甾体皂苷组25016.5515.8414.3213.6813.69结构式(1)化合物508.688.348.008.327.99结构式(2)化合物509.859.9410.029.689.31结构式(3)化合物509.229.339.048.999.15结构式(4)化合物509.559.018.999.689.84结构式(5)化合物508.759.268.839.559.31结构式(6)化合物5010.0211.2512.1411.6811.77结构式(7)化合物508.899.289.859.239.11结构式(8)化合物5014.2013.7213.5312.5813.59各组大鼠hba1c的比较(见表3):与对照组相比,各组hba1c明显升高,与模型组相比,各治疗组hba1c值均有不同程度降低。各组大鼠fins的比较(见表3):与对照组相比,各组fins水平明显降低,与模型组相比,各治疗组fins有不同程度的升高。表3:第16周大鼠糖化血红蛋白和胰岛素水平比较各组大鼠不同时间点24h尿蛋白定量情况的比较(见表4):对照组24h尿蛋白定量最低,并保持稳定,无明显增高或减低。模型组尿蛋白定量在不同时间点逐步增高。与模型组相比,各治疗组在不同时间点检测尿蛋白定量明显减低。表4:不同时间点各组大鼠尿蛋白量(mg/24h)比较各组大鼠16w肾功能的比较(见表5):ua、scr、bun水平比较:与对照组相比,模型组及各治疗组ua、scr、bun均有不同程度增高。与模型组相比,各治疗组ua、scr、bun均有降低。表5:第16周各组大鼠肾功能比较各组大鼠16w血脂的比较(见表6):与对照组相比,模型组及各治疗组tc、tg、vldl水平升高。与模型组相比,各治疗组tc、tg、vldl水平降低。各组hdl相比,无明显统计学差异。表6:第16周各组大鼠血脂指标的比较实施例6结构式(1)—结构式(8)化合物抗人肝癌细胞株hepg2的细胞增殖活性将人肝癌细胞株hepg2细胞接种于96孔培养板(100μl,20×104孔/ml),在37℃孵育6h。然后,加入不同浓度的所述结构式(1)—结构式(8)化合物、甾体皂苷提取物孵育48h。活细胞的数量使用wst-1细胞增殖分析系统读取。表阿霉素作为阳性对照。结果显示:与阳性对照表阿霉素(ic50,1.6μm)相比,结构式(7)化合物能显著抑制hepg2细胞的活性(ic50,3.2μm),而结构式(1)—结构式(7)化合物和甾体皂苷提取物具有一定的抗hepg2的细胞增殖活性(ic50>20μm)。比较了化合物的结构,发现14位无α-羟基取代的δ5,6-螺甾皂苷表现较强的抗细胞增殖活性。所述甾体皂苷类化合物和甾体皂苷提取物抗人肝癌细胞株hepg2的细胞增殖活性为首次发现和报道,可以用于制备治疗、改善和/或预肝癌的药物、食品功能添加剂或保健食品。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1