强心苷类化合物及其制备方法与应用与流程
本发明涉及从欧洲夹竹桃(neriumoleanderlinn.)中分离提取的化合物及其制备方法与应用,尤其是强心苷类化合物及其制备方法与应用。
背景技术:
强心苷是指自然界存在的一类对心脏有显著生理活性的甾体苷类,强心苷具有广泛的药理作用,具有强心,细胞毒性,抗癌,利尿,作用中枢神经等生物活性,主要治疗充血性心力衰竭及节律障碍等心脏疾病。近年来发现强心苷具有抑制na+/k+-atpase抑制作用,使细胞凋亡,并且经发现具有较好的抗癌活性。使得越来越多的研究者强心苷类化合物。强心苷主要分布于玄参科的洋地黄属、夹竹桃科的黄花夹竹桃属和夹竹桃属、杠柳属、马利筋属、铃兰属、万年青属、糖介属、侧金盏花属等,主要存在于植物的果,叶或根中。
欧洲夹竹桃(neriumoleanderlinn.)夹竹桃科夹竹桃属植物,在《中药大辞典》中有关于夹竹桃的药用记载,其叶、皮可入药,味苦、性寒,有毒。强心,镇痛,归心经,为强心类的药物,具有强心、利尿、抗炎、抑菌、镇痛、镇静和抗肿瘤的作用。夹竹桃中主要含有强心苷类、三萜类、孕甾烷类、生物碱类和油脂类化合物。此外,还有酚酸类化合物,黄酮苷类化合物,甾醇类化合物等其他化合物。此外,夹竹桃还具有绿化环保、生物防治和化感等作用。欧洲夹竹桃主要成分之一强心苷类化合物,具有强心、抑菌、镇痛、镇静和抗肿瘤的作用,其他的相关作用及作用机制还有待进一步发现。强心苷类化合物科特异性结合na+/k+-atpase并抑制其功能,使细胞内k+减少na+增加,进而使细胞膜电压门控ca2+通道激活和na+-ca2+交换器启动,导致胞内ca2+持续性升高,使细胞发生凋亡。
技术实现要素:
本发明所要解决的技术问题在于提供强心苷类化合物。
本发明所要解决的另一技术问题在于提供上述强心苷类化合物的制备方法。
本发明所要解决的另一技术问题在于提供上述强心苷类化合物的应用。
为解决上述技术问题,本发明的技术方案是:
一种强心苷类化合物(强心苷类化合物a),为8β-羟基夹竹桃苷元-3-o-β-d-地芰糖苷(8-hydroxy-oleandrigenin-3-o-β-d-diginoside),具有式(ⅰ)所述结构式,
上述强心苷类化合物:白色晶体(氯仿/甲醇),
上述强心苷类化合物的制备方法,具体步骤如下:
(1)夹竹桃鲜叶每20kg,干燥粉碎后在渗漉桶里用450l,95%(v/v)乙醇浸14天,将滤液通过减压蒸馏得到夹竹桃浓缩液5l;
(2)向所得的5l凝缩液中加入等体积的石油醚萃取,重复萃取4次,合并萃取液减压蒸馏得到两个馏分:水层,石油醚层;
(3)应用d101大孔树脂柱对水层部位馏分进行分离,分别用水、30%、60%、95%的乙醇进行梯度洗脱,然后分别进行减压蒸馏得到四个部分;
(4)60%乙醇部分经硅胶柱色谱,二氯甲烷:甲醇=100:0-0:100溶剂系统梯度洗脱,得11个流份fr.1-11;
(5)石油醚:乙酸乙酯=100:0-0:100溶剂洗脱流份-流份fr.1,梯度洗脱,经硅胶柱,且经薄层色谱进行检测,显色,合并相同的部分,得8个流份fr.1(1-8);
(6)二氯甲烷:甲醇=100:0-0:100溶剂洗脱流份-流份fr.1-6,经硅胶柱色谱,分离得到5α-欧夹竹桃苷a(5α-oleasidea);
(7)石油醚:乙酸乙酯=100:0-0:100溶剂洗脱流份-流份fr.2,经硅胶柱色谱,且经薄层色谱进行检测,显色,合并相同的部分,得5个流份fr.2(1-5);
(8)流份fr.2-4经ods柱梯度洗脱,洗脱溶剂甲醇水,所得流份经制备型高效液相色谱甲醇:水=60:40溶剂洗脱,分离得到14β-羟基-5β,14β-强心甾-8,16,20(22)-三烯-3-o-β-d-地芰糖苷(3β-o-(β-d-diginosyl)-14β-hydroxy-5β,14β-card-8,16,20(22)-trienolide);流份fr.2-5经ods柱梯度洗脱,洗脱溶剂甲醇水,所得流份经制备型高效液相色谱甲醇:水=55:45溶剂洗脱,分离得到目标化合物8β-羟基夹竹桃苷元3-o-β-d-地芰糖苷(8-hydroxy-oleandrigenin-3-o-β-d-diginoside);或所得流份经制备型高效液相色谱甲醇:水=65:35溶剂洗脱,分离得到14-羰基奈利苷(14-carbanyl-neriaside)。
上述方法得到的强心苷类化合物,归属于甲型强心苷,强心苷元的甾核的c10,c13都是连有βch3,c17侧链为α,β-不饱和-γ-五元内酯环,且在c3,c14位都有羟基取代,都是β-构型;强心苷元甾体母核四个环的稠合方式是b/c环都是反式,c/d环都是顺式,a/b两种稠合方式都有。a/b环反式稠合,d-地芰糖与苷元c3-oh结合形成苷(b);也有a/b环顺式稠合,d-地芰糖与苷元c3-oh结合形成苷(a,c,d),c16被乙酰氧基取代或c8位羟基化(a),c8,c9之间形成双键,c16,c17之间形成双键(d),8,14-位的碳碳键断裂,形成羰基或羟基(c)。化学结构特点:甲型强心苷母核c17侧链为α,β-不饱和-γ-五元内酯环;8,9-位和16,17-位形成双键;或者c8位羟基化,c16位被乙酰氧基取代;a/b环的稠合的方式为反式或顺式;8,14-位的碳碳键断裂,形成羰基或羟基;与苷元c3-oh结合形成苷的单糖都是β-d-diginose。
上述强心苷类化合物在制备抗肿瘤活性药物方面的应用。
一种抗肿瘤药物组合物,包含治疗有效量的上述强心苷类化合物以及任选的药学可接受的赋形剂。
本发明的有益效果是:
所述强心苷类化合物,是通过从欧洲夹竹桃中分离提取而发现的新的强心苷类化合物,采用冷浸提取、大孔树脂柱色谱、硅胶柱色谱、ods柱色谱、凝胶柱色谱、制备型高效液相等方法成功分离得到,具有抗肿瘤作用,所述化合物可以作为其他化合物的先导物,以及新药开发和药理活性研究的原料,亦可用于制备抗肿瘤的药物。
附图说明
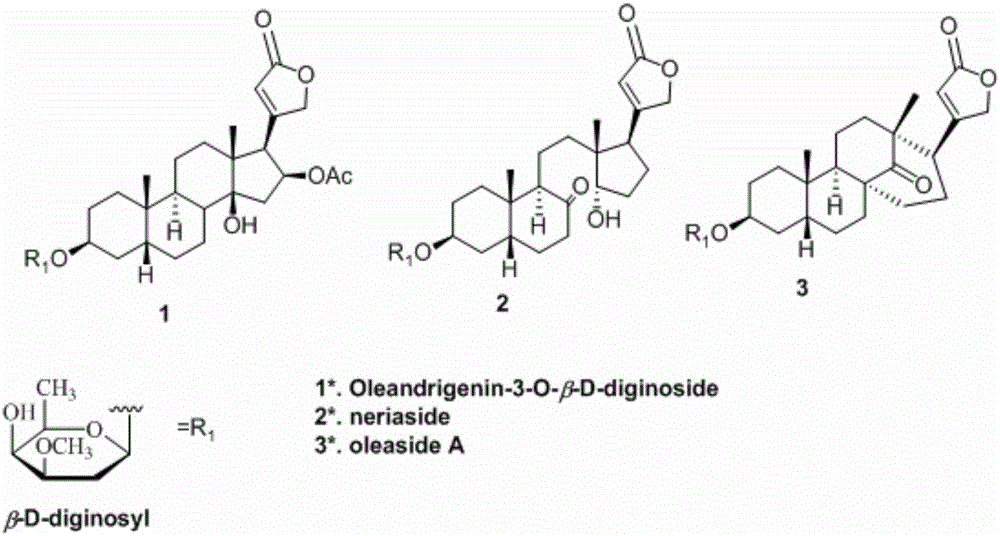
图1是已知化合物1、2、3的化学结构式;
图2是强心苷类化合物中新化合物谱图(1h-nmr、13c-nmr、hmbc、noesy图谱),其中,
a:8-hydroxy-oleandrigenin-3-o-β-d-diginoside;
b:5α-oleasidea;
c:14-carbanyl-neriaside;
d:3β-o-(β-d-diginosyl)-14β-hydroxy-5β,14β-card-8,16,20(22)-trienolide;
具体实施方式
为了使本领域的技术人员更好的理解本发明的技术方案,下面结合具体实施方式对本发明所述技术方案作进一步的详细说明。
实验仪器与试剂:傅里叶变换核磁共振波谱仪(瑞士bruker公司,aviii型600hz);显色剂:10%硫酸乙醇。
实施例1
强心苷类化合物的制备(提取分离流程)
夹竹桃新鲜的叶(20kg)于2014年7月采集于安徽合肥。夹竹桃鲜叶每20kg,干燥粉碎后在渗漉桶里用450l,95%(v/v)乙醇冷浸14天,将滤液通过减压蒸馏得到夹竹桃浓缩液5l;向所得的5l凝缩液中加入等体积的石油醚萃取,重复萃取4次,合并萃取液减压蒸馏得到两个馏分:水层(600g),石油醚层(300g);应用d101大孔树脂柱对水层部位(600g)馏分进行分离,分别用水、30%、60%、95%的乙醇进行梯度洗脱,然后分别进行减压蒸馏得到四个流份部分;60%乙醇洗脱流份(85g)经硅胶柱色谱(拌样硅胶100-200目,柱硅胶200-300目,二氯甲烷:甲醇=100:0(指100%二氯甲烷洗脱情况)-0:100溶剂系统梯度洗脱),得11个流份fr.1-11;石油醚:乙酸乙酯=100:0-0:100溶剂洗脱流份-流份fr.1,梯度洗脱,经硅胶柱,且经薄层色谱进行检测,显色,合并相同的部分,得8个流份fr.1(1-8);二氯甲烷:甲醇=100:0-0:100溶剂洗脱流份-流份fr.1-6,经硅胶柱色谱,分离得到5α-oleasidea;石油醚:乙酸乙酯=100:0-0:100溶剂洗脱流份-流份fr.2,经硅胶柱色谱,且经薄层色谱进行检测,显色,合并相同的部分,得5个流份fr.2(1-5);流份fr.2-4经ods柱梯度洗脱,洗脱溶剂甲醇水,所得流份经制备型高效液相色谱甲醇:水=60:40溶剂洗脱,分离得到3β-o-(β-d-diginosyl)-14β-hydroxy-5β,14β-card-8,16,20(22)-trienolide;流份fr.2-5经ods柱梯度洗脱,洗脱溶剂甲醇水,所得流份经制备型高效液相色谱甲醇:水=55:45溶剂洗脱,分离得到8-hydroxy-oleandrigenin-3-o-β-d-diginoside;或所得流份经制备型高效液相色谱甲醇:水=65:35溶剂洗脱,分离得到14-carbanyl-neriaside。各结构式如下:
其中,
a:8β-羟基夹竹桃苷元3-o-β-d-地芰糖苷(8-hydroxy-oleandrigenin-3-o-β-d-diginoside);
b:5α-欧夹竹桃苷a(5α-oleasidea):
c:14-羰基奈利苷(14-carbanyl-neriaside);
d:14β-羟基-5β,14β-强心甾-8,16,20(22)-三烯-3-o-β-d-地芰糖苷(3β-o-(β-d-diginosyl)-14β-hydroxy-5β,14β-card-8,16,20(22)-trienolide)
a,白色晶体(氯仿/甲醇),
化合物a的nmr谱数据与化合物oleandrigenin-3-o-β-d-diginoside(已知化合物见附图1和表3)比较,主要区别在于c-8位的次甲基碳信号(δ42.4)消失,而在δ77.1显示一个连氧季碳信号,提示苷元8位发生了羟基化。
hsqc,hmbc等信息进一步证实以上推测,化合物的结构如下所示。
noesy谱中,根据roesy图谱上的相关信号:h-5/h-19,h-19/oh-8,oh-14/h-18,h-12α/h-15α,以及19位甲基信号的化学位移为δ24.4,因此确定苷元的骈合方式为cis-a/b,trans-b/c以及cis-c/d。此外,h-3质子显示为宽单峰,提示h-3处于平伏键。由于内酯环的自由旋转可以观测到h-18/h-21和h-18/h-22的roesy相关信号也说明h-17处于α位。化合物a被鉴定为3β-o-(β-d-diginosyl)-16β-acetoxy-8,14-dihydroxy-5β,14β-card-20(22)-enolide经过scifinder检索,该化合物为一未见文献报道的新化合物,将其命名为8-hydroxy-oleandrigenin-3-o-β-d-diginoside.
b,白色无定形粉末(氯仿/甲醇),
1h-nmr(400mhz,inc5d5n)和13c-nmr(100mhz,inc5d5n)图谱(附图2)显示出甲型强心苷α,β-不饱和-γ-五元内酯环的特征吸收信号:内酯羰基(δc174.5),一个双键(δh5.91,δc116.8,172.4)以及一个连氧亚甲基(δh4.86,4.75,δc74.0),以及糖端基信号(δh4.84,δc98.8)。说明该化合物为单糖甲型强心苷。同时结合dept图谱判断,该化合物包括2个酰基,4个季碳,10个次甲基,11个亚甲基,2个甲基以及1个甲氧基碳信号。与化合物oleasidea(已知化合物见附图1和表3)比较,发现主要区别是19位甲基信号的化学位移(δ26.4)向高场场移动(δ14.0),提示苷元a/b环是反式稠合。因此化合物b被鉴定3β-o-(β-d-diginosyl)-14-oxo-15(14→8)abeo-5α-card-20(22)-enolide。经过scifinder检索,该化合物为一未见文献报道的新化合物,将其命名为5α-oleasidea。
hsqc,hmbc等信息进一步证实以上推测,化合物的结构如下所示。
c,白色无定形粉末(氯仿/甲醇),
hsqc,hmbc等信息进一步证实以上推测,化合物的结构如下所示。
d,白色无定形粉末(氯仿/甲醇),
1h-nmr(600mhz,c5d5n)和13c-nmr(150mhz,c5d5n)图谱显示出甲型强心苷α,β-不饱和-γ-五元内酯环的特征吸收信号:内酯羰基(δc175.2),一个双键(δh6.41,δc112.2,160.2)以及一个连氧亚甲基(δh5.06,δc72.4),以及糖端基信号(δh4.80,δc99.6),提示该化合物也为单糖甲型强心苷。13c-nmr(150mhz,c5d5n)图谱显示有30个碳信号,其中δc132.3(c-8),137.7(c-9)和135.3(c-16),142.6(c-17)为两组烯碳信号。
在hmbc图谱中质子信号δ2.28(h-7),δ1.78(h-12)和δ1.05(h-19)分别与δ137.1(c-9)相关,质子信号δ2.92/2.81(h-15),δ2.28(h-7)和δ1.49(h-18)分别与δ132.3(c-8)相关,提示了8和9位之间也存在一个双键,质子信号δ6.41(h-22),δ2.92/2.81(h-15)和δ1.49(h-18)分别与δ142.6(c-17)相关,质子信号δ6.17(h-16),δ2.92/2.81(h-15)分别与δ135.3(c-16)相关,提示16和17位之间也存在一个双键。根据noesy图谱上的相关信号:h-5/h-19,h-19/h-11,h-11/h-18,h-18/h-15,h-7/h-12,h-12α/h-15α,以及19位甲基信号的化学位移为δ26.7。因此确定苷元的骈合方式为cis-a/b,trans-b/c以及cis-c/d。此外,h-3质子显示为宽单峰,提示h-3处于平伏键。结合糖上质子的1h-1h-cosy相关信号与邻位偶合常数以及碳的化学位移值,确定单糖部分为β-d-diginose。根据hmbc图谱,相关信号h-3/c-1′和h-1′/c-3确定糖连接在苷元3位。综合以上信息,得出化合物的结构。
因此,化合物d被鉴定3β-o-(β-d-diginosyl)-14β-hydroxy-5β,14β-card-8,16,20(22)-trienolide。经过scifinder检索,该化合物为一未见文献报道的新化合物。
表1.a和b的氢谱和碳谱数据
表2.c和d的氢谱和碳谱数据
表3.已知化合物1、2和3的氢谱和碳谱数据
1.夹竹桃苷元-3-o-β-d-地芰糖苷(oleandrigenin-3-o-β-d-diginoside)
2.奈利苷(neriaside)
3.夹竹桃苷a(oleasidea)
实施例2
本发明所述化合物对肿瘤细胞的细胞毒性活性。
材料与试剂
人结肠癌hct116细胞系、人结肠癌ht29细胞系、人结肠癌sw620细胞系、人结肠癌rko细胞系和人宫颈癌hela细胞系(atcc,罗克维尔,md,美国)和人胃癌gt细胞系(从四川大学华西医院胃癌患者获得),rpmi-1640购自于美国hyclone公司;dmem/highglucose购自于美国hyclone公司;foetalbovineserum(fbs)购自于美国gibco公司;双抗(青链霉素)购自于美国hyclone公司;mtt购自于北京solarbio公司;dmso购自于北京solarbio公司。
具体步骤如下:
(1)用dmso溶解各单体化合物,将其配置成浓度为20mm的母液,实验时用基础培养基(dmem/highglucose或rpmi-1640)进行稀释使用。
(2)rpmi1640的配制:在基本培养基rpmi1640(hyclone)中加入1%双抗和10%胎牛血清,混匀即得。
(3)dmem的配制:在基本培养基dmem/highglucose(hyclone)中加入1%双抗和10%胎牛血清,混匀即得。
(4)hct116、ht29、sw620、rko、hela细胞系购进后,用含1%双抗和10%胎牛血清的rpmi1640(hyclone)培养基在37℃,5%co2条件下培养,传3代后,取对数生长期细胞用于实验。
(5)gt细胞系用含1%双抗和10%胎牛血清的dmem/highglucose(hyclone)培养基在37℃,5%co2条件下培养,传3代后,取对数生长期细胞用于实验。
(6)取对数期生长良好的细胞,经0.25%胰蛋白酶消化后制成单细胞悬液,调节浓度为1×105cells/ml,以每孔100μl细胞悬液接种到96孔板。每块板都设置细胞对照组、空白组和实验组,每组设3个复孔;将其移入培养箱中培养;
(7)接种约12小时后,取出96孔板,弃去孔中旧培养基。向实验组中每孔加入100μl含有不同浓度药物的培养液(dmem/highglucose或rpmi-1640),化合物的浓度分别为100μg/ml,10μg/ml,1μg/ml,0.1μg/ml,0.01μg/ml,0.001μg/ml,对照组和空白组中每孔加入100μl相应的培养液(dmem/highglucose或rpmi-1640),放在培养箱中继续培养;
(8)培养48小时后,加入1mg/l的mtt溶液(每孔50μl),37℃孵育4小时;
(9)待结晶在100μl的dmso中完全溶解后,在酶标仪上于波长570nm处测定吸光度od值;
(10)采用graphpadprism5软件计算各药物对不同细胞的ic50。
实验结果
化合物体外细胞毒活性ic50数据如下表4所示。
表4
经过肿瘤细胞体外细胞毒活性实验表明化合物a、d对肿瘤细胞具有显著的细胞毒性作用,从而证实具有抗癌效果,具有进一步开发为抗肿瘤药的潜力。
综上,本发明所述从夹竹桃科夹竹桃属植物欧洲夹竹桃(neriumoleanderlinn.)的鲜叶中分离纯化得到的四种新强心苷类化合物采用冷浸提取、大孔树脂柱色谱、硅胶柱色谱、ods柱色谱、凝胶柱色谱、制备型高效液相等方法成功分离得到,所述方法分离得到的化合物纯度较高,具有如下特征:甲型强心苷母核c17侧链为α,β-不饱和-γ-五元内酯环;8,9-位和16,17-位形成双键;或者c8位羟基化,c16位被乙酰氧基取代;a/b环的稠合的方式为反式或顺式;8,14-位的碳碳键断裂,形成羰基或羟基;与苷元c3-oh结合形成苷的单糖都是β-d-diginose;所述强心苷类化合物a、d具有显著细胞毒活性和抗肿瘤作用,使细胞凋亡,可作为抗肿瘤的治疗药物,具有重要的药物开发价值。
实施例3
制备方法:将上述比例的强心苷类化合物、乳糖和淀粉均匀混合,过200目筛,用水均匀润湿后的混合物干燥再过筛,加入硬脂酸镁,然后将混合物压片,每篇中250mg,活性成分含量为10mg。
实施例4
胶囊剂:强心苷类化合物20mg
半乳糖188mg
硬脂酸镁2mg
制备方法:按上述比例将强心苷类化合物与半乳糖均匀混合,过200目筛,把得到的混合物,加入硬脂酸镁,装入2号胶囊,即的。
上述参照具体实施方式对该强心苷类化合物及其制备方法与应用进行的详细描述,是说明性的而不是限定性的,可按照所限定范围列举出若干个实施例,因此在不脱离本发明总体构思下的变化和修改,应属本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!