一种梨S7-RNase蛋白的体外表达方法及其多克隆抗体的制备方法与流程
本发明涉及生物工程技术领域,特别涉及一种梨S7-RNase蛋白的体外表达方法及其多克隆抗体的制备方法。
背景技术:
梨自交不亲和性是被子植物中普遍存在的限制自花受精的机制之一,它阻止基因型相同的花粉管在雌蕊中正常的生长,完成受精。梨自交不亲和性为基于S-RNase的配子体型自交不亲和反应,众多果树如苹果、杏、果梅等,都表现出此现象。由于梨树自花授粉不能结实,在生产上必须配置授粉树,或进行人工授粉才能保证座果,增加了农民的生产成本。因此,梨自交不亲和性机制的研究具有理论价值和实践价值的双重意义。近30年来,国内外对于梨自交不亲和性机制进行了很多研究,面临的首当其冲的问题就是S-RNase的提取,而由于材料的来源、保存和繁琐的蛋白提取过程等问题,给研究带来了很大的阻力。所以利用基因工程技术制备重组梨S-RNase蛋白是解决上述问题的一个有效途径。
利用基因工程技术制备重组蛋白是一种具有广阔前景的技术手段。到目前为止,已有多种蛋白质表达系统,如原核表达系统、真核表达系统、无细胞表达系统等。大肠杆菌表达系统是最常用的一种原核表达系统,相比传统从活体材料中提取蛋白的方法,该系统具有遗传背景和生化特性清楚、生长快、成本低、表达量高、表达产物分离纯化相对简单和便于大规模生产等优点。长期以来,已有无数成功表达重组蛋白的案例。与此同时,S-RNase作为梨自交不亲和性反应的重要影响因子,市场上还没有效价高、特异性好的针对性抗体,故为了进一步研究S-RNase在梨自交不亲和性反应中的作用及其他相关生物学功能,本专利拟制备兔源抗梨S7-RNase蛋白抗体。
技术实现要素:
本发明的目的是提供一种低成本、高产率、易纯化的梨S7-RNase蛋白体外表达的制备方法。
本发明的另目的是提供一种效价高、特异性好的梨S7-RNase蛋白多克隆抗体的制备方法。
本发明所解决的技术问题采用以下技术方案来实现:
一种梨S7-RNase蛋白体外表达的方法,包括以下步骤:
a.提取梨花柱总RNA,反转录成cDNA,设计引物PCR扩增梨S7-RNase基因;
b.构建表达梨S7-RNase蛋白的原核重组表达载体;
c.将步骤b构建的原核重组表达载体转化到大肠杆菌菌株Rosetta(DE3)中,构建S7-RNase重组表达菌株;
d.培养步骤c所构建的S7-RNase重组表达菌株至OD600达到0.4-0.6,并低温处理后,加入诱导剂IPTG,诱导表达梨S7-RNase蛋白;
e.纯化诱导表达的梨S7-RNase蛋白。
作为一种优选技术方案,步骤a中,用于PCR扩增梨S7-RNase基因的引物对序列为:
正向引物为5’-CCGCTCGAGATGTACGATTATTTTCAATTTACGCAGC-3’,
反向引物为5’-CTAGTCTAGAATACTTAACATCGGCCGGGC-3’。
进一步优选的,步骤a中,PCR扩增梨S7-RNase基因的PCR反应体系为:ddH2O 33μl,上下游引物各1.5μl,cDNA 1μl,10×KOD-Plus-PCR buffer 5μl,2mM dNTPs 5μl,25mM MgSO4 2μl,KOD-Plus-DNA polymerase 1μl;PCR反应条件为:94℃预变性2min,然后进行94℃15s,60℃30s,68℃1min,共30个循环,最后68℃延伸10min。
作为一种优选技术方案,步骤b中,构建表达梨S7-RNase蛋白的原核重组表达载体时,所使用的原核表达载体为大肠杆菌表达载体pCold-TF,克隆梨S7-RNase基因的插入位点为Xho I和Xba I酶切位点之间。进一步优选的,PCR产物经1%的琼脂糖凝胶电泳分析并切胶回收,回收产物用Xho I和Xba I限制性内切酶双酶切后连接到经同样双酶切的大肠杆菌表达载体pCold-TF的Xho I和Xba I位点上。
作为一种优选技术方案,步骤d中,所述的低温处理为置于冰上5-10min,然后15-18℃静置40-60分钟,所述诱导剂IPTG的终浓度为0.5-1.0mmol/L,所述诱导表达的条件为15-18℃诱导18-24小时。
进一步优选的,步骤d中诱导表达梨S7-RNase蛋白的详细过程为:将构建的S7-RNase重组表达菌株按照1:50(v:v)的比例接种到100ml含100μg/ml氨苄青霉素的LB液体培养基中,37℃、200~250rpm震荡培养过夜,然后按1:50的比例转接到300ml含100μg/ml氨苄青霉素的LB液体培养基中,37℃、200~250rpm震荡培养至菌液OD600达到0.4-0.6,迅速置于冰上5-10分钟,然后15-18℃静置40-60分钟;然后加入终浓度为0.5-1.0mmol/L的诱导剂IPTG,15~18℃、200~250rpm震荡培养,诱导表达18-24小时;
步骤e中纯化诱导表达的梨S7-RNase蛋白的详细过程为:诱导表达完成后,于4℃下12000rpm离心10分钟后弃上清,收集沉淀,向沉淀中加入裂解液重悬沉淀;重悬后菌液使用超声破碎,超声破碎完成后,12000rpm离心15分钟,收集上清,上清经0.45μm滤膜过滤后,使用镍柱亲和层析法对梨S7-RNase蛋白进行纯化,使用镍柱亲和层析介质纯化蛋白前,需用10倍柱体积的平衡缓冲液来平衡层析介质;收集纯化蛋白,使用截流量为30kDa的超滤管在4℃下6000rpm转速下进行浓缩、脱盐,最后放入-80℃保存备用;
使用镍柱亲和层析法对梨S7-RNase蛋白进行纯化的过程为:经滤膜过滤后的20ml蛋白上清样经过纯化柱,控制流速为1ml/min;20倍柱体积含30mM咪唑的清洗液(500mM氯化钠,20mM三(羟甲基)氨基甲烷,30mM咪唑,pH 7.3)冲洗柱子,控制流速为1ml/min;10倍柱体积含80mM咪唑的洗脱冲液(500mM氯化钠,20mM三(羟甲基)氨基甲烷,80mM咪唑,pH 7.3)洗脱纯化柱,控制流速为1ml/min,收集洗脱液得纯化蛋白。
所述裂解液的配方为:140mM氯化钠,2.7mM氯化钾,10mM磷酸氢二钠,1.8mM磷酸二氢钾,50×EDTA-free protease inhibitor cocktail III(德国默克密理博),pH为7.3;
所述平衡缓冲液的配方为:500mM氯化钠,20mM三(羟甲基)氨基甲烷,5mM咪唑,pH为7.3。
所述梨S7-RNase蛋白N端带有6个表达载体上的组氨酸标签(His-Tag)。
上述方法制备的重组梨S7-RNase蛋白作为抗原在制备梨S7-RNase多克隆抗体中的应用。
一种梨S7-RNase多克隆抗体的制备方法,将上述方法制得的重组梨S7-RNase蛋白作为抗原免疫日本大耳白兔,第一次免疫采用重组梨S7-RNase蛋白与等体积的弗氏完全佐剂乳化后注射实验兔,3周后用重组梨S7-RNase蛋白与等体积的弗氏不完全佐剂乳化后第二次免疫实验兔,之后每两周进行1次加强免疫,总共4次免疫,最后一次免疫7天后采血,收集抗血清。
为评定抗体的效价和特异性在免疫前采血0.5ml,收集血清作为阴性血清,以阴性血清作为阴性对照,用ELISA法对梨S7-RNase多克隆抗体进行抗体效价评定、用Western blotting法评定抗体特异性。
优选的,第一次免疫采用500μg重组梨S7-RNase蛋白与等体积的弗氏完全佐剂乳化后注射实验兔;3周后用300μg重组梨S7-RNase蛋白与等体积的弗氏不完全佐剂乳化后第二次免疫实验兔。
本发明梨S7-RNase蛋白体外表达的方法的最优选技术方案包括以下步骤:
(1)梨S7-RNase基因的序列分析及克隆
(1.1)一种梨S7-RNase(BAA32416.1)基因,其核苷酸序列为SEQ ID NO:1,氨基酸序列为SEQ ID NO:2。利用序列分析网站SignalP 4.1Serve(http://www.cbs.dtu.dk/services/SignalP/)分析并去除信号肽序列。
(1.2)按照植物总RNA提取试剂盒说明书提取砀山酥梨花柱RNA,用反转录试剂盒反转录成cDNA。
(1.3)引物设计及PCR反应:设计正向引物(S7-pCold-cutSignalP-Xho I-Lp)为5’-CCGCTCGAGATGTACGATTATTTTCAATTTACGCAGC-3’(下划线为Xho I酶切位点,加粗部分为起始密码子),反向引物(S7-pCold-cutSignalP-Xba I-Rp)为5’-CTAGTCTAGAATACTTAACATCGGCCGGGC-3’(下划线为Xba I酶切位点);
PCR反应体系为:ddH2O 33μl,上下游引物各1.5μl,cDNA 1μl,10×KOD-Plus-PCR buffer 5μl,2mM dNTPs 5μl,25mM MgSO4 2μl,KOD-Plus-DNA polymerase 1μl;PCR反应条件为:94℃预变性2min,然后进行94℃15s,60℃30s,68℃1min,共30个循环,最后68℃延伸10min。
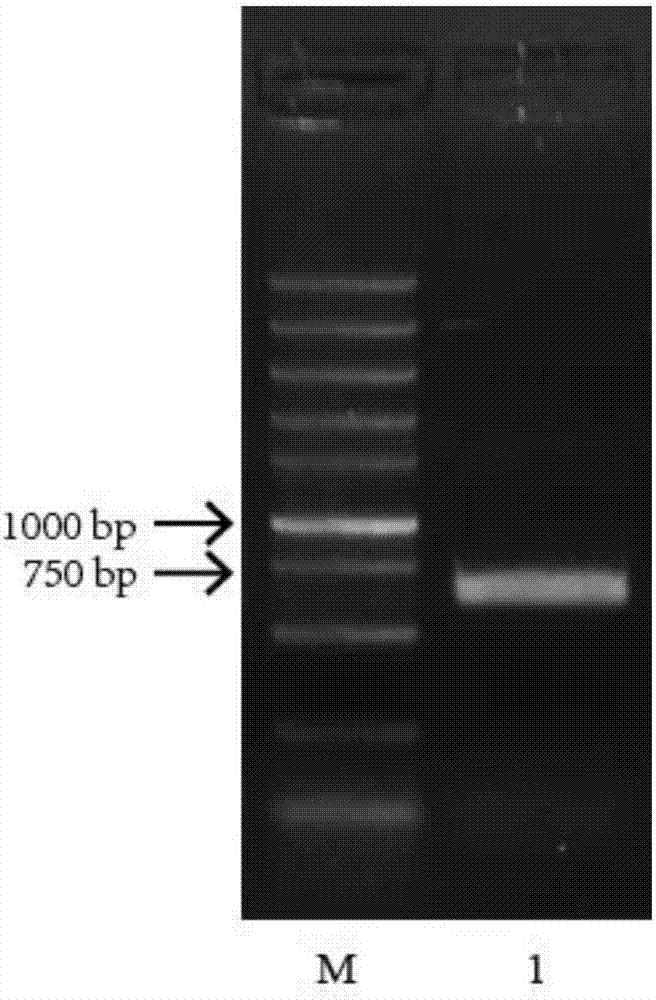
(1.4)上述PCR产物经1%的琼脂糖凝胶电泳分析并切胶回收,如附图2可见,在500~750bp有一清晰亮带,与预期大小符合。回收产物用Xho I和Xba I限制性内切酶双酶切后连接到经同样双酶切的大肠杆菌表达载体pCold-TF的Xho I和Xba I位点上(参见TAKARA公司载体图谱)。
(1.5)构建好重组表达载体S7-cutSignalP-pCold-TF,酶切鉴定正确后,再经苏州金唯智生物科技有限公司DNA测序验证其正确性。
(2)表达菌株的构建
将验证正确的重组表达载体S7-cutSignalP-pCold-TF经化学法转化到大肠杆菌株Rosetta(DE3)中,在LB固体平板(含100μg/ml氨苄青霉素)上37℃培养,挑取单菌落到1ml LB(含100μg/ml氨苄青霉素)液体培养基中,37℃、250rpm震荡培养过夜,吸取1μl菌液做模板经PCR验证正确后,按700μl菌液加入300μl灭菌的50%(v/v)甘油,混匀后液氮速冻并于-80℃冰箱保存,保存的菌株即为重组表达菌株。
(3)梨S7-RNase的诱导表达及纯化
(3.1)梨S7-RNase的诱导表达
将步骤(2)中保存的重组表达菌株按照1:50的体积比接种到100ml LB(含100μg/ml氨苄霉素)液体培养基中,37℃、200-250rpm震荡培养过夜,按1:50再转接到300ml LB(含100μg/ml氨苄青霉素)液体培养基中,37℃、200-250rpm至菌液OD600达到0.4-0.6,迅速置于冰上5-10分钟,然后放入15-18℃摇床中静置40-60分钟,在15-18℃、200-250rpm下于0.5-1.0mmol/L IPTG浓度震荡培养,诱导表达18-24小时。
(3.2)梨S7-RNase蛋白的纯化
诱导表达完成后,4℃下12000rpm离心10分钟后弃上清,收集沉淀,向沉淀中加入裂解液(140mM氯化钠,2.7mM氯化钾,10mM磷酸氢二钠,1.8mM磷酸二氢钾,50×EDTA-free protease inhibitor cocktail III(德国默克密理博),pH为7.3)重悬沉淀。重悬后菌液使用超声破碎,功率240W,条件为:开启3s,停7s,共27分钟。超声破碎完成后,12000rpm离心15分钟,收集上清,上清经0.45μm滤膜过滤后,使用镍柱亲和层析法对梨S7-RNase蛋白进行纯化,使用镍柱亲和层析介质纯化蛋白前,需用10倍柱体积的平衡缓冲液(500mM氯化钠,20mM三(羟甲基)氨基甲烷,5mM咪唑,pH 7.3)来平衡层析介质;经滤膜过滤后的20ml蛋白上清样经过纯化柱,控制流速为1ml/min;20倍柱体积含30mM咪唑的清洗液(500mM氯化钠,20mM三(羟甲基)氨基甲烷,30mM咪唑,pH 7.3)冲洗柱子,控制流速为1ml/min;10倍柱体积含80mM咪唑的洗脱冲液(500mM氯化钠,20mM三(羟甲基)氨基甲烷,80mM咪唑,pH 7.3)洗脱纯化柱,控制流速为1ml/min,收集洗脱液得纯化蛋白。使用超滤管(截流量为30kDa)在4℃下6000rpm转速下进行浓缩、脱盐。之后取50μl纯化后样品,加入50μl 2×SDS-PAGE上样缓冲液,取10μl进行SDS-PAGE电泳,经考马斯亮蓝染色后确定梨S7-RNase纯化条件,收集纯化蛋白,-80℃保存备用;
(4)梨S7-RNase蛋白多克隆抗体的制备
按照上海生工生物工程公司BCA蛋白浓度测定试剂盒对纯化后重组梨S7-RNase蛋白的蛋白浓度进行测定。将纯化后的重组梨S7-RNase蛋白作为抗原免疫日本大耳白兔。实验免疫前采血0.5ml,收集血清作为阴性血清。第一次免疫用500μg纯化的重组梨S7-RNase蛋白与等体积的弗氏完全佐剂乳化后免疫实验兔,3周后用300μg纯化的重组梨S7-RNase蛋白与等体积的弗氏不完全佐剂乳化后第二次免疫实验兔,之后每两周用300μg纯化的重组梨S7-RNase蛋白进行1次加强免疫,总共4次免疫,最后一次加强免疫一周后采血,收集抗血清;阴性血清作为阴性对照,ELISA法测定抗体效价,Western blotting测定抗体特异性。
本发明的有益效果
(1)本发明采用分子生物学的方法,首次体外表达和纯化了梨S7-RNase蛋白,也为进一步制备抗体奠定基础。
(2)采用本发明中的体外表达及纯化蛋白的方法,适用于所有梨S基因,可根据自己的研究目的与需要灵活变通。
(3)本发明中梨S7-RNase蛋白抗体可与梨花柱组织蛋白和纯化的梨S7-RNase蛋白特异性结合,特异性好,广泛适用于各种检测梨S7-RNase蛋白的免疫检测工具。
(4)本发明表达的梨S7-RNase蛋白能够直接在体外条件下引起砀山酥梨花粉的自交不亲和反应,对梨自交不亲和性机制的研究具有理论指导意义和应用参考价值。
附图说明
图1是梨S7-RNase基因序列信号肽预测示图。
图2是PCR扩增梨S7-RNase基因的琼脂糖凝胶电泳示图;
其中,M为DNA标准分子质量;1为PCR扩增产物。
图3是重组梨S7-RNase蛋白的诱导表达及纯化后SDS-PAGE示图;
其中,M为蛋白质标准分子量;1为不含IPTG诱导菌体总蛋白;2为0.5mmol/L IPTG诱导后的菌体总蛋白;3为纯化后的重组梨S7-RNase蛋白。
图4是anti-His(C-term)单克隆抗体为一抗鉴定纯化后重组梨S7-RNase蛋白的Western blotting示图;
其中,M为蛋白质标准分子量;1为纯化后的重组梨S7-RNase蛋白。
图5是ELISA法评定抗体效价示图;
其中,横坐标为不同稀释比例;纵坐标为OD490吸收值。
图6是制备的多克隆抗体与重组梨S7-RNase蛋白的Western blot示图;
其中,M为蛋白质标准分子量;1为纯化后的重组梨S7-RNase蛋白。
具体实施方式
下面详细描述本发明的实施例。下面通过参考附图描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
实施例1:S7-cutSignalP-pCold-TF重组质粒的构建与鉴定
取新鲜砀山酥梨梨花花柱,植物总RNA提取试剂盒提取花柱总RNA,用反转录试剂盒反转录得到总cDNA;如图1所示,分析并去除梨S7-RNase基因的信号肽序列,设计引物,正向引物(S7-pCold-cutSignalP-Xho I-Lp)为5’-CCGCTCGAGATGTACGATTATTTTCAATTTACGCAGC-3’(下划线为Xho I酶切位点,加粗部分为起始密码子),反向引物(S7-pCold-cutSignalP-Xba I-Rp)为5’-CTAGTCTAGAATACTTAACATCGGCCGGGC-3’(下划线为Xba I酶切位点);
以cDNA为模板进行PCR扩增,PCR反应体系(总反应体系50μl)为:ddH2O 33μl,上下游引物(10μm)各1.5μl,cDNA 1μl,10×KOD-Plus-PCR buffer 5μl,2mM dNTPs 5μl,25mM MgSO4 2μl,KOD-Plus-DNA polymerase 1μl。PCR反应条件为:94℃预变性2min,然后进行94℃15s,60℃30s,68℃1min,共30个循环,最后再68℃延伸10min。PCR产物经1%的琼脂糖凝胶电泳进行鉴定。由图2可见,在500~750bp间有一清晰的亮带,与预期大小吻合。
PCR产物参考康为世纪公司Gel extraction kit快速琼脂糖凝胶DNA回收试剂盒说明书进行回收。回收后的PCR产物经Xho I和Xba I双酶切后通过T4-DNA连接酶插入到经同样双酶切的pCold-TF表达载体中,4℃连接18小时,构建S7-cutSignalP-pCold-TF重组质粒,将重组质粒转化到大肠杆菌菌株DH5α,在LB固体平板(含100μg/ml氨苄青霉素)上于37℃培养,挑选单菌落经酶切鉴定正确后,再通过苏州金唯智生物科技有限公司DNA测序验证其序列正确性。测序结果表明,所获得的梨S7-RNase基因编码区序列与预计相符。说明重组质粒构建成功并将其命名为S7-cutSignalP-pCold-TF。梨S7-RNase基因编码区序列与pCold-TF连接克隆测序结果为SEQ ID NO:3,其氨基酸序列为SEQ ID NO:4。
实施例2:梨S7-RNase在大肠杆菌中的表达
1.获得表达梨S7-RNase的重组表达菌株
挑测序成功的菌接种到4ml含有氨苄青霉素(100μg/ml)的LB液体培养基中,37℃、250rpm振荡培养过夜,按照康为世纪公司的QuickPure Plasmid Mini kit快速质粒小提取试剂盒将S7-cutSignalP-pCold-TF重组表达载体提取出来,取1ng重组表达载体S7-cutSignalP-pCold-TF转化大肠杆菌Rosetta(DE3),涂布于含100μg/mL的氨苄青霉素平板上筛选重组子,培养温度为37℃,培养时间为过夜培养,获得重组子为表达梨S7-RNase的基因工程菌,随机选取1个单菌落进行划线培养,取少量长出的划线培养菌接种于1ml LB(含100μg/ml氨苄青霉素)液体培养基中,37℃、250rpm振荡培养过夜,然后按700μl菌液加入300μl灭菌20%(v/v)甘油,混匀后用液氮速冻贮存于﹣80℃冰箱,得到表达梨S7-RNase重组表达菌株。
2.梨S7-RNase重组蛋白的表达
将上述得到的梨S7-RNase重组表达菌株按1:50接种到100ml LB(含100μg/ml氨苄青霉素)液体培养基中,37℃、250rpm振荡培养过夜,活化重组表达菌株。将活化的重组表达菌株再按1:50转至300ml LB液体培养基(含氨苄青霉素100μg/mL)中培养,培养条件为37℃、200rpm,振荡培养至OD600为0.4-0.6时后取5ml菌液作为阴性对照,其余菌液迅速置于冰上5分钟,然后放入15℃摇床中静置40分钟,最后加入终浓度为0.5mmol/L的IPTG,15℃、240rpm震荡培养,诱导表达24小时。表达完成后取5ml菌液离心,收集菌体沉淀,沉淀与阴性对照各加入200μl 10%SDS(10g/100ml),混匀后100℃沸水水浴10分钟,置于冰中冷却2分钟,之后于4℃下12000rpm离心10分钟,各取上清50μl,加入50μl 2×蛋白上样缓冲液后取10μl进行12%常规SDS-PAGE电泳,考马斯亮蓝染色、脱色后检测重组蛋白表达情况,结果如图3第1、2条泳道显示。
实施例3:重组梨S7-RNase蛋白的分离纯化及鉴定
将梨S7-RNase重组表达菌株按1:50接种100ml LB(含100μg/ml氨苄青霉素)液体培养基中,37℃、250rpm振荡培养过夜,活化重组表达菌株。将活化的重组表达菌株再按1:50转至300ml LB培养基(含氨苄青霉素100μg/mL)中培养,培养条件为37℃,200rpm,振荡培养至OD600为0.4-0.6时后,迅速置于冰上5分钟,然后放入15℃摇床中静置40分钟,最后加入终浓度为0.5mmol/L的IPTG,15℃、240rpm震荡培养诱导表达24小时。表达完成后4℃、12000rpm离心10分钟后弃上清,收集菌体沉淀,用20ml裂解液(140mM氯化钠,2.7mM氯化钾,10mM磷酸氢二钠,1.8mM磷酸二氢钾,50×EDTA-free protease inhibitor cocktail III(德国默克密理博),pH为7.3)重悬菌体后超声波破碎,功率240W,条件为:开启3s,停7s,共27分钟,破碎至溶液澄清。超声破碎完成后,于4℃下12000rpm离心15分钟,收集上清,上清经0.45μm滤膜过滤去除杂质。利用德国默克密理博公司的Ni-NTA琼脂糖亲和层析填料纯化梨S7-RNase重组蛋白,具体操作为:10倍柱体积的平衡缓冲液(500mM氯化钠,20mM三(羟甲基)氨基甲烷,5mM咪唑,pH 7.3)平衡柱子,控制流速为1ml/min;经滤膜过滤后的20ml蛋白上清样经过纯化柱,控制流速为1ml/min;20倍柱体积含30mM咪唑的清洗液(500mM氯化钠,20mM三(羟甲基)氨基甲烷,30mM咪唑,pH 7.3)冲洗柱子,控制流速为1ml/min;10倍柱体积含80mM咪唑的洗脱冲液(500mM氯化钠,20mM三(羟甲基)氨基甲烷,80mM咪唑,pH 7.3)洗脱纯化柱,控制流速为1ml/min,收集洗脱液得纯化蛋白,使用超滤管(截流量为30kDa)于4℃下6000rpm进行浓缩、脱盐,最后﹣80℃保存。取少量蛋白进行SDS-PAGE电泳纯度分析和Western Blotting鉴定,结果如图3第3条泳道所示。利用anti-His单克隆抗体的Western Blotting鉴定结果如图4第1条泳道所示,确定其为梨S7-RNase重组蛋白。
实施例4:梨S7-RNase蛋白的多克隆抗体的制备及抗体效价和特异性评定
按照BCA蛋白浓度测定试剂盒说明书对纯化后重组梨S7-RNase蛋白的蛋白浓度进行测定。将纯化后的重组梨S7-RNase蛋白作为抗原免疫日本大耳白兔。实验免疫前耳部静脉采血0.5ml,收集血清作为后续ELISA检测的阴性对照。首次免疫用500μg溶于0.5ml PBS纯化的重组梨S7-RNase蛋白与等体积的弗氏完全佐剂乳化后免疫实验兔,3周后用300μg溶于0.3ml PBS纯化的重组梨S7-RNase蛋白与等体积的弗氏不完全佐剂乳化后第二次免疫实验兔,之后每两周用300μg纯化的重组梨S7-RNase蛋白进行1次加强免疫,总共4次免疫,最后一次加强免疫一周后采血,收集抗血清;阴性血清作为阴性对照,ELISA法测定抗体效价(阴性血清作为阴性对照),Western blotting测定抗体特异性。稀释后的抗血清在490nm吸光度大于免疫前(阴性对照)血清2.1倍时的最高稀释倍数定义为抗体的效价,ELISA结果如图5所示,表明经制备的梨S7-RNase多克隆抗体抗血清效价约为1:1024000;制备的梨S7-RNase多克隆抗体的抗体特异性经Western blotting分析得出其特异性良好,图6第1条泳道所示。
序列表
<110> 南京农业大学
<120> 一种梨S7-RNase蛋白的体外表达方法及其多克隆抗体的制备方法
<160> 4
<170> SIPOSequenceListing 1.0
<210> 1
<211> 681
<212> DNA
<213> 梨(Pyrus spp)
<400> 1
atggggatta cggggatgat atatatagtt acgatggtat tttcattaat tgtattgata 60
ttgtcttcct ctacggtggg atacgattat tttcaattta cgcagcaata tcagccagct 120
gtctgcaact ccaaacctac tccttgtaag gatcctcctg acaagttgtt cacggttcac 180
ggtttgtggc cttcaaactt gaatggacct cacccagaaa attgcactaa tgcaaccgtg 240
aatcctcaca ggataaaaaa tatccaagcc cagttgaaaa ttatttggcc gaatgtactc 300
gatcgaacca atcatgtagg cttctggaat aaacagtgga taaaacatgg cagctgtggg 360
tatcccgcaa taatgaacga cacgcattac tttcaaacag taatcaacat gtacataacc 420
cagaaacaaa acgtctctga aatactctca aaggcgaaga ttgaaccgtt gggaatacaa 480
aggccactgg tgcatattga aaatgccata cggaatagta ccaacaataa gaaaccaaaa 540
ttcaagtgcc aaaagaattc tggggtgact gaattagttg aggtcggtct ttgcagcgat 600
ggcagcttaa cgcagttcag aaattgcccc cacccaccac caggatcacc atatctctgc 660
ccggccgatg ttaagtatta a 681
<210> 2
<211> 226
<212> PRT
<213> 梨(Pyrus spp)
<400> 2
Met Gly Ile Thr Gly Met Ile Tyr Ile Val Thr Met Val Phe Ser Leu
1 5 10 15
Ile Val Leu Ile Leu Ser Ser Ser Thr Val Gly Tyr Asp Tyr Phe Gln
20 25 30
Phe Thr Gln Gln Tyr Gln Pro Ala Val Cys Asn Ser Lys Pro Thr Pro
35 40 45
Cys Lys Asp Pro Pro Asp Lys Leu Phe Thr Val His Gly Leu Trp Pro
50 55 60
Ser Asn Leu Asn Gly Pro His Pro Glu Asn Cys Thr Asn Ala Thr Val
65 70 75 80
Asn Pro His Arg Ile Lys Asn Ile Gln Ala Gln Leu Lys Ile Ile Trp
85 90 95
Pro Asn Val Leu Asp Arg Thr Asn His Val Gly Phe Trp Asn Lys Gln
100 105 110
Trp Ile Lys His Gly Ser Cys Gly Tyr Pro Ala Ile Met Asn Asp Thr
115 120 125
His Tyr Phe Gln Thr Val Ile Asn Met Tyr Ile Thr Gln Lys Gln Asn
130 135 140
Val Ser Glu Ile Leu Ser Lys Ala Lys Ile Glu Pro Leu Gly Ile Gln
145 150 155 160
Arg Pro Leu Val His Ile Glu Asn Ala Ile Arg Asn Ser Thr Asn Asn
165 170 175
Lys Lys Pro Lys Phe Lys Cys Gln Lys Asn Ser Gly Val Thr Glu Leu
180 185 190
Val Glu Val Gly Leu Cys Ser Asp Gly Ser Leu Thr Gln Phe Arg Asn
195 200 205
Cys Pro His Pro Pro Pro Gly Ser Pro Tyr Leu Cys Pro Ala Asp Val
210 215 220
Lys Tyr
225
<210> 3
<211> 603
<212> DNA
<213> 梨(Pyrus spp)
<400> 3
atgtacgatt attttcaatt tacgcagcaa tatcagccag ctgtctgcaa ctccaaacct 60
actccttgta aggatcctcc tgacaagttg ttcacggttc acggtttgtg gccttcaaac 120
ttgaatggac ctcacccaga aaattgcact aatgcaaccg tgaatcctca caggataaaa 180
aatatccaag cccagttgaa aattatttgg ccgaatgtac tcgatcgaac caatcatgta 240
ggcttctgga ataaacagtg gataaaacat ggcagctgtg ggtatcccgc aataatgaac 300
gacacgcatt actttcaaac agtaatcaac atgtacataa cccagaaaca aaacgtctct 360
gaaatactct caaaggcgaa gattgaaccg ttgggaatac aaaggccact ggtgcatatt 420
gaaaatgcca tacggaatag taccaacaat aagaaaccaa aattcaagtg ccaaaagaat 480
tctggggtga ctgaattagt tgaggtcggt ctttgcagcg atggcagctt aacgcagttc 540
agaaattgcc cccacccacc accaggatca ccatatctct gcccggccga tgttaagtat 600
taa 603
<210> 4
<211> 200
<212> PRT
<213> 梨(Pyrus spp)
<400> 4
Met Tyr Asp Tyr Phe Gln Phe Thr Gln Gln Tyr Gln Pro Ala Val Cys
1 5 10 15
Asn Ser Lys Pro Thr Pro Cys Lys Asp Pro Pro Asp Lys Leu Phe Thr
20 25 30
Val His Gly Leu Trp Pro Ser Asn Leu Asn Gly Pro His Pro Glu Asn
35 40 45
Cys Thr Asn Ala Thr Val Asn Pro His Arg Ile Lys Asn Ile Gln Ala
50 55 60
Gln Leu Lys Ile Ile Trp Pro Asn Val Leu Asp Arg Thr Asn His Val
65 70 75 80
Gly Phe Trp Asn Lys Gln Trp Ile Lys His Gly Ser Cys Gly Tyr Pro
85 90 95
Ala Ile Met Asn Asp Thr His Tyr Phe Gln Thr Val Ile Asn Met Tyr
100 105 110
Ile Thr Gln Lys Gln Asn Val Ser Glu Ile Leu Ser Lys Ala Lys Ile
115 120 125
Glu Pro Leu Gly Ile Gln Arg Pro Leu Val His Ile Glu Asn Ala Ile
130 135 140
Arg Asn Ser Thr Asn Asn Lys Lys Pro Lys Phe Lys Cys Gln Lys Asn
145 150 155 160
Ser Gly Val Thr Glu Leu Val Glu Val Gly Leu Cys Ser Asp Gly Ser
165 170 175
Leu Thr Gln Phe Arg Asn Cys Pro His Pro Pro Pro Gly Ser Pro Tyr
180 185 190
Leu Cys Pro Ala Asp Val Lys Tyr
195 200
- 还没有人留言评论。精彩留言会获得点赞!