水稻生长素运输蛋白基因OsPIN9的基因工程应用的制作方法
本发明公开了水稻生长素运输蛋白基因ospin9的基因工程应用,属于基因工程技术领域,具体地讲涉及水稻中编码生长素运输蛋白及其调控的基因应用。
背景技术:
随着人口增长和经济发展,我国粮食持续性的刚性需求使得化肥施用量不断增加,水稻上情况同样不容乐观(武良等,2016),从2002到2009,水稻单位面积氮肥用量从每公顷191kg增加到210kg,比世界稻田平均用量(145kgha-1)高50%;虽然我国稻谷产量与日本的单产水平相当,但单位施氮量的产谷效率不足日本的50%;同样在印度、菲律宾等东南亚国家水稻施氮量为120-150kgha-1,也能获得8-9mgha-1的稻谷产量(fao,2006)。水稻节氮不仅在土壤-作物-肥料系统中有很大潜力(即土壤条件和施肥方面的调控),而且从作物本身出发,研究其对氮素养分高效利用的根系生物学及吸收同化的生理机制,挖掘具有氮素高效利用的功能基因同样具有广阔的前景。
生长素是最早被发现的一种植物激素,极性运输的特性是其区别于多种植物激素的独有特征。目前,人们普遍认为生长素输入输出载体在细胞质膜上的不均匀分布实现了生长素的极性运输,并建立了生长素在植物体内的梯度分布。生长素的极性运输参与了植物许多重要的生长发育过程,其中包括植物的分枝、向性生长和根系的生长发育等。生长素及其极性运输不仅影响植物的形态特征,而且和矿质元素的吸收,运输和分布之间存在着密切的联系,矿质营养与植物内源激素的相互关系一直是植物营养研究的重要内容。
研究表明细胞和细胞之间的iaa极性运输是iaa运输蛋白来完成的。其中iaa内流运输蛋白有aux1和lax(aux1-like)基因家族,外流运输蛋白基因有pin基因家族(eiichi.regulationofrootgrowthbyplanthormones-rolesforauxinandgibberelin.criticalreviewsinplantscience,2005,24(4):249-265.)和pgp/mdr(p-glycoprotein/multigrug-resistance-like)家族。拟南芥pin1突变体对iaa的运输能力下降且不能形成正常的花序(okadak,junichiu,komakimk,bellcjandshimuray.requirementoftheauxinpolartransportsysteminearlystagesofarabídopsisfloralbudformation.theplantcell,1991,3(7):677-684.),atpin2突变体导致根系向重力性消失(mullera,guanch,galweilerl,tanzlerp,huijserp,marchanta,parryg,bennettm,wismanmandpalmek.atpin2definesalocusofarabidopsisforrootgravitropismcontrol.theembojournal.1998,17(23):6903-6011.)水稻中首次报道的是ospin1(xum,zhul,shouhandwup.plantcellphysiol.apin1familygene,ospin1,involvedinauxin-dependentadventitiousrootemergenceandtilleringinrice.2005,46(10):1674-1681.),其超表达材料主根变长,侧根数目增多,rnai材料分蘖数目增多,不定根数目减少(minxuetal.,2005);ospin2超表达材料分蘖数目增多,分蘖角度增大,株高变矮(yingnanchenetal.,2011);ospin3t参与水稻的干旱胁迫并能提高水稻的抗旱性(qianzhangetal.,2012),但并未报道对氮的吸收及产量性状的改善。
本发明首次公开了过量表达生长素运输蛋白基因ospin9对水稻分蘖发生、氮的吸收有很大作用,能够提高水稻对氮肥的利用率、改善水稻株型、增加水稻的产量。
技术实现要素:
技术问题:
本发明的目的旨在提供水稻生长素运输蛋白基因ospin9的基因工程应用,该基因在水稻中过量表达可以增加分蘖数目、生物量、总氮含量和最终水稻产量。
技术方案
本发明提供了水稻生长素运输蛋白基因ospin9的基因工程应用,基因序列在ncbi网站登录号是ak059229。
进一步的,该基因在调节水稻分蘖发生、氮素吸收,提高氮肥利用效率和/或最终产量方面的应用。
进一步的,包括:
1)总rna的提取
水稻日本晴种子经质量比30%naclo消毒,催芽,培养到二叶一心时,挑选出大小一致的水稻植株,去掉胚乳后移栽至ph5.5的1/2国际水稻所irri营养液中,四叶一心时换为国际水稻所irri全营养液,培养一周后,取根及叶片迅速置于液氮中冷冻保存,称取0.1g样品,用液氮研碎,研磨充分加入1.5ml离心管,迅速加入1mltrizol试剂,加入0.2ml氯仿,离心后吸取上清,加入0.5ml异丙醇,离心后弃上清,加入70%乙醇洗涤沉淀,rna溶于体积比为1‰的depc水中,用质量比为1.7%的琼脂糖凝胶电泳检测rna质量,并用分光光度计检测总rna的浓度和纯度;
2)总cdna合成
每个rna样品2μg,加入50μmoll-1oligodt18,加1‰depc水补足10μl,70℃下水浴5min,冰上放置5min后,依次加入rnaseinhibitor0.5μl和5xrtbuffer5μl,10mmdntp2.5μl,m-mlv反转录酶1μl,1‰depc水补足25μl,42℃水浴60min后,70℃水浴10min终止反应;
3)ospin9基因的cdna全长的获得
用以上获得的水稻日本晴总cdna为模板,设计pcr引物,其pcr产物包含完整的ospin9阅读框,引物序列为:
pin9-f:5’-atgattacgggttcggaggt-3’(seqidno.1)
pin9-r:5’-tcacagccccaacagaatat-3’(seqidno.2)
pcr程序如下:95℃预变性3min,95℃变性30s,56℃退火72℃复性延伸1min20s,30个循环后,72℃7min,扩增的pcr产物通过1%琼脂糖凝胶电泳检测,其大小为1281bp片段,将目的pcr产物经琼脂糖电泳分离后切胶回收,将回收的片段与p-easyblunt载体连接,酶连体系总体积5μl,包含1μl载体,4μl的pcr纯化产物,加完样后混合均匀,离心甩至管底,28℃放置15min,然后转化;
42℃热击转入大肠杆菌dh5α感受态细胞中,加500-700μl不含抗生素的lb液体培养基摇菌1h,然后低速离心,富集菌体,将其涂在含有卡纳100μgml-1的lb固体培养基上生长12h-14h后,挑取阳性菌落进行dna测序,ospin9基因登录号为ak059229,ospin9的开放阅读框orf全长1281bp;将测序正确的菌液加入等体积30%甘油于-70℃保存备用,将含有ospin9的开放阅读框的p载体命名为pin9inp;
4)超量表达载体pubi-pin9的构建
根据水稻生长素运输蛋白基因ospin9的cdna序列,设计pcr引物,其pcr产物包含完整的ospin9阅读框,并在上游和下游引物上分别引入限制性内切酶位点kpni和spei,引物序列为:
overpin9-f:5’-aaggtaccatgattacgggttcggaggt-3’kpni(seqidno.3)
overpin9-r:5’-atactagttcacagccccaacagaatat-3spei(seqidno.4)
用以上获得的ppin9inp质粒为模板,pcr程序如下:95℃预变性1min,95℃变性30s,56℃退火72℃复性延伸1min20s,30个循环后,72℃7min,扩增的pcr产物通过1%琼脂糖凝胶电泳检测,pcr产物大小约为1300bp;将目的pcr产物经琼脂糖电泳分离后切胶回收,回收产物用限制性内切酶kpni和spei进行酶切回收,同时用kpni和spei双酶切植物过量表达载体ptck303质粒,然后分别回收酶切过的pcr片段和载体,将载体进行去磷酸化后再次回收;回收后通过t4连接酶将线性化的载体与酶切过的pcr片段在16℃下连接过夜,将酶连产物转化到大肠杆菌dh5a感受态细胞中,涂在含有卡那霉素100μgml-1的lb固体培养基上生长12h后,挑取阳性菌落,提取质粒经kpni和spei酶切验证片段大小无误后,将该菌液进行dna测序,将含有测序正确克隆的菌液加入等体积30%甘油于-70℃保存,提取阳性克隆质粒命名为pubi-pin9;
最后通过电击法将pubi-pin9质粒转化至根癌农杆菌eha105的感受态细胞中,涂在含有卡那霉素和链霉素均为50μgml-1的yep固体培养基上生长48h后,挑取阳性菌落,提取质粒,经kpni和spei双酶切验证无误后,菌液加入等体积30%甘油于-70℃保存,转基因备用;
5)转基因植株的获得
将以上获得的转有pubi-pin9质粒的农杆菌,侵染水稻愈伤组织,共培养60小时,经过选择培养、分化、生根、炼苗得到t0代转基因植株;对所有转基因材料都进行了两次扩繁,得到了稳定遗传的t1代和t2代材料。
进一步的,应用获得的含有目的基因ospin9cdna全长序列的重组质粒pubi-pin9。
有益效果:
1、通过系统研究,首次提供了水稻生长素运输蛋白基因ospin9的生物学功能,发现超表达植株具有更强大的分蘖能力(图4、图5)。
2、利用特异引物研究ospin9在水稻中的表达,发现ospin9主要在根和根茎结合部表达(图1),在其他部位有微弱的表达。
3、ospin9超表达后增大了水稻的吸收氮量、生物量,从而使水稻产量得到提高(图8、图9)。
利用特异引物发现ospin9在根和根茎结合部有强烈的表达,在叶片和叶鞘中不表达或表达量很低(图1)。通过转基因手段获得的ospin9超表达材料使得ospin9不仅在根系表大量增加并且在叶片中也发生表达,由此使水稻植株体内生长素的运输分配发生变化,有利于水稻对养分尤其是氮素的吸收和利用,提高氮素利用效率。此外,转基因材料(oe7、oe13、oe17)平均分蘖数为58,与野生型相比分蘖数提高60%(图4、图5);。本发明公开的ospin9超表达材料(oe7、oe13、oe17)与野生相比产量提高30%(图6、图7),分蘖是影响水稻最终产量的重要指标,有可能是由于ospin9在地上地下部超表达使水稻株型得到改善,从而使产量得到提高。
附图说明
图1:ospin9在水稻不同部位(根、根茎结合、叶片、叶鞘)表达特征;
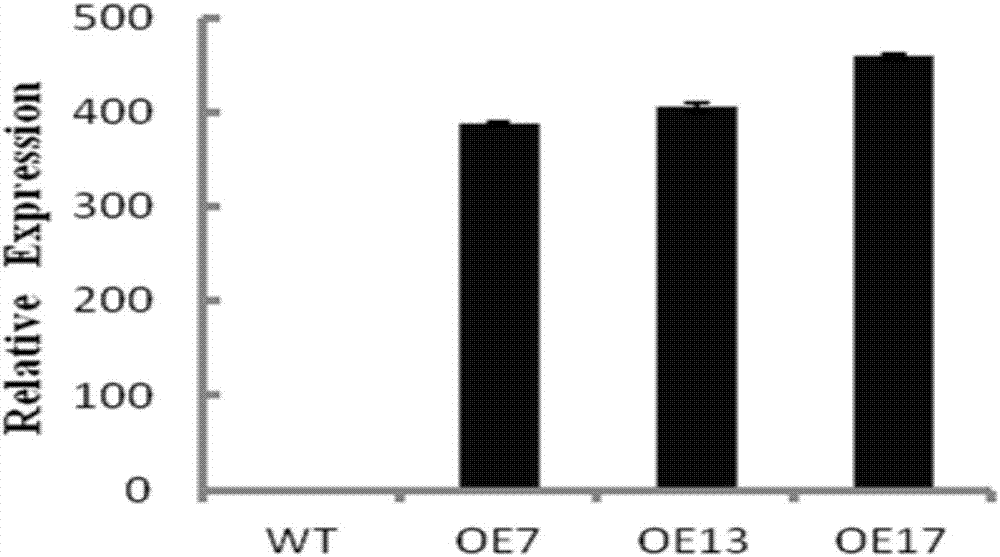
图2:t2代ospin9三个超表达株系(oe7、oe13、oe17)的超表达效果鉴定(wt是wildtype,oe7、oe13、oe17分别是三个独立的超表达株系);
图3:三个超表达株系(oe7、oe13、oe17)的拷贝数鉴定(m是marker,p是空载质粒,wt是wildtype,oe7、oe13、oe17分别是三个独立的超表达株系);
图4:t2代ospin9超表达材料(oe7、oe13、oe17)与野生型(日本晴)相比分蘖数量增加;
图5:三个超表达株系(oe7、oe13、oe17)的分蘖数量,相对于野生型分蘖数目增大60%。
图6:单株t2代ospin9超表达材料(oe7、oe13、oe17)与野生型(日本晴)收获得到的穗子形态;
图7:统计的单株收获的种子重量,t2代ospin9超表达材料(oe7、oe13、oe17)与野生型(日本晴)相比产量提高30%;
图8:t2代ospin9超表达材料(oe7、oe13、oe17)与野生型(日本晴)的单株的生物量;
图9:t2代ospin9超表达材料(oe7、oe13、oe17)与野生型(日本晴)的单株各部位的总氮含量,各部位柱状图由左至右分别为wt、oe7、oe13、oe17。
具体实施方式
(一)ospin9基因(登录号为ak059229)在水稻中表达特征
1)总rna的提取水稻日本晴种子经质量比30%naclo消毒,催芽,培养到二叶一心时,挑选出大小一致的水稻植株,去掉胚乳后移栽至ph5.5的1/2国际水稻所irri营养液中,四叶一心时换为国际水稻所irri全营养液(maodr.themethodsofplantnutritionresearch.beijing:beijingagriculturaluniversitypress,1994.),培养一周后,取根及叶片迅速置于液氮中冷冻保存,称取0.1g左右样品,用液氮研碎,研磨充分加入1.5ml离心管,迅速加入1mltrizol试剂,加入0.2ml氯仿,离心后吸取上清,加入0.5ml异丙醇,离心后弃上清,加入70%乙醇洗涤沉淀,rna溶于depc水中(体积比为1‰),用质量比为1.7%的琼脂糖凝胶电泳检测rna质量,并用分光光度计检测总rna的浓度和纯度;
2)总cdna合成每个rna样品2μg,加入50μmoll-1oligodt18,加1‰depc水补足10μl,70℃下水浴5min,冰上放置5min后,依次加入rnaseinhibitor0.5μl和5xrtbuffer5μl,10mmdntp2.5μl,m-mlv反转录酶1μl,1‰depc水补足25μl,42℃水浴60min后,70℃水浴10min终止反应(oligodt18由南京金斯瑞公司合成;反转录试剂盒购自fermentas公司,canada)。
3)定量pcr反转录合成总cdna第一链后,以其为模板进行pcr扩增。反应过程:水稻各组织cdna扩增反应在96孔pcr板中进行。反应体系为20μl:sybrmix(2x),(takara,大连宝生物)10μl,rox0.4μl,正向引物和反向引物各0.4μl,cdna模板1μl,无菌水7.8μl,总体积20μl。配制混合物充分混匀后分配pcr板中。反应条件如下:95℃5s、94℃变性30s、65℃退火30s、72℃延伸30s,40次循环,72℃延伸5min。
计算方法:采用双δδct值计算获得结果。基因的序列号和引物设计如下表:
*:参考文献,xiaorongfan,lijunjia,yilinli,susanj.smith,anthonyjmillerandqirongshen,2007comparingnitratestorageandremobilizationintworicecultivarsthatdifferintheirnitrogenuseefficiency,journalofexperimentalbotany58(7):1729-40
通过对该基因在水稻不同部位(叶片、叶鞘、根茎结合、根)进行表达分析发现ospin9只在根和根茎结合中表达,而在叶片中不表达或表达量很低(图1)。
(二)ospin9基因的超量表达植株
1)ospin9基因的cdna全长的获得
用以上获得的水稻日本晴总cdna为模板,设计pcr引物,其pcr产物包含完整的ospin9阅读框(从起始密码子atg至tag),引物序列为:
pin9-f:5’-atgattacgggttcggaggt-3’;(seqidno.1)
pin9-r:5’-tcacagccccaacagaatat-3’(seqidno.2)
pcr程序如下:95℃预变性3min,95℃变性30s,56℃退火72℃复性延伸1min20s,30个循环后,72℃7min,扩增的pcr产物通过1%琼脂糖凝胶电泳检测,其大小为1281bp片段,将目的pcr产物经琼脂糖电泳分离后切胶回收,将回收的片段与p-easyblunt载体连接,酶连体系总体积5μl,包含1μl载体,4μl的pcr纯化产物,加完样后混合均匀,离心甩至管底,28℃放置15min,然后转化;
42℃热击转入大肠杆菌dh5α感受态细胞中,加500-700不含抗生素的lb液体培养基摇菌1h,然后低速离心,富集菌体,将其涂在含有卡纳100μgml-1的lb固体培养基上生长12h-14h后,挑取阳性菌落进行dna测序,ospin9基因登录号为ak059229,ospin9的开放阅读框(orf)全长1281bp;将测序正确的菌液加入等体积30%甘油于-70℃保存备用,将含有ospin9的开放阅读框的p载体命名为pin9inp。
2)超量表达载体pubi-pin9的构建
根据水稻生长素运输蛋白基因ospin9的cdna序列,设计pcr引物,其pcr产物包含完整的ospin9阅读框(从起始密码子atg至终止密码tag),并在上游和下游引物上分别引入限制性内切酶位点kpni和spei,引物序列为:
overpin9-f:5’-aaggtaccatgattacgggttcggaggt-3’kpni(seqidno.3)
overpin9-r:5’-atactagttcacagccccaacagaatat-3’spei(seqidno.4)
用以上获得的ppin9inp质粒为模板,pcr程序如下:95℃预变性1min,95℃变性30s,56℃退火72℃复性延伸1min20s,30个循环后,72℃7min,扩增的pcr产物通过1%琼脂糖凝胶电泳检测,pcr产物大小约为1300bp。将目的pcr产物经琼脂糖电泳分离后切胶回收,回收产物用限制性内切酶kpni和spei进行酶切回收,同时用kpni和spei双酶切植物过量表达载体ptck303质粒,然后分别回收酶切过的pcr片段和载体,将载体进行去磷酸化后再次回收;回收后通过t4连接酶将线性化的载体与酶切过的pcr片段在16℃下连接过夜,转化到大肠杆菌dh5a感受态细胞中,涂在含有卡那霉素100μgml-1的lb固体培养基上生长12h后,挑取阳性菌落,提取质粒经kpni和spei酶切验证片段大小无误后,将该菌液进行dna测序,将含有测序正确克隆的菌液加入等体积30%甘油于-70℃保存,提取阳性克隆质粒命名为pubi-pin9;
最后通过电击法将pubi-pin9质粒转化至根癌农杆菌eha105的感受态细胞中,涂在含有卡那霉素和链霉素均为50μgml-1的yep固体培养基上生长48h后,挑取阳性菌落,提取质粒,经kpni和spei双酶切验证无误后,菌液加入等体积30%甘油于-70℃保存,转基因备用;
3)转基因植株的获得
为了避免转基因过程产生的植物细胞质基因突变,我们进行了不同批次的转基因实验。分别于2006年12月-2007年2月和2007年12月-2008年2月将以上获得的转有pubi-pin9质粒的农杆菌,侵染水稻愈伤组织,共培养3天,经过抗性愈伤组织的选择培养、分化、生根、炼苗得到不同年份不同批次的t0代转基因植株。为了避免植株性状的改变是由于非基因组插入导致的细胞质嵌合体造成的,我们在对所有转基因材料都进行了两次扩繁,得到了稳定遗传的t1代和t2代材料,并对稳定遗传的t2代材料进行的生理测定。
3.1)试剂和溶液缩写
本发明中培养基所用到的英文所写缩写表示如下:6-ba(6-benzylaminopurine,6-苄基腺嘌呤);car(carbenicillin,羧苄青霉素);naa(napthaleneaceticacid,萘乙酸);iaa(indole-3-aceticacid,吲哚乙酸);2,4-d(2,4-dichlorophenoxyaceticacid,2,4-二氯苯氧乙酸);as(acetosringone,乙酰丁香酮);ch(caseinenzymatichydrolysate,水解酪蛋白);l-pro(l-脯氨酸);l-glu(l-谷氨酰胺);mes(2-(n-morpholino)ethanesulfonicacid);n6(n6大量元素成份溶液);b5(b5微量元素成份溶液);aa(aa大量元素成份)。
3.2)溶液与培养基配方
1)n6培养基母液每升含量(20倍):
2)b5微量母液每升含量(100倍):
3)有机母液:
4)铁盐(100倍):
5)aa大量元素母液(每升含量):
6)诱导愈伤组织与继代培养基(每升含量):
7)水稻愈伤组织与农杆菌共培养培养基(每升含量):
8)抗性愈伤组织选择培养基(每升含量):
9)分化培养基配方(每升含量):
10)生根培养基配方(每升含量):
11)感菌液配方(每升含量):
12)农杆菌生长的yep液体培养基配方(每升含量):
3.3)农杆菌介导的水稻转化
诱导愈伤组织:去皮的水稻种子(一盘14粒)入三角瓶,用70%乙醇浸泡1min(淹没种子),倒掉70%乙醇,用30%次氯酸钠浸泡30min,然后用灭菌水清洗5-6次直至清亮。用镊子把种子拨到灭菌的滤纸上,吸干水分,最后把种子置于诱导培养基上,在30℃光照培养箱培养20-30d。
继代培养:选择小米粒大小的黄色有韧性的脱落下来的愈伤组织,用灭菌的镊子转移到继代培养基生长7-14d。
农杆菌的准备:挑取转有pubi-pin9质粒的农杆菌eha105原液20μl,接种于5ml含50mgl-1链霉素和50mgl-1卡那霉素的yep(sambrook,etal.分子克隆实验指南.2001)液体培养基中,28℃振荡过夜。取活化菌液500μl,接种于5ml含相同抗生素新鲜的yep培养基中,继续培养至菌液在600nm波长处的吸光值(od600)0.8-1.0。
侵染愈伤组织和共培养:将水稻愈伤组织从继代培养基中挑出放入离心管中,愈伤组织的数量量没过50ml离心管锥形部位即可(选择淡黄圆润有韧性的愈伤组织)。取培养好的菌液1ml于1.5ml离心管中,4℃,5000rpm,离心lmin,去上清。用含200μmo1l-1乙酰丁香酮(as)的30ml感菌液将收集的菌体制成悬浮液,此悬浮液倒入挑好的愈伤组织中,侵染5min。倒掉液体,将愈伤组织取出,置于无菌的含吸水纸的培养皿上沥干30-40min。将愈伤组织置于共培养培养基上(上面垫上一层9cm无菌滤纸),25℃暗培养60小时。
洗菌和抗生素筛选培养:将愈伤组织从共培养培养基中取出,用无菌水清5次,每次不停的振荡5min。再用含500mgl-1羧苄青霉素(car)的无菌水浸泡40-60min。最后置于无菌滤纸上沥干2h。第一轮筛选:将晾干的愈伤组织转入含250mgl-1羧苄青霉素(car)和50mgl-1潮霉素(hyg)的选择培养基上进行第一次选择,30℃,光照培养14d;第二轮筛选:将长有抗性愈伤组织的初始愈伤组织转到含250mgl-1羧苄青霉素(car)和80mgl-1潮霉素(hyg)的选择培养基上,30℃,光照培养10d然后转移到组培室中培养4d。
抗性愈伤组织的诱导分化和生根:挑取颜色鲜黄的抗性愈伤组织移入装有分化培养基的分化灌中,放入恒温培养室中,等待分化成苗(30d左右,组培室培养条件为24-30℃,14h光/8h暗),待苗长至5cm左右,放入生根培养基中壮苗。
转基因苗的锻炼和移栽:将苗根部和茎叶分化得较完好的试管挑出(苗长至试管顶部,就要及时开盖),打开封口膜,加入适量无菌水(防止培养基长菌),炼苗3d至7d左右,然后洗去琼脂,移栽到温室进行水培或土培生长、检测。
3.4)潮霉素快速检测转基因幼苗得到t0代植株
剪取并收集待检测苗1cm左右长的新鲜绿色叶片(两端均留有切口),平放于含潮霉素(80mgl-1)培养基上,30℃,16h/8h(光/暗)培养48h叶片依旧保持鲜绿的即为阳性植株,而阴性幼苗的叶片出现块状坏死(郑晔.水稻高效转基因体系的建立及其应用.2008)。通过潮霉素筛选得到阳性t0植株100个株系。2015年4月到11月在南京农业大学牌楼温网室进行对超表达材料的种植得到t0代种子。
3.5)ospin9超表达株系的分子鉴定
t0代种子发芽后得到t1代转基因苗,提取转基因t1代苗不同株系的根部的总rna,反转录总cdna,进行定量pcr鉴定(总rna的提取,总cdna的合成,定量pcr方法同“ospin9基因在水稻中表达特征”),得到稳定遗传的o7、o13、o17转基因株系(图2、图3)。
3.6)超表达株系的扩繁及生理测定
2016年5月到11月在南京农业大学牌楼温网室进行对超表达材料的扩繁,得到植株性状稳定遗传的t2代材料。
观察t1代和t2代转基因水稻与野生型水稻的生长差异。从图6、图7可以看出ospin9超表达材料比野生型产量提高30%,氮素吸收量比野生型高3倍。
综上所述,本发明人提供的ospin9基因是首次在水稻中验证其生物学功能,发现它参与生长素运输,影响水稻分蘖发生。该基因在水稻中过量表达可以增加水稻分蘖数量、生物量、氮素利用效率和最终水稻产量。可利用本发明ospin9基因作为目的基因构建植物表达载体,其中可用任何一种启动子例如花椰菜花叶病毒(camv)35s启动子、ubiquitin启动子或其它启动子,该表达载体中必要时可包括增强子,不论是转录增强子或翻译增强子。为了简化转化细胞的鉴定可使用选择性标记包括对抗生素抗性的酶,也可利用颜色变化(例如b-葡糖醛酸糖苷酶gus)或发光(例如荧光素酶)来识别的化合物的酶类,也可用无标记选择。所用的表达载体可使用ti质粒,ri质粒,植物病毒载体等。转化方法可用经农杆菌介导法、基因枪法、花粉管通道法或其它方法转化植物。
本发明中应用的ospin9基因来自水稻,具有适合于水稻等单子叶植物表达的优化密码子,该基因除了可应用于双子叶植物,如大豆、棉花、烟草等,更加适合于水稻、玉米、小麦等单子叶植物。
序列表
<110>南京农业大学
<120>水稻生长素运输蛋白基因ospin9的基因工程应用
<160>8
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
atgattacgggttcggaggt20
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
tcacagccccaacagaatat20
<210>3
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>3
aaggtaccatgattacgggttcggaggt28
<210>4
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>4
atactagttcacagccccaacagaatat28
<210>5
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>5
ttatggttgggatgggaca19
<210>6
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>6
agcacggcttgaatagcg18
<210>7
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>7
gatacaagatagcgtcgttctc22
<210>8
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>8
atgatgtctgcgtggacct19
- 还没有人留言评论。精彩留言会获得点赞!
- 大豆低温诱导人工合成启动子SP5及应用的制造方法与工艺
- 一种来源于虎眼万年青的尿苷-5’-二磷酸半乳糖差向异构酶,其核苷酸序列及应用的制造方法与工艺
- 一种来源于虎眼万年青的尿苷-5’-二磷酸木糖差向异构酶,其核苷酸序列及应用的制造方法与工艺
- 新的赖氨酸脱羧酶突变体及其应用的制造方法与工艺
- 一种嗜热中性蛋白酶基因、工程菌、酶及其应用的制造方法与工艺
- 一种碱性耐盐普鲁兰酶PulA及其基因和应用的制造方法与工艺
- 一种热稳定性提高的β‑淀粉酶突变体的制造方法与工艺
- 一类耐热型植酸酶突变体及其编码基因和应用的制造方法与工艺
- 含CCL5和SSTR2基因的重组痘病毒及其制备方法与流程
- 一种催化黄酮类化合物葡萄糖苷化的基因工程菌及其应用的制造方法与工艺