蛋白质OsARE1在调控植物抗低氮性中的应用的制作方法
本发明涉及生物
技术领域:
,具体涉及蛋白质osare1在调控植物抗低氮性中的应用。
背景技术:
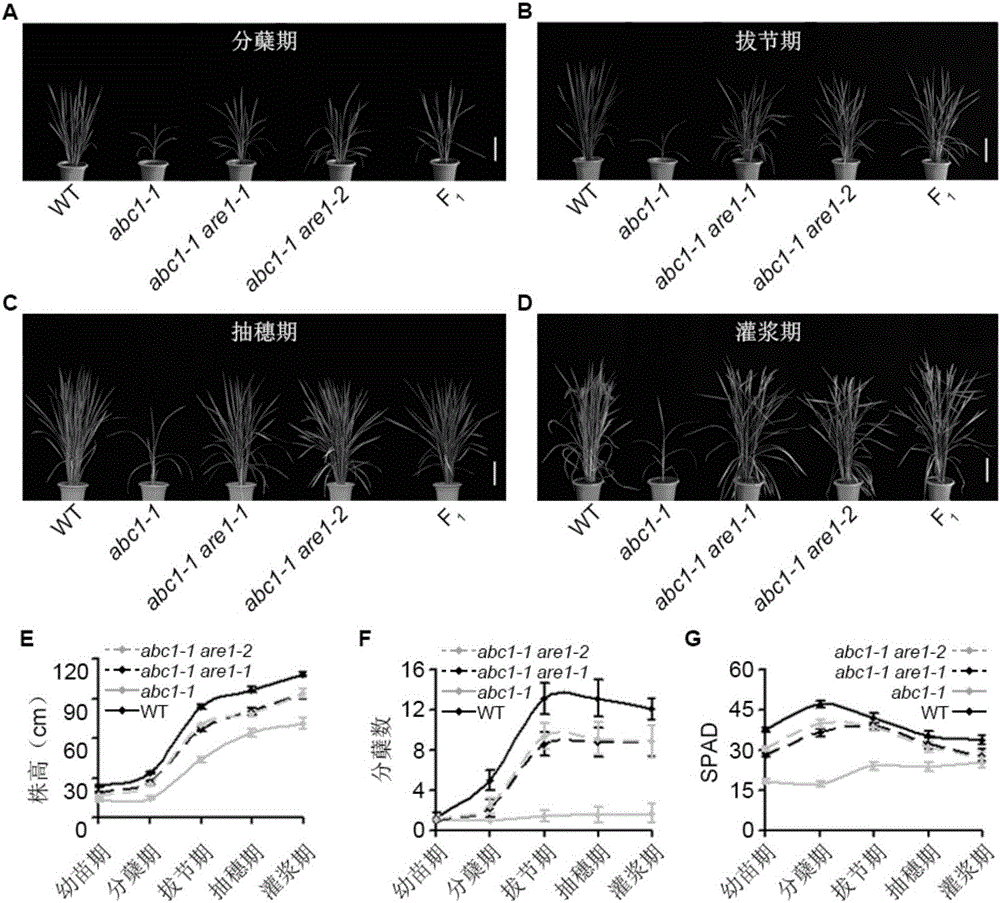
:现代农业生产的可持续发展与作物养分利用效率的改良紧密相关。氮素作为植物生长发育所必需的大量营养元素之一,对农作物产量的影响至关重要。植物氮素利用效率受遗传因子和环境因素及其互作调控,是影响农业生产可持续发展的重要因素之一,对其深入研究具有重要的理论意义和应用价值。在过去的五十多年,由于种质资源的创新、栽培管理的优化和商品化肥的使用,作物产量得到了持续提高。但是,随着人口的继续增长和消费需求的不断提高,尤其是过度依赖使用化肥而带来的增产,使得高产作物品种的产量表现及其稳定性在未来将面临更加严峻的挑战。氮元素是植物生长发育所必需的大量营养元素之一,也是影响作物产量的关键因素之一。工业革命之后,随着氮肥的大面积使用,全世界范围内农作物产量迅速增加,但同时造成农业生产成本增加、土壤养分失衡和生态环境污染等问题。因此,由包括国际水稻所在内的15个研究中心组成的国际农业研究磋商组织提出以通过改良养分利用效率而提高作物产量为目标的第二次绿色革命。提高农作物氮素利用效率是实现农业可持续发展的有效途径之一。植物氮素利用效率主要包括氮素吸收效率、氮素同化效率和氮素再利用效率等,受多种遗传因子和环境因素及其互作的调控。其中,氮素吸收效率和氮素同化效率是影响农作物氮素利用效率的两个重要因素。植物、动物和人类体内氮素的最初来源,几乎全部来自于土壤。植物从土壤中获取氮素主要包括三个过程,即氮素吸收与转运、氮素同化以及氮素再利用。一般认为,富氧型土壤中无机氮源的主要形式是硝酸根离子(no3-),而水田、湿地或酸性土壤中无机氮的主要形式是铵根离子(nh4+)。因此,生长在高ph和氧化态土壤(如旱田等富氧环境)中的植物偏好吸收no3-,而生长在低ph和还原态土壤(如沼泽或水田等缺氧环境)中的植物偏好吸nh4+或氨基酸。植物根系周围的无机氮源除具有上述异质性特征外,还呈现波动性特征(根系周围的氮浓度通常为100μm至10mm),植物因此演化出亲和性不同的氮素转运系统,即高亲和性转运系统和低亲和性转运系统。植物吸收土壤无机氮主要通过根中细胞膜上的铵根转运蛋白和硝酸根转运蛋白协同完成。水稻吸收转运无机氮源的主要形式是nh4+。此外,水稻根部通气组织能够向根系周围释放氧气,促使根表面nh4+发生硝化作用而生成no3-。因此,no3-也是水稻吸收无机氮源的一种重要形式。工业革命之后,随着商品化肥的大规模生产和使用,全球粮食产量显著增长。据估计,在未来40年,农业化肥施用量需增加近3倍才能满足持续增长的人口和消费需求。因此,提高农作物氮素利用效率(nitrogenuseefficiency,nue)是降低农业生产成本和解决消费需求的有效途径之一。植物nue受多种遗传因子和环境因素及其互作调控。nue的定义通常指单位氮肥施用量获得的植物总生物量或总产量,主要包括氮素吸收效率(nupe)、氮素同化效率(nute/nae)、氮素转运效率(nte)及氮素再利用效率(nre)等。通常来说,植物nue主要由nupe和nae决定。由于施加到土壤中的氮肥受土壤微生物活动、土壤类型以及土壤和植物损失气态氮等因素影响,很难精确计算植物可获得的氮肥总量或植物实际吸收的氮肥总量。水稻作为单子叶植物基础理论研究的模式植物,亦是人类社会重要的粮食作物,其为全世界近一半人口提供主食。氮元素是植物生长发育所必需的大量营养元素之一,是影响农作物产量及地球生态环境的主要因素之一。植物氮素利用效率是一类复杂的农艺性状,受不同遗传因子和环境因素及其互作调控,对其深入研究具有重要的理论意义与应用价值。分离鉴定植物氮素利用效率的控制基因,可为提高植物抗低氮胁迫能力及培育耐低氮胁迫作物新品种提供有效分子策略。技术实现要素:本发明所要解决的技术问题是如何调控植物的抗低氮性。为解决上述技术问题,本发明首先提供了蛋白质osare1的应用,可为如下a1)至a27)中的至少一种:a1)调控植物抗低氮性;a2)调控植物器官的氮含量;a3)调控植物茎鞘的氮含量;a4)调控植物叶片的氮含量;a5)调控植物穗的氮含量;a6)调控植物的生物量;a7)调控植物根的生物量;a8)调控植物的根冠比;a9)调控植物的叶绿素含量;a10)调控植物的株高;a11)调控植物的分蘖数;a12)调控植物的氮素吸收效率;a13)调控植物的氮素利用效率;a14)调控植物中氮素吸收标志基因的表达量;a15)调控植物中氮素同化标志基因的表达量;a16)调控植物的产量;a17)调控植物的单株产量;a18)调控植物的穗粒数;a19)调控植物的穗长;a20)调控植物的一级枝梗数;a21)调控植物的二级枝梗数;a22)调控植物中amt1;1基因的表达量;a23)调控植物中amt1;2基因的表达量;a24)调控植物中amt1;3基因的表达量;a25)调控植物中gs1;2基因的表达量;a26)调控植物中nadh-gogat1基因的表达量;a27)调控植物在低氮生长条件下对氮的吸收。所述蛋白质osare1来源于禾本科稻属粳稻亚种(oryzasatival.),全称为abc1repressor1。所述蛋白质osare1可为a1)或a2)或a3)或a4):a1)氨基酸序列是序列表中序列1所示的蛋白质;a2)在序列表中序列1所示的蛋白质的n端或/和c端连接标签得到的融合蛋白质;a3)将序列表中序列1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同生物学功能的蛋白质;a4)与序列表中序列1限定的氨基酸序列具有80%或80%以上同一性,来源于水稻且具有相同生物学功能的蛋白质。其中,序列表中序列1由427个氨基酸残基组成。为了使a1)中的蛋白质便于纯化,可在序列表中序列1所示的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。表1.标签的序列标签残基序列poly-arg5-6(通常为5个)rrrrrpoly-his2-10(通常为6个)hhhhhhflag8dykddddkstrep-tagii8wshpqfekc-myc10eqkliseedl上述a3)中的蛋白质,所述一个或几个氨基酸残基的取代和/或缺失和/或添加为不超过10个氨基酸残基的取代和/或缺失和/或添加。上述a3)中的蛋白质,均可人工合成,也可先合成其编码基因,再进行生物表达得到。上述a3)中的蛋白质的编码基因可通过将序列表中序列2自5′末端第467-1750位所示的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′末端和/或3′末端连上表1所示的标签的编码序列得到。编码所述蛋白质osare1的核酸分子的应用也属于本发明的保护范围;编码所述蛋白质osare1的核酸分子的应用可为如下a1)至a27)中的至少一种:a1)调控植物抗低氮性;a2)调控植物器官的氮含量;a3)调控植物茎鞘的氮含量;a4)调控植物叶片的氮含量;a5)调控植物穗的氮含量;a6)调控植物的生物量;a7)调控植物根的生物量;a8)调控植物的根冠比;a9)调控植物的叶绿素含量;a10)调控植物的株高;a11)调控植物的分蘖数;a12)调控植物的氮素吸收效率;a13)调控植物的氮素利用效率;a14)调控植物中氮素吸收标志基因的表达量;a15)调控植物中氮素同化标志基因的表达量;a16)调控植物的产量;a17)调控植物的单株产量;a18)调控植物的穗粒数;a19)调控植物的穗长;a20)调控植物的一级枝梗数;a21)调控植物的二级枝梗数;a22)调控植物中amt1;1基因的表达量;a23)调控植物中amt1;2基因的表达量;a24)调控植物中amt1;3基因的表达量;a25)调控植物中gs1;2基因的表达量;a26)调控植物中nadh-gogat1基因的表达量;a27)调控植物在低氮生长条件下对氮的吸收。上述应用中,所述编码所述蛋白质osare1的核酸分子可为如下b1)或b2)或b3)或b4)或b5)所示的dna分子:b1)核苷酸序列是序列表中序列2所示的dna分子;b2)核苷酸序列是序列表中序列3所示的dna分子;b3)编码区如序列表中序列2自5′末端起第467-1750位所示的dna分子;b4)与b1)或b2)或b3)限定的核苷酸序列具有90%或90%以上同一性,来源于水稻且编码所述蛋白质osare1的dna分子;b5)在严格条件下与b1)或b2)或b3)限定的核苷酸序列杂交,且编码所述蛋白质osare1的dna分子。其中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。所述核酸分子可为编码所述蛋白质osare1的基因及其调控序列形成的核酸分子。序列表中序列2由2640个核苷酸组成,序列表中序列2自5′末端第467-1750位所示的核苷酸序列编码序列表中序列1所示的氨基酸序列。序列表中序列3所示的核苷酸序列是cdna(序列表中序列2所示)的基因组dna。序列表中序列3由7229个碱基组成,序列表中序列3中,自5′末端起第1至1810位为启动子区,第1811至2276位为5′utr区,第6340至7229位为3′utr区,第2277至2883位为第一个外显子,第2884至3476位为第一个内含子,第3477至3564位为第二个外显子,第3565至3800位为第二个内含子,第3801至3972位为第三个外显子,第3973至4116位为第三个内含子,第4117至4232位为第四个外显子,第4233至4722位为第四个内含子,第4723至4820位为第五个外显子,第4821至5692位为第五个内含子,第5693至5828位为第六个外显子,第5829至6272位为第六个内含子,第6273至6339位为第七个外显子。本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码蛋白质osare1的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明的蛋白质osare1的核苷酸序列90%或者更高同一性的核苷酸,只要编码蛋白质osare1且来源于水稻,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码蛋白质osare1的核苷酸序列具有90%或更高,或95%或更高同一性的核苷酸序列。所述编码所述蛋白质osare1的核酸分子既可为osare1基因的cdna序列,也可为osare1基因的基因组基因序列;与osare1基因具有90%以上同一性且编码蛋白质osare1的dna序列,是将osare1基因的cdna用已知的方法进行分离和/或修饰和/或设计得到的。本领域的技术人员应该理解,特定基因序列中核苷酸同一性的微小改变可能会导致该基因效能的降低或者加强,而且在一些应用(例如,反义或共抑制技术)中,部分序列经常会和全长序列同样有效的发挥作用。基因序列变化或缩短的方法,以及测试这些发生变异的基因的有效性的方法均是本领域技术人员熟知的。本发明还提供了的培育转基因植物的方法。本发明所提供的培育转基因植物的方法,具体可为方法一,可包括向出发植物甲中导入提高所述蛋白质osare1的含量和/或活性的物质,得到转基因植物甲的步骤;所述转基因植物甲与所述出发植物甲相比植物抗低氮性降低和/或植物器官的氮含量降低和/或植物茎鞘的氮含量降低和/或植物叶片的氮含量降低和/或植物穗的氮含量降低和/或植物的生物量降低和/或植物根的生物量降低和/或植物的根冠比降低和/或植物的叶绿素含量降低和/或植物的株高降低和/或植物的分蘖数降低和/或植物的氮素吸收效率降低和/或植物的氮素利用效率降低和/或植物中氮素吸收标志基因的表达量降低和/或植物中氮素同化标志基因的表达量降低和/或植物的产量降低和/或植物的单株产量降低和/或植物的穗粒数降低和/或植物的穗长降低和/或植物的一级枝梗数降低和/或植物的二级枝梗数降低和/或植物中amt1;1基因的表达量降低和/或植物中amt1;2基因的表达量降低和/或植物中amt1;3基因的表达量降低和/或植物中gs1;2基因的表达量降低和/或植物中nadh-gogat1基因的表达量降低和/或植物在低氮生长条件下对氮的吸收降低。上述方法一中,所述“提高所述蛋白质osare1的含量和/或活性”可通过多拷贝、改变启动子、调控因子、转基因等本领域熟知的方法,达到表达或过量表达所述蛋白质、或提高所述蛋白质的活性的效果。上述方法一中,所述“向出发植物甲中导入提高所述蛋白质osare1的含量和/或活性的物质”具体可为向出发植物甲中导入编码所述蛋白质osare1的核酸分子。上述方法一中,所述“向出发植物甲中导入编码所述蛋白质osare1的核酸分子”通过重组表达载体导入所述出发植物甲;所述重组表达载体具体可为实施例提及的osare1基因过量表达载体或osare1互补载体。本发明所提供的培育转基因植物的方法,具体可为方法二,可包括向出发植物乙中导入抑制所述蛋白质osare1的含量和/或活性的物质,得到转基因植物乙的步骤;所述转基因植物乙与所述出发植物乙相比植物抗低氮性增加和/或植物器官的氮含量增加和/或植物茎鞘的氮含量增加和/或植物叶片的氮含量增加和/或植物穗的氮含量增加和/或植物的生物量增加和/或植物根的生物量增加和/或植物的根冠比增加和/或植物的叶绿素含量增加和/或植物的株高增加和/或植物的分蘖数增加和/或植物的氮素吸收效率增加和/或植物的氮素利用效率增加和/或植物中氮素吸收标志基因的表达量增加和/或植物中氮素同化标志基因的表达量增加和/或植物的产量增加和/或植物的单株产量增加和/或植物的穗粒数增加和/或植物的穗长增加和/或植物的一级枝梗数增加和/或植物的二级枝梗数增加和/或植物中amt1;1基因的表达量增加和/或植物中amt1;2基因的表达量增加和/或植物中amt1;3基因的表达量增加和/或植物中gs1;2基因的表达量增加和/或植物中nadh-gogat1基因的表达量增加和/或植物在低氮生长条件下对氮的吸收增加。上述方法二中,所述“抑制所述蛋白质osare1的含量和/或活性”可通过rna干扰、同源重组、基因定点编辑等本领域熟知的方法,达到抑制所述蛋白质的表达量和/或活性的目的。上述方法二中,所述“抑制所述蛋白质osare1的含量和/或活性的物质”可为特异rna分子;所述特异rna分子如式(i)所示:a反向-y-a正向(i);所述a正向的序列为编码所述蛋白质osare1的基因中的200-500bpdna片段转录得到的单链rna分子;所述a反向的序列与所述a正向的序列反向互补;所述y是所述a正向与所述a反向之间的间隔序列,在序列上,所述y与所述a正向及所述a反向均不互补。上述方法二中,所述“在出发植物乙中导入特异rna分子”的实现方法可如下:将特异dna分子甲导入出发植物乙;所述特异dna分子甲如式(ii)所示:seq反向-x-seq正向(ii);所述seq正向的序列为编码所述蛋白质osare1的基因中的200-500bpdna片段;所述seq反向的序列与所述seq正向的序列反向互补;所述x是所述seq正向与所述seq反向之间的间隔序列,在序列上,所述x与所述seq正向及所述seq反向均不互补。上述方法二中,所述特异dna分子甲通过重组表达载体导入所述出发植物乙;所述重组表达载体为将序列表中的序列5第14至1138位所示的dna分子插入ptck303载体的saci和bamhi识别位点之间得到的重组表达载体。上述方法二中,所述“抑制所述蛋白质osare1的含量和/或活性的物质”可为植物基因组编辑的载体;所述植物基因组编辑的载体含有grna编码基因;所述grna在植物中识别的靶标dna为编码蛋白质osare1的dna片段。上述方法二中,所述grna编码基因是序列表中序列2自5′末端起第552-570位和/或第1094-1112位所示的dna分子。本发明所提供的培育转基因植物的方法,具体可为方法三,包括将通过上述方法一或上述方法二获得的转基因植物与待改良植物杂交,得到后代转基因植物的步骤;所述后代转基因植物与所述转基因植物(即作为亲本的转基因植物)表型基本一致。本发明还保护特异rna分子、特异dna分子、特异重组质粒或植物基因组编辑的载体。所述特异rna分子如式(i)所示:a反向-y-a正向(i);所述a正向的序列为编码所述蛋白质osare1的基因中的200-500bpdna片段转录得到的单链rna分子;所述a反向的序列与所述a正向的序列反向互补;所述y是所述a正向与所述a反向之间的间隔序列,在序列上,所述y与所述a正向及所述a反向均不互补。所述特异dna分子可为特异dna分子甲或特异dna分子乙。所述特异dna分子甲如式(ii)所示:seq反向-x-seq正向(ii);所述seq正向的序列为编码所述蛋白质osare1的基因中的200-500bpdna片段;所述seq反向的序列与所述seq正向的序列反向互补;所述x是所述seq正向与所述seq反向之间的间隔序列,在序列上,所述x与所述seq正向及所述seq反向均不互补。所述特异dna分子乙可包括dna片段一、间隔序列和dna片段二;所述dna片段一的序列为编码所述蛋白质osare1的基因中的200-500bpdna片段;所述dna片段二与所述dna片段一的序列反向互补。所述特异重组质粒可为含有所述特异dna分子的重组质粒。所述植物基因组编辑的载体可含有grna编码基因;所述grna在植物中识别的靶标dna为编码蛋白质osare1的dna片段。上述任一所述a正向的序列可为编码所述蛋白质osare1的基因中5’utr区或3’utr区的200-500bpdna片段转录得到的单链rna分子。上述任一所述seq正向的序列或上述任一所述dna片段一的序列可为编码所述蛋白质osare1的基因中5′utr区或3′utr区的200-500bpdna片段。所述5′utr区的核苷酸序列可如序列表中序列2自5′末端起第1至466位所示。所述3′utr区的核苷酸序列可如序列表中序列2自5′末端起第1751至2640位所示。上述任一所述特异rna分子中,所述a正向的序列具体可为序列表中序列4自5′末端起第840至1138位所示。其中,序列表中序列2自5′末端第567至865位核苷酸序列转录出序列表中序列4自5′末端第840至1138位核苷酸。上述任一所述seq正向的序列或上述任一所述dna片段一的序列具体可为序列表中序列5自5′末端起第840至1138位所示。其中,序列表中序列2自5′末端第567至865位核苷酸序列为序列表中序列5自5′末端第840至1138位核苷酸。上述任一所述seq反向的序列或上述任一所述dna片段二的序列具体可为序列表中序列5自5′末端起第14至312位所示。上述任一所述间隔序列的核苷酸序列可如序列表中的序列5自5′末端起第313至839位所示。上述任一所述特异dna分子甲或上述任一所述特异dna分子乙的核苷酸序列可为如下s1)或s2)或s3)或s4)所示的dna分子:s1)核苷酸序列是序列表中的序列5自5′末端起第14至1138位所示的dna分子;s2)核苷酸序列是序列表中序列5所示的dna分子;s3)与s1)或s2)限定的核苷酸序列具有70%或70%以上同一性,来源于水稻且且具有相同生物学功能的dna分子;s4)在严格条件下与s1)或s2)限定的核苷酸序列杂交,来源于水稻且且具有相同生物学功能的dna分子。上述任一所述植物基因组编辑的载体中,所述grna编码基因可为序列表中序列2自5′末端起第552-570位和/或第1094-1112位所示的dna分子。上述任一所述植物基因组编辑的载体具体可为osare1基因敲除载体。所述osare1基因敲除载体为将序列表中序列2自5′末端起第552至570位和/或第1094至1112位所示的dna分子插入pylcrispr/cas9-mh载体bsai识别位点得到的重组表达载体。osare1基因敲除载体特异识别序列表中序列3自5′末端起第2362至2380位和/或第3497至3515位所示的dna分子。上述任一所述特异rna分子、上述任一所述特异dna分子、上述任一特异重组质粒、或上述任一所述植物基因组编辑的载体在培育抗低氮性增加和/或器官的氮含量增加和/或茎鞘的氮含量增加和/或叶片的氮含量增加和/或穗的氮含量增加和/或生物量增加和/或根的生物量增加和/或根冠比增加和/或叶绿素含量增加和/或株高增加和/或分蘖数增加和/或氮素吸收效率增加和/或氮素利用效率增加和/或氮素吸收标志基因的表达量增加和/或氮素同化标志基因的表达量增加和/或产量增加和/或单株产量增加和/或穗粒数增加和/或穗长增加和/或一级枝梗数增加和/或二级枝梗数增加和/或amt1;1基因的表达量增加和/或amt1;2基因的表达量增加和/或amt1;3基因的表达量增加和/或gs1;2基因的表达量增加和/或nadh-gogat1基因的表达量增加和/或在低氮生长条件下对氮的吸收增加的转基因植物中的应用也属于本发明的保护范围。本发明还保护植物育种方法一或植物育种方法二:所述植物育种方法一,可包括如下步骤:增加植物中所述蛋白质osare1的含量和/或活性,从而植物抗低氮性降低和/或植物器官的氮含量降低和/或植物茎鞘的氮含量降低和/或植物叶片的氮含量降低和/或植物穗的氮含量降低和/或植物的生物量降低和/或植物根的生物量降低和/或植物的根冠比降低和/或植物的叶绿素含量降低和/或植物的株高降低和/或植物的分蘖数降低和/或植物的氮素吸收效率降低和/或植物的氮素利用效率降低和/或植物中氮素吸收标志基因的表达量降低和/或植物中氮素同化标志基因的表达量降低和/或植物的产量降低和/或植物的单株产量降低和/或植物的穗粒数降低和/或植物的穗长降低和/或植物的一级枝梗数降低和/或植物的二级枝梗数降低和/或植物中amt1;1基因的表达量降低和/或植物中amt1;2基因的表达量降低和/或植物中amt1;3基因的表达量降低和/或植物中gs1;2基因的表达量降低和/或植物中nadh-gogat1基因的表达量降低和/或植物在低氮生长条件下对氮的吸收降低。所述植物育种方法二,可包括如下步骤:降低植物中所述蛋白质osare1的含量和/或活性,从而植物抗低氮性增加和/或植物器官的氮含量增加和/或植物茎鞘的氮含量增加和/或植物叶片的氮含量增加和/或植物穗的氮含量增加和/或植物的生物量增加和/或植物根的生物量增加和/或植物的根冠比增加和/或植物的叶绿素含量增加和/或植物的株高增加和/或植物的分蘖数增加和/或植物的氮素吸收效率增加和/或植物的氮素利用效率增加和/或植物中氮素吸收标志基因的表达量增加和/或植物中氮素同化标志基因的表达量增加和/或植物的产量增加和/或植物的单株产量增加和/或植物的穗粒数增加和/或植物的穗长增加和/或植物的一级枝梗数增加和/或植物的二级枝梗数增加和/或植物中amt1;1基因的表达量增加和/或植物中amt1;2基因的表达量增加和/或植物中amt1;3基因的表达量增加和/或植物中gs1;2基因的表达量增加和/或植物中nadh-gogat1基因的表达量增加和/或植物在低氮生长条件下对氮的吸收增加。上述任一所述植物的生物量为植物的鲜重。上述任一所述植物根的生物量为植物根的鲜重。上述任一所述植物可为如下c1)至c9)中的任一种:c1)双子叶植物;c2)单子叶植物;c3)禾本科植物;c4)水稻;c5)水稻品种日本晴;c6)水稻品种南京6号;c7)水稻品种明恢63号;c8)水稻品种空育131;c9)水稻品种黄华占。上述任一所述低氮具体可为氮含量低于120kg/ha(如120kg/ha、60kg/ha或0kg/ha)。上述任一所述低氮生长条件为氮含量低于120kg/ha(如120kg/ha、60kg/ha或0kg/ha)的生长条件。以蛋白质osare1或其编码基因作为rna干扰靶点而培育抗低氮胁迫转基因植物的应用也属于本发明保护的范围。携带有本发明osare1基因或其它同源序列的植物表达载体可通过使用原生质体-化学介导法(ca2+、peg)、ti质粒、ri质粒、植物病毒载体、直接dna转化、花粉管、微注射、电激、基因枪、农杆菌介导等常规生物学方法中的任一一种或几种方法的组合转化植物细胞、组织或器官,并将转化的植物细胞、组织或器官培育成植株;所述组织和器官可包括宿主植物的果荚、愈伤组织、茎尖、叶片和种子等。转基因植株对低氮胁迫抗性的改变包括植物体内氮代谢通路标志基因(包括氮素吸收标志基因amt和氮素同化标志基因gs/gogat等)和不同器官(包括茎鞘、叶片和穗等)中氮素含量的提高或降低,以及植物氮素调控性状(包括植株生物量、根生物量、根冠比、叶绿素含量、株高、分蘖数、单株产量、穗粒数、一级枝梗数和二级枝梗数等)的改变。上述任一所述双子叶植物还可为拟南芥、油菜、花生、棉花、大豆、向日葵、棕榈树、橄榄树、蓖麻、马铃薯或烟草。上述任一所述单子叶植物还可为玉米、小麦、大麦、燕麦、黑麦、高梁或草坪草。实验证明,蛋白质osare1负调控植物对低氮胁迫的抗性,过量表达osare1基因降低植物对低氮胁迫的抗性,下调表达或敲除osare1基因提高植物对低氮胁迫的抗性。are1-1位点是改良水稻抗低氮胁迫的有效位点。利用植物基因工程技术对osare1基因进行定点改造,为培育抗低氮胁迫作物新品种提供了有效分子策略。附图说明图1为abc1-1are1双突变体的遗传筛选;a为水稻在分蘖期的表型(标尺为15cm);b为水稻在拔节期的表型(标尺为15cm);c为水稻在抽穗期的表型(标尺为15cm);d为水稻在灌浆期的表型(标尺为15cm);e为水稻分别在幼苗期、分蘖期、拔节期、抽穗期和灌浆期时株高的定量分析;f为水稻分别在幼苗期、分蘖期、拔节期、抽穗期和灌浆期时分蘖数的定量分析;g为水稻分别在幼苗期、分蘖期、拔节期、抽穗期和灌浆期时顶层叶片相对叶绿素含量(spad)的定量分析;e、f和g中数值均表示平均值±标准偏差,每个生育时期的样本容量为50株植物;wt为野生型水稻(水稻品种日本晴),abc1-1为abc1-1突变体,abc1-1are1-1为abc1-1are1-1双突变体,abc1-1are1-2为abc1-1are1-2双突变体,f1为abc1-1are1-1双突变体与abc1-1are1-2双突变体杂交获得的杂种f1代植物。图2为are1-1单突变体的表型分析;a-e为水稻分别在幼苗期、分蘖期、拔节期、抽穗期和成熟期时植株的表型(标尺为15cm);f为水稻开花后0-60d旗叶中相对叶绿素含量(spad)的定量分析,数值表示平均值±标准偏差,样本容量为40株植物;g为水稻在成熟期株高的定量分析,数值表示平均值±标准偏差,样本容量为40株植物;h为水稻主穗粒数的定量分析,数值表示平均值±标准偏差,样本容量为40株植物;i为水稻种子中谷蛋白含量的定量分析,数值表示平均值±标准偏差,由3次技术重复结果统计而来,每个样品包含20粒种子;j为水稻种子中醇溶蛋白含量的定量分析,数值表示平均值±标准偏差,由3次技术重复结果统计而来,每个样品包含20粒种子;**表示在t测验中二者差异达到极显著性水平(p<0.01);wt为野生型水稻(水稻品种日本晴),are1-1为are1-1单突变体。图3为are1-1单突变体对低氮胁迫的抗性分析;a为水稻在正常(+nh4no3)和缺氮(-nh4no3)生长条件下生长20d后根重的定量分析;数值表示平均值±标准偏差,样本容量为40株植物;b为水稻在正常(+nh4no3)和缺氮(+nh4no3)生长条件下生长20d后根冠比的定量分析;数值表示平均值±标准偏差,样本容量为40株植物;c为水稻在正常(+nh4no3)和缺氮(+nh4no3)生长条件下生长20d、25d和30d后第一片真叶的表型分析(标尺为1cm);d为c中叶片叶绿素含量的定量分析,数值表示平均值±标准偏差,样本容量为12株植物;e-i为水稻在正常(300kg/ha)和低氮(120kg/ha)生长条件下的根中氮素吸收标志基因osamt1;1、osamt1;2和osamt1;3以及氮素同化标志基因osgs1;2和osnadh-gogat1表达量的定量分析。具体步骤为:将水稻分别种植在正常生长条件(尿素施用量为300kg/ha)和低氮生长条件(尿素施用量为120kg/ha)下,移栽50天后,取新鲜不定根检测上述氮代谢相关标记基因表达量。数值表示平均值±标准偏差,由3次技术重复结果统计而来,每个样品包含3株植物;j和k为水稻在不同施氮水平条件下氮素吸收效率(nupe)和氮素利用效率(nue)的定量分析。具体步骤为:采用凯氏定氮法测定水稻茎鞘、叶片和穗中总氮含量;nupe由穗含氮总量与外源施氮量比值计算而来,而nue由小区总产量与外源施氮量比值计算而来;数值均表示平均值±标准偏差,由3次独立的生物重复结果统计而来,每个样品包含6株植物;*和**分别表示在t测验中二者差异达到显著水平(p<0.05)和极显著性水平(p<0.01);正常生长条件的水培营养液包含1.46mmnh4no3,而缺氮生长条件下的水培营养液不包含任何氮源;wt为野生型水稻(水稻品种日本晴),are1-1为are1-1单突变体。图4为are1-1单突变体在不同施氮水平条件下的氮素调控性状分析;a为水稻在不同施氮水平条件下的成熟期田间照片;b为水稻在不同施氮水平条件下的成熟期植株表型(标尺为15cm);c-j为水稻在2014年田间氮肥试验旗叶相对叶绿素含量(spad)、株高、分蘖数、主穗长、一级枝梗数、二级枝梗数、主穗粒数和千粒重的定量分析,数值均表示平均值±标准偏差,样本容量为40株植物。k-n为水稻在不同施氮水平条件下的连续4年小区产量的统计分析;每个小区包含200株植物。数值均表示平均值±标准偏差,由3-5个生物学重复统计而来。*和**分别表示在t测验中二者差异达到显著水平(p<0.05)和极显著性水平(p<0.01);wt为野生型水稻(水稻品种日本晴),are1-1为are1-1单突变体。图5为osare1基因的图位克隆;a为利用水稻籼稻品种明恢63号和南京6号分别与abc1-1are1-1双突变体构建的f2遗传定位群体中170棵交换单株,osare1基因被初步定位于水稻第8号染色体(chr.8)短臂的两个ssr分子标记rm3374和rm3481之间;n代表交换单株的数目;b为利用扩大的f2定位群体中分离的1233棵交换单株,osare1基因被进一步精细定位在两个snp分子标记m79和m81之间约410kb区间内;直线下的数字表示osare1基因与该分子标记之间交换单株的数目;c为osare1基因精细定位区间内13个候选基因的相对位置和方向;黑色箭头指示osare1基因所在位置和方向;d为osare1基因编码区简图;黑色方框表示外显子,细线表示内含子;黑色三角形符号指示are1-1突变体中osare1基因发生单核苷酸缺失突变的突变位点,灰色三角形符号指示are1-2突变体中osare1基因发生单核苷酸替换突变的突变位点。图6为osare1基因的遗传互补分析;a为水稻在灌浆期的表型(标尺为15cm);b为水稻在成熟期的表型(标尺为15cm);c为b中植株旗叶中部的表型(标尺为2cm);d为水稻开花后0-60d旗叶中相对叶绿素含量(spad)的定量分析,数值表示平均值±标准偏差,每个时间点样本容量为40株植物;wt为野生型水稻,abc1-1为abc1-1突变体,are1-1为are1-1单突变体,abc1-1are1-1为abc1-1are1-1双突变体,a中的pare1为将osare1基因全长序列转入abc1-1are1-1双突变体得到的t1代转基因植物,b、c和d中的pare1为将osare1基因全长序列转入are1-1单突变体得到的t1代转基因植物。图7为osare1转基因植物对低氮胁迫的抗性分析;a为水稻品种日本晴(wt)、abc1-1突变体、abc1-1are1-1双突变体和abc1-1突变体背景的3个独立的t1代osare1基因沉默植物(#29、#10和#34)在蜡熟期的表型(标尺为15cm);b为a中植物旗叶中osare1基因相对表达量的定量分析,数值表示平均值±标准偏差,由3次技术重复结果统计而来,每个样品包含6株植物;c为a中植物株高的定量分析;d为a中植物旗叶中相对叶绿素含量(spad)的定量分析;e为低氮生长条件下(尿素施用量为180kg/ha)的水稻品种日本晴和3个独立的t1代osare1基因沉默的日本晴(#1、#37和#24)在蜡熟期的表型(标尺为15cm);f为e中植物旗叶中osare1基因相对表达量的定量分析,数值表示平均值±标准偏差,由3次技术重复结果统计而来,每个样品包含6株植物;g为e中植物株高的定量分析;h为e中植物单株产量的定量分析;i为水稻品种日本晴和3个独立的t1代转osare1基因的日本晴(#55、#77和#36)在蜡熟期的表型(标尺为15cm);j为i中植物旗叶中osare1基因相对表达量的定量分析,数值表示平均值±标准偏差,由3次技术重复结果统计而来,每个样品包含6株植物;k为i中植物株高的定量分析;l为i中植物单株产量的定量分析;c、d、g、h、k和l中数值均表示平均值±标准偏差,样本容量为30-40株植物。b-d、f-h及j-l中**表示在t测验中二者差异达到极显著性水平(p<0.01)。图8为osare1基因敲除植物对低氮胁迫的抗性分析;a为osare1基因经crispr/cas9系统敲除产生的5种等位变异形式分析;本发明的发明人分别选取osare1基因的两个目标序列进行基因编辑,目标序列1为自5′末端第94至111位核苷酸,目标序列2为自5′末端第622至649位核苷酸(转录起始位点被视为+1);灰色字体指示插入突变,灰色圆点指示缺失突变;b携带a中不同osare1基因型的黄华占植物在高氮(尿素施用量为240kg/ha)和低氮(尿素施用量为150kg/ha)生长条件下的成熟期的表型(标尺为15cm);c-f为b中植物株高、旗叶中相对叶绿素含量(spad)、主穗粒数和单株产量的定量分析;数值均表示平均值±标准偏差,样本容量为30株植物;*和**分别表示在t测验中二者差异达到显著性水平(p<0.05)和极显著性水平(p<0.01)。图9为are1-1片段代换系植物对低氮胁迫的抗性分析;a为明恢63号(mh63)和明恢63号遗传背景的are1-1片段代换系(mh63are1-1)植物在不同施氮水平条件下的植物表型(标尺为15cm);b-e为a中植物在蜡熟期的株高、旗叶中相对叶绿素含量(spad)、主穗粒数和单株产量的定量分析;f为空育131(ky131)和空育131遗传背景的are1-1片段代换系(ky131are1-1)植物在不同施氮水平条件下的植物表型(标尺为15cm);g和h为f中植物在蜡熟期时旗叶中相对叶绿素含量(spad)和主穗粒数的定量分析;b-e、g和h中数值均表示平均值±标准偏差,样本容量为30株植物;*和**分别表示在t测验中二者差异达到显著性水平(p<0.05)和极显著性水平(p<0.01)。具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中涉及的引物的信息见表2,第1列为引物名称,第2列为引物的核苷酸序列,第3列为在实施例中的用途。表2实施例1、abc1-1are1双突变体的遗传筛选本发明的发明人通过化学诱变水稻品种日本晴(nipponbare,npb),筛选到一个细胞分裂素响应异常的突变体,并将其命名为abnormalcytokininreponse1突变体(abc1-1突变体)(yangetal.,2016)。abc1基因编码一个叶绿体定位的fd-gogat蛋白,是催化氮素同化过程的一个关键酶。abc1-1突变体具有明显的生长发育缺陷表型,包括植株矮化、分蘖数减少及叶片黄化等氮同化异常表型。本发明的发明人进一步筛选到了abc1-1突变体的抑制突变abc1-1repressors(are突变)。在分离鉴定的系列abc1-1are双突变体中,有2个双突变体表型相似。将这2个双突变体分别与abc1-1突变体回交3次,表型分析发现bc2f2群体中仍然分离出稳定的abc1-1表型部分恢复突变体。对这2个双突变体进行等位分析发现,不同生长发育时期的杂种f1代植物均不能互补abc1-1突变体表型(图1中a、b、c和d),表明它们是同一个基因的两个等位变异造成的,因此我们将其分别命名为abc1-1are1-1双突变体和abc1-1are1-2双突变体。本发明的发明人通过连续多年多点的田间表型分析实验证明:在水稻整个生命周期中,abc1-1are1双突变体均能够部分地恢复abc1-1突变体包括株高降低、分蘖数减少和叶绿素含量降低等氮代谢异常表型(图1中e、f和g)。由此可知,are1突变部分抑制abc1-1突变体氮同化异常表型,暗示are1突变可能增强水稻耐低氮胁迫能力。实施例2、are1-1单突变体的表型分析为了获得are1单突变体,本发明的发明人将abc1-1are1-1双突变体和abc1-1are1-2双突变体分别与水稻品种日本晴回交3次,得到bc2f2分离群体。然后对bc2f2分离群体进行表型分析,获得are1-1单突变体和are1-2单突变体。are1-1单突变体和are1-2单突变体具有相似的表型,本发明选取are1-1单突变体进行后续代表性实验分析。在正常生长条件下,与水稻品种日本晴相比,are1-1单突变体在营养生长阶段不具有明显的表型差异(图2中a、b和c),are1-1单突变体抽穗期推迟大约3至5d,具有明显的晚衰表型(图2中d、e和f),are1-1单突变体旗叶叶绿素含量在抽穗后35d增加近一倍(图2中f),进入抽穗期后,are1-1单突变体株高逐渐增加(图2中d、e和g),穗粒数显著增加(图2中e和h)。此外,与水稻品种日本晴相比,are1-1单突变体种子大小没有发生显著变化,但种子主要储存蛋白谷蛋白和醇溶蛋白含量显著增加(图2中i和j)。上述分析结果表明,are1-1突变改良了水稻系列氮素调控性状,are1-1突变可能具有耐低氮胁迫的生物学功能。实施例3、are1-1单突变体对低氮胁迫的抗性分析为明确are1-1突变是否改变水稻对低氮胁迫的耐受性,本发明的发明人分析了are1-1单突变体在低氮生长条件下的表型。为了应对环境养分缺乏造成的生长抑制,植物演化出各种应对策略以维持正常的生命活动,其中包括增加低氮生长条件下的根冠比。分别将are1-1单突变体和水稻野生型品种日本晴种植在正常生长条件和缺氮生长条件下,第20d时统计根重和和根冠比,第20d时、第25d时和第30d时观察第一片真叶的表型并检测叶片中叶绿素含量。结果表明,在缺氮生长条件下,与水稻品种日本晴相比,are1-1单突变体根重增加(图3中a),根冠比增加(图3中b),are1-1单突变体叶片中叶绿素含量显著提高(图3中c和d),表明are1-1单突变体对氮饥饿处理具有较高的抗性。本发明的发明人还采用凯氏定氮法测定了不同施氮水平条件下水稻品种日本晴与are1-1单突变体不同器官(包括茎鞘、叶片和穗)中的氮素含量。实验结果由3次生物学重复统计而来,每个生物学重复包含6株植物。结果表明(表3),在不同施氮水平条件下,are1-1单突变体不同器官氮素含量均高于水稻品种日本晴,且在低氮生长条件下增加比例更加明显,表明are1-1突变增强水稻利用氮素的能力。根据不同器官氮素含量计算出氮素吸收效率(nupe)和氮素利用效率(nue)。结果表明,are1-1单突变体在低氮生长条件下的nupe和nue均显著高于水稻品种日本晴(图3中j和k)。相应地,在低氮生长条件下,are1-1单突变体根中氮素吸收标志基因osamt1;1、osamt1;2和osamt1;3及同化标志基因osgs1;2和osnadh-gogat1表达量均增加(图3中e、f、g、h和i)。上述结果表明,are1-1突变增强水稻对低氮胁迫的抗性,增强的氮素吸收效率是are1-1单突变体耐低氮生长条件的原因之一。表3实施例4、are1-1突变体在不同施氮水平条件下的氮素调控性状分析上述实验结果表明,are1-1突变增强水稻对低氮胁迫的抗性,暗示are1-1单突变体在低氮生长条件下可能具有一定的生长优势。因此,采用随机区组设计方案,本发明的发明人进行了连续四年(2013-2016年)的田间氮肥试验,以分析are1-1单突变体在不同施氮水平条件下的氮素调控性状,侧重分析产量相关农艺性状。选用尿素作为唯一氮源,分别设置300kg/ha、240kg/ha、180kg/ha、120kg/ha、60kg/ha和0kg/ha六个处理浓度。在水稻幼苗期、分蘖期和孕穗期,每个处理分别按30%、40%和30%的尿素总量施用氮肥。选用硫酸钾和重过磷酸钙作为钾肥和磷肥的唯一来源,并按30kg/ha纯钾和120kg/ha纯磷标准于秧苗移栽期等量施用。水稻品种日本晴和are1-1单突变体分别等量对角种植于3.8-4.0×4.0m的小区内,株距×行距为25×25cm(图4中a)。在营养生长阶段,are1-1单突变体与水稻品种日本晴相比,未表现出明显的表型差异。抽穗后,are1-1单突变体在不同施氮水平条件下均具有明显的晚衰表型(图4中a和b),这伴随着灌浆期间有效光合能力的增强(图4中c)和氮素利用效率的增加(图3中k)。与水稻品种日本晴相比,虽然are1-1单突变体株高和分蘖数略有变化(图4中d和e),但其穗长、一级枝梗数和二级枝梗数增加,且在低氮生长条件下增加更加明显(图4中f、g和h)。相应地,are1-1单突变体穗粒数显著增加(图4中i)。然而,are1-1单突变体种子千粒重略有降低(图4中j)。最终,小区产量测定结果表明,在40%-60%的正常施氮水平条件下,are1-1单突变体增产约10%-20%(图4中k、l、m和n),且在该施氮水平条件下,are1-1单突变体与水稻品种日本晴的nupe和nue差异尤为显著(图3中j和k)。此外,当氮肥施用量降低为正常施肥量一半左右时,are1-1单突变体产量与水稻品种日本晴在正常施氮水平条件下的产量相当(图4中k、l、m和n)。上述结果表明,are1-1突变改良了水稻品种日本晴在低氮胁迫条件下的氮素调控性状,are1-1单突变体为选育抗低氮胁迫水稻品种提供了理想的遗传材料。实施例5、osare1基因的图位克隆为了确定are1-1突变的性质,本发明的发明人将are1-1单突变体与水稻品种日本晴进行回交分析。回交获得的18株杂种f1代植物全部表现为水稻品种日本晴的表型,具有正常和晚衰表型的植物在f2群体中呈现出接近3:1的表型分离比(561:196=2.86:1;χ2c<χ20.05=3.84)。由此可见,are1-1单突变体是由单个核基因的隐性突变造成。本发明的发明人采用图位克隆方法分离鉴定候选的osare1基因。利用abc1-1are1-1双突变体与水稻籼稻品种明恢63号和南京6号分别构建了遗传作图群体。以叶片晚衰表型作为挑选指标,利用f2分离群体中170棵具有类似abc1-1are1-1双突变体晚衰表型的交换单株,osare1基因被初步定位在第8号染色体短臂的两个ssr分子标记rm3374与rm3481之间(图5中a)。利用扩大的f2遗传作图群体中1233棵交换单株,osare1基因被进一步精细定位在两个snp分子标记m79和m81之间约410kb的区间内(图5中b)。通过比对水稻基因组注释数据库(ricegenomeannotionproject)发现,该区间一共包含13个有功能注释的候选基因(图5中c),将其全部测序发现只有loc_os08g12780基因发生突变。在abc1-1are1-1双突变体和are1-1单突变体中,该基因第4个外显子均发生单碱基缺失突变,造成其编码产物蛋白质osare1发生移码突变,产生一个c端截短的蛋白质;在abc1-1are1-2双突变体和are1-2单突变体中,该基因第6个外显子均发生单碱基替换突变(c突变为t),导致一个高度保守的氨基酸发生替换(脯氨酸替换为亮氨酸)(图5中d)。实施例6、osare1基因的遗传互补验证一、水稻基因组dna的提取1)取约400mg水稻品种日本晴叶片,装入含有钢珠的离心管(规格为2ml)中,加入400μldna提取液(含500mmnacl、50mmedta和1%(1mg/100ml)sds的ph7.5、100mmtris-hcl缓冲液)。2)完成步骤1)后,将所述离心管装载至混合磨样仪(retsch公司的产品,型号为mm400),以最大频率振荡3min,然后65℃水浴30min,冷却至室温。3)完成步骤2)后,取所述离心管,加入等体积氯仿,振荡混匀,13000r/min离心10min。4)完成步骤3)后,取所述离心管,转移上清至另一新的离心管(规格为1.5ml),加入等体积异丙醇,混匀,-20℃静置1h。5)完成步骤4)后,取所述离心管,13000r/min离心10min,弃上清,70%(v/v)乙醇水溶液洗涤沉淀2次,晾干。6)完成步骤5)后,取所述离心管,加入400μl去离子水,混匀,得到水稻基因组dna。-20℃保存备用。二、osare1互补载体的构建1)以水稻基因组dna为模板,采用引物对甲(are1comp1f和are1comp1r组成)进行pcr扩增,然后采用dna琼脂糖凝胶纯化回收试剂盒(biomed公司的产品,产品目录号为dh101)纯化回收,得到约5000bp的产物甲;取克隆载体pbluescriptskii(-)(alting-meesetal.,1992),用限制性内切酶ecorv酶切,得到载体骨架;将载体骨架和产物甲连接,得到中间载体甲。按照上述步骤,将引物对甲替换为引物对乙(are1comp2f和are1comp2r组成),其它步骤均不变,得到中间载体乙。按照上述步骤,将引物对甲替换为引物对丙(are1comp3f和are1comp3r组成),其它步骤均不变,得到中间载体丙。2)将中间载体甲、中间载体乙和中间载体丙分别转化大肠杆菌dh5α,得到重组大肠杆菌菌株甲、菌株乙和菌株丙;采用wizardplusminiprepsdnapurificationsystem试剂盒(promega公司的产品,产品目录号为a9280)小量提取质粒dna,然后测序。测序结果表明,中间载体甲中含有序列表中序列3自5′末端起第1至3860位所示的核苷酸序列,中间载体乙中含有序列表中序列3自5′末端起第3761至5760位所示的核苷酸序列,中间载体丙中含有序列表中序列3自5′末端起第5041至7229位所示的核苷酸序列。3)用限制性内切酶psti和kpni酶切中间载体甲,回收约3809bp的酶切产物甲。用限制性内切酶kpni酶切中间载体乙,回收约1880bp的酶切产物乙。用限制性内切酶kpni和sali酶切中间载体丙,回收约1540bp的酶切产物丙。取pcambia1300载体(robertsetal.,1997),用限制性内切酶psti和sali酶切,得到载体骨架甲;将载体骨架甲、酶切产物甲、酶切产物乙和酶切产物丙连接,得到osare1互补载体。将osare1互补载体进行测序。根据测序结果,对osare1互补载体进行结构描述如下:向pcambia1300载体的限制性内切酶psti和sali之间插入序列表中序列3所示的dna分子(loc_os08g12780基因的基因组全长序列),得到的重组质粒。三、电激转化法与根癌农杆菌介导的水稻遗传转化1)采用电激转化法,将osare1互补载体导入根癌农杆菌eha105,得到重组农杆菌,命名为eha105/osare1-comp。2)采用根癌农杆菌介导的水稻遗传转化方法,将eha105/osare1-comp导入abc1-1are1-1双突变体,得到t1代转osare1基因的abc1-1are1-1双突变体。3)采用根癌农杆菌介导的水稻遗传转化方法,将eha105/osare1-comp导入are1-1单突变体,得到t1代转osare1基因的are1-1单突变体。四、osare1转基因互补植物的表型分析t1代转osare1基因的双突变体能够完全互补abc1-1are1-1双突变体至abc1-1突变体表型,包括株高降低、分蘖数减少、叶绿素含量降低及整个植株生物量降低等(图6中a);t1代转osare1基因的are1-1单突变体能够完全互补are1-1单突变体至水稻野生型品种日本晴表型(图6中b),尤其是叶片叶绿素含量降低和早衰表型(图6中c和d)。水稻遗传互补实验结果表明,loc_os08g12780基因就是osare1基因。osare1基因的基因组全长序列的核苷酸序列如序列表中序列3所示,osare1基因的cdna的核苷酸序列如序列表中序列2所示,序列表中序列2自5'末端起第467-1750位所示的核苷酸序列编码序列表中序列1所示的蛋白质osare1。实施例7、osare1转基因植物对低氮胁迫的抗性分析一、日本晴的cdna的获得1)采用rnapreppure植物总rna提取试剂盒(tiangen公司的产品,产品目录号为dp432)提取水稻品种日本晴叶片中总rna,得到日本晴总rna。2)取1-2μg日本晴总rna,采用transscriptfirst-strandcdnasynthesissupermix试剂盒(transgenbiotech公司的产品,产品目录号为at301)合成第一链cdna,得到日本晴的cdna。二、osare1基因沉默载体的构建通过水稻基因组序列比对,选取osare1基因转录起始位点下游101-400bp(转录起始位点被视为+1)序列作为osare1基因沉默的靶标序列。1)以日本晴的cdna为模板,采用引物对(are1rnaif和are1rnair组成)进行pcr扩增,然后采用dna琼脂糖凝胶纯化回收试剂盒纯化回收,得到约323bp的产物;取克隆载体pbluescriptskii(-),用限制性内切酶ecorv酶切,得到载体骨架;将载体骨架和产物连接,得到中间载体。将中间载体进行测序。测序结果表明,中间载体中含有序列表中序列5自5′末端第840至1138位所示的核苷酸序列。2)用限制性内切酶spei和saci酶切中间载体,回收约305bp的dna片段1;用限制性内切酶spei和saci酶切ptck303载体(wangetal.,2004),回收约14.6kb的载体骨架1;将dna片段1和载体骨架1连接,得到重组质粒1;用限制性内切酶kpni和bamhi酶切中间载体,回收约311bp的dna片段2;用限制性内切酶kpni和bamhi酶切重组质粒1,回收约14.9kb的载体骨架2;将dna片段2和载体骨架2连接,得到osare1基因沉默载体。将osare1基因沉默载体进行测序。根据测序结果,对osare1基因沉默载体进行结构描述如下:将序列表中的序列5自5′末端第14至312位所示的dna分子插入ptck303载体的spei和saci识别位点之间,同时将序列表中的序列5自5′末端第840至1138位所示的dna分子插入ptck303载体的kpni和bamhi识别位点之间得到的重组表达载体。osare1基因沉默载体表达序列表中序列4自5′末端第14至1138位所示的rna分子。三、osare1基因过量表达载体的构建1)以水稻品种日本晴的cdna为模板,采用引物对(are1oef和are1oer组成)进行pcr扩增,然后采用dna琼脂糖凝胶纯化回收试剂盒纯化回收,得到约1281bp的产物;取psk-flag载体(alting-meesetal.,1992),用限制性内切酶psti和xmai酶切,得到约3kb的载体骨架;将载体骨架和产物连接,得到中间载体甲。将中间载体甲进行测序。测序结果表明,中间载体甲中含有序列表中序列2自5'末端起第467-1747位所示的核苷酸序列。2)用限制性内切酶psti和spei酶切中间载体甲,回收约1293bp的dna片段1;用限制性内切酶psti和spei酶切pcambia1300-nos载体(robertsetal.,1997),回收约9.2kb的载体骨架1;将dna片段1和载体骨架1连接,得到中间载体乙。3)以pcambia1300载体(robertsetal.,1997)为模板,采用引物对(35sf和35sr组成)进行pcr扩增,得到约861bp的pcr扩增产物。4)用限制性内切酶psti酶切步骤3)得到的pcr扩增产物,然后采用dna琼脂糖凝胶纯化回收试剂盒纯化回收,得到dna片段2;用限制性内切酶psti酶切中间载体乙,回收约10.5kb的载体骨架2;将dna片段2和载体骨架2连接,得到osare1基因过量表达载体。四、osare1转基因植物的对低氮胁迫的抗性分析1)采用电激转化法,将osare1基因沉默载体导入根癌农杆菌eha105,得到重组农杆菌,命名为eha105/osare1-rnai。采用电激转化法,将osare1基因过量表达载体导入根癌农杆菌eha105,得到重组农杆菌,命名为eha105/osare1-oe。2)采用根癌农杆菌介导的水稻遗传转化方法,将eha105/osare1-rnai导入abc1-1突变体,得到3个独立的t1代osare1基因沉默的abc1-1突变体。采用根癌农杆菌介导的水稻遗传转化方法,将eha105/osare1-rnai导入水稻品种日本晴,得到3个独立的t1代osare1基因沉默的日本晴。采用根癌农杆菌介导的水稻遗传转化方法,将eha105/osare1-oe导入水稻品种日本晴,得到3个独立的t1代osare1基因过量表达的日本晴。结果如下:3个独立的t1代osare1基因沉默的abc1-1突变体旗叶中osare1基因表达量显著降低,株高、分蘖数、旗叶中叶绿素含量和植株生物量(均为氮素调控性状)均显著增加(图7中a和b),且株高和叶绿素含量增加的程度与基因表达量降低程度正相关(图7中b、c和d);3个独立的t1代osare1基因沉默的日本晴旗叶中osare1基因表达量显著降低,株高和单株产量(均为氮素调控性状)均显著增加(图7中e、f、g和h);3个独立的t1代osare1基因过量表达的日本晴旗叶中osare1基因表达量显著增加,但株高和单株产量均显著降低(即抑制氮素调控性状)(图7中i、j、k和l)。上述实验结果表明,osare1基因参与负调控植物抗低氮胁迫过程,是选育耐低氮植物品种的优良遗传位点。实施例8、osare1基因敲除植物对低氮胁迫的抗性分析crispr/cas9介导的基因编辑技术为改良植物特定性状提供了有效方法。为明确osare1基因是否可通过该技术敲除及其敲除植物是否具有抗低氮性,本发明的发明人构建了osare1基因敲除载体并分析了osare1基因敲除植物在低氮生长条件下的表型。一、osare1基因敲除载体的构建为了提高基因编辑效率,通过比对水稻基因组数据库,选择osare1基因外显子区2个高特异性序列5′-atgttcgacactggttcc-3′(被编辑的目标序列1,位于第1个外显子中,转录起始位点下游94-111bp位置,转录起始位点被视为+1)和5′-ttattgattgtgattccatgggtgttgg-3′(被编辑的目标序列2,位于第2个外显子中,转录起始位点下游622-649bp位置,转录起始位点被视为+1),作为osare1基因编辑的潜在靶点(图8中a)。1)利用特异引物对a(u6af和u6ar组成)合成grnaa接头(含有转录起始位点下游86-104bp的osare1基因片段,转录起始位点被视为+1);用限制性内切酶bsai酶切grna表达载体pylgrna-u6a(maetal.,2016),回收约3kb的载体骨架a;将grnaa与载体骨架a连接,得到重组质粒a;2)利用特异引物对b(u6bf和u6br组成),合成grnab接头(含有转录起始位点下游628-646bp的osare1基因片段,转录起始位点被视为+1);用限制性内切酶bsai酶切grna表达载体pylgrna-u6b(maetal.,2016),回收约3kb的载体骨架b;将grnab与载体骨架b连接,得到重组质粒b;3)用限制性内切酶bsai分别酶切重组质粒a和重组质粒b,分别回收约800bp和600bp的grna表达盒a(u6a启动子驱动grnaa表达)和grna表达盒b(u6b启动子驱动grnab表达);用限制性内切酶bsai酶切单子叶植物基因组编辑载体pylcrispr/cas9-mh(maetal.,2016),回收约16.5kb的载体骨架;将grna表达盒a和grna表达盒b与载体骨架连接,获得osare1基因敲除载体。将osare1基因敲除载体进行测序。根据测序结果,对osare1基因敲除载体进行结构描述如下:将序列表中序列2自5′末端起第552至570位和/或第1094至1112位所示的dna分子插入pylcrispr/cas9-mh载体bsai识别位点得到的重组表达载体。osare1基因敲除载体特异识别序列表中序列3自5′末端起第2362至2380位和/或第3497至3515位所示的dna分子。二、osare1基因敲除效果的分子检测1)采用电激转化法,将osare1基因敲除载体导入根癌农杆菌eha105,得到重组农杆菌,命名为eha105/osare1-ko。2)采用根癌农杆菌介导的水稻遗传转化方法,将eha105/osare1-ko导入水稻品种黄华占(hhz,一个推广面积大、适应性强的水稻品种,其具有一定的早衰表型),得到osare1基因敲除植物。为了分析osare1基因是否被编辑及其编辑效果,通过测序方法检测了osare1基因敲除植物中osare1基因的完整性。结果表明,在osare1基因目标序列1和目标序列2区域均产生1至多个碱基的缺失或插入突变,共获得5类osare1基因等位变异形式的t1代转基因植物(图8中a)。与野生型黄华占(基因型为hhzare1)相比,hhzare1-2在目标序列1处缺失4个碱基tcga;hhzare1-10在目标序列1处缺失3个碱基cga,在目标序列2处增加1个碱基t;hhzare1-12在目标序列1处缺失2个碱基ga,在目标序列2处缺失1个碱基g;hhzare1-18在目标序列1处增加1个碱基g,在目标序列2处缺失37个碱基;hhzare1-25在目标序列1处增加1个碱基t(图8中a)。将5类osare1基因等位变异衍生的osare1突变蛋白序列与蛋白质osare1序列进行比对发现,5类等位变异均导致氨基酸移码突变及蛋白翻译提前终止,表明5类等位变异的突变性质均为osare1基因功能缺失型突变。因此,本发明的发明人对这5类osare1基因敲除植物的表型进行了分析,侧重对低氮生长条件下的表型分析,以检测osare1基因敲除植物对低氮胁迫的抗性。三、osare1基因敲除植物对低氮胁迫的抗性分析在高氮和低氮生长条件下,与野生型黄华占相比,osare1基因敲除植物分蘖数变化不明显,株高略有增加(图8中b和c)。氮元素是影响叶绿素生物合成的重要因素之一,因此本发明的发明人检测了osare1基因敲除植物旗叶的叶绿素含量。分析发现,在不同施氮水平条件下,osare1基因敲除植物旗叶中叶绿素含量较野生型黄华占均增加近1倍(图8中d)。叶片叶绿素含量高低与植物光合能力强弱密切相关,暗示osare1基因敲除可能影响水稻产量。穗数、穗粒数和粒重是决定水稻产量的三个主要因素。分析发现,在不同施氮水平条件下,5类独立的osare1基因敲除的黄华占穗粒数均增加(图8中e)。相应地,osare1基因敲除的黄华占在高氮生长条件下,单株产量略增加,但在低氮生长条件下增加比例更加明显(图8中f)。以上结果表明,敲除osare1基因可提高水稻对低氮胁迫的抗性,为改良植物抗低氮能力提供了有效位点和方法。实施例9、are1-1片段代换系对低氮胁迫的抗性分析为检测are1-1突变在改良水稻氮素利用效率中的应用潜力,本发明的发明人构建了一系列are1-1片段代换系。选取高产籼稻品种明恢63号(minghui63,mh63)和粳稻主栽品种空育131(kongyu131,ky131)两类受体品种进行分析。将are1-1单突变体分别与mh63和ky131杂交获得杂种f1代植物,继续用受体品种回交6次,获得are1-1突变的bc5f3代片段代换系mh63are1-1和ky131are1-1。在不同施氮水平条件下,与受体亲本mh63相比,mh63are1-1植物株高、叶片叶绿素含量和主穗粒数等氮素调控性状均明显改良(图9中a、b、c和d)。与此相一致,mh63are1-1植物单株产量增加,且在低氮生长条件下,效果更加明显(图9中e)。水稻包括粳稻和籼稻两个亚种,与粳稻相比,籼稻通常具有更高的氮素利用效率。are1-1片段能够进一步提高高产籼稻品种mh63对低氮胁迫的抗性,表明are1-1片段是提高水稻抗低氮胁迫能力的重要遗传靶点。采取相同策略检测了are1-1突变对粳稻主栽品种ky131抗低氮胁迫能力的改良效果。ky131are1-1植物抗低氮胁迫能力显著增加,包括叶片叶绿素含量的增加和主穗粒数的增加(图9中f、g和h)。以上结果表明,are1-1突变是培育抗低氮胁迫水稻品种的有效位点,利用遗传回交方法构建are1-1片段代换系是改良水稻受体品种抗低氮胁迫能力的有效方法。上述实验结果表明,osare1基因是调控植物抗低氮胁迫的重要基因。are1-1突变抑制水稻氮代谢异常引起的缺陷表型,增加水稻抗低氮胁迫能力,提高低氮生长条件下的nue和水稻产量,是改良水稻抗低氮胁迫能力的有效遗传位点;抑制osare1基因表达或敲除osare1基因,均增加水稻抗低氮胁迫能力,是培育耐低氮胁迫植物新材料的有效方法。<110>中国科学院遗传与发育生物学研究所<120>蛋白质osare1在调控植物抗低氮性中的应用<160>5<170>patentinversion3.5<210>1<211>427<212>prt<213>水稻oryzasatival.<400>1metserargseralavalsersergluglyglyilealaleuargleu151015phevalasptrpargileargargargargvalcysalacyslysmet202530pheaspthrglyserglnargglyargvallysglnleuvalalaphe354045alalyslysargargargprolyslysglnproserargargprotrp505560trplysalatrppheserasptrpasnaspgluglugluserleuser65707580glytrparggluaspglugluleuleuglugluvalglyglygluglu859095glyleuseraspaspglulysphegluthrtrplysarglysalaglu100105110alailevalgluleuargglualaargglnaspalametasnalaglu115120125glyargsertrpgluasptrpileglyglyglyserserthralagly130135140aspglyglyglyasptrpglyglyaspleuaspvalseraspleuile145150155160thraspaspprothrgluilevalargasplysglyleuilegluthr165170175pheargaspservalaspgluasptyrasnaspmetleuphegluasp180185190argvalpheleutyralaserthrasnseralalyspheleualaleu195200205leuilevalileprotrpvalleuasppheleuvalhisasptyrval210215220leumetpropheleugluargtyrvalglnlysvalproleualaala225230235240gluleuleuaspvalargargserglnlysleuleumetvallysasp245250255ileasnthrglulysalaargtyrargphegluvalgluileglylys260265270serproproleuseraspaspgluleutrpsergluleuargglulys275280285alailegluleuargaspglutrpargleugluasnarglysalaphe290295300alaasniletrpseraspmetvaltyrglyileserleupheleuleu305310315320mettyrpheasnglnserlysvalalametleulysphethrglytyr325330335lysleuleuasnasnileseraspserglylysalapheleuileile340345350leuvalseraspileleuleuglytyrhissergluserglytrphis355360365serleuvalgluvalileleugluhistyrglyleuglualaaspgln370375380alaalailethrphephevalcysleuvalprovalalaleuaspval385390395400pheilelysphetrpvaltyrlystyrleuproargleuserproser405410415valglyasnileleuaspgluilelysarghis420425<210>2<211>2640<212>dna<213>水稻oryzasatival.<400>2cgggcgtccccttcccgtgtcttatccactcccaacgttccattctgtggatgcttccgc60caccgccaccgcccaacgaccagcagcaagcagctcagccaaggggctccccatcgtatc120gatccccattcgcgccgtcctcttcttcttcttcttcttctcgattcataggtgtggttt180ccatttcttgctgtggttgctggttgaactagcttttgctttgcttggattgtgttttga240ttgaggggtttgttagtgttagcaatctaacccaagatatctttgcaattatatgctcca300gttaatccgtcaggcttttgttgcttgctgctgctgctgcggtggcgggtggggaggaag360gatgctgattgcggctgatttcccgggagattcgacggtgtcccgatgcgcattccccgg420tttgttctgagtgatgatgcggtctccgtttcgtgatctttgattgatgagccgttccgc480ggtaagctctgaaggcggcattgcgctccggctcttcgtggactggaggatccggcgccg540gagggtctgcgcatgcaagatgttcgacactggttcccaaaggggtagggtgaagcagct600ggtggcttttgccaagaagaggaggcggcccaagaagcagccgtcgcggcggccatggtg660gaaggcgtggttctcggactggaacgacgaggaggagagcttgtctggctggagggagga720tgaggagctgctcgaggaggttggcggcgaggaagggctgtcggacgacgagaagtttga780gacgtggaagaggaaggccgaggctattgtcgagctgcgggaggcgcggcaggatgccat840gaacgcggaagggcgctcgtgggaggattggattggcgggggcagtagcacagcggggga900tggcggcggtgactggggtggggatttggatgtgtcagacctgataacggatgatcctac960agagatagtgagggataaaggtttgattgaaactttcagagactctgtagatgaagatta1020caatgacatgctgtttgaagaccgggtttttctgtatgcttcaacgaattcggccaaatt1080tctagcattattgattgtgattccatgggtgttggattttctggttcatgactatgttct1140gatgccatttttggaaaggtacgtccagaaggtaccacttgctgctgagctgcttgatgt1200aaggcgcagccagaaactcctgatggtaaaggacataaatactgagaaagcaagatatcg1260ttttgaagtagagattggtaaatctcctccactttctgatgatgagctctggtcagagtt1320acgggaaaaagcgatagagttgagagatgaatggagattagaaaaccgaaaagcgtttgc1380aaatatctggtctgacatggtttatggaatttccctattccttcttatgtacttcaacca1440gagtaaagttgcgatgctgaaattcacaggatataagttactaaataatatttcagacag1500tgggaaagcattccttataattctagtttcagacatccttctagggtaccattcagagtc1560aggttggcattctttggtagaagtcattctcgagcactacggccttgaagccgatcaagc1620tgcaatcaccttctttgtttgtctggttcctgttgccttggatgtatttataaaattttg1680ggtatacaaataccttccaagattatcacctagtgtgggtaacattttggatgaaataaa1740gcgtcattagagactttccatcaggaatttgatctgcttaattcattccattaagaattt1800gaaggaaagaccatccttccaggtatgtattcggtgttatatacctttggcttgtattgt1860gttgttatcaaaggttcattagcaactttttgtgatggtgtttgcgaggtgcttcttgat1920tctttcttaaattgttgaaatattggctttctttctttctttctttctttctttttgaac1980cagactgtgaatgaaacagagataaacatgtctgattgacaaaagaactagttacatatt2040gctgtgagcagttaatcgttcattgagaaagcaaatttgaatctgagtttctgaagaaag2100ctactctgctgcagggctcactcggggctagtgtctgattgatgaaatgccaacatagtt2160gccatggattgcaatttcggaggtcgccctaaccagtgcttaccctacaaaaggcataca2220taacattctgtagtatatatactctccacataaaaaaaatgtgctgattacacatatcat2280ccaggaatattcaggttgatgcggtattcaccgataatgagcgattttgtcccaggatgc2340tcacatatcgaaccttctgtgttttcatctttttgttatgtgaaattcgaaacaactatg2400tatatgtatacaaacagcagaggctgcagtaggaatttgcctttcccccttttttctcca2460ttgtagttccttgtggcatttgtaatgttatcaaggaatttaggccagtctaagaaaata2520atttaggtccaatttggtgtgcgggatgagactattttcttgttcctgcaggaaattatt2580caattcatgcatgtgaggaaatacctatgcttcaatcagaaattgctcccttttttacaa2640<210>3<211>7229<212>dna<213>水稻oryzasatival.<400>3ctgcaggggaggagggtgccgccgcgccagccaggaggaggatgttgggaaggaggaggc60ctaccggggaggagtgtgacgggcagggaggagggcgccacccgggatgagggcgtcggc120aggggaggagggcgccggccaggaggagcggcgtagatccgtggaggcgcagctagcggg180atatttcacgtgaaaaaagaagtgcccgcgtgtctctgccgcggatgggggctgcggaga240aagcccctgggactgggggcctgaggggataatttggaggccttcctattttaggggctt300tagtaggggccttattggacctgattttttagtctcaactctcaaaattagtataggggc360tgtgtttagaacctctactggagatgctctaagggaaaatatatggaatggagcctctgc420aaccctaattagtgtggatccatcttatatatattgtcatcacataatatttcatgatag480gaaaaactataagctatagaactttaacaccgctgaggtcgataacatagcacacctcaa540agtttaggtggatcaaacacgttagccacttgccactaggtcatggctgatcagtgacag600tacatggtggattggtgccgccctgatgcttagaccattgctaagattttcagcccgtgt660caaaagacaaaaaaagaggtttctatttaacaaatactaaataaacagagtacattttac720ttcaatctatataaatatagaaaaattgcatgaatttcatgtgatcaacgtcaactagag780ctataccaaaggaacttactaactgacaacgatggtgatgatcatgactaagtaggaact840aagaagaattatcatatcataaagcagtgattcagttctccttactaagcgaacaaatat900agtggaacctttactgcctggaatgcacattcacatcatcatcatgagctttagttcttt960gaggtagctgtagccgagaaaaaacaagcttgttctagctaaataagtgaaagagaaaaa1020gagactttaaaaaatagaacaagaagatcttaaaattatattaaaagtgcatttggcttt1080gactggattataaaataagaggttattttttgaagggaagatgttgggttctggacagca1140aagttgggtcacgtgttccactatgtcatataggacgctccgtctttggttgaggtagtg1200cactatgattaaatttacaatttttgtaacctgttattgaatttaggtttcgtagaactc1260ccatccggttaatgaaatggtcgacaattttgtcgacaagagtttttttctttaagaatt1320ttgtgtaacacaatatataatatatgttttgagataggagatacagtaggtagcaaggcc1380ctcgtagcgatgtcgcaaacttacaatagaaggtcaggccaaagttataaaatttgataa1440tttgattgtattaacacttgtggcaatgaccacgtgggaccttctcgagtctacgacggt1500aagtcaggatgtcaaataatcaaagtactccctccgtctcaaaaaaagtaaacctaggag1560gggatgtgacattttctggtacaacaaatctagataaagggctgtccagatttattgtat1620taggagatgtcacatatttgcttgagtttttttttttgacggagtacagtttatatagga1680tgttaaaaaaagaagagagagagagagaaagatatctctgggccaaaggtagggtcggac1740aaatgggcccaacagccaatacggtactagttacgtagcccagcaacatggcgccatccg1800tggaacggaacgggcgtccccttcccgtgtcttatccactcccaacgttccattctgtgg1860atgcttccgccaccgccaccgcccaacgaccagcagcaagcagctcagccaaggggctcc1920ccatcgtatcgatccccattcgcgccgtcctcttcttcttcttcttcttctcgattcata1980ggtgtggtttccatttcttgctgtggttgctggttgaactagcttttgctttgcttggat2040tgtgttttgattgaggggtttgttagtgttagcaatctaacccaagatatctttgcaatt2100atatgctccagttaatccgtcaggcttttgttgcttgctgctgctgctgcggtggcgggt2160ggggaggaaggatgctgattgcggctgatttcccgggagattcgacggtgtcccgatgcg2220cattccccggtttgttctgagtgatgatgcggtctccgtttcgtgatctttgattgatga2280gccgttccgcggtaagctctgaaggcggcattgcgctccggctcttcgtggactggagga2340tccggcgccggagggtctgcgcatgcaagatgttcgacactggttcccaaaggggtaggg2400tgaagcagctggtggcttttgccaagaagaggaggcggcccaagaagcagccgtcgcggc2460ggccatggtggaaggcgtggttctcggactggaacgacgaggaggagagcttgtctggct2520ggagggaggatgaggagctgctcgaggaggttggcggcgaggaagggctgtcggacgacg2580agaagtttgagacgtggaagaggaaggccgaggctattgtcgagctgcgggaggcgcggc2640aggatgccatgaacgcggaagggcgctcgtgggaggattggattggcgggggcagtagca2700cagcgggggatggcggcggtgactggggtggggatttggatgtgtcagacctgataacgg2760atgatcctacagagatagtgagggataaaggtttgattgaaactttcagagactctgtag2820atgaagattacaatgacatgctgtttgaagaccgggtttttctgtatgcttcaacgaatt2880cggtgagctctttacctatcttgttttctgtcaccaaatgttataacccactgtccagtg2940ataaccatgagatacttgtaatgctttttgaatatgatgaactacttcctccgtttcata3000ttttaagtcgttttgacttttttcttcatcaaacttctttaaatttgaccaaatttgtag3060aaaaaattagcaacacctatcacaccaaattagtttcattaaatatagcattgaatatat3120tttgatagtacgtttgttttatgttggaaatgttaccatatttttctataaacttggtca3180aactaaaaaaagtttgactggtaaaaaagccaaaacgacgtataatatgaaatagaggta3240gtactatataatattggagtgcataatatagcaacaaactttaatctttacaccttacaa3300tattatcgaacgctgagggtccattttgatggtaatgattttgcatctggtggctggtgt3360attttgaccattttgatgattaaaaattaaaaatgttaaaaagtgtagcagcattatatt3420gttatattaagaccctagcaaattggatctaacaaaagaaagtttgcactttcaggccaa3480atttctagcattattgattgtgattccatgggtgttggattttctggttcatgactatgt3540tctgatgccatttttggaaaggtaaatcctctcacagtgttccatttttactttcttaac3600tttttcccctcacttcttaatgtaagaaaatgcattccatgtacacccaatctgatgttt3660aggaatttataaggtgaagtttcaagcactgatgatattctcagtttctcactctctgtg3720cttctgaaattacatgcgatcaataatcatctatgctaaatgcagaattgattacatgga3780acattacacaataacaggtacgtccagaaggtaccacttgctgctgagctgcttgatgta3840aggcgcagccagaaactcctgatggtaaaggacataaatactgagaaagcaagatatcgt3900tttgaagtagagattggtaaatctcctccactttctgatgatgagctctggtcagagtta3960cgggaaaaagcgtgagaaacactctaactattatactttcttgccttgttgtaacttctg4020ttgatgcactagcattgtctgacatgagcaatggaccttctatcctgcaatttcatatgt4080tcaatcttaacagatctgctctgctacttgatcaggatagagttgagagatgaatggaga4140ttagaaaaccgaaaagcgtttgcaaatatctggtctgacatggtttatggaatttcccta4200ttccttcttatgtacttcaaccagagtaaagtatgttttatcagataagcagctttgttt4260tttttttccatctttgattgtgttccaataaatttttcagctttctgagtgtgcatgtga4320gctaagtgattggttataaataaacaccccacaagttgacaaatttctgcactattaggc4380ctctctcagagttatccgatttctgctgttaatacatagtacatgatgattttgtgccaa4440aagaactgcagtgatgaactgaccagagtattcccccattctatttgtacctggttatac4500atcatacttttctgacctagtgcagtagtaagaccacctcagtttctgcaatatgtttga4560ttgttagtatcatttagtaacacatacctggagtccatgatttatgtacaatgaattcat4620caatctatcttatccatcatcgtagcctatttttctctcccattgaatgcttagtgttat4680cctgcgtacaacttattcttattgcctgctaagctttcaggttgcgatgctgaaattcac4740aggatataagttactaaataatatttcagacagtgggaaagcattccttataattctagt4800ttcagacatccttctagggtgagttacaattcatttttcttgagttcatatatacatgtg4860gttttagtgtgaacctagtttgtaacaaagcatacactaaacaattgtgctatttctttt4920gctggataatggatgtcagcaacctaactaaaggcaaataacatgagttctaacctacct4980ctctcatgtgttacctgcttatctaaaaaatcatacatttaaataagtaattcttgttaa5040aagaagattcgtccaaaatgttcaaagaagttaaagaggaggccagagctccctccaggg5100gagagtgccttttcttttcagaaactaatatcagggggatactcagcagcatgttttaga5160aagcaattcattatatcttgtcatcatgattcatgagcgattttttaaatattctctcat5220aagtatggataagtttgtaaaaatgcatggaagaaatattatagctattttttttgtcag5280gaatgaggcagatggttctgtgtttcttcttcgttcgcacttcaaatatgatcttaatat5340ttcttcatttttctctctcttcaaagatgtttgtagcattcgtgtggcagaatcttattt5400atcatctagttagaaacttagaatagtgaacctaagtggtacagtatcccgttagaagtt5460aattcacacaaatgcatatgaactgctttgcgaataatggaattcttcctgttcatgctt5520atgttatacatcatgacatcttttctgtttcaaacaaactatggatagtttgtaattttg5580tttctgctttttttcttgttttcatgtaaacgtaacacaaggttaacattgttttggttt5640gtctgtgatcttgttgactatattaacatcatttagctgcattttcacaggtaccattca5700gagtcaggttggcattctttggtagaagtcattctcgagcactacggccttgaagccgat5760caagctgcaatcaccttctttgtttgtctggttcctgttgccttggatgtatttataaaa5820ttttgggtcagtccacttcttgccttcacacaatcaagctaatagggctatgaacattta5880ttttattctttaaaaaacatttatttcattttatctttttttaaaaaagaatataagtgt5940ttgttaaggcctcataatttatgactagtttcacccaaagttgataacattatagattca6000cgtttggctactcagcgctaacatttcagataatattaactgaaagttttatagtctttc6060tacaaagtgatttgaactttattgctgggccgacagttattaggaagacaaccttttgta6120gatacaatttcatttcctgacactgctcttaaatcaattgttcaccttgcatgtgctaga6180acccattgcattttttaataactggaaatacatgttctcttgataagatcaacaattcga6240cgtacttaattttatttccttattttccaggtatacaaataccttccaagattatcacct6300agtgtgggtaacattttggatgaaataaagcgtcattagagactttccatcaggaatttg6360atctgcttaattcattccattaagaatttgaaggaaagaccatccttccaggtatgtatt6420cggtgttatatacctttggcttgtattgtgttgttatcaaaggttcattagcaacttttt6480gtgatggtgtttgcgaggtgcttcttgattctttcttaaattgttgaaatattggctttc6540tttctttctttctttctttctttttgaaccagactgtgaatgaaacagagataaacatgt6600ctgattgacaaaagaactagttacatattgctgtgagcagttaatcgttcattgagaaag6660caaatttgaatctgagtttctgaagaaagctactctgctgcagggctcactcggggctag6720tgtctgattgatgaaatgccaacatagttgccatggattgcaatttcggaggtcgcccta6780accagtgcttaccctacaaaaggcatacataacattctgtagtatatatactctccacat6840aaaaaaaatgtgctgattacacatatcatccaggaatattcaggttgatgcggtattcac6900cgataatgagcgattttgtcccaggatgctcacatatcgaaccttctgtgttttcatctt6960tttgttatgtgaaattcgaaacaactatgtatatgtatacaaacagcagaggctgcagta7020ggaatttgcctttcccccttttttctccattgtagttccttgtggcatttgtaatgttat7080caaggaatttaggccagtctaagaaaataatttaggtccaatttggtgtgcgggatgaga7140ctattttcttgttcctgcaggaaattattcaattcatgcatgtgaggaaatacctatgct7200tcaatcagaaattgctcccttttttacaa7229<210>4<211>1145<212>rna<213>人工序列<220><223><400>4ggauccgagcucccucccacgagcgcccuuccgcguucauggcauccugccgcgccuccc60gcagcucgacaauagccucggccuuccucuuccacgucucaaacuucucgucguccgaca120gcccuuccucgccgccaaccuccucgagcagcuccucauccucccuccagccagacaagc180ucuccuccucgucguuccaguccgagaaccacgccuuccaccauggccgccgcgacggcu240gcuucuugggccgccuccucuucuuggcaaaagccaccagcugcuucacccuaccccuuu300gggaaccaguguacuagugguacccucgaggucgacagaucugcuagcgguaaguuacua360caaaccuuuuuguacuuauguuccagugacaauuauuuguguucucauguuccacguauc420acuuuaauguucaugguugaucauuguaccgccucaucucuuuuagaggaucaagaguau480augccugucuuaacuuuuucuuucucugguccagucuuuccgcugauauuaagaugaauu540uuacaacaaaaaaugugcugccuguguaugaagguucagaggcauaguucauaauuuuac600ccuguucucaauuaggaaauguauuuugcaaggucauaaagucuugacauugaugaucaa660auauuuucuagagcuaaaauuucauaaucaaauaugacaguuccacggcaguagauaaag720aguacccacuguauauauuaguaugaagauuaacacuugaaaaaaccuuugauuguuccu780auaacaccuaaugauugacuaugacacggcuguuucgagauuuucagaucgauacuagua840cacugguucccaaagggguagggugaagcagcugguggcuuuugccaagaagaggaggcg900gcccaagaagcagccgucgcggcggccaugguggaaggcgugguucucggacuggaacga960cgaggaggagagcuugucuggcuggagggaggaugaggagcugcucgaggagguuggcgg1020cgaggaagggcugucggacgacgagaaguuugagacguggaagaggaaggccgaggcuau1080ugucgagcugcgggaggcgcggcaggaugccaugaacgcggaagggcgcucgugggaggg1140agcuc1145<210>5<211>1145<212>dna<213>人工序列<220><223><400>5ggatccgagctccctcccacgagcgcccttccgcgttcatggcatcctgccgcgcctccc60gcagctcgacaatagcctcggccttcctcttccacgtctcaaacttctcgtcgtccgaca120gcccttcctcgccgccaacctcctcgagcagctcctcatcctccctccagccagacaagc180tctcctcctcgtcgttccagtccgagaaccacgccttccaccatggccgccgcgacggct240gcttcttgggccgcctcctcttcttggcaaaagccaccagctgcttcaccctaccccttt300gggaaccagtgtactagtggtaccctcgaggtcgacagatctgctagcggtaagttacta360caaacctttttgtacttatgttccagtgacaattatttgtgttctcatgttccacgtatc420actttaatgttcatggttgatcattgtaccgcctcatctcttttagaggatcaagagtat480atgcctgtcttaactttttctttctctggtccagtctttccgctgatattaagatgaatt540ttacaacaaaaaatgtgctgcctgtgtatgaaggttcagaggcatagttcataattttac600cctgttctcaattaggaaatgtattttgcaaggtcataaagtcttgacattgatgatcaa660atattttctagagctaaaatttcataatcaaatatgacagttccacggcagtagataaag720agtacccactgtatatattagtatgaagattaacacttgaaaaaacctttgattgttcct780ataacacctaatgattgactatgacacggctgtttcgagattttcagatcgatactagta840cactggttcccaaaggggtagggtgaagcagctggtggcttttgccaagaagaggaggcg900gcccaagaagcagccgtcgcggcggccatggtggaaggcgtggttctcggactggaacga960cgaggaggagagcttgtctggctggagggaggatgaggagctgctcgaggaggttggcgg1020cgaggaagggctgtcggacgacgagaagtttgagacgtggaagaggaaggccgaggctat1080tgtcgagctgcgggaggcgcggcaggatgccatgaacgcggaagggcgctcgtgggaggg1140agctc1145当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1