拮抗水稻白叶枯病菌活性单体化合物及其制备方法与流程
本发明属于微生物技术农药生产领域,涉及1种从菌核曲霉(Aspergillus sclerotiorum)As-75菌株发酵液中提取、分离、纯化、鉴定对水稻白叶枯病菌有抑制作用的天然活性单体化合物。
背景技术:
水稻白叶枯病与稻瘟病、纹枯病一起被称为水稻的“三大病害”。水稻白叶枯病俗称白叶痕、地火烧等,是一种世界性的细菌病害,由水稻黄单胞菌致病变种(Xanthomonas oryzae pv. oryzae,Xoo)引起。现阶段,我国遭遇白叶枯病侵害的地区主要集中于华东、华中等水稻生产区,而西南、西北等地区较少见。该病菌经由水流传播,通过叶片上的小孔或伤口侵入水稻,一般在台风暴雨较多或发生洪涝的年份引起病害的流行。水稻遭受白叶枯病后,一般减产 10%~30%,发病严重的可达 50%,甚至绝收。从品质方面讲,米质松脆,口感非常不好。严重威胁全球农业和粮食安全。
目前,培育抗性品种是控制白叶枯病最经济有效的方法。但由于致病菌株不断发生变异,使得抗性水稻品种逐渐表现出感病症状,因此,化学防治仍是防治水稻白叶枯病不可缺少的重要手段。目前化学防治一般采用化学合成杀菌剂来防治,常用的化学合成药剂主要有噻枯唑、克菌壮、叶枯唑及其复配剂和噻森铜等。但是,这些化学合成杀菌剂也存在着显而易见的缺点,包括:1)对水稻白叶枯病的防治效果较差,一般只能达到 60% 左右的效果;2)长期使用易产生抗药性;3)产生农药残留,污染环境,甚至影响人类健康。为此寻求防治白叶枯病发生的有效生物防治方法对农业生产具有重要的意义。
目前,已见报道的对白叶枯病菌具有拮抗作用的微生物主要是细菌类如肠杆菌属、放线菌类如白蚁链霉菌,真菌类如生赤壳属、盾壳霉属等。如宋迤明等[5]从水稻试验田土壤中筛选得到1株对水稻白叶枯病菌有抑菌作用的放线菌—白蚁链霉菌(Streptomyces termitum);刘琴英等从水稻植株内部分离到1种对水稻白叶枯病有抑制作用的内生真菌—淡色生赤壳菌(Bionectria ochroleuca)。而关于曲霉(Aspergillus)拮抗白叶枯病菌的研究还未见报道。
曲霉(Aspergillus)广泛分布于谷物、空气、土壤和各种有机物品上,与人类的生产、生活和医药卫生等密切相关,是发酵工业和食品加工业的重要菌种,已被利用的有近60种。近几年许多曲霉新代谢活性物质的功效相继被证实,如抑制癌细胞增殖和抗真菌的多肽、促进植物生长的赤霉素、可用于灭蚊的生物活性物质、可降解塑料的酶、生产降血压药洛伐他汀等,曲霉的代谢产物作用广泛,已引起了国内外研究学者的广泛关注。
申请人申请的中国发明专利(申请号:2017111943811,申请日:2017-11-24)公开了1株拮抗水稻白叶枯病菌的菌核曲霉(Aspergillus sclerotiorum)As-75菌株及其在植物病害防冶中的应用。该菌株保藏于中国典型培养物保藏中心,保藏地址是:中国武汉武汉大学,保藏编号为:CCTCC NO:M 2017350,保藏日期为:2017年6月19日。本发明的菌核曲霉As-75菌株可用于拮抗水稻白叶枯病菌,制备生物农药,用于水稻白叶枯病的防治。同时,对金黄色葡萄球菌和枯草芽孢杆菌等细菌也有一定的抑制作用,对小麦赤霉病菌和杨树枯萎病菌等植物病原真菌有较强的抑制作用。
技术实现要素:
为了解决上述的技术问题,本发明的第一个目的是提供一种拮抗水稻白叶枯病菌活性单体化合物,该化合物来源于菌核曲霉As-75菌株,具有生态环境友好、成本低、无污染的特点。本发明的第二个目的是提供上述的化合物的制备方法。
为了实现上述的第一个目的,本发明采用了以下的技术方案:
拮抗水稻白叶枯病菌活性单体化合物,该化合物的结构式如下:
为了实现上述的第二个目的,本发明采用了以下的技术方案:
单体化合物的制备方法,该单体化合物从菌核曲霉(Aspergillus sclerotiorum)As-75菌株发酵液中分离得到;菌核曲霉As-75菌株保藏于中国典型培养物保藏中心,保藏编号为 CCTCC NO:M 2017350,保藏日期为:2017年6月19日。
作为具体的实施方法,该方法包括以下的步骤:
1)制备菌核曲霉As-75菌株发酵液粗浸膏,
2)选用玻璃层析柱,200-300目硅胶进行湿法填柱;用二氯甲烷溶解菌核曲霉As-75菌株发酵液粗浸膏,然后利用布氏漏斗过滤掉少量的不溶物,用100-200目硅胶进行拌料;在层析柱上端加上干净的漏斗,将已经完全干燥且与样品充分吸附的硅胶通过漏斗慢慢上样;按照少量多次的加入原则,将样品硅胶加入到层析柱内;使样品均匀装填在层析柱内,保证样品与分离娃胶接触面水平、均匀;
3)用体积比二氯甲烷:甲醇=100:0(V:V),100:1,100:2,100:4,100:8,100:16,100:64作为洗脱剂进行梯度洗脱,在旋转蒸发仪上50℃ 蒸发浓缩至干;通过TLC点板,将相同成份合并,蒸干,甲醇溶解回收;
以白叶枯病菌生理小种为指示菌,牛津杯法分别测定各组物质活性,设置甲醇处理作为对照组,实验结果重复3次;
4)将分离纯化得到的含有拮抗物质的混合物用甲醇溶解,用胶头滴管逐滴加入到凝胶层析柱中;在上样过程中贴壁缓慢加入,防止液滴下落过快造成凝胶面不均匀;上样完毕后,轻轻旋开塞子,控制甲醇滴落流速,保证流速为0.5 mL/min并观察样品进入凝胶的速度;
5)待样品完全进入凝胶后,缓慢加入甲醇,保持流速,直至样品带出现分层;
6)当凝胶中被洗脱样品,不同流速的成分色带已经完全分幵,而且洗脱速度最快的成分距层析柱底部约为10 cm时,打开旋塞全速冼脱;收集洗脱液;将洗脱液分别由旋转蒸发器50 ℃蒸干,甲醇溶解;通过硅胶薄层层析,将得到样品分别用不同极性的展开剂展开验证,确定回收成分是否单一;
以白叶枯病菌P6菌株为指示菌,以牛津杯法分别测定分离得到的成分的抑菌活性,设置甲醇为对照,实验结果重复3次,确定拮抗活性单体化合物。
本发明菌核曲霉As-75菌株发酵滤液对水稻白叶枯病菌有较强抑制作用。在发酵培养基初始pH为6.0~6.5,培养温度为28 ℃条件下,液体发酵培养9 d后,发酵滤液对水稻白叶枯病菌的抑菌圈直径达31 mm(专利号:201710750156.5)。滤液经乙酸乙酯萃取后旋转蒸发得到粗浸膏,将粗浸膏用甲醇配成浓度为0.5 mg/mL的溶液,取200μL,牛津杯法测得的抑菌圈直径为40 mm;进一步分离纯化得活性单体化合物M,将其化合物M配成浓度为0.5 mg/mL的溶液,取200μL,牛津杯法测得的抑菌圈直径可达44 mm(附图2),活性单体化合物M对水稻白叶枯病的防效可达78.3 %。由此获得化合物M对水稻白叶枯病菌的抑制作用显著,故而用此化合物制备对水稻白叶枯病病菌有抑菌活性的生物农药,有良好的应用前景。
附图说明
图1为本发明化合物的结构式。
图2 As-75菌株发酵液粗浸膏对水稻白叶枯病菌的抑制效果;A:甲醇对照,B:发酵液粗浸膏(抑菌圈直径为40 mm)。
图3 活性单体化合物M对水稻白叶枯病菌的抑制效果;A:甲醇对照,B: 单体化合物M(抑菌圈直径为44 mm)。
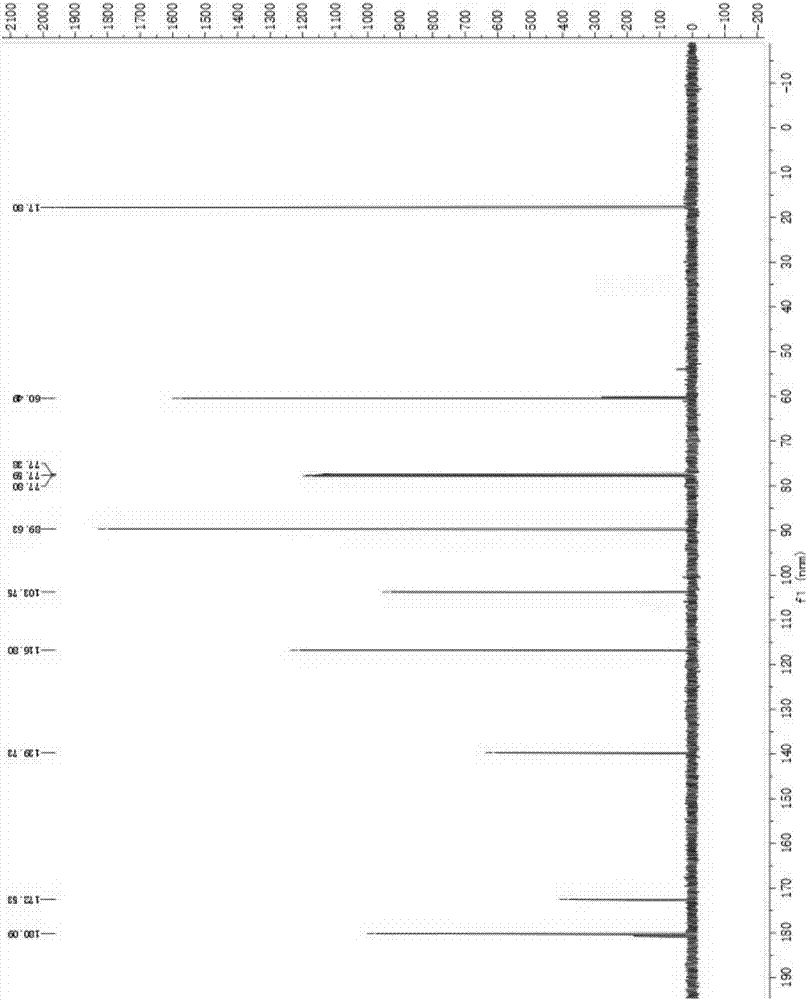
图4 活性单体化合物M核磁共振氢谱。
图5 活性单体化合物M核磁共振碳谱。
图6 活性单体化合物M 质谱。
图7 活性单体化合物M不同处理方法对水稻白叶枯病的防效。
具体实施方式
下面对本发明具体实施方式做一个详细的说明。
实施例1 菌核曲霉(A. sclerotiorum)As-75菌株发酵液和粗浸膏制备
1 菌株
(1)菌核曲霉(A. sclerotiorum)As-75菌株。
(2)水稻白叶枯病菌(Xanthomonas oryzae pv. oryzae,Xoo)P6小种
2 培养基
(1)PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂粉20 g,水1 L,pH 6.5。用于As-75菌株的活化和复壮培养。
(2)PD培养液:马铃薯200 g、葡萄糖20 g、水1 L,pH 6.5。用于As-75菌株的发酵培养。
(3) 水稻白叶枯病菌固体培养基(Xoo固体培养基):马铃薯300 g,胰蛋白胨5 g,蔗糖15 g,Ca(NO3)·H2O 0.5 g,Na2HPO4·12H2O 2 g,琼脂粉20 g,水1 L,pH 6.5。用于水稻白叶枯病菌的固体培养。
(4)水稻白叶枯病菌培养液(Xoo培养液):马铃薯300 g,胰蛋白胨5 g,蔗糖15 g,Ca(NO3)·H2O 0.5 g,Na2HPO4·12H2O 2 g,水1 L,pH 6.5。用于水稻白叶枯病菌的液体培养。
3实验方法
3.1 As-75菌株发酵液的制备
(1)As-75菌株的活化和复壮培养:将实验室保藏的As-75菌株接入PDA培养基平板上,28℃活化培养48 h;待白色绒毛状菌丝长出后,取少许菌丝转接于另一PDA培养基平板上继续复壮培养4 d。
(2)As-75菌株发酵液制备:取 3 个菌饼(直径6 mm)接种到装有100 mL PD 液体培养基的250 mL锥形瓶中,于摇床上28 ℃、180 r/min振荡培养,共发酵3 L,培养9 d后,获得发酵液。
3.2 As-75菌株酵液粗浸膏的制备
将所得的发酵液在室温下经真空泵抽滤得到滤液,滤液进一步用0.22 μm微孔滤膜过滤,将所得滤液用等体积的乙酸乙酯进行萃取,直到上层乙酸乙酯层无色为止。将得到的乙酸乙酯层合并,在旋转蒸发仪上50 ℃蒸发浓酸至干即得As-75菌株发酵液的乙酸乙酯粗浸膏。
3.3 发酵液粗浸膏抑菌活性测定
(1)水稻白叶枯病菌菌液的培养:取水稻白叶枯病菌接入Xoo培养液中,于摇床上(28 ℃,180 r/min)振荡培养48 h得白叶枯病菌菌液。取150 μL上述菌液涂布于Xoo固体培养基平板上,于28℃培养30 min,待用。
(2)将粗浸膏用甲醇配成浓度为0.5 mg/mL的溶液,取200μL;采用牛津杯法测定抑菌效果,用十字交叉法测量抑菌圈的直径。以甲醇作为空白对照,每处理重复3次。
4 实验结果
4.1 As-75菌株制备的发酵液和粗浸膏
通过摇床发酵,共得到2.5 L发酵滤液,滤液经乙酸乙酯萃取、旋转蒸发仪蒸干,共得到1.5 g橙黄色粗浸膏。
4.2 发酵液和粗浸膏抑菌活性测定结果
通过牛津杯法测定As-75菌株发酵液对水稻白叶枯病菌的抑菌效果,抑菌圈直径为31 mm(专利号:201710750156.5);浓度为0.5 mg/mL的粗浸膏200μL对水稻白叶枯病菌的抑菌效果好,抑菌圈直径为40 mm(附图2)。由此可知,乙酸乙酯粗浸膏对水稻白叶枯病菌有抑菌作用且效果好,可用于进一步分离纯化抑菌活性化合物。
实施例2 菌核曲霉(A. sclerotiorum)As-75菌株发酵液拮抗水稻白叶枯病菌活性单体化合物M的制备和结构解析
1 菌株
(1)菌核曲霉(A. sclerotiorum)As-75菌株。
(2)水稻白叶枯病菌(Xanthomonas oryzae pv. oryzae,Xoo)P6小种
2 培养基
同实施例1。
3实验方法
3.1 As-75菌株发酵液粗浸膏制备
按照实例1所述方法制备得27 L发酵液,经真空泵抽滤得25 L滤液,用等体积乙酸乙酯萃取,共萃取3次。萃取液在旋转蒸发仪上50 ℃ 蒸发浓酸至干,得到橙黄色的发酵液粗浸膏(15.5 g)。
3.2 As-75菌株拮抗水稻白叶枯病菌活性单体化合物的制备
3.2.1 硅胶柱层析初步分离
选用60 cm×3 cm玻璃层析柱,200-300目硅胶进行湿法填柱。用二氯甲烷溶解乙酸乙酯粗浸膏,然后利用布氏漏斗过滤掉少量的不溶物,用100-200目硅胶进行拌料。在层析柱上端加上干净的漏斗,将已经完全干燥且与样品充分吸附的硅胶通过漏斗慢慢上样。按照少量多次的加入原则,将样品硅胶加入到层析柱内。使样品均匀装填在层析柱内,保证样品与分离娃胶接触面水平、均匀。
用二氯甲烷:甲醇=100:0(V:V),100:1(V:V),100:2(V:V),100:4(V:V),
100:8(V:V),100:16(V:V),100:64(V:V)等作为洗脱剂进行梯度洗脱,每管100 mL,在旋转蒸发仪上50 ℃ 蒸发浓缩至干。通过TLC点板,将相同成份合并,蒸干,甲醇溶解回收。
以白叶枯病菌生理小种为指示菌,牛津杯法分别测定各组物质活性,设置甲醇处理作为对照组,实验结果重复3次。
3.2.2 凝胶柱层析纯化活性单体化合物
将分离纯化得到的含有拮抗物质的混合物用甲醇溶解,用胶头滴管逐滴加入到凝胶层析柱中。在上样过程中贴壁缓慢加入,防止液滴下落过快造成凝胶面不均匀。上样完毕后,轻轻旋开塞子,控制甲醇滴落流速,保证流速为0.5 mL/min并观察样品进入凝胶的速度。
待样品完全进入凝胶后,缓慢加入甲醇,保持流速,直至样品带出现分层。
当凝胶中被洗脱样品,不同流速的成分色带已经完全分幵,而且洗脱速度最快的成分距层析柱底部约为10 cm时,打开旋塞全速冼脱。收集洗脱液。将洗脱液分别由旋转蒸发器50 ℃蒸干,甲醇溶解。通过硅胶薄层层析,将得到样品分别用不同极性的展开剂展开验证,确定回收成分是否单一。
以白叶枯病菌P6菌株为指示菌,以牛津杯法分别测定分离得到的成分的抑菌活性,设置甲醇为对照,实验结果重复3次,确定拮抗活性单体化合物。
3.3 活性单体化合物M结构解析
采用波谱学技术,核磁共振氢谱(1H NMR)、核磁共振碳谱(13C NMR)和质谱(MS)等方法测定和解析拮抗活性单体化合物的分子量和化学式。
4 实验结果
4.1拮抗活性单体化合物的硅胶柱层析初步分离结果
将拮抗化合物的粗浸膏经硅胶柱层析,TLC点板合并后共得5个组分(A、B、C、D、E),采用牛津杯法分别测定其抑菌活性。结果表明,活性组分主要集中在二氯甲烷:甲醇=100:0(V:V)洗脱下来的洗脱物A中,当供试浓度为0.5 mg/mL时,取200μL,牛津杯法测定抑菌圈直径为40 mm(附图2)。将洗脱物A浓缩至干得到黄色固体。
4.2活性单体化合物的凝胶柱层析纯化结果
将二氯甲烷洗脱得到的物质,通过凝胶柱层析,在层析柱中出现三条色带分层,甲醇洗脱,收集三个组分,分别标号组分①、组分②、组分③。经硅胶薄层层析验证,组分①为少量的混合物,组分②为单点,组分③为少量的混合物。向牛津杯中分别加入组分①、组分②、组分③的甲醇溶液,用牛津杯法验证抑菌活性,证明组分②是抑菌活性成分,抑菌圈直径为44 mm(附图3)。将组分②命名为化合物M,将其放在室温下至干。
4.3 活性单体化合物M的结构解析
单体化合物M:淡黄色,易溶于乙酸乙酯、甲醇、二氯甲烷,微溶于水。化合物M的核磁共振氢谱如附图4、核磁共振碳谱如附图5、质谱如附图6。
由以上图可知单体化合物M的波普数据为:ESI-MS : m/z calcd. for 170 ( C8H10O4 ) . 1H NMR (600 MHz, CDCl3) δ 5.43 (s, 1H), 5.14 (d, J = 11.8 Hz, 1H), 5.11 (s, 1H), 3.89 (s, 2H), 3.88 (s, 1H), 1.72 (s, 3H);13C NMR (151 MHz, CDCl3) δ 180.09 (s), 172.53 (s), 139.73 (s), 116.80 (s), 103.75 (s), 89.63 (s), 77.80 (s), 77.59 (s), 77.38 (s), 60.49 (s), 17.80 (s).
化合物M的结构式如附图1。命名为( 2Z )-2-Butendioic acid, 2-(1-methylethenyl)-, 4-methyl ester;中文名为Z2-(1-甲基乙烯基)-4-顺丁烯二酸单甲酯。
实施例3 活性单体化合物M对水稻白叶枯病的防效研究
1 病菌和水稻品系
水稻白叶枯病菌(Xanthomonas oryzae pv. oryzae,Xoo)P6小种。
水稻品系:选用对白叶枯病菌生理小种P6感病的TN1水稻品系。
2 实验方法
2.1活性单体化合物M水溶液制备
将化合物M配置成0.5 mg/mL水溶液,伴有悬浮状态。
2.2 单体化合物M对水稻白叶枯病的防效实验
参照文献[田小卫, 龙建友, 白红进, 等.一株放线菌次生代谢产物抗菌活性的初步研究植物保护 [J], 2004, 30(2) : 51-54.]的方法,用化合物M水溶液处理TN1水稻品系叶片;参照文献[8,9]的方法接种P6小种和病情的统计。
(1)P6小种的培养和接种:用平板划线法接种P6小种于Xoo固体培养基上活化48 h;用接种环刮取1环接种至Xoo培养液中,置于28 ℃、180 r/min摇床培养48 h。当菌液的OD值达到0.6时,备用。
(2)P6小种接种水稻叶片:待水稻长至分蘖期,用灭菌剪刀蘸取P6小种菌悬液,水平剪去水稻叶尖1.5 cm。
(3)对水稻白叶枯病的防效实验
实验设置P6小种菌悬液处理对照组(CK1)、蒸馏水空白对照组(CK2)、方法1处理组(处理1)和方法2处理组(处理2)。
① CK1:用灭菌剪刀蘸取P6小种菌悬液后进行剪叶处理,并做好接种部位的保湿。
② CK2:用灭菌剪刀蘸取蒸溜水后进行剪叶处理,并做好接种部位的保湿。
③ 处理1:先用喷壶喷洒浓度0.5 mg/mL化合物M水溶液,按1 mL/cm2药液量、每隔0.5 h一次、共6次进行喷洒处理。12 h后,按P6小种菌悬液处理对照组方法接种菌悬液,并做好接种部位的保湿。
④ 处理2:先用灭菌剪刀蘸取P6小种菌悬液进行剪叶处理,保湿处理2 h后,按方法1喷洒化合物M水溶液。
待水稻叶片病斑的产生及发展趋于稳定后,记录并统计发病情况。
3 不同处理方法对水稻白叶枯病的防效结果
病斑长度测量结果见附图7,P6小种菌液处理对照组(CK1)病斑长度为130 mm;蒸馏水空白对照组(CK2),无病斑长出;方法1处理组(处理1),病斑平均长度为28.2 mm;方法2处理组(处理2),病斑平均长度为60.7 mm。处理1和处理2对TN1水稻品系病斑抑制率分别为78.3 %和53.3 %。实验结果表明,化合物M在白叶枯病菌P6小种侵染TN1水稻叶片的过程中,发挥了较好的防病作用,方法1较方法2防病效果更显著。
- 还没有人留言评论。精彩留言会获得点赞!