一种雌二醇新晶型及其制备方法与流程
本发明属于生物医药领域,涉及一种雌二醇新晶型及其制备方法。
背景技术:
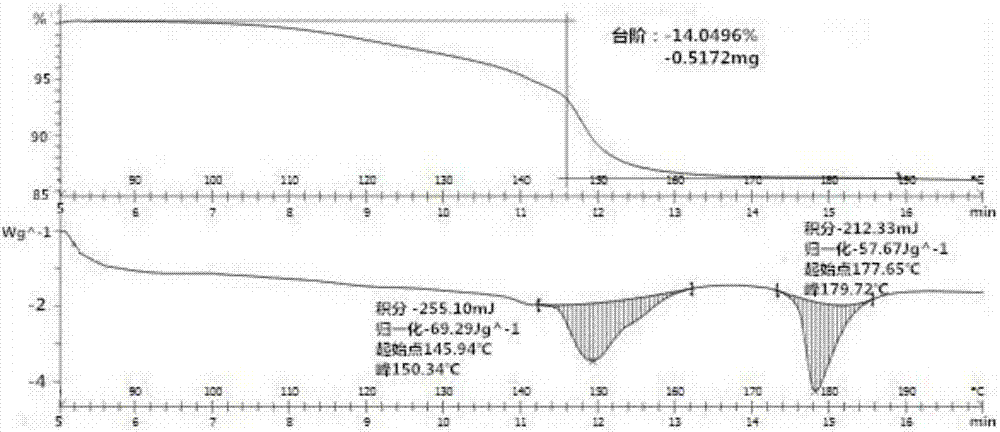
:雌二醇(e2)是卵巢分泌的类固醇类激素,是主要的雌性激素,负责调节女性特征、附属性器官的成熟和月经、排卵周期,促进乳腺导管系统的产生。雌二醇在药学方面不仅对生殖和性功能有重要作用,也影响例如骨骼等其他器官,主要用于激素替代疗法、避孕以及更年期和绝经后症状。e2为白色或类白色结晶粉末,分子式c18h24o2,化学名:雌甾-1,3,5(10)-三烯-3,17-二醇。依据药物溶解性和肠道通透性,一般可将其分成四类:i类,高溶解性、高通透性;ii类,低溶解性、高通透性;iii类,高溶解性、低通透性和iv类,低溶解性、低通透性;而雌二醇属于第ii类,在水中的溶解度仅为0.2-5μg/ml,并且溶出速率很慢,导致生物利用度低(人体约为10%)。因此,通过改善溶解性提高其生物利用度具有重要意义。对于临床药物,治疗效果和安全性最为重要,但在药物开发中,药物活性成分的水溶性差、生物利用度低、物理化学性能不稳定等固体特性通常是影响药物开发的关键因素,也往往是阻碍它进入临床试验的重要原因。研究表明,目前市售的小分子药物中有约90%左右的药物是以固体形态给药,盐、多晶型、水合物和溶剂化物等是较为常见的药物固体形态。药物的不同固体形态能表现出不同的理化性质,而理化性质上的差异会影响其储存稳定性、可压性和密度、以及溶解度和溶出速率等。因此,在药物的固体形态中,特定晶型的药物由于具有某些性质上的优势而被优先选用。其中溶解度是评估优选晶型的最重要的指标之一,药物的溶解度或溶出度会极大地影响其体内生物利用度。近年来,研究人员通过改变药物活性成分的结晶形态,以期改善其理化性质,希望在药物开发阶段找到最合适的药物固体形态以减少后续开发的时间和成本。因此研究雌二醇的新晶型对于临床药物的开发,提高药品生产质量具有重要的意义。技术实现要素:为了弥补现有技术的不足,本发明的目的在于提供一种溶解度高的雌二醇新晶型以及新晶型的制备方法。为了实现上述目的,本发明采用如下技术方案:本发明提供了一种雌二醇晶型,所述晶型为雌二醇的甲酰胺溶剂合物。进一步,所述晶型的实验式为c19h27no3。进一步,所述晶型为正交晶系,空间群为空间群为p212121,晶胞参数为α=β=γ=90°,z=8,晶胞体积为进一步,使用cu-kβ的x-射线粉末衍射方法,2θ角在约14.971°、15.0082°、20.740°、20.8286°、21.479°、21.632°处有特征衍射峰。进一步,使用cu-kβ的x-射线粉末衍射方法,2θ角还在约12.490°、16.142°、16.574°、18.881°、27.052°、28.956°处有特征衍射峰。本发明提供了上述雌二醇晶型的制备方法,方法为:将雌二醇原料药溶解在四氢呋喃中,而后加入甲酰胺溶剂,降温至0-5℃反应24h,过滤后烘干,得到雌二醇晶型。进一步,雌二醇雌二醇与四氢呋喃的重量体积比为50:1~75:1,在本发明的具体实施方式中,雌二醇与四氢呋喃的重量体积比为75:1。进一步,四氢呋喃与甲酰胺的体积比为1:0.5~1,在本发明的具体实施方式中,四氢呋喃与甲酰胺的体积比为1:0.5。本发明提供了上述雌二醇晶型在制备治疗妇科疾病的药物组合物中的应用。本发明提供了一种药物组合物,包括上述的雌二醇晶型及药学上可接受的载体。进一步,药学上可接受的载体包括但不限于缓冲剂、乳化剂、悬浮剂、稳定剂、防腐剂、生理食盐等。作为缓冲剂,能够使用磷酸盐、甘氨酸,山梨酸,山梨酸钟,饱和植物脂肪酸的部分甘油酯混合物,水,盐或电解质例如硫酸钾、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐,胶态二氧化硅,三硅酸镁,聚乙烯吡咯烷酮,基于纤维素的物质,聚乙二醇,羧甲基纤维素钠,聚丙烯酸酯,蜡,聚乙烯-聚氧丙烯嵌段共聚物,聚乙二醇和羊毛脂等。作为乳化剂,能够使用阿拉伯树胶、海藻酸钠、西黄芪胶等。作为悬浮剂,能够使用单硬脂酸甘油、单硬脂酸铝、甲基纤维素、羧甲基纤维素、羟甲基纤维素、月桂基硫酸钠等。作为稳定剂,能够使用丙二醇、二亚乙基亚硫酸盐、抗坏血酸等。作为防腐剂,能够使用叠氮化钠、苯扎氯铵、对羟苯甲酸、氯丁醇等。本发明的药物组合物还可以包括离子交换剂如矾土,硬脂酸铝,卵磷脂,半乳化药物递送系统(sedds)例如dα一生育酚聚乙二醇1000琥珀酸盐,在药物剂型中使用的表面活性剂例如吐温或其它类似聚合递送基质,血清蛋白例如人血清白蛋白,也可以使用环糊精例如α-环糊精、β-环糊精、和γ-环糊精,或化学修饰的衍生物例如是羟基烷基环糊精,包括2-和3-羟基丙基-β-环糊精、或其它增溶衍生物来促进本发明化合物的递送。本发明的药物组合物还包括药学上可接受的赋形剂、填充剂、凝结剂与调和剂,如含水乳糖或无水乳糖、淀粉、葡萄糖、蔗糖、甘露醇、山梨醇、硅酸、微晶纤维素、羟甲基纤维素钠、淀粉甘醇酸钠及其衍生物等。本发明的药物组合物还包含界面活性剂、乳化剂、扩散剂、消泡剂等。任何药学上或医学上可接受的界面活性剂、乳化剂、扩散剂、消泡剂等皆可被使用。本发明的药物组合物还包括药学上可接受的涂层材料包括(但不限于),快速分解涂层材料、染色剂、肠溶性聚合物、增塑剂、水溶性聚合物、水不溶性聚合物、染料、色素、其他崩散剂。常见快速分解涂层材料包括opadry;肠溶性聚合物包括甲基内烯酸聚合物、磷羟丙甲基纤维素苯二甲酸酯、羟丙甲基纤维素乙酸酯、羟丙甲基纤维素琥珀酸酯、羟甲乙基纤维素、乙酰磷苯二甲酸纤维素;增塑剂包括聚乙二醇(peg)、丙二醇等。本发明所述药物组合物可口服给药、非胃肠道给药、通过吸入喷雾给药、局部给药、直肠给药、鼻给药、颊给药、阴道给药或通过植入的贮药装置给药。优选口服给药或注射给药。本发明药物组合物可含有任何常用的无毒可药用载体、辅料或赋形剂。在某些情况下,药用酸、碱或缓冲剂可用来调节制剂的ph以提高所配制的化合物或其给药剂型的稳定性。本文所用术语非胃肠道包括皮下、皮内、静脉内、肌内、关节内、动脉内、滑膜内、胸骨内、鞠内、损伤部位内、和颅内注射或输注技术。只要能达到目标组织,本发明所述药物组合物可以通过任何途径给予受体。本发明药物组合物可以以任何口服剂型的形式口服给药,包括但不限于胶囊、片剂、乳剂和水悬浮液、分散剂和溶液。对于口服片剂,常用载体包括乳糖和玉米淀粉。一般还加入润滑剂例如硬脂酸镁。为了以胶囊形式口服给药,适用的稀释剂包括乳糖和无水玉米淀粉。当口服施用水悬浮液和/或乳液时,可将活性组分悬浮或溶解在油相中,并与乳化剂和/或悬浮剂合并。如果需要的话,可加入一些甜味剂和/或矫味剂和/或着色剂。适当时,可将用于口服给药的剂量单位制剂包微囊。例如,通过在聚合物、蜡等中将颗粒物质包衣或包埋,也可制备所述制剂已延长或维持释放。本发明的药物组合物可用于妇产科疾病的治疗,包括治疗月经不调、不孕不育、性腺疾病等妇科疾病。在本发明中,图1所示的衍射峰不代表式雌二醇晶型所显示衍射峰的详尽情况。x射线粉末衍射图的2θ值是可以随着机器以及随着样品制备中的变化和批次间变化而轻微变化,所引用的值不视为绝对值。还应理解的是,峰的相对强度可能随取向效应而变,因此本发明所含的pxrd迹线中所示的强度是示例性的,并不用于绝对比较。本发明的优点和有益效果:本发明发现了一种雌二醇新晶型,该晶型化合物具有较高的溶解度。本发明提供了雌二醇新晶型的制备方法,该方法操作简单,方便,适用于工业生产。附图说明图1是雌二醇晶型的pxrd扫描图谱;图2为雌二醇晶型的tga/dsc扫描图谱。具体的实施方式下面结合附图和实施例对本发明作进一步详细的说明。以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。实施例1雌二醇晶型的制备在4ml的四氢呋喃溶液中加入雌二醇300mg,而后升温溶清,缓慢加入甲酰胺2ml,而后反应液缓慢降到0-5度,保持24h,过滤烘干得到产品。实施例2雌二醇晶型的单晶-x射线衍射(sxrd)检测1、使用仪器是x-射线单晶衍射仪(geminiaultra,美国agilent公司),发射的mokα射线,以ω/2θ扫描方式收集数据。数据的还原和吸收校正使用olex2软件处理。空间群根据系统的消光规律确定,并由精修结果验证。晶体结构使用shelxs程序,由直接法解出,以全矩阵最小二乘法修正结果,碳上的氢原子坐标按理论计算加入,其他原子上的氢原子坐标根据电子密度图计算加入。2、结果结果如表1所示,雌二醇晶型为甲酰胺溶剂合物。表1雌二醇甲酰胺溶剂合物的结晶学参数实施例3雌二醇新晶型的pxrd检测1、晶型样品的处理晶型样品经研磨并过100目筛,精密称量50mg作为衍射实验用样品。2、x-射线粉末衍射检测仪的设定使用日本rigaku公司的x-射线粉末衍射检测仪(d/texultra250)进行检测,具体采集信息如下:cu阳极(40kv,150ma),2θ扫描范围3~90°,扫描速度10.4018°/min,步长0.02°,ds发射狭缝0.5°,rs接收狭缝为0.3mm。3、结果结果如表2和图1所示,雌二醇新晶型的x-射线粉末衍射图谱在2θ值的相应位置对应有特征衍射峰。表2雌二醇新晶型的x-射线粉末衍射图的表征数据peak2-θ(deg)d(ang)height(cps)112.490(5)7.081(3)14998(361)214.971(7)5.913(3)30880(517)315.0082(15)5.8983(6)42582(608)416.142(8)5.487(3)10105(296)516.574(4)5.3443(13)19693(413)618.881(16)4.696(4)9596(288)720.740(6)4.2792(12)106018(959)820.8286(14)4.2613(3)289832(1585)921.479(6)4.1338(12)43303(613)1021.632(5)4.1048(10)93301(899)1127.052(5)3.2935(6)9853(292)1228.956(6)3.0811(7)17266(387)实施例4雌二醇新晶型tga/dsc检测1、将约3.6815mg的样品精确称重到铝坩埚盘中,使用非密封的盖来密封。2、将样品负载到dsc仪器中,将样品以10k/min从30℃加热到200℃,氩气流速为50ml/min,监测热-流动反应中的变化。根据需要,使用铟和铅参考标准的两点校准来预先校准仪器。3、结果tga/dsc检测结果如图2所示,雌二醇甲酰胺溶剂合物在室温至170℃范围内,其失重率为14%,说明该晶型中含有约14%的溶剂,与x射线单晶衍射结果一致;该晶型有2个吸热峰,在约179.72℃处存在最大的吸热峰。实施例5雌二醇新晶型的稳定性研究1、将样品分别在高温(60±2℃)、高湿(90%±5%)、光照(4500±500lx)条件下放置10天,于第0天、5天、10天分别取样进行粉末x射线衍射分析。2、于压力为2t、4t、6t和8t条件下压片,取样进行粉末x射线衍射分析。3、结果经x射线粉末衍射测式,主要2θ角均未发生显著变化,说明雌二醇晶型在高温、高湿、光照下稳定,雌二醇晶型属于稳定晶型。实施例6雌二醇的溶出行为研究1、溶出条件装置:桨法溶出介质:水、ph1.2盐酸氯化钠缓冲液、ph4.5醋酸盐缓冲液、ph6.8磷酸盐缓冲液、0.2%sds水(w/v)、0.5%sds水(w/v)体积:1000ml温度:37℃转速:100rpm2、溶出介质的制备水:采用去离子水,脱气备用ph1.2介质:取氯化钠约2.0g和盐酸7.0ml,加脱气后水溶解并稀释至1000ml,即得。ph4.5介质:取无水醋酸钠约2.99g,加2mol/l醋酸溶液(取120.0g(114ml)冰醋酸用水稀释至1000ml)14ml,用脱气后水稀释至1000ml,即得。0.2%sds水介质:取sds约2g,用脱气后水溶解并稀释至1000ml,即得。3、不同晶型的雌二醇的制备按照文献(parkjsetal.eurjpharmbiopharm.(2005),doi:10.1016/j.ejpb.2005.01.010)中所示的方法制备雌二醇晶型em、et和ec。4、溶出方法分别取不同晶型的雌二醇化合物适量,研细,分别取细粉约20mg,置溶出仪中,照上述条件进行,分别于10min、20min、30min、45min、60min、90min、120min、180min、240min、300min取样10ml,并补液10ml,0.45μm膜滤过,采用hplc方法进行测定,计算其累积溶出度。5、结果不同晶型的雌二醇在不同的介质中的溶出度如表3-6所示,雌二醇的新晶型甲酰胺溶剂合物晶型具有较高的溶出度。表3雌二醇在0.2%sds水介质中的溶出度表4雌二醇在0.5%sds水介质中的溶出度表5雌二醇在ph4.5介质中的溶出度表6雌二醇在ph1.2介质中的溶出度上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1