沙棘GPD1基因的构建方法与流程
本发明涉及生物工程技术领域,具体涉及沙棘GPD1基因的构建方法。
背景技术:
木本油料的开发利用是缓解当前食用油供应不足且耕地逐渐减少的有效途径。沙棘是重要的生态经济树种,果实油脂中富含omega-3、omega-6和omega-7脂肪酸,在预防和治疗癌症、冠心病和胃肠疾病等方面具有显著疗效,但较低的含油率(种子为7~11%,鲜果肉为1~5%)制约了沙棘油的高效开发和利用。
沙棘油脂的主要成分是甘油三脂(Triacylglycerols,TAG),TAG合成的关键原料是3-磷酸甘油(glycerol-3-phosphate,G3P),而G3P是由糖酵解的中间产物磷酸二羟丙酮被3-磷酸甘油脱氢酶(glycerol-3-phosphatedehydrogenase,GPD1)还原而来,例如Vigeolas等从酵母中分离GPD1基因,通过调控种子特殊启动子活性,使GPD1活性增加2倍,油菜种子中的G3P水平增加3~4倍,种子含油量提高40%(PlantBiotechnologyJournal.2007,5:431-441)。目前,GPD1的功能研究多基于酵母、菌类和草本植物等试验材料,而在木本植物,尤其沙棘中的研究罕见,如沙棘GPD1基因序列、载体构建、遗传转化和功能分析均未见报道,而且种子油脂合成和积累机制也仍存在许多未知,如油脂合成关键基因在相对贡献、代谢流调节及代谢物在不同组织间转运等。
技术实现要素:
为弥补现有技术的不足,本发明提供沙棘的GPD1基因的构建方法如下:
(1)提取沙棘果肉RNA,并获得GPD1基因cDNA;
(2)构建沙棘GPD1基因过表达载体;
(3)利用沙棘GPD1基因过表达载体转化农杆菌;
(4)利用pBI121-T-GPD1重组表达载体转化烟草;
(5)转化烟草的分子检测;
(6)测定烟草叶片含油率。
进一步的,步骤(3):农杆菌感受态细胞制备过程中,采用含有100mg/L链霉素和100mg/L利福平的发根农杆菌培养基,在冻融法转化农杆菌过程中,采用含有100mg/L链霉素(Str)、100mg/L利福平(Rif)和50mg/L卡那霉素(Kan)的发根农杆菌培养基(YEB)。
进一步的,步骤(4)转化烟草过程中使用的MS预培养固体培养基组成为:4.74g/LMS培养基粉末、30g/L蔗糖、8g/L琼脂粉、0.5mg/L6-苄氨基腺嘌呤(6-BA)、0.1mg/Lα.萘乙酸(NAA),pH6.0。
进一步的,步骤(4)转化烟草过程中使用的分化培养基组成为:4.74g/LMS培养基粉末、30g/L蔗糖、8g/L琼脂粉、0.5mg/L 6-苄氨基腺嘌呤(6-BA)、0.1mg/Lα/萘乙酸(NAA)、50mg/L卡那霉素(Kan)、500mg/L羧苄青霉素(Car),pH6.0。
沙棘GPD1基因的序列如下:ATGGCTCCAGAAGCCTTCGAGTCTCACCAGGAGGAAGGTACTTTGTCCCTCTACAATGAAGTTGTTGTTGAAAAATCCAAAGTCACTGTTGTGGGTAGTGGCAATTGGGGTAGCGTGGCTGCCAAGCTTATTGCTTCCAATACCCTCAGGCTCAGCTCTTTTCATGATGAGGTGAGAATGTGGGTATTTGAGGAAACATTGCCAAGTGGAGAGAAACTCACAGATGTAATCAACCGGACCAATGAAAATGTCAAATATCTTCCAGGTATAAAGCTTGGTAAAAATGTTGTTGCTGATCCAAACCTTGAAAATGCAGCAAAGGATGCAAACATGTTGGTATTCGTAACCCCGCATCAGTTTATGGAGGATATTTGTAAAAGGCTGTTAGGGAAGATAAAAAGAGGCGTGGATGCTATATCCCTTGTTAAAGGAATGGAGGTCAAGATGGAAGGTCCTTGCATGATCTCTACTCTAATCTCCCAGCAACTGGGTGTTAATTGCTGTGTTCTAATGGGGGCAAATATAGCAAATGAGATTGCTGTGGAGAAATTTAGTGAAGCAACTGTCGGATACAGAGCAAATAGAGAGGTTGCAGAGAAATGGGTTCACCTGTTTAGTACTCCCTATTTCATTGTCACACCTGTCCAAGATGTGGAAGGAGTAGAACTATGTGGAACCCTGAAAAATGTTGTAGCTATAGCAGCAGGTTTTGTGGATGGGTTGGATATGGGAAATAACACAAAGGCTGCAATTATGAGAATTGGTCTCAGAGAGATGAAGGCATTTTCCAAATTGTTGTTTCCATCGGTCAAAGACAACACGTTCTTTGAGAGCTGTGGTGTTGCTGATCTCATTACAACATGCTTGGGAGGACGAAACAGGAAAGTTGCTGAAGCTTTTGCAAAGAATGGGGGGAATAGATCATTTGATGAGCTTGAAGCAGAAATGCTGCAAGGCCAGAAATTACAGGGTGTCTCCACAGCAAAAGAAGTTTATGAGGTTTTAACTCATCGTGGATGGCTAGAAATGTTTCCACTTTTCGCAACAGTGCAGGAGATCTGCATTGGCCGTCTCCCACCACCCGCAATAGTTCAACATGCTGAGCACAAGCTTAAATTTTCTGTGCTAGAAGGCTCTTCA。
本发明的有益效果如下:
(1)沙棘是自然界中罕有的在非种子组织中高积累油脂的植物,其果肉油脂约占干重的30%。本发明首次发现高低油品种的果肉含油率比值3.9与果肉GPD1基因表达量峰值的比值3.4相近。
(2)本发明首次从沙棘果肉中分离获得GPD1基因,并通过构建过表达载体及农杆菌介导法成功转化烟草,使烟草叶片油脂含量提高28%。这为沙棘果肉以及植物非种子组织油脂合成积累机制研究提供技术依据。
(2)农杆菌感受态细胞制备过程中,采用了含有100mg/L Str和100mg/L Rif的YEB液体培养基,在冻融法转化农杆菌过程中,采用了含有100mg/L Str、100mg/L Rif和50mg/L Kan的YEB固体培养基,这样有效的抑制其他杂菌,减少污染,提高转化效率。
(3)烟草转化过程中,应用叶片预培养、共培养、筛选分化培养和继代生根培养过程中所使用的经过改进的MS培养基,提高了转化烟草的分化和生根效率。
附图说明
图1为重组表达载体的构建示意图;
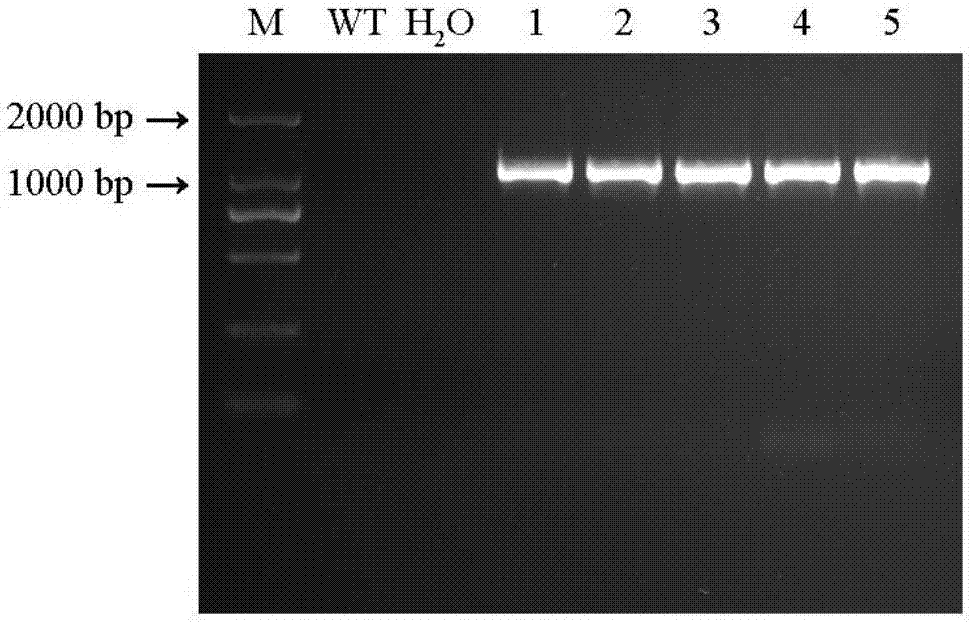
图2转化烟草叶片的PCR检测图。
具体实施方式
下面结合实施例对本发明做进一步的说明,但不限制本发明的保护范围。
实施例1提取沙棘果肉RNA,并获得GPD1基因cDNA
收集高果肉油品系‘TF2-36’(由黑龙江省农业科学院浆果研究所培育)的成熟期果实,采摘后液氮速冻,将完好的果实剔除种子后用液氮研磨。参照上海生工公司柱式植物总RNA抽提纯化试剂盒推荐方法进行沙棘果肉总RNA提取和纯化。参照大连宝生物(TaKaRa)公司Prime Script TMII 1st Strand Cdna Synthesis Kit试剂盒方法,以Oligo(dT)为引物反转录合成cDNA。以上述cDNA为模板,分别以ATGGCTCCAGAAGCCTTCGA和TGAAGAGCCTTCTAGCACAGAA为上下游引物进行PCR扩增。PCR反应体系如下:
反应程序为:94℃5min预变性;94℃变性30s,55℃退火30s,72℃延伸1min,35个循环;72℃延伸10min;4℃保存。
用1%琼脂糖凝胶电泳检测PCR产物,利用紫外凝胶成像仪上切取目的片段(大小约为1140bp)。参照TaKaRaMiniBESTAgaroseGelDNAExtraction试剂盒方法回收纯化DNA片段,并连接目的片段与克隆载体pMD18-T,测序验证获得沙棘GPD1全长cDNA。
实施例2构建沙棘GPD1基因过表达载体
根据沙棘GPD1基因序列,设计5’端分别带有BamHI和SacI限制性酶切位点的上下游引物cgGGATCCATGGCTCCAGAAGCCTTCGA和cGAGCTCTGAAGAGCCTTCTAGCACAGAA。以pMD18-T-GPD1质粒为模板,扩增含有酶切位点的目的片段。将pBI121空载体质粒以及重组质粒pMD18-T-GPD1分别用BamHI和SacI进行酶切。利用T4连接酶连接pBI121载体框架和pMD18-T-GPD1,反应体系如下:
反应程序为:16℃条件下反应6-8h。将连接产物转化大肠杆菌DH5α,在Kan抗性培养基上筛选转化子,挑取阳性克隆提取质粒进行酶切鉴定,载体图见图1所示。
实施例3利用沙棘GPD1基因过表达载体转化农杆菌
在YEB固体培养基平板上划线培养农杆菌GV3101菌株,28℃条件下倒置培养18-20h;将单菌落置于YEB液体培养基(含有100mg/L Str和100mg/L Rif),28℃条件下振荡培养18-20h;100倍体积的不含抗生素的菌液加入菌液中,28℃条件下振荡培养OD600至0.3-0.5;冰上冷却后,4℃条件下4000r/min离心5min,弃上清;加入20mmol/L的CaCl2溶液使沉淀悬浮,4℃条件下4000r/min离心5min,弃上清;加入20mmol/L的CaCl2溶液再次使菌体沉淀悬浮备用。
采用冻融法,将含有重组过表达载体pBI121-T-GPD1的质粒加入到农杆菌感受态细胞GV3101中,先置于冰上10min,然后液氮速冻5min,最后37℃水浴5min。反应液与YEB液体培养基在28℃条件下培养2-3h后5000r/min离心2min,弃一部分上清,重新悬浮菌体,将其涂布于YEB固体培养基(含有100mg/L Str、100mg/L Rif和50mg/L Kan)平板上倒置培养36-48h。以阳性单菌落的菌液为模板,用GPD1基因特异性引物进行PCR检测,产物片段与目的基因大小一致,表明成功获得了含重组表达载体pBI121-GPD1的农杆菌菌株。
实施例4pBI121-T-GPD1重组表达载体转化烟草
将消毒后的烟草种子播种于MS固体培养基上,25±3℃条件下16h光照/8h黑暗培养5周。剪取烟草叶片,近轴面朝上置于MS预培养固体培养基上(4.74g/LMS培养基粉末+30g/L蔗糖+8g/L琼脂粉+0.5mg/L 6-BA+0.1mg/L NAA,pH6.0),25±3℃条件下黑暗培养2天。将烟草叶片置于含有pBI121-T-GPD1重组表达载体的农杆菌菌液中浸泡5min,然后吸干叶片表面菌液,再将其近轴面朝上重新放回培养基,25±3℃条件下黑暗共培养2天。将共培养2天的烟草叶片用含500mg/LCar的无菌水清洗两遍,无菌滤纸吸干表面液体后置于含有抗生素的MS固体筛选分化培养基上(4.74g/L MS培养基粉末+30g/L蔗糖+8g/L琼脂粉+0.5mg/L 6-BA+0.1mg/L NAA+50mg/L Kan+500mg/L Car,pH6.0),25±3℃条件下16h光照/8h黑暗进行筛选和分化培养,直到外植体切口处形成愈伤并分化出小苗。选取带有生长点且发育状态良好的抗性苗,将其切下后转移到1/2MS培养基中(2.47g/L1/2MS培养基粉末+20g/L蔗糖+8g/L琼脂条+50mg/L Kan+250mg/L Car,pH5.8)进行继代增殖和生根培养。
实施例5转化烟草的分子检测
参照天根生化科技有限公司的基因组DNA提取试剂盒方法提取未转化的野生型烟草(WT)和Kan筛选后的转化烟草的叶片基因组DNA,以上述基因组DNA为模板,利用沙棘GPD1特异性引物进行PCR扩增,反应体系及扩增条件如实施例1所述,用1%琼脂糖凝胶电泳验证目的条带大小,有5个转基因株系扩增出与目的基因大小相同的条带,而WT植株无扩增条带,如图2所示,表明GPD1基因已成功地转入烟草。
实施例6测定烟草叶片含油率
采用氯仿甲醇法,冷冻干燥的叶片粉末转移至玻璃试管中,加入甲醇和氯仿(体积浓度百分比2:1),漩涡混匀后超声30min,上清液转移到新试管中,残渣用氯仿甲醇溶液再次提取,合并的上清液,加入上清液1/4体积的氯化钾溶液(质量浓度0.88%),收集下层液至玻璃样品瓶中,挥发至恒重。含油率(%)=(m1-m2)/m×100;m1为油脂和玻璃样品瓶的质量(g);m2为玻璃样品瓶的质量(g);m为干燥样品粉末的质量(g),3次重复。
未转化的野生烟草叶片含油率约为5.02%,转化GPD1基因的烟草叶片含油率为6.43%,可见,转化沙棘GPD1基因可使烟草叶片油脂含量提高28%。
<110>大连民族大学
<120>沙棘GPD1基因的构建方法
<160>1
<210>1
<211>1140
<212>DNA
<400>1
ATGGCTCCAGAAGCCTTCGAGTCTCACCAGGAGGAAGGTACTTTGTCCCTCTACAATGAAGTTGTTGTTGAAAAATCCAAAGTCACTGTTGTGGGTAGTGGCAATTGGGGTAGCGTGGCTGCCAAGCTTATTGCTTCCAATACCCTCAGGCTCAGCTCTTTTCATGATGAGGTGAGAATGTGGGTATTTGAGGAAACATTGCCAAGTGGAGAGAAACTCACAGATGTAATCAACCGGACCAATGAAAATGTCAAATATCTTCCAGGTATAAAGCTTGGTAAAAATGTTGTTGCTGATCCAAACCTTGAAAATGCAGCAAAGGATGCAAACATGTTGGTATTCGTAACCCCGCATCAGTTTATGGAGGATATTTGTAAAAGGCTGTTAGGGAAGATAAAAAGAGGCGTGGATGCTATATCCCTTGTTAAAGGAATGGAGGTCAAGATGGAAGGTCCTTGCATGATCTCTACTCTAATCTCCCAGCAACTGGGTGTTAATTGCTGTGTTCTAATGGGGGCAAATATAGCAAATGAGATTGCTGTGGAGAAATTTAGTGAAGCAACTGTCGGATACAGAGCAAATAGAGAGGTTGCAGAGAAATGGGTTCACCTGTTTAGTACTCCCTATTTCATTGTCACACCTGTCCAAGATGTGGAAGGAGTAGAACTATGTGGAACCCTGAAAAATGTTGTAGCTATAGCAGCAGGTTTTGTGGATGGGTTGGATATGGGAAATAACACAAAGGCTGCAATTATGAGAATTGGTCTCAGAGAGATGAAGGCATTTTCCAAATTGTTGTTTCCATCGGTCAAAGACAACACGTTCTTTGAGAGCTGTGGTGTTGCTGATCTCATTACAACATGCTTGGGAGGACGAAACAGGAAAGTTGCTGAAGCTTTTGCAAAGAATGGGGGGAATAGATCATTTGATGAGCTTGAAGCAGAAATGCTGCAAGGCCAGAAATTACAGGGTGTCTCCACAGCAAAAGAAGTTTATGAGGTTTTAACTCATCGTGGATGGCTAGAAATGTTTCCACTTTTCGCAACAGTGCAGGAGATCTGCATTGGCCGTCTCCCACCACCCGCAATAGTTCAACATGCTGAGCACAAGCTTAAATTTTCTGTGCTAGAAGGCTCTTCA。
- 还没有人留言评论。精彩留言会获得点赞!