用于纯化纤维蛋白原的方法与流程
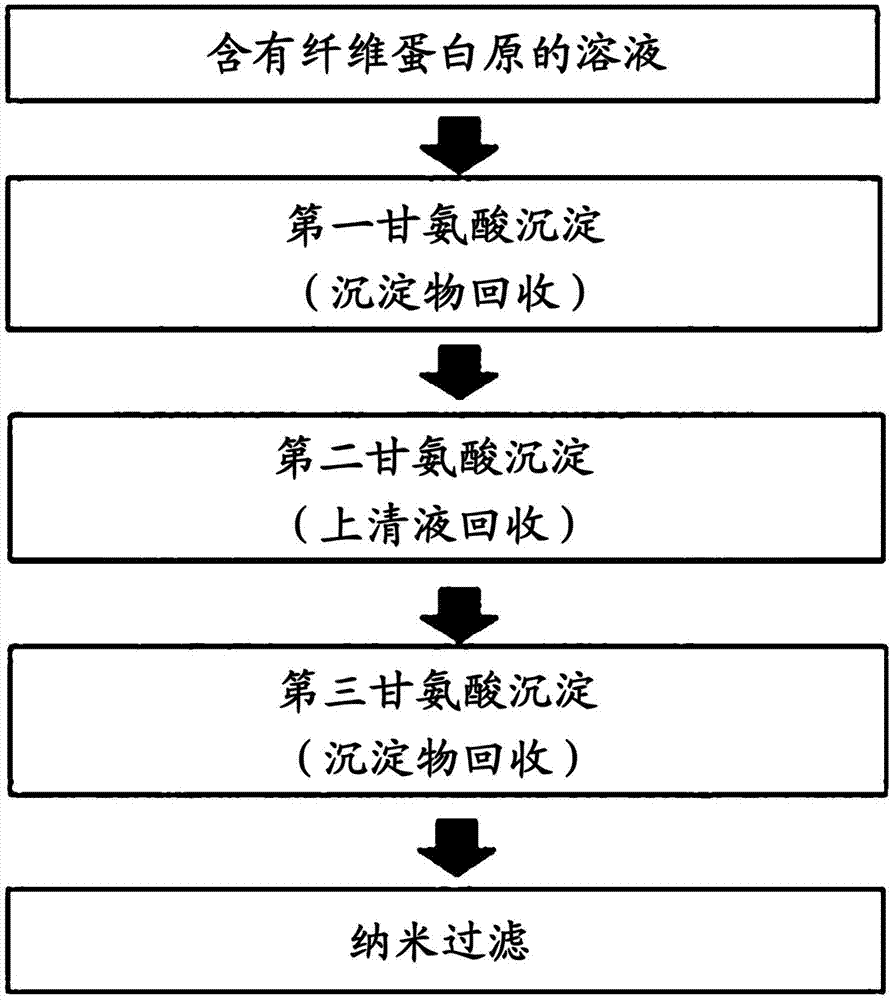
本发明涉及一种用于纯化纤维蛋白原的方法,并且更具体地,涉及一种包括以下步骤的用于纯化纤维蛋白原的方法:(a)通过将甘氨酸添加到含有纤维蛋白原的溶液中使甘氨酸的浓度为1.5至2.5m而使该溶液中的纤维蛋白原沉淀,然后去除上清液,并回收沉淀物(第一甘氨酸沉淀);(b)使步骤(a)的第一甘氨酸沉淀的沉淀物溶解于溶解缓冲液中以获得溶液,通过向其中添加甘氨酸使甘氨酸浓度为0.2至1.2m而使所述溶液沉淀,和回收上清液(第二甘氨酸沉淀);(c)通过向其中添加甘氨酸使甘氨酸浓度为1.5至2.5m而使步骤(b)的上清液沉淀,和回收沉淀(第三甘氨酸沉淀);和(d)使步骤(c)的沉淀溶解于溶液缓冲液以获得溶液,并使用纳米过滤器使所述溶液经受纳米过滤(nf)。
背景技术
纤维蛋白原,也称为凝血因子i,在止血和伤口愈合中起关键作用。它是在肝脏中合成的糖蛋白,具有340kda的表观分子量,并且由两个二聚体组成,两个二聚体中的每个由通过二硫桥连接的称为aα、bβ和γ的三对不相同多肽链构成。它以约150-400μg/ml的浓度在血流中循环。在血管损伤时,血小板被激活并形成栓。纤维蛋白原通过帮助交联活化的血小板而参与初期止血。
与此同时,开始凝血级联的活化。作为终点,通过藉由凝血酶蛋白水解释放纤维蛋白肽a和以更低速率蛋白水解释放纤维蛋白肽b,使纤维蛋白原转化为纤维蛋白。将可溶纤维蛋白单体装配成双链扭曲的纤丝。随后,这些纤丝以横向方式排列,产生更粗的纤维。然后通过fxiiia使这些纤维交联成纤维蛋白网络,其通过纤维蛋白与活化的血小板的相互作用稳定了血小板栓,产生稳定的凝块。
病症和缺乏
先天性无纤维蛋白原血症是一种罕见的出血病症,其中,患者由于纤维蛋白原的缺乏或功能失常而患有血液凝固不足。该病症可导致自发出血或在小的创伤后或在介入性程序过程中过度出血。
纤维蛋白原的获得性缺陷比先天性无纤维蛋白原血症更常见,并且可由血稀释或其他事件诸如手术、创伤、弥散性血管内凝血(dic)或脓毒症过程中的失血诱导。
可以通过替代疗法静脉输注新鲜冷冻血浆或低温沉淀物,而将纤维蛋白原缺乏校正到血浆中约1.5-3g/l的正常纤维蛋白原水平。然而,这些治疗有将病原体例如病毒或朊病毒引入患者的风险,并且因此导致另外的病症。因此建议经过静脉应用病毒失活的纤维蛋白原组合物以安全的方式恢复生理水平的纤维蛋白原。
纤维蛋白原纯化
人血浆含有超过100种蛋白质的复杂混合物,纤维蛋白原占蛋白质总量的约2%。因此,纤维蛋白原的纯化和分离通常需要多个步骤,并且这些单独过程步骤的多种组合是可能的。
常规地,从人血浆纯化纤维蛋白原的一个重要组分是沉淀。已知的沉淀方法使用氨基酸诸如甘氨酸或丙氨酸(参见,欧洲专利号ep0383234;国际公开号wo2001/48016;jakobsen&kierulf,thrombosisresearch,3:145-159,1973),硫酸铵(参见:美国专利号5,773,033;美国专利号6,037,457;takeda,y,journalofclinicalinvestigation,45:103-111,1966),聚合物诸如聚乙二醇(peg)(参见,国际公开号wo1995/25748;vilaetal.,thrombosisresearch39:651-656,1985),乙醇(参见,欧洲专利号ep0408029,其中用5-10%乙醇将纤维蛋白原沉淀并与其他血浆蛋白质分离;blomback&blomback,arkivforkemi,10:415-443,1956),硫酸化多糖(sps,例如肝素)(参见:国际公开号wo1999/37680;美国专利号4,210,580),和低离子强度溶液(参见,美国专利号4,188,318)。
公开的在人纤维蛋白原纯化过程中与甘氨酸沉淀有关的常规技术的实例包括两步甘氨酸沉淀过程,其包括去除在用于去除病原粒子(例如病毒)的巴斯德消毒法过程中产生的杂质和浓缩纤维蛋白原(cslbehring,2009),和三步甘氨酸沉淀过程,其通过仅使用高浓度1.5-1.7m甘氨酸获得纤维蛋白原沉淀物(作为参考:美国专利号7,442,308;grifols,es)。然而,尚未报道的是通过使用浓度比上述过程中使用的甘氨酸的浓度低2至4倍的甘氨酸进行沉淀过程去除含有杂质和不溶性物质的甘氨酸沉淀物,用高浓度的甘氨酸沉淀回收的上清液,并且当纳米过滤含有溶解于其中的沉淀物的纤维蛋白原溶液时,通过改善纳米过滤的功效而增加高纯度纤维蛋白原的回收率。
在该技术背景下,本发明的发明人已经做出广泛努力来开发一种用于纯化纤维蛋白原的方法,其包括以下步骤:(a)通过将甘氨酸添加到含有纤维蛋白原的溶液中使甘氨酸的浓度为1.5至2.5m而使该溶液的纤维蛋白原沉淀,然后去除上清液,并回收沉淀物(第一甘氨酸沉淀);(b)使步骤(a)的第一甘氨酸沉淀的沉淀物溶解于溶解缓冲液中以获得溶液,通过向其中添加甘氨酸使甘氨酸浓度为0.2至1.2m而使所述溶液沉淀,和回收上清液(第二甘氨酸沉淀);(c)通过向其中添加甘氨酸使甘氨酸浓度为1.5至2.5m而使步骤(b)的上清液沉淀,和回收沉淀物(第三甘氨酸沉淀);和(d)使步骤(c)的沉淀物溶解于溶解缓冲液中以获得溶液,和使用纳米过滤器使所述溶液经受纳米过滤(nf),过滤的功效增加至少2倍,从而可回收从其中去除了病毒的高纯度纤维蛋白原,由此完成本公开内容的发明。
技术实现要素:
技术问题
本公开内容的目的是提供一种用于纯化高纯度纤维蛋白原的方法,其可增加纳米过滤的功效。
技术方案
为了实现上述目的,本公开内容提供了一种用于纯化纤维蛋白原的方法,其包括以下步骤:(a)通过将甘氨酸添加到含有纤维蛋白原的溶液中使甘氨酸的浓度为1.5至2.5m而使所述溶液的纤维蛋白原沉淀,然后去除上清液,并回收沉淀物(第一甘氨酸沉淀);(b)使步骤(a)的第一甘氨酸沉淀的沉淀物溶解于溶解缓冲液中以获得溶液,通过向其中添加甘氨酸使甘氨酸浓度为0.2至1.2m而使所述溶液沉淀,和回收上清液(第二甘氨酸沉淀);(c)通过向其中添加甘氨酸使甘氨酸浓度为1.5至2.5m而使步骤(b)的上清液沉淀,和回收沉淀物(第三甘氨酸沉淀);和(d)使步骤(c)的沉淀物溶解于溶液缓冲液中以获得溶液,和使用纳米过滤器使所述溶液经受纳米过滤(nf)。
附图说明
图1显示了根据本公开内容的一种用于纯化纤维蛋白原的方法。
图2显示了通过使用根据本公开内容的一种用于纯化纤维蛋白原的方法从低温糊状物(cryopaste)配制纤维蛋白原产物的一种具体制备方法。
图3显示了当仅进行第一和第三甘氨酸沉淀过程而没有第二甘氨酸沉淀过程时获得的纤维蛋白原的纯度。
图4显示了当进行全部第一至第三甘氨酸沉淀过程(在20℃、0.75m和15mg/ml的条件下)时获得的纤维蛋白原的纯度。
图5显示了当进行全部第一至第三甘氨酸沉淀过程(在25℃、0.8m和20mg/ml的条件下)时获得的纤维蛋白原的纯度。
图6显示了当进行全部第一至第三甘氨酸沉淀过程(在15℃、0.8m和10mg/ml的条件下)时获得的纤维蛋白原的纯度。
图7显示了当进行全部第一至第三甘氨酸沉淀过程(在15℃、0.5m和20mg/ml的条件下)时获得的纤维蛋白原的纯度。
图8显示了在进行第二甘氨酸沉淀过程后或不进行第二甘氨酸沉淀过程,过滤通过planova20n过滤器的纤维蛋白原的量。
具体实施方案
除非另有定义,本文所使用的所有技术和科学术语与本发明所述领域的普通技术人员通常理解的那些具有相同的含义。一般地,以下将描述的本文所使用的命名和实验方法是本领域中公知和通常采用的那些。
如在本文中可互换使用的术语“过程”、“纯化”、“分离(separation)”和“分离(isolation)”指使用至少一个方法或系统以实现纯化过程中的特定目的(例如,纤维蛋白原纯化)。
在一方面,本公开内容涉及一种用于纯化纤维蛋白原的方法,其包括以下步骤:(a)通过将甘氨酸添加到含有纤维蛋白原的溶液中使甘氨酸的浓度为1.5至2.5m而使该溶液的纤维蛋白原沉淀,然后去除上清液,并回收沉淀物(第一甘氨酸沉淀);(b)使步骤(a)的第一甘氨酸沉淀的沉淀物溶解于溶解缓冲液中以获得溶液,通过向其中添加甘氨酸使甘氨酸浓度为0.2至1.2m而使所述溶液沉淀,和回收上清液(第二甘氨酸沉淀);(c)通过向其中添加甘氨酸使甘氨酸浓度为1.5至2.5m而使步骤(b)的上清液沉淀,和回收沉淀物(第三甘氨酸沉淀);和(d)使步骤(c)的沉淀物溶解于溶液缓冲液中以获得溶液,和使用纳米过滤器使所述溶液经受纳米过滤(nf)。
不同于包括从使用甘氨酸沉淀过程获得沉淀物的步骤的常规方法,根据本发明的用于纯化纤维蛋白原的方法包括使用相对低浓度的甘氨酸进行沉淀过程,然后回收上清液,而不是沉淀物,并纳米过滤,使获得极高纯度的纤维蛋白原成为可能。具体地,根据本公开内容的纤维蛋白原纯化方法具有的作用在于,使用本发明的方法使纳米过滤器的过滤功效增加多于两倍,以显示出纯度为98%的高的纤维蛋白原回收率,并且使用降低浓度的甘氨酸进行沉淀过程,从而可去除在病毒失活过程中产生的杂质,以及可增加纳米过滤器的过滤功效,如表3和图3至8所示。
在一个实施方案中,在步骤(a)中第一甘氨酸沉淀的甘氨酸浓度为1.5至2.5m,优选为1.8至2.2m,最优选为1.9至2.1m。
在一个实施方案中,在步骤(b)中第二甘氨酸沉淀的甘氨酸浓度为0.2至1.2m,优选为0.3至1.1m,最优选为0.5至0.9m。
在一个实施方案中,在步骤(c)中第三甘氨酸沉淀的甘氨酸浓度为1.5至2.5m,优选为1.8至2.3m,最优选为1.9至2.2m。
在步骤(b)和(d)中用于溶解沉淀物的溶解缓冲液可为本公开内容所属领域中通常使用的溶解缓冲液,并且沉淀物的溶解使用ph6.0至9.0、优选7.0至8.0、最优选7.5的,优选含有10至100mm、更优选含有30至70mm的柠檬酸钠的缓冲液进行。
在一个实施方案中,甘氨酸沉淀和回收沉淀物可通过在每一步骤中添加合适浓度的甘氨酸,并且在4至30℃以200至1,000rpm搅拌,接着在4至25℃在3,000至10,000rpm下离心进行,但是本公开内容的范围不限于此。
另外,步骤(d)中的纳米过滤可使用可商购的纳米过滤系统进行,并且可用于本公开内容的过滤器的类型优选为来自pall公司的sv420n或来自asahikasei有限公司的planova20n,但不限于此,并且可使用合适的缓冲液进行。优选地,可使用ph6.0至9.0、优选7.0至8.0、最优选7.2至7.8的,含有10mm至30mm柠檬酸钠、50mm至150mmnacl、1%至7%优选2%至5%精氨酸的缓冲液。步骤(d)中的纳米过滤当使用sv420n时可在1至2bar的压力下,当使用planova20n可在0.5至1bar的压力下,在20至37℃、优选在28至35℃、最优选在25至35℃进行。
优选地,步骤(a)的含有纤维蛋白原的溶液通过包括如下步骤的过程可获得,但不限于此:
(i)使用溶解缓冲液溶解含有纤维蛋白原的低温糊状物以获得溶液;
(ii)将吸附剂添加到所述溶液,由此通过吸附去除杂质;和
(iii)通过溶剂/去污剂(s/d)处理使包含在所述低温糊状物中的病毒失活。
步骤(i)中的低温糊状物可使用溶解缓冲液以1:2至1:6、优选1:3至1:5、最优选1:4的体积比溶解。步骤(i)中的溶解缓冲液可为含有10mm至30mm、优选20mm柠檬酸钠,50mm至150mm、优选100mmnacl,和50mm至150mm、优选100mm甘氨酸的缓冲液,但不限于此。
另外,步骤(ii)中使用的吸附剂优选为氢氧化铝(al(oh)3),但不限于此。al(oh)3吸附凝胶(即吸附杂质的吸附沉淀物)可由离心去除。吸附剂氢氧化铝可具有1.0%至5.0%、优选具有1.5%至3.0%、最优选具有2.0%的浓度,并且可以以基于低温糊状物的重量0.05wt%至0.5wt%、优选0.07wt%至0.3wt%、最优选0.09wt%至0.15wt%的量使用。
在步骤(iii)的溶剂/去污剂处理中,可使用任何溶剂和去污剂而没有限制,只要它们具有使病毒特别是有脂质包膜的病毒失活的能力。去污剂可选自下组:非离子和离子去污剂,并且优选地选为基本上非变性的。特别地,在去除方便性方面,非离子去污剂是优选的,并且溶剂最优选为磷酸三正丁酯(tnbp),如美国专利号4,764,369所公开的,但不限于此。
优选地,步骤(iii)的溶剂/去污剂处理可使用含有非离子去污剂和磷酸三正丁酯(tnbp)的溶剂/去污剂溶液进行。用于本公开内容的病毒失活剂(virus-inactivatingagent)优选为tnbp和选自聚山梨醇酯80(tween80)、聚山梨醇酯20(tween20)、tritonx-100和tritonx-45的至少一个的混合物,但不限于此。
添加优选的溶剂/去污剂混合物使tnbp在含有纤维蛋白原的溶液中的浓度为0.2wt%至0.6wt%、优选为0.24wt%至0.36wt%,并且使tween80的浓度为0.5wt%至1.5wt%、优选为0.8wt%至1.2wt%。
另外,本公开内容的方法在步骤(c)和(d)之间可进一步包括步骤(c’):使在步骤(c)中回收的沉淀物溶解于溶解缓冲液中以获得溶液,通过向其中添加甘氨酸使甘氨酸浓度与步骤(a)的甘氨酸浓度相同而使所述溶液沉淀,以获得沉淀物(第四甘氨酸沉淀)。
本公开内容的方法在步骤(d)的纳米过滤后可任选地包括
(e)超滤/渗滤(uf/df)或超滤步骤;和/或
(f)配制步骤。
如本文所使用的,“渗滤”指使用能够根据组分的分子量(分子大小)实现分离的可渗透的过滤器从靶物质(溶液)去除或收集任何组分(例如粒子),由此增加靶物质的纯度的一种技术。步骤(e)中的超滤/渗滤(uf/df)可使用典型的uf/df系统进行,并且可包括对恒定的渗透压的改变,缓冲液的交换和缓冲液浓度的调节。
术语“纤维蛋白原”优选地指可以被纯化的人纤维蛋白原,例如从含有纤维蛋白原并且已经从人血液中获得的混合物中纯化的人纤维蛋白原。短语“从血液中获得的混合物”指例如全血、血浆、血浆组分(plasmafraction)或血浆沉淀物。来自人血浆或低温沉淀物的纤维蛋白原,特别是来自cohn组分1的纤维蛋白原是优选的。纤维蛋白原可从汇集的血浆捐赠物和从个体捐赠物中分离。
人纤维蛋白原还可从转基因动物的体液(例如乳汁)(美国专利号5,639,940)或通过从细胞培养物重组表达(美国专利号6,037,457)获得。另外,纤维蛋白原可从适当的发酵上清液或由此产生的组分中分离。与此同时,纤维蛋白原可从含有纤维蛋白原的动物血液中,优选地从来源于哺乳动物(例如猪、马、牛、山羊、绵羊和狗)的血液中分离。
本公开内容中的杂质或不溶性蛋白质指在血浆中出现的或在转基因动物体液(例如乳汁)中出现的或在细胞培养物上清液中出现的除纤维蛋白原以外的所有蛋白质,并且优选地,可包括能够通过蛋白水解降解纤维蛋白原的纤维蛋白原降解蛋白,或必须事先活化用于蛋白水解降解纤维蛋白原的纤维蛋白原降解蛋白的前体(酶原),或纤维蛋白原降解蛋白酶的活化剂,和具有低分子量的纤维蛋白原降解片段。
短语“含有纤维蛋白原的低温糊状物”指来源于上述动物(优选人)的含有纤维蛋白原的低温沉淀物。
在本公开内容中,溶液(例如溶解的溶液)的“ph”测量了相对于水样品的电离的酸度或碱度。水的ph为中性,即7。大部分ph读数范围为从0至14。具有比水高的[h+](ph小于7)的溶液是酸性的;具有比水低的[h+](ph大于7)的溶液是碱性的或碱的。ph可使用ph计测量。缓冲液的ph可使用酸或碱诸如hcl或naoh调节。用于本公开内容的溶解缓冲液优选在中性ph范围内。
如本文所使用的,术语“纯化”可与术语“澄清”互换使用,并且指使用缓冲液再溶解沉淀物或类似物,然后从由再溶解得到的溶液中去除杂质。
通过本公开内容的方法纯化的纤维蛋白原具有至少90%,优选地至少93%,最优选地至少98%的纯度。特别地,在本公开内容中产生的纤维蛋白原蛋白可为具有至少98%的纯度的纤维蛋白原蛋白。
实施例
以下,将参考实施例进一步详细描述本公开内容。对本领域普通技术人员将显而易见的是这些实施例仅用作示例说明的目的并且不被解释为限制本公开内容的范围。
实施例1:用于溶解含有纤维蛋白原的低温糊状物和用al(oh)3凝胶处理的过程
1)将用于溶解含有纤维蛋白原的低温糊状物的4l的溶解缓冲液(含有50mm柠檬酸钠,ph7.5,100mm氯化钠(nacl),和100mm甘氨酸)置于带夹套的烧杯中,然后在37℃的受控循环器温度下搅拌30分钟或更久。此时,使缓冲液的温度保持在37℃。
2)将1kg的含有纤维蛋白原的低温糊状物添加到4l的溶解缓冲液(含纤维蛋白的低温糊状物:溶解缓冲液=1kg:4l),然后在37℃以150rpm的受控搅拌器速度搅拌2小时。
3)将含有纤维蛋白原的低温糊状物溶液控制到20至25℃的温度,然后每千克的含有纤维蛋白原的低温糊状物添加150g的氢氧化铝(al(oh)3)(优选地,以0.5重量%的比例添加2%氢氧化铝),接着在20至25℃以150rpm的受控搅拌器速度搅拌1小时。
4)在反应完成后,在15℃以4000rpm进行离心30分钟。
5)在离心完成后,通过opticapxl2polysepii过滤器(merckmillipore)过滤上清液。
病毒失活过程:溶剂/去污剂(s/d)处理
每1l的过滤的含有纤维蛋白原的低温糊状物溶液添加55.7ml的病毒失活溶液(1%tween80,0.3%tnbp(磷酸三正丁酯)),接着在25℃以150rpm搅拌1小时。
作为结果,通过使用溶剂/去污剂(s/d)处理过滤的含有纤维蛋白原的低温糊状物溶液而获得推定(putative)病毒组分被灭活的溶液。
实施例2:第一甘氨酸沉淀过程
1)向实施例1的推定病毒组分失活的过滤的含有纤维蛋白原的低温糊状物溶液中,添加甘氨酸直到甘氨酸浓度的最终浓度变为1.9至2m。此时,添加甘氨酸,使得含有纤维蛋白原的低温糊状物溶液的蛋白质含量会是20至30mg/ml。
2)在4至25℃以300rpm的受控搅拌器速度进行搅拌90分钟。
3)在15℃以4000rpm离心2)的搅拌的添加甘氨酸的含有纤维蛋白原的低温糊状物溶液30分钟。
4)去除上清液,并且称重沉淀物(以下称为第一甘氨酸沉淀沉淀物),然后在-70℃或以下冷冻保存。
实施例3:第二甘氨酸沉淀过程
3-1:第二甘氨酸沉淀过程(在20℃、0.75m和15mg/ml的条件下)
1)为了溶解实施例2的冷冻保存的第一甘氨酸沉淀沉淀物,将溶解缓冲液(50mm柠檬酸钠,ph7.5)置于带夹套的烧杯中,然后在37℃的受控循环器温度下搅拌30分钟或更久。此时,使缓冲液的温度保持在37℃。
2)将实施例2的冷冻保存的第一甘氨酸沉淀沉淀物添加到1)的溶解缓冲液,然后在37℃以150rpm的受控搅拌器速度搅拌90分钟。
3)使2)的搅拌的第一甘氨酸沉淀沉淀物溶液过滤通过opticapxl2polysepii过滤器(merckmillipore)。
4)将3)的过滤的第一甘氨酸沉淀沉淀物溶液置于带夹套的烧杯中,然后将循环器的温度控制到20℃。
5)当第一甘氨酸沉淀沉淀物溶液达到预定的温度时,添加甘氨酸直到甘氨酸浓度的最终浓度变为0.5至0.9m。此时,添加甘氨酸使得第一添加甘氨酸的沉淀沉淀物溶液的蛋白质含量会是14至15mg/ml。
6)以300rpm进行搅拌90分钟,同时使循环器的温度保持在20℃。
7)在15℃以4000rpm离心6)的搅拌的、添加甘氨酸的第一甘氨酸沉淀沉淀物溶液30分钟。
8)去除7)的沉淀物,并且测量上清液(以下称为第二甘氨酸沉淀上清液)的量。
3-2:第二甘氨酸沉淀过程(在25℃、0.8m和20mg/ml的条件下)
除了使用以下条件之外以与实施例3-1所述相同的方式进行实验:甘氨酸浓度:0.8m;温度:25℃;和蛋白质浓度:19至20mg/ml,。
3-3:第二甘氨酸沉淀过程(在15℃、0.8m和10mg/ml的条件下)
除了使用以下条件之外以与实施例3-1所述相同的方式进行实验:甘氨酸浓度:0.8m;温度:15℃;和蛋白质浓度:9至10mg/ml。
3-4:第二甘氨酸沉淀过程(在15℃、0.5m和20mg/ml的条件下)
除了使用以下条件之外以与实施例3-1所述相同的方式进行实验:甘氨酸浓度:0.5m;温度:15℃;和蛋白质浓度:19至20mg/ml。
实施例4:第三甘氨酸沉淀过程
1)将循环器的温度控制到20°。当实施例3中获得的第二甘氨酸沉淀上清液的温度达到20℃时,将甘氨酸添加到上清液直到甘氨酸浓度的最终浓度变为2.1m。
在对比实施例中,在35℃将在实施例2中获得的第一甘氨酸沉淀沉淀物溶解于50mm柠檬酸钠(ph7.5)缓冲液中,持续90分钟。此后,将甘氨酸添加到溶液中,直到甘氨酸浓度的最终浓度变为2.1m。
2)以300rpm进行搅拌90分钟。
3)在15℃以4000rpm离心2)的搅拌的添加甘氨酸的第二甘氨酸沉淀上清液30分钟。
4)去除上清液,并且称重沉淀物(以下称为第三甘氨酸沉淀沉淀物),然后在-30℃或以下冷冻保存。
通过sec-lc分析样品纯度
通过以下测试方法测量经受第二甘氨酸沉淀过程的第三甘氨酸沉淀沉淀物中的纤维蛋白原的纯度和没经受第二甘氨酸沉淀过程的第三甘氨酸沉淀沉淀物中的纤维蛋白原的纯度,并比较彼此。
a.样品溶液制备:将样品浓度被校正为2mg/ml,并且将200μl的样品添加到每个lc小瓶。
b.测试条件:在以下条件下进行测试:流速:0.5ml/min;柱温度:室温(rt);注射体积:20μl;分析时间:30分钟;检测波长:uv280nm;和泵分布(pumpdistribution):100%等度(isocratic)。
c.测试程序:
1)根据watershplc操作说明,制备hplc系统。
2)tsk-gelg3000swxl柱和tskgelswxl保护柱沿着液体流动方向布置。
3)柱的平衡:允许流动相以0.5ml/min的流速流动至少30分钟,并且当达到色谱上的平衡时,停止流动。
4)在与上述测试条件相同的条件下进行分析。
下表1显示了当进行第二甘氨酸沉淀过程时或不进行第二甘氨酸沉淀过程时获得的纤维蛋白原的纯度。
另外,图3显示当仅进行第一和第三甘氨酸沉淀过程而没有第二甘氨酸沉淀过程时获得的结果,以及图4(实施例3-1的条件)、5(实施例3-2的条件)、6(实施例3-3的条件)和7(实施例3-4的条件)显示当进行全部第一至第三甘氨酸沉淀过程时获得的结果。
综上所述,如下表1和图3至7所示,与当仅进行第一和第三甘氨酸沉淀过程而没有第二甘氨酸沉淀过程时比较,当进行全部第一至第三甘氨酸沉淀过程时,最终获得的纤维蛋白原的纯度显著高,不管沉淀过程的条件如何。因此,可见当使用降低浓度的甘氨酸进行沉淀过程时,获得了去除从病毒失活过程产生的杂质的作用。
表1
实施例5:任选的第四甘氨酸沉淀过程
显示了当如以上实施例1至4所述的第一至第三甘氨酸沉淀过程全部进行时,可以以极高纯度获得纤维蛋白原。在该实施例中,进行研究以确定当任选地进行不是必要过程的另外的甘氨酸沉淀过程时,纤维蛋白原的纯度是否可进一步增加。
1)为了溶解实施例4的冷冻保存的第三甘氨酸沉淀沉淀物,将溶解缓冲液(50mm柠檬酸钠(ph7.5))置于带夹套的烧杯中,然后在37℃的受控循环器温度搅拌30分钟。
2)向1)的缓冲液中添加实施例4的冷冻保存的第三甘氨酸沉淀沉淀物,然后在30至35℃以290至310rpm的受控搅拌器速度搅拌90分钟。
3)将第三甘氨酸沉淀沉淀物溶液的温度降低至25℃,并且向溶液中添加甘氨酸至2.1m的最终浓度。
4)以300rpm进行搅拌90分钟,同时使循环器的温度保持在25℃。
5)在15℃以4000rpm离心搅拌的添加甘氨酸的第三甘氨酸沉淀沉淀物溶液30分钟。
6)回收5)的第四甘氨酸沉淀沉淀物、称重,然后在-30℃或以下冷冻保存。
实施例6:纳米过滤过程的doe实验
1)制备实施例4或5中获得的250mg或更多的第三或第四甘氨酸沉淀沉淀物。
2)向第三或第四甘氨酸沉淀沉淀物添加溶解缓冲液(ph7.5的含有20mm柠檬酸钠,100mm氯化钠(nacl),和1%至6%精氨酸),并且通过在室温下搅拌2小时溶解沉淀物,使得最终蛋白质浓度会是约3mg/ml。
3)在280nm的uv波长下测量2)的溶解的第四甘氨酸沉淀沉淀物的浓度,然后通过使用溶解缓冲液(含有ph7.5的20mm柠檬酸钠,100mm氯化钠(nacl),和1%至6%精氨酸)稀释沉淀物至0.7-3mg/ml的浓度,和在280nm的uv波长下测量最终浓度。
4)在校正浓度后,通过瓶顶过滤器(0.2μm)过滤样品。
5)在室温(20至25℃)和2bar的压力下使4)的过滤的样品过滤通过pall100n过滤器(10cm2面积)。
6)使5)的过滤的样品再次过滤通过pall50n(或planova35n)过滤器(10cm2面积)。此时,在室温(20至25℃)和2bar(对于planova35n为1bar)的条件下进行过滤。
7)使6)的过滤的样品过滤通过planova20n(或sv420n)(10cm2面积)。此时,在25至35℃和0.5至2bar(planova20n:0.5至1bar;sv420n:1至2bar)的条件下进行过滤(纳米过滤过程时间:15至20小时)(进行实施例6后,可以进行作为另外过程的uf/df)。
下表2显示了当进行第二甘氨酸沉淀过程时或不进行第二甘氨酸沉淀过程时获得的planova20n和sv420n过滤器的效率和回收率。
表2
作为结果,如上表2和图8所示,在如实施例3所述的进行第二甘氨酸沉淀过程和不进行第二甘氨酸沉淀过程的情况之间,比较过滤通过纳米过滤器的纤维蛋白原的纯度。作为比较的结果,显示了当进行第二甘氨酸沉淀过程时,具有98%的纯度的纤维蛋白原的回收率高。因此,当使用降低浓度的甘氨酸进行沉淀过程时,获得了去除在病毒失活过程中产生的杂质和将纳米过滤器的过滤功效增加至少2倍的作用。
工业实用性
根据本公开内容的用于纯化纤维蛋白原蛋白的新的方法是一种高度安全的方法,其基本上阻断了源自动物的病原组分(病毒)的进入。此外,其可通过简单的过程以高纯度和高回收率纯化纤维蛋白原蛋白,因此是非常经济和有效的。另外,通过本公开内容的方法纯化的纤维蛋白原相对于通过常规方法纯化的纤维蛋白原具有的优势在于其具有更高的纯度,并且因此具有增加的局部活性,这表示其可有效地用于预防和治疗血液相关疾病,特别是血液凝固疾病。
尽管已经参考具体特征详细描述了本公开内容,对本领域技术人员显而易见的是这样的描述仅用于优选的实施方案,并不限制本公开内容的范围。因此,本公开内容的实质范围将由所附权利要求及其等同物来限定。
- 还没有人留言评论。精彩留言会获得点赞!