用于筛选核酸适配体的方法与流程
本发明涉及用于筛选核酸适配体的方法。
背景技术
所谓核酸适配体,是指具有分子识别能力的单链dna或rna,于1990年由ellington等人和tuerk等人首次报道。核酸适配体可通过被称为指数富集配体系统进化(systematicevolutionofligandsbyexponentialenrichment,selex)的进化工程学方法获得,也已报道了大量的具有能与抗体相匹敌的结合能力、特异性的核酸适配体。此外,能够针对以蛋白质、细胞为代表的难以取得抗体的低分子化合物这样的各种靶标而取得适配体,在治疗药、诊断药中的应用受到期待。然而,抗体的获得概率据称为90%以上,与此相对,目前的核酸适配体的获得概率据称为30%以下。即,可以说核酸适配体的获得概率的技术性提高是今后要将核酸适配体在产业上广泛应用时所面临的主要课题。
核酸适配体作为代替抗体的新型的分子识别成分而受到关注,但一般认为核酸适配体的获得率为30%以下,期望开发出高效的适配体获得方法。ce-selex是利用了毛细管电泳的优异的分离能力的快速筛选核酸适配体的方法。然而,由于实验条件设定(分选区域的设定)的难度、作为靶标的分子必须为在与ssdna文库结合时电泳迁移率大幅变化这样的一定程度以上的大小的限制,不能否认其缺乏通用性。
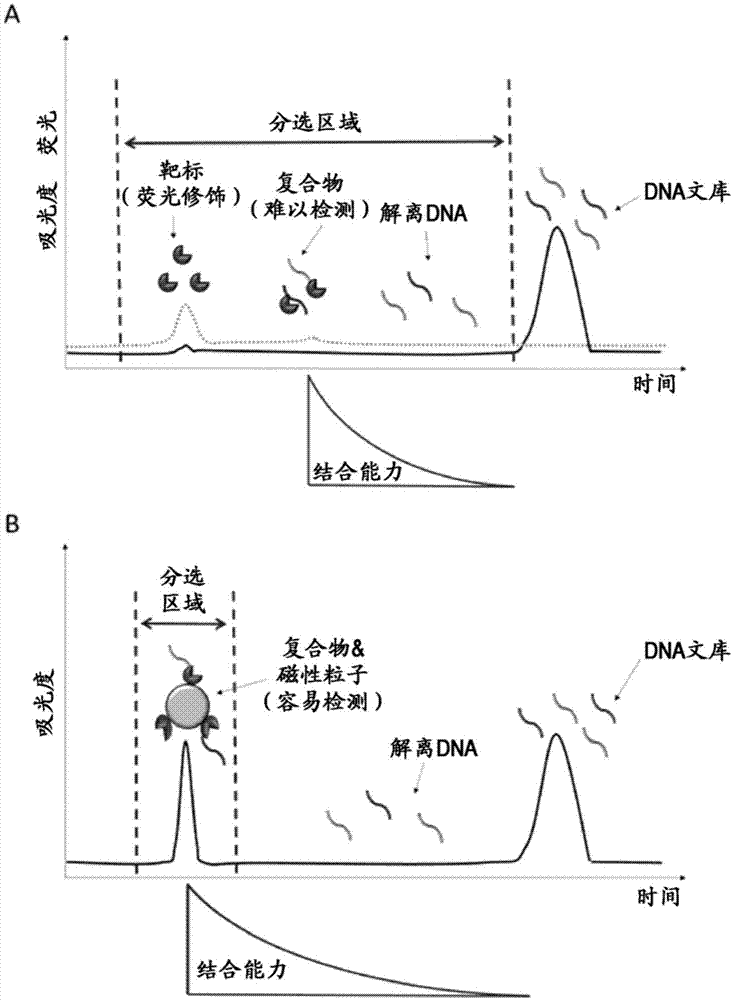
ce-selex中,分选区域的设定是影响适配体获得率的重要的要素。需要将未混入不具有对靶标的结合能力的ssdna文库的、确实地包含与靶标形成了复合体的ssdna文库的区域分选出来。理想的分选区域是来自ssdna文库与靶标的复合体的峰的范围。然而,靶分子为muts蛋白那样容易与ssdna发生相互作用的分子,并且,只要不使用高灵敏度的荧光检测器,就难以检测出ssdna文库与靶标的复合体。此前,为了优化分选区域,已尝试了多种方法:通过荧光修饰而使靶蛋白质可视化,通过实时pcr来预测靶标-适配体复合体的检测位置,等等。然而,仍然难以检测出复合体,通常是将从靶分子的检出位置开始至即将检出ssdna文库之前为止的区域作为分选区域。该分选区域的设定方法中,存在下述这样的问题:在中途解离的结合能力低的序列也容易被包含在分选区域中(图1a)。
另外,在将低分子化合物等小分子作为靶标时,几乎不能期待与ssdna文库结合时的电泳迁移率变化,因此,认为难以应用ce-selex。通过ce-selex获得针对低分子化合物的适配体的例子迄今只有一例,由此也可窥见其难度(非专利文献1)。
现有技术文献
非专利文献
非专利文献1:yang,j.&bowser,m.t.capillaryelectrophoresis-selexselectionofcatalyticdnaaptamersforasmall-moleculeporphyrintarget.anal.chem.85,1525-1530(2013).
技术实现要素:
发明所要解决的课题
本发明提供在有效发挥ce-selex的优点的同时、解决了实验条件设定的难度、可应用的靶分子种类少这样的缺陷的新型ce-selex。具体而言,本发明涉及组合了粒子和ce-selex的用于筛选核酸适配体的方法。此前虽然报道了组合了粒子和毛细管电泳的rna、抗原的定量分析方法,但尚未报道组合了粒子和ce-selex的方法。
用于解决课题的手段
本申请的发明人进行了深入研究,结果发现,通过将粒子与ce-selex组合能解决以往的课题,从而完成了本发明。
本发明涉及以下方案。
[1]用于筛选核酸适配体的方法,其包括下述工序:
(a)使固定于固相载体上的靶分子与核酸适配体候选物接触,
(b)通过毛细管电泳来分选(日文:分取)已与靶分子结合的核酸适配体候选物,
(c)通过pcr对核酸适配体候选物进行扩增;
[2]如[1]所述的方法,所述方法还包括下述工序:(d)使扩增而得到的pcr产物成为单链;
[3]如[1]或[2]所述的方法,其中,固相载体为粒子;
[4]如[1]~[3]中任一项所述的方法,其中,粒子的粒径的最小值为0.05μm;
[5]如[1]~[4]中任一项所述的方法,其中,靶分子为蛋白质或低分子量化合物;
[6]如[1]~[5]中任一项所述的方法,其中,核酸适配体候选物为单链dna文库;
[7]如[2]~[6]中任一项所述的方法,其中,最多反复进行3次工序(a)~(d)。
关于固相载体,可使用能将靶分子固定在其表面上的任意的固相载体。可举出例如层状的石墨烯、碳纳米管、富勒烯及粒子。关于粒子,可使用现有已知的任意的粒子。例如,可举出二氧化硅珠、聚苯乙烯珠、胶乳珠、金属胶体。本发明的粒子可以是磁性粒子。粒子的平均粒径的最大值可根据毛细管的内径确定。优选为100μm,更优选为10μm,进一步更优选为1μm。粒子的平均粒径的最小值优选为100nm,更优选为10nm,进一步更优选为1nm。粒子的平均粒径可利用已知的任意方法确定。例如,筛分法、显微镜法、沉降法、激光衍射散射法、电气检测法。优选为显微镜法。
为了不使用昂贵的荧光检测器、而使用可见光部的吸光度检测器,粒子需要具有对于通过可见光的散射来进行检测而言充分的粒径。此时的粒子的平均粒径的最小值优选为0.05μm,更优选为0.5μm,进一步更优选为5μm。
本发明中所谓靶分子,是指在利用了核酸适配体的检测方法等中作为检测的靶标的分子。靶分子的化学种类没有特别限制,可包含低分子化合物、高分子化合物、及来自生物体的物质等各种化学种类。另外,可将靶分子固定于固相载体的表面。更具体而言,可举出例如糖类、脂质类、低聚肽、蛋白质、及核酸。作为靶分子功能,可举出例如抗原、抗体、配体、受体、相互作用蛋白等。
本发明中所谓核酸适配体,是指对于规定的靶分子的亲和性高、能与其特异性地结合的核酸分子。将具有这样的性质的核酸分子称为核酸适配体,只要没有特别说明,则不受碱基序列、分子的大小、分子的立体结构等的限制。优选核酸适配体为单链的rna或dna。
本发明中所谓固定于固相载体上的靶分子,是指靶分子通过疏水性相互作用、静电相互作用、共价键、配位键、非共价键性的分子间相互作用(生物素-链霉亲和素等)等而被固定于固相载体表面。
本发明中所谓核酸适配体候选物,是指由多种rna及/或dna构成的候选库(pool)。优选为由单链的核酸形成的单链核酸文库,更优选为由单链的dna形成的单链dna文库。需要说明的是,在其一部分中也可包含通过单链核酸中的全部或一部分碱基发生相互对合而形成的双链核酸。
本发明中所谓毛细管电泳,是指下述方法:通过在毛细管内装满水溶液、导入包含目标物的水溶液并放置于电场中,从而发挥电荷的移动和亲和性、电渗流等的作用,能进行分离纯化。关于毛细管的内径,可使用任意的内径的毛细管。
本发明中,通过毛细管电泳来分选已与靶分子结合的核酸适配体候选物。在毛细管电泳系统中设置预先进行了前处理的毛细管。然后,注入混合ssdna文库和固定有靶标物质的粒子而成的样品,然后,在运行缓冲液(runningbuffer)中进行电泳。在电泳期间,例如,可以随时间经过而利用二极管阵列检测器测定195、260、280、550nm等波长处的吸光度,将得到的峰作为指标,进行磁性粒子部分的回收((a)工序及(b)工序)。
本发明中,通过pcr对分选得到的核酸适配体候选物进行扩增。所谓pcr,是聚合酶链反应,可以通过在试管内反复进行基于dna合成酶的dna合成反应,从而将该特定的dna区域扩增数十万倍。此时使用的引物随着使用的dna文库的固定序列(与引物序列互补的序列)的不同而不同,可举出例如agcagcacagaggtcagatg(正向引物)、ttcacggtagcacgcatagg(反向引物)等。可通过将dna聚合酶、tris-hcl、kcl、mgcl2、及dntps与引物和分选得到的核酸适配体候选物混合,用热循环仪调节加热温度、时间,反复进行该循环,从而对dna区域进行扩增((c)工序)。
本发明中,根据情况,使扩增而得到的pcr产物成为单链。例如,在使用生物素化引物进行扩增而得到的pcr产物中混合固定有链霉亲和素的磁性粒子(例如magnospherems300/streptavidin(invitrogen)等),适当地反复进行上清液的除去、洗涤的工序。然后,添加适当浓度的naoh,使目标ssdna从磁性粒子表面溶出,将其回收((d)工序)。
本发明中,可以任选地反复进行上述工序(a)~(d)。优选最多反复进行3次上述工序(a)~(d)。
发明的效果
本发明是仅将靶分子固定于粒子表面的非常简单的方法,但理论上存在能大致解决此前ce-selex所存在的问题的可能性。首先,本发明的使用了磁性粒子的ce-selex(以下,称为mb-ce-selex。)中的分选区域的设定比以往的ce-selex容易得多。能通过光的散射而使吸光检测器高灵敏度地检测粒子,因此,不需要昂贵的荧光检测器。无论是哪种靶分子,均可将来自磁性粒子的峰作为分选区域(图2)。利用pinpoint而将靶标-适配体候选物复合体的峰作为分选区域,从而能排除在中途解离的结合能力低的ssdna文库,可期待适配体获得率的提高。
另外,本发明与以往的ce-selex相比,具有优异的获得率。因此,能以较少的轮(round)数来选择所期望的适配体。
以下,示出以往的selex与本发明的不同点。
[表1]
附图说明
[图1]图1示出以往的ce-selex与本发明的不同点。
[图2]图2示出基于spr传感器的凝血酶适配体候选物的结合能力评价(以往的ce-selex)。各图a~j(合计10幅)示出表3上段所示的10个适配体候选物序列的考察结果。
[图3]图3示出基于spr传感器的凝血酶适配体候选物的结合能力评价(本发明的mb-ce-selex)。各图a~j(合计10幅)示出表3中段所示的10个适配体候选物序列的考察结果。
[图4]图4示出基于spr传感器的凝血酶适配体候选物的结合能力评价(本发明的mb-ce-selex改良版)。各图a~j(合计10幅)示出表3下段所示的10个适配体候选物序列的考察结果。
[图5]图5示出t_beads_re_apt.1、t_beads_re_apt.5的独特的解离相。(a)为200nmt_beads_re_apt.1的响应曲线和放大图。(b)为200nmt_beads_re_apt.5的响应曲线和放大图。
[图6]图6示出各挑选方法中的凝血酶适配体的获得率(仅由上游10个序列计算)。以往的ce-selex:23%,mb-ce-selex:83%,mb-ce-selex(改良版):91%
具体实施方式
以下通过实施例进一步详细地说明本发明,但本发明不受这些实施例的任何限制。
实施例1
靶分子在磁性粒子上的固定
将在表面具有羧基的磁性粒子dynabeadsmyone(商标)carboxylicacid(invitrogen)作为载体,按照产品附带的操作规程,进行分子的固定。添加20mmtris-hcl、10mmnacl、1mmmgcl2缓冲液(ph7.4)100μl,以10mg/ml的磁性粒子储备溶液的形式于4℃进行保存。
ce-selex条件优化
毛细管电泳条件
使用了毛细管电泳系统(agilent7100:大冢电子)。关于毛细管,使用了长度为80.6cm、有效长度(至检测窗的长度)为72.2cm、内径为75μm的气泡熔融石英毛细管(bubblecellfused-silicacapillary)(agilenttechnologies)。以从输入侧(注入口,阳电极侧)与输出侧(溶出口,阴极侧)的电极之间露出相等长度的毛细管的方式,将毛细管设置于盒(cassette)中。作为前处理,通过应用约1bar的压力,使0.1mnaoh水溶液流过10~20分钟。此外,通过使运行缓冲液(100mm硼酸缓冲液,ph8.5)流过10~20分钟,从而使毛细管内平衡化。
与靶标结合的ssdna的分离和分选
样品的制备
对于作为靶蛋白质的凝血酶、ssdna文库,用样品缓冲液(20mmtris-hcl、10mmnacl、1mmmgcl2缓冲液,ph7.4)溶解或稀释。作为ssdna文库,使用了用20mer的固定序列夹着30mer的随机序列的两端(5’侧和3’侧)而得到的合计70mer的合成低聚dna。将样品缓冲液和100μmssdna文库放入至pcr管中,通过吹吸而将其混合。通过热循环仪(takarabioinc.),于95℃加热ssdna文库溶液2分钟,然后,以每秒0.1℃的速度冷却至25℃,由此进行退火。
样品的注入
退火后,添加2μm的凝血酶或5~10mg/ml固定有凝血酶的磁性粒子溶液1μl,在室温(25℃)下孵育30分钟以上。通过施加100mbar的压力6~9秒,从而从毛细管的输入侧注入靶标-ssdna文库混合溶液。可基于hagen-poiseuille定律,由下式预测大致的注入量。v表示注入量(nl),δp表示压力变化(bar),d表示毛细管内径(m),π表示圆周率,t表示注入时间(s),η表示溶液粘度,l表示毛细管全长(m)。
v=δpd4πt/128ηl×1012[nl]
样品的电泳
将装有50μl运行缓冲液的小瓶分别设置在输入侧(注入口,+电极侧)和输出侧(溶出口,-电极侧),施加30kv的恒电压,进行电泳。在电泳期间,随时间经过而利用二极管阵列检测器测定195、260、280、550nm处的吸光度。假设电泳速度始终不变,由下式计算溶出时间,由此,设定分选时间。t溶出表示溶出时间,t检测表示检测时间,l全长表示毛细管全长,l有效长度表示毛细管有效长度。
t溶出=t检测×l全长/l有效长度
样品的回收
使用热循环仪,于95℃对使用了固定有凝血酶的磁性粒子的分选样品加热10分钟,由此,使磁性粒子表面的蛋白质变性,使ssdna游离。在磁力架(magnetstand)上静置1分钟,然后回收上清液。
基于pcr的分选样品的扩增
利用pcr使通过毛细管电泳分选的ssdna样品扩增。在1.5ml管中装入2×premix400μl、depc处理水192μl、4μm的正向引物80μl、4μm的5’-生物素化反向引物80μl并将其混合,向8个200μl的pcr管中分别注入94μl。在6个管中分别添加分选样品6μl,在剩余的两个管中分别添加1~10pmssdna文库和depc处理水各6μl作为阳性对照和阴性对照。使用热循环仪(takarabioinc.),于94℃加热1分钟,然后反复进行23~28次“94℃下15秒、55℃下5秒、72℃下20秒”这样的操作。pcr结束后,通过聚丙烯酰胺凝胶电泳(page),调查目标尺寸的dna是否已被扩增。将电泳后的凝胶浸渍于染色液中,振荡10分钟。通过uv照射器,检测染色后的dna的条带。
pcr产物的纯化和单链化
将pcr产物单链化,作为在下一轮中使用的ssdna文库。使用作为固定有链霉亲和素的磁性粒子的magnospherems300/streptavidin(invitrogen),按照附带的说明书进行固定、洗涤操作。添加预先制备的0.1mnaoh50μl,缓缓吹吸10~15次,使其悬浮,然后在常温下静置4分钟,由此,使适配体候选物游离并将其提取。
基于下一代测序仪的碱基序列分析
样品的制备和乳液pcr
按照产品附带的操作规程,制备乳液pcr用的样品,通过page,确认目标尺寸的dna是否已被扩增。然后,利用fastgenegel/pcrextractionkit(nippongeneticsco,ltd.),对pcr产物进行柱纯化。最终,使用iononetouchtm2系统(lifetechnologies)和ionpgmtemplateot2200kit(lifetechnologies),进行乳液pcr和珠纯化。参考的附带的操作规程为出版号(publicationnumber)man0007220,rev.5.0。
基于下一代测序仪的大规模序列分析
使用进行乳液pcr后的纯化珠,进行基于ionpgm系统(lifetechnologies)及半导体芯片ion314chip和ion318chip(lifetechnologies)、ionpgmsequencing200kitv2(lifetechnologies)的大规模序列分析。按照附带的操作规程(出版号man0007273,rev.3.0)进行操作。序列数据作为fastaq文件输出,用clcgenomicsworkbench(clcbio)除去dna文库的引物区域的序列(固定序列),仅提取28~32mer的随机序列。进而还调查了重复序列的计数,作为excel文件而输出序列信息。在excel(microsoft)上将序列转化为fasta形式,作为文本文件输出。通过mafft进行比对(alignment),提取类似的序列(家族序列)。进而使用memesuite4.11.0调查家族序列。
所挑选的适配体的结合能力评价
靶蛋白质在传感器芯片上的固定
通过biacorex100(gehealthcare),按照附带的手册,进行靶蛋白质在传感器表面上的固定、以及与适配体的相互作用分析。
作为运行缓冲液,使用了hbs-ep(hepes,150mmnacl,ph7.0)。将经羧甲基葡聚糖修饰的cm5传感器芯片(gehealthcare)设置于流路中,以10μl/min的流速流过edc/nhs溶液7分钟,将传感器芯片上的羧基活化。使利用10mm乙酸/乙酸钠缓冲液(ph6.0)进行了稀释的10~20μg/ml凝血酶溶液流过7分钟。最后,流过乙醇胺7分钟,进行封闭,完成偶联反应。
基于相互作用分析的解离常数的计算
利用运行缓冲液将适配体候选物样品稀释成2~4μm。使用热循环仪,于95℃进行2分钟加热,然后以每秒0.1℃的速度冷却至25℃,由此进行退火。退火后,用运行缓冲液进一步稀释至50~200nm。将固定有凝血酶的芯片设置于流路中,以30μl/min的流速流过已稀释的适配体候选物时,调查是否显示特异性的响应。作为再生溶液,使用了1mnacl溶液。对于得到了特异性的响应的适配体候选物,在6.25~400nm的范围内制备多个稀释样品,进行多动力学(multi-kinetics)分析。但是,对于用1mnacl溶液未能再生的适配体候选物,进行单动力学(singlekinetics)分析(在中途不插有再生工序)。使用评价软件(evaluationsoftware),计算解离常数。
基于下一代测序仪的凝血酶适配体候选物序列的鉴定
使用下一代测序仪确定凝血酶适配体候选物序列的步骤·结果如下所示。
大规模序列分析
利用下一代测序仪(ionpgm系统)对以往的ce-selex、mb-ce-selex(第1次)、mb-ce-selex(改良版)的各轮(1~3轮)中得到的适配体候选物序列进行分析。每轮的总前导序列数为90000~800000(表2)。利用各挑选方法得到的第3轮的序列中,主要对计数多的10个序列进行分析。将序列名记为t_apt.1~10(以往的ce-selex)、t_beads_apt.1~10(mb-ce-selex)、t_beads_re_apt.1~10(mb-ce-selex改良版)。
表2各轮中挑选出的适配体候选物序列的总前导序列(lead)数
[表2]
上游碱基序列的浓缩效率的计算
首先,调查上游序列(日文:上位配列)的存在率“(各序列的计数/总前导序列数)×100(%)”,结果,对于利用各挑选方法时被最大程度地浓缩的序列的存在率而言,利用以往的ce-selex时为0.16%,利用mb-ce-selex时为12%,利用mb-ce-selex(改良版)时为5.1%(表3)。根据由bowser等人报道的与使用ce-selex进行的vegf适配体的取得有关的论文,已提出了利用ce-selex获得的适配体富于多样性、特定序列的浓缩相当困难这样的假设,实际上,在第4轮结束时,被最大程度地浓缩的序列的存在率为0.8%左右。与本研究的结果相比,关于利用以往的ce-selex得到的上游序列的存在率,观察到与先前研究同样的倾向。另一方面,确认到:关于利用基于mb-ce-selex的挑选而得到的上游序列的存在率,与利用以往的ce-selex得到的上游序列的存在率相比,显示出高达50~100倍的存在率,与先前研究相比,显示出相当高的浓缩效果。对于mb-ce-selex而言,认为是具有特定的结合能力的ssdna容易被浓缩的条件。
表3各挑选方法的第3轮中的上游序列的每轮的计数·存在率
[表3]
适配体候选物序列的结合能力
将使用表面等离子共振(spr)传感器计算而得的各候选物序列的针对凝血酶的结合能力示于表4。
以往的ce-selex与mb-ce-selex的适配体获得率的比较
对上游序列中对于凝血酶具有高结合能力的序列的比例进行比较,由此,对新型的mb-ce-selex的性能进行评价。首先,调查利用以往的ce-selex得到的上游序列(合计10个序列)有无结合能力(图2)。根据预实验可知,在ssdna文库中,未观测到特异性的响应的上升,因此,凝血酶不与ssdna非特异性地相互作用(图2a)。t_apt.1~10中,在t_apt.3、t_apt.4、t_apt.6这3种适配体候选物中得到了特异性的响应(图2b~k)。关于t_apt.1、t_apt.10,虽然观测到响应稍微上升,但峰的形状为箱型,即,解离非常快,因此认为,结合能力低(图2b、k)。作为对照,对于具有与tba15完全相同的序列的tba_like_apt.1,也进行了结合实验,结果,得到了特异性的响应(图2l)。
同样地操作,调查利用mb-ce-selex得到的上游序列(合计10个序列)有无结合能力,结果,在t_beads_apt.1、t_beads_apt.3、t_beads_apt.7、t_beads_apt.8这4种适配体候选物中得到了特异性的响应(图3)
最后,调查利用mb-ce-selex(改良版)得到的上游序列(合计10个序列)有无结合能力,结果,在除t_beads_re_apt.6、t_beads_apt.9以外的8种适配体候选物中得到了特异性的响应(图4)。尤其是,关于t_beads_re_apt.1和t_beads_re_apt.5,得到了在其他适配体中未见到的独特的响应曲线。对于这2种适配体而言,在描绘了较快的解离曲线后,保持了一定的高度的响应(图5)。即,认为一定数量的适配体处于牢固地与凝血酶结合而不分离的状态。
对于各挑选方法的上游序列中显示高结合能力的上游序列的比例而言,以往的ce-selex为3/10,mb-ce-selex为4/10,mb-ce-selex(改良版)为8/10。由10个各上游序列的计数(存在率)计算适配体获得概率(具有高结合能力的序列的计数之和/调查了结合能力的序列的计数之和),结果,以往的ce-selex为23%,mb-ce-selex为83%,mb-ce-selex(改良版)为91%(图6)。表明mb-ce-selex与以往的ce-selex相比,能以更高概率取得凝血酶适配体。
凝血酶适配体的解离常数的计算
关于得到特异性的响应曲线的序列,通过多动力学分析或单动力学分析,算出结合速度常数(ka)、解离速度常数(kd)、解离常数kd(图7,表4)。关于t_beads_re_apt.10,不仅解离非常慢,而且即使利用高浓度的nacl也未能从凝血酶解离,因此,通过单动力学分析,计算解离常数(图7j)。t_beads_re_apt.1和t_beads_re_apt.5具有高结合能力的可能性高,但由于不存在解离曲线的斜率,因而难以计算解离速度(kd)(图a和e),未能利用spr传感器计算解离常数(kd)。
各挑选方法的第3轮中的上游序列和结合速度常数、解离速度常数、解离常数
[表4]
通过mb-ce-selex(改良版),不仅适配体获得概率(具有高结合能力的序列的计数之和/调查了结合能力的序列的计数之和)提高,而且取得了解离速度常数小的(难以解离的)核酸适配体。例如,得到了具有得不到解离曲线的斜率的程度的结合能力的t_beads_re_apt.1和t_beads_re_apt.5、唯有通过单动力学分析才能算出解离常数的t_beads_re_apt.10。确认到有意地加宽了分选窗的第一次的mb-ce-selex、与缩窄了分选窗的mb-ce-selex(改良版)中的分选区域的仅18秒左右的差异对适配体获得率、解离速度常数有贡献。通过设法进行分选窗的优化、使来自磁性粒子的峰变得更尖锐,由此,有可能使本系统得到进一步改善。
产业上的可利用性
本发明对于筛选核酸适配体有用。
- 还没有人留言评论。精彩留言会获得点赞!