用于原位分子检测的杂交链反应方法与流程
本申请要求于2016年4月25日提交的美国临时申请号62/326,959号的优先权,其通过引用纳入本文用于所有目的。
政府权益的声明
本发明是在国家科学基金会授予的批准号dge1144152和国立卫生研究院授予的批准号hg005550的政府支持下完成的。政府对本发明拥有一定的权利。
背景
choi,harrymt,victora.beck和nilesa.pierce,新一代原位杂交链反应:增益更高,成本更低,更持久(next-generationinsituhybridizationchainreaction:highergain,lowercost,greaterdurability),acsnano8.5(2014):4284-4294中描述了杂交链反应方法。其他方法包括us2005/0260635,us2006/0228733和us7,727,721中公开的那些。
技术实现要素:
本公开的实施方式涉及使用基于杂交链反应(“hcr”)的一个或多个或多种探针集的方法,用于鉴定和/或测序样品,如生物样品中的一个或多个或多种分子。通常,杂交链反应使用核酸引发序列,例如dna引发序列,和两个或更多个或多种亚稳态hcr单体,其可以是以下形式:通过在双链部分的一端的接头连接的双链部分和单链序列,例如粘性末端(toehold)序列,其附连至双链序列另一端的一条链上。示例性亚稳态hcr单体是具有粘性末端序列的dna发夹。为了便于理解,可以参考发夹序列作为亚稳态hcr单体的示例,应理解可以使用具有不同结构的其他亚稳态hcr单体。引发序列与第一个发夹序列的一条链杂交,导致第一个发夹序列打开,留下单链标记的延伸,其然后可以与第二个发夹序列杂交,导致第二个发夹序列打开,留下单链延伸,其然后可以与第三发夹序列等杂交,以形成具有多个标记物的聚合物。关于使用杂交链反应的材料和方法在us2006/0228733中提供,其通过引用整体并入本文。
本文描述的方法包括杂交链反应(“hcr”)作为基于动态dna的感测平台,其可用于读出由dna或rna的起始链的存在,丰度和定位所编码的信息,其引发来自稳定或亚稳定的hcr单体(例如发夹)的库的核酸分子的杂交链反应,其通常在本文中理解为包括在一端通过接头或接头序列连接的双链部分。hcr通过增加定位于起始链的可检测部分(例如荧光团)的数量来放大信号。据说起始链在起始链可以设计成与包括多个靶分子的样品中的特定靶分子相关的意义上是编码信息的。
本公开内容提供了杂交链反应循环策略。探针集用于产生多个串联进行的hcr反应,例如2至10个串联反应,5至100个串联反应,10至100个串联反应,或20至100个串联反应;或作为串联进行的并联反应集,例如2至10个串联反应集,10至100个串联反应集,或20至100个串联反应集,其中每集反应包含2至4个hcr反应,2至10个hcr反应,2至20个hcr反应,5至20个hcr反应,或5至50个hcr反应。这些串联反应或串联的并联反应集可用于实现多种分析物,例如10至1000,10至10000,100至1000000,500至100000,或1000至10000种分析物的连续或组合标记。本公开内容提供了使用串联探测事件的时间表使用针对靶分析物(无论是修饰的还是未修饰的)的探针集的方法。本公开提供了对针对靶分析物的探针与一种或多种hcr引发序列之间的关联进行编程的方法。本公开提供了对hcr引发序列的功能进行编程的方法。本公开内容提供了使用hcr发夹集(无论是修饰的还是未修饰的)的方法,用于hcr聚合物的可编程组装/拆解。本公开提供了对hcr聚合物和荧光信号之间的关联进行编程的方法。
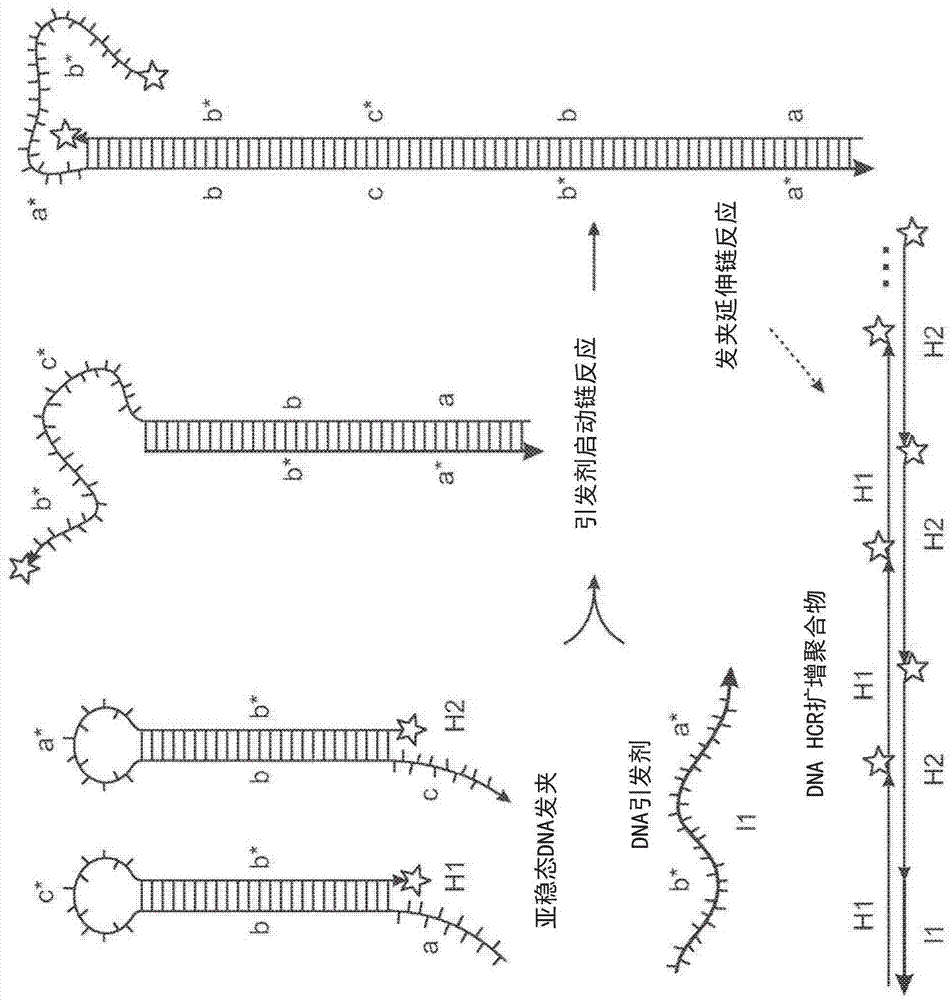
本文描述的方法结合了如图1a-1c所示和如acsnano8.5(2014):4284-4294中所述的特征,其全部内容通过引用并入本文。图1a-1c描述了通过杂交链反应(hcr)的原位扩增。图1a描述了hcr机制。亚稳态荧光发夹在检测到同源引发剂后自组装成荧光扩增聚合物。包含单链区段“b*-a*”的引发剂i1,通过与h1的单链粘性末端“a”的碱基配对与发夹h1成核,介导分支迁移,其打开发夹形成含有单链区段“c*-b*”的复合物i1·h1。该复合物通过与单链粘性末端“c”碱基配对与发夹h2成核,介导分支迁移,其打开发夹形成含有单链区段“b*-a*”的复合物i1·h1·h2。因此,引发序列被再生,为交替的h1和h2聚合步骤的链反应提供基础。红色星星表示荧光团。图1b描述了原位杂交方案。在检测阶段,将包含一个或多个或多种引发链的探针集与mrna靶标杂交,并从样品中洗去未使用的探针。在使用如图1a中所述的引发剂和多个发夹的杂交链反应的扩增阶段,引发剂触发来自发夹的系连的荧光扩增聚合物的自组装,并且从样品中洗掉未使用的发夹。图1c描绘了实验时间线。使用相同的两阶段方案,与靶mrna的数量无关。对于多重实验(描绘的三色实例),针对不同靶mrna的探针集(每集描绘的五个探针)携带正交引发剂,其触发由光谱上不同的荧光团标记的正交hcr扩增级联。
“hcr系统”,“hcr探针集”或“hcr引发剂/发夹集”包括一种或多种核酸引发链以及一种或多种亚稳态hcr单体,例如核酸发夹,它们一起能够形成杂交链反应聚合物。根据本文所述的方法,使用标准来设计hcr系统以获得所需的性质,例如与其他核酸种类的正交性或非反应性,以及具有所需的动力学和热力学性质。hcr系统可以使用标准方法合成,例如化学核酸合成,包括商业来源,例如集成dna技术公司(idt,爱荷华州科拉尔维尔),w.m.keck基金寡聚物合成研究项目(康涅狄格州新汉文),或分子设备公司(加利福尼亚州帕萨迪纳)。或者,可以使用标准酶促方法,例如pcr,随后λ核酸外切酶消化一条链以产生ssdna(参见currentprotocolsinmolecularbiology(2014):14-23,其全部内容通过引用并入本文)或体外转录,然后进行反转录以产生ssdna(参见science348:6233(2015):aaa6090,其全部内容通过引用并入本文)合成和/或扩增hcr系统组分。
本文描述的利用杂交链反应特征的方法可用于检测一种或多种分析物或靶分子,例如在生物样品(原位)内,通过设计一个或多个或多种hcr反应(串联、或作为串联进行的并联反应集进行)用于对多个靶分子、分子种类、分子质量或分子组成进行连续或组合标记,使得每个靶标在整个hcr反应中与独特的hcr信号或hcr信号集相关联。靶分子包括核酸聚合物,例如rna,dna及其类似物,氨基酸聚合物,包括蛋白质,上述任何化学修饰,脂质,代谢物,生物分子和其他小分子,以及包括以上任何的一种或多种的分子组合物。
靶分子或分析物通过探针靶向,所述探针可以与引发链连接。本公开内容提供了可通过接头与引发链连接的探针。本公开提供了引发链可以从探针上移除。本公开内容提供了接头可以是可切割接头。本公开提供了接头可以由可以结合在一起并分离的任何分子结合对形成。结合对将连接探针和引发链,使得探针和引发剂不会直接连接,而是通过分子结合对间接连接。
本文描述的方法允许信号的快速和等温扩增以及对同一样品中多种分析物或靶分子的检测。本文描述的方法包括通过同时使用独立和正交hcr系统来检测不同分析物而进行多重化,通过同时使用经光谱不同染料标记的独立和正交hcr系统来检测不同分析物而进行多重化,通过组合或比色条码化增加光谱不同标记物的空间,如通过每个hcr系统同时使用一个或多个荧光团(参见science297:836-840(2002),其全文通过引用并入本文),通过使用保护引发剂的触发探针直至探针特异性结合靶标的特异性,通过使用自猝灭hcr系统组件与在组装成扩增聚合物时分离的荧光团/猝灭剂对而减少的背景,其中未反应的hcr系统组分表现出抑制的荧光,通过使用快速扩散并渗透到小孔基质,例如甲醛固定的生物样品或聚丙烯酰胺水凝胶的小hcr系统组件高效渗透到样品中,通过使用非线性hcr机制进行灵敏的定量扩增,所述非线性hcr机制提供指数生长成特定最终尺寸的聚合物,和通过使用呈现线性,二次或指数聚合物生长的hcr系统进行可编程扩增。
因此,本文所述的方法利用可被跟踪用于分析的靶分子或分析物,因为本文所述的方法利用循环方法来分析此类靶分子或分析物。也就是说,使用如本文所述的hcr对特定的靶分子或分析物进行重复或循环分析,因此以可从可能在同一样品中的其它靶分子或分析物在光谱上可分辨的方式进行跟踪。跟踪特定靶分子或分析物的一种示例性方法是通过将样品固定在三维基质中,使得每个靶分子或分析物在基质内具有固定的已知位置,并且可以经受本文所述的重复或循环hcr程序,其中可以监测和分析由hcr产生的信号,以产生相同或特定靶分子或分析物的时间有序信号。
本文描述的方法,例如某些方法步骤的重复或循环,有利地克服了与已知系统相关的正交hcr系统的数量上限。参见acsnano8.5(2014):4284-4294。已知hcr限于五个正交dnahcr探针集。为了同时使用,hcr探针集必须彼此不反应,这通常通过同时计算设计hcr探针集来实现。该过程可能是计算密集型的,并且放大同时设计的探针集数量可能显著增加计算成本。在实践中,增加hcr探针集的数量是以增加背景和假阳性扩增为代价的,因为考虑到由hcr系统功能结构域(例如,引发结构域和传播区)的大小限定的核酸序列空间,核酸序列空间中探针集之间的距离缩小。通过增加核酸序列“设计空间”的大小可能存在与对hcr探针进行更具特异性的工程改造相关的其他成本,例如,具有较长传播区的hcr探针集可能需要明显更长的时间才能聚合。
本文描述的方法有利地克服了与已知系统相关的固有条码化限制。如果每个hcr探针集用n种光谱不同的染料中的一种标记,则可以同时标记n种分析物。如果使用所有组合和单色条形码,则同时标记的分析物的数量等于2n-1。
生物系统在分子种类,分子质量和分子构型方面表现出极大的复杂性。本文所述的方法可用于同时多重标记多种分子种类,分子构型和分子质量,以便确定生物系统内分子的种类,丰度和定位,例如,测量生物系统的分子构型。靶分析物的某种性质包含关于需要被测量的靶的存在,定位,丰度,数量,种类,质量,构型或其他性质的一些“原始信息”;其中“信息”被广泛地认为是指在生物系统内由原子,分子,化合物或分子复合物的特定空间和/或时间排列所承载或表示的,其是需要被测量的。在检测期间,该信息或其一部分通过标记和检测从靶分析物传递到人或计算机系统。
给定n个正交,独立和光谱不同的hcr系统,本文描述的方法通过使用分析物的串联标记的方法步骤来提供更大的多重性,用于线性或指数条码化。线性条码化重复使用(即使用相同的)n个hcr系统连续k次以标记k×n个总分析物。这可以通过在每轮hcr扩增和检测之间改变分析物和hcr引发剂之间的关联来实现,使得每个hcr引发剂在每轮hcr期间与不同的分析物相关联。指数条码化重复使用(即使用相同的)n个hcr系统连续k次以标记nk个总分析物。这可以通过在hcr扩增和检测的每个循环之间改变分析物和hcr引发剂之间的关联来实现,使得每个分析物在整个连续hcr循环中与多个hcr引发剂相关联(在hcr的每个连续循环期间,每个分析物与0和1个之间的hcr系统相关联)。在整个hcr循环中,与靶分析物相关的组合标记物由此在每个循环内由各个hcr信号构建。在这两种情况下,靶分析物和hcr反应之间的关系(可以理解为产生检测到的荧光信号)是可编程的,因为hcr反应随着时间的推移经工程改造以产生用于标记分析物,例如原位标记分析物目的的编码荧光信号集。总的来说,该技术在本文中称为循环hcr(chcr),因为整个标记过程中的步骤可以循环,即以连续和重复的方式发生。
本公开内容提供了用于“编程”hcr反应的标记级联的方法和材料,包括使样品与探针接触,使样品与hcr引发序列接触,使样品与亚稳态hcr单体(例如发夹)接触,和使样品与荧光部分接触的步骤,其中探针结合靶分析物,并且其中hcr引发序列与探针相关联,并且其中引发序列与同源发夹成核并触发系连的扩增聚合物的自组装,并且其中系连的扩增聚合物与荧光部分相关联,并且其中通过测量样品的荧光来检测靶分析物。
本公开还提供了用于“编程”标记级联的方法和材料,包括使样品与探针接触,使样品与hcr引发序列接触,使样品与亚稳态hcr单体(例如发夹)接触,和使样品与荧光部分接触的步骤,其中探针结合靶分析物,并且其中hcr引发序列与探针相关联,并且其中引发序列与同源发夹成核并触发系连的扩增聚合物的自组装,并且其中系连的扩增聚合物与荧光部分相关联,并且其中通过测量样品的荧光来检测靶分析物;并且还包括以下步骤:从hcr聚合物中解离荧光部分并从样品中除去它们的,例如通过洗涤,降解或拆解hcr聚合物,并从样品中除去组分碎片,例如通过洗涤,解离或者从接触靶分析物的探针中除去hcr引发序列,并从样品中除去它,例如通过洗涤,和/或从靶分析物中解离探针,并从样品中除去它,例如通过洗涤。
通过方法和材料特异性启用循环hcr,以实现每个信息传输步骤的可编程性。“可编程性”是指使信息传递或标记级联的每个步骤能够被门控,即根据预定的,不连续的时间表执行的材料和方法,其中信息传递或标记级联取决于一个或多个,或多种输入;或者,每个步骤都能够被特定地反转,即,在被检测到之后,传递给标记级联中的后续步骤的信息被选择性地失活,去除,破坏或变得不可检测;或者每个步骤都可以是门控的和可逆的。这里使用的“门控”可以表示“不活动”,“限制”,“不能继续”,并且如本文所使用的“非门控”可以表示“活动”,“激活”,“不受限制”,“能够继续”等。
本公开提供了用于检测生物样品中的靶分析物的方法,包括以下步骤:使样品与包含引发序列的探针接触,使样品与一个或多个,或多种亚稳态荧光hcr单体(例如发夹)接触,其中探针结合靶分析物,并且其中引发序列与同源发夹成核并触发系连的荧光扩增聚合物的自组装,并通过测量样品的荧光检测样品中的靶分析物。在一个实施方式中,可以添加多种探针用于检测多种靶分析物。在另一个实施方式中,可以添加具有光谱上不同的荧光团的多个亚稳态荧光发夹用于多重检测。在一个实施方式中,分析物包含核酸聚合物,包括rna,dna及其类似物。在另一个实施方式中,分析物包含氨基酸聚合物,包括蛋白质及其化学修饰。在又一个实施方式中,分析物包含脂质,代谢物,生物分子和其他小分子。在一个实施方式中,引发序列是dna引发序列。在另一个实施方式中,本发明的方法还包括用于多重检测的线性或指数条码化的分析物连续标记。在一个实施方式中,本公开的方法还包括将接头探针或二级探针附连至靶分析物。在另一个实施方式中,接头探针或二级探针与包括引发序列的探针结合。在某些实施方式中,引发序列对于靶分析物是共有的或独特的。在一个实施方式中,探针是触发或可激活的探针,使得引发序列受到保护或抑制,直到探针特异性结合靶分析物,于是引发序列被激活。在某些实施方式中,使用循环hcr从一个或多个或多种单独的hcr信号构建与靶分析物相关联的独特标记物。
本公开还提供了一种原位成像方法,包括以下步骤:使生物样品与探针接触,使样品与变得关联探针的hcr引发序列接触,使生物样品与亚稳态hcr单体例如发夹接触,其中探针结合生物样品中的靶分析物,并且其中hcr引发序列与探针相关联,并且其中引发序列与同源发夹成核并触发系连的扩增聚合物的自组装,并且其中系连的扩增聚合物与荧光部分相关联,并且其中通过测量聚合物的荧光检测生物样品中的靶分析物。
在一个实施方式中,可以添加多种探针用于对多种靶分析物成像。在另一个实施方式中,可以添加具有光谱上不同的荧光团的多个亚稳态荧光发夹用于多重成像。在另一个实施方式中,本发明的方法还包括用于多重检测的线性或指数条码化的分析物的连续标记。在一个实施方式中,本公开内容的方法还包括将接头探针或二级探针附连至靶分析物,其中接头探针或二级探针对靶分析物是独特的。在另一个实施方式中,接头探针或二级探针与包括引发序列的探针结合。在某些实施方式中,引发序列对于靶分析物是常见的或独特的。在一个实施方式中,探针是触发的探针,其中引发序列受到保护或抑制,直到探针特异性结合靶分析物,于是引发序列被激活。根据本发明的方法还包括多轮杂交链反应“hcr”和检测循环。
本公开内容提供了杂交链反应“hcr”系统,其包括含有一种或多种核酸引发链的探针,和亚稳核酸荧光hcr单体如发夹,其中引发链能够与同源发夹成核并触发hcr荧光聚合物的自组装。在一个实施方式中,存在多种探针用于对多种靶分析物成像。在另一个实施方式中,存在具有光谱上不同的荧光团的多个亚稳态荧光发夹用于多重成像。在一个实施方式中,使用标准对系统进行设计以获得所需的性质,例如与其他核酸种类的非反应性或正交性,并进行设计以具有所需的动力学和热学性质。在在一个实施方式中,发夹可以通过化学和/或酶促合成产生。在一些实施方式中,可以进行多轮杂交链反应“hcr”和检测循环。在一个实施方式中,可以重复使用引发剂和发夹。在另一个实施方式中,可以以编程方式生成和重置荧光信号。
根据一个方面,本公开提供了用于检测样品中的一种或多种靶分析物的方法,包括使样品与一个或多个探针集接触,其中每个探针集包含一个或多个一级探针,每个一级探针与接头同源,并且其中每个探针集特异于靶分析物,使样品与一个或多个杂交链反应(hcr)引发剂接触,所述引发剂与接头结合,使样品与一个或多个hcr扩增器系统接触,其中每个hcr扩增器系统包含两个或更多个亚稳态hcr单体,其中至少一种hcr单体包含可检测标记物,其中一级探针结合靶分析物,其中接头连接一级探针与引发剂,并且其中引发剂与同源hcr扩增器单体接触并触发自组装和系连的核酸扩增聚合物产物的杂交链反应,并且其中检测可检测标记物。在一个实施方式中,各自特异于靶分析物的多个探针集被设计用于可编程和时间有序的杂交链反应。在另一个实施方式中,可检测标记物是荧光标记物,并且时间产生的荧光信号的总数为每种靶分析物提供独特的信息集,包括分子种类,分子质量或分子构型。在一个实施方式中,样品可以同时与探针集和引发剂接触。在另一个实施方式中,hcr扩增器系统包含两个亚稳态dna发夹。在一个实施方式中,hcr扩增器系统的可检测标记物包括用于多重检测的光谱上不同的荧光信号。在另一个实施方式中,hcr扩增器系统的可检测标记物包含用于通过杂交进行荧光测序,通过连接进行荧光测序或通过合成进行荧光测序的测序模板。在一些实施方式中,靶分析物包含核酸聚合物,包括rna,dna及其类似物。在其他实施方式中,靶分析物包含氨基酸聚合物,包括蛋白质及其化学修饰。在一些实施方式中,靶分析物包含脂质,代谢物,生物分子和其他小分子。在某些实施方式中,引发剂包含核酸杂交链反应(hcr)起始区。在一个实施方式中,引发剂包含dna。在一些实施方式中,hcr扩增器单体包含通过接头连接的亚稳态dna双链。在一些实施方式中,靶分析物是连续标记的。在一个实施方式中,来自hcr全部循环的组合的时间有序的检测标记物集包括每种靶分析物的独特复合标记物,其中每个循环包括检测一种或多种hcr系统的可检测标记物。在另一个实施方式中,复合标记物包括用于多重检测的线性或指数条形码。在一个实施方式中,独特复合标记物包括条形码化消息。在另一个实施方式中,条码化消息还包含附加信息,包括用于错误检测或纠错。在一个实施方式中,可编程和时间有序的杂交链反应和同源荧光信号集的设计包括针对每种靶分析物的独特条码化消息。在一个实施方式中,通过每个信息传送步骤的可编程性来启用循环hcr。可编程性是指使信息传输的每个步骤都可以被门控和/或反转。门控信息传输指的是根据预定的不连续计划执行,其中信息传输取决于一个或多个输入。在一个实施方式中,将一个或多个一级探针集与靶标的结合重复两次或更多次。在一个实施方式中,一级探针和接头通过共价或非共价相互作用连接。在另一个实施方式中,接头和引发剂通过共价或非共价相互作用连接。在一个实施方式中,接头可以是键或包含与包含引发序列的寡核苷酸的序列部分互补的序列部分,并与包含引发序列的寡核苷酸杂交。在另一个实施方式中,一级探针和接头之间的连接可编程地被破坏或反转。在一个实施方式中,接头和引发剂之间的连接可编程地被破坏或反转。在另一个实施方式中,接头包含与保护基团同源的引发序列,其防止引发剂启动hcr。在一个实施方式中,引发序列受保护性寡核苷酸保护。在另一个实施方式中,保护基团可编程地从接头中断,这允许引发剂启动hcr。在一个实施方式中,可以引入去保护性寡核苷酸以通过粘性末端链置换除去保护性寡核苷酸。在另一个实施方式中,在检测到可检测标记物后,hcr聚合物被降解或拆解。在一个实施方式中,hcr聚合物和检测标记物之间的连接在检测后可编程地被破坏或反转。在另一个实施方式中,可以可编程地破坏和反转一级探针与靶标的结合,以及一级探针,接头,引发剂,聚合物和检测部分之间的连接。在某些实施方式中,该方法还包括多轮杂交链反应“hcr”和检测循环。在其他实施方式中,该方法可用于生物样品的原位成像。
根据另一方面,本公开提供了包含一个或多个探针集的循环杂交链反应“hcr”系统,其中每个探针集包含一个或多个一级探针,每个一级探针与接头同源,并且其中每个探针集对靶分析物,引发剂和一种或多种hcr扩增器系统特异,其中每个hcr扩增器系统包含两种或更多种亚稳态hcr单体,其中至少一种hcr单体包含可检测标记物,其中引发剂与同源hcr扩增器单体接触并触发自组装和系连的核酸扩增聚合物产物的杂交链反应,并且其中检测可检测标记物。在一个实施方式中,各自特异于靶分析物的多个探针集被设计用于可编程和时间有序的杂交链反应。在另一个实施方式中,时间产生的荧光信号的总数为每种靶分析物提供独特的信息集,包括分子种类,分子质量或分子构型。在一个实施方式中,hcr扩增器单体是dna发夹。在另一个实施方式中,hcr扩增器单体的可检测标记物还包括用于多重检测的光谱上不同的荧光信号。在一个实施方式中,使用标准对系统进行设计以获得所需的性质,例如与其他核酸种类的非反应性或正交性,并进行设计具有所需的动力学和热力学性质。在另一个实施方式中,hcr单体可以通过化学和/或酶促合成产生。在一个实施方式中,可以使用非荧光hcr单体。在另一个实施方式中,在hcr聚合阶段期间或之后荧光标记非荧光hcr单体。在一个实施方式中,在hcr聚合阶段后,由非荧光单体形成的聚合物被荧光标记。在另一个实施方式中,在通过杂交进行荧光测序,通过连接进行荧光测序,或通过合成,通过酶促反应或通过化学反应进行荧光测序的hcr聚合阶段后,由非荧光单体形成的聚合物被荧光标记。在某些实施方式中,可以进行超过一轮的杂交链反应“hcr”和荧光检测。在其他实施方式中,可以重复使用探针,接头,引发剂和hcr单体。在一个实施方式中,接头是与包含引发剂的寡核苷酸互补的核酸序列。在另一个实施方式中,接头包含用于与引发剂可编程解离的官能团。在一个实施方式中,接头包含与保护基团同源的引发剂,其防止引发剂起始hcr。在另一个实施方式中,在每轮杂交链反应“hcr”和检测周期期间,可以破坏和反转一级探针与靶标的结合,以及一级探针,接头,引发剂,聚合物和可检测标记物之间的连接,以实现系统的可编程性。在一个实施方式中,可以以编程方式生成和重置对可检测标记物的检测。在另一个实施方式中,hcr扩增器单体含有用于可编程拆解或降解聚合物的官能团。在一个实施方式中,官能团由粘性末端链置换序列组成。在另一个实施方式中,官能团包括化学不稳定,酶不稳定或光不稳定的化学基团。在某些实施方式中,通过包括以下的方法来反转探针与靶分析物的结合:化学处理,酶处理,rnaish探针的dna酶处理,5′phosish探针的核酸外切酶处理,核酸探针的核酸酶处理,肽探针的蛋白酶处理,使用热或变性剂来破坏核酸杂交,使用热或变性剂来破坏适体结合,或使用热或变性剂来破坏抗体和蛋白质之间的键合。在一个实施方式中,该系统包括用于将hcr引发剂功能性连接至结合探针编程的方法。在另一个实施方式中,用于将hcr引发剂功能性连接至结合探针编程的方法包括a)使用核酸杂交使用通过杂交测序将引发剂添加至带有互补核酸分子的接头探针,b)使用酶添加引发剂至接头探针,c)使用热或变性剂破坏核酸杂交以除去与接头探针杂交的引发剂,d)使用粘性末端链置换以从通过接头探针定位于靶分子的引发剂中除去保护链,和e)在引发剂和接头探针之间掺入化学,酶或光不稳定基团,使得可通过化学,酶促或光处理除去引发剂,这些处理破坏了引发剂和接头探针之间的化学连接。在一个实施方式中,将引发剂添加至接头探针的酶是催化夹板连接反应的dna连接酶。在另一个实施方式中,该系统包括用于反转杂交链反应的方法。在一个实施方式中,用于反转杂交链反应的方法包括a)使用包含一个或多个额外序列的修饰的hcr单体用于粘性末端链置换,使得添加一个或多个互补dna链将导致hcr聚合物拆解,和b)使用在hcr单体的dna主链中包含一个或多个酶或化学敏感基团或光不稳定基团的修饰的hcr单体,使得hcr聚合物可以通过化学,酶促或光处理而被片段化或破坏。在一个实施方式中,该系统包括用于编程hcr聚合物荧光信号的功能性产生的方法。在某些实施方式中,编程hcr聚合物荧光信号的功能性产生的方法包括a)使用包含能够通过合成测序(sbs),通过连接测序(sbl)或通过杂交测序(sbh)被探测到的额外序列的修饰的hcr单体将荧光部分引入hcr聚合物,b)使用在hcrdna单体主链和荧光部分之间包含酶,化学或光不稳定基团的修饰的hcr单体,使得可以通过化学,酶促,或者光处理除去荧光部分,c)使用能够例如通过sbs,sbl或sbh标记hcr聚合物的修饰的荧光探针,其中荧光探针包含用于粘性末端链置换的额外序列,使得荧光探针可以通过破坏荧光探针和hcr聚合物之间的杂交从hcr聚合物中除去,和d)使用能够例如通过sbs,sbl或sbh标记hcr聚合物的修饰的荧光探针,其中荧光探针包含hcr聚合物主链和荧光部分之间的酶,化学或光不稳定基团,使得荧光部分可以通过化学,酶促或光处理除去。
根据一个方面,本公开提供了用于杂交链反应(hcr)原位检测生物样品中的一种或多种靶分析物的方法,包括使样品与一个或多个探针集接触,其中每个探针集包含一个或多个一级探针,每个一级探针与接头相关,并且其中每个探针集特异于靶分析物,使样品与一个或多个杂交链反应(hcr)引发剂接触,使样品与一种或多种hcr扩增器系统接触,其中每个hcr扩增器系统包含两个或更多个亚稳态hcr单体,其中至少一种hcr单体包含可检测标记物,其中一级探针结合靶分析物,其中接头连接一级探针与引发剂,并且其中引发剂与同源hcr扩增器单体接触并触发自组装和系连的核酸扩增聚合物产物的杂交链反应,并且其中检测可检测标记物。在一个实施方式中,各自特异于靶分析物的多个探针集被设计用于可编程和时间有序的杂交链反应。在另一个实施方式中,时间产生的荧光信号的总数为每种靶分析物提供独特的信息集,包括分子种类,分子质量或分子构型。在一个实施方式中,样品可以同时与探针集和引发剂接触。在另一个实施方式中,可以反转探针与靶分析物的结合,以便可以使用杂交链反应重新探测靶分析物以扩增信号。在某些实施方式中,通过包括以下的方法来反转探针与靶分子的结合:化学处理,酶处理,rnaish探针的dna酶处理,5′phosish探针的核酸外切酶处理,核酸探针的核酸酶处理,肽探针的蛋白酶处理,使用热或变性剂来破坏核酸杂交,使用热或变性剂来破坏适体结合,或使用热或变性剂来破坏抗体和蛋白质之间的键合。在一个实施方式中,该方法还包括用于将hcr引发剂功能性连接编程为结合探针的方法。在一个实施方式中,用于将hcr引发剂功能性连接至结合探针编程的方法包括a)使用核酸杂交使用通过杂交测序将引发剂添加至带有互补核酸分子的接头探针,b)使用酶添加引发剂至接头探针,c)使用热或变性剂破坏核酸杂交以除去与接头探针杂交的引发剂,d)使用粘性末端链置换以从通过接头探针定位于靶分子的引发剂中除去保护链,和e)在引发剂和接头探针之间掺入化学,酶或光不稳定基团,使得可通过化学,酶促或光处理除去引发剂,这些处理破坏了引发剂和接头探针之间的化学连接。在一个实施方式中,将引发剂添加至接头探针的酶是催化夹板连接反应的dna连接酶。在一个实施方式中,该方法还包括用于反转杂交链反应的方法。在一个实施方式中,用于反转杂交链反应的方法包括a)使用包含一个或多个额外序列的修饰的hcr单体用于粘性末端链置换,使得添加一个或多个互补dna链将导致hcr聚合物拆解,和b)使用在hcr单体的dna骨架中包含一个或多个酶或化学敏感基团或光不稳定基团的修饰的hcr单体,使得hcr聚合物可以通过化学,酶促或光处理而被片段化或破坏。在一个实施方式中,该方法还包括用于编程hcr聚合物荧光信号的功能性产生的方法。在一个实施方式中,编程hcr聚合物荧光信号的功能性产生的方法包括a)使用包含能够通过合成测序(sbs),通过连接测序(sbl)或通过杂交测序(sbh)被探测到的额外序列的修饰的hcr单体将荧光部分引入hcr聚合物,b)使用在hcrdna单体主链和荧光部分之间包含酶,化学或光不稳定基团的修饰的hcr单体,使得可以通过化学,酶促,或者光处理除去荧光部分,c)使用能够例如通过sbs,sbl或sbh标记hcr聚合物的修饰的荧光探针,其中荧光探针包含用于粘性末端链置换的额外序列,使得荧光探针可以通过破坏荧光探针和hcr聚合物之间的杂交从hcr聚合物中除去,和d)使用能够例如通过sbs,sbl或sbh标记hcr聚合物的修饰的荧光探针,其中荧光探针包含hcr聚合物主链和荧光部分之间的酶,化学或光不稳定基团,使得荧光部分可以通过化学,酶促或光处理除去。
根据另一方面,本公开提供了用于检测一种或多种靶分析物的方法,包括使样品与循环杂交链反应“hcr”系统接触超过一次,其中样品中的每种靶分析物在hcr循环的总数上与一种扩增的荧光信号相关联。在一个实施方式中,由循环hcr产生的hcr循环和光谱可分辨荧光信号的组合包含靶分析物的独特标记物。
根据另一方面,本公开提供了用于检测一种或多种靶分析物的方法,包括使样品与循环杂交链反应“hcr”系统接触超过一次,其中样品中的每种靶分析物在hcr循环的总数上与超过一种扩增的荧光信号相关联。在一个实施方式中,由每种靶分析物产生的扩增的荧光信号在信息上组合成复合标记物。在一个实施方式中,每种靶分析物与独特的复合标记物相关联。在另一个实施方式中,样品被固定。在一个实施方式中,通过hcr循环之间的靶分析物的空间不变性产生复合标记物。在一个实施方式中,靶分析物附连于3d基质。在另一个实施方式中,通过hcr循环之间的靶分析物的空间不变性产生复合标记物。在一个实施方式中,通过hcr循环之间的靶分析物的未知顺序不变性产生复合标记物。在另一个实施方式中,循环hcr系统的一个或多个组件附连到3d矩阵。在一个实施方式中,通过hcr循环之间的靶分析物的空间不变性产生复合标记物。在另一个实施方式中,通过hcr循环之间的靶分析物的未知顺序不变性产生复合标记物。在一个实施方式中,靶分析物和hcr荧光信号之间的关联是可编程的。在另一个实施方式中,靶分析物和hcr荧光信号之间的关联是可编程的。
根据一个方面,本公开提供了用于检测样品中一种或多种靶分析物的方法,包括(a)使样品与一个或多个探针集接触,其中每个探针集包含一种或多种各自具有接头的一级探针,和其中每个探针集对靶分析物具有特异性,其中一种或多种具有接头的一级探针结合靶分析物;(b)使样品与一种或多种与接头结合的杂交链反应(hcr)引发剂接触,(c)使样品与两种或更多种亚稳态hcr单体接触,其中一种或多种引发剂与两种或更多种亚稳态hcr单体接触和引发杂交链反应以产生自组装和系连的核酸扩增聚合物产物,和(d)将一种或多种可检测标记物附连至系连的核酸扩增产物,并任选地检测一种或多种可检测标记物。在一个实施方式中,探针可从靶分析物中除去,引发剂可从接头上除去,核酸扩增聚合物产物可从引发剂中除去,或者一种或多种可检测标记物可从核酸扩增聚合物产物中除去。在另一个实施方式中,探针可从靶分析物中除去,引发剂可从接头上除去,并且核酸扩增聚合物产物可从引发剂中除去。在一个实施方式中,探针可从靶分析物中除去。在另一个实施方式中,引发剂可从接头上除去。在一个实施方式中,核酸扩增聚合物产物可从引发剂中除去。在另一个实施方式中,一种或多种可检测标记物可从核酸扩增聚合物产物中除去。在另一个实施方式中,探针可从靶分析物中除去,引发剂可从接头上除去,核酸扩增聚合物产物可从引发剂中除去,并且一种或多种可检测标记物可从核酸扩增聚合物产物中除去。
根据另一个方面,本公开提供了用于检测样品中一种或多种靶分析物的方法,包括(a)使样品与一个或多个探针集接触,其中每个探针集包含一种或多种各自具有接头的一级探针,和其中每个探针集对靶分析物具有特异性,其中一种或多种具有接头的一级探针结合靶分析物;(b)使样品与一种或多种与接头结合的杂交链反应(hcr)引发剂接触,(c)使样品与两种或更多种包括可检测标记物的亚稳态hcr单体接触,其中一种或多种引发剂与两种或更多种亚稳态hcr单体接触和引发杂交链反应以产生自组装和系连的核酸扩增聚合物产物,和(d)任选地检测一种或多种可检测标记物。在一个实施方式中,探针可从靶分析物中除去。在另一个实施方式中,引发剂可从接头上除去。在另一个实施方式中,核酸扩增聚合物产物可从引发剂中除去。
根据一个方面,本公开提供了用于鉴定样品中靶分析物的方法,包括(a)使样品与一种或多种探针接触,其中所述一种或多种探针的给定探针与接头偶联,和其中所述给定探针具有与所述靶分析物序列互补的序列,其中当所述样品与所述一种或多种探针接触时,所述给定探针与所述靶分析物结合;(b)在足以允许所述一种或多种hcr引发剂的给定hcr引发剂与接头结合的条件下使样品与一种或多种杂交链反应(hcr)引发剂接触,其中所述给定hcr引发剂与所述给定探针分开,并且其中在使所述样品与所述一种或多种hcr引发剂接触时,所述接头将所述探针与所述给定hcr引发剂偶联;(c)使样品与一种或多种hcr扩增器接触以引发杂交链反应,其中所述一种或多种hcr扩增器的给定hcr扩增器包含至少一种包含可检测标记物的hcr单体,从而产生包含所述hcr单体的扩增产物,该扩增产物与所述给定探针偶联;和(d)检测所述扩增产物,从而鉴定所述靶分析物。在一个实施方式中,该方法还包括使样品与多个探针集接触,每个探针集特异于靶分析物,所述多个探针集配置成允许可编程和时间有序的杂交链反应。在另一个实施方式中,可检测标记物是荧光标记,并且所述检测包括检测荧光信号,其中全部时间产生的荧光信号提供独特信息集,包括每种靶分析物的分子种类,分子质量或分子构型。在一个实施方式中,一种或多种hcr扩增器包含两个亚稳态dna发夹。在另一个实施方式中,一种或多种hcr扩增器的可检测标记物包括用于多重检测的光谱上不同的荧光信号。在一个实施方式中,hcr单体的可检测标记物包含用于通过杂交进行荧光测序,通过连接进行荧光测序或通过合成进行荧光测序的测序模板。在另一个实施方式中,靶分析物包括核酸聚合物,其包括rna,dna,rna类似物,dna类似物,蛋白质及其化学修饰。在又一个实施方式中,靶分析物包含脂质,代谢物,生物分子和其他小分子。在一个实施方式中,该方法还包括连续标记靶分析物。在一个实施方式中,所述连续标记包括将每种分析物与多种hcr引发剂相关联。在另一个实施方式中,给定hcr扩增器包含两种或更多种亚稳态hcr单体。在一个实施方式中,所述给定与靶分析物的所述结合重复两次或更多次。在一个实施方式中,接头可以是键或包含与包含引发序列的寡核苷酸的序列部分互补的序列部分,并与包含引发序列的寡核苷酸杂交。在某些实施方式中,该方法还包括破坏或反转给定探针和接头之间的偶联,接头和hcr引发剂之间的偶联,或所述给定探针和hcr引发剂之间的偶联。在一个实施方式中,接头包含与保护基团同源的引发序列,其防止hcr引发剂触发hcr。在另一个实施方式中,保护基团是保护性寡核苷酸。在另一个实施方式中,该方法还包括从接头中破坏保护基团,从而允许hcr引发剂触发hcr。在一个实施方式中,所述破坏包括将去保护性寡核苷酸引入样品以通过粘性末端链置换除去保护基团。在另一个实施方式中,该方法还包括在所述检测后降解或拆解扩增产物。在一个实施方式中,该方法还包括在所述检测后破坏或反转扩增产物和检测标记物之间的偶联。在另一个实施方式中,该方法还包括破坏或反转所述给定探针与所述靶分析物的结合。在另一个实施方式中,该方法还包括进行包括多个检测循环的多轮杂交链反应。在一个实施方式中,多轮杂交链反应包括重复使用一种或多种hcr引发剂或一种或多种hcr扩增器。在另一个实施方式中,该方法还包括用于对给定hcr引发剂与给定探针之间的功能性连接编程,其中所述编程包括a)使用核酸杂交使用通过杂交测序将hcr引发剂添加至带有互补核酸分子的接头探针,b)使用酶添加hcr引发剂至接头探针,c)使用热或变性剂破坏核酸杂交以除去与接头探针杂交的hcr引发剂,d)使用粘性末端链置换以从通过接头探针定位于靶分子的hcr引发剂中除去保护链,或e)在hcr引发剂和接头探针之间掺入化学,酶或光不稳定基团,使得可通过化学,酶促或光处理除去hcr引发剂,这些处理破坏了引发剂和接头探针之间的化学连接。在一个实施方式中,将hcr引发剂添加至接头探针的酶是催化夹板连接反应的dna连接酶。在另一个实施方式中,该方法还包括反转或阻滞杂交链反应。在一个实施方式中,反转或阻滞杂交链反应包括a)使用包含一个或多个额外序列的修饰的hcr单体用于粘性末端链置换,使得添加一个或多个互补dna链将导致扩增产物拆解,或b)使用在hcr单体的dna骨架中包含一个或多个酶或化学敏感基团或光不稳定基团的修饰的hcr单体,使得扩增产物通过化学,酶促或光处理而被片段化或破坏。在另一个实施方式中,该方法还包括通过以下对从扩增产物生成荧光信号编程:a)使用包含能够通过合成测序(sbs),通过连接测序(sbl)或通过杂交测序(sbh)被探测到的额外序列的修饰的hcr单体将荧光部分引入扩增产物,b)使用在hcr单体的dna主链和荧光部分的可检测标记物之间包含酶,化学或光不稳定基团的修饰的hcr单体,使得可以通过化学,酶促,或者光处理除去荧光部分,c)使用能够例如通过合成测序(sbs),通过连接测序(sbl)或通过杂交测序(sbh)标记扩增产物的修饰的荧光探针,其中荧光探针包含用于粘性末端链置换的额外序列,使得荧光探针可以通过破坏荧光探针和扩增产物之间的杂交从扩增产物中除去,和d)使用能够例如通过sbs,sbl或sbh标记扩增产物的修饰的荧光探针,其中荧光探针包含扩增产物主链和包含荧光部分的可检测标记物之间的酶,化学或光不稳定基团,使得荧光部分可以通过化学,酶促或光处理除去。在一个实施方式中,给定探针可从靶分析物中除去,hcr引发剂可从接头上除去,扩增产物可从hcr引发剂中除去,或可检测标记物可从扩增产物中除去。
根据另一方面,本公开内容提供了循环杂交链反应(hcr)系统,包含:一种或多种探针,其中所述一种或多种探针的给定探针与接头偶联,其中所述给定探针具有与靶分析物互补的序列,一种或多种hcr引发剂,其中所述一种或多种hcr引发剂的给定hcr引发剂与所述给定探针分开,并且其中所述给定hcr引发剂配置为与所述接头结合并将所述探针与所述给定hcr引发剂偶联,和一种或多种hcr扩增器,其中所述一种或多种hcr扩增器的给定hcr扩增器包含至少一种包含可检测标记物的hcr单体,其中所述给定hcr引发剂配置成与hcr单体偶联并引发杂交链反应以产生包含所述hcr单体的扩增产物,该扩增产物与所述给定探针偶联。在一个实施方式中,该系统进一步包括多个探针集,每个探针集特异于靶分析物,其中多个探针集设计用于可编程和时间有序的杂交链反应。在一个实施方式中,多个探针集配置成提供时间上产生的荧光信号,并且其中时间上产生的荧光信号的总数为每个靶分析物提供独特的信息集,包括分子种类,分子质量或分子构型。在另一个实施方式中,每个hcr扩增器包含两种或更多种亚稳态hcr单体,每种单体都是dna发夹。在另一个实施方式中,所述一种或多种hcr扩增器包含两种或更多种包含可检测标记物的亚稳态hcr单体,所述可检测标记物包含用于多重检测的光谱不同的荧光信号。在一个实施方式中,所述hcr单体是非荧光hcr单体。在另一个实施方式中,非荧光hcr单体配置成在产生扩增产物期间或之后被荧光标记。在一个实施方式中,在通过杂交进行荧光测序,通过连接进行荧光测序,或通过合成,通过酶促反应或通过化学反应进行荧光测序而产生扩增产物后,由非荧光单体形成的扩增产物被荧光标记。在另一个实施方式中,一种或多种探针,接头,一种或多种hcr引发剂或一种或多种hcr扩增器配置为重复使用。在一个实施方式中,接头是与包含hcr引发剂的寡核苷酸互补的核酸序列。在另一个实施方式中,接头包含用于与引发剂可编程解离的官能团。在一个实施方式中,可以以编程方式生成和重置对可检测标记物的检测。在另一个实施方式中,hcr单体含有用于可编程拆解或降解扩增产物的官能团。在一个实施方式中,官能团包含粘性末端链置换序列。在另一个实施方式中,官能团包括化学不稳定,酶不稳定或光不稳定的化学基团。在一个实施方式中,给定探针与靶分析物的结合被配置为在杂交链反应期间被破坏或反转。在另一个实施方式中,通过以下来破坏或反转给定探针与靶分析物的结合:化学处理,酶处理,rna原位杂交(ish)探针的dna酶处理,5′phosish探针的核酸外切酶处理,核酸探针的核酸酶处理,肽探针的蛋白酶处理,使用热或变性剂来破坏核酸杂交,使用热或变性剂来破坏适体结合,或使用热或变性剂来破坏抗体和蛋白质之间的键合。
根据一个方面,本公开提供了用于鉴定样品中的靶分析物的方法,包括(a)使所述样品与包含与所述靶分析物的序列互补的序列的一级探针接触;(b)使所述样品与二级探针接触,所述二级探针配置成与所述一级探针偶联,其中所述一级探针与所述二级探针的偶联促进在至少一个包含可检测标记物的hcr扩增器存在下的杂交链反应(hcr),产生包含所述可检测标记物的扩增产物,其中所述二级探针与hcr扩增器和所述一级探针分开;并且(c)检测所述可检测标记物,从而鉴定所述靶分析物。在一个实施方式中,所述hcr不是聚合酶链反应。在另一个实施方式中,所述扩增产物与所述一级探针偶联。在一个实施方式中,所述hcr扩增器具有与所述二级探针的序列互补的序列。在另一个实施方式中,所述一级探针与接头偶联,所述接头允许所述一级探针与所述二级探针偶联。在一个实施方式中,一级探针包含启动所述hcr的hcr引发剂。在另一个实施方式中,一级探针包含保护基团,其防止hcr引发剂在所述样品与二级探针接触之前启动所述hcr。在一个实施方式中,保护基团是保护性寡核苷酸。在另一个实施方式中,一级探针包含启动所述hcr的hcr引发剂。在一个实施方式中,所述二级探针不包含可检测标记物。在另一个实施方式中,所述hcr扩增器包含两种或更多种亚稳态hcr单体。在一个实施方式中,所述两种或更多种亚稳态hcr单体中的每一种包含亚稳态dna发夹。
根据另一方面,本公开提供了一种用于鉴定样品中的靶分析物的系统,包括用于检测可检测标记物的检测器;与所述检测器操作性偶联的控制器,其中所述控制器包括一个或多个计算机处理器,所述计算机处理器被单独地或共同地编程以指导:(i)使所述样品与包含与所述靶分析物序列互补的序列的一级探针接触;(ii)使所述样品与二级探针接触,所述二级探针配置成与所述一级探针偶联,其中所述一级探针与所述二级探针的偶联促进在包含可检测标记物的至少一个hcr扩增器存在下的杂交链反应(hcr),以产生包含所述可检测标记物的扩增产物,其中所述二级探针与hcr扩增器和所述一级探针分开;和(iii)使用所述检测器检测所述可检测标记物,从而鉴定所述靶分析物。
根据另一方面,本发明提供了用于鉴定样品中的靶分析物的试剂盒,包括含有可检测标记物的杂交链反应(hcr)扩增器,该hcr扩增器配置为促进hcr;一级探针,其包含与所述靶分析物的序列互补的序列;和二级探针,其配置成与所述一级探针偶联,其中所述二级探针不包括可检测标记物,其中所述二级探针与所述hcr扩增器和所述一级探针分开。在一个实施方式中,试剂盒还包括使用所述hcr扩增器,一级探针和二级探针进行所述hcr的说明书。在另一个实施方式中,试剂盒还包含切割剂,所述切割剂配置成切割一级探针和二级探针之间的接头,从而破坏一种或多种hcr引发剂以防触发与一种或多种hcr扩增器的链反应。在另一个实施方式中,所述hcr扩增器具有与所述二级探针的序列互补的序列。在一个实施方式中,所述一级探针与接头偶联,所述接头允许所述一级探针与所述二级探针偶联。在另一个实施方式中,一级探针包含启动所述hcr的hcr引发剂。在一个实施方式中,一级探针包含保护基团,其防止hcr引发剂在所述一级探针与二级探针偶联之前启动所述hcr。在另一个实施方式中,保护基团是保护性寡核苷酸。在一个实施方式中,二级探针包含启动所述hcr的hcr引发剂。在另一个实施方式中,所述hcr扩增器包含两种或更多种亚稳态hcr单体。
根据另一方面,本公开内容提供了用于破坏杂交链反应(hcr)扩增产物的产生的方法,包括(a)提供包含与二级探针偶联的一级探针的样品,其中所述一级探针包含与靶分析物的序列互补的序列,并且其中所述一级探针在足以促进杂交链反应(hcr)以产生扩增产物的条件下与所述靶分析物杂交;和(b)使所述样品与切割剂接触以使所述一级探针与所述二级分离,而不将所述一级探针与所述靶分析物分离,从而防止所述hcr并破坏所述扩增产物的产生。
本发明的某些实施方式的其他特征和优势将在权利要求中以及以下附图和实施方式的说明下更为显而易见。
附图说明
本专利或申请文件包含至少一幅有色附图。本专利或专利申请公开与彩色附图的副本将根据要求,在支付所需的费用之后由政府机关提供。结合附图,通过以下示例性实施方式的详述能够更清楚地理解本发明的上述和其他特征和其他优点,其中:
图1a-1c描述了通过杂交链反应(hcr)的原位扩增。图1a描述了hcr机制。亚稳态荧光发夹在检测到同源引发剂后自组装成荧光扩增聚合物。包含单链区段“b*-a*”的引发剂i1,通过与h1的单链粘性末端“a”的碱基配对与发夹h1成核,介导分支迁移,其打开发夹h1形成含有单链区段“c*-b*”的复合物i1·h1。该复合物通过与单链粘性末端“c”碱基配对与发夹h2成核,介导分支迁移,其打开发夹形成含有单链区段“b*-a*”的复合物i1·h1·h2。因此,引发序列被再生,为交替的h1和h2聚合步骤的链反应提供基础。红色星星表示荧光团。图1b描述了原位杂交方案。检测阶段:dna探针集,每个探针含有引发剂11和i2,以及与mrna靶互补的区域,与mrna靶标杂交;从样品中洗去未结合的探针。扩增阶段:引发剂触发系连的荧光扩增聚合物的自组装;从样品中洗去未聚合的发夹。图1c描绘了实验时间线。使用相同的两阶段方案,与靶mrna的数量无关。对于多重实验(描绘的三色实例),针对不同靶mrna的探针集(每集描绘的五个探针)携带正交引发剂,其触发由光谱上不同的荧光团标记的正交hcr扩增级联。
图2a-2b描绘了循环hcr技术的信息传送步骤a-d的示意图。原始信息是被检测的分析物的性质,例如询问的分子种类,分子质量或分子构型。在步骤a中,分析物被探针靶向,探针特异性地结合靶分析物,使得分析物的原始信息由结合探针的存在表示。在步骤b中,由探针承载的分析物信息或其某些部分通过接头转移至hcr引发剂。hcr引发剂与探针相关联,该探针与分析物相关联。接头将探针连接到引发剂。在步骤c中,通过引发一种或多种亚稳态hcr单体(例如发夹)的杂交链反应,将传递给hcr引发剂的存在和定位的分析物信息或其一部分转化为dna聚合物,称为hcr聚合物。将亚稳态hcr单体加入到样品中,并且引发剂最初与亚稳态hcr单体结合,然后一个或多个剩余hcr单体的链反应导致形成hcr聚合物。在步骤d中,将传递给hcr聚合物的存在和定位的分析物信息或其一部分转换成放大的荧光信号,其可以使用光子检测器(例如配备有数码相机的显微镜)测量。hcr聚合物与一个或多个或多种可检测部分相关联。这些步骤a-d描述了使用hcr的分析物检测实验,例如图1中描绘的hcr扩增的mrna荧光原位杂交实验中的一般方法和信息传递链。通过方法和材料特异性启用循环hcr,以实现每个信息传输步骤的可编程性。“可编程性”是指使信息传递的每个步骤能够被门控,即根据预定的,不连续的时间表执行的材料和方法,其中信息传递取决于多次输入;或者,每个步骤都能够被特定地反转,即,在被检测到之后,传递给过程中的后续步骤的信息被选择性地破坏或去除或变得不可检测;或者每个步骤都可以是门控的和可逆的。可检测的部分可以从hcr聚合物中除去或已经从中除去,hcr聚合物可以从引发剂中除去或已经从中除去,引发剂可以从探针中除去或已经从中除去,并且探针可以从分析物中除去或已经从中除去。这与图1中的hcr反应形成对比,其中信息传递是连续的和不可逆的,例如,探针(与mrna序列互补的序列区域,其结合mrna)与hcr引发剂不可逆地连接,并在引入互补hcr发夹后开始产生hcr聚合物。例如,步骤c的可编程性旨在表明引发剂和hcr发夹之间的反应以某种方式被门控,例如通过需要除必需的hcr发夹之外的另一输入信号,以使反应进行,并且可以反转hcr聚合物的形成,例如通过聚合物的靶向降解。信息传输步骤之间的可编程性由图2b中的连接线表示,每个端部带有箭头。
图3描绘了在使用循环hcr的分析物检测实验中分析物的原始信息的信息和物理表示的示意图。原始信息是被检测的分析物的性质,例如询问分子种类,分子质量或分子构型。原始信息与信息标记物(称为“标记物”)唯一关联。标记物在这里表示为二进制字符串,但用于表示承载原始信息的任何符号表示,例如对应于分析物的字母数字值或其原始信息,例如,基因名称或其参考。信息标记物由信息消息唯一地表示,该信息消息通过包括检测到的消息的时空组织的荧光信号承载。信息标记物和消息可以是相同的,或者消息可以包含除了参考标记物所严格必需的信息之外的附加信息,如在用于错误检测或纠错的附加信息中那样。在这个例子中,“消息”被构造为标记物的位串,后面是标记物的反转位串。在检测到该消息时,标记物的每个位将被检测两次,允许检测到某些错误(例如,如果标记物的第一位在消息的第一位被检测为“0”,则在消息的最后一位被检测为“1”,很明显在传输或检测消息期间发生了错误,如在探测,hcr,成像或图像处理期间)。该消息被转换成时间有序的荧光hcr信号的独特集,这是检测到的消息。hcr信号的时间顺序由循环hcr方法和材料的可编程性实现,设计为一组实验方案和材料,例如,一级(步骤a)探针,步骤b探针,步骤c探针,和/或步骤d探针,显微镜,其他试剂等,并通过实验实施。
图4描绘了编程探针在两轮循环hcr上与靶分子结合以连续检测两种靶分析物的示意图。在时间=0时,样品中存在两种靶分子。在时间=1时,一级(步骤a)探针,例如抗体,适体或dna/rnaish探针,称为“探针α”,表示为橙色三角形被添加到样品中并结合到靶1,该探针通过某个接头(该接头表示为短红线,例如化学键或分子相互作用,但被理解为循环hcr的步骤b所述的任何种类的可编程或不可编程的接头)与hcr引发剂“i1”同源。在时间=2时,将hcr发夹引入样品,与引发剂接触,随后产生扩增的荧光hcr信号。在时间=3时,已从样品中剥离探针α,并且还使用循环hcr的步骤c中描述的任何方法除去hcr聚合物。在时间=4时,通过某种接头(例如化学键或分子相互作用,但被理解为如循环hcr的步骤b所述的任何类型的可编程或非可编程接头)与同一hcr引发剂“i1”同源的新探针“探针β”已加入样品并结合靶2;在时间=5时,将hcr发夹添加到样品中,与引发剂接触,随后产生扩增的荧光hcr信号。在时间=6时,已从样品中剥离探针β,并且还使用循环hcr的步骤c中描述的任何方法除去hcr聚合物。在该实施例中,在两个hcr循环中重复使用相同的hcr荧光信号放大发夹和引发剂以检测两个串联的靶分子。hcr的第一循环在时间=1到3表示,而hcr的第二循环在时间=4到6表示。其中hcr荧光的检测表示为二进制1,并且缺乏hcr荧光表示为二进制0,对应于靶1的检测到的消息是“10”,而对应于靶2的检测到的消息是“01”。因此,尽管这两种分子的检测利用相同的hcr荧光信号放大发夹和引发剂,但构成检测到的信息的有序荧光信号集对于每种靶分子是唯一的。
图5a-c描绘了通过循环hcr方法的步骤a编程一级探针结合的特定机制的示意图。图5a描绘了步骤1中与靶核酸或核酸类似物适体结合的靶分析物,称为“探针α”,与hcr引发剂同源,随后通过扩增的荧光hcr信号检测,通过接头,例如化学键或分子相互作用,但被理解为由循环hcr的步骤b描述的任何种类的可编程或不可编程的接头,称为“接头α”。在该示意图中,接头表示通过循环hcr的步骤b-d的所有下游信息传输。在步骤2中,适体和靶分子之间的结合被破坏,如通过用变性剂例如甲酰胺处理,其使诸如适体和靶分子之间的氢键和疏水相互作用的相互作用不稳定。然后从样品中洗去探针α。在步骤3,将相同的一级探针,适体探针α重新引入样品,再次结合靶分子,但同源于不同的接头“接头β”,其代表循环hcr反应的下游步骤b-d。例如,接头β与接头α的不同之处可能在于接头β,而不是接头α与光谱上不同的hcr荧光信号相关联。图5b描绘了步骤1中被作为一级探针“探针α”抗体结合的靶分析物,其与hcr引发剂同源并随后通过扩增的荧光hcr信号通过称为“接头α”的接头(例如化学键或分子相互作用)检测。在步骤2中,如在5a步骤2中那样破坏抗体和靶分子之间的结合。在步骤3中,引入不同的抗体“探针β”以结合相同的靶分析物,与hcr引发剂同源并随后通过扩增荧光hcr信号,通过称为“接头β”的接头,例如化学键或分子相互作用检测,其与如5a中所示步骤1中的“接头α”不同。图5c描绘了与图5a中步骤a相同的可逆性,除了rna或dna靶分子,其被称为“探针α”的核酸或核酸类似物ish探针结合。在该实施例中,循环hcr步骤a的反转在图5c的步骤2中介导,如通过掺入探针α中的光不稳定基团的活化,其破坏通过uv光诱导的核酸退火;或通过用dna酶处理以消化与靶rna分子结合的dnaish探针α。
图6描绘了编程一级探针和hcr引发序列“i1”之间的功能连接的示意图,用于通过两个连续轮次的循环hcr连续检测两种靶分析物,利用步骤b的两种方法,即通过步骤b探针编程hcr引发剂与一级探针的物理关联,并对门控hcr引发剂的状态进行编程。在时间=0时,存在两种靶分析物并且已经被一级探针结合,所述一级探针还含有接头基序但不含功能性hcr引发序列。靶1已被“探针α”结合,其也含有称为“接头α”的结合部分。靶2已被“探针β”结合,其附着于门控无活性hcr引发剂“i1*”,称为“接头β”。在时间=1时,包含接头α结合部分的互补结合部分的步骤b探针,例如互补核酸序列,与接头α结合,并且还含有hcr引发序列“i1”;在时间=2时,添加hcr发夹,其产生检测到的扩增的荧光hcr信号。在时间=3时,已使用本文步骤c中描述的方法和材料去除来自时间=1的hcr荧光信号,并且已通过本文所述的方法从一级探针α除去或分离步骤b探针,并从样品洗去。在时间=4时,一级探针β的接头β中包含的门控的hcr引发序列被激活,例如通过使用输入信号。在时间=5时,添加hcr发夹,其产生检测到的扩增的荧光hcr信号。在时间=6时,已使用本文步骤c中描述的方法和材料除去来自时间=1的hcr荧光信号,并且存在于接头β中的hcr引发剂已经失活。以这种方式,对应于引发序列“i1”的hcr系统已经串联使用以检测两种靶分析物。hcr的第一循环在时间=1到3表示,而hcr的第二循环在时间=4到6表示。
图7a-c描绘了编程循环hcr的步骤b的方法的示意图。在图7a中,分析物已经被“探针α”结合,其包含与hcr引发序列“i1”的连接。这些之间的连接可以是共价的,如将hcr引发序列寡核苷酸直接偶联到抗体探针α上以检测蛋白质靶分析物。然而,连接不是功能性的,因为引发序列不能引发hcr聚合反应,因为它受到保护寡聚物的保护,其以紫色显示,其还含有另外的序列“a”。在步骤1,将称为步骤b探针的去保护寡聚物引入样品中,并通过粘性末端链置换除去保护链。从样品中洗去置换的保护链。随后,添加hcr发夹,其产生检测到的扩增的荧光hcr信号。在步骤2中,再次使引发剂“i1”通过用互补的保护链“i1”封端而不能引发hcr聚合反应。在图7b中,靶分析物被一级步骤a探针“β”结合,其不含有hcr引发序列,而是包含额外的结合部分“b”,例如dna寡核苷酸序列,称为“接头β”。在步骤1,将称为步骤b探针“b′-i1”的寡核苷酸探针添加到样品中并与接头β杂交,引入hcr引发序列“i1”。随后,添加hcr发夹,其产生检测到的扩增的荧光hcr信号。在步骤2,切割基序“b”互补的步骤b探针“b′-i1”的区域与含有引发序列“i1”的区域之间的连接,例如通过硝酸银切割寡核苷酸“b′-i1”的主链中的桥接硫代磷酸酯键,其中可切割基团由“b′-i1”的小黄色圆圈表示,使一级步骤a探针返回到不能引发hcr聚合反应的状态。图7c描绘了与7b中相同的步骤b反应,除了在7c中,在一级探针和hcr引发剂之间产生功能性连接的机制是通过连接反应测序以偶联含有与接头基序a互补的序列的寡核苷酸“a2,”和一级探针上包含hcr引发序列“i1”的单独序列。通过连接反应的测序由寡核苷酸“a1’”引发。在步骤2中,再次使引发剂“i1”通过用互补的保护链“i1”封端而不能引发hcr聚合反应。
图8描绘了使用步骤a和b的循环hcr实施。在时间=0时,样品中存在两种靶分析物。在hcr的第一循环中,如在时间1到3期间所描绘的,检测第一分析物。在时间=1时,靶标1与一级探针“α”结合,其通过理解为使用如本文步骤b可编程性中所述方法的共价连接或可编程连接的“接头α”功能性地连接至hcr引发序列“i1”。在时间=2时,将与hcr引发剂“i1”同源的hcr发夹添加到样品中,并接触引发剂“i1”;形成hcr聚合物并检测扩增的荧光信号。在时间=3时,对于靶1反转步骤b,例如通过从接头切割引发剂“i1”。此时,步骤c和d也被理解为已经反转,使得在时间=2时检测到的荧光信号不再存在。在时间=4时,通过引入一级探针“β”将步骤a重复到下一个循环,其结合靶分析物2,并且通过理解为使用如本文在步骤b可编程性中描述的方法的共价连接或可编程连接的“接头α”功能性地连接到hcr引发序列“i1”。在时间=5时,将与hcr引发剂“i1”同源的hcr发夹添加到样品中,并接触引发剂“i1”;形成hcr聚合物并检测扩增的荧光信号。在时间=6时,对于靶2反转步骤b,如通过将hcr引发剂门控到无效状态“i1*”。以这种方式,步骤a和b以协调的方式循环以检测两种靶分析物。
图9描绘了编程步骤c的示意图,即hcr聚合反应。在时间=0时,存在两种靶分子。靶1已与一级探针“α”结合,其通过“接头α”功能性地连接到hcr引发序列“i1”。靶2已与一级探针“β”结合,理解其通过接头功能性地连接到hcr引发序列“i2”。接头可以是使用如本文步骤b可编程性描述的方法的共价连接或可编程连接。在时间=1时,将与引发剂“i1”同源的hcr发夹加入到样品中,并且“i1”与同源hcr发夹接触,形成hcr聚合物,由红色星代表,表示红色荧光信号,其被检测到。随后在时间=2时降解或拆解hcr聚合物,从而使样品返回到没有hcr聚合物的先前状态。在时间=3时,将与引发剂“i2”同源的hcr发夹加入到样品中,并且“i2”与同源hcr发夹接触,形成hcr聚合物,由红色星代表,表示相同红色荧光信号,其被检测到。随后在时间=4时降解或拆解hcr聚合物,从而使样品返回到没有hcr聚合物的先前状态。hcr的第一循环在时间=1到2表示,而hcr的第二循环在时间=3到4表示。
图10a-c描绘了编程循环hcr的步骤c的方法和材料的示意图。图9a描绘了被一级探针“α”结合的靶分析物,其通过表示为“l”但理解为如循环hcr的步骤b中所述的任何种类的可编程或非可编程接头的接头与引发序列“i1”功能性连接。在步骤1中,将可切割的荧光hcr发夹添加到样品中。蓝色星代表荧光部分;而蓝色方块代表可切割部分,例如hcr发夹的主链中的5′或3′桥接硫代磷酸酯键。发夹接触引发序列“i1”并在靶分析物处形成扩增的荧光hcr聚合物,其被检测。在步骤2中,向样品中加入催化裂解可切割部分的试剂,例如用于桥连硫代磷酸酯键的硝酸银,这使得hcr发夹在由蓝色方块表示的修饰主链的位点处被切割。由此将hcr聚合物片段化,并从样品中洗去片段。在该描述中,与序列“i1”互补的片段与引发序列结合,有效地加帽引发剂,其代表循环hcr步骤b和c的协同反转。图10b描绘了被一级探针“α”结合的靶分析物,其通过表示为“l”但理解为如循环hcr的步骤b中所述的任何种类的可编程或非可编程接头的接头与引发序列“i1”功能性连接。在步骤1中,将可切割的荧光hcr发夹添加到样品中。蓝色星代表荧光部分,并且hcr发夹包含额外的序列基序柄,表示为发夹的紫色区段。发夹接触引发序列“i1”并在靶分析物处形成扩增的荧光hcr聚合物,其被检测。hcr聚合物还含有单链序列的额外的柄基序。在步骤2中,将粘性末端置换链(在本文中统称为步骤c探针)添加到样品中,其与hcr聚合物的额外的柄序列结合并诱导粘性末端链置换反应,这导致hcr聚合物被拆解成双链片段,其从样品中洗去。图10c描绘了被一级探针“α”结合的靶分析物,其通过表示为“l”的接头与引发序列“i1”功能性连接,“l”理解为如循环hcr的步骤b中所述的任何种类的可编程或非可编程接头。在步骤1中,将可切割的荧光hcr发夹添加到样品中。蓝色星形代表荧光部分,并且hcr发夹包含由红色三角形表示的另外的修饰,其被外切核酸酶识别,例如被终止子外切核酸酶识别的5′单磷酸。发夹接触引发序列“i1”并在靶分析物处形成扩增的荧光hcr聚合物,其被检测。在步骤2,将靶向修饰的发夹的外切核酸酶添加到样品中,其识别修饰的hcr聚合物并将集成的寡核苷酸消化成单个核苷酸,其从样品中洗去。在图10a-c的每一个中,样品处于不存在hcr聚合物或相关荧光信号的状态。
图11进一步描绘了可逆hcr聚合实施例的图。左)hcr聚合物通过user酶反应酶促降解,其中组成单体链带有du核碱基,该反应将udg和endoviii酶组合以在du位点切开dsdna。右)通过引入带有完整互补序列的新dna链,拆解带有额外3′或5′粘性末端置换结构域序列的hcr聚合物。洗去dsdna单体。
图12描绘了编程步骤d的示意图,荧光部分与hcr聚合物相关联。在时间=0时,两个靶分析物1和2分别被一级步骤a探针“α”和“β”结合,分别通过表示为“l”但理解为如循环hcr的步骤b中描述的任何类型的可编程或不可编程的接头的接头与引发序列“i1”和“i2”功能性连接。对应于由引发剂“i1”和“i2”启动的正交hcr系统的hcr发夹已被添加到样品中,并且已经接触了分别与一级探针α和β连接的引发序列“i1”和“i2”,并在靶分析物上形成hcr聚合物。在时间=1时,由与探针α连接的引发剂“i1”产生的hcr聚合物已与荧光部分偶联并检测荧光,从而检测靶分析物1。在时间=2时,从hcr聚合物中除去荧光部分。在时间=3时,由与探针β连接的引发剂“i2”产生的hcr聚合物已与荧光部分偶联并检测荧光,从而检测靶分析物2。在时间=4时,从hcr聚合物中除去荧光部分。在该实施例中,连续重复使用仅单个荧光部分以标记两种靶分析物。hcr的第一循环在时间=1到2表示,而hcr的第二循环在时间=3到4表示。
图13描绘了编程循环hcr的步骤d的示意图。分析物被一级步骤a探针结合,其通过表示为“l”的接头与引发序列“i1”功能性连接,“l“理解为如循环hcr的步骤b中所述的任何种类的可编程或非可编程接头。含有额外柄序列的hcr发夹已被添加到样品中,并接触引发序列“i1”并在靶分析物处形成hcr聚合物。hcr聚合物还包含额外的柄。在步骤1中,将与hcr发夹的柄互补的荧光步骤d探针添加到样品中并与hcr聚合物的柄序列杂交,将扩增的荧光信号与聚合物相关联并通过延伸与靶分析物相关联,其被检测。在步骤2中,荧光步骤d探针从hcr聚合物中剥离或以步骤d方法和材料中所述的方式特异性降解,使得hcr聚合物不再被荧光标记。
图14a-b描绘了使用步骤d方法和材料对hcr聚合物进行循环荧光标记的图。图14a描绘了由蓝色圆圈表示的靶分析物,其由多个一级探针标记,由橙色三角形表示,功能性连接至hcr启动子,其已经产生hcr扩增子,以编程方式荧光标记,例如通过杂交测序(例如杂交荧光探针至包含在hcr扩增子中的特定序列),或通过合成或连接测序。这里,信号在两个周期之间是相加的,例如,仅使用荧光与聚合物相关联,而不是荧光与聚合物的解离的可编程性。图14b描绘了步骤d探针与hcr聚合物偶联,例如通过杂交测序或通过连接反应测序,携带荧光团。成像后,荧光部分从hcr扩增子化学切割,如通过dna链中的桥连硫原子硫代磷酸酯键的银切割,在hcr聚合物上留下双链突出端,但将样品重置为黑暗状态。
图15a-d描绘了在指数标记空间中构成条形码的多个hcr循环上检测组合信号作为检测到的消息的实施方式的示意图。在图15a中,两个靶标各自用表示为橙色三角形的四个独立一级探针标记,每个在循环hcr实验期间产生时间有序的荧光信号。每个时间有序的荧光信号被称为“标记物”,具有n个总标记物。每个独特标记物对应于循环hcr反应中荧光光谱信号和时间点的独特组合。例如,第一轮循环hcr中的cy3信号可以被理解为“标记物a”,而第二轮循环hcr中的cy3信号可以被理解为“标记物f”。请注意,两个靶分析物共享“标记物a”,但在所有有序荧光信号的集中,每个靶分析物都有独特的有序标记物集,[a,d,h,m]用于靶1,[a,f,g,n]用于靶2,例如,该实施例中的一级探针可以是针对每个mrna靶1和2的四种ish探针。进行循环hcr,并检测有序荧光信号。在全部hcr循环和检测事件之后,为每个靶分析物生成组合标记物,并且组合标记物被映射到某些原始信息,例如靶分析物的分子种类。在图15b中,每个靶1和2与显示为橙色三角形的单个一级探针结合,其包含许多独立标记物,其中每个独特标记物被理解为循环hcr反应内荧光光谱信号和时间点的独特组合。在该实施例中,一级探针可以是与蛋白质靶标1和2结合的抗体;标记物可以理解为不同的dna接头基序,其在循环hcr实验中被步骤b探针串联或并联杂交。进行循环hcr,并检测有序荧光信号。在全部hcr循环和检测事件之后,为每个靶分析物生成组合标记物,并且组合标记物被映射到一些原始信息,例如靶分析物的分子种类。图15c描绘了将来自图15a的标记物映射到时间有序的,光谱上不同的hcr信号集的查找表。左列包含标记物索引。“hcr循环”列是指循环hcr反应中的循环数或检测时间点。在该示例中,在ceil(n/k)循环中由k个正交和光谱上不同的hcr系统检测n个标记物。“hcr索引”列指的是在hcr的每个循环期间k个正交和光谱上不同的hcr系统中的哪个/哪些对应于每个标记物。图15d描绘了查找表,其检测到的消息(该消息被理解为由图15a中描绘的构成条形码的靶产生的hcr信号的有序集合)映射到被检测的分析物的种类。条形码由三元值构成,即集[1,2,3],它们分别对应于图15c中的hcr索引。在该实施例中,hcr指数可以指三个正交hcr系统,每个系统用光谱上不同的荧光部分标记。条形码中的值的顺序对应于图15c中的hcr循环的顺序。
图16描绘了对图15a,15c和15d中描绘的样品进行的hcr实验的循环图。在循环hcr实验中的每轮hcr中,一级探针(描绘为橙色三角形)与称为“标记物x”的接头偶联,其独特地指以下组合:hcr循环数和hcr系统或光谱不同荧光信号。通过引入步骤b探针对步骤b进行编程,所述步骤b探针通过dna杂交将一级探针与hcr引发序列(集合“i1”,“i2”或“i3”之一)功能性连接。在该实施例中,在每个hcr循环中,三个步骤b探针的集与一级探针接头杂交,添加引发序列。加入对应于3个正交hcr系统的hcr发夹并与引发剂接触,形成hcr发夹并检测扩增的荧光信号。在该实例中,三个hcr系统中的每一个可以被理解为具有光谱上不同的荧光信号。在随后的hcr轮次之间,反转步骤b,使得从样品中除去前一循环的引发剂。对于每个后续循环,添加新的步骤b探针以将一不同集的一级探针功能性地连接到三个hcr引发剂之一。在hcr的每个循环中重复使用三个正交hcr系统。来自每个循环的信号被组合成条形码,使用表5d将其映射到靶分析物。
图17a-b描绘了使用循环hcr对核酸靶分子进行指数条码化的实例的图。以绿色显示的rna或dna分子被靶向并被分配由24个有序位(224)组成的独特信息标记物。信息标记物被转换成由12个有序四元数值组成的唯一条形码,即从集[0,1,2,3]中选择的12个有序整数。条形码被分成3个四个值的“块”,“b1-b4”,“b5-b8”和“b9-b12”。每个单独的四元数值,即[0,1,2,3]对应于包括引发序列和发夹的独特的,正交的,光谱可分辨的hcr系统。在四元条形码串中的每个位置,即“b1”到“b12”,将四个唯一序列分配给每个可能的四元值,即[0,1,2,3],总共48个称为“接头”的唯一序列。设计接头序列在某些反应条件下与杂交正交,使得与48中的一个互补的探针将与其结合伴侣特异性杂交,并且不与其他47个接头基序中的任一个非特异性结合。对于靶rna或dna,设计了多个数量上等于3k的一级探针,其含有与靶rna或dna序列互补的序列(以蓝色显示)。每个一级探针被分配三个条形码块中的一个,使得在整个一级探针集合中,每个标记物存在k次。在图17a中,每个一级探针在寡核苷酸的3′和5′末端用额外的序列修饰,以包含分配该四个分配给每个探针的块中每个条形码位置的四元值的四个序列,针对分配给靶分子的条形码。靶rna或dna分子与多个一级探针杂交。在图17b中,在循环hcr的每个循环期间,将四个步骤b探针集合添加到样品中,对应于条形码的各位置的每个位置“bx”处的四元值[0,1,2,3]。对应于四元值的四个步骤b探针各自包含称为引发剂iq的用作四个正交的,光谱可分辨的hcr系统之一的hcr引发剂的额外序列。在图17b中,包含序列“bn”的四个步骤b探针集被退火并且过量被洗掉。每个步骤b探针包含对应于四元值q=[0,1,2,3]的四个“bn”序列之一;因此,步骤b探针可以唯一地称为“bn,q”,其中n指的是hcr的循环和在该循环中检测到的条形码位置,q指的是四元值[0,1,2,3]。在图17b的步骤1中,将hcr发夹添加到样品中,与引发剂接触,并且在引发剂iq处产生hcr聚合物q,产生检测到的放大的荧光信号。在17b的步骤2中,已经使用用于编程循环hcr步骤c的方法和材料降解hcr扩增子,并且还已经使用用于编程步骤b的方法和材料从样品中去除接头步骤b探针。循环hcr的步骤b和c使用该方法循环总共12次,以检测12数值条形码的每个位置,每个值对应于四个光谱上不同的扩增hcr荧光信号之一。仅使用四个正交的,独立的,光谱上不同的hcr系统来使用n=12个循环hcr循环产生超过1600万个独特条形码,每个循环通过4n个正交接头结构域读出四个可能的四元数值(条形码空间412)。
图18a-d描绘了指数条码化探针设计的示例的图。探针集的一种设计,其中每个探针包含针对靶rna或dna分子(以绿色显示)的靶向杂交区域(以蓝色显示),以及含有关于hcr(n)和hcr探针集(k)循环的组合成对信息的带信息标记序列。这里,一级探针针对靶核酸的靶向杂交的区域长25-42个碱基,并且一级探针的标记序列部分长25个碱基。所有探针集均设计用于5个循环的hcr,使用4个正交hcr探针集,每个探针集编码靶条形码中的四元信号值,并使用该集[fam,cy3,德克萨斯红,和cy5]的光谱可分辨荧光信号进行检测,需要20个带正交信息的探针集并给出1024种可能条形码(45)。图18a描绘了一级探针的设计和程序的顺序,包括杂交一级探针集然后进行循环hcr的步骤。图18b包含表格,该表格包括标记序列,集0-19,循环,正交hcr系统和荧光信号的部分图谱,作为实验设计的一部分。图18c描绘了hcr的第一循环,其中四个步骤b探针与样品杂交,其中的一个退火至每个靶分子上的一级探针。洗去过量的步骤b探针,并将hcr发夹加入样品中,在那里它们与引发剂接触并聚合成荧光标记的hcr聚合物。检测荧光信号并将其理解为条形码第一位置中的四元值之一。在该组图中,靶分子在条形码的第一个位置具有值2,对应于具有cy3荧光信号的hcr系统编号2。在检测到信号后,使用如循环hcr步骤c所述的方法从样品中除去hcr聚合物,并且还反转步骤b,使得一级探针不再含有或连接到功能性hcr引发剂。图18d描绘了hcr的第二循环,其中四个步骤b探针与样品杂交,其中的一个退火至每个靶分子上的一级探针。洗去过量的步骤b探针,并将hcr发夹加入样品中,在那里它们与引发剂接触并聚合成荧光标记的hcr聚合物。检测荧光信号并将其理解为条形码第一位置中的四元值之一。在该组图中,靶分子在条形码的第一个位置具有值1,对应于具有fam荧光信号的hcr系统编号1。在检测到信号后,使用如循环hcr步骤c所述的方法从样品中除去hcr聚合物,并且还反转步骤b,使得一级探针不再含有或连接到功能性hcr引发剂。在未示出的三个额外的hcr循环之后,使用在循环hcr期间产生的五个扩增的荧光信号的独特组合,并构成独特的组合条形码来鉴定每个靶分子。
图19描绘了使用步骤a-d检测靶核酸分子的循环hcr实验的示意图。步骤1涉及将一级ish探针集引入和结合至靶分析物。步骤2涉及在hcr引发剂和一级探针之间建立功能性连接,如通过引入和结合含有与一级探针和hcr引发剂互补的序列的循环hcr步骤b探针。在该图中,循环hcr步骤b探针包含可切割基团,由绿色圆圈表示。步骤3涉及引入hcr发夹,其与引发剂接触并聚合成称为hcr聚合物的系连的核酸聚合物。在该图中,用由绿色圆圈表示的可切割基团修饰hcr发夹。步骤4涉及hcr聚合物的荧光标记,荧光部分在聚合物上表示为橙色点。步骤5涉及通过反转hcr聚合物的荧光标记来编程循环hcr步骤d。步骤6涉及通过切割hcr聚合物来编程循环hcr步骤b和c,如通过引入与可切割部分反应的化学试剂,其也从一级探针切割hcr引发剂。步骤7涉及从样品中洗去hcr聚合物片段。步骤8涉及通过从靶分析物中剥离一级探针来编程循环hcr步骤a,如通过使用dna酶消化dnaish探针,其不消化rna靶标。步骤9涉及通过引入新的循环hcr步骤b探针集作为产生新hcr聚合物的前体来编程循环hcr步骤b。
图20描绘了使用体外转录或聚合酶延伸合成多重hcr发夹,然后进行λ外切核酸酶消化以产生单链dna发夹的方法的示意图。
图21描绘了hcr标记策略i。通过化学合成或化学合成然后dna聚合酶链延伸产生dsdna模板。dsdna模板包含hcr发夹的序列,以及任何其他序列,例如用于荧光探针杂交或粘性末端链置换的柄。dsdna模板含有rna聚合酶启动子,例如t7rna聚合酶启动子序列。还可以通过聚丙烯酰胺凝胶电泳(page)纯化dsdna模板。dsdna模板用于通过体外转录(ivt)产生rna分子。可以从dsdna模板中纯化rna。rna分子用作逆转录(rt)的模板以产生互补的ssdna分子。rna被降解和/或ssdna被纯化并折叠成亚稳态发夹。hcr发夹以多种方式被荧光标记,例如通过末端脱氧转移酶反应以添加一个或多个末端荧光修饰的dna碱基。rt引物含有一个或多个荧光团,其掺入所得的ssdna分子中。在逆转录期间将荧光dna碱基掺入ssdna分子中。或者,在逆转录期间向hcr分子添加额外的序列,其用作通过杂交测序(sbh),合成测序(sbs)或连接测序(sbl)荧光标记的位点。
图22描绘了hcr标记策略ii。通过dna聚合酶延伸随后λ核酸外切酶消化dna链之一产生ssdna发夹,留下ssdna分子,其可以通过page纯化并折叠成hcr发夹。hcr发夹以多种方式被荧光标记,例如通过末端脱氧转移酶反应以添加一个或多个末端荧光修饰的dna碱基。保护免受核酸外切酶消化的dna链可含有一个或多个荧光团。在聚合酶延伸期间将荧光dna碱基掺入ssdna分子中。或者,在逆转录期间向hcr分子添加额外的序列,其用作通过杂交测序(sbh),合成测序(sbs)或连接测序(sbl)荧光标记的位点。
图23描绘了来自三个循环hcr循环的循环hcr实验数据的示意图。纵轴表示时间轴,其跨越对应于三个hcr循环的三个时间点。每个框描绘了单个细胞的四色图像。四种颜色对应于来自四个光谱可分辨的荧光部分的信号,所述荧光部分与四个正交hcr系统同源,在循环hcr的每个时间点使用。标记为“靶1”的框描绘了特定靶分析物的复合标记,由在每个时间点将“靶1”框连接到荧光hcr信号的箭头指示。在该描述中,靶分析物1由唯一的时间有序复合标记或条形码[0,3,2]识别。“hcr信号”框描绘了对应于四个正交hcr系统的四个光谱可分辨荧光信号,以及与每个信号相关联的四元数值。在细胞内同时检测到大量靶分析物。在hcr的每个循环内,荧光信号是简并的,或者不是唯一识别的,但是在整个hcr循环中,组合的时间有序复合信号是每个靶分析物的唯一识别标记物。随着时间的推移跟踪每个靶分析物,允许来自每个循环的信号组合成复合标记物。每种靶分析物被鉴定为特定的分子种类,分子质量或分子构型。通过这种方式,可以测量每种靶分析物的空间定位和空间分布,以及每种靶分析物的丰度。
图24描绘了使用修饰的合成hcr试剂,特别是用于编程循环hcr的步骤c的可切割hcr单体的体外证明。该1%琼脂糖dna电泳凝胶在泳道1中显示尺寸梯标,其尺寸条带对应于箭头所示的25bp,0.5kb和2.65kb。泳道2显示没有引发剂并且没有切割的单体表明亚稳态单体的最小扩增泄漏。泳道3显示,在存在切割试剂的情况下(其在这些发夹的情况下是硝酸银),切割桥接硫代磷酸酯键,发夹和单体降解并且没有明显的条带。泳道4显示,在存在引发剂和单体但没有切割试剂的情况下,单体扩增成较大的聚合物,可看到较高的分子量,涂抹达数千碱基的尺寸。
图25a-c描绘了循环hcr技术的某些实施方式。图25a描绘了珠上的hcr荧光扩增。通过将珠与dna寡聚物在pbs缓冲液中杂交30分钟,然后使用磁铁洗涤数次以防止珠被上清液除去来将链霉抗生物素蛋白偶联的磁珠(dynabeads)与生物素修饰的dna寡核苷酸偶联。然后通过在2xssc中孵育10分钟,将一个称为“+步骤b探针”的珠集合与包含hcr引发剂的二级探针退火,所述二级探针与一级生物素化探针互补。“-步骤b探针”仅在ssc中孵育,不含二级寡聚物。将两个珠集在0.2xssc中洗涤5次,每次5分钟。然后将珠加入带正电荷的玻璃中。根据方案(分子设备公司(molecularinstruments))快速冷却cy3标记的hcr扩增器单体,并将各自30pmol加入到500ul体积的5xssc中至珠中,并在室温下孵育4小时。将两种珠在0.2xssc中洗涤5次,每次5分钟。珠在宽视野和cy3通道中成像,证明选择性扩增带步骤b探针的珠。以这种方式,从一级探针到hcr荧光信号检测的标记级联已经解耦。在图25b中,收获黑腹果蝇(drosophilamelanogaster)胚胎并根据标准方案透化,然后与标记物x试剂一起孵育以修饰具有丙烯酰胺部分的rna。然后将胚胎包埋在丙烯酰胺水凝胶基质中,将rna分子连接到水凝胶上。然后用蛋白酶对样品进行充分处理以澄清样品并减少自发荧光。使用表1中的序列,通过在含有ssc和挤出剂硫酸葡聚糖的杂交缓冲液中孵育过夜,将样品用于针对rnapoliimrna的原位杂交。胚胎然后将来自表2的具有标记物id0的步骤b探针与一级探针杂交。hcr导致在果蝇胚胎内产生扩增的荧光斑点。图25c描绘了来自大规模多重循环hcrish的两个hcr循环,其靶向原代人成纤维细胞中的500个mrna的集合。将人成纤维细胞在玻璃上培养,固定并透化。将靶向500个mrna集的dnaish探针集合加入到样品中,并在含有ssc和挤出剂硫酸葡聚糖的杂交缓冲液中杂交48小时。步骤b接头探针的某一子集与一级探针杂交,并且hcr用于产生两个非荧光,正交系连的hcr聚合物群,每个聚合物具有用于荧光步骤d探针杂交的额外柄。在循环1中,将某个步骤d探针与一个聚合物子集杂交并用于产生被检测的扩增荧光信号。然后用硝酸银处理样品以切割来自步骤d探针的荧光团。在循环2中,将另一个步骤d探针与另一个聚合物子集杂交,以使用与循环1中相同的荧光部分产生被检测的扩增的荧光信号。
具体实施方式
本公开提供了用于检测样品中一种或多种靶分析物的方法,包括以下步骤:(a)使样品与一个或多个探针集接触,其中每个探针集包含一种或多种各自具有接头的一级探针,和其中每个探针集对靶分析物具有特异性,其中一种或多种具有接头的一级探针结合靶分析物;(b)使样品与一种或多种与接头结合的杂交链反应(hcr)引发剂接触,(c)使样品与两种或更多种亚稳态hcr单体接触,其中一种或多种引发剂与两种或更多种亚稳态hcr单体接触和引发杂交链反应以产生自组装和系连的核酸扩增聚合物产物,和(d)将一种或多种可检测标记物附连至系连的核酸扩增产物,并任选地检测一种或多种可检测标记物。本发明提供了,探针可从靶分析物中除去,引发剂可从接头上除去,核酸扩增聚合物产物可从引发剂中除去,或者一种或多种可检测标记物可从核酸扩增聚合物产物中除去。本发明提供了,探针可从靶分析物中除去,引发剂可从接头上除去,核酸扩增聚合物产物可从引发剂中除去,并且一种或多种可检测标记物可从核酸扩增聚合物产物中除去。
本公开提供了用于检测样品中一种或多种靶分析物的方法,包括以下步骤:(a)使样品与一个或多个探针集接触,其中每个探针集包含一种或多种各自具有接头的一级探针,和其中每个探针集对靶分析物具有特异性,其中一种或多种具有接头的一级探针结合靶分析物;(b)使样品与一种或多种与接头结合的杂交链反应(hcr)引发剂接触,(c)使样品与两种或更多种包括可检测标记物的亚稳态hcr单体接触,其中一种或多种引发剂与两种或更多种亚稳态hcr单体接触和引发杂交链反应以产生自组装和系连的核酸扩增聚合物产物,和(d)任选地检测一种或多种可检测标记物。本公开提供了探针可从靶分析物中除去。本公开提供了引发剂可从接头除去。本公开提供了核酸扩增聚合物产物可从引发剂中除去。
本公开的方面涉及在连续hcr反应的多个循环中产生由n个正交,独立和光谱可分辨的hcr系统产生的荧光信号和靶分析物之间的可编程关联,以标记多于n个分析物,其中hcr技术组件之间的信息-传输联系是模块化的,即显示为单独的步骤或活动,如图2所示。在图2中,分析物中的信息被广泛地认为是指由需要测量的原子,分子,化合物或分子复合物的特定空间和/或时间排列承载或表示的信息,例如被询问的分子种类,分子质量或分子构型。在检测期间,该信息或其一部分通过标记和检测从靶分析物转移到人或计算机系统。在本文中,“转移”是指通过物理或电磁相互作用(例如通过分子接触或光子)传递的信息或其某些部分或其某些表示。
原始信息是被检测的分析物的性质,例如询问分子种类,分子质量或分子构型。通过探针接触的分析物转移信息,其特异性地结合靶分析物,使得分析物的原始信息由结合探针的存在表示。由探针承载的分析物信息或其某些部分通过接头转移至hcr引发剂。通过引发一种或多种亚稳态发夹的杂交链反应,将承载到hcr引发剂的存在和定位的分析物信息或其一部分转化为dna聚合物,称为hcr聚合物。将承载至hcr聚合物的存在和定位的分析物信息或其一部分转移成放大的荧光信号,其可以使用光子检测器(例如配备有数码相机的显微镜)测量。这些步骤描述了使用hcr的分析物检测实验中的信息链转移,如图1和2所示。在本公开的上下文中,“信息链转移”可以指各个方法的关联步骤,例如可逆地关联探针与靶分析物,例如可逆地关联引发剂链与探针相,例如可逆地关联引发剂链与亚稳态hcr单体以产生hcr聚合物并且例如可逆地关联hcr聚合物与一个或多个或多种可检测标记物或部分。该过程中的每个步骤可以是可逆的,以返回到先前步骤并最终返回到原始靶分析物。该过程中的每个步骤可以反转并重复或循环多次。
在使用循环hcr的分析物检测实验中,分析物的原始信息具有信息和物理表示,如图3所示。原始信息与信息标记物(称为“标记物”)唯一关联。标记物可表示为二进制字符串,但是用于表达原始信息的任何符号表示,例如对应于分析物的字母数字值或其原始信息,例如,基因名称或其参考。信息标记物由信息消息唯一地表示,该信息消息通过包括检测到的消息的时空集织的荧光信号表达。信息标记物和消息可以是相同的,或者消息可以包含除了参考标记物所严格必需的信息之外的附加信息,如在用于错误检测或纠错的附加信息中那样。例如,“消息”可被构造为标记物的位串,后面是标记物的反转位串。在检测到该消息时,标记物的每个位将被检测两次,允许检测到某些错误(例如,如果标记物的第一位在消息的第一位被检测为“0”,则在消息的最后一位被检测为“1”,很明显在传输或检测消息期间发生了错误,如在探测,hcr,成像或图像处理期间)。用于构造消息的其他方法包括用于错误检测和纠正的额外信息,包括重复码,奇偶校验位的使用,校验和的使用,reed-solomon码,golay码和汉明码。该消息被转换成一集唯一的时间有序的荧光hcr信号,这是检测到的消息。hcr信号的时间顺序由循环hcr方法和材料的可编程性实现,设计为一集实验方案和材料,例如,一级(步骤a)探针,步骤b探针,步骤c探针,和/或步骤d探针,显微镜,其他试剂等,并通过实验实施。
通过方法和材料特异性启用循环hcr,以实现每个信息传输步骤的可编程性。“可编程性“是指使信息传递的每个步骤能够被门控,即根据预定的,不连续的时间表执行的材料和方法,其中信息传递取决于多次输入;或者,每个步骤都能够被特定地反转,即,在被检测到之后,传递给过程中的后续步骤的信息被选择性地破坏或变得不可检测;或者每个步骤都可以是门控的和可逆的。
在这种情况下,使用本文所述的hcr方法询问分析物。在步骤a中,分析物被探针靶向,探针特异性地结合靶分析物,使得分析物的原始信息由结合探针的存在表示。在步骤b中,由探针承载的分析物信息或其某些部分通过接头转移至hcr引发剂。在步骤c中,通过引发一种或多种亚稳态hcr单体或发夹的杂交链反应,将承载至hcr引发剂的存在和定位的分析物信息或其一部分转化为dna聚合物,称为hcr聚合物。在步骤d中,将承载至hcr聚合物的存在和定位的分析物信息或其一部分转换成放大的荧光信号,其可以使用光子检测器(例如配备有数码相机的显微镜)测量。这种信息流,也称为标记级联,如图2所示。
在从a到b到c到d的流程图的每个步骤,或者对于这些步骤的任何子集,该过程循环所需的次数,如本文进一步描述的。因此,通过方法和材料实现循环hcr,以实现信息传送步骤的可编程性,以便循环它们多次。每个步骤可以循环,即重复多次。在循环hcr的优选实施方式中,一个或多个信息转移步骤a-d(即,一级探针附着于分析物,一级探针与hcr引发序列功能性连接,引发剂与发夹结构接触,杂交链反应发生,并且所得到的聚合物产生可检测的信号,其被检测,例如荧光信号)是可逆的,以允许这些步骤重复一次或多次。
在整个说明书中提及的“反向”,“反转”或“可逆”可以指已经接合或以其他方式连接的分子的去除或分离,或从样品中去除荧光部分,或以其他方式将样品返回到没有可检测部分或待检测的活化部分的状态。可检测部分可以使用本文所述的方法或本领域技术人员已知的方法除去。这允许每轮使用整个光谱上不同的信号空间。或者,信号可以是叠加性的,在这种情况下,每轮hcr将新信号添加到现有信号中。在这种情况下,可以计算减去现有信号以推断新信号。“反向”,“反转”或“可逆”可以指将样品返回到较早的状态,例如样品处于状态d并且被修改以将样品放置在步骤a,b或c中。
循环杂交链反应(chcr)可用于检测一种或多种分析物或靶分子,通过设计一个或多个或多种hcr反应,串联,或作为串联进行的并联反应集进行,用于多个靶分子的分子种类,分子质量或分子组成进行连续或组合标记,使得每个靶标在整个hcr反应中与独特的hcr信号或hcr信号集相关联。靶分子包括核酸聚合物,例如rna,dna及其类似物,氨基酸聚合物,包括蛋白质,上述任何化学修饰,脂质,代谢物,生物分子和其他小分子,以及包括以上任何的一种或多种的分子组合物。
循环hcr通过使来自hcr的每个循环的荧光信号组合成比任何单个荧光信号中包含的信息含量更高信息含量的复合标记物或条形码来实现多重分析物检测。在检测样品中存在的荧光信号时,通过数字显微镜获取信息。chcr实验的检测时间点可以通过循环chcr步骤a-d的任何组合来确定。例如,检测时间点的某些子集可以在循环步骤d期间发生,所述循环步骤d即通过一级探针和理解为如本文描述的非可编程或可编程chcr步骤b中任一个的接头将荧光信号与系连至靶分析物上的hcr聚合物相关联的循环,所述接头包含功能性hcr引发剂。同一实验中的另一个检测时间点子集可以在步骤b-d的循环期间发生,即通过功能性地将hcr引发剂连接到一级探针,产生系连的hcr聚合物,以及检测扩增的荧光信号。这些时间点子集可以是顺序的或交错的。检测时间点由chcr实验的设计确定。在任何情况下,每个不同的检测事件被理解为图像数据的获取。在检测事件之间,由hcr产生的荧光信号与靶分析物之间的关联以某种方式改变。荧光信号和靶分析物之间的关联可以是叠加的,在这种情况下,在每个循环中添加新荧光信号。或者,可以交换荧光信号和靶分析物之间的关联,从而消除先前的信号并建立新信号。
由时间有序信号构成的复合标记物可以在多重化或理论信息内容上变化。假设在hcr的每个循环中,使用n个光谱分辨的正交hcr系统来产生荧光信号。这n个光谱分辨信号可以是荧光部分,其发射光谱能够使用本领域技术人员已知的技术区分,例如通过使用带通滤波器来检测来自任何特定图像中的特定波长的光。或者,n个光谱分辨信号可包括荧光部分的“比色”组合。复合标记物或条形码用于通过组合来自循环hcr实验中超过一个检测事件的信息来标记靶分析物。
通过在循环hcr实验过程中检测每个靶分子超过一个荧光信号,可以实现指数或组合条码化。术语“组合”用于具体指代排列的数学概念,其涉及将集的所有成员排列成某种序列或顺序的行为,包括部分排列,其是从集中选择的k个不同元素的有序排列(当k等于集的大小时,这些是集的排列)。在循环hcr技术中,序列或顺序被理解为在循环hcr实验过程中荧光检测事件的时间排序,例如通过循环chcr步骤a-d中的一个或多个。该集的成员被理解为由chcr的任何单个时间点内的全部hcr系统产生的所有光谱可分辨的荧光信号的集。如果单个时间点内的每个不同的hcr信号由n个光谱上不同的染料之一产生,则信号是大小为n的该集的成员。如果使用所有单色和组合,则光谱可分辨的荧光信号集中有2n-1个成员(例如,如果我们有单色红色和蓝色,我们认为不同信号集包含红色,蓝色和红色和蓝色的组合信号的三种信号)。
术语“指数”用于具体指代条形码空间随循环数,即有序检测事件的数量指数增长的情况。例如,如果在每个时间点使用n个不同的信号的集,并且在循环hcr期间使用k个时间点进行检测(如通过循环chcr步骤a-d中的一个或多个),则条形码长度被理解为k,并且潜在条形码的空间是nk,定义了能够识别的不同标记物的上限,即能够在chcr实验中检测到的靶分析物的数量。在该实例中,每个靶分析物与每个时间点的荧光信号相关联。
在chcr的每个循环中,0到1个不同的信号与每个靶分析物相关联。在每个靶分析物在循环hcr期间恰好在一个时间点中产生不同信号的情况下,条码化被理解为线性的,例如,能够被标记的靶分析物的数量通过每个额外循环至多n个不同信号线性增长。因此,使用k个循环,在每个时间点使用n个不同的信号,可以检测至多n×k个靶分析物。
在数学上,在每个时间点使用在包含具有n个不同信号的k个循环的循环hcr实验中能够用长度为a的复合条形码清楚地标记的靶分析物的数量的上限等于k/a×na。使用这个公式,我们可以很容易地得出较早值。在较早情况下,其中每个靶分析物在k个时间点的每一个处具有荧光信号,复合条形码的长度a=k,并且该公式减少已知的nk。在每个靶分析物在具有k个检测时间点的循环hcr实验中恰好在一个时间点具有荧光信号的情况下,该公式减少至k×n。可以构建循环hcr实验,其中每个靶分析物与长度为a的复合标记物相关联,给定1≤a≤k。
该公式仅描述了能够在循环hcr实验中明显标记的靶分析物数量的上限。如所描述的,具有长度a的检测到的信息消息可以包含超出识别唯一靶分析物标记物所必需的信息,例如用于错误检测或纠正错误的信息。
为了构建长度大于1的复合标记物或条形码,即在使用指数条形码的任何情况下,必须在周期或时间点之间连接来自靶分析物的信号,以便组装时间有序的复合标记物。这通常通过将靶分析物固定在空间中来实现,例如通过生物样品的化学固定,或通过将靶分析物交联到诸如水凝胶的3d基质,以在hcr循环之间保留靶分子的空间组织。然而,还可以通过跟踪靶分析物随时间的位置来连接来自靶分析物的信号,使得hcr信号可以映射到单个靶分析物。例如,可以将跟踪部分固定到靶分析物上,该靶分析物连续地或以足以跟踪靶分析物随时间的位置的时间间隔被检测。在每次hcr检测事件中,hcr信号然后可以与特定的靶分子相关联。允许来自每个时间点的hcr信号被映射到特定靶分子的任何方法将使得能够从单独荧光信号组装复合标记物。
对于使用长度等于1的循环hcr产生的独特标记,即对于循环hcr标记方法(其中每个靶分析物在整个hcr循环中产生恰好一个扩增的荧光信号),不必随时间跟踪靶分析物,因为单个检测事件承载所有原始信息并且足以识别靶分析物。
当在某些实施方式下组装复合标记物时,检测与单个靶分子相关联的信号可能是重要的。例如,如果两个靶分子在衍射限制距离内在空间上定位,则将使用衍射限制显微镜来叠加它们产生的荧光信号。因此,这两种靶分子的复合标记物(如果它们具有不同的标记物)将被卷积,并且可能无法从卷积复合标记物中识别背后的复合标记物。然而,任何数量的策略都与循环hcr兼容以避免此问题。例如,可以使用任何数量的现有超分辨率显微技术来在空间上解析信号。这些包括任何随机超分辨率方法,如dnapaint,storm,palm,sofi等(其中物体随机闪烁,然后以亚衍射限制精度定位),以及确定性超分辨率显微镜方法,例如sted,sim等。循环hcr发明的方面可以实现随机或确定性超分辨率检测的新方法,例如通过在循环hcr实验中的任何一个时间仅检测复合标记物的子集,然后稍后检测另一个子集,等等,使得每个子集中的靶分析物的浓度足够低,使得所有单个靶分子在每个检测事件(即分配)内在空间上可分辨。在某些实施方式中,靶分析物可物理连接至可溶胀3d基质,例如(science347(6221):543-548)中的膨胀基质,其物理地分离靶分析物,使得它们可被单独分辨。在其他实施方式中,一种或多种一级探针,接头,步骤b探针,hcr引发剂,hcr聚合物,或可检测标记物,或包含或代表被检测的原始信息的任何物理对象可以连接到膨胀基质。任何能够在检测过程中分离单个靶分子,使得复合标记可以针对单个靶分子组装,或者使得能够对检测到的卷积复合标记物进行信息反卷积,使得可以回收对应于各个靶分子的复合标记物的方法能够使用循环hcr检测复合标记物。
步骤a)通过一种或多种一级探针循环标记多种靶分子。
根据本文所述的方法,样品中的多个靶分子各自单独地串联或者优选地并联检测,包括将一个或多个或多种一级探针连接至靶分子的步骤。一级探针也称为“一级探针”,“一级步骤a探针”,或“步骤a探针”。稍后,包括可检测部分或可检测标记物的核酸发夹分子的杂交链反应将多个可检测部分或可检测标记物与探针相关联,从而与靶分子相关联。检测可检测部分或可检测标记物。通过方法和材料实现步骤a的可编程性,以反转靶分析物和一级探针之间的关联。参见图4-5。
探针负责分析物检测的特异性。每个探针必须与靶分析物形成化学键或分子相互作用(例如疏水性,电荷等),例如亲和性或反应性关联。在某些条件下,每种探针对靶分析物具有一定的特异性,这可能是简并的。一级探针通过探针本身的结合或反应性特征,在实验条件下和样品的背景下确定检测和传输的原始信息。例如,与特定蛋白质物质结合的一级探针被认为转移或检测蛋白质物质的存在和种类的信息,从而可用于测量该蛋白质物质的随时间的空间中分布,存在,种类,数量,和丰度。一级探针可以特异性结合以某种方式修饰的修饰或分子物质,从而转移关于分子物质的存在和种类以及修饰状态的信息。一级探针可以在某种构象中或在某种情况下(例如局部环境,样品预处理)特异性结合分子物质。一级探针可以结合一类或一个相关蛋白质或核酸分子的集,从而转移关于潜在分子物质集之一的存在的信息。一级探针可以以一定的动力学结合和解离速率与原子,分子或分子复合物的空间构型中的一个或多个或多种结合,其中转移的信息具有概率性,其中结合分子物质是任何特定物质的概率与一级探针的结合和结合动力学性质,一级探针结合的潜在靶标的浓度和可及性,以及实验的其他条件有关相关,其全部或部分可能是已知的,在分析数据的过程中推断或测量。
一级探针的实例包括但不限于dna和rna原位杂交(ish)寡核苷酸,其含有与靶核酸互补的核酸序列;核酸类似物探针,其与靶核酸结合;免疫蛋白质,免疫衍生蛋白质或肽片段,例如抗体,纳米抗体,单链可变片段,噬菌体展示颗粒等,其结合靶分析物,包括蛋白质,修饰蛋白质和其他类型的生物分子;适体,包括与靶分析物结合的核酸和核酸类似物聚合物配体;结合某些碳水化合物分析物的蛋白质,如凝集素;其他类型的配体,其在任何条件下都表现出对其他分子的任何非随机结合模式。
图4涉及编程一级探针和靶分析物之间的相互作用。图5a涉及作为一级探针的适体的实例。图5b涉及作为一级探针的抗体的实例。图5c涉及寡核苷酸ish一级探针的实例。
步骤a的可逆性方法固有地与探针的性质相关。步骤a的可逆性可以通过任何反转靶分析物和探针之间的化学键或分子相互作用的方法来实现。例如,温度,盐浓度和/或变性剂如盐酸胍,尿素和甲酰胺可用于破坏核酸退火,从靶核酸分子中除去结合的dna或rnaish探针。温度,盐和/或变性剂如盐酸胍,尿素和甲酰胺也可用于破坏肽配体如抗体和凝集素之间的相互作用,从而反转配体与靶分析物的结合。酶处理可以通过特异性降解探针来反转探针结合,例如通过dna酶消化靶向mrna或rna分子的dnaish探针,其消化dna探针但不消化靶分子。可合成寡核苷酸或核酸类似物探针以及肽探针以包含对光学,化学或酶处理敏感的化学基团,该处理使得探针不稳定,如从靶分子降解或置换。例如,抗体探针可以在氨基酸聚合物的主链中含有具有可切割基团的非天然氨基酸残基,导致抗体被特异性降解。核酸或核酸类似物一级探针可含有修饰的碱基或修饰的糖主链(例如3′或5′桥接硫代磷酸酯键,其被ag离子切割),或光可裂解基团(其被uv光切割),或者光不稳定基团(其在通过uv光处理后改变原子构象,改变寡核苷酸的构象以破坏核酸退火)。含偶氮苯的胍衍生物(bergen等,2016acsnanoletters)的引入可用作光可逆核酸退火的光敏嵌入剂,破坏探针与靶核酸的结合。
在反转靶分析物和探针之间的化学键或分子相互作用后,在这种情况下探针未结合或特异性降解,从样品中除去探针或探针片段,例如通过洗涤。然而,至少一部分靶分析物保持完整并且能够在随后的循环hcr循环中探测。
例如,通过使用dna酶对dnaish探针的特异性降解,靶mrna分子保持完整并且能够使用相同或新的一集一级探针重新探测。在另一个实例中,在一个hcr循环中探测蛋白质靶标;之后,通过用变性剂如尿素处理从蛋白质中除去蛋白质靶探针,并洗去一级探针。然后可以使用相同或新的一级探针集重新探测靶蛋白。或者,循环hcr的后续循环可以靶向其他类型的分子,例如核酸,其不受蛋白质探针的探测或去除,即步骤a可编程性的正向和反向机制的影响。
在hcr的每个循环中标记感兴趣的分析物可以被反转或破坏,或者一级探针可以以其他方式与靶分子分离,例如,通过从靶核酸上剥离杂交的核酸探针,例如通过加热或使用变性剂(例如尿素或甲酰胺),或通过酶促消化杂交的核酸探针,如通过dna酶i消化结合rna分子的dna探针,其不被dna酶降解。可以通过加热或化学处理(例如,甲酰胺)剥离结合的抗体。但是,请注意,反转靶分析物的标记不一定会去除hcr聚合物和相关联的荧光信号;因此,这些方法可以与用于反转步骤c和d的方法组合。例如,通过触发含有一个或多个光不稳定基团的一级探针的构象变化来破坏核酸ish探针和靶核酸之间的退火不一定去除hcr聚合物本身,其可能不含光不稳定基团,因此将保持聚合,尽管现在与靶分子断开。因此,步骤a的这种反转可以与步骤b,c和/或d的反转相结合,以便于去除hcr引发剂,hcr聚合物或与hcr聚合物相关联的荧光信号,使得样品返回到适用于使用循环hcr的后续轮检测的状态。
可以组合用于步骤a的任何数量的正交循环系统以编程方式呈现在一个循环内结合或未结合的一级探针的子集。例如,可以使用光不稳定基团对一级探针子集进行循环,而通过使用化学不稳定基团同时或串联循环其他子集以去除一级探针。
循环hcr反应可以不利用步骤a可编程性,如在所有所需多个靶分子同时用一级探针探测一次的情况下,并且进行使用步骤b-d中任何一个的可编程性的循环hcr反应。在这种情况下,永远不会从靶分子中除去探针。
步骤b)一级探针与hcr引发剂的可编程功能连接。
根据本文所述的方法,检测样品内的多个靶分子,包括将探针或探针集连接到多个靶分子中的每一个的步骤,使得所有所需的多种靶分子或其一些所需子集具有与其附连的探针或探针集,其中每个探针能够通过循环hcr步骤b-d转移信息,即与hcr引发剂的功能性连接,hcr聚合反应的引发,以及产生hcr聚合物的扩增荧光信号。一级探针和hcr引发剂之间的功能性连接旨在描述一级探针和hcr引发剂之间包括化学键和分子相互作用的物理连接,以及门控或非门控的hcr引发剂的状态,例如,能够在适当的条件下和在互补的hcr单体如发夹的存在下启动hcr。一级探针和hcr引发剂之间的功能性连接可以通过控制一级探针和hcr引发剂之间的物理连接来编程,使得可以建立和/或特异性地分解物理连接;或者通过门控hcr引发剂使得引发剂可以在适当条件下和在互补发夹存在下特异性地启动hcr和/或特别地使其在适当条件下和在补充发夹存在下不能启动hcr;或两者。
通过使用二级探针将hcr引发剂物理连接到一级探针(称为“步骤b探针”),可以实现一级探针和hcr引发剂之间的可编程功能连接。步骤b探针包括与与附着部分(如果它是核酸序列)互补的核酸序列结合的引发剂分子或步骤a探针的附着部分的结合对添加到样品且步骤b探针结合与靶分子结合的步骤a探针。然后加入相应的发夹分子,并如本文所述进行杂交链反应。以这种方式,样品中的每个靶分子与具有步骤b探针的二级结合位点的一级步骤a探针结合。含有hcr引发剂基序的步骤b探针用于在循环hcr实验过程中将相同引发序列或引发序列的集共同集之一与每个靶分子相关联。以这种方式,可以在每个检测步骤期间使用相同或共同的引发序列和发夹序列,或用于检测多个靶分子中的每个靶分子。检测可检测部分或可检测标记物。包含hcr引发剂基序的步骤b探针随后可以从一级步骤a探针剥离,除去或以其他方式解离,使得步骤a探针不再与hcr启动子物理连接,因此被认为是“反转的”或“重置的”或不能引发hcr聚合反应。以这种方式,系统检测靶分子的功能被反转,即返回到更早的状态,从而可以检测第二分析物或靶分析物的子集。然后使用对下一个靶分子或靶分子集的步骤a探针的结合部分特异的一个或多个步骤b探针,对第二和随后的靶分子或靶分子子集重复该过程,但是其中步骤b探针具有相同的hcr引发序列和与第一靶分子或靶分子集一起使用的相同的可检测部分或可检测标记物。以这种方式,可以使用相同的引发剂和发夹分子,即对每个靶分子“重复使用”。
根据某些方面,提供了用于在一级步骤a探针(即,负责结合靶分析物的一级探针,但也具有用于附连包含hcr引发序列的步骤b探针的第二附着位点)和具有hcr引发剂的步骤b探针之间形成化学键(离子,共价或氢)的方法和材料。这些方法包括通过杂交测序,例如,将核酸步骤b探针退火至一级步骤a探针上的互补序列,如图7b所示;通过连接测序,如图7c所示,以形成稳定的双链核酸或核酸类似物,其将步骤b探针中的hcr引发序列连接至步骤a探针;或者使用与hcr引发序列偶联的配体作为步骤b探针,如通过抗体,适体或蛋白质配体,其特异性结合步骤a探针上存在的表位,例如,链霉亲和素修饰的hcr引发序列,其与生物素化的一级探针结合。
提供了用于破坏一级步骤a探针和步骤b探针之间的化学键(离子,共价或氢)的其他方法和材料,或者用于以任何方式切断一级探针和hcr引发序列之间的物理连接或关联的方法和材料。这些方法包括通过温度,盐浓度,变性剂(尿素,甲酰胺,盐酸胍)破坏退火核酸或核酸类似物之间的键的方法;或用于在步骤b探针的结合步骤a探针的部分中的任何地方引入光不稳定,化学不稳定或酶不稳定基团的步骤b探针材料和方法,使得结合在诱导时被破坏,如通过光处理或引入化学或酶促剂,例如光不稳定基团,其通过uv光处理改变构象,改变寡核苷酸的构象,破坏步骤a探针和步骤b探针之间的核酸退火;用于在步骤a探针的结合步骤b探针的部分中的任何地方引入光不稳定,化学不稳定或酶不稳定基团的步骤a探针材料和方法,使得在诱导时结合被破坏,如通过光处理或引入化学或酶促剂,例如光不稳定基团,其通过uv光处理改变构象,改变寡核苷酸的构象,破坏步骤a探针和步骤b探针之间的核酸退火;用于在步骤b探针的结合步骤a探针和hcr引发剂的部分之间的任何地方引入光不稳定,化学不稳定或酶不稳定基团的步骤b探针材料和方法,使得物理连接被破坏并且可以洗去或除去hcr引发序列;例如在与步骤a探针互补的区域和hcr引发序列之间的dna寡核苷酸主链中引入3′或5′桥接硫代磷酸酯键;用于将光不稳定,化学不稳定或酶不稳定基团引入到步骤a探针的结合靶分析物的部分和结合步骤b探针的部分之间的任何地方的步骤a探针材料和方法,使得物理连接被破坏,hcr引发序列可以被洗去或去除;例如在与步骤b探针互补的区域和与靶分析物接触的步骤a一级探针的区域之间的dna寡核苷酸的主链中引入3′或5′桥接硫代磷酸酯键;用于特异性降解含有hcr引发剂或负责结合步骤a探针的步骤b探针或其部分的步骤b探针材料和方法;例如dna酶消化dna步骤b探针,其中通过修饰的碱基保护步骤a探针免受dna酶活性影响,使得步骤b探针被特异性降解;用于特异性降解步骤a探针的至少部分的材料和方法,所述步骤a探针含有负责结合步骤b探针的结合部分;例如dna酶消化与肽步骤a探针偶联的dna。
根据一个方面,方法包括通过同时标记多种靶分析物来循环步骤b,使得每种分析物与一种或多种一级探针结合,但是没有一种一级探针是固有的hcr引发剂。系统地,一级探针的子集与hcr引发剂相关联,如通过杂交测序或通过连接测序。在前一种情况下,与一级步骤a探针中包含的序列互补并且还携带hcr引发序列的核酸探针与样品杂交。在后一种情况下,dna连接酶用于共价延伸与一级探针序列部分互补但也带有hcr引发序列的第二链dna。
一级探针与hcr引发剂的关联可以被反转,即步骤a探针和hcr引发剂可以分开,例如,通过从步骤a探针中剥离带有引发序列的杂交核酸探针,称为步骤b探针。可以置换hcr聚合物并且带有hcr引发剂结构域的核酸被封端,例如通过粘性末端链置换。参见naturechemistry3:103-113(2011),在此通过引用纳入。带有hcr引发剂结构域的核酸可以被化学切割,例如通过硝酸银与位于连接探针和hcr引发序列之间的化学键之间的桥接硫硫代磷酸酯键反应。带有hcr引发剂结构域的dna链可以酶促或化学降解,如通过λ外切核酸酶消化带有5′-磷酸的dna链,ds特异性dna酶,或通过user系统(udg/endoviii)或endov分别消化含有du和di核碱基的dna。或者,内切核酸酶可切割引发序列。反转hcr引发剂和靶标之间的关联可能不一定去除hcr聚合物和相关的荧光信号;因此,这些方法可以与反转步骤c和d的方法相结合。
此外,一级探针和hcr引发剂之间的可编程功能连接仅通过方法和材料来实现,以特异性地分解一级探针和hcr引发剂之间的连接,或者以任何方式切断一级探针和hcr引发序列之间的物理连接或关联。在一个实施方式中,一级探针包含有功能活性的hcr引发剂。然后加入相应的发夹分子,并如本文所述进行杂交链反应。稍后,一级探针上的hcr引发剂与一级探针物理分离,或者降解。图7b步骤2涉及从一级探针中除去功能性引发剂,与图7b步骤1的使用无关。可以将新的一级探针添加到样品中,引入相同的hcr引发序列。以这种方式,每个靶分子可以在循环hcr实验过程中与相同或一集共同的引发序列之一相关联。以这种方式,可以在每个检测步骤期间使用相同或共同的引发序列和发夹序列,或用于检测多个靶分子中的每个靶分子。检测可检测部分或可检测标记物。用于特异性溶解一级探针和hcr引发剂之间的连接的方法和材料包括上面列出的所有方法和材料。当一级探针和hcr引发剂之间的连接包括如步骤a中所述的任何连接方法时,这些也被理解为包括在步骤b中;例如,使用任何配体将步骤b探针与步骤a探针结合,以及任何溶解该连接的方法。
此外,一级探针和hcr引发剂之间的可编程功能连接通过用于门控物理连接到一级探针的hcr引发剂的方法和材料来实现。可以通过门控hcr引发剂来编程步骤b,使得通过一些外部输入调节一级探针启动hcr的能力。步骤b可以通过材料和方法编程以对hcr引发剂进行门控,使得它依赖于另一输入,例如任何类别的物理或电磁信号或使用原子或分子激活剂来启动hcr;或者通过方法和材料来门控hcr引发剂,使得输入(例如任何类别的物理或电磁信号)或使用原子或分子活化剂使hcr引发剂失活,使得它不再能引发hcr聚合反应;或两者。将包含门控的hcr引发剂分子的一级探针添加到样品中并与靶分子结合。稍后,可以激活hcr引发剂,将hcr单体如发夹加入样品中并与活性引发剂接触,产生hcr聚合物,并检测可检测部分,例如荧光部分。稍后,hcr引发剂可以被灭活,使得发夹被添加到样品中,但是不能接触引发剂或以其他方式接触惰性引发剂但不引起聚合反应。
在一个实施方式中,一级探针包含有功能活性的hcr引发剂。然后加入相应的发夹分子,并如本文所述进行杂交链反应。稍后,一级探针上的hcr引发剂被门控,或者呈现不能引发hcr聚合反应。新一级探针可以添加到样品中,引入相同的hcr引发序列,或样品中已存在的但其hcr引发序列是门控的并且不能启动hcr的现有一级探针然后可以非门控并使其能够启动hcr聚合反应。以这种方式,每个靶分子可以在循环hcr实验过程中与相同或一集共同的引发序列之一相关联。以这种方式,可以在每个检测步骤期间使用相同或共同的引发序列和发夹序列,或用于检测多个靶分子中的每个靶分子。检测可检测部分或可检测标记物。
在另一个实施方式中,一级探针含有无活性或门控的hcr引发序列,其不能引发hcr聚合反应。一级探针上的hcr引发序列的全部或一些子集是非门控的,然后加入相应的发夹分子,并如本文所述进行杂交链反应。据一个方面,随后的hcr循环,hcr引发序列的其他子集是非门控的,在每个循环产生叠加的hcr信号。根根据另一方面,一级探针上的hcr引发剂或者与一级探针物理分离,或者以其他方式降解,或门控,或者使得不能引发hcr聚合反应,使得随后的hcr循环在没有在先信号情况下产生新信号。通过这种方式,新一级探针可以添加到样品中,引入相同的hcr引发序列,或样品中已存在的但其hcr引发序列是门控的并且不能启动hcr的现有一级探针然后可以非门控并使其能够启动hcr聚合反应。以这种方式,每个靶分子可以在循环hcr实验过程中与相同引发序列或引发序列的共同集之一相关联。以这种方式,可以在每个检测步骤期间使用相同或共同的引发序列和发夹序列,或用于检测多个靶分子中的每个靶分子。检测可检测部分或可检测标记物。
门控hcr引发剂的方法包括在hcr引发剂上引入保护部分的方法,使得它不能引发hcr聚合反应;用互补链保护hcr引发剂的方法,使得它不能引发hcr聚合反应,如图7a所示;当保护链含有额外的序列时,可以引入互补链(也称为步骤b探针,因为它负责编程一级探针和hcr引发剂之间的功能性连接),使得发生粘性末端链置换,使hcr引发序列为单链和/或可用于引发hcr聚合反应;用于在hcr引发剂上引入和/或除去光不稳定,化学不稳定或酶不稳定的保护部分的方法和材料,使得它不能引发hcr聚合反应;用于特异性激活hcr引发剂或用于特异性灭活hcr引发剂,例如通过添加或去除结合部分,例如ssdna结合蛋白的方法,其阻断ssdna引发序列接触hcr发夹;用于化学,光学或酶不稳定的hcr引发序列的方法和材料及其用途,使得能够调节hcr引发剂的原子构象以允许hcr引发剂接触或被阻止接触hcr发夹;通过保护和/或去保护引发序列来提供循环步骤b的方法,例如通过用互补保护链双链化引发序列。互补保护链可以通过dna粘性末端链置换而移位。保护链可以经化学切割,例如通过硝酸银与沿着保护链的主链与桥接硫硫代磷酸酯键的反应。保护链可以被酶促或化学降解,如通过λ核酸外切酶消化带有5′-磷酸的dna链,ds特异性dna酶,或通过user系统(udg/endoviii)或endov分别消化含有du和di核碱基的dna。通过掺入在暴露于不同波长的光时改变原子构型的光不稳定碱基,可以迫使保护链不杂交。
广泛地,负责接触和结合靶分析物的一级探针或其区域与hcr引发序列之间的功能性连接被描述为“该接头”,“接头”,“功能性接头”,“步骤b接头”或“可编程接头”。在使用步骤b可编程性的循环hcr的情况下,任何上述方法和材料构成接头,例如,步骤a探针和步骤b探针的组合结合部分,其在一级探针和hcr引发剂之间建立物理连接,或者包含门控或可门控hcr引发剂的步骤a探针。
循环hcr反应可能不利用步骤b可编程性,如在所有一级探针与非门控的hcr引发剂直接同源的情况下,例如,hcr引发剂,其将在互补发夹的存在下和在合适的环境(例如水性缓冲液,温度等)中引发hcr聚合反应。在这种情况下,一级探针与hcr引发剂的功能性连接可以通过直接化学连接,例如,直接与抗体一级探针偶联(例如solulink)偶联dnahcr引发剂;或者通过核酸或与靶核酸分子互补的核酸类似物一级探针的区域和含有hcr引发剂基序的区域之间核酸主链中的磷酸二酯键;或者通过非反应性间隔序列,例如在核酸或与靶核酸分子互补的核酸区域或核酸类似物一级探针的区域与含有hcr引发剂基序的区域之间的聚-t,聚-a或聚-[ta]重复。在这些实施例中,探针和非门控的hcr引发剂之间的物理连接是直接的,并且功能性连接(也指hcr引发剂的物理连接和状态是门控的或不是门控的情况)也是直接的,并且不是以任何能够物理分离或门控的方式设计的;因此,步骤b不可编程。这些也称为“接头”。循环hcr反应仍可利用步骤a,c和d中的任何步骤的可编程性。
可以组合任意数量的正交步骤b策略以可编程方式地使引发剂结构域的子集在一个循环内可及并起作用。例如,一级探针的子集可以存在于由保护链门控的hcr引发剂的循环内,而一级探针的不同子集不含hcr启动子,而含有与包含hcr引发剂的步骤b探针互补的序列。
图6针对步骤b的两种方法的使用,即通过步骤b探针编程hcr引发剂与一级探针的物理关联,并编程门控的hcr引发剂的状态,用于使用两个hcr循环检测两个靶分析物。图7涉及对一级探针和hcr引发剂之间的功能连接进行编程的机制,其中图7a是使用门控的hcr引发剂的示例,并且图7b和7c是编程一级探针和hcr引发剂之间的物理连接的示例,使用通过杂交测序(7b)和通过连接测序(7c)反应。
步骤c)循环hcr聚合。
根据本文所述的方法,检测样品内的多个靶分子,包括将一个或多个或多种一级探针附连到多个靶分子中的每一个的步骤,使得在循环hcr方法期间的一些预定时间上,所需的多个靶分子中的每一个具有与其附连的一级探针或一级探针集,其中每个一级探针在一些预定时间上功能性连接至hcr引发剂。添加可转移的hcr单体,例如发夹分子,其对应并结合引发剂并且可以是引发剂独特的,并且如本文所述进行杂交链反应,在引发剂的位点产生系连的hcr聚合物。将hcr聚合物“系连”至初始hcr单体与引发剂杂交或结合的程度,并将剩余的hnr单体串联延伸以制备hcr聚合物。在一些预定时间上,系连的hcr聚合物被一个或多个或多种荧光或可检测部分标记。以这种方式,样品中的每个靶分子与具有hcr引发剂的探针结合,并加入hcr单体如发夹分子以检测靶分子。对于样品中的每个靶分子,该过程可以随时间串联或并行进行。每个靶分子可以与具有hcr引发剂的探针结合,其中随后在循环hcr方法的过程中一次或多次加入hcr单体如发夹分子以检测靶分子。在循环hcr方法的整个过程中,每个分析物或被询问的原始信息的每个独特方面,例如分子种类,分子质量或分子构型,通过循环hcr产生独特的有序扩增荧光信号模式。对于循环hcr,hcr发夹分子和相关或同源的引发序列可以简并到每个靶分子。在有序集的hcr聚合反应中,可以重复使用相同hcr聚合物或hcr聚合物的共同集,hcr聚合物在hcr聚合反应之间在功能上反转,如通过反转聚合反应或者通过hcr聚合物的降解或剥离。以这种方式,单个hcr系统或正交hcr系统集可用于检测样品中的所有多个靶分子。通过本文所述的材料和方法能够形成和降解或剥离hcr聚合物,其在每个hcr聚合反应之间功能性地重置样品,允许hcr系统在循环hcr的循环之间重复使用。
图9涉及使用两个正交hcr系统检测两种靶分析物的两个hcr循环,但仅有一个光谱可分辨的荧光信号。靶1由一级探针“α”结合,其包含引发序列“i1”,并且靶2由一级探针“β”结合,其包含引发序列“i2”。在时间=1时,将与引发剂“i1”同源的hcr发夹加入到样品中,并且“i1”与同源hcr发夹接触,形成hcr聚合物,由红色星代表,表示红色荧光信号,其被检测到。随后在时间=2时降解或拆解或剥离hcr聚合物,从而使样品返回到没有hcr聚合物的先前状态。在时间=3时,将与引发剂“i2”同源的hcr发夹加入到样品中,并且“i2”与同源hcr发夹接触,形成hcr聚合物,由红色星代表,表示相同红色荧光信号,其被检测到。随后在时间=4时降解或拆解或剥离hcr聚合物,从而使样品返回到没有hcr聚合物的先前状态。
根据某些方面,提供了仅在存在相应hcr发夹的引发序列处发生的hcr聚合反应的方法。图9针对此,因为在时间1和3处的hcr聚合各自仅在两个引发序列“i1”和“i2”之一处发生,因为在每个时间点仅添加一个与“i1”或“i2”同源的hcr发夹集。根据某些方面,hcr聚合反应在引发序列的存在下进行,尽管引发序列可能需要如步骤b那样可及或活化。根据某些方面,可以加入,活化,除去或“反转”可检测部分,如本文步骤d中所述。根据某些方面,hcr聚合物本身经历靶向的降解或拆解或剥离,构成步骤c的可编程性。
步骤c可以通过hcr聚合物的靶向的降解或拆解或剥离来反转,即hcr聚合物可以降解或拆解或剥离。如图10b所示,hcr聚合物的一条或多条链可以通过dna粘性末端链置换而移位。hcr聚合物的一条或多条链可被化学切割,例如通过硝酸银与沿着dna主链与桥接硫硫代磷酸酯键连接的反应,如图10a所示。hcr聚合物的一条或多条链可以被酶促或化学降解,如通过λ核酸外切酶消化带有5′-磷酸的dna链,ds特异性dna酶,或通过user系统(udg/endoviii)或endov分别消化含有du和di核碱基的dna,如图10c所示。其他酶包括cas9,锌指核酸酶和其他靶向的内切核酸酶和外切核酸酶。通过掺入在暴露于特定波长的光时改变原子构型的光不稳定碱基,可以迫使hcr链不杂交。这些示例性方法可以或可以不除去引发剂本身。为了防止循环hcr轮次的叠加信号,可以使用上述用于反转步骤a和b的方法。
可以组合任意数量的正交步骤c策略以可编程方式地使hcr聚合物的子集在一个循环内聚合。例如,一些聚合物可以使用化学方法降解,而其他聚合物使用粘性末端链置换同时或连续拆解。
循环hcr反应可能不利用步骤c可编程性,如在通过hcr聚合反应形成后hcr聚合物在样品中保持完整的情况,即hcr聚合物不可除去。循环hcr反应仍可利用步骤a,b和d中的任何步骤的可编程性。例如,hcr聚合物可以随时间以叠加方式形成,但是通过使用步骤d可编程性,在任何一个时间上仅使一个子集呈现荧光。或者,hcr聚合物可以恰好形成一次,但是通过使用步骤d可编程性,在任何一个时间上只有一个子集呈现荧光。
步骤d)hcr聚合物的可编程荧光标记。
根据本文所述的方法,检测样品内的多个靶分子,包括将一级探针或一级探针集附连到多个靶分子中的每一个的步骤,使得在循环hcr方法期间的一些预定时间上,所需的多个靶分子中的每一个具有与其附连的一级探针或一级探针集,其中每个一级探针在一些预定时间上功能性连接至hcr引发剂。添加hcr单体,例如发夹分子,其与引发剂相关联并且可以是引发剂独特的,并且如本文所述进行杂交链反应,在引发剂的位点产生系连的hcr聚合物。在一些预定时间上,系连的hcr聚合物被一个或多个或多种荧光或可检测部分标记。以这种方式,样品中的每个靶分子与具有hcr引发剂的探针结合,并加入hcr单体如发夹分子以检测靶分子。对于样品中的每个靶分子,该过程可以随时间串联或并行进行。每个靶分子可以与具有hcr引发剂的探针结合,其中随后在循环hcr方法的过程中一次或多次加入hcr单体如发夹分子以检测靶分子。在循环hcr方法的整个过程中,每个分析物或被询问的原始信息的每个独特方面,例如分子种类,分子质量或分子构型,通过循环hcr产生独特的有序扩增荧光信号模式。对于循环hcr,荧光信号可以在任何hcr循环期间简并到每个靶分子。通过用荧光信号编程hcr聚合物的方法能够实现步骤d的可编程性,使得荧光部分可以特异性地与hcr聚合物偶联和/或特异性地从hcr聚合物中除去。以这种方式,在一集有序的hcr聚合反应中,可以重复使用相同可检测部分或可检测部分的共同集。
通过使hcr聚合物与可检测部分(例如荧光部分)特异性关联的材料和方法;从hcr聚合物中特异性除去可检测部分如荧光部分的材料和方法;或两者,使得循环hcr的步骤d的可编程性成为可能。
使用带有可检测部分(例如荧光部分)的二级探针(称为步骤d探针)允许可检测部分被引入hcr聚合物,和/或从聚合物中除去。该过程可以对样品中的每个靶分子串联或并联进行,其中可检测部分在靶分子处产生的所有hcr聚合物分子集内和之间可以相同。以这种方式,单个可检测部分可用于检测样品中的所有多个靶分子。检测可检测部分或可检测标记物。根据某些方面,在检测后从hcr聚合物中除去可检测部分或可检测标记物,即可检测标记物是可去除的。以这种方式,系统检测靶分子的功能被反转。根据某些方面,组成hcr单体,例如形成hcr聚合物的发夹含有可检测部分,例如荧光部分,使得hcr聚合物含有多个可检测部分,例如荧光部分;由此检测到hcr聚合物;并且检测后,从hcr聚合物中除去可检测部分或可检测标记物。以这种方式,系统检测靶分子的功能被反转。
图12涉及使用循环hcr步骤d可编程性的两个hcr循环。两个靶分析物分别被一级步骤a探针“α”和“β”结合,分别通过表示为“l”但理解为如循环hcr的步骤b中所述的任何类型的可编程或不可编程的接头的接头与引发序列“i1”和“i2”功能性连接。对应于由引发剂“i1”和“i2”启动的正交hcr系统的hcr单体发夹已被添加到样品中,并且已经接触了分别与一级探针α和β连接的引发序列“i1”和“i2”,并在靶分析物上形成hcr聚合物。在串联中,与引发剂“i1”和“i2”关联或同源的每种hcr聚合物与由蓝色星表示的检测荧光部分偶联。在检测后,荧光部分从hcr聚合物中除去,尽管hcr聚合物保持完整,从而使样品返回到在hcr循环之间无可检测的荧光信号的状态。
能够可编程标记hcr聚合物的方法和材料包括具有用于结合探针(称为步骤d探针,包括可检测部分)的核酸柄部分的hcr单体或发夹分子。加入包括一个或多个可检测部分的一个或多个互补的寡核苷酸步骤d探针,以结合hcr聚合物的柄;具有被称为步骤d探针的配体结合的表位(包括一个或多个可检测部分)的hcr单体或发夹分子。添加包含一个或多个可检测部分的一个或多个配体步骤d探针以结合hcr聚合物的表位。具有化学基团或柄的hcr单体或发夹分子,其化学或酶促反应可特异性地将可检测部分偶联到hcr聚合物上;例如,通过末端转移酶添加荧光dntp的可及3′oh;或用于通过dna连接酶添加荧光寡核苷酸的可及5′-磷酸;或带有伯胺,用于与偶联nhs-酯的荧光团反应。
能够可编程地去除检测部分的方法和材料,例如,反转hcr聚合物的荧光标记,包括通过温度,盐浓度,变性剂(尿素,甲酰胺,盐酸胍)破坏退火核酸或核酸类似物之间的键以从hcr聚合物中去除荧光步骤d探针的方法;用于在结合hcr聚合物的步骤d探针的部分中的任何地方引入光不稳定,化学不稳定或酶不稳定基团的步骤d探针材料和方法,使得结合在诱导时被破坏,如通过光处理或引入化学或酶促剂,例如光不稳定基团,其通过uv光处理改变构象,改变寡核苷酸的构象,破坏步骤d探针和hcr聚合物之间的核酸退火;用于在hcr发夹的结合步骤d探针的部分中的任何地方引入光不稳定,化学不稳定或酶不稳定基团的hcr聚合物或发夹材料和方法,使得在诱导时结合被破坏,如通过光处理或引入化学或酶促剂,例如光不稳定基团,其通过uv光处理改变构象,改变寡核苷酸的构象,破坏步骤d探针和hcr聚合物之间的核酸退火;用于在步骤d探针的结合hcr聚合物和荧光或检测部分之间的任何地方引入光不稳定,化学不稳定或酶不稳定基团的步骤d探针材料和方法,使得物理连接被破坏并且可以洗去或除去荧光或检测部分;例如在与hcr聚合物物理连接的步骤d探针的区域和荧光或检测部分之间的dna寡核苷酸主链中引入3′或5′桥接硫代磷酸酯键;用于将光不稳定,化学不稳定或酶不稳定基团引入到参与hcr聚合物形成的hcr发夹部分和包括荧光或检测部分的步骤d探针的结合伴侣之间的任何地方的hcr单体或发夹材料和方法,使得聚合物和荧光部分的物理连接被破坏,并且荧光或检测部分可以被洗去或去除;例如在hcr聚合物内与另一个hcr发夹退火的hcr发夹的区域和含有与含荧光或检测部分的步骤d探针的结合伴侣的区域之间的dna寡核苷酸的主链中引入3′或5′桥接硫代磷酸酯键;用于特异性降解含有荧光部分或负责结合hcr聚合物的步骤d探针或其部分的步骤d探针材料和方法;例如dna酶消化dna步骤d探针,其中通过修饰的碱基保护步骤hcr聚合物免受dna酶活性影响,使得步骤d探针被特异性降解;用于特异性降解步骤d探针的结合伴侣hcr单体或发夹材料和方法,如酶促或化学消化肽,切割或片段化核酸柄,使得步骤d探针的结合伴侣从hcr聚合物中除去,从而使含有检测或荧光部分的步骤d探针通过扩散或洗涤从hcr发夹中除去;用于猝灭荧光或检测部分,如光漂白荧光部分以永久消除检测部分的荧光激发/发射质量的步骤d探针材料和方法;或引入二级步骤d探针,其结合一级步骤d探针的部分并带有猝灭基团。
公开提供了hcr聚合物可通过杂交荧光测序,通过合成测序或通过连接反应测序来产生荧光信号。荧光标记物可以通过荧光部分从hcr聚合物的酶促或化学切割或通过dna粘性末端链置换而解离或“反转”。图13涉及通过hcr聚合物上存在的另外的柄序列将循环hcr步骤d探针与hcr聚合物杂交,然后在检测荧光信号后从hcr发夹上剥离荧光步骤d探针,将荧光对hcr聚合物进行编程。图14a涉及循环hcr步骤d的叠加编程,例如,仅对荧光与hcr聚合物的关联性,而不是荧光与hcr聚合物的解离进行编程,使得步骤d的每个循环向样品添加额外的荧光信号。图14b涉及荧光信号与hcr聚合物的关联和解离的可编程性。
本公开内容提供了通过用另外的5′或3′柄序列修饰hcr聚合物来荧光标记hcr聚合物的方法,其中载有荧光团的寡聚物(称为步骤d探针)可以杂交。或者,柄可以用作酶促测序反应的模板位点,例如使用dna聚合酶通过合成测序或通过连接测序以将荧光部分掺入hcr扩增子的子集中。例如,在第一循环中,互补dna链步骤d探针与hcr探针柄序列的子集杂交,用作测序引物。聚合酶可用于在该hcr聚合物子集上掺入荧光碱基。在随后的循环中,使用正交测序引物荧光标记hcr聚合物空间的其他子集。在另一个实例中,互补dna链步骤d探针与hcr探针柄序列的子集杂交,用作测序引物。聚合酶可用于在该hcr聚合物子集上掺入荧光碱基。在随后的循环中,四个dna碱基中的每一个用于荧光标记hcr聚合物空间的其他子集,其中每个碱基的模板纳入针对hcr聚合物空间的子集。在该实例中,在测序反应期间串联掺入的每种荧光标记的核苷酸可以使用共同的荧光颜色。
为了解离或“反转”荧光信号,带荧光团的链步骤d探针可以通过dna粘性末端链置换而移位。荧光部分可以经化学切割,例如通过硝酸银与沿着dna主链的桥接硫硫代磷酸酯键的反应。带有荧光部分的dna链可以酶促或化学降解,如通过λ核酸外切酶消化带有5′-磷酸的dna链,ds特异性dna酶,或通过user系统(udg/endoviii)或endov分别消化含有du和di核碱基的dna。或者,hcr聚合物本身可以带有负责循环步骤d的官能团,因为化学,光学或酶不稳定基团被合成到负责形成hcr聚合物和步骤d探针的柄或结合部分的区域之间的hcr发夹中,其含有一个或多个荧光部分。
在正交独立hcr系统的数量n大于光谱上不同的荧光信号f的数量的情况下,可以使用循环hcr发明的步骤d通过在k个串联循环的hcr上使用时域来虚拟地增加不同信号的数量以分离光谱无法区分的荧光信号。k×f的集合空间仅受n限制。在该实施方式中,n个分析物用带有n个引发序列的n个探针标记,随后将n个hcr发夹添加到样品中,导致n种hcr聚合物扩增,每个聚合物具有独特的序列,用作荧光步骤d探针杂交的柄。在每轮循环hcr中引入f个步骤d探针,每个携带光谱上不同的荧光团。检测荧光信号,并且任选地从hcr聚合物中除去步骤d探针,或者如本文所述反转荧光信号。在步骤d的后续循环中,引入f个步骤d探针,靶向n个hcr聚合物的不同子集。该方法可以独立于这里描述的其他机制使用,以确保时间光谱上不同的荧光信号的数量总是等于n,即正交的独立hcr系统的数量。此方法可用于指数条码化。
可以组合任意数量的正交步骤d策略以可编程方式地使hcr聚合物的子集在一个循环内荧光标记。例如,hcr聚合物的一个子集可以通过将含有荧光部分的互补寡核苷酸与hcr聚合物的柄特征杂交而被荧光标记,而另一个hcr聚合物子集可以通过与链霉亲和素偶联的荧光部分结合到附连hcr聚合物的生物素基团上被荧光标记。
循环hcr反应可能不利用步骤d可编程性,如在hcr单体或发夹直接含有荧光或检测部分的情况下,例如通过化学连接或荧光团直接偶联发夹,或含有荧光核酸类似物的发夹,并且不可除去。循环hcr反应仍可利用步骤a,b和c中的任何步骤的可编程性。例如,hcr聚合物可以是直接荧光的,但是通过反转hcr聚合并通过使用本文所述的材料和方法洗涤荧光hcr片段去除仍然有效循环的荧光。
循环hcr方法的步骤a-d之间的关系
本文描述的循环hcr方法的步骤a-d在它们涉及在从通过一级探针的结合捕获的靶分析物的原始信息到荧光信号的检测和分析的整个标记和检测级联中传输信息时在概念上是模块化的,即能够作为离散步骤分离,但在特定循环hcr方法的实际设计和实现以及使用中可以在功能上是模块化的或协调的。任何一个步骤的性能或反转可以与循环hcr方法的一个或多个其他步骤的性能和/或反转相协调。
在本发明的某些方面,反转循环hcr的一个步骤有效地反转了其他步骤。例如,将hcr聚合物降解成片段,即步骤c的反转,从样品中洗去片段,可以有效地从样品中除去相关联的荧光,也有效地反转步骤d。作为另一个实例,靶向rna靶的dnaish探针的dna酶消化可以通过同时消化hcr引发剂和hcr聚合物来反转步骤a以及步骤b-c。
在本发明的某些方面,通过循环多个步骤进行循环hcr。图8涉及使用步骤a和b的循环hcr的实例。图8描绘了两个步骤a循环,使用可编程添加的一级探针,与两个步骤b循环协调,使用hcr引发剂与一级探针的可编程灭活或物理分离。图19涉及使用chcra-d的所有四个步骤的可编程性的循环hcr的实例。
实施例
提出以下实施例作为本公开的代表。这些实施例不应解释为限制本发明的范围,因为鉴于本公开,附图和所附权利要求,这些和其它等同实施方式将是显而易见的。
rna的指数循环hcr条码化的实例:存在二十个正交的独立hcr系统。将20个hcr系统分成对并用两种光谱上不同的荧光颜色中的一种标记,使得每对具有两个荧光团,作为编码10个有序位(例如第一对编码第一位)的信号0和1。针对1024个基因中的每一个设计40个smrna鱼探针的集(例如使用生物研究技术公司(biosearchtechnologies,inc.),stellarisrnafish探针设计器工具)。每个基因被分配一个唯一的10位二进制条形码(例如0111010010)。根据基因条形码,每个smrna鱼探针在5′或3′末端被标记,其中10个引发序列中的3个定义基因条形码。引发剂在给定基因的探针中均等分布,例如每个基因120个位点(每个探针3个位点,每个基因40个探针),条形码的10个值中的每一个存在12次。这提供了冗余,使得即使只有一小部分一级探针与靶rna杂交,也可以检测条形码的每个值。根据标准程序将所有探针同时杂交至生物样品。信号在10轮chcr中扩增,每个循环检测20个标记物中的两个。在每次hcr扩增和成像后,样品用硝酸银处理,化学切割hcr聚合物的主链,其用桥接硫硫代磷酸酯修饰物修饰,使hcr聚合物片段化,并从样品中洗去片段,使得在chcr循环之间没有荧光信号。
使用具有一种颜色的八个hcr循环的指数rna条码化的实例:针对100个基因中的每一个设计40个smrna鱼探针的集(例如使用生物研究技术公司,stellarisrnafish探针设计器工具)。每个基因被分配一个唯一的8位二进制条形码(例如01110010)。根据基因条形码,smrna鱼探针在5′或3′末端用hcr引发序列i1(=0)或i2(=1)标记(choi等,acsnano8.5:4284-4294,2014),对应于条形码的一个位。合成总共八个探针库,对应于八个hcr循环,其中探针集靶向每个集合内的每个基因,其含有对应于条形码的1-8位的引发序列。根据标准程序将探针在8个循环中与生物样品连续杂交,并且通过dnahcr集合h1和h2扩增的信号,其各自用另外的柄修饰。在每次hcr扩增后,连续地将与两种hcr聚合物物质中的每一种的柄互补的荧光chcr步骤d探针与样品杂交并成像,仅使用单个荧光部分检测信号“i1”hcr聚合物和“i2”hcr聚合物(条形码值分别为0和1)。该信号在循环之间是叠加的,但是从第二步骤器件检测到的信号计算减去来自聚合物“i1”的信号,以产生对应于“i2”hcr聚合物的新虚拟信号。检测后,用dna酶混合物处理样品以除去结合的ish探针,hcr引发序列和hcr聚合物,将其从样品中除去。100个条形码被分配在255条形码空间(28-1)内,以最大化条形码之间的汉明(hamming)距离,作为错误检测的一种形式。
线性蛋白质条码化的实例:从例如西格玛公司(sigma)购买8种一级抗体,来自两种宿主生物的各四种,靶向八种蛋白质靶标。购买已经与生物素偶联的能够识别两种一抗物质的免疫球蛋白但不交叉反应的两种二抗,使得含有hcr引发序列i1和i2的两种链霉抗生物素蛋白修饰的dna寡核苷酸可以分别与二抗偶联。一抗和二抗染色成对进行,每个染色包含每个原始生物体中的一个,并且通过两个正交,独立和光谱不同的dnahcr集合h1和h2扩增信号。在每次hcr扩增和成像后,用甲酰胺处理样品,其破坏抗体和表位之间的相互作用,使得抗体和引发剂在每一轮之间被洗去。(经过四个循环后,使用了所有8种抗体。)
循环hcr实验的实施示例方案
用循环hcr读数的rna原位杂交
1.准备用于rna原位杂交的生物样品
a.在玻璃底(mattek)培养皿上以30-80%汇合铺板成纤维细胞
b.培养细胞至少12小时以便附着
c.加入4℃的含4%pfa的pbs+1xrna酶抑制剂中,例如,2mm氧钒核糖核苷复合物(vrc)
d.在37℃孵育10分钟
e.为了淬灭固定,加入含100mm甘氨酸的pbs+rna酶抑制剂,例如,2mmvrc
f.在24℃孵育5分钟
g.用不含rna酶的1xpbs和rna酶抑制剂,例如2mmvrc洗涤1x持续1分钟
h.用含0.1%曲通-x的不含rna酶的1xpbs+rna酶抑制剂,例如,2mmvrc对细胞进行透化30分钟
i.用不含rna酶的1xpbs与rna酶抑制剂,例如,2mmvrc洗涤两次,每次1分钟
j.加入预杂交缓冲液2x达氏溶液+1x不含rna酶的pbs+rna酶抑制剂,例如,2mmvrc
k.孵育5分钟
1.在200ul杂交缓冲液(1ml配方)中加入2nmolrnaish探针集合:
i.100ul20xssc
ii.300ul甲酰胺
iii.10ulrna酶抑制剂,例如vrc
iv.40ul50x达氏溶液(最终2x)
v.200ul50%聚丙烯酸(钠盐)mw1000
vi.350ulh2o
m.37℃下杂交36小时
2.准备用于循环hcr的样品和hcr试剂
a.在含有0.1%吐温-20(sasct)的2x醋酸钠柠檬酸钠缓冲液中洗涤样品5次,每次5分钟
b.通过在10ul5xsasc中快速冷却(在95℃加热90秒并在台式上冷却至室温30分钟),每次hcr循环制备30pmol每种发夹,用du碱基掺入改性。
c.通过将所有快速冷却的发夹添加到每个hcr循环的200μl的5xsasct的体积中来制备发夹溶液。
3.对于每个hcr循环,通过正向步骤b和反向步骤b和c的机制的循环hcr:
a.通过在2xssc+30%甲酰胺+2mmvrc中加入2.5um浓度的每种接头链,使用桥接硫代磷酸酯修饰的接头链的循环子集在37℃下杂交30分钟
b.在2xssct中洗涤5次,每次5分钟。
c.向样品中加入发夹溶液,在室温下孵育30分钟至16小时。
d.在2xssct中洗涤5次,每次5分钟。
e.对样品成像
f.按照neb规范添加user反应,并在37℃下孵育30分钟以降解hcr聚合物
g.加入硝酸银至50mm终浓度,以从接头探针上切下引发剂
h.在2xssct中洗涤3次,每次5分钟。
i.重复3直到已使用所有接头链子集。
用循环hcr读数的dna原位杂交
1.准备用于rna原位杂交的生物样品
a.在玻璃底(mattek)培养皿上以30-80%汇合铺板成纤维细胞
b.培养细胞至少12小时以便附着
c.加入4℃的含4%pfa的1x无dna酶的pbs
d.在37℃孵育10分钟
e.为了猝灭固定,加入含100mm甘氨酸的1x不含dna酶的pbs
f.在24℃孵育5分钟
g.用不含dna酶的1xpbs洗涤1次持续1分钟
h.用含0.1%曲通-x的不含dna酶的1xpbs使细胞透化
i.用不含dna酶的1xpbs洗涤两次,每次1分钟
i.用2xssct+50%甲酰胺洗涤两次
k.按照oligopaints制备杂交主混合物(beliveau,brianj.,nicholasapostolopoulos,和chao-tingwu,用oligopaintfish探针可视化基因组(visualizinggenomeswitholigopaintfishprobes),currentprotocolsinmolecularbiology(2014):14-23,通过引用纳入本文),使用oligopaint设计,使得每个基因组基因座使用来自20个正交和独立hcr系统集的5个hcr信号进行条码化,用四种不同的荧光颜色检测,设计用于5个循环读出4个hcr聚合物集。将构成基因座条形码的5个hcr引发序列添加到oligopaints的3′和5′非基因组杂交臂或柄中。
1.将样品载玻片在2xssct+50%甲酰胺中于92℃加热2.5分钟。
m.添加oligopaint探针(20-30pmol的oligopaint探针通常足以在固定的组织培养细胞中产生强染色;组织切片和整个组织推荐多10倍的探针)在能够覆盖样品的最小体积杂交主混合物中,在42℃下在加热的加湿培养箱中孵育超过14小时。
2.准备用于循环hcr的样品和hcr试剂
a.用2xssct洗涤样品,然后在60℃下孵育15分钟。
b.用0.2xssc洗涤样品四次,每次5分钟。
c.通过在10ul5xsasc中快速冷却制备30pmol的各发夹(在95℃加热90秒并在台上冷却至室温30分钟)。用延伸的柄修饰hcr发夹,通过杂交测序进行询问,例如通过杂交荧光探针,使得每个独立和正交的hcr系统具有独特且正交的25碱基杂交位点。杂交位点可以通过计算机设计为相互正交且与hcr系统正交,从而防止跨物种杂交,如通过使用计算机dna设计工具。
d.通过将所有快速冷却的发夹添加到每循环hcr的200μl的5xsasct的体积中来制备发夹溶液。
e.将所有20个hcr集的发夹溶液加入样品中,并在室温下孵育30分钟至16小时。
f.在2xsasct中洗涤5次,每次5分钟。
3.通过每个hcr循环的正向和反向步骤d的机制的循环hcr:
a.对于每个hcr读出循环,将四个探针(每个探针与光谱上不同的荧光团偶联)与中间体3′硫醇-di碱基杂交,在室温下在2xsasct中以2.5um浓度添加探针10分钟
b.在0.2xsasct中洗涤4次,每次5分钟
c.成像
d.加入硝酸银至终浓度为50mm,以从与hcr聚合物的柄杂交的dna链切去荧光团
e.在0.2xsasct中洗涤4次,每次5分钟
指数条码化的其他实施方式
如图17所示,其描绘了根据本公开内容的方法的指数条码化的实例,rna或dna分子被靶向并与多个互补探针杂交,每个探针具有三个3′和5′柄基序中的一个。每个探针含有四个接头结构域,每个接头结构域包含有关hcr和hcr引发剂循环的组合信息。将接头与引入引发序列的信息承载结构域退火,所述引发序列用于产生hcr扩增子和相应的荧光信号。在成像之后,使用所描述的任何方法重置信号,并执行下一个循环。仅使用四个正交,独立,光谱不同的hcr系统通过4n正交接头结构域产生超过1600万个独特条形码(412)。
如图18所示,其描绘了根据本发明的指数条码化探针设计方法的实例,在探针集的一种设计中,其中每个探针包含针对靶rna或dna分子的靶向杂交的区域,以及信息-携带探针序列,其含有关于hcr(n)和hcr探针集(k)的循环的组合成对信息。这里的信息承载探针长25个碱基。所有探针集均使用4个正交hcr探针集设计用于5个hcr循环,需要20个正交信息承载探针集并给出1024种可能的条形码。在每个hcr循环中,向样品中加入四个步骤b探针,其与一级探针的“标记物”基序杂交,将hcr引发剂与一级探针连接。hcr用于扩增和检测荧光信号。
如图15所示,其描绘了根据本发明的指数条码化方法的实例,在第一个hcr循环中,添加了三个步骤b探针,通过步骤b探针基序“标记物x”将携带信息的一级探针序列与hcr引发剂连接,该基序包含关于hcr循环和将产生放大的荧光聚合物的正交和光谱可区分的hcr系统的组合信息。hcr用于读出荧光信号。如图15a所示,组合的有序荧光信号集可以由每个靶分子处的多个探针产生,其中每个一级探针仅包含条形码的一部分,即通过一级探针的结合特异性地检测的靶分析物中原始信息的标识符。如图15b所示,组合的有序荧光信号集可以由每个靶分子处的单个探针产生,其中一级探针包含整个条形码。
修饰的hcr试剂的合成方法
根据配置,可能有许多可能的hcr探针集设计。这些探针通常具有一个或多个亚稳态hcr单体的正交集的特征,例如能够进行hcr的发夹。hcr发夹本身可以通过化学dna合成以及酶促合成产生。引入了诸如荧光标记和用于以编程方式生成和重置荧光信号的化学物质的其他特征。
图20中显示了根据本发明的用于合成多重hcr单体或发夹的方法的示意图。
hcr标记策略i和ii
图21涉及根据本公开内容的方法的hcr标记策略i。通过化学合成或化学合成然后dna聚合酶链延伸产生dsdna模板。dsdna模板含有hcr单体或发夹的序列,以及任何其他序列,例如用于荧光探针杂交或粘性末端链置换的柄。dsdna模板含有rna聚合酶启动子,例如t7rna聚合酶启动子序列。还可以通过聚丙烯酰胺凝胶电泳(page)纯化dsdna模板。dsdna模板用于通过体外转录(ivt)产生rna分子。可以从dsdna模板中纯化rna。rna分子用作反转录(rt)的模板以产生互补的ssdna分子。rna被降解和/或ssdna被纯化并折叠成亚稳态发夹。hcr发夹以多种方式被荧光标记,例如通过末端脱氧转移酶反应以添加一个或多个末端荧光修饰的dna碱基。rt引物含有一个或多个荧光团,其掺入所得的ssdna分子中。在反转录期间将荧光dna碱基掺入ssdna分子中。或者,在hcr分子中添加额外的序列,如在反转录期间,其使用本领域技术人员已知的方法用作通过杂交测序(sbh),通过合成测序(sbs)或通过连接测序(sbl)荧光标记的位点。
图22涉及根据本发明的方法的hcr标记策略ii。通过dna聚合酶延伸随后λ核酸外切酶消化dna链之一,留下ssdna分子,其可以通过page纯化并折叠成hcr发夹产生ssdna发夹。hcr发夹以多种方式被荧光标记,例如通过末端脱氧转移酶反应以添加一个或多个末端荧光修饰的dna碱基。保护免受核酸外切酶消化的dna链可含有一个或多个荧光团。在聚合酶延伸期间将荧光dna碱基掺入ssdna分子中。或者,在反转录期间向hcr分子添加额外的序列,其用作通过杂交测序(sbh),通过合成测序(sbs)或通过连接测序(sbl)的荧光标记的位点。
表1.示例性fish探针集
(用于针对黑腹果蝇基因rnapii的循环hcr的探针集)
表1包含dnaish探针集,其使用步骤b靶向chcr的mrna果蝇基因rnapii。标记物id(步骤b探针基序)是指与还含有hcr引发剂的步骤b探针互补的柄序列。每个序列中带下划线的“tat”序列用作与靶mrna互补的区域(以小写字母显示)和与步骤b探针互补的区域(以大写字母显示)之间的间隔区。该基因的条形码由标记物集[0,4,8,12,16]确定,它们通过chcr转换成有序荧光信号集,其中标记物和hcr信号之间的关系由步骤b探针确定,它将一级探针功能性地连接到hcr引发剂。
表2.示例性接头集
(在rnapii探针和hcr引发剂之间的可切割接头集)
表2包含对应于多个一级探针的步骤b探针序列,包括表1中列出的靶向rnapii的一级探针。“标记物id”列指的是与一级探针互补的步骤b探针序列基序,并编码chcr循环和hcr信号有关的信息。“hcr系统”指的是四个正交hcr系统中与每个标记物id相关联的系统。“步骤b探针序列”是指结合一级探针的步骤b探针的序列,其是每个标记物的一级探针中包含的序列的反向互补物。“间隔子”是设计用于空间隔离探针b序列的区域的短序列,所述探针b序列负责将一级探针与含有hcr引发剂的区域结合。hcr引发序列见表3。“接头寡核苷酸序列”栏目包含以小写字母显示的对应于该寡核苷酸的hcr系统的hcr引发序列,以下划线显示的与间隔序列结合,与以大写字母显示的与步骤b探针序列结合。x表示含有桥连硫代磷酸酯键的5′硫醇-di修饰的碱基,其可以使用硝酸银溶液切割。
表3.示例性hcr引发序列
表4.示例性修饰的hcr发夹
(使用酶促和化学切割的可切割hcr发夹的序列)
许多修饰的hcr发夹序列设计用于酶促或化学切割。键值(key)包含寡核苷酸序列中包含的修饰序列的参考。
表5.hcr聚合物的可编程荧光标记的示例性序列
用大写字母显示将针对hcr聚合物的荧光探针的sbh柄序列,用于将荧光信号与hcr聚合物可编程地关联。负责hcr聚合的序列以小写字母显示。还显示了可切割的步骤d探针,其中步骤d探针可以与hcr聚合物杂交以使荧光与聚合物相关联,并且在检测之后,可以添加硝酸银以从步骤d探针切去荧光染料,使hcr聚合物返回非荧光状态。
在本申请中引用的所有参考文献,专利和公开的专利申请的内容为了所有目的通过引用整体并入本文。
等同物
其他实施例对于本领域技术人员来说是显而易见的。应该理解的是,前面的描述仅是为了清楚起见而提供的,并且仅仅是示例性的。本发明的精神和范围不限于上述示例,而是包含在权利要求中。以上引用的所有出版物,专利和专利申请均出于所有目的通过引用整体并入本文,其程度如同每个单独的出版物或专利申请被具体指出通过引用并入。
- 还没有人留言评论。精彩留言会获得点赞!