EGFR结合分子的制作方法
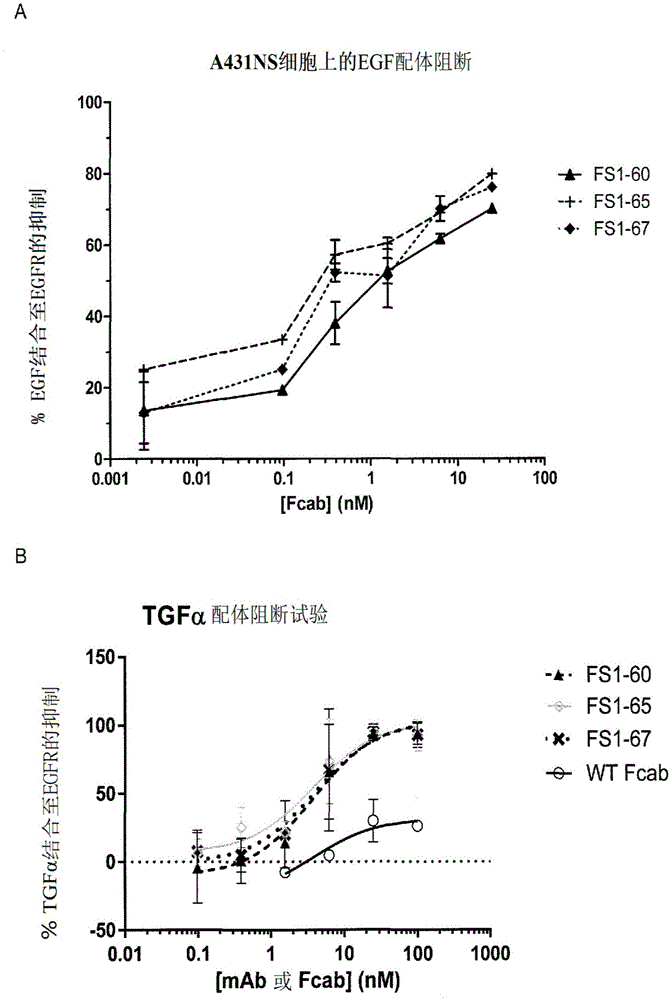
本案要求来自2016年7月19日提交的gb1612520.5的优先权,所述文献的内容因而通过引用的方式完整并入本文。本发明涉及结合人表皮生长因子受体(egfr)的特异性结合成员。特异性结合成员优选地包括egfr抗原结合位点,其可以位于特异性结合成员的ch3结构域的两个或更多个结构性环中。本发明的特异性结合成员用于治疗表达egfr的癌症。
背景技术:
:表皮生长因子受体(egfr;也称作erbb-1和her1)是胞外蛋白质配体的表皮生长因子家族(egf-家族)成员的细胞表面受体。egfr是具有单次跨膜区和旁侧有非催化性调节区的胞质酪氨酸激酶结构域的大型、单聚糖蛋白。序列分析已经显示,胞外结构域(ectodomain)含有四个亚结构域,称作l1、cr1、l2和cr2,其中l和cr是分别大型和cys丰富的首字母缩写词。l1结构域和l2结构域还已经分别称作结构域i和结构域iii。cr结构域先前已经称作结构域ii和结构域iv,或称作s1.1-s1.3和s2.1-s2.3,其中s是小的缩写。已知表达egfr的癌症包括肺癌(例如,非小细胞肺癌[nsclc])(pao等人,2010;amm等人,2005)、多形性胶质母细胞瘤(taylor等人,2102)、皮肤癌(例如,皮肤鳞状细胞癌)(uribe等人,2011)、头颈癌(如头颈鳞状细胞癌[hnscc])(zimmermann等人,2006;smilek等人,2012)、乳腺癌(masuda等人,2013)、胃癌(胃癌)(terashima等人,2012)、结直肠癌(crc)(spano等人,2005;saletti等人,2015)、卵巢癌(hudson等人,2009)、胰腺癌(troiani等人,2012)或子宫内膜癌(scambia等人,1994)。已经描述了针对egfr的胞外结构域的单克隆抗体。这些抗体破坏配体与egfr结合及后续的信号转导。mabc225(erbitux/西妥昔单抗(cetuximab))是一种嵌合igg1抗体,其与egfr的胞外结构域结合并与egf竞争结合至egfr,因而抑制下游途径信号传导并阻断肿瘤细胞的增殖(voigt等人,2012)。西妥昔单抗经fda批准用于治疗头颈癌、尤其与放射疗法组合治疗局部或区域性晚期头颈鳞状细胞癌、与采用5-fu的铂基疗法组合治疗复发性局部疾病或转移性头颈鳞状细胞癌,和铂基治疗后复发性或转移性头颈鳞状细胞癌进展。西妥昔单抗也经fda批准用于治疗、尤其作为一线治疗与folfiri组合、或与伊立替康(irinotecan)组合在抵抗基于伊立替康的化疗的患者中用于治疗如借助fda批准的检验所确定的表达kras突变阴性(野生型)egfr的转移性结直肠癌,以及用于治疗基于奥沙利铂(oxaliplatin)和基于伊立替康的化疗已经失败的患者或不耐受伊立替康作为单一药物的患者。abx-egf(vectibix/帕尼单抗(panitumumab))是人igg2抗体,其类似于西妥昔单抗,与egfr的胞外结构域结合并与egf竞争结合于egfr,因而抑制下游途径信号传导并阻断肿瘤细胞的增殖(voigt等人,2012)。帕尼单抗是由fda批准作为一线治疗与folfox组合,或在含有氟嘧啶、含有奥沙利铂和含有伊立替康的化疗先期治疗(priortreatment)后疾病进展之后作为单药疗法(monotherapy),用于治疗如借助fda批准的检验所确定的野生型kras(外显子2的密码子12或13中)转移性结直肠癌(mcrc)患者。妥珠单抗(necitumumab)(耐昔妥珠单抗(portrazza))是另一种结合egfr的抗体并且在2015经fda批准与吉西他滨(gemcitabine)和顺铂联用,用于一线治疗转移性鳞状非小细胞肺癌患者。尼妥珠单抗(nimotuzumab)(先前称作h-r3)是在众多国家中入选临床试验的与egfr的胞外区结合的人源化igg1抗体。尼妥珠单抗已在印度、古巴、阿根廷、哥伦比亚、科特迪瓦(象牙海岸(ivorycoast))、加蓬、乌克兰、秘鲁和斯里兰卡经批准用于治疗头颈部鳞状细胞癌;以及在古巴、阿根廷、菲律宾和乌克兰经批准用于治疗胶质瘤(儿童和成人);和在中国经批准用于治疗鼻咽癌(ramakrishn等人,2009)。已经启动对靶向egfr的其他抗体(包括扎鲁妥珠单抗(zalutuzumab)(humax-egfr)和马妥珠单抗(matuzumab)(前称emd72000))的临床检验,但是这些抗体尚未授予监管批准,并且开发因此停止。egfr的多种小分子抑制剂也已经批准用于治疗癌症,包括厄洛替尼(erlotinib)(tarceva)和吉非替尼(gefitinib)(iressa)。尽管在治疗癌症时靶向egfr的单一药物疗法已取得某种成功,许多肿瘤在治疗后获得单药疗法抗性。已经将肿瘤细胞表面上egfr和其他分子之间的交互作用确定为这些肿瘤籍此变得抵抗治疗的潜在机理。例如,已经在众多肿瘤类型(包括胶质母细胞瘤、nsclc、结直肠癌和胃癌)中发现egfr-c-met交互作用,从而导致肿瘤对靶向egfr的单一药物疗法(single-agenttherapies)的逃逸机制。由于hgf/c-met信号传导增加可能限制egfr途径抑制作用的效果,这已经与靶向egfr的药物的获得性抗性关联。对两种受体的活性的扰动表明它们的信号传导是高度和动态互联的(castoldi等人,2013)。c-met(人类中的met受体、hgfr、c-met)是在许多肿瘤细胞(包括还表达egfr的那些)的表面上发现的受体酪氨酸激酶(rtk)。肝细胞生长因子(hgf),也称作扩散因子(sf),是c-met的唯一已知配体。hgf由间充质细胞分泌,并在主要为上皮来源的细胞上通过细胞表面上其受体c-met充当多功能细胞因子。它作为单一无活性多肽分泌并由丝氨酸蛋白酶剪切成二硫键连接的69kdaα链和34kdaβ链,以产生异二聚活性分子(naldini等人,1992)。hgf具有针对c-met的高亲和结合位点和针对硫酸肝素蛋白聚糖的低亲和结合位点。hgf在血管生成中发挥作用并在众多细胞和组织类型中促进细胞增殖、存活、运动性、分散分化和形态发生(organ等人,2011)。hgf与其受体c-met的结合诱导c-met发生同型二聚化及酪氨酸磷酸化,导致其活化和许多rtk常见的下游信号传导。在体内,c-met/hgf信号传导途径在神经诱导、肝脏再生、伤口血管生成、生长、侵入、形态学分化和正常胚胎发育中发挥作用。c-met/hgf途径还在癌症中通过激活关键致瘤途径(包括ras、pi3k、stat-3和β联蛋白(catenin))来发挥重要作用。已经证实借助这条途径的异常信号传导涉及肿瘤发生,尤其涉及浸润性和转移性癌表型的形成。最常见地在胶质瘤、骨肉瘤、胰腺癌和胃癌中见到c-met的自分泌刺激(stone等人,2014)。已经在临床测试了通过与c-met以及其他rtk结合来影响c-met途径的小分子激酶抑制剂。卡巴替尼(cobazantinib)和克唑替尼(crizotinib)已经获得fda批准,而在临床受检的其他药物包括替瓦替尼(tivatinib)和埃替尼(etinib)。与c-met或hgf结合的抗体也已经接受临床检验,包括奥纳妥珠单抗(metmab)。奥纳妥珠单抗(onartuzumab)是阻断hgf与c-met结合的抗c-met人源化单价单克隆抗体。阻断hgf与c-met结合的抗hgf抗体也已经在临床试验中受检,并且包括雷莫芦单抗(rilotumumab)、芬克拉妥珠单抗(ficlatuzumab)和hul2g7。但是,这些抗体均尚未获得批准临床使用。雷莫芦单抗(前称amg102)是结合于hgf并中和hgf,从而阻断它与c-met结合的全人igg2单克隆抗体。与仅给予化疗的患者相比,在雷莫芦单抗+化疗(表柔比星(epirubicin)、顺铂和卡培他滨(capecitabine)(ecx))治疗的患者中观察到总生存期显著更差及毒性更差,从而导致患者死亡例增加后,晚期胃癌中雷莫芦单抗的临床试验中断。芬克拉妥珠单抗(前称av-299)是人源化igg1单克隆抗体,其与hgf结合并且与雷莫芦单抗类似,中和与c-met的结合作用。在复发性/转移性hnscc患者中评价芬克拉妥珠单抗与西妥昔单抗组合的临床试验正在进行。此外,还在患有先前未治疗的转移性egfr突变型非小细胞肺癌(nsclc)并具有bdx004阳性标记物的患者中研究芬克拉妥珠单抗+厄洛替尼的治疗。复发性和难治性急性髓性白血病患者中芬克拉妥珠单抗与高剂量阿糖胞苷组合的临床检验也正在进行中。评价芬克拉妥珠单抗、顺铂和调强放疗法(imrt)的研究已经暂停。在患有先前未治疗的肺腺癌(具有或没有egfr突变)的亚洲患者中吉非替尼(geftinib)单一或联用芬克拉妥珠单抗的随机ii期研究未能展示改善的总生存期或无进展生存期。hul2g7(前称tak-701)是有效中和hgf并在i期研究中对晚期非血液学恶性病检验过的人源化单克隆抗体,但是似乎并未推进到进一步开发。wo2006/072620、wo2009/132876、wo2009/000006和ep2546268中描述特异性结合成员的制备,所述特异性结合成员包含经工程化成抗体结构域(如抗体恒定结构域或可变结构域)的一个或多个结构性环的抗原结合位点。技术实现要素:如上文解释,临床上使用靶向egfr的单一药物疗法有限,原因在于形成获得性抗性和肿瘤后续复发、以及同时靶向egfr和hgf的联合疗法迄今尚未批准临床使用的事实。因此需要同时抑制egfr信号传导途径和c-met信号传导途径的治疗剂,以阻断交互作用并改善靶向egfr的疗法的疗效。通过广泛筛选和亲和力成熟程序,本发明人能够鉴定出在分子的ch3结构域中包含对egfr特异的结合位点的三种特异性结合成员。可以将这些特异性结合成员有利地并入具有基于cdr的对第二肿瘤相关抗原特异的结合位点的抗体分子中,以向特异性结合成员提供强力抗肿瘤作用。已经随已知的抗egfr疗法观察到皮肤毒性,例如导致皮疹和损伤。当并入具有基于cdr的对第二抗原(在这种情况下ctla-4或hgf)特异的结合位点的抗体分子时,发现与仅特异性结合成员治疗的小鼠中观察到的皮肤毒性相比,在小鼠中特异性结合成员有利地激发更少的皮肤毒性(参见实施例18)。因此,在第一方面,本发明提供特异性结合成员(specificbindingmember),其与egfr结合并且包含位于特异性结合成员的ch3结构域中的egfr抗原结合位点。egfr抗原结合位点优选地包含或含有氨基酸序列:(i)ldeggp(seqidno:1)和shwrwys(seqidno:3);(ii)ldeggp(seqidno:1)和sywrwvk(seqidno:8);或(iii)tddgp(seqidno:13)和sywrwyk(seqidno:14)。例如,egfr抗原结合位点可以位于特异性结合成员的ch3结构域的结构性环区域中,其中结构性环区域优选地包含两个或更多个结构性环,并且其中egfr抗原结合位点优选地包含以下氨基酸序列:(i)ldeggp(seqidno:1)和shwrwys(seqidno:3);(ii)ldeggp(seqidno:1)和sywrwvk(seqidno:8);或(iii)tddgp(seqidno:13)和sywrwyk(seqidno:14)。作为又一个示例,可以将egfr抗原结合位点工程化入特异性结合成员的ch3结构域的两个或更个种结构性环,其中egfr抗原结合位点优选地包含以下氨基酸序列:(i)ldeggp(seqidno:1)和shwrwys(seqidno:3);(ii)ldeggp(seqidno:1)和sywrwvk(seqidno:8);或(iii)tddgp(seqidno:13)和sywrwyk(seqidno:14)。seqidno:1和13所示的氨基酸序列优选地位于特异性结合成员的ch3结构域的第一结构性环中,并且seqidno:3、8和14所示的氨基酸序列在优选地位于ch3结构域的第二结构性环中。如上文提到,egfr抗原结合位点的序列优选地位于特异性结合成员的ch3结构域的两个或更多个结构性环中。在一个优选实施方案中,egfr抗原结合位点含有或包含:(i)ch3结构域的ab环中seqidno:1所示的氨基酸序列,和/或ef环中seqidno:3所示的氨基酸序列;(ii)ch3结构域的ab环中seqidno:1所示的氨基酸序列,和/或ef环中seqidno:8所示的氨基酸序列;或(iii)ch3结构域的ab环中seqidno:13所示的氨基酸序列,和/或ef环中seqidno:14所示的氨基酸序列。更优选地,egfr抗原结合位点包含ch3结构域的ab环中seqidno:1所示的氨基酸序列,和ef环中seqidno:3或seqidno:8所示的氨基酸序列;egfr抗原结合位点优选地还包含氨基酸序列tyg(seqidno:2)。这个序列优选地位于ch3结构域的第三结构性环、更优选地ch3结构域的cd环中。seqidno:1所示的氨基酸序列优选地位于ch3结构域的残基(位置)13.a至18处;seqidno:3所示的氨基酸序列优选地位于特异性结合成员的ch3结构域的残基(位置)92至98处;seqidno:8所示的氨基酸序列优选地位于特异性结合成员的ch3结构域的残基(位置)92至98处;seqidno:13所示的氨基酸序列优选地位于ch3结构域的残基(位置)14至18处;并且seqidno:14所示的氨基酸序列优选地位于ch3结构域的残基(位置)92至98处。seqidno:2所示的氨基酸序列优选地位于特异性结合成员的ch3结构域的残基(位置)44至45.1处。特异性结合成员的残基在本文中根据imgt(immunogenetics)编号方案编号。除seqidno:1所示的氨基酸序列和seqidno:3所示的氨基酸序列之外,特异性结合成员优选地在ch3结构域的残基(位置)88处包含精氨酸。除egfr抗原结合位点的序列之外,不具体地限制特异性结合成员的ch3结构域的序列。优选地,ch3结构域是人免疫球蛋白g结构域,如人igg1、igg2、igg3或igg4ch3结构域,最优选地是人igg1ch3结构域。本领域已知人igg1、igg2、igg3或igg4ch3结构域的序列。在一个优选实施方案中,本发明的特异性结合成员包含seqidno:4、seqidno:9或seqidno:15的ch3结构域。更优选地,本发明的特异性结合成员包含seqidno:4或9的ch3结构域。特异性结合成员还可以包含ch2结构域。ch2结构域优选地位于特异性结合成员的ch3结构域的n末端处,如同人igg分子中那样。特异性结合成员的ch2结构域优选地是人igg1、igg2、igg3或igg4的ch2结构域,更优选地人igg1的ch2结构域。本领域已知人igg结构域的序列。在一个优选实施方案中,特异性结合成员包含具有seqidno:19所示序列的iggch2结构域。本发明的特异性结合成员优选地包含seqidno:6、seqidno:11或seqidno:17所示的ch2和ch3结构域序列。更优选地,本发明的特异性结合成员包含seqidno:6或11所示的ch2和ch3结构域序列。优选地,特异性结合成员在ch2结构域的n末端包含免疫球蛋白铰链区或其部分。免疫球蛋白铰链区优选地具有在seqidno:48所示的序列或其片段,更优选地在seqidno:49所示的序列。本发明的特异性结合成员可以是由两种多肽组成的二聚体,其中每种多肽具有或包含seqidno:6、seqidno:11或seqidno:17、优选地seqidno:6或11所示的ch2和ch3结构域序列,并且其中每种多肽还在ch2结构域的n末端包含免疫球蛋白铰链区或其部分、优选地在seqidno:49所示的免疫球蛋白铰链区。本文中,这些特异性结合成员也分别称作fs1-60、fs1-65、和fs1-67。除ch3结构域中的egfr抗原结合位点之外,本发明的特异性结合成员还可以包含一个或多个额外的抗原-结合位点以产生双特异性或多特异性分子。优选地,特异性结合成员包含基于cdr的抗原结合位点。基于cdr的抗原结合位点发现于天然存在的免疫球蛋白分子的可变区中并且本领域熟知它们的结构。在特异性结合成员包含基于cdr的抗原结合位点时,特异性结合成员优选地是抗体分子。不具体地限制抗体分子,前提是它包含如本文定义的ch3结构域和基于cdr的抗原结合位点。在一个优选实施方案中,抗体分子是人免疫球蛋白g分子,如人igg1、igg2、igg3或igg4分子,更优选地人igg1分子。本领域已知人免疫球蛋白g分子的序列并且向这种分子引入如本文中公开的ch3结构域或ch3结构域序列将不给技术人员带来任何困难。在特异性结合成员包含一个或多个基于cdr的抗原结合位点时,基于cdr的抗原结合位点优选地与作为肿瘤相关抗原的分子结合。肿瘤相关抗原优选地是由表达egfr的癌表达的肿瘤相关抗原。在一个优选实施方案中,肿瘤相关抗原优选地是受体酪氨酸激酶的配体或受体酪氨酸激酶。受体酪氨酸激酶配体优选地是人c-met(肝细胞生长因子受体[hgfr])的配体,最优选地肝细胞生长因子(hgf)的c-met配体。受体酪氨酸激酶优选地是人c-met。在本发明的特异性结合成员还包含一个或多个如本文所述的基于cdr的抗原结合位点,如与hgf结合的基于cdr的抗原结合位点时,相比不包含这种或任何基于cdr的抗原结合位点的特异性结合成员,该特异性结合成员可以在施用至(人类)患者时激发更少的皮肤毒性,如皮疹和损伤。在一个优选实施方案中,特异性结合成员包含对hgf特异的第二抗原结合位点,其中该结合位点包含seqidno:21-26所示的抗体雷莫芦单抗(ri)的互补决定区(cdr)或在seqidno:31-36所示的芬克拉妥珠单抗(fi)的cdr。更优选地,特异性结合成员包含seqidno:29和30所示的抗体雷莫芦单抗的vh和/或vl结构域;或在seqidno:39和40所示的抗体芬克拉妥珠单抗的vh和/或vl结构域。这种特异性结合成员可以包含seqidno:28的轻链序列,或seqidno:38的轻链序列。本发明的特异性结合成员可以包含seqidno:28所示的ri的轻链序列;和/或分别在seqidno:41、43和45所示的ri/fs1-60、ri/fs1-65或ri-fs1-67mab2的重链序列。本发明的特异性结合成员包含seqidno:28所示的ri的轻链序列;和分别在seqidno:41、43和45所示的ri/fs1-60、ri/fs1-65或ri-fs1-67mab2的重链序列。本发明的特异性结合成员可以包含seqidno:38所示的fi的轻链序列;和/或分别在seqidno:42、44和46所示的fi/fs1-60、fi/fs1-65或fi-fs1-67mab2的重链序列。优选地,本发明的特异性结合成员包含seqidno:38所示的fi的轻链序列;和分别在seqidno:42、44和46所示的fi/fs1-60、fi/fs1-65或fi-fs1-67mab2的重链序列。可选地,在特异性结合成员包含对hgf特异的第二抗原结合位点时,该结合位点可以包含美国专利号7,632,926中描述的抗体hul2g7的互补决定区(cdr)。seqidno:62-67中阐述这个hul2g7的cdr。特异性结合成员还可以与免疫系统调节物、细胞毒性分子(cytotoxicmolecule)、放射性同位素或可检测标记物缀合。免疫系统调节物或细胞毒性分子可以是细胞因子。本发明还提供编码本发明特异性结合成员或抗体分子的核酸以及包含这种核酸的载体。还提供包含本发明核酸或载体的重组宿主细胞。这种重组宿主细胞可以用来产生本发明的特异性结合成员。因此,还提供一种产生本发明特异性结合成员或抗体分子的方法,所述方法包括在产生特异性结合成员或抗体分子的条件下培养重组宿主细胞。该方法还可以包括分离和/或纯化特异性结合成员或抗体分子的步骤。本发明的特异性结合成员和抗体预计用于治疗性应用,尤其人体中的治疗性应用,如癌症治疗。因此,还提供是一种药物组合物,其包含本发明的特异性结合成员或抗体分子、和药学可接受赋形剂。本发明还提供本发明的特异性结合成员或抗体分子,其在治疗患者中癌症的方法中使用。还提供是一种治疗患者中癌症的方法,其中该方法包括向患者施用治疗有效量的本发明特异性结合成员或抗体分子。进一步提供根据本发明的特异性结合成员或抗体分子在制造治疗患者中癌症的药物中的用途。附图说明图1a显示抗egfrfcabfs1-60、fs1-65和fs1-67阻断egf配体与a431ns(过量表达egfr的人表皮状腺癌细胞)上的egfr结合。egf与egfr结合作用的抑制百分数针对pbs对照归一化,其中pbs产生0%抑制作用。图1b显示fs1-60、fs1-65和fs1-67阻断tgfα配体与重组egfr/fc结合。tgfα与egfr结合作用的抑制百分数针对pbs对照归一化,其中pbs产生0%抑制作用。图2显示如通过流式细胞术所测量,抗egfrfcabfs1-60、fs1-65和fs1-67与a431ns细胞上的egfr结合。将几何平均荧光结合信号对fcab浓度作图。fcab以浓度依赖性方式与a431ns细胞结合,而wtfcab则否。图3显示抗egfrfcab(fs1-60、fs1-65和fs1-67)、igg1同种型对照、wtfcab和西妥昔单抗对4mbr-5细胞增殖的影响。用针对pbs对照归一化的渐增浓度的抗egfrfcab(fs1-60、fs1-65和fs1-67)处理细胞时,观察到4mbr-5细胞增殖减少。用wtfcab或igg1同种型对照处理并未造成细胞增殖发生任何变化。图3中的brdu信号是相对于fcab浓度归一化的均值和sem。如从图3中所示数据测定的fs1-60、fs1-65、fs1-67和西妥昔单抗的ic50分别是27.41、0.99、7.53和0.13nm。图4显示携带人类患者衍生异种移植(pdx)肿瘤的小鼠中fs1-60、fs1-65、fs1-67、西妥昔单抗和wtfcab的抗肿瘤功效。小鼠在第0、2、4、7、9、11和14天给药,如图4中通过箭头所示。显示接受每种治疗的小鼠中随时间推移的平均绝对肿瘤体积。一周两次取得肿瘤量值。用抗egfrfcab和西妥昔单抗治疗的全部小鼠均显示肿瘤完全消退。在图的右侧显示出现肿瘤复发的小鼠的数目(例如fs1-60治疗的7只小鼠中1只复发)。图5显示以下链的示意图:1.小鼠κ轻链骨架(backbone)中的9d9轻链(seqidno:50)2.9d9m2a重链:小鼠igg2a骨架(ch1-铰链-ch2-ch3)中的9d9vh(seqidno:52)3.9d9h1重链:嵌合小鼠igg2a-人igg1骨架(小鼠igg2ach1–人igg1铰链-ch2-ch3)中的9d9vh(seqidno:54)4.9d9/fs1-67重链:嵌合小鼠igg2a–修饰的人igg1骨架(小鼠igg2ach1–人igg1铰链-ch2-egfrfcabfs1-67ch3)中的9d9vh(seqidno:56)图6显示fi/fs1-60mab2和ri/fs1-60mab2抑制u87mg人原发性胶质母细胞瘤细胞中met(pmet)和信号传导蛋白mapk(pmapk)的磷酸化。用fi/fs1-60、ri/fs1-60、芬克拉妥珠单抗(fi)、雷莫芦单抗(ri)、fs1-60、芬克拉妥珠单抗和fs1-60(fi+fs1-60)组合、雷莫芦单抗和fs1-60(ri+fs1-60)组合、或同种型对照igg1κ(igg)处理细胞。hgf或egf的添加由“+”指示,hgf或egf的不存在由“-”指示。使用gapdh作为内参对照(loadingcontrol)。受hgf和egf二者刺激时,仅mab2分子、和与egfr结合的fcab组合的fi或ri阻断下游信号传导分子mapk和akt的磷酸化。fi/fs1-60和ri/fs1-60能够抑制c-met和egfr的磷酸化。图7显示mab2ri/fs1-60(图7a)和mab2fi/fs1-60(图7b)能够同时与其两种同族抗原(cognateantigen)结合,如通过表面等离子体共振所测量。令mab2流过hgf包被的芯片并且随后注入加his标签的egfr。结合响应(bindingresponse)显示mab2可以同时与hgf和hgfr二者结合。图8显示mab2ri/fs1-60和mab2fi/fs1-60以及fs1-60fcab阻断egf配体与过量表达egfr的mda-mb-468乳腺癌细胞上的egfr结合。与pbs对照相比,显示配体与egfr结合作用的抑制百分数,其中pbs产生0%抑制作用。图9显示mab2fi/fs1-60、ri/fs1-60、fi/fs1-65和ri/fs1-65在不同细胞系中具有抗增殖活性。图9a显示在fi/fs1-60和ri/fs1-60存在下4天后细胞增殖的浓度依赖性减少,但是采用芬克拉妥珠单抗(fi)、雷莫芦单抗(ri)或fs1-60单药疗法、或用fi+fs1-60或ri+fs1-60组合处理时不减少。将处理浓度对活细胞计数百分数(针对pbs对照归一化)作图。图9b显示采用fi/fs1-65的相同测定的重复,并且再次,mab2显示未随单药疗法或fi+fs1-65组合观察到细胞增殖的浓度依赖性减少。图9c显示fi/fs1-65、ri/fs1-65和fi+fs1-65组合还在nci-h596细胞中以浓度依赖性方式抑制hgf和egf引起的细胞增殖,而芬克拉妥珠单抗单药疗法则否。处理浓度对归因于egf和hgf刺激的生长%作图。归因于egf和hgf刺激的生长百分数由点线指示,无配体刺激下的生长百分数也由点线指示。图9d显示fi/fs1-65还在hgf刺激的nci-h1975细胞中以浓度依赖性方式减少细胞增殖,而芬克拉妥珠单抗或fs1-65单药疗法或fi+fs1-65组合则否。将处理浓度对活细胞计数百分数(针对hgf刺激的细胞归一化)作图。图9e显示fi/fs1-60、fi/fs1-65、ri/fs1-65和fi+fs1-65组合在kp4细胞中以浓度依赖性方式减少细胞增殖。fi也抑制细胞增殖,但是程度更低。fs1-65、wtfcab和igg显示很小的影响。将处理浓度对活细胞计数百分数(针对pbs对照归一化)作图。图9f显示在nci-h1975细胞中,fi/fs1-65(300nm)减少hgf引起的细胞增殖,而厄洛替尼、fi或fi+厄洛替尼处理则否。将各成像部位上计数的平均细胞数作图。图9g显示hcc827细胞中hgf的存在赋予厄洛替尼抗性。可以通过厄洛替尼与fi组合减弱这种抗性的影响,但是厄洛替尼+fi/fs1-65组合可能进一步减少为抑制细胞增殖所要求的剂量。将厄洛替尼处理浓度对各成像部位上计数的平均细胞数作图。图10a显示用mab2fi/fs1-60和fi/fs1-65处理egfr阳性细胞系a431ns导致标记的hgf内化。图10a中所示的结果表明随温育时间增加,hgf内化更多。仅hgf组中未观察到时间依赖性内化。图10b显示使用hgf自分泌u87mg细胞的相同测定的重复。用mab2fi/fs1-60和fi/fs1-65处理导致hgf的时间依赖性内化。在mab2处理不存在时检测到hgf内化小幅增加,但速率低得多。图10c显示在采用以下处理温育4天后从u87mg细胞采集的培养基中游离hgf的浓度:pbs对照、人igg1κ(igg)、wtfcab、fs1-65、芬克拉妥珠单抗(fi)、雷莫芦单抗(ri)、fi+fs1-65或ri+fs1-65的组合、mab2fi/fs1-65和mab2ri/fs1-65。与pbs对照相比,fi、ri和这些mab与fs1-65的组合导致培养基中hgf的浓度降低。mab2fi/fs1-65和ri/fs1-65造成hgf浓度更大降低。图11a显示来自hgf自分泌u87mg模型的体内肿瘤响应数据。将每个处理组随时间推移的平均绝对肿瘤体积作图。箭头显示给药天数。一周两次取得肿瘤量值。在抑制肿瘤生长方面,fi/fs1-60和ri/fs1-60mab2优于靶向egfr或hgf的单药疗法。fi/fs1-60还优于靶向egfr和hgf的fi+fs1-60的组合处理。图11b显示来自nsclch596模型的体内肿瘤响应数据。将每个处理组随时间推移的平均绝对肿瘤体积作图。箭头显示给药天数。一周两次取得肿瘤量值。在抑制肿瘤生长方面,fi/fs1-60和fi/fs1-65mab2优于靶向egfr或hgf的单药疗法。图11c显示研究期间来自nsclch596模型的小鼠的存活率。将每个组随时间推移的存活百分数作图。相比用fi+fs1-65组合处理、fs1-65单药疗法的那些小鼠或溶媒组(vehiclegroup),用两种mab2处理的小鼠具有更高的生存率。在fi/fs1-60处理的小鼠组中,全部小鼠在研究结束时均存活。图11d显示在处理后第16天来自全部小鼠的血清检测到的游离hgf的浓度,其针对每只小鼠的肿瘤大小归一化。与溶媒组相比,用fi/fs1-60处理的小鼠显示hgf水平显著降低。图12显示体内研究中抗egfr治疗的皮肤毒性。显示在肿瘤植入后第16天拍摄的来自每个组的代表性小鼠的照片。用小鼠igg2a对照(对照)、fs1-67fcab(抗egfrfcab)、抗ctla-49d9m2a(抗ctla4mab)或9d9-fs1-67mab2(egfr/ctla4mab2)处理小鼠。如与未处理的小鼠、抗ctla4mab处理的小鼠或抗egfr/ctla4mab2处理的小鼠相比,用单一fs1-67处理的小鼠出现明显脱毛和皮肤损伤。与单一fcab处理相比,双特异性mab2导致皮肤毒性降低。图13显示egfrmab24420/fs1-60、4420/fs1-65和4420/fs1-67、西妥昔单抗和4420对照在携带lxfa677pdx肿瘤的小鼠中的抗肿瘤功效。小鼠在第0、2、4、7、9、11和14天给药,如箭头所示。显示接受每种治疗的小鼠中随时间推移的平均绝对肿瘤体积。一周两次取得肿瘤量值。在研究期间,用抗egfrmab2和西妥昔单抗处理的全部动物均显示肿瘤完全消退,不过mab2组中观察到复发。具体实施方式本发明涉及与egfr结合的特异性结合成员。本发明的特异性结合成员包含位于特异性结合成员的恒定结构域中的egfr抗原结合位点。除非上下文另有说明,否则术语“egfr”可以指人egfr和/或鼠egfr(如小鼠egfr)。优选地,术语“egfr”指人egfr。术语“特异性结合成员”描述包括恒定结构域、优选地ch3结构域(其包含egfr抗原结合位点)的免疫球蛋白或其片段。优选地,特异性结合成员包含ch2和ch3结构域,其中ch2或ch3结构域,优选地ch3结构域,包含egfr抗原结合位点。在一个优选实施方案中,特异性结合成员还在ch2结构域的n末端包含免疫球蛋白铰链区或其部分。本文中,这种分子也称作抗原结合fc片段或fcabtm。特异性结合成员可以是部分地或完全地合成产生。如本文所用,术语“特异性结合成员”因此包括特异性结合成员的片段,前提是所述片段包含位于恒定结构域中的egfr抗原结合位点,如ch1、ch2、或ch3结构域、优选地ch3结构域。除非上下文另有说明,否则如本文所用的术语“特异性结合成员”因此等同于“特异性结合成员或其片段”。在一个优选实施方案中,特异性结合成员是抗体分子。术语“抗体分子”涵盖包含egfr抗原结合位点的抗体分子的片段,前提是这类片段包含恒定结构域,如ch1、ch2或ch3结构域、优选地ch3结构域。除非上下另有说明,否则如本文所用的术语“抗体分子”,因此此等同于“抗体分子或其片段”。抗体分子可以是人的或人源化的。抗体分子优选地是单克隆抗体分子。抗体分子的示例是免疫球蛋白同种型,如免疫球蛋白g,及其同种型亚类,如igg1、igg2、igg3和igg4,以及其片段。可以取得单克隆抗体和其他抗体并使用技术重组dna技术产生保留原有抗体的特异性的其他抗体或嵌合分子。这类技术可以包括向不同的免疫球蛋白引入cdr或可变区。例如在ep-a-184187、gb2188638a或ep-a-239400中描述了将一种免疫球蛋白的cdr引入另一种免疫球蛋白。相似技术可以用来向不同的特异性结合成员引入提供egfr抗原结合位点的相关恒定结构域序列或结构性环序列。可选地,产生特异性结合成员的杂交瘤或其他细胞可以接受遗传突变或其他变化,这可能改变或可能不改变产生的特异性结合成员的结合特异性。由于抗体可以按许多方式修饰,所以术语“特异性结合成员”应当解释为涵盖抗体片段、抗体衍生物、功能性等同物和同源物,无论是否为天然或完全或部分地合成。包含ch3结构域的抗体片段的示例是抗体的fc结构域。包含cdr和ch3结构域二者的抗体片段的示例是迷你抗体,其包含与ch3结构域连接的scfv(hu等人(1996),cancerres.,56(13):3055-61)。本发明的特异性结合成员与egfr结合。在这种情况下,结合可以指特异性结合。术语“特异的”可以指这样的情况,其中特异性结合成员将不显示与除其特异性结合配偶物(此处为egfr)之外的分子的任何明显结合。例如,特异性结合成员可以不与her2、her3和/或her4结合。术语“特异性”还适用于对多种抗原携带的特定表位(如egfr上的表位)特异的特异性结合成员,在这种情况下,特异性结合成员将能够与携带该表位的多种抗原结合。本发明的特异性结合成员优选地包含egfr抗原结合位点。egfr抗原结合位点位于特异性结合成员的恒定结构域(如ch1、ch2、ch3或ch4结构域)中。优选地,egfr抗原结合位点位于特异性结合成员的ch3结构域中。egfr结合位点可以包含氨基酸序列ldeggp(seqidno:1)和shwrwys(seqidno:3)。可选地,egfr结合位点可以包含氨基酸序列ldeggp(seqidno:1)和sywrwvk(seqidno:8)。作为又一个备选,egfr结合位点可以包含氨基酸序列tddgp(seqidno:13)和sywrwyk(seqidno:14)。优选地,egfr结合位点包含氨基酸序列(i)ldeggp(seqidno:1)和shwrwys(seqidno:3);或(ii)ldeggp(seqidno:1)和sywrwvk(seqidno:8)。seqidno:1、3、8、13和14所示的氨基酸序列优选地位于特异性结合成员的恒定结构域的结构性环中。例如在wo2006/072620和wo2009/132876中描述了将序列引入抗体恒定结构域的结构性环区域,以产生新的抗原结合部位。恒定结构域的结构性环包括ab环、cd环和ef环。在ch3结构域中,ab环、cd环和ef环位于ch3结构域的残基11-18、43-78和92-101处,其中氨基酸残基根据immunogenetics(imgt)编号方案编号。seqidno:1和13所示的氨基酸序列优选地位于恒定结构域的ab环中。seqidno:3、8和14所示的氨基酸序列优选地位于恒定结构域的ef环中。更优选地,seqidno:1所示的氨基酸序列位于ch3结构域的残基13.a至18处,seqidno:13所示的氨基酸序列位于ch3结构域的残基14至18处,和/或seqidno:3、8和14所示的氨基酸序列位于ch3结构域的残基92至98处,其中氨基酸残基根据imgt编号方案编号。此外,特异性结合成员优选地在特异性结合成员的恒定结构域的结构性环中包含seqidno:2所示的氨基酸序列。结构性环优选地是cd环并且恒定结构域优选地是ch3结构域。seqidno:2所示的氨基酸序列优选地位于特异性结合成员的ch3结构域的残基44至45.1处,其中氨基酸残基根据imgt编号方案编号。本发明的特异性结合成员还可以在ch3结构域的位置88处包含精氨酸残基(r),其中氨基酸残基根据imgt编号方案编号。特别地,在ef结构性环中包含seqidno:3的特异性结合成员优选地还在ch3结构域的位置88处包含精氨酸残基(r)。本发明的特异性结合成员优选地包含来自人igg1、igg2、igg3或igg4的ch3结构域、更优选地人igg1ch3结构域,具有提供egfr抗原结合位点的上述一个或多个结构性环序列。在一个优选实施方案中,本发明的特异性结合成员包含这样的ch3结构域—其包含seqidno:4、9或15所示的序列、具有该序列或由该序列组成;优选地这样的ch3结构域—其包含seqidno:4或9所示的序列、具有该序列或由该序列组成。本发明的特异性结合成员可以包含这样的ch3结构域—其包含seqidno:4、9或15所示的序列、具有该序列或由该序列组成,其中ch3结构域序列还在seqidno:4、9或15中所示序列的直接c末端包含赖氨酸残基(k)。因此,例如,本发明的特异性结合成员可以包含这样的ch3结构域,其包含seqidno:4所示的序列、具有该序列或由该序列组成,具有在seqidno:4中所示序列的c末端具有赖氨酸残基。这种ch3结构域的序列将如下所示:gqprepqvytlppsrdeldeggpvsltclvkgfypsdiavewestygpennykttppvldsdgsfflysrltvshwrwysgnvfscsvmhealhnhytqkslslspgk(seqidno:68)此外,本发明的特异性结合成员可以包含免疫球蛋白g分子的ch2结构域,如igg1、igg2、igg3或igg4分子的ch2结构域。优选地,本发明的特异性结合成员包含igg1分子的ch2结构域。ch2结构域可以具有seqidno:19所示的序列。特异性结合成员的ch2结构域可以包含减少或消除ch2结构域与一种或多种fcγ受体如fcγri、fcγriia、fcγriib、fcγriii和/或与补体结合的突变。人igg的ch2结构域正常情况下与fcγ受体和补体结合并且发明人假定与fcγ受体的结合降低将减少抗体依赖的细胞介导细胞毒性(adcc)和与补体的结合降低将减少特异性结合成员的补体依赖细胞毒性(cdc)活性。减少或消除ch2结构域与一种或多种fcγ受体和补体结合的突变是已知的并且包括bruhns等人(2009)和xu等人(2000)中描述的“lala突变”。因此,特异性结合成员可以包含ch2结构域,其中ch2结构域在ch2结构域的位置4和5处包含丙氨酸残基,其中根据imgt编号方案进行编号。在一个优选实施方案中,本发明的特异性结合成员包含seqidno:6、11或17所示的序列、更优选地seqidno:6或11所示的序列。优选地,特异性结合成员在ch2结构域的n末端包含免疫球蛋白铰链区或其部分。免疫球蛋白铰链区允许二个ch2-ch3结构域序列缔合并形式二聚体。优选地,铰链区或其部分、是人igg1、igg2、igg3或igg4铰链区或其部分。更优选地,铰链区或其部分是igg1铰链区或其部分。seqidno:48中显示人igg1铰链区的序列。seqidno:49中显示可以形成特异性结合成员的部分的合适的截短型铰链区。这个铰链区存在于实施例中测试的fcab分子中,而全长igg1铰链区存在于mab2分子中。因此,特异性结合成员优选地在ch2结构域的n末端包含免疫球蛋白铰链区或其部分,其中铰链区具有seqidno:48或seqidno:49所示的序列、或其中铰链区具有这样的氨基酸序列,其与seqidno:48或49所示的序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性。可选地,特异性结合成员可以在ch2结构域的n末端包含免疫球蛋白铰链区或其部分,其中铰链区包含seqidno:48所示的序列或其片段,其中所述片段包含seqidno:48的至少五个、至少六个、至少七个、至少八个、至少九个、至少十个、至少十一个、至少十二个、至少十三个或至少十四个氨基酸残基。本发明的特异性结合成员可以包含第二抗原结合位点、优选地基于cdr的抗原结合位点。术语“基于cdr的抗原结合位点”指特异性结合成员可变区的由六个cdr残基组成的抗原结合位点。第二抗原结合位点优选地与肿瘤相关抗原结合或对其特异。优选地,肿瘤相关抗原是受体酪氨酸激酶配体或受体酪氨酸激酶。在一个优选实施方案中,受体酪氨酸激酶配体是hgf,并且受体酪氨酸激酶是c-met。最优选地,第二抗原结合位点与hgf结合。本发明的特异性结合成员可以因此抑制hgf/c-met信号传导途径。本领域已知用于确定对hgf/c-met信号传导途径抑制的方法。例如,spiess等人(2013)中描述了合适的方法。针对给定抗原如肿瘤抗原的抗体分子和测定这种抗体分子的cdr序列完全处于技术人员的能力范围内并且本领域已知许多合适的技术。另外,本领域已知针对多种受体酪氨酸激酶配体和受体酪氨酸激酶的抗体,包括cdr序列。因此,技术人员将毫无困难地制备这样的特异性结合成员,其中除如本文所述的egfr抗原结合位点之外,特异性结合成员还包含针对第二抗原(如受体酪氨酸激酶配体或受体酪氨酸激酶)的基于cdr的抗原结合位点。优选地,本发明的特异性结合成员包含抗体雷莫芦单抗或芬克拉妥珠单抗的hcdr3。已知hcdr3在决定抗体分子的特异性方面发挥作用(segal等人,(1974),pnas,71:4298-4302;amit等人,(1986),science,233:747-753;chothia等人,(1987),j.mol.biol.,196:901-917;chothia等人,(1989),nature,342:877-883;caton等人,(1990),j.immunol.,144:1965-1968;sharon等人,(1990a),pnas,87:4814-4817;sharon等人,(1990b),j.immunol.,144:4863-4869;kabat等人,(1991b),j.immunol.,147:1709-1719)。特异性结合成员可以还包含抗体雷莫芦单抗或芬克拉妥珠单抗的hcdr1、hcdr2、lcdr1、lcdr2和/或lcdr3。本领域普通技术人员将毫无困难地测定来自分别在seqidno:29和30以及39和40中所示的抗体雷莫芦单抗或芬克拉妥珠单抗的vh和vl结构域序列的cdr序列。可以例如根据kabat(kabat,e.a.等人(1991))或imgt编号方案测定cdr序列。根据kabat编号方案,分别在seqidno:21、22、23、24、25和26中阐述抗体雷莫芦单抗的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3的序列。根据kabat编号方案,分别在seqidno:31、32、33、34、35和36中阐述抗体芬克拉妥珠单抗的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3的序列。抗体还可以包含抗体雷莫芦单抗或芬克拉妥珠单抗的vh和/或vl结构域。抗体雷莫芦单抗或芬克拉妥珠单抗的vh和vl结构域序列分别在seqidno:29和30以及39和40中显示。在一个优选实施方案中,本发明的特异性结合成员包含(i)针对hgf的基于cdr的抗原结合位点,其包含抗体雷莫芦单抗或芬克拉妥珠单抗的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3序列,和(ii)位于特异性结合成员的ch3结构域中的egfr抗原结合位点,其中egfr结合位点包含seqidno:1、2和3、seqidno:1、2和8或者seqidno:13、2和14所示的氨基酸序列。更优选地,本发明的特异性结合成员包含(i)针对hgf的基于cdr的抗原结合位点,其包含抗体雷莫芦单抗或芬克拉妥珠单抗的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3序列,和(ii)位于特异性结合成员的ch3结构域中的egfr抗原结合位点,其中egfr结合位点包含seqidno:1、2和3或者seqidno:1、2和8所示的氨基酸序列。在一个优选实施方案中,本发明的特异性结合成员包含这样的vh结构域和vl结构域,前述结构域包含分别在seqidno:29和30、或者seqidno:39和40所示的序列、具有该序列或由该序列组成;和这样的ch3结构域,其包含seqidno:4、9或15所示的序列、具有该序列或由该序列组成;优选地这样的ch3,其包含seqidno:4或9所示的序列、具有该序列或由该序列组成。在又一个优选的实施方案中,特异性结合成员包含重链,所述重链包含seqidno:41、43或45所示的序列、具有该序列或由该序列组成,和轻链,所述轻链包含seqidno:28所示的序列、具有该序列或由该序列组成。更优选地,特异性结合成员包含重链,所述重链包含seqidno:41或43所示的序列、具有该序列或由该序列组成,和轻链,所述轻链包含seqidno:28所示的序列、具有该序列或由该序列组成。在可选的优选实施方案中,特异性结合成员包含重链,所述重链包含seqidno:42、44或46所示的序列、具有该序列或由该序列组成,和轻链,所述轻链包含seqidno:38所示的序列、具有该序列或由该序列组成。更优选地,特异性结合成员包含重链,所述重链包含seqidno:42或44所示的序列、具有该序列或由该序列组成,和轻链,所述轻链包含seqidno:38所示的序列、具有该序列或由该序列组成。本发明的特异性结合成员还可以包含本文公开的结构性环、ch3结构域、ch2结构域、ch2和ch3结构域、cdr、vh结构域、vl结构域、轻链或重链序列的变体。可以通过序列改变或突变、和筛选方法获得合适的变体。在一个优选实施方案中,特异性结合成员包含一个或多个变体序列,其保留亲本特异性结合成员的一个或多个功能特征,如针对egfr和/或第二抗原(如hgf)的结合特异性和/或结合亲和力。例如,特异性结合成员包含一个或多个变体序列,其中相比(亲本)特异性结合成员,所述变体序列优选地以相同亲和力或更高亲和力与egfr和/或第二抗原如hgf结合。亲本特异性结合成员是不包含已经并入变异特异性结合成员中的氨基酸置换、缺失和/或插入的特异性结合成员。例如,本发明的特异性结合成员可以包含与本文公开的结构性环、ch3结构域、ch2结构域、ch2和ch3结构域、cdr、vh结构域、vl结构域、轻链或重链序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%、至少99.8%或至少99.9%序列同一性的结构性环、ch3结构域、ch2结构域、ch2和ch3结构域、cdr、vh结构域、vl结构域、轻链或重链序列。在一个优选实施方案中,本发明的特异性结合成员包含与seqidno:4、9或15、更优选地seqidno:4或9所示的ch3结构域序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%、至少99.8%或至少99.9%序列同一性的ch3结构域序列。在又一个优选实施方案中,本发明的特异性结合成员包含与seqidno:6、11或17、更优选地seqidno:6或11所示的ch2和ch3结构域序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%、至少99.8%或至少99.9%序列同一性的ch2和ch3结构域序列。常见地参考算法gap(威斯康辛gcg软件包,accelerysinc,sandiegousa)确定序列同一性。gap使用比对两个完整序列的needlem和wunsch算法,该算法使匹配数最大化并使空位数最小化。通常,使用默认参数,缺口生成罚分=12和空位延伸罚分=4。可以优选使用gap,但是可以使用其他算法,例如blast(其使用altschul等人(1990)j.moi.biol.215:405-410的方法)、fasta(其使用pearson和lipman(1988)pnasusa85:2444-2448的方法)、或smith-waterm算法(smith和waterman(1981)j.moibiol.147:195-197)或上文altschul等人(1990)的tblastn程序,通常使用默认参数。特别地,可以使用psi-blast算法(nucl.acidsres.(1997)253389-3402)。本发明的特异性结合成员还可以包含与本文公开的结构性环、ch3结构域、ch2结构域、ch2和ch3结构域、cdr、vh结构域、vl结构域、轻链或重链的氨基酸序列序列相比,具有一个或多个改变(氨基酸残基添加、缺失、置换和/或插入)、优选地20个或更少改变、15个或更少改变、10个或更少改变、5个或更少改变、4个或更少改变、3个或更少改变、2个或更少改变或1个改变的结构性环、ch3结构域、ch2结构域、ch2和ch3结构域、cdr、vh结构域、vl结构域、轻链或重链序列。特别地,可以在特异性结合成员的一种或多种构架区中做出改变。在一个优选实施方案中,本发明的特异性结合成员可以包含与seqidno:4、9或15、更优选地seqidno:4或9所示的ch3结构域序列相比,具有一个或多个改变(氨基酸残基添加、缺失、置换和/或插入)、优选地20个或更少改变、15个或更少改变、10个或更少改变、5个或更少改变、4个或更少改变、3个或更少改变、2个或更少改变或1个改变的ch3结构域序列。在又一个优选的实施方案中,本发明的特异性结合成员包含与seqidno:6、11和17、更优选地seqidno:6或11所示的ch3和ch2结构域序列相比,具有一个或多个改变(氨基酸残基添加、缺失、置换和/或插入)、优选地20个或更少改变、15个或更少改变、10个或更少改变、5个或更少改变、4个或更少改变、3个或更少改变、2个或更少改变或1个改变的ch3和ch2结构域序列。还构思是这样的特异性结合成员,其与本发明的特异性结合成员竞争结合egfr或者结合于egfr上与本发明的特异性结合成员相同的表位,其中特异性结合成员优选地包含位于特异性结合成员的ch3结构域中的egfr抗原结合位点。本领域已知用于确定两种特异性结合成员对抗原竞争的方法。例如,可以使用表面等离子体共振(例如biacore)确定两种特异性结合成员竞争与抗原结合。类似地本领域已知用于定位抗体结合的表位的方法,并且这些方法可以用来定位本发明的特异性结合成员结合的表位或多个表位。本发明的特异性结合成员优选地以4.5nm的亲和力(kd)或更大亲和力与egfr结合。例如,本发明的特异性结合成员可以按4.5nm、4nm、3.6nm、3.5nm、2.6nm、2.5nm、2nm、1.8nm、1.6nm、1.5nm、1.3nm、1nm、0.7nm的亲和力(kd)或更大亲和力与egfr结合。可以例如通过表面等离子体共振法(spr)确定特异性结合成员对同族抗原(如egfr)的结合亲和力。可以通过流式细胞术确定特异性结合成员对细胞表面上表达的同族抗原(如egfr)的结合亲和力。本发明的特异性结合成员优选地能够与细胞表面上表达的egfr结合。细胞优选地是癌细胞。在特异性结合成员包含对第二抗原特异的第二抗原结合位点,如基于cdr的抗原结合位点时,特异性结合成员优选地能够同时与egfr和第二抗原结合。优选地,特异性结合成员能够同时与egfr和第二抗原结合。本发明的特异性结合成员可以与人egfr和/或鼠egfr(如小鼠egfr)结合。优选地,本发明的特异性结合成员与人egfr结合。本发明的特异性结合成员可以与治疗剂(therapeuticagent)或可检测标记物缀合。在这种情况下,特异性结合成员可以称作缀合物。例如,特异性结合成员可以与免疫系统调节物、细胞毒性分子、放射性同位素或可检测标记物缀合。免疫系统调节物或细胞毒性分子可以是细胞因子。可检测标记物可以是放射性同位素,例如非治疗用放射性同位素。特异性结合成员可以借助肽键或接头与治疗剂或可检测标记物缀合,即处于包含所述治疗剂或可检测标记物、及特异性结合成员或其多肽链组分的融合多肽内。其他缀合手段包括化学缀合法,尤其使用双官能试剂的交联法(例如使用double-reagentstm交联试剂选择指导,pierce)。特异性结合成员、和治疗剂或可检测标记物可以因此彼此直接连接,例如通过任何合适的化学键或通过接头,例如肽接头直接连接。肽接头可以短(2-20个、优选地2-15个残基的氨基酸残基段)。本领域已知肽接头序列的合适示例。可以使用一个或多个不同的接头。接头可以长约5个氨基酸。化学键可以例如是共价键或离子键。共价键的示例包括肽键(酰胺键)和二硫键。例如,特异性结合成员、和治疗剂或诊断剂可以共价连接,例如通过肽键(酰胺键)共价连接。因此,特异性结合成员、和治疗剂或诊断剂可以作为单链多肽产生(分泌)。本发明也提供编码本发明特异性结合成员的分离的核酸。本领域普通技术人员将毫无困难地使用本领域熟知的方法制备这类核酸。分离的核酸可以用来表达本发明的特异性结合成员,例如,通过在细菌、酵母、昆虫或哺乳动物宿主细胞中表达。优选的宿主细胞是哺乳动物细胞如cho、hek或ns0细胞。核酸将通常以用于表达的重组载体的形式提供。分离的核酸可以,例如,包含seqidno:5、7、10、12、16或18所示的序列。包含这类核酸和载体的体外宿主细胞是本发明的组成部分,其表达本发明特异性结合成员的用途也是如此,所述特异性结合成员可以随后从细胞培养物纯化和任选地配制成药物组合物。本发明因此还提供一种产生本发明特异性结合成员的方法,所述方法包括在产生特异性结合成员的条件下培养本发明的重组宿主细胞。本领域熟知用于培养如上文提到的合适宿主细胞的方法。该方法还可以包括分离和/或纯化特异性结合成员。该方法还可以包括将特异性结合成员配制成药物组合物,任选地采用药学可接受赋形剂或如下文描述的其他物质配制。如上文提到,已经证实许多癌在其细胞表面上表达egfr。发明人已经显示,在特异性结合成员的ch3结构域中包含egfr抗原结合位点(即结合egfr的抗原结合位点)的特异性结合成员具有抗肿瘤特性,包括阻断表皮生长因子(efg)与egfr结合的能力,其中已知所述结合过程刺激细胞生长、增殖和分化。向具有已知抗肿瘤作用的抗体并入egfr抗原结合位点产生了抗肿瘤特性比亲本抗体更强(包括肿瘤细胞增殖抑制作用更强)的特异性结合成员。此外,显示在ch3结构域中包含egfr抗原结合位点的特异性结合成员由肿瘤细胞内化。特异性结合成员由肿瘤细胞内化可以提供多个优点。例如,认为egfr随特异性结合成员一起内化。不希望受理论约束、认为egfr内化导致egfr降解,因而减少受体激活,因为其配体将不再能够与受体结合。此外,与特异性结合成员缀合的任何抗肿瘤分子将随特异性结合成员一起内化,预计这例如减少抗肿瘤分子的非特异性毒性。另外,还预计与特异性结合成员的基于cdr的第二抗原结合位点结合的任何可溶性配体(如hgf)随特异性结合成员一起内化并且因此与环境隔绝。特异性结合成员的快速内化还可以导致更快速的初始治疗响应,因而有可能在早期确定患者是否响应于该治疗。因此,本发明提供用于治疗患者中癌症的本发明特异性结合成员,其中所述癌症的细胞表达egfr。还提供是本发明特异性结合成员在制造用于治疗患者中癌症的药物中的用途,其中所述癌症的细胞表达egfr,以及一种治疗患者中癌症的方法,其中所述癌症的细胞表达egfr,并且其中该方法包括向该患者施用的治疗有效量本发明的特异性结合成员。在特异性结合成员包含与hgf或c-met结合的第二抗原结合位点时,用特异性结合成员待治疗的癌症的细胞优选地还分泌hgf和/或表达c-met。患者优选地是人类患者。使用本发明特异性结合成员待治疗的癌症的细胞表达egfr,例如在其细胞表面上表达。在一个实施方案中,可以已经确定待治疗的癌症的细胞表达egfr,例如在其细胞表面上表达。用于确定抗原在细胞表面上表达的方法是本领域已知的并且例如包括流式细胞术。使用本发明特异性结合成员待治疗的癌可以选自:肺癌(例如,非小细胞肺癌)、多形性胶质母细胞瘤、胰腺癌、皮肤癌(例如皮肤鳞状细胞癌)、头颈癌(例如头颈鳞状细胞癌)、乳腺癌、结直肠癌、卵巢癌、胃癌和子宫内膜癌。如本文提到的胃癌包括食管癌,如胃食管癌。已经显示上文提到的全部癌均表达egfr。表达egfr的癌可以称作egfr阳性(egfr+)或称作过量表达egfr。因此,如本文提到的癌可以是egfr阳性的。此外或可选地,如本文提到的癌可以过量表达egfr。可以例如使用免疫组织化学(ihc)确定癌是否为egfr阳性或过量表达egfr。优选地,癌是肺癌、多形性胶质母细胞瘤、胰腺癌、皮肤癌、头颈癌、结直肠癌、胃癌或乳腺癌。更优选地,癌是肺癌、多形性胶质母细胞瘤、胰腺癌、头颈癌或胃癌。最优选地,癌是肺癌、多形性胶质母细胞瘤或胰腺癌。在特异性结合成员是包含对hgf特异的第二抗原结合位点的特异性结合成员时,所述结合位点包含seqidno:21-26所示的抗体雷莫芦单抗的互补决定区(cdr),癌症优选地是胃癌,其中所述癌症的细胞表达egfr。已经在临床对雷莫芦单抗测试治疗胃癌。在特异性结合成员是包含对hgf特异的第二抗原结合位点的特异性结合成员时,所述结合位点包含seqidno:31-36所示的抗体芬克拉妥珠单抗的互补决定区(cdr),癌症优选地是肺癌,最优选地是非小细胞肺癌,其中所述癌症的细胞表达egfr。已经在临床显示芬克拉妥珠单抗适于治疗肺癌、尤其非小细胞肺癌。其中本申请提及特定类型的癌症,如肺癌时,这指相关组织(在这种情况下肺组织)的恶变。源自不同组织(例如乳腺组织)恶变的癌症可以在身体内的另一个位置(如肺)导致转移性病灶,但不因而是如本文提到的肺癌,而是乳腺癌。癌可以是原发性或继发性癌。因此,本发明的特异性结合成员可以在治疗患者中癌症的方法中使用,其中癌是原发性肿瘤和/或肿瘤转移灶。本发明的特异性结合成员旨在用于治疗患者、优选地人类患者的方法中。特异性结合作用成员通常将以药物组合物的形式施用,所述药物组合物可以包含至少一种除特异性结合成员之外的组分,如药学可接受赋形剂。例如,除活性成分之外,本发明的药物组合物可以包含药学可接受赋形剂、载体、缓冲液、稳定剂或本领域技术人员熟知的其他材料。这类材料应当无毒并且不应当干扰活性成分的功效。载体或其他材料的精确性将取决于施用途径,施用途径可以是注射,例如静脉内或皮下注射。特异性结合成员可以静脉内或皮下施用。液态药物组合物通常包含液态载体如水、石油、动物或植物油、矿物油或合成油。可以包含生理盐水溶液、右旋糖或其他糖溶液或二醇类如乙二醇、丙二醇或聚乙二醇。对于静脉内注射或患病部位处注射,特异性结合成员或包含特异性结合成员的药物组合物优选地处于肠胃外可接受的水溶液形式,所述水溶液无热原并具有合适的ph、等渗性和稳定性。例如使用等渗溶媒如氯化钠注射液、ringer注射液、乳酸化ringer注射液,本领域的那些相关技术人员完全能够配制合适的溶液剂。按要求,可以使用防腐剂、稳定剂、缓冲剂、抗氧化剂和/或其他添加物。本领域技术人员已知用于制备药物制剂的许多方法。参见,例如robinson编著,sustainedandcontrolledreleasedrugdeliverysystems,marceldekker,inc.,newyork,1978。可以将包含本发明特异性结合成员的组合物单独施用、或同步或依次与其他治疗组合施用、或作为合并制品与另一种治疗剂或多种治疗剂一起施用,这取决于待治疗的病状。例如,本发明的特异性结合成员可以与用于待治疗疾病(例如如上文提到的癌症)的现有治疗剂组合施用。例如,本发明的特异性结合成员可以与第二抗癌疗法如化疗、放疗法、免疫疗法或激素疗法组合施用至患者。特别地,本发明的特异性结合成员可以与egfr抑制剂如厄洛替尼或西妥昔单抗、优选地厄洛替尼组合施用至患者或用于与之组合施用。可选地,本发明的特异性结合成员可以与结合hgf的抗体分子如芬克拉妥珠单抗或雷莫芦单抗组合施用至患者或用于与之组合施用。一种治疗患者中癌症的方法因此可以包括将治疗有效量的本发明特异性结合成员与化疗剂、放射性核素、免疫治疗剂或激素疗法药物组合施用至患者。化疗剂、放射性核素、免疫治疗剂、或激素疗法药物优选地是用于所讨论癌症的化疗剂、放射性核素、免疫治疗剂、或激素疗法药物,即已经显示有效治疗所讨论癌症的化疗剂、放射性核素、免疫治疗剂或激素疗法药物。选择已经显示对所讨论癌症有效的合适化疗剂、放射性核素、免疫治疗剂或激素疗法药物完全处于熟练执业者的能力范围内。施用可以按“治疗有效量”进行,这量足以对患者显示益处。这种益处可以至少是至少一种症状改善。因此,特定疾病的“治疗”指至少一种症状的改善。施用的实际量和施用速率和时程将取决于正接受治疗的对象的性质和严重程度、正接受治疗的具体患者、个体患者的临床状况、病症原因、组合物递送部位、特异性结合成员的类型、施用方法、施用计划和医疗执业者已知的其他因素。治疗处方,例如对剂量等的决定,属于全科医生和其他医疗医生的责任,并且可以取决于症状严重程度和/或正在接受治疗的疾病的进展情况。本领域熟知特异性结合成员的适宜剂量(ledermann等人(1991)int.j.cancer47:659-664;和bagshawe等人(1991)antibody,immunoconjugatesandradiopharmaceuticals4:915-922)。如果对正在施用的特异性结合成员适宜,则可以使用本文中或在physician'sdeskreference(2003)中所示的具体剂量。可以通过比较动物模型中特异性结合成员的体外活性和体内活性,确定其治疗有效量或合适剂量。已知将小鼠和其他试验动物中有效剂量外推至人类的方法。精确剂量将取决于多种因素,包括待治疗区域的大小和位置及特异性结合成员的精确性质。根据医师的决定,治疗可以按每日、每周两次、每周或每月间距重复。治疗可以术前和/或术后给予,并且可以在外科治疗的解剖部位直接施用或施加。鉴于本公开包括以下实验性范例,本发明的其他方面和实施方案将对本领域技术人员是显而易见的。本说明书中提到的全部文件均通过引用的方式并入本文。在本文使用时,“和/或”应理解为具体公开二个指定特征或组分的每一者,同时公开或未公开另一者。例如“a和/或b”应理解为具体公开(i)a、(ii)b和(iii)a和b的每一者,正如本文中单独提到每一者那样。除非上下文指出,否则对上述特征的描述和定义不限于本发明的任何具体方面或实施方案并且同等地适用于描述的全部方面和实施方案。现在将以举例方式并参考上文描述的附图,说明本发明的某些方面和实施方案。实施例实施例1–抗egfr抗原结合fcs(fcab)的制备如下文描述,通过荧光激活的细胞分选法(facs)从酵母展示fcab文库及通过磁珠捕获法从噬菌体展示fcab文库选择egfr特异性fcab。使用facs从自酵母文库原初选择抗egfrfcabwo2009/132876中描述了用来通过facs从酵母展示fcab文库选择抗原特异性fcab的方法。将酵母细胞表面上表达fcab克隆的文库与300nm生物素酰化的egfr胞外结构域温育。随后将细胞用链霉亲和素-别藻蓝蛋白(apc)(bdbioscience,349024)染色以使用高速细胞分选仪(bdbioscience,facsaria),依据荧光信号分离结合抗原的酵母细胞。将这个选择程序重复几次以富集足够纯的结合抗原的酵母细胞群体。链霉亲和素-apc和抗生物素-apc(miltenyibiotec,130-090-856)交替用于染色以避免非特异性选择。从已富集群体筛选个体克隆的抗原结合作用并且将最有前景的克隆克隆入毕赤酵母(pichia)表达载体ppiczalphaa以遵循供应商的方案(invitrogen,k1740-01)表达可溶性蛋白及表征。从自噬菌体展示fcab文库原初选择抗egfrfcab通过捕获在磁珠上从噬菌体展示fcab文库选择egfr特异性fcab。将含有大约1x1010个噬菌体和200μl链霉亲和素包被磁珠(invitrogen,dyna珠)的噬菌体展示文库单独地在室温(rt)转动下在含2%乳/pbst的1.5ml管中封闭1小时。将封闭的噬菌体展示文库在室温与2%乳/pbst中的1–100nm生物素酰化的egfr温育1小时以进行结合作用选择。通过以下方式捕获封闭的链霉亲和素包被磁珠:将1.5ml管固定在磁力架(dynamag,invitrogen)中,同时移除上清液,随后在生物素酰化的egfr/噬菌体混合物中重悬并温育5分钟。通过磁体捕获珠/egfr/噬菌体复合体并使用1mg/ml胰蛋白酶洗脱10分钟。将洗脱的噬菌体用来感染大肠杆菌tg1感受态细胞(lucigen)并在37℃温育30分钟。将噬菌体感染的tg1细胞铺种在2xyt琼脂上并且随后在37℃在100ml2xyt培养基中过夜培育以扩增。在通过离心移除tg1细胞后,将培养基上清液与peg/nacl按比率4:1混合并在冰上温育1小时以沉淀富集的噬菌体。通过在4℃按4400转/分钟离心30分钟,沉淀噬菌体,并且使其重悬于pbs中。通过重复选择过程几次,将这个富集的噬菌体展示egfr特异性fcab克隆的群体用于进一步富集。通过elisa筛选各个克隆,并且将强烈结合egfr的克隆如上文描述那样克隆入毕赤酵母并表达。选定fcab的亲和力成熟对于亲和力成熟,通过环改组,将序列多样性引入选自酵母和噬菌体展示文库的fcab。通过pcr,使用引物1和2扩增ab_cd环区域,并且使用引物3和4扩增cd_ef环区域。下表1中列出引物序列。表1将ab_cd环区域和cd_ef环区域混合并装配以通过拉通(pull-through)pcr产生新序列组合。将改组的pcr产物连接入噬菌体展示载体fdmyc并通过电穿孔,转化入tb1大肠杆菌细胞。将这个环改组的文库用于如上文所述的噬菌体选择以筛选改进的结合物。在后续的选择和筛选策略中使用从100nm至10nm和1nm递减的抗原浓度以鉴定高亲和力结合物。在毕赤酵母和hek细胞中表达结合亲和力改进的亲和力成熟的egfr特异性各个fcab以表征。使用这种选择策略鉴定的fcab包括fs1-60(seqidno:6)、fs1-65(seqidno:11)和fs1-67(seqidno:17)。这些fcab在ch2结构域的n末端包含分别在seqidno:6、11和17所示的ch2和ch3结构域序列,和seqidno:49中所说的截短的铰链区。实施例2—与egfr特异性结合的egfr特异性fcab酶联免疫吸附测定(elisa)用来确定抗egfrfcab、fs1-60、fs1-65和fs1-67是否与her受体家族中的egfr特异性结合。使用lightning-linktmbiotin试剂盒(innovabiosciences,704-0030)遵循供应商的方案,将包括egfr(自行产生)、her2his标签(sinobiological,10004-h08h)、her3his标签(sinobiological,10201-h08h)和her4his标签(sinobiological,10363-h08h)的抗原生物素酰化。将生物素酰化的抗原在maxisorp平板(nunc)上的不同孔中按pbs中的1μg/ml在4℃包被过夜,并且用pbs洗去过量的未结合的抗原。抗原包被的平板在室温用pbs中的1%tween(pbst)封闭1小时。在移除pbst后,将0.1%pbst中的抗egfrfcab(1μm)和相关的阳性和igg阴性抗体对照(1μm)温育1小时以结合包被的抗原,随后洗涤。相对于her4阳性对照,通过蛋白a-hrp(thermofisher101023)或抗小鼠igg-辣根过氧化物酶(hrp)(sigmaa9044)检测结合的fcab或抗体。使用四甲基联苯胺(tmb)(ebioscience00-4201-56)作为底物与hrp酶相互作用以便比色检测。添加1m硫酸以终止酶-底物反应。在450nm的吸光度读取平板,扣除630nm作为背景。her2的阳性对照曲妥珠单抗(roche)和帕妥珠单抗(genentech)、her3的阳性对照抗体mm121(merrimack)和her4的阳性对照抗her4抗体(r&dsystems,mab11311)与它们的相应抗原结合。抗egfrfcabfs1-60、fs1-65和fs1-67显示与egfr结合但是不与her2、her3或her4结合,从而显示它们对egfr的特异性。实施例3—egfr特异性fcab与egfr上不同于西妥昔单抗的表位结合表面等离子体共振(spr)用来确定egfr特异性fcabfs1-60、fs1-65和fs1-67是否与已知的抗egfr抗体-西妥昔单抗(merck)竞争结合于egfr。biacore3000(gehealthcare)用来确定egfr特异性fcabfs1-60、fs1-65和fs1-67是否可能与经西妥昔单抗(cx)饱和的人egfr包被芯片结合和反之亦然。将链霉亲和素芯片(sa芯片)(gehealthcarebr-1000-32)用200ru的生物素酰化人egfr胞外结构域(ecd)包被。在hbs-p缓冲液中使用20μl/min的流量(gehealthcare)实施实验,并且通过将50mmnaoh按照50μl/min持续12秒流过三次,再生egfr表面。将结合egfr的第一化合物(egfr特异性fcab或西妥昔单抗)按20μl/min注入4分钟,并随后将结合egfr的第二化合物(西妥昔单抗或egfr特异性fcab)注入4分钟(第二次注入在含有第一化合物的混合物中进行,以消除第二次注入期间第一化合物的解离),随后在hbs-p缓冲液中解离。在第一次和第二次注入使用相同化合物(西妥昔单抗,随后西妥昔单抗)进行的情况下,在第二次注入时观察到少许或未观察到附加响应,显示egfr结合表面饱和。表2:fcab与西妥昔单抗竞争结合已固定egfr的biacore响应表2显示与egfr特异性fcab与egfr裸露表面结合的结合响应(36.3-54.2ru)相比,egfr特异性fcab在西妥昔单抗饱和的egfr包被芯片上的结合响应略微减少(22.2-27.4ru),这表明egfr特异性fcab结合至egfr上与西妥昔单抗表位不同、但与之部分重叠的表位。当注入顺序逆转时,也观察到相同的效果:与西妥昔单抗与egfr裸露表面结合的结合响应(39.0-40.5ru)相比,西妥昔单抗在fcab饱和的表面上的结合响应(31.0-35.4ru)略微减少。实施例4-egfr特异性fcab对人和小鼠egfr的结合亲和力使用spr测定egfr特异性fcab对人和小鼠egfr的结合亲和力。为了测量亲和力,使用biacore3000仪(gehealthcare)并将sa芯片用200或1000ru的生物素酰化人(自制)或小鼠(sinobiological)egfr胞外结构域包被。将hbs-p缓冲液(gehealthcare)中系列浓度的fcab(1-1000nm)按20μl/min注入2.5分钟以测量结合速率。随后注入hbs-p缓冲液15分钟以测定解离速率。将50mmnaoh按照50μl/min持续10秒使用两次,再生egfr表面。使用bia评价软件第3.2rc1版(gehealthcare),从1:1(朗格缪尔)拟合模型导出结合亲和力(kd)。结果显示egfr特异性fcab以0.7–6.0nm之间的结合亲和力与人及小鼠egfr结合(参见表3)。表3:egfr特异性fcab对人和小鼠egfr的结合亲和力(kd)fcab人egfrkd(nm)小鼠egfrkd(nm)fs1-602.66.0fs1-650.70.8fs1-671.32.5实施例5-抗egfrfcab的配体阻断活性对抗egfrfcabfs1-60、fs1-65和fs1-67测试阻断配体egf与表达egfr的人表皮状腺癌细胞系a431ns(atcccrl-2592)结合的能力。将a431ns细胞用细胞解离缓冲液(gibco,13151-014)解离20分钟,以避免损伤细胞表面egfr受体。将细胞悬浮于含2%胎牛血清(fbs)(lifetechnologies,10270)的pbs中(流式缓冲液)。将2x105个细胞以100μl铺种在96孔平板中并且随后与多种浓度(0.002-25nm)的fcab一起温育15分钟,使用pbs作为阴性对照。随后将这些细胞与40ng/ml的生物素酰化egf(invitrogen,eb477)在4℃温育1小时,以便与fcab竞争结合至egfr。用流式缓冲液从细胞洗去未结合的fcab或生物素酰化egf。在冰上温育45分钟后,通过链霉亲和素-pe(invitrogen,sa10041)检测与细胞结合的生物素酰化egf,并且在流式细胞仪(bdaccuric6)上读取信号。图1a显示针对pbs对照归一化的egf与egfr结合作用的抑制百分数,其中pbs产生0%抑制作用。结果显示,抗egfrfcab以0.46至0.61nm的ic50阻断egf与egfr结合(参见表4)。这些结果因此显示,fs1-60、fs1-65和fs1-67阻断egf与细胞表面egfr结合。还通过elisa,对抗egfrfcabfs1-60、fs1-65和fs1-67测试阻断配体tgfα与重组egfr/fc结合的能力。将tgfα在ph9.2的碳酸氢盐缓冲液中在4或37℃固定在maxisorp平板(nunc)上过夜,并用pbs洗去过量的tgfα。将tgfα包被的平板用1%tweenpbs(pbst)中的1%bsa在室温封闭2小时,之后与fcab(0.1–100nm)和egfr/fc(2μg/ml)混合物(预混1小时)在37℃温育1小时。洗去与fcab结合的egfr/fc,而用抗人igg-hrp(sigma)检测与tgfα结合的egfr/fc。使用tmb(ebioscience)作为底物与hrp酶相互作用以便比色检测,并通过1m硫酸终止反应。图1b显示针对tgfα与egfr/fc的结合归一化,tgfα与egfr/fc结合被抗egfrfcab阻断的百分数,以无fcab作为0%阻断。结果显示,抗egfrfcab以3.7-4.0nm的ic50阻断tgfα与egfr/fc结合(表4)。表4fcabegf结合作用的阻断(ic50[nm])tgfα结合作用的阻断(ic50[nm])fs1-600.6063.8fs1-650.4653.7fs1-670.4754.0实施例6–评估抗原结合作用的流式细胞术通过流式细胞术测试抗egfrfcab与a431ns细胞上细胞表面egfr的结合。通过将a431ns细胞与抗egfrfcab在冰上的流式缓冲液中温育1小时,评估fs1-60、fs1-65和fs1-67的结合作用。使用野生型(wt)fcab(seqidno:47)作为对照。洗涤细胞并且用冰上黑暗下温育45分钟的alexafluor-647-标记的抗人igg第二抗体(invitrogen,#a21445)检测fcab的结合作用。洗去过量的第二抗体,并使用accuric6流式细胞仪(bdbiosciences),通过流式细胞术分析信号。将几何平均荧光信号对fcab浓度作图以确定每种fcab的ec50(图2)。全部三种抗egfrfcab均以浓度依赖性方式与a431ns细胞结合,而wtfcab则否,从而显示这些fcab对egfr的特异性。表5中总结抗egfrfcab的结合亲和力。表5:依据流式细胞术的抗egfrfcab对a431ns细胞的结合亲和力fcab细胞结合作用(ec50[nm])fs1-603.3fs1-652.6fs1-678.9实施例7–抗egfrfcab介导的抗体依赖性细胞介导细胞毒性(adcc)当结合靶标的抗体或fcab的fc效应子部分同时与效应细胞的细胞表面上的fcγriiia受体结合时,它造成二个细胞交联,因而激活adcc途径,从而导致激活活化型t细胞(nfat)途径的核因子及最终激活所靶向细胞的受控细胞死亡。使用spr,测试抗egfrfcab与fcγriiia受体的结合。使用biacore3000仪(gehealthcare)并将cm5芯片用2000rufcγriiia(sinobiological)包被。将hbs-p缓冲液(gehealthcare)中系列浓度的fcab(62-1000nm)按20μl/min注入3分钟以缔合,随后流过hbs-p缓冲液进行5分钟解离。将10mmnaoh按照20μl/min使用15秒,再生fcγriiia包被的芯片。使用bia评价软件第3.2rc1版(gehealthcare),从稳态拟合导出结合亲和力(kd)。结果显示抗egfrfcab以277-289nm之间的结合亲和力结合fcγriiia(参见表6)。为了确定抗egfrfcab是否激发adcc,进行adcc报告基因生物测定(adccreporterbioassay)(promega,g7018)。adcc报告基因生物测定使用稳定表达fcγriiia受体的工程化jurkat细胞作为效应细胞和驱动萤光素酶表达的nfat反应元件。依据因nfat活化所致的萤光素酶产生,定量adcc活性。根据生产商的说明实施该测定。简而言之,将表达egfr的mda-mb-468细胞(atcc,htb-132)与渐增浓度的抗egfrfcab温育。随后,添加adcc生物测定效应细胞并在37℃在5%co2下温育6小时。最后,添加萤光素酶试剂是并定量相对发光。结果显示,抗egfrfcab以nm范围的ec50值介导adcc活性(表6),显示adcc可能是这些fcab借以展示抗肿瘤活性的作用机制之一。表6:抗egfrfcab与fcγriiia的结合和抗egfrfcab的adcc报告基因生物测定响应实施例8-大小排阻色谱对抗egfrfcab的生物物理表征与wtfcab相比,fs1-60、fs1-65和fs1-67在ab、cd、和ef环中具有允许结合靶的突变。为了评估这些突变对fcab结构的影响,进行抗egfrfcab的生物物理表征。在agilent1200系列hplc系统上,使用zorbexgf-2509.4mmidx25cm柱(agilent),通过大小排阻高效液相色谱法(se-hplc)分析fcab重复样品。将80μl等分的1mg/ml样品注入并且在50mm磷酸钠、150mm氯化钠、500mml-精氨酸、ph6.0中按1ml/分钟运行15分钟。使用chemstation软件(agilent)软件分析可溶性聚集物水平。fcab显示对称性单峰se-hplc曲线,柱保留时间类似于wtfcab(表7)。这些结果显示,fs1-60、fs1-65和fs1-67中的突变对fcab结构具有微小影响,并且这些fcab为单聚的并且不形式可溶性聚集物。表7:se-hplc生物物理表征实施例9–抗egfrfcab对细胞增殖的影响表达egfr的恒河猴肺上皮细胞系4mbr-5(atcc,ccl-208)用来研究fs1-60、fs1-65和fs1-67对细胞增殖的影响。使用根据生产商说明(2004年11月版)进行的细胞增殖elisabrdu(比色)免疫测定(roche,11647229001)对细胞增殖定量。在brdu存在下,将4mbr-5细胞在37°与多种浓度的抗egfrfcab在含有1%热灭活的胎牛血清(fbs)(thermofisher,10270)和1ng/ml重组人表皮生长因子(egf)(r&dsystems,236-eg)的hamf-12k培养基(thermofisher21127022)中温育3天。纳入仅pbs、wtfcab、igg同种型对照和西妥昔单抗(merck)作为对照。在3天温育时间期间,brdu在dna合成期间并入细胞中。在elisa测定中通过抗brdu-过氧化物酶检测因细胞增殖所致的dna合成水平。图3中显示结果。图3显示用渐增浓度的抗egfrfcab或西妥昔单抗处理细胞时,检测到brdu减少。结果对pbs对照归一化。与pbs对照相比,用wtfcab或igg1同种型对照(2000nm)处理细胞并未造成brdu掺入情况的任何变化。表8中显示抗egfrfcab和西妥昔单抗的ic50。这些数据显示,用渐增浓度的抗egfrfcab处理4mbr-5细胞时,观察到细胞增殖减少。表8:抗egfrfcab(ic50)对4mbr-5细胞的抗增殖活性。fcab抗细胞增殖(ic50)(nm)fs1-6027.41fs1-650.99fs1-677.53西妥昔单抗0.13实施例10–体内功效研究:egfr驱动的人类患者衍生肺腺癌异种移植模型lxfa677中的抗egfrfcab治疗使用携带人类患者衍生的异种移植物(pdx)肿瘤的小鼠,评价抗egfrfcab的体内功效。对大约5-7周龄的免疫缺陷性nmri裸鼠(charlesriver)植入肿瘤。表达egfr的lxfa677pdx(oncotest)衍生自一位62岁男性患者的原发性肺腺癌。将肿瘤片段(3-4mm边缘长度)用于小鼠腹部的单侧或双侧皮下植入。在第0天,将携瘤动物随机分派至实验组以产生给药方案开始时100-120mm3的组平均肿瘤体积。用以下抗体治疗各组七只小鼠:fs1-60、fs1-65、fs1-67、wtfcab、西妥昔单抗或pbs(作为溶媒对照)。fcab和西妥昔单抗按20mg/kg给药并且溶媒按10ml/kg给药。经两周静脉内施用每种治疗七剂。使用二维(直径x高度)测量肿瘤的卡尺,每周二次监测肿瘤体积直至第87天为止。根据公式:(直径x高度2)x0.5计算肿瘤体积。如果肿瘤体积超过2000mm3,则处死动物。全部三种抗egfrfcab以及西妥昔单抗均在全部治疗的小鼠中引起肿瘤完全缓解,而wtfcab不显示任何抗肿瘤功效(图4)。相对于溶媒对照组和/或wtfcab治疗组,全部抗egfrfcab以及西妥昔单抗的肿瘤抑制作用是统计显著(kruskal-wallis/dunn)(表9)。末剂后四周,在抗egfrfcab治疗的一些、但非全部动物中观察到肿瘤再生长(fs1-60治疗后,7只动物中1只复发;fs1-67治疗后,7只动物中4只复发;并且fs1-65治疗后,7只动物中5只复发)。对无再生长的肿瘤,继续测量并且完全缓解持续至第87天研究结束。相对于溶媒对照组以及wtfcab治疗组,对全部fcab治疗均观察到统计显著的肿瘤生长延迟400%(kaplan-meier)。总之,在良好耐受的剂量水平,全部三种fcab均在egfr依赖性pdx模型lxfa677中引起完全缓解。表9:lxfa677体内研究中fcab功效的统计比较实施例11–mab2分子的制备egfr/hgfmab2制备通过将单克隆抗体雷莫芦单抗(ri)和芬克拉妥珠单抗(fi)的ch3结构域分别替换为egfr特异性fcabfs1-60和fs1-65的ch3结构域,制备mab2分子ri/fs1-60(重链:seqidno:41;轻链:seqidno:28)、fi/fs1-60(重链:seqidno:42;轻链:seqidno:38)、ri/fs1-65(重链:seqidno:43;轻链:seqidno:28)和fi/fs1-65(重链:seqidno:44;轻链:seqidno:38)。对于人igg1单克隆抗体fi,将编码该抗体的完整ch3结构域的dna序列替换为fs1-60或fs1-65fcab的ch3结构域。对于人igg2单克隆抗体ri,使用相同方法。通过geneart(lifetechnologies)合成了编码单克隆抗体ri和fi重链和亲本轻链的修饰型ch3结构域的基因序列,限制性位点hindiii和ecori分别在5’和3’末端以便亚克隆入gs载体(lonza)。将构建体转染入哺乳动物细胞(chok1svgs-ko细胞)以表达可溶性蛋白(lonza)。转染chok1svgs-ko细胞并将其培育直至12天以允许最佳瞬时蛋白质表达和分泌。使用chogssystemtm(lonza),还生成稳定的汇集物。通过蛋白a亲和色谱从细胞上清液纯化由chok1svgs-ko细胞表达和分泌的mab2。可以通过类似地将人抗体(如fi、ri或hul2g7)的ch3结构域序列(galaxybiotech,参见ep2016162b1)替换所需fcab的ch3结构域序列,制备其他mab2分子。除fs1-60和fs1-65之外,合适的fcab还包括fs1-67。egfr/ctla4mab2制备(用于实施例18中)抗小鼠ctla4抗体9d9可变区重链(vh)和轻链(vl)衍生自专利申请号us2011/0044953a1中公开的9d9scfv序列(seqidno:48)。以下mab和mab2分子基于这些可变区设计并在图5中示意性显示。通过geneart(lifetechnologies)合成了编码9d9轻链(seqidno:50)、9d9m2a重链(seqidno:52)、和9d9/fs1-67重链(seqidno:56)的基因序列,限制性位点ecori和bamhi分别在5’和3’末端以便克隆入ptt5(nrcc)表达载体。9d9h1重链基因序列(seqidno:54)旨在编码ch2和ch3结构域的dna序列之间包含xhoi位点以允许通过xhoi/bamhi消化和dna连接而亚克隆不同的ch3结构域。将构建体转染入哺乳动物细胞(293-6e细胞,nrcc)以瞬时表达可溶性蛋白(自制)。转染293-6e细胞并将其培育直至5天以允许最佳蛋白质表达和分泌。通过蛋白a亲和色谱从细胞上清液纯化由293-6e细胞表达和分泌的编码的mab2。使用chogssystemtm(lonza),还生成稳定的汇集物。可以通过类似地将人抗体如伊匹木单抗(ipilimumab)(轻链seqidno:58和重链seqidno:60)的ch3结构域序列替换所需的抗原结合性fcab的ch3结构域序列,制备其他mab2分子。合适的fcab包括fs1-67、fs1-65和fs1-60。实施例12-通过抗egfr/hgfmab2阻断egfr、c-met和信号传导蛋白的磷酸化测试抗egfrmab2fi/fs1-60和ri/fs1-60阻断由hgf和egf刺激的c-met和egfr磷酸化及随后第二信使丝裂原-活化蛋白激酶(mapk)和akt磷酸化的能力。细胞裂解物的制备将胶质母细胞瘤细胞系u87mg(atcchtb-14)的过夜培养物从含有10%fbs的培养基移至含有0.1%fbs的低血清培养基,以优化配体刺激作用的灵敏度。将细胞温育过夜。次日,将包括终浓度200nm(或200+200nm组合)的fi/fs1-60、ri/fs1-60、fi、ri、fs1-60、igg1κ、fi+fs1-60组合和ri+fs1-60组合的处理添加至细胞并0.6nmhgf(peprotech,100-39)和1.6nmegf(r&dsytems,236-eg)存在下,于37℃温育20分钟以便刺激。包括存在和不存在生长因子刺激的无抗体处理的对照。使用包含1:100蛋白酶抑制剂混合物(calbiochem,539131)和1:100磷酸酶抑制剂混合物(calbiochem,524625)的裂解缓冲液(10mmtrisph7.5、150mmnacl、1mmedta)裂解处理的细胞,并收集裂解物供分析。蛋白质印迹法使用4-12%bis-tris蛋白质凝胶(thermofisher,np0322box),裂解物样品经历标准蛋白质印迹分析,并转移至硝酸纤维素膜(thermofisher,ib301001)。该膜用5%marvel乳/tbst封闭并且随后使用对tyr1234/1235处磷酸化的c-met特异的兔单克隆抗体(cellsignaling,3077)探测磷酸-c-met,使用对tyr1068处磷酸化的egfr特异的小鼠单克隆抗体(cellsignaling,2236)探测磷酸-egfr,使用对thr202/tyr204处磷酸化的p44/42mapk(erk1/2)特异的小鼠单克隆抗体(cellsignaling,9106)探测磷酸-mapk,并且使用对ser473处磷酸化的akt特异的兔单克隆抗体(cellsignaling,9271)探测磷酸-akt。洗涤该膜并添加与hrp缀合的第二抗体(抗小鼠,jacksonimmunoresearch,或抗兔,jacksonimmunoresearch)是添加,之后与增强型化学发光底物(thermofisher,34076)反应以检测信号。使用小鼠单克隆抗gapdh抗体(sigma-aldrich、g8795),在相同膜上探测gapdh作为内参对照。在6图中显示结果,并且其显示hgf刺激c-met磷酸化和后续的mapk和akt磷酸化。egf刺激egfr磷酸化且也刺激后续的mapk和akt磷酸化。类似于fi和ri,mab2分子能够阻断hgf所致的c-met磷酸化。阻断磷酸-c-met导致阻断磷酸-mapk和磷酸-akt。但是,这种阻断可以通过egf刺激egfr来克服,从而导致mapk和akt磷酸化。因此,fi和ri不能在egf存在下阻断mapk和akt的磷酸化。同样地,fs1-60单独不能在hgf存在下阻断mapk和akt的磷酸化。受hgf和egf二者刺激时,仅mab2分子、和与fs1-60组合的fi或ri阻断下游信号传导分子mapk和akt的磷酸化。这些结果显示,fi/fs1-60和ri/fs1-60能够抑制c-met和egfr的磷酸化,并因此还能够抑制下游信号传导,比单独的fi、ri或fs1-60效率更高。预计阻断这些受体酪氨酸激酶的激活可能抑制细胞增殖、细胞移行和细胞存活。实施例13-mab2分子的同时双特异性结合作用使用biacore3000仪(gehealthcare),通过spr测量mab2分子同时与其两种同族抗原结合的能力。使用标准胺偶联法,用1200ruhgf包被cm5芯片。在第一注入步骤中,将ri/fs1-60mab2或fi/fs1-60mab2(500nm)按20μl/min注入5分钟,以允许对芯片上包被的hgf的结合作用饱和。在第二注入步骤中,将20μg/ml加his标签的egfr按20μl/min注入5分钟,随后在hbs-p缓冲液中解离。将40mmnaoh按照45μl/min使用17秒,重复三次,再生hgf表面。饱和的hgf芯片上第二注入步骤中egfr的结合响应显示,ri/fs1-60和fi/fs1-60mab2可以同时与hgf和egfr结合(图7)。实施例14–抗egfr/hgfmab2阻断egf与egfr结合测试抗egfr/hgfmab2fi/fs1-60和ri/fs1-60阻断配体egf与表达egfr的mda-mb-468细胞结合的能力。使用如实施例5中所述的相同方法,不过使用mda-mb-468细胞替代a431ns细胞。在多种浓度(25-0.002nm)测试以下对象:mab2fi/fs1-60、mab2ri/fs1-60、fs1-60fcab、人igg1(igg1)或wtfcab,以pbs作为对照。图8显示针对pbs对照归一化的egf与egfr结合作用的抑制活性百分数,其中pbs具有0%抑制活性。结果显示,egfrmab2fi/fs1-60和ri/fs1-60以0.45至0.71nm之间的ic50阻断egf与egfr结合(表10)。这与fs1-60fcab的ic50相当。这些数据显示,抗egfrfcab的egf阻断活性不受其插入mab2样式影响。表10mab2或fcabegf与egfr结合作用阻断ic50(nm)ri/fs1-600.45fi/fs1-600.71fs1-600.43实施例15–抗egfr/hgfmab2对癌细胞系的细胞增殖的影响使用四个癌细胞系测试抗egfr/hgfmab2对细胞增殖的影响。u87mg细胞将胶质母细胞瘤u87mg细胞(自分泌产生hgf)在37℃与多种浓度的fi、fi/fs1-60、fi+fs1-60(1:1组合)、ri、ri/fs1-60、ri+fs1-60(1:1组合)、fs1-60、人igg1κ(igg)或pbs温育4天。活细胞计数用来确定不同处理的抗增殖作用。在4天后,将1μg/ml的hoechst33342(invitrogen,h3570)和2.5μg/ml的碘化丙啶(pi)(sigma、p4864)添加至细胞,并将细胞在室温黑暗下温育25分钟,以分别针对总细胞计数和死细胞着染胞核。使用imagexpressmicro(ixm)显微镜(moleculardevices)按4x放大率测定活细胞数目。在mab2fi/fs1-60和ri/fs1-60存在下观察到细胞增殖的浓度依赖性减少(图9a)。与fi、ri或fs1-60fcab单药疗法相比时,fi/fs1-60和ri/fs1-60具有优越功效。fi/fs1-60和ri/fs1-60mab2优于fi+fs1-60或ri+fs1-60处理。用另一个mab2(fi/fs1-65)重复该测定,并且结果反映了随fi/fs1-60mab2观察到的那些结果(图9b)。这些数据显示,mab2fi/fs1-60、ri/fs1-60和fi/fs1-65在hgf自分泌u87mg细胞中具有抗增殖活性。nci-h596细胞nci-h596(atcchtb-178)是衔接egf信号传导途径和hgf信号传导途径并用来研究mab2分子阻断增殖能力的肺腺鳞状癌细胞系。使用与上文描述的u87mg测定中相同的方法,例外是用egf和hgf配体二者刺激nci-h596细胞。在处理之前一天,培养基中所用的fbs的水平从10%降至1%。次日,在2ng/mlegf(r&dsystems,236-eg)和12ng/mlhgf(peprotech,100-39)存在下,按多种浓度(10-1000nm)添加处理并在37℃温育3天。还包括对照hgf+egf、仅egf、仅hgf和无配体刺激。结果显示,fi/fs1-65和ri/fs1-65mab2以浓度依赖性方式抑制hgf和egf引起的细胞增殖(图9c)。在1000nm,fi/fs1-65、ri/fs1-65和fi+fs1-65组合完全阻断由配体刺激引起的细胞增殖。相反,当存在两种配体时,fs1-65单药疗法或单一fi不能阻断刺激。这些数据显示,双特异性抗egfr/hgfmab2fi/fs1-65和ri/fs1-65有效抑制egf和hgf引起的增殖。nci-h1975细胞nci-h1975(atcccrl-5908)是表达组成型活性的突变型egfrl858r和egfrt790m的非小细胞肺癌(nsclc)细胞系(kobayashi等人2005)。这些突变是已知在nsclc患者中赋予egfr酪氨酸激酶抑制剂(tki)疗法抗性的获得性次生突变。nci-h1975细胞系也表达c-met。该细胞系用来研究mab2分子阻断hgf刺激的增殖的能力。使用与上文描述的u87mg测定中相同的方法,例外是用hgf配体刺激nci-h1975细胞。在处理之前一天,将所用的培养基从含有10%fbs变成不含血清。在80ng/mlhgf存在下,按多种浓度(0.003-300nm)添加处理并在37℃温育3天。结果显示,fi/fs1-65mab2处理以浓度依赖性方式减少hgf引起的细胞增殖(图9d)。未随测试的其他处理观察到影响。这些数据显示,双特异性fi/fs1-65mab2有效抑制携带egfr激活性突变的nci-h1975细胞中的细胞增殖。nci-h1975细胞系还用来研究fi/fs1-65mab2与egfrtki厄洛替尼组合时阻断增殖的能力。在伴随和不伴随厄洛替尼(2μm)的情况下,按300nm添加fi和fi/fs1-65mab2。结果显示,fi/fs1-65mab2处理减少hgf所致细胞增殖的能力(图9f)不受厄洛替尼的存在影响。未随厄洛替尼、fi或fi+厄洛替尼处理观察到影响。这些数据显示,在抑制携带egfr激活性突变的nci-h1975细胞中的细胞增殖方面,双特异性fi/fs1-65mab2有效且优于厄洛替尼。kp4细胞kp4(rikenrcb1005)是具有hgf自分泌产生的胰腺导管细胞癌。将细胞于37℃在供应商推荐的条件下与一系列浓度(0.003-300nm)的fi、fi/fs1-60、fi/fs1-65、ri/fs1-65、fi+fs1-65(1:1组合)、fs1-65、人igg1κ(igg)或wtfcab温育3天,如图9e中所示。在3天后,如生产商的方案中所述,使用细胞增殖试剂wst-1(roche)分析细胞以确定活细胞数目。稳定的四唑鎓盐wst-1因活细胞中nad(p)h的糖酵解性产生而切割成可溶性形式。形成的甲臜染料的量在吸光度450nm和630nm定量。随渐增浓度的mab2fi/fs1-60、fi/fs1-65、ri/fs1-65、fi+fs1-65组合和fi观察到细胞增殖的浓度依赖性减少(图9e)。与单药疗法fi或fs1-65相比时,三种mab2均具有优越功效。fi/fs1-65和ri/fs1-65mab2还优于fi+fs1-65处理。这些数据显示,mab2fi/fs1-60、fi/fs1-65和ri/fs1-65在hgf自分泌kp4细胞中具有抗增殖活性。hcc827细胞hcc827(atcccrl-2868)是表达激活性egfre746-a750缺失并具有egfr拷贝数扩增的肺腺癌细胞系(furugaki等人,2014)。已经显示该细胞系借助met扩增获得egfrtki抗性(shien等人,2015)。该细胞系用来研究mab2和厄洛替尼阻断hgf刺激的增殖的能力。在10%fbs中培养细胞。在处理之前一天,fbs降至1%。在40ng/mlhgf存在下,将厄洛替尼(0.1%dmso中)按多种浓度(10μm至0.0256nm)添加至细胞,并且将细胞在37℃温育3天。在一些试验中,添加与厄洛替尼组合的300nmfi或fi/fs1-65mab2。作为溶媒对照,使用0.1%dmso。结果显示,hgf的存在赋予厄洛替尼抗性(图9g)。可以通过厄洛替尼与fi组合减弱这种抗性的影响,但是厄洛替尼+fi/fs1-65组合处理进一步减少为抑制细胞增殖所要求的厄洛替尼剂量。这些结果表明,厄洛替尼处理与fi/fs1-65mab2组合可能减少治疗中所要求的厄洛替尼剂量并且因此降低潜在毒性,但与fi组合时则否。实施例16-抗egfr/hgfmab2处理引起的hgf内化和培养基中hgf水平降低为了研究hgf内化是否为抗egfr/hgfmab2籍此减少c-met活化作用并抑制细胞增殖的机制,使用a431ns和u87mg细胞测试由fi/fs1-60和fi/fs1-65mab2引起的hgf内化。通过流式细胞术检测根据生产商的说明经lightning-rapid488(innovabiosciences,322-0010)标记的hgf。将6.5nm标记的hgf与33.3nmfi/fs1-60或fi/fs1-65在室温预温育1小时。使用不伴有mab2的hgf作为对照。将混合物与a431ns细胞温育以结合1小时并且在冰上进行温育以减缓任何内化活性。通过用含有1%bsa(sigma、a7906)的冰冷pbs(lonza、be17-516f)洗涤细胞两次,移除任何未结合的hgf和mab2。将细胞重悬于冰冷的培养基中并转移至37℃持续180、120、60、30或10分钟时间,以加速内化,一组自始至终保留在冰上作为对照。在温育时间结束时,通过用含有1%bsa的冰冷dpbs(thermofisher,14040-133)中的0.05%nan3(sigma、s2002)洗涤细胞两次,抑制进一步内化。通过细胞与200nm抗alexafluor488igg(thermofisher,a-11094)在冰上温育1小时,使细胞表面结合的标记hgf猝灭。通过细胞表面保护内化的标记hgf免遭这种猝灭,因此检测到的任何标记的hgf均是内化的hgf。将细胞用fixedcell试剂(thermofisher,r37606)根据生产商的方案染色,之后通过流式细胞术分析。用u87mg细胞进行相应的实验。结果显示在mab2fi/fs1-60和fi/fs1-65存在下,标记的hgf信号随温育时间增加(图10a和图10b)。无论时间如何,单独的hgf温育均不改变检出的信号。自始至终在冰上温育的对照细胞不显示hgf信号增加。这些数据显示,mab2fi/fs1-60和fi/fs1-65促进hgf内化入a431ns和u87mg细胞中,假定通过mab2内化作用促进。另外,在抑制u87mg细胞增殖方面,与抗egfr/hgfmab2温育比靶向hgf的mab+egfrfcab组合更有力(实施例15)。假设借助抗egfr/hgfmab2的hgf内化在系统中导致hgf水平降低。为了试验这种假设,在分泌hgf的u87mg细胞中检查与抗egfr/hgfmab2温育所致的游离hgf水平的变化。将u87mg培养物与30nm的不同处理在37℃温育4天。这些是fi/fs1-65、ri/fs1-65、fi、ri、fs1-65、fi+fs1-65组合、ri+fs1-65组合、wtfcab、人igg1κ和pbs对照。在第4天,从每种细胞培养物收集培养基以分析hgf水平。遵循生产商的方案,使用hgf人elisa试剂盒(thermofisher,kac2211)测量hgf浓度。使用单克隆抗hgf抗体时,培养基中检测到游离hgf(游离hgf定义为培养基中由检测抗体结合的hgf)。结果显示与pbs、igg、wtfcab和fs1-65对照相比,fi和ri二者及其与fs1-65的组合引起培养基中游离hgf的浓度显著降低,假定通过隔绝hgf所致(图10c)。在fi/fs1-65和ri/fs1-65处理的细胞培养物中观察到更大的游离hgf水平降低。这种显著降低与以下理论相符:通过将hgf借助egfr结合作用而内化入细胞以及通过隔绝hgf,fi/fs1-65和ri/fs1-65从培养基移除hgf。预计在mab2抑制细胞增殖方面,这种游离hgf水平降低导致的效果比组合处理时所观察的效果更有力。实施例17–体内功效研究:抗egfr/hgfmab2处理胶质母细胞瘤hgf自分泌u87mg和nsclch596异种移植模型胶质母细胞瘤使用移植有hgf自分泌u87mg胶质母细胞瘤细胞系的小鼠,评价靶向egfr和hgf的双特异性mab2的体内功效。对大约8-12周龄的雌性无胸腺裸鼠(crl:nu(ncr)-foxn1nu,charlesriver)植入肿瘤。在雌性裸鼠中通过连续植入,维持u87mg胶质母细胞瘤。为了启动肿瘤生长,将1mm3片段皮下植入每只试验动物的右腹部。用卡钳测量按二个维度肿瘤尺寸并使用共识:(宽度x长度)x0.5计算平均体积。研究持续期间每周二次测量肿瘤。在第0天,将具有独立肿瘤体积75至144mm3的动物随机分配至六个组,每个组有八只动物,组平均肿瘤体积为102mm3。从第1天起,全部小鼠均每周二次静脉内给药直至八周。六组处理是:pbs溶媒(24.9ml/kg)、fs1-60、fi、fi+fs1-60组合、fi/fs1-60和ri/fs1-60,均按剂量60mg/kg进行。如果动物的肿瘤超过体积2000mm3,则使其安乐死。与溶媒相比,全部处理均显示肿瘤缓解,例外是用仅靶向egfr的fs1-60处理的小鼠。fi和fi+fs1-60组合之间未观察到差异。在fi/fs1-60治疗组和ri/fs1-60mab2治疗组中观察到超过溶媒、fs1-60和fi的优越抗肿瘤活性。fi/fs1-60mab2还优于fi+fs1-60组合处理。对数秩(mantel-cox)检验和gehan-breslow-wilcoxon检验用来确定二个组的总生存经历(生存曲线)之间差异的显著性。表11中总结了结果。图11a中显示每个组随时间推移的平均肿瘤体积。表11:通过对数秩检验比较不同的处理。*=p<0.05;**=p<0.01;***=p<0.001ns=不显著。总之,在抑制肿瘤生长方面,fi/fs1-60和ri/fs1-60mab2优于靶向egfr或hgf的单药疗法。fi/fs1-60还优于靶向egfr和hgf的fi+fs1-60的组合处理。在处理时间期间,取得血清样品以确定接受不同处理的小鼠中分泌自异种移植物的人游离hgf。在第16天,从全部幸存者收集血清样品,以便如实施例16中所述,遵循生产商的方案,使用hgf人elisa试剂盒(thermorfisher,kac2211)进行分析。检测到的hgf浓度对相应小鼠的肿瘤尺寸归一化。结果显示与溶媒组相比,fi/fs1-60引起血清中游离hgf的浓度显著降低(图11d)。与溶媒组相比,在fi+fs1-60组合和ri/fs1-60治疗的组中也观察到大幅降低,不过它们是统计不显著的。这些观察结果与以下观念相符:fi/fs1-60内化并隔绝hgf,在抑制细胞增殖方面导致更有力的效果。nsclc在小鼠模型中研究携带改变hgf/met信号传导的人类癌症的挑战之一是以下事实:小鼠hgf对人met显示低亲和力并且因此没有为这类人肿瘤生长提供理想环境。表达人hgf的转基因小鼠—hhgftg-scid(vanandelinstitute),为肿瘤环境提供了物种相容的hgf(人)(zhang等人,2005)。nsclc细胞系h596衔接egfr号传导途径和hgf信号传导途径,但是无hgf自分泌。为了评价h596模型中用fi/fs1-60和fi/fs1-65mab2处理的体内功效,将nsclc细胞移植到转基因hhgftg-scid小鼠以提供刺激hgf的环境。全部hhgftg-scid雌性小鼠均在右腹部植入1x106个细胞。当肿瘤达到大约100mm3时,将动物随机分配至六个组,每组具有八只动物。每周二次测量肿瘤并使用公式:(长度x宽度)/深度计算肿瘤体积。从第0天起,对六组已植入的小鼠用以下处理腹腔内给药,每周二次直至七周:pbs溶媒(24ml/kg)、fs1-65、fi、fi+fs1-65、fi/fs1-60和fi/fs1-65,均按剂量60mg/kg给药。如果动物的肿瘤超过体积2500mm3,则使其安乐死。与溶媒相比,全部处理显示肿瘤缓解。与fs1-65或fi单药疗法相比,fi+fs1-65组合处理未显示改善在中的总生存期。与其他处理相比,fi/fs1-60mab2处理在改善总生存期方面优越。对数秩(mantel-cox)检验和gehan-breslow-wilcoxon检验用来确定二个组的总生存经历(生存曲线)之间差异的显著性。表12中总结了结果。图11b中显示每个组随时间推移的平均肿瘤体积。fi/fs1-65mab2处理组中八只动物有两只显示肿瘤完全缓解。图11c中显示每个组中小鼠随时间推移的生存期。相比用fi+fs1-65组合处理的那些小鼠,用两种mab2处理的小鼠具有更高的生存率。在fi/fs1-60处理的小鼠组中,全部小鼠在研究结束时均存活。总之,在抑制肿瘤生长方面,fi/fs1-60和fi/fs1-65mab2优于靶向egfr或hgf的单药疗法。fi/fs1-60还优于靶向egfr和hgf的fi+fs1-60的组合处理。表12:通过对数秩检验比较不同的处理。*=p<0.05;**=p<0.01;***=p<0.001ns=不显著。实施例18–含有抗egfr的mab2治疗的小鼠中皮肤毒性减少已经随已知的抗egfr疗法观察到皮肤毒性,导致皮疹、损伤等。为了确定抗egfrfcab和含有抗egfrfc的mab2的毒性,实施体内研究。在如kramanm等人(2010)中所述的同基因小鼠肿瘤模型ll2.ova中测试抗egfr/ctla4mab29d9/fs1-67和对照(实施例11)的控制肿瘤生长功效。将肿瘤细胞(5x105个细胞)皮下植入6-8周龄雌性c57bl6(charlesriver)小鼠的腹侧,并且将小鼠随机分配至各含八只小鼠的四个队列。在植入肿瘤后第3、第6和第10天,用250μg的以下处理(10mg/kg,假定25g/小鼠)腹腔注射小鼠:小鼠igg2a对照、fs1-67fcab、抗ctla-49d9m2a和9d9/fs1-67mab2。用电子卡钳在第10、第12、第14、第17、第19、第20和21天测量肿瘤体积。在第16天,拍摄小鼠照片以显示观察到的皮肤毒性。在fs1-67单药疗法治疗的小鼠中,观察到的皮肤毒性最明显。四只小鼠中存在大量脱毛并且它们当中二者显示病灶,不过未在肿瘤植入部位显示病灶。两只用9d9/fs1-67mab2治疗的小鼠还显示某种脱毛,但不如fs1-67单药疗法治疗的小鼠那样明显。图12中显示结果。表13总结了这项试验中观察到皮肤毒性。不希望受理论限制,认为肿瘤浸润性treg中高水平的ctla4表达可以将mab2浓集于肿瘤处并限制egfrfcab对皮肤的影响,因此解释随该mab2观察到的皮肤毒性降低。9d9/fs1-67mab2还显示最高水平地控制肿瘤生长。表13:皮肤毒性体内研究总结组抗体小鼠显示脱毛脱毛程度皮肤损伤1fs1-674/8+++2/829d9m2a0/8-0/839d9/fs1-672/8+0/84ctrl0/8-0/8在h596的体内功效研究中,也随基于抗egfr的mab2观察到皮肤毒性降低。fs1-65组和fi+fs1-65组合组中的小鼠显示脱毛。但是,在fi/fs1-60和fi/fs1-65mab2治疗组中,脱毛明显减少。该观察与以下理论相符:mab2中的第二靶将双特异性分子指引至第二靶表达水平高的部位,从而限制抗egfr结构域对皮肤的影响。两个实施的体内试验因此显示,基于抗egfr的mab2导致皮肤毒性降低。实施例19-大小排阻色谱对基于抗egfr的mab2的生物物理表征通过将单克隆抗体ri和fi的ch3结构域替换为抗egfrfcab的ch3结构域,制备mab2ri/fs1-60、ri/fs1-65、fi/fs1-60和fi/fs1-65。为了评估这种ch3结构域摇摆的影响,进行基于抗egfr的mab2的生物物理表征。在agilent1200系列hplc系统上,使用zorbexgf-2509.4mmidx25cm柱(agilent),通过大小排阻高效液相色谱法(se-hplc)分析mab2和mab样品。将80μl等分的1mg/ml样品注入并且在50mm磷酸钠、150mm氯化钠、500mml-精氨酸、ph6.0中按1ml/分钟运行15分钟。使用chemstation软件(agilent)软件分析可溶性聚集物水平。mab2显示对称性单峰se-hplc曲线,柱保留时间类似于相应的亲本mab(表14)。这些结果显示,ch3结构域摇摆对亲本mab结构具有微小影响,并且这些mab2为单聚的并且不形式可溶性聚集物。表14:se-hplc生物物理表征实施例20–抗egfrmab2与egfr的结合通过流式细胞术,测试抗egfrmab2和fcab与nci-h1975(详情参见实施例15)和hcc827(atcccrl-2868,具有egfr酪氨酸激酶结构域中获得性缺失[e746-a750]的肺腺癌)上细胞表面egfr的结合。通过将细胞系与mab2或fcab在冰上的流式缓冲液中温育1小时,评估ri/fs1-65、fi/fs1-65和fs1-65fcab的结合作用。使用野生型(wt)fcab和igg作为对照。洗涤细胞并且在冰上黑暗下用r-藻红蛋白缀合的抗人igg第二抗体(jackson,#109-116-098)检测mab2或fcab结合作用,并且在冰上温育45分钟。洗去过量的第二抗体,并使用流式细胞(facscantoii,bdbiosciences),通过流式细胞术分析信号。将几何平均荧光信号对mab2或fcab浓度作图以确定ec50(表15)。全部抗egfrmab2和fcab均以浓度依赖性方式与nci-h1975和hcc827细胞系结合,而wtfcab和igg则否,从而显示这些mab2和fcab对egfr的特异性。表15:依据流式细胞术的抗egfrmab2或fcab对nci-h1975和hcc827细胞系的结合亲和力使用spr,测定抗egfrmab2对加his标签的人egfr(sinobiological)的结合亲和力。为了测量亲和力,使用biacoret200仪(gehealthcare)和6120–8520ru抗人fab抗体包被的cm5芯片(gehealthcare,28-9583-25)。将抗egfrmab2(5μg/ml)按10μl/min注入hbs-ep+缓冲液(gehealthcare)中5分钟,以便捕获于抗fab包被的cm5芯片上。将系列浓度的人egfr(0.27–139nm)按30μl/min注入10分钟以测量结合速率。随后注入hbs-ep+缓冲液10分钟以测定解离速率。通过将egfr抗原注入到流动小室,同时无mab2捕获步骤,进行参比扣除。将10mm甘氨酸按照30μl/min持续60秒使用两次,再生fab表面。使用biacoaret200评价软件第3.0版(gehealthcare),从1:1(朗格缪尔)拟合模型导出结合亲和力(kd)。结果显示基于抗egfr的mab2以1.6–3.6nm之间的亲和力与人egfr结合(参见表16)。表16:抗egfrmab2对人egfr的结合亲和力(kd)mab2人egfrkd(nm)ri/fs1-603.6fi/fs1-603.54420/fs1-604.5ri/fs1-651.8fi/fs1-651.64420/fs1-652.04420/fs1-672.5实施例21–体内功效研究:egfr驱动的人类患者衍生肺腺癌异种移植模型lxfa677的抗egfrmab2治疗使用携带人类患者衍生的异种移植物(pdx)肿瘤的小鼠,评价靶向egfr的模拟mab2的体内功效。使用如实施例10中所述的相同方法。用以下抗体治疗各组七只小鼠:模拟mab24420/fs1-60、4420/fs1-65、4420/fs1-67、西妥昔单抗、对照4420mab或作为溶媒对照的pbs。mab2样品或对照mab样品按20mg/kg给药并且溶媒按10ml/kg给药。经两周静脉内施用各治疗七剂。每周二次监测肿瘤体积直至第88天为止。用抗egfr模拟mab24420/fs1-60、4420/fs1-65和4420/fs1-67治疗导致总体完全的肿瘤缓解,但是全部三个组中的各个肿瘤仅发生部分缓解。4420对照mab未显示任何抗肿瘤功效(图13)。末剂后一周至五周,在抗egfrmab2治疗的全部动物中均观察到肿瘤再生长,例外是一只给予4420/fs1-65的小鼠。相对于溶媒对照组以及4420对照组,对全部mab2均观察到统计显著的肿瘤生长延迟至400%(kaplan-meier)(表17)。总之,在良好耐受的剂量水平,全部三种mab2均导致egfr依赖性pdx模型lxfa677的完全缓解。已知测试的三种mab2测试与小鼠egfr有交叉反应性并且因此与人egfr特异性西妥昔单抗相比,可能导致皮肤影响。假设补偿皮肤影响的抗egfrmab2进一步给药导致连续性肿瘤缓解。可选地,治疗开始前的负荷剂量可能规避这种影响。表17:lxfa677体内研究中mab2功效的统计比较序列表fcabfs1-60ch3结构域结构性环的氨基酸序列fs1-60ab环–ldeggp(seqidno:1)fs1-60cd环–tyg(seqidno:2)fs1-60ef环–shwrwys(seqidno:3)fcabfs1-60ch3结构域的氨基酸序列(seqidno:4)gqprepqvytlppsrdeldeggpvsltclvkgfypsdiavewestygpennykttppvldsdgsfflysrltvshwrwysgnvfscsvmhealhnhytqkslslspg包含c末端赖氨酸的fcabfs1-60ch3结构域的氨基酸序列(seqidno:4)gqprepqvytlppsrdeldeggpvsltclvkgfypsdiavewestygpennykttppvldsdgsfflysrltvshwrwysgnvfscsvmhealhnhytqkslslspgk(seqidno:68)编码fcabfs1-60ch3结构域的核苷酸序列(seqidno:5)ggccagcctcgagaaccacaggtgtacaccctgcccccatcccgggatgagttggatgaggggggtcctgtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcacttatgggccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaggctcaccgtgtctcattggaggtggtactctgggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacacagaagagcctctccctgtctccgggtfcabfs1-60的ch2和ch3结构域的氨基酸序列(seqidno:6)apellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeldeggpvsltclvkgfypsdiavewestygpennykttppvldsdgsfflysrltvshwrwysgnvfscsvmhealhnhytqkslslspg编码fcabfs1-60的ch2和ch3结构域的核苷酸序列(seqidno:7)gcccccgagctgctgggaggcccttccgtgtttctgttccccccaaagcccaaggacaccctgatgatctcccggacccccgaagtgacctgcgtggtggtggatgtgtcccacgaggaccctgaagtgaagttcaattggtacgtggacggcgtggaagtgcacaacgccaagaccaagcccagagaggaacagtacaactccacctaccgggtggtgtccgtgctgaccgtgctgcaccaggattggctgaacggcaaagagtacaagtgcaaggtgtccaacaaggccctgcctgcccccatcgaaaagaccatctccaaggccaagggccagccccgggaaccccaggtgtacacactgccccctagcagggacgagctggatgaaggcggacctgtgtccctgacctgtctcgtgaagggcttctacccctccgatatcgccgtggaatgggagtccacctacggccccgagaacaactacaagaccaccccccctgtgctggactccgacggctccttctttctgtactcccgcctgaccgtgtcccactggcggtggtactctggcaacgtgttctcctgcagcgtgatgcacgaggccctgcacaaccactacacccagaagtccctgtccctgagccccggcfcabfs1-65ch3结构域结构性环的氨基酸序列fs1-65ab环–ldeggp(seqidno:1)fs1-65cd环–tyg(seqidno:2)fs1-65ef环–sywrwvk(seqidno:8)fcabfs1-65ch3结构域的氨基酸序列(seqidno:9)gqprepqvytlppsrdeldeggpvsltclvkgfypsdiavewestygpennykttppvldsdgsfflyskltvsywrwvkgnvfscsvmhealhnhytqkslslspg编码fcabfs1-65ch3结构域的核苷酸序列(seqidno:10)ggccagcctcgagaaccacaggtgtacaccctgcccccatcccgggatgagttggatgaggggggtcctgtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcacttatgggccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtgtcttactggaggtgggttaaagggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacacagaagagcctctccctgtctccgggtfcabfs1-65的ch2和ch3结构域的氨基酸序列(seqidno:11)apellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeldeggpvsltclvkgfypsdiavewestygpennykttppvldsdgsfflyskltvsywrwvkgnvfscsvmhealhnhytqkslslspg编码fcabfs1-65的ch2和ch3结构域的核苷酸序列(seqidno:12)gcccccgagctgctgggaggcccttccgtgtttctgttccccccaaagcccaaggacaccctgatgatctcccggacccccgaagtgacctgcgtggtggtggatgtgtcccacgaggaccctgaagtgaagttcaattggtacgtggacggcgtggaagtgcacaacgccaagaccaagcccagagaggaacagtacaactccacctaccgggtggtgtccgtgctgaccgtgctgcaccaggattggctgaacggcaaagagtacaagtgcaaggtgtccaacaaggccctgcctgcccccatcgaaaagaccatctccaaggccaagggccagcctcgagaaccacaggtgtacaccctgcccccatcccgggatgagttggatgaggggggtcctgtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcacttatgggccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtgtcttactggaggtgggttaaagggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacacagaagagcctctccctgtctccgggtfcabfs1-67ch3结构性环的氨基酸序列fs1-67ab环–tddgp(seqidno:13)fs1-67cd环–tyg(seqidno:2)fs1-67ef环–sywrwyk(seqidno:14)fcabfs1-67ch3结构域的氨基酸序列(seqidno:15)gqprepqvytlppsrdetddgpvsltclvkgfypsdiavewestygpennykttppvldsdgsfflyskltvsywrwykgnvfscsvmhealhnhytqkslslspg编码fcabfs1-67ch3结构域的核苷酸序列(seqidno:16)ggccagcctcgagaaccacaggtgtacaccctgcccccatcccgggatgagactgacgacggtccggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcacttatgggccggagaacaactacaagaccacgcctcccgtgctggactccgacggatccttcttcctctacagcaagctcaccgtgtcttactggaggtggtacaaagggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacacagaagagcctctccctgtctccgggtfcabfs1-67的ch2和ch3结构域的氨基酸序列(seqidno:17)apellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdetddgpvsltclvkgfypsdiavewestygpennykttppvldsdgsfflyskltvsywrwykgnvfscsvmhealhnhytqkslslspg编码fcabfs1-67的ch2和ch3结构域的核苷酸序列(seqidno:18)gcccccgagctgctgggaggcccttccgtgtttctgttccccccaaagcccaaggacaccctgatgatctcccggacccccgaagtgacctgcgtggtggtggatgtgtcccacgaggaccctgaagtgaagttcaattggtacgtggacggcgtggaagtgcacaacgccaagaccaagcccagagaggaacagtacaactccacctaccgggtggtgtccgtgctgaccgtgctgcaccaggattggctgaacggcaaagagtacaagtgcaaggtgtccaacaaggccctgcctgcccccatcgaaaagaccatctccaaggccaagggccagcctcgagaaccacaggtgtacaccctgcccccatcccgggatgagactgacgacggtccggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcacttatgggccggagaacaactacaagaccacgcctcccgtgctggactccgacggatccttcttcctctacagcaagctcaccgtgtcttactggaggtggtacaaagggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacacagaagagcctctccctgtctccgggtfcabfs1-60、fcabfs1-65和fcabfs1-67ch2结构域的氨基酸序列(seqidno:19)apellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak编码fcabfs1-60、fcabfs1-65和fcabfs1-67ch2结构域的核苷酸序列(seqidno:20)gcccccgagctgctgggaggcccttccgtgtttctgttccccccaaagcccaaggacaccctgatgatctcccggacccccgaagtgacctgcgtggtggtggatgtgtcccacgaggaccctgaagtgaagttcaattggtacgtggacggcgtggaagtgcacaacgccaagaccaagcccagagaggaacagtacaactccacctaccgggtggtgtccgtgctgaccgtgctgcaccaggattggctgaacggcaaagagtacaagtgcaaggtgtccaacaaggccctgcctgcccccatcgaaaagaccatctccaaggccaag雷莫芦单抗(ri)cdr的氨基酸序列ricdr1vh–iyyws(seqidno:21)ricdr2vh–yvyysgstnynpslks(seqidno:22)ricdr3vh–ggydfwsgyfdy(seqidno:23)ricdr1vl–rasqsvdsnla(seqidno:24)ricdr2vl–gastrat(seqidno:25)ricdr3vl–qqyinwppit(seqidno:26)雷莫芦单抗(ri)重链的氨基酸序列(seqidno:27)斜体=雷莫芦单抗vh(cdr加下划线);粗体=人igg2ch1;粗体和加下划线=人igg2铰链区;粗体和斜体=人igg2ch2;粗斜体和加下划线=人igg2ch3雷莫芦单抗(ri)和ri/fs1-60、ri/fs1-65和ri/fs1-67轻链的氨基酸序列(seqidno:28)斜体=雷莫芦单抗vl(cdr加下划线);粗体=人iggκ恒定区雷莫芦单抗(ri)vh结构域的氨基酸序列(seqidno:29)qvqlqesgpglvkpsetlsltctvsggsisiyywswirqppgkglewigyvyysgstnynpslksrvtisvdtsknqfslklnsvtaadtavyycarggydfwsgyfdywgqgtlvtvss雷莫芦单抗(ri)vl结构域的氨基酸序列(seqidno:30)eivmtqspatlsvspgeratlscrasqsvdsnlawyrqkpgqaprlliygastratgiparfsgsgsgteftltisslqsedfavyycqqyinwppitfgqgtrleikr芬克拉妥珠单抗(fi)cdr的氨基酸序列ficdr1vh–tywmh(seqidno:31)ficdr2vh–einptnghtnynqkfqg(seqidno:32)ficdr3vh–nyvgsifdy(seqidno:33)ficdr1vl–kasenvvsyvs(seqidno:34)ficdr2vl–gasnres(seqidno:35)ficdr3vl–gqsynypyt(seqidno:36)芬克拉妥珠单抗(fi)重链的氨基酸序列(seqidno:37)斜体=芬克拉妥珠单抗vh(cdr加下划线);粗体=人igg1ch1;粗体和加下划线=人igg1铰链区;粗体和斜体=人igg1ch2;粗斜体和加下划线=人igg1ch3芬克拉妥珠单抗(fi)和fi/fs1-60、fi/fs1-65和fi/fs1-67轻链的氨基酸序列(seqidno:38)斜体=芬克拉妥珠单抗vl(cdr加下划线);粗体=人iggκ恒定区芬克拉妥珠单抗(fi)vh结构域的氨基酸序列(seqidno:39)qvqlvqpgaevkkpgtsvklsckasgytfttywmhwvrqapgqglewigeinptnghtnynqkfqgratltvdkststaymelsslrsedtavyycarnyvgsifdywgqgtlltvss芬克拉妥珠单抗(fi)vl结构域的氨基酸序列(seqidno:40)divmtqspdslamslgervtlnckasenvvsyvswyqqkpgqspklliygasnresgvpdrfsgsgsatdftltissvqaedvadyhcgqsynypytfgqgtkleikrmab2ri/fs1-60重链的氨基酸序列(seqidno:41)qvqlqesgpglvkpsetlsltctvsggsisiyywswirqppgkglewigyvyysgstnynpslksrvtisvdtsknqfslklnsvtaadtavyycarggydfwsgyfdywgqgtlvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssnfgtqtytcnvdhkpsntkvdktverkccvecppcpappvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsrdeldeggpvsltclvkgfypsdiavewestygpennykttppvldsdgsfflysrltvshwrwysgnvfscsvmhealhnhytqkslslspgmab2fi/fs1-60重链的氨基酸序列(seqidno:42)qvqlvqpgaevkkpgtsvklsckasgytfttywmhwvrqapgqglewigeinptnghtnynqkfqgratltvdkststaymelsslrsedtavyycarnyvgsifdywgqgtlltvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeldeggpvsltclvkgfypsdiavewestygpennykttppvldsdgsfflysrltvshwrwysgnvfscsvmhealhnhytqkslslspgmab2ri/fs1-65重链的氨基酸序列(seqidno:43)qvqlqesgpglvkpsetlsltctvsggsisiyywswirqppgkglewigyvyysgstnynpslksrvtisvdtsknqfslklnsvtaadtavyycarggydfwsgyfdywgqgtlvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssnfgtqtytcnvdhkpsntkvdktverkccvecppcpappvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsrdeldeggpvsltclvkgfypsdiavewestygpennykttppvldsdgsfflyskltvsywrwvkgnvfscsvmhealhnhytqkslslspgmab2fi/fs1-65重链的氨基酸序列(seqidno:44)qvqlvqpgaevkkpgtsvklsckasgytfttywmhwvrqapgqglewigeinptnghtnynqkfqgratltvdkststaymelsslrsedtavyycarnyvgsifdywgqgtlltvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeldeggpvsltclvkgfypsdiavewestygpennykttppvldsdgsfflyskltvsywrwvkgnvfscsvmhealhnhytqkslslspgmab2ri/fs1-67重链的氨基酸序列(seqidno:45)qvqlqesgpglvkpsetlsltctvsggsisiyywswirqppgkglewigyvyysgstnynpslksrvtisvdtsknqfslklnsvtaadtavyycarggydfwsgyfdywgqgtlvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssnfgtqtytcnvdhkpsntkvdktverkccvecppcpappvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsrdetddgpvsltclvkgfypsdiavewestygpennykttppvldsdgsfflyskltvsywrwykgnvfscsvmhealhnhytqkslslspgmab2fi/fs1-67重链的氨基酸序列(seqidno:46)qvqlvqpgaevkkpgtsvklsckasgytfttywmhwvrqapgqglewigeinptnghtnynqkfqgratltvdkststaymelsslrsedtavyycarnyvgsifdywgqgtlltvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdetddgpvsltclvkgfypsdiavewestygpennykttppvldsdgsfflyskltvsywrwykgnvfscsvmhealhnhytqkslslspg人igg1fc片段的氨基酸序列(野生型[wt]fcab)(seqidno:47)tcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg人igg1铰链区的氨基酸序列(seqidno:48)epkscdkthtcppcp截短的人igg1铰链区的氨基酸序列(seqidno:49)tcppcp9d9轻链的氨基酸序列(seqidno:50)divmtqttlslpvslgdqasiscrssqsivhsngntylewylqkpgqspklliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedlgvyycfqgshvpytfgggtkleikradaaptvsifppsseqltsggasvvcflnnfypkdinvkwkidgserqngvlnswtdqdskdstysmsstltltkdeyerhnsytceathktstspivksfnrnec编码9d9轻链的核苷酸序列(seqidno:51)gacatcgtgatgacccagaccaccctgagcctgcccgtgagcctgggcgaccaggccagcatcagctgcagaagcagccagagcatcgtgcacagcaacggcaacacctacctggagtggtacctgcagaagcccggccagagccccaagctgctgatctacaaggtgagcaacagattcagcggcgtgcccgacagattcagcggcagcggcagcggcaccgacttcaccctgaagatcagcagagtggaggccgaggacctgggcgtgtactactgcttccagggcagccacgtgccctacaccttcggcggcggcaccaagctggagatcaagagagccgacgccgcccccaccgtgagcatcttcccccccagcagcgagcagctgaccagcggcggcgccagcgtggtgtgcttcctgaacaacttctaccccaaggacatcaacgtgaagtggaagatcgacggcagcgagagacagaacggcgtgctgaacagctggaccgaccaggacagcaaggacagcacctacagcatgagcagcaccctgaccctgaccaaggacgagtacgagagacacaacagctacacctgcgaggccacccacaagaccagcaccagccccatcgtgaagagcttcaacagaaacgagtgc9d9m2a重链的氨基酸序列(seqidno:52)eiqlqqsgpvlvkpgasvkmsckasgytftdyymnwvkqshgkslewigvinpyngdtsynqkfkgkatltvdkssstaymelnsltsedsavyycaryygswfaywgqgtlitvstakttapsvyplapvcgdttgssvtlgclvkgyfpepvtltwnsgslssgvhtfpavlqsdlytlsssvtvtsstwpsqsitcnvahpasstkvdkkieprgptikpcppckcpapnllggpsvfifppkikdvlmislspivtcvvvdvseddpdvqiswfvnnvevhtaqtqthredynstlrvvsalpiqhqdwmsgkefkckvnnkdlpapiertiskpkgsvrapqvyvlpppeeemtkkqvtltcmvtdfmpediyvewtnngktelnykntepvldsdgsyfmysklrvekknwvernsyscsvvheglhnhhttksfsrtpgk编码9d9m2a重链的核苷酸序列(seqidno:53)gagatccagctgcagcagagcggccccgtgctggtgaagcccggcgccagcgtgaagatgagctgcaaggccagcggctacaccttcaccgactactacatgaactgggtgaagcagagccacggcaagagcctggagtggatcggcgtgatcaacccctacaacggcgacaccagctacaaccagaagttcaagggcaaggccaccctgaccgtggacaagagcagcagcaccgcctacatggagctgaacagcctgaccagcgaggacagcgccgtgtactactgcgccagatactacggcagctggttcgcctactggggccagggcaccctgatcaccgtgagcaccgccaagaccaccgcccccagcgtgtaccccctggcccccgtgtgcggcgacaccaccggcagcagcgtgaccctgggctgcctggtgaagggctacttccccgagcccgtgaccctgacctggaacagcggcagcctgagcagcggcgtgcacaccttccccgccgtgctgcagagcgacctgtacaccctgagcagcagcgtgaccgtgaccagcagcacctggcccagccagagcatcacctgcaacgtggcccaccccgccagcagcaccaaggtggacaagaagatcgagcccagaggccccaccatcaagccctgccccccctgcaagtgccccgcccccaacctgctgggcggccccagcgtgttcatcttcccccccaagatcaaggacgtgctgatgatcagcctgagccccatcgtgacctgcgtggtggtggacgtgagcgaggacgaccccgacgtgcagatcagctggttcgtgaacaacgtggaggtgcacaccgcccagacccagacccacagagaggactacaacagcaccctgagagtggtgagcgccctgcccatccagcaccaggactggatgagcggcaaggagttcaagtgcaaggtgaacaacaaggacctgcccgcccccatcgagagaaccatcagcaagcccaagggcagcgtgagagccccccaggtgtacgtgctgcccccccccgaggaggagatgaccaagaagcaggtgaccctgacctgcatggtgaccgacttcatgcccgaggacatctacgtggagtggaccaacaacggcaagaccgagctgaactacaagaacaccgagcccgtgctggacagcgacggcagctacttcatgtacagcaagctgagagtggagaagaagaactgggtggagagaaacagctacagctgcagcgtggtgcacgagggcctgcacaaccaccacaccaccaagagcttcagcagaacccccggcaag9d9h1重链的氨基酸序列(seqidno:54)eiqlqqsgpvlvkpgasvkmsckasgytftdyymnwvkqshgkslewigvinpyngdtsynqkfkgkatltvdkssstaymelnsltsedsavyycaryygswfaywgqgtlitvstakttapsvyplapvcgdttgssvtlgclvkgyfpepvtltwnsgslssgvhtfpavlqsdlytlsssvtvtsstwpsqsitcnvahpasstkvdkkiepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg编码9d9h1重链的核苷酸序列(seqidno:55)gagatccagctgcagcagagcggccccgtgctggtgaagcccggcgccagcgtgaagatgagctgcaaggccagcggctacaccttcaccgactactacatgaactgggtgaagcagagccacggcaagagcctggagtggatcggcgtgatcaacccctacaacggcgacaccagctacaaccagaagttcaagggcaaggccaccctgaccgtggacaagagcagcagcaccgcctacatggagctgaacagcctgaccagcgaggacagcgccgtgtactactgcgccagatactacggcagctggttcgcctactggggccagggcaccctgatcaccgtgagcaccgccaagaccaccgcccccagcgtgtaccccctggcccccgtgtgcggcgacaccaccggcagcagcgtgaccctgggctgcctggtgaagggctacttccccgagcccgtgaccctgacctggaacagcggcagcctgagcagcggcgtgcacaccttccccgccgtgctgcagagcgacctgtacaccctgagcagcagcgtgaccgtgaccagcagcacctggcccagccagagcatcacctgcaacgtggcccaccccgccagcagcaccaaggtggacaagaagatcgagcccaagagctgcgacaagacccacacctgccccccctgccccgcccccgagctgctgggcggccccagcgtgttcctgttcccccccaagcccaaggacaccctgatgatcagcagaacccccgaggtgacctgcgtggtggtggacgtgagccacgaggaccccgaggtgaagttcaactggtacgtggacggcgtggaggtgcacaacgccaagaccaagcccagagaggagcagtacaacagcacctacagagtggtgagcgtgctgaccgtgctgcaccaggactggctgaacggcaaggagtacaagtgcaaggtgagcaacaaggccctgcccgcccccatcgagaagaccatcagcaaggccaagggccagcccagagagccccaggtgtacaccctgccccccagcagagacgagctgaccaagaaccaggtgagcctgacctgcctggtgaagggcttctaccccagcgacatcgccgtggagtgggagagcaacggccagcccgagaacaactacaagaccaccccccccgtgctggacagcgacggcagcttcttcctgtacagcaagctgaccgtggacaagagcagatggcagcagggcaacgtgttcagctgcagcgtgatgcacgaggccctgcacaaccactacacccagaagagcctgagcctgagccccggcaag9d9/fs1-67重链的氨基酸序列(seqidno:56)eiqlqqsgpvlvkpgasvkmsckasgytftdyymnwvkqshgkslewigvinpyngdtsynqkfkgkatltvdkssstaymelnsltsedsavyycaryygswfaywgqgtlitvstakttapsvyplapvcgdttgssvtlgclvkgyfpepvtltwnsgslssgvhtfpavlqsdlytlsssvtvtsstwpsqsitcnvahpasstkvdkkiepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdetddgpvsltclvkgfypsdiavewestygpennykttppvldsdgsfflyskltvsywrwykgnvfscsvmhealhnhytqkslslspg编码9d9/fs1-67重链的核苷酸序列(seqidno:57)gagatccagctgcagcagagcggccccgtgctggtgaagcccggcgccagcgtgaagatgagctgcaaggccagcggctacaccttcaccgactactacatgaactgggtgaagcagagccacggcaagagcctggagtggatcggcgtgatcaacccctacaacggcgacaccagctacaaccagaagttcaagggcaaggccaccctgaccgtggacaagagcagcagcaccgcctacatggagctgaacagcctgaccagcgaggacagcgccgtgtactactgcgccagatactacggcagctggttcgcctactggggccagggcaccctgatcaccgtgagcaccgccaagaccaccgcccccagcgtgtaccccctggcccccgtgtgcggcgacaccaccggcagcagcgtgaccctgggctgcctggtgaagggctacttccccgagcccgtgaccctgacctggaacagcggcagcctgagcagcggcgtgcacaccttccccgccgtgctgcagagcgacctgtacaccctgagcagcagcgtgaccgtgaccagcagcacctggcccagccagagcatcacctgcaacgtggcccaccccgccagcagcaccaaggtggacaagaagatcgagcccaagagctgcgacaagacccacacctgccccccctgccccgcccccgagctgctgggcggccccagcgtgttcctgttcccccccaagcccaaggacaccctgatgatcagcagaacccccgaggtgacctgcgtggtggtggacgtgagccacgaggaccccgaggtgaagttcaactggtacgtggacggcgtggaggtgcacaacgccaagaccaagcccagagaggagcagtacaacagcacctacagagtggtgagcgtgctgaccgtgctgcaccaggactggctgaacggcaaggagtacaagtgcaaggtgagcaacaaggccctgcccgcccccatcgagaagaccatcagcaaggccaagggccagcccagagagccccaggtgtacaccctgccccccagcagagacgagaccgacgacggccccgtgagcctgacctgcctggtgaagggcttctaccccagcgacatcgccgtggagtgggagagcacctacggccccgagaacaactacaagaccaccccccccgtgctggacagcgacggcagcttcttcctgtacagcaagctgaccgtgagctactggagatggtacaagggcaacgtgttcagctgcagcgtgatgcacgaggccctgcacaaccactacacccagaagagcctgagcctgagccccggc伊匹木单抗轻链的氨基酸序列(seqidno:58)diqmtqspgtlslspgeratlscrasqsvgssylawyqqkpgqaprlliygafsratgipdrfsgsgsgtdftltisrlepedfavyycqqygsspwtfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec编码伊匹木单抗轻链的核苷酸序列(seqidno:59)gacatccagatgacccagagccccggcaccctgagcctgagccccggcgagagagccaccctgagctgcagagccagccagagcgtgggcagcagctacctggcctggtaccagcagaagcccggccaggcccccagactgctgatctacggcgccttcagcagagccaccggcatccccgacagattcagcggcagcggcagcggcaccgacttcaccctgaccatcagcagactggagcccgaggacttcgccgtgtactactgccagcagtacggcagcagcccctggaccttcggccagggcaccaaggtggagatcaagagaaccgtggccgcccccagcgtgttcatcttcccccccagcgacgagcagctgaagagcggcaccgccagcgtggtgtgcctgctgaacaacttctaccccagagaggccaaggtgcagtggaaggtggacaacgccctgcagagcggcaacagccaggagagcgtgaccgagcaggacagcaaggacagcacctacagcctgagcagcaccctgaccctgagcaaggccgactacgagaagcacaaggtgtacgcctgcgaggtgacccaccagggcctgagcagccccgtgaccaagagcttcaacagaggcgagtgc伊匹木单抗重链的氨基酸序列(seqidno:60)qvqlvesgggvvqpgrslrlscaasgftfssytmhwvrqapgkglewvtfisydgnnkyyadsvkgrftisrdnskntlylqmnslraedtaiyycartgwlgpfdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkverkccvecppcpappvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg编码伊匹木单抗重链的核苷酸序列(seqidno:61)caggtgcagctggtggagagcggcggcggcgtggtgcagcccggcagaagcctgagactgagctgcgccgccagcggcttcaccttcagcagctacaccatgcactgggtgagacaggcccccggcaagggcctggagtgggtgaccttcatcagctacgacggcaacaacaagtactacgccgacagcgtgaagggcagattcaccatcagcagagacaacagcaagaacaccctgtacctgcagatgaacagcctgagagccgaggacaccgccatctactactgcgccagaaccggctggctgggccccttcgactactggggccagggcaccctggtgaccgtgagcagcgccagcaccaagggccccagcgtgttccccctggcccccagcagcaagagcaccagcggcggcaccgccgccctgggctgcctggtgaaggactacttccccgagcccgtgaccgtgagctggaacagcggcgccctgaccagcggcgtgcacaccttccccgccgtgctgcagagcagcggcctgtacagcctgagcagcgtggtgaccgtgcccagcagcagcctgggcacccagacctacatctgcaacgtgaaccacaagcccagcaacaccaaggtggacaagaaggtggagagaaagtgctgcgtggagtgccccccctgccccgccccccccgtggccggccccagcgtgttcctgttcccccccaagcccaaggacaccctgatgatcagcagaacccccgaggtgacctgcgtggtggtggacgtgagccacgaggaccccgaggtgaagttcaactggtacgtggacggcgtggaggtgcacaacgccaagaccaagcccagagaggagcagtacaacagcacctacagagtggtgagcgtgctgaccgtgctgcaccaggactggctgaacggcaaggagtacaagtgcaaggtgagcaacaaggccctgcccgcccccatcgagaagaccatcagcaaggccaagggccagcccagagagccccaggtgtacaccctgccccccagcagagacgagctgaccaagaaccaggtgagcctgacctgcctggtgaagggcttctaccccagcgacatcgccgtggagtgggagagcaacggccagcccgagaacaactacaagaccaccccccccgtgctggacagcgacggcagcttcttcctgtacagcaagctgaccgtggacaagagcagatggcagcagggcaacgtgttcagctgcagcgtgatgcacgaggccctgcacaaccactacacccagaagagcctgagcctgagccccggcaaghul2g7cdr的氨基酸序列hul2g7cdr1vh–gnwie(seqidno:62)hul2g7cdr2vh–eilpgsntnynefkfkg(seqidno:63)hul2g7cdr3vh–gghyygsswdy(seqidno:64)hul2g7cdr1vl–kasenvvtyvs(seqidno:65)hul2g7cdr2vl–gasnryt(seqidno:66)hul2g7cdr3vl–gqgysypyt(seqidno:67)参考文献本说明书中提到的全部文件均通过引用的方式并入本文。amman等人(2005)“aberrantepidermalgrowthfactorreceptorsignalingandenhancedsensitivitytoegfrinhibitorsinlungcancer”;cancerres;65;226castoldir.等人(2013)“anovelbispecificegfr/<etantibodyblockstumor-promotingphenotypiceffectsinducedbyresistancetoegfrinhibitionandhaspotentantitumoractivity”;oncogene;32,5593-5601hudsonl.g.,zeineldinr.,silberbergm.,stackm.s.(2009)“activatedepidermalgrowthfactorreceptorinovariancancer”;cancertreatres;149;203-226furugakik等人(2014)“lossofanegfr-amplifiedchromosome7asanovelmechanismofacquiredresistancetoegfr-tkisinegfr-mutatednsclccells”;lungcancer;83;44-50kawaslh,yamamotobj,wrightjw,hardingjw.mimicsofthedimerisationdomainofhepatocytegrowthfactorexhibitanti-metandanticanceractivity.j.pharmacol.exp.ther.2011;339(2):509-18.kobayashis等人(2005)“egfrmutationandresistanceofnon-small-celllungcancertogefitinib”,nengljmed;352:786-792paow.,millerv.,politik.,rielyg.,somwarr.,zakowskim.,krism.,varmush.,(2005)“acquiredresistanceoflungadenocarcinomastogefitiniborerlotinibisassociatedwithasecondmutationintheegfrkinasedomain”,plosmed,2(3);e73kramanm等人.suppressionofantitumorimmunitybystromalcellsexpressingfibroblastactivationprotein-alpha.science2010;330(6005):827–830masudah.,zhangd.,bartholomeuszc.,doiharah.,hortobagyi,g.n.,ueno,n.t.(2013)“roleofepidermalgrowthfactorreceptorinbreastcancer”;breastcancerrestreat;136(2)naldinil.,tamagnonel.,vignae.(1992)“extracellularproteolyticcleavagebyi=urokinaseisrequiredforactivationofhepatocytegrowthfactor/scatterfactor”;emboj,11:4825-4833organs.landtsaom(2011)“anoverviewofthec-metsignallingpathway”;theradvmedoncol;3(1suppl);s7-s19paow.,chmieleckij.(2010)“rational,biologicallybasedtreatmentofegfr-mutantnon-small-celllungcancer”;naturereviewscancer10,760-774pedersenmw,jacobsenhj,koefoedk,heya,pykec,haurumjs,kraghm.sym004:anovelsynergisticanti-epidermalgrowthfactorreceptorantibodymixturewithsuperioranticancerefficacy.cancerres.2010;70(2):588-97.ramakrishnanm.s.,eswaraiaha.,crombett.,piedra.,saurezg.,iyerh.,arvinda.s.(2009)“nimotuzumab,apromisingtherapeuticmonoclonalfortreatmentoftumorsofepithelialorigin”,mabs;1(1);41-48salettip.,molinarif.,dedossos.,frattinim.(2015)“egfrsignallingincolorectalcancer:aclinicalperspective”;gastrointestinalcancer:targetsandtherapy;5;21-38scambiag.,panicip.b.,ferrandinag.,battagliaf.,distefanom.,d’andreag.(1994)“significanceofepidermalgrowthfactorreceptorexpressioninprimaryhumanendometrialcancer”;intjcancer;1;26-30shienk.等人(2013)“acquiredresistancetoegfrinhibitorsisassociatedwithamanifestationofstemcell–likepropertiesincancercells”;cancerres;73(10):3051-3061smilekp.等人(2012)“epidermalgrowthfactorreceptor(egfr)expressionandmutationsintheegfrsignallingpathwayincorrelationwithanti-egfrtherapyinheadandnecksquamouscellcarcinomas”;neoplasma;59(5);508-15spanoj.p.等人(2005)“epidermalgrowthfactorreceptorsignallingincolorectalcancer:preclinicaldataandtherapeuticperspectives”;annoncol;16(2);189-194spiessc.,merchantm.,huanga.,zhengz.,yangn.,pengj.,ellermand.,shatzw.,reillyd.,yansurad.,scheerj.m.(2013)“bispecificantibodieswithnaturalarchitectureproducedbyco-cultureofbacteriaexpressingtwodistincthalf-antibodies”,natbiotech31(8):753stonea.,harringtonk,.frakesm,blank.,rajannas(2014)“egfrandc-metinhibitorsandeffectiveinreducingtumorigenicityincancer”jcarcinogmutagen5:173taylort.e.,furnarif.b.,cavaneew.k.(2012)“targetingegfrfortreatmentofglioblastoma:molecularbasistoovercomeresistance”;currcancerdrugtargets;12(3);197-209terashimam.,kitadak.,ochiaia.,ichikawaw.,kurahashii.,sakuramotos.,kataih.,sanot.,imamurah.,sasakom.(2012)“impactofexpressionofhumanepidermalgrowthfactorreceptorsegfranderbb2onsurvivalinstageii/iiigastriccancer”,clincancerres;18(21);5992-6000troianit.,martinellie.,capassoa.,morgillof.,ordituram.(2012)“targetingegfrinpancreaticcancertreatment”;currdrugtargets;13;802-10uribep.和gonzalezs.(2011)“epidermalgrowthfactorreceptor(egfr)andsquamouscellcarcinomaoftheskin:molecularbasesforegfr-targetedtherapy”;patholrespract;207(6);337-42voigtm.,braigf.,gothelm.,schultea.,lamszuzk.,bokemeyerc.,binderm.(2012)“functionalpanitumumabandcetuximabepitopes”,neoplasia;14(11);1023-1031zimmermannm.,zouhaira.,azriad.,ozsahinm.(2006)“theepidermalgrowthfactorreceptor(egfr)inheadandneckcancer;itsroleandtreatmentimplications”;radiatoncol;1;11.当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1