用于前列腺癌诊断及治疗的方法及组合物与流程
本发明主张2016年6月8日提交的美国临时申请案62/347,600的权益,其内容通过引用整体并入本文。
本发明涉及用于诊断、预后(prognosing)、监测及治疗罹患前列腺癌(prostatecancer)的一患者的多种组合物及多种方法。特别地,本发明涉及作为用于确认适合的治疗施用物的多种诊断标志物的多种ncrna及多种mirna。
背景技术:
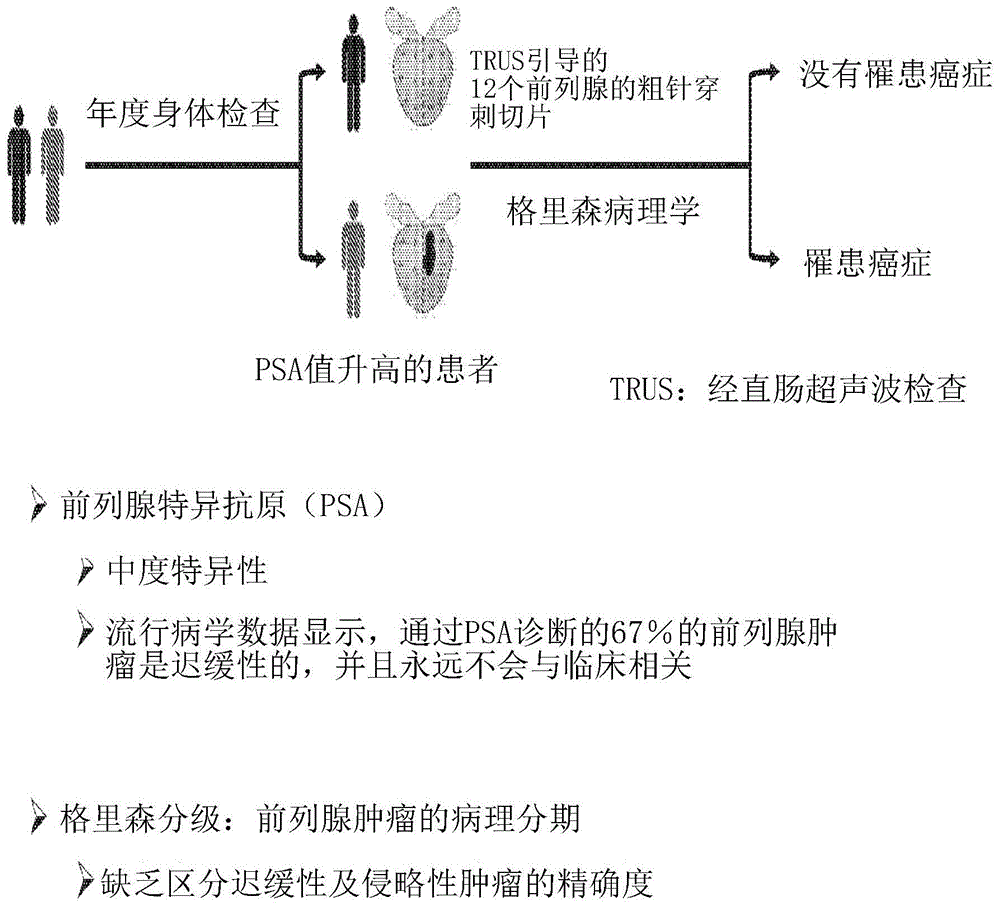
2012年11月,美国预防服务工作小组建议针对健康男性的前列腺癌的前列腺特异性抗原(prostate-specificantigen,psa)进行筛检,因为「从中度到高度确定这个服务是没有益处的,并且实际上是弊大于利的」(moyer,2012)。虽然所述工作小组承认所述测试是灵敏的、准确的且具有一低的误报率,但他们认为「几乎没有证据能够表明psa筛检能够挽救生命,但取而代之的是许多男性患有许多不致命的疾病,例如:性无能(impotence)、失禁(incontinence)、与治疗多种微小的肿瘤有关的多种心脏病」不意外地,许多泌尿科医生不同意,以及许多着名的泌尿外科肿瘤学家发表了许多强烈的不同意见(mcnaughton-collins&barry,2011;catalona等人,2012)。实际上,使用seer-stat软件及joinpoint软件回归分析对监测流行病学及最终结果(seer)的数据库进行了一仔细的、基于人群的研究,所述研究将一致的十年的追踪结果纳入考量,以确定基于发病率的死亡率及年度百分比的变化,从而得出了通过早期的psa筛检得以延长寿命的结论(wachtel等人,2013)。
为了因应持续的争议,美国泌尿学协会在2013年5月的年会上发布了新的指南(carter等人,2013),建议75岁以上的男性不应再接受筛检,以及45岁以下的男性应该被建议不要进行筛检。所述争议的核心是在psa筛检及一阳性穿刺活体组织切片(positiveneedlebiopsy)的基础下(所述阳性穿刺活体组织切片是需要确定性的治疗方式以治疗一侵袭性(致命)肿瘤),10位男性中只有3位被诊断患有前列腺癌,而10位男性中有7位以同样的方式被诊断出来罹患迟缓性(非致命)疾病,并且永远不需要治疗。不幸的是,格里森评分及psa的多个程度都没有区分迟缓性(indolent)及侵袭性(aggressive)疾病,并且在没有进行测试的情况下,几乎所有被诊断患有前列腺癌的男性都被视为患有侵袭性疾病,因此造成医疗保健系统每年花费约26亿美元的不必要的治疗费用。相较于观察性等待/积极监控(as),与根治性前列腺切除术相关的所述多种显着并发症,包括:勃起功能障碍(erectiledysfunction)、尿失禁、腹股沟疝(inguinalhernia)及肠功能受损,估计增加了50%的总治疗成本(国家癌症合作中心,2008;ramsay等人,2012)。更难以估计的是这些副作用对多位患者及其家属的非常显着的情绪影响,以及对质量调整生命年(qaly)的测量的影响(liatsikos等人,2008;mirza等人,2011)。
如上所述,与前列腺癌的过度诊断及过度治疗相关的问题不在于所述psa筛检本身,而是在于一旦通过粗针穿刺切片而确认肿瘤后,目前无法区分迟缓性及侵袭性疾病。如果不是更长的时间,这个问题已经被认知至少20年,(partin等人,1992;coffey,1993),并且至今仍然是一个主要的问题(keller等人,2007;getzenberg&carter,2012)。在此期间,已经有许多尝试开发预后检测侵袭性疾病的标志物,包括染色体套数(ploidy)、核形态(nuclearmorphology)及核基质结构(nuclearmatrixarchitecture)、基于微阵列的转录组分析、dna甲基化的状态,以及pca3及tmprss2的检测:erg基因融合的检测(mohler等人,1992;partin等人,1993;ross等人,1999;leman&getzenberg,2002;phéetal,2010;salagierski&schalken,2012;bismar等人,2013)。这些方法中没有一种被证明比格里森评分(gleasonscores)更显着优于作为前列腺肿瘤进展的多个指标,并且它们没有充分地识别迟缓性疾病(velonas等人,2013)。在没有更好的多个预后指标的情况下,甚至有些人讨论将格里森评分为6的腺癌的名称改为「癌症」以阻止立即及不必要的干预(carter等人,2012)。然而,最近重新评估格里森评分,考虑到所述评价标准的变化(montironi等人,2010)、前导时间偏差及其他因素,表明格里森评分进展是不常见的,并且前列腺肿瘤进展的所述生物学不是由格里森评分的变化所证实的(penney等人,2013)。关于所述格里森评分在识别迟缓性肿瘤方面的数值的所述争议,使得医生及患者没有可靠的测量方式来决定治疗的选择,导致许多男性不必要地选择临床干预。由于格里森评分的「黄金标准」本身并不是前列腺肿瘤进展的一可靠指标,因此所述格里森评分也妨碍了多种新的预后工具的开发。
在过去,已经开发了用于使用多个mrna的表达谱(mrnaexpressionprofiles)来区分迟缓性及侵袭性疾病的测试,然而,每种测试都表现出显着的多个缺陷及多个缺点。首先,除了一个例外,所有这些检验都使用来自根治性前列腺切除术的多个样本的肿瘤材料,并且因此顶多能够预测早期肿瘤的复发。尽管对于做出与持续的多个临床决策相关的多个术后决策可能是有用的,但它们没有解决在手术前区分迟缓性及侵袭性前列腺癌相关的多个问题。其次,许多这些基因组的方法专注于与前列腺癌进展有关的多个特定途径,包括:雄激素受体(ar)调节的基因表达(heemers等人,2011)、上皮细胞与基质细胞的相互作用(chen等人,2012)及细胞周期(cuzick等人,2011,2012;freeland等人,2013;cooperberg等人,2013)。这些测定是基于所有前列腺肿瘤都沿着一共同途径而进展的所述假设。其他商业上可获得的生物标志物的检验是利用通过一小部分的基因的实时聚合酶链锁反应(real-timepcr)产生的mrna表达谱。
2006年首次描述了人类实体瘤(包括:乳腺癌及前列腺癌)中失调的mirna表达的关联性(volinia等人,2006)。将可移植的lucap家族的前列腺异种移植模型与雄激素受体阳性及阴性的人类前列腺癌细胞系中的mirna的表达进行比较,所述比较的结果被用于定义一30个mirna的特征,其区分良性前列腺增生(benignprostatichyperplasia,bph)及根治性前列腺切除术的前列腺癌(porkka等人,2007)。这些研究还表明一21个mirna的特征可能预测着去势抗性前列腺癌(castrationresistantprostatecancer,crpc)的出现。尽管多种mirna的所述潜在的临床应用已被充分地认识(deverewhite,2009;ha,2011;casanova-salas等人,2012;maugeri-sacca等人,2012),但到目前为止,所述小组尚未使用临床材料进行后续验证的研究。
最近的一些研究调查了选择的多种mirna在源自根治性前列腺切除术及肿瘤周围的正常组织的多种肿瘤中的表达(siva等人,2009;carlsson等人,2011;schubert等人,2013)、高级别的前列腺上皮内瘤变及转移的疾病(leite等人,2013)或正常上皮组织与低(格里森评分为6)及高(格里森评分≥8)级别的多个肿瘤(walter等人,2013)。
这些研究使用了各种不同的平台,包括:商业上可用的sybr-greenpcr、
迄今为止,对前列腺癌中的多种ncrna仅进行了一次全基因组转录组的研究(martens-uzunova等人,2012)。所述研究使用illumina/solexa深度定序及微阵列分析对包含在sangermirbasev10.1中编目的723个人类mirna的affometrixmirnav2微阵列,比较来自同一患者的新冷冻根治性前列腺切除术样品及邻近正常组织中的mirna及snorna的特征。这些研究提供了用于比较在前列腺癌及肿瘤周围的良性组织(peritumoralbenigntissue)中表达的多种ncrna的所述补体的一有价值的数据集,但是对于在临床干预之前将预后肿瘤进展的一组ncrna的所述合理设计来说是没有用。由于所述技术需要快速冷冻材料,因此将它作为一般筛选技术也是有缺陷的。
因此,需要进行准确地识别患有侵袭性前列腺癌的患者的一测试,因此,可以快速为需要治疗的患者提供明确的治疗方式,同时还可以识别不需要治疗的迟缓性前列腺癌的患者,从而避免对于寿命及健康的不必要的费用及妥协。此外,需要在开始任何治疗干预(例如:手术或放射)之前提供临床可操作信息的测试。需要一种不干扰泌尿学实践中的当前工作流程的测试或负责肿瘤切片的常规诊断评估的组织病理学实验室。最后,需要进行可以进行的测试,并且及时向尿道肿瘤学团队及患者提供结果,以便在开始任何治疗之前将结果用于计划治疗。
技术实现要素:
本发明的一个方面提供了用于诊断对象中的迟缓性或侵袭性前列腺癌的方法,所述方法包括:(a)从一人类患者获得一生物样品;(b)通过将所述生物样品与在一体外检验中的一试剂接触,以检测选自于由seqidno:1至209所组成的群组中的至少10个ncrna的表达程度;以及(c)当所述至少10个ncrna的综合的表达程度高于在一迟缓性前列腺癌的生物样品中的综合的表达程度,则鉴定为所述对象罹患侵袭性前列腺癌;或者,当所述至少10个ncrna的所述综合的表达程度低于或等于在一迟缓性前列腺癌的生物样品中的所述综合的表达程度,则鉴定为所述对象罹患迟缓性前列腺癌。
在一些实施例中,所述生物样品是选自于由前列腺组织(prostatetissue)及多个前列腺细胞所组成的群组。在某些实施例中,所述前列腺组织是经过福马林固定及石蜡包埋(formalin-fixedparaffin-embedded)的组织。在某些实施例中,从所述生物样品中提取ncrna。
在一些实施例中,所述检测是选自于由反转录酶链锁反应(reversetranscriptionpolymerasechainreaction)、聚合酶链锁反应(polymerasechainreaction)及核酸杂交或其任意组合所组成的群组。在某些实施例中,所述试剂是选自于由多种寡核糖核苷酸引物(oligoribonucleotideprimers)、多种寡核苷酸引物、多种寡核糖核苷酸探针(oligoribonucleotideprobes)及多种寡核苷酸探针或其任意组合所组成的群组。
在一些实施例中,所述多个ncrna是选自于由mirna、c/d盒snorna、h/aca盒snorna、scarna、pirna及lncrna或其任意组合所组成的群组。
本发明的另一个方面提供一种筛选一对象的迟缓性或侵袭性前列腺癌的方法,所述方法包括:(a)使用包含用于多个全基因组ncrna的多个探针的一微阵列,与来自所述对象的一生物样品的多个ncrna进行杂交结合;(b)检测至少10种选自于由seqidno:1至209所组成的群组中的ncrna的多个杂交结合产物的相对丰度;以及(c)比较来自所述生物样品的所述至少10个ncrna的累积表达程度与来自一迟缓性前列腺癌的生物样品的至少10个ncrna的累积表达程度,其中所述对象中的所述至少10个ncrna的表达程度的增加是代表需要进一步治疗的侵袭性前列腺癌,并且其中所述对象的所述至少10个ncrnas的所述表达程度为等于或低于则是代表不需要进一步治疗的迟缓性前列腺癌。
在一些实施例中,所述生物样品是选自于由前列腺组织及多个前列腺细胞所组成的群组。在其他实施例中,所述前列腺组织是经过福马林固定及石蜡包埋的组织。在某些实施例中,所述方法包括:从所述生物样品中提取ncrna。
在一些实施例中,所述检测是通过下述方法来完成,所述方法是选自于由反转录酶链锁反应、聚合酶链锁反应及核酸杂交或其任意组合所组成的群组。在某些实施例中,所述试剂是选自于由多种寡核糖核苷酸引物、多种寡核苷酸引物、多种寡核糖核苷酸探针及多种寡核苷酸探针或其任意组合所组成的群组。
本发明的另一方面提供了一种治疗一对象中的侵袭性前列腺癌的的方法,所述方法包括:(a)从一人类患者获得一生物样品;(b)通过将所述生物样品与在一体外检验中的一试剂接触,以检测选自于由seqidno:1至209所组成的群组中的至少10个ncrna的表达程度;(c)当所述至少10个ncrna的综合的表达程度高于在一迟缓性前列腺癌的生物样品中的综合的表达程度,则鉴定所述对象罹患侵袭性前列腺癌;或者,当所述至少10个ncrna的综合的表达程度低于或等于在一迟缓性前列腺癌的生物样品中的综合的表达程度,则鉴定所述对象罹患迟缓性前列腺癌;以及(d)治疗所述侵袭性前列腺癌。
在一些实施例中,所述治疗是选自于由以下多种方式来治疗所述侵袭性前列腺癌的群组:(i)、部分地或完全地利用手术切除前列腺组织的手术;(ii)、施用一有效剂量的放射线;以及(iii)、施用一治疗有效量的用于治疗侵袭性前列腺癌的一药物。
在某些实施例中,所述手术是选自腹腔镜手术、腹腔镜根除性前列腺切除术(laparoscopicradicalprostatectomy)、前列腺切除术及根除性耻骨后前列腺切除术(radicalretropubicprostatectomy)。在其他实施例中,所述放射线是选自体外照射放射治疗、短程放射治疗(brachytherapy)、3维顺型治疗、伽玛刀治疗及粒子束治疗。在一些实施例中,用于治疗所述侵袭性前列腺癌的所述药物是选自一化学治疗药物及一性激素抑制剂。在其他实施例中,所述化学治疗药物是选自多西他赛(欧洲紫杉醇)、卡巴他赛(去癌达)、戈舍瑞林(诺雷德)、氟他胺(尤力欣)、比卡鲁胺(可苏多锭)、阿比特龙(泽珂)及尼鲁米特(尼鲁米特片)。在一些实施例中,所述性激素抑制剂是亮丙瑞林(柳菩林)。
在一些实施例中,通过所述至少10个ncrna的所述综合的表达程度来全部地或部分地决定用于治疗侵袭性前列腺癌的所述治疗。
图示说明
图1是用于诊断患者中的前列腺癌的当前临床实践的一示意图;
图2是用于前列腺癌患者的预后及治疗的当前临床实践的一示意图;
图3是用于诊断迟缓性或侵袭性前列腺癌的所述方法的一示意图;
图4是在多个前列腺组织切片中的ncrna的表达的一热图表示图,所述表达是通过格里森评分对多种mirna、多种c/d盒snorna及多种h/aca盒snorna所聚类而成的;
图5a是针对比较的及累积的ncrna的表达程度所进行分析的多个前列腺组织切片的一进展评分表示图,其指示已知所述结果的所述多个代表性患者(例如:迟缓性或侵袭性)的生化结果;
图5b是针对比较的及累积的ncrna的表达程度所进行分析的前列腺组织切片的一进展评分表示图,其指示未知所述结果的所述多个代表性患者(例如:迟缓性或侵袭性)的生化结果;
图6是所述方法的所述益处的一示意图;
图7是使用来自38个不同患者的前列腺组织样品中的56种mirna及多种snorna而进行计算的所述进展评分的多个瀑布图的示意图;
图8是mirna及小ncrna种类的茎环rt-qpcr的所述设计的一示意图;
图9是正向及反向引物及
图10是显示所述未转化的数据,所述数据显示每种特定的mirna/sncrna序列的多个ct曲线。
具体实施方式
本文提供了一种用于诊断一对象中的迟缓性或侵袭性前列腺癌的方法。在一些实施例中,所述方法提供了一稳固的进展评分(ps)以准确地区分来自多个患者的多个生物样品中的迟缓性及侵袭性前列腺癌。如本文所用,「侵袭性」前列腺癌由生化复发的证据来定义。临床上,这包括(1)psa的上升(以psa速度的绝对psa程度来测量);(2)转移进展的证据;重新进行切片检查时(治疗前),格里森评分的变化;或x射线或电脑断层扫描上的新转移的证据。如本文所用,「迟缓性」前列腺癌的肿瘤通过不存在侵袭性前列腺癌的肿瘤的所述多个事件来定义。
在一些实施例中,用于诊断一对象中的迟缓性或侵袭性前列腺癌的所述方法包括:从一人类患者获得一生物样品,通过将所述生物样品与在一体外检验中的一试剂接触,以检测选自于由seqidno:1至209所组成的群组中的至少10个ncrna的表达程度;以及当所述至少10个ncrna的综合的表达程度高于在一迟缓性前列腺癌的生物样品中的综合的表达程度,则鉴定为所述对象罹患侵袭性前列腺癌;或者,当所述至少10个ncrna的所述综合的表达程度低于或等于在一迟缓性前列腺癌的生物样品中的所述综合的表达程度,则鉴定为所述对象罹患迟缓性前列腺癌。
在一些实施例中,所述生物样品选自于由前列腺组织、血液、血浆、血清、尿液、尿液上清液、尿液细胞沉淀物、精液、前列腺分泌物及前列腺细胞。在特定的多个实施例中,所述生物样品是来自诊断粗针穿刺切片的经过福尔马林固定及石蜡包埋的组织。在其他实施例中,所述生物样品是从尿液外泌体分离的多种ncrna。
在某些实施例中,从各个粗针组织切片处提取多种mirna(20个至24个核苷酸)及多种ncrna(最多300个核苷酸)。如本文所用,多种小rna的所述混合物统称为多种ncrna。由于它们的大小(<300个核苷酸),所述多种ncrna是容易地从ffpe组织中提取,并且在固定或提取的过程中不会降解,从而避免了从多个ffpe组织中提取mrna所固有的问题。来自所述多个切片检查的多种ncrna的产量是足以进行多次分析的。使用affymetrix公司的多个基因芯片mir3.0阵列,所述多个基因芯片包含:针对5500种小的非编码rna(1733种mirna、1658种pre-rna、2216种sno/scarna)的多个探针,我们已经鉴定了一组在良性组织及格里森评分为8的肿瘤之间的差异表达多个的ncrna。所述分析已经鉴定了多种mirnas,所述多种mirna靶向涉及前列腺肿瘤进展的多个基因本体及涉及转移进展的几种ncrna(c/d盒及h/aca盒snorna)。在一些实施例中,一ncrna阵列在一quantstudio12kopenarraytm的仪器平台上产生,所述平台是一种新的高灵敏度、高含量、高通量的平台,其显着降低了测定的成本。
已经鉴定了多种ncrna的一选择的子集,所述选择的子集中的比较的及累积的表达程度使得能够区分多种迟缓性及多种侵袭性肿瘤。这些多种ncrna的选择与psa、格里森评分或生物途径的分析无关,并且因此是完全无偏差的。已经使用了一独立的训练集来验证了一算法,所述训练集证明所述统计方法的最小化类型1(假阴性)及类型2的错误(假阳性),以确保所述进展评分(ps)的严格区分迟缓性及侵袭性疾病。在所述当前的配置中,本文描述的所述方法没有假阴性及非常低(<5%)的假阳性率。
在一些实施例中,所述方法使用相同的openarraytm技术来询问一组ncrna(mirna、cd/盒及haca/盒)。在某些实施例中,所述方法采用依赖于每种ncrna的表达程度及临床结果的一算法(肿瘤的存在与否受限于经过12个粗针穿刺切片之后,用于所述诊断测试及生化失败存活率以及肿瘤进展的预后测试)。在前列腺癌的情况下,所述方法不依赖于血清前列腺的特异性抗原(psa)的多种程度、格里森评分(两者都不是肿瘤进展的有意义的标志物)。所述方法也独立于任何生物途径的分析。实际上,使用从多个前列腺组织样品中分离的多种非编码rna来进行所述分析,如本文描述的所述多个方法将男性分为具有前列腺癌(早期及晚期)的类别及不具有前列腺癌的类别。所述方法可以取代血清psa作为前列腺癌的主要筛选测试。
本文描述的多种方法使用相同的定制筛选来区分迟缓性及侵袭性前列腺癌,并且再次独立于病理学(格里森评分)、肿瘤体积或psa。在一些实施例中,从具有已知癌症结果(即迟缓性或侵袭性)的患者的前列腺切片检查中所提取的rna被反转录,并且与含有多种非编码rna(多种ncrna)的一全基因组阵列(例如:affymetrix公司的基因芯片mir3.0)杂交,并且鉴定了在迟缓性及侵袭性前列腺肿瘤中的差异调节的多种ncrna。与其他转录物表达的多个调节研究或测试相比,鉴定的ncrna(seqidno:1至209)的相对的及累积的表达程度与迟缓性或侵袭性前列腺癌的肿瘤中发现的表达谱相比,提供了一令人惊讶的稳固且准确的前列腺癌的多种预后的测定及结果,可以开始适当的多个治疗选择(或缺乏治疗选择)。
在一些实施例中,组合至少10个ncrna的相对的及累积的表达谱,并且与迟缓性或侵袭性前列腺癌组织中的相同的累积的表达谱进行比较。在某些实施例中,与迟缓性前列腺癌组织中的累积表达谱相比,具有较高的累积表达谱表明患者具有侵袭性前列腺癌并且需要治疗。在其他实施例中,等于或低于迟缓性前列腺癌组织中的所述累积的表达谱是表示所述患者不具有侵袭性前列腺癌及监测,但可能不需要治疗。
在一些实施例中,所选的多种ncrna的所述累积表达谱可以是所述多种ncrna的各种类型的调节表达的一聚集。在一些实施例中,所述调节的表达可以是相对于其他多种组织类型中的相同ncrna的表达的降低,例如:健康的前列腺组织、迟缓性前列腺癌组织或侵袭性前列腺癌组织。在某些实施例中,所述调节的表达可以是相对于其他多种组织类型中的相同的ncrna的表达增加,例如:健康的前列腺组织、迟缓性前列腺癌组织或侵袭性前列腺癌组织。
在一些实施例中,所选的多个ncrna的累积表达谱可以是某些ncrna的所述降低的表达程度的一聚集,以及在相同组织样品中的其他多个ncrna的所述增加的表达程度。例如,至少10个ncrna的一进展评分或相对的累积或综合表达程度可包括:相对于另一组织类型或在相同组织样品中的其他多个ncrna具有降低的表达程度的一个或多个ncrna,而剩余的一个或多个相对于同一组织样品中的另一个组织类型或其他ncrna,至少10个ncrna表现出增加的表达程度。至少10个不同调节的ncrna的累积表达程度提供了前列腺癌的肿瘤是迟缓性还是侵袭性的复杂、无偏见的指示。与仅评估单个靶分子的存在与否或简单增加或减少的其他方法不同,如同与正常组织相比,所述方法提供了对前列腺组织样品的真正无偏差、独立及多变量的分析,从而允许令人惊讶地准确诊断前列腺癌的肿瘤是迟缓性还是侵袭性的。
在一些实施例中,分析前列腺组织样品的至少10个ncrna的相对及累积表达谱,所述至少10个ncrna选自于由seqidno:1至209所组成的群组,并且与在患有迟缓性癌症的前列腺组织样品中或具有侵袭性癌症的前列腺组织样品中的相同的10个ncrna的相对及累积表达谱进行比较。
在一些实施例中,分析一前列腺组织样品的至少10个ncrna的相对及累积表达谱,所述至少10个ncrna选自于由seqidno:21、27、33、55、61、67、71、86、94、95、102、105、111、112、126、131、136、141、160、162、166、185、189、193及202组成的群组,并且与患有迟缓性癌症的一前列腺组织样品或患有侵袭性癌症的一前列腺组织样品中的相同的多种ncrna的所述相对及累积表达谱来进行比较。
在一些实施例中,分析一前列腺组织样品的至少10个ncrna的相对及累积表达谱,所述至少10个ncrna选自于由seqidno:2、6、8、12、14、18、23、40、44、46、48、80、90、91、102、106、109、110、134、141、147、148、163、194及201组成的群组,并且与患有迟缓性癌症的一前列腺组织样品或患有侵袭性癌症的一前列腺组织样品中的相同的多种ncrna的所述相对及累积表达谱来进行比较。
在一些实施例中,分析一前列腺组织样品的至少10个ncrna的相对及累积表达谱,所述至少10个ncrna选自于由seqidno:9、20、24、25、27、30、31、39、41、42、47、50、54、55、60、67、83、94、97、103、108、122、168、195及204组成的群组,并且与患有迟缓性癌症的一前列腺组织样品或患有侵袭性癌症的一前列腺组织样品中的相同的多种ncrna的所述相对及累积表达谱来进行比较。
在一些实施例中,分析一前列腺组织样品的至少10个ncrna的相对及累积表达谱,所述至少10个ncrna选自于由seqidno:17、25、37、40、48、59、62、72、80、83、87、100、104、128、144、145、151、157、158、161、168、188、196、197及209组成的群组,并且与患有迟缓性癌症的一前列腺组织样品或患有侵袭性癌症的一前列腺组织样品中的相同的多种ncrna的所述相对及累积表达谱来进行比较。
在一些实施例中,分析一前列腺组织样品的至少10个ncrna的相对及累积表达谱,所述至少10个ncrna选自于由seqidno:11、28、32、34、43、49、58、64、66、72、77、104、105、125、137、143、149、157、160、171、173、177、197、202及207组成的群组,并且与患有迟缓性癌症的一前列腺组织样品或患有侵袭性癌症的一前列腺组织样品中的相同的多种ncrna的所述相对及累积表达谱来进行比较。
在一些实施例中,分析一前列腺组织样品的至少10个ncrna的相对及累积表达谱,所述至少10个ncrna选自于由seqidno:13、15、19、33、37、38、57、63、71、76、81、84、85、89、95、112、129、131、135、146、150、155、160、200及203组成的群组,并且与患有迟缓性癌症的一前列腺组织样品或患有侵袭性癌症的一前列腺组织样品中的相同的多种ncrna的所述相对及累积表达谱来进行比较。
在一些实施例中,分析一前列腺组织样品的至少10个ncrna的相对及累积表达谱,所述至少10个ncrna选自于由seqidno:4、29、40、62、64、65、72、75、94、96、108、125、136、137、146、150、161、165、167、171、185、202、203及209组成的群组,并且与患有迟缓性癌症的一前列腺组织样品或患有侵袭性癌症的一前列腺组织样品中的相同的多种ncrna的所述相对及累积表达谱来进行比较。
在一些实施例中,分析一前列腺组织样品的至少10个ncrna的相对及累积表达谱,所述至少10个ncrna选自于由seqidno:15、24、29、32、38、43、49、53、57、63、74、82、85、96、108、114、115、124、147、150、153、181、187、203及208组成的群组,并且与患有迟缓性癌症的一前列腺组织样品或患有侵袭性癌症的一前列腺组织样品中的相同的多种ncrna的所述相对及累积表达谱来进行比较。
在一些实施例中,分析一前列腺组织样品的至少10个ncrna的相对及累积表达谱,所述至少10个ncrna选自于由seqidno:7、12、20、22、23、39、47、51、60、64、69、89、90、91、121、134、138、142、145、146、148、150、155、161及167组成的群组,并且与患有迟缓性癌症的一前列腺组织样品或患有侵袭性癌症的一前列腺组织样品中的相同的多种ncrna的所述相对及累积表达谱来进行比较。
在一些实施例中,分析一前列腺组织样品的至少10个ncrna的相对及累积表达谱,所述至少10个ncrna选自于由seqidno:6、16、53、61、74、75、96、107、113、114、115、116、123、124、127、128、130、156、166、169、174、185、186、187及190组成的群组,并且与患有迟缓性癌症的一前列腺组织样品或患有侵袭性癌症的一前列腺组织样品中的相同的多种ncrna的所述相对及累积表达谱来进行比较。
在一些实施例中,分析一前列腺组织样品的相对及累积表达谱,所述表达谱包含10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59或60个ncrna,所述多个ncrna选自于由seqidnos:1至209组成的群组,并且与患有迟缓性癌症的一前列腺组织样品或患有侵袭性癌症的一前列腺组织样品中的相同的多种ncrna的所述相对及累积表达谱来进行比较。
在一些实施例中,分析前列腺组织样品的相对及累积表达谱中的60至70、71至80、81至90、91至100、101至110、111至120,121至130、131至140、141至150、151至160、161至170、171至180、181至190、191至200或201至209的多个ncrna,所述多个ncrnas选自于由seqidno:1至209组成的群组;并且与患有迟缓性癌症的一前列腺组织样品或患有侵袭性癌症的一前列腺组织样品中的相同的多个ncrna的所述相对及累积表达谱来进行比较。
本文还提供了一种筛选一对象的迟缓性或侵袭性前列腺癌的方法。在一些实施例中,所述方法包括使用包含针对全基因组的多个ncrna的多个探针的一微阵列,杂交来自来自所述对象的一生物样品的多个ncrna;检测选自于由seqidno:1至209组成的群组的至少10个ncrna的杂交产物的相对丰度;将来自所述生物样品的至少10个ncrna的累积表达程度与来自迟缓性前列腺癌生物样品的至少10个ncrna的累积表达程度进行比较,其中所述对象中的至少10个ncrna的表达程度增加,则鉴定为所述对象罹患需要进一步治疗的侵袭性前列腺癌,并且其中所述对象中的至少10个ncrna的表达程度等于或低于所述程度的表达,则鉴定为所述对象罹患不需要进一步治疗的迟缓性前列腺癌。
本文另外提供了一种用于治疗一对象中侵袭性前列腺癌的方法,所述方法包括:从一人类患者获得一生物样品;通过将所述生物样品与在一体外检验中的一试剂接触,以检测选自于由seqidno:1至209所组成的群组中的至少10个ncrna的表达程度;以及当所述至少10个ncrna的综合的表达程度高于在一迟缓性前列腺癌的生物样品中的综合的表达程度,则鉴定为所述对象罹患侵袭性前列腺癌;或者,当所述至少10个ncrna的所述综合的表达程度低于或等于在一迟缓性前列腺癌的生物样品中的所述综合的表达程度,则鉴定为所述对象罹患迟缓性前列腺癌;并且治疗所述侵袭性前列腺癌。
在一些实施例中,所述治疗选自于由(i)、部分地或完全地利用手术切除前列腺组织的手术;(ii)、施用一有效剂量的放射线;以及(iii)、施用一治疗有效量的用于治疗侵袭性前列腺癌的一药物所组成的群组。
在一些实施例中,在一试剂盒中提供了通过将所述生物样品与在一体外检验中的一试剂接触,以检测选自于由seqidno:1至209所组成的群组中的至少10个ncrna的所述表达程度。在一些实施例中,所述试剂盒包括一第一试剂溶液,用于将多个ncrna从一患者的生物样品中分离。在一些实施例中,所述试剂盒包括一第二试剂溶液,用于检测来自所述第一试剂溶液的至少10个ncrna的多个表达程度。在一些实施例中,使用多个引物对、多个探针、多个微阵列或其组合来测定所述表达程度。在此方面,本领域的技术人员将容易地认识到存在用于多种核酸的定量表达分析的多种技术。在一些实施例中,使用各种机械及分析装置来处理含有所述生物样品的所述多种试剂,例如但不限于:多种离心机、多种热循环仪及多种荧光成像仪。
在一些实施例中,所述手术是选自腹腔镜手术、腹腔镜根除性前列腺切除术、前列腺切除术及根除性耻骨后前列腺切除术。在一些实施例中,所述放射线是选自体外照射放射治疗、短程放射治疗、3维顺型治疗、伽玛刀治疗及粒子束治疗。在一些实施例中,用于治疗所述侵袭性前列腺癌的所述药物是选自一化学治疗药物及一性激素抑制剂。在其他的实施例中,所述化学治疗药物是选自多西他赛(欧洲紫杉醇)、卡巴他赛(去癌达)、戈舍瑞林(诺雷德)、氟他胺(尤力欣)、比卡鲁胺(可苏多锭)、阿比特龙(泽珂)及尼鲁米特(尼鲁米特片)。在一些实施例中,所述性激素抑制剂是亮丙瑞林(柳菩林)。
在一些实施例中,所述治疗的选择的成功可能性或一般相容性是由所述选择及分析的多种ncrna的所述综合表达程度来确定。个体化医疗是一种将多个患者分为不同群体的一医疗程序,根据多个患者的预测反应或疾病风险,为个别的患者量身定制多种医疗决策、多种实践、多种干预措施及/多种或产品。个体化医疗、精准医疗及分层医疗的所述术语也描述了这种伴随多种疗法的概念。在一些实施例中,指示一侵袭性前列腺癌的至少10个ncrna的一综合表达程度的分析也指示所述对象是最有可能积极响应所述治疗。
在整个说明书中,除非在上下文中另有规定,否则所述词语「包括」或诸如「包含」或「含有」的多个变体将被理解为暗示包括所述步骤或元素或整数或一组步骤或元素或整数但是不排除任何其他步骤或元素或整体或一组元素或多个整体。在整个说明书中,除非另外特别说明或在上下文中另有规定,否则提及一单个步骤、物质组合物、步骤组或物质组合物组应包括一个及多个(例如:一个或多个)的步骤、物质组合物、步骤组或物质组合物组。
除非另外特别说明,否则本文所述的每个实施例都比照适用于每个其他的实施例。本领域的技术人员将理解,除了具体描述的那些内容之外,本发明易于进行变化及修改。应当理解,本发明包括所有这些变化及修改。除非另外特别说明,否则本发明的内容还包括本说明书中单独或共同提及或指出的所有步骤、特征、组合物及化合物,以及任何所有的组合或所述步骤或多个特征中的任何两个或更多个。
本发明不限于本文描述的所述多个具体实施例的范围,这些实施例仅用于举例说明的目的。如本文所述,功能等同的多种产品、组合物及方法显然在本发明的范围内。
应当理解,为了清楚起见,在单独的实施例的上下文中描述的本发明的某些特征也可以在单个实施例中组合提供。相反地,为了简洁起见,在单个实施例的上下文中描述的本发明的各种特征也可以单独地提供或以任何合适的子组合提供。
多个实例:
在以下多个实例中提供了本发明的多个实施例的多个实例。在以下多个实例中仅以说明的方式呈现,并且有助于普通技术人员来使用本发明。这些实例无意以任何方式来限制本发明的所述范围。
实例1:用于前列腺癌的粗针穿刺切片的预后平台。
用于从多个粗针穿刺切片的检查中提取及表征mirna及snorna(统称为ncrna)的标准操作方案。信息性ncrna的列表以往是用于发展所述预后诊断。使用所述比较的ncrna表达数据集从多个粗针穿刺切片处产生瀑布图,并且区分侵袭性及迟缓性肿瘤。
实例2:来自ffre核心针活组织检查的rna提取物。
所述标准处理步骤描述了去除标记及条形码化的粗针穿刺切片的多个切片的所述提取过程及处理,以在将所述多个切片送到所述实验室后获得多种rna材料。
所述样品必须包含来自前列腺的粗针穿刺切片的多个材料的至少两段厚度为10微米的ffpe组织切片。
rna提取:
a、制备
在处理或运输多个样品时,所有实验室人员都应戴上手套并用适当的去污剂净化工作环境。
当处理多种rna材料时及在所有提取过程中使用rna酶、不含dna酶的多个管及多个过滤尖管。它们被妥善地在生物危害箱中处理,并且不再用于任何目的。
在获得多种rna材料之后,多个样品管、多个rna提取柱及多个最终的洗脱管应该是立即地贴上预条形码或条形码。
b、程序
1.加入1毫升的脱蜡溶液或十六烷,并且剧烈震荡10秒。简单地离心所述管以使所述样品到达底部。取出840微升的溶剂,然后在56℃下培育3分钟,然后在室温下冷却。(如果所述混合物看起来是不透明的,则加入额外的1毫升的脱蜡溶液或十六烷来溶解过量的石蜡。去除多余的溶剂,使最终体积达到160微升)。
2.向样品管中加入150微升的缓冲溶液pkd,短暂地震荡并以11,000g离心1分钟。
3.将10微升的蛋白酶k加入较低的澄清相中。通过轻轻抽吸液体来混合。
4.在56℃下培育15分钟,然后在80℃下培育15分钟。
5.将较低的澄清相转移到一新的2毫升的微量离心管中,并且在冰上培育3分钟。以20,000g离心15分钟。对于使用qiacube进行自动式纯化,将上清液转移到2毫升的样品管rb中,并将所述多个管置于qiacube中。
6.加入16微升的dna酶加强缓冲液及10微升的第一型dna酶的储备溶液;通过倒置所述多个管来进行混合;短暂地离心。
7.在室温下培育15分钟,然后加入320微升的缓冲液rbc。利用移液器来进行混合。
8.向所述样品中加入1120微升的100%的乙醇,通过移液管充分地混合。
9.将700微升的样品转移至rneasyminielute离心柱中,并且关闭所述盖子。或者,(i)开启所述多个核酸纯化柱连接的所述真空;完成应用真空;关闭所述真空并且通风所述真空歧管;(ii)以≥8000g的速度离心30秒;丢弃流通。(重复所述步骤直到所有样品都通过所述核酸纯化柱)。
10.向所述核酸纯化柱中加入500微升的缓冲液rpe并关闭盖子。(i)打开所述真空;施加真空直到完成转移;关闭所述真空并通风真空歧管;ii)以≥8000g的转速,离心30秒;丢弃净化管。
11.向所述核酸纯化柱中加入500微升的缓冲液rpe并且关闭盖子。开启所述真空;施加真空直到完成转移;关闭真空并且使真空歧管通风。以≥8000g的转速,离心2分钟。
12.将所述核酸纯化柱置于一新的2毫升的收集管中。在所述盖子打开的情况下以全速离心5分钟。
13.将所述核酸纯化柱置于一新的预条形码的1.5毫升的收集管中。将20微升的不含rna酶的水直接加入所述核酸纯化柱膜。关闭所述盖子,并且全速离心1分钟,以洗脱rna。
后提取rna的处理:
1.使用具有1.5微升的最终洗脱液的nanodrop分光光度计来测定从每种前列腺的粗针穿刺切片的多种材料中,所获得的总rna的浓度。
2.多种rna材料应转移并储存在预条形码的96孔rna酶、无dna酶的孔盘中,其具有对应于每个孔的匹配登录号及质料控制的概要,并且储存在私人服务器上以供在电子笔记本中使用。
3.所有样品应储存在指定的-80℃的冰箱中直到准备用于分析。
实例3:用于从ffpe组织中提取rna的qiacube自动化系统。
这个标准操作程序描述了运行qiacube自动系统以从多个ffpe组织切片,进行总rna纯化的设置及程序。
所述材料必须含有至少两个厚度为10微米的ffpe组织切片,所述ffpe组织来自多种前列腺粗针穿刺切片的材料,所述多种材料已经经过脱石蜡,蛋白酶k已经被消化并且不含有多种不溶性的组织及多种材料。
rna提取:
a.制备
在处理或运输多个样品时,所有实验室人员都应戴上手套并用适当的去污剂净化工作环境。
当与qiacube一起使用时,必须使用预条形码的1.5m毫升的rna酶、不含dna酶的多个收集管及1000微升的过滤尖管(qiagencat#990352)。使用之后,它们被妥善地在生物危害箱中处理,并且不再用于任何目的。
填满rna提取物所需的所有试剂瓶,包括:缓冲液rbc、100%的乙醇、缓冲液rpe(加入100%的乙醇)及rna酶、不含dna酶的水。
在开始运行之前检所述查仪器上的喷嘴环。
b.程序
1.在2毫升的rb样品管中制备12个样品(145微升的第一型dna酶的混合物+232微升的dna酶的加强缓冲液)的第一型dna酶的培育混合物。将所述管放入微量离心管槽a中。
2.将缓冲液rbc置于位置2、将100%的乙醇置于位置3、将缓冲液rpe置于位置5,并且将rna酶、不含dna酶的水置于试剂瓶架的位置6。打开盖子,放在qiacube上。
3.在qiacube中放置两个完整的一次性1000微升的过滤嘴。
4.在转子适配器支架上设置位置1至位置12的转子适配器。(i)将
5.将所述转子适配器放入所述离心机中,其数量与所述转子适配器支架上的数量相匹配。
6.将多个样品转移至所述2毫升的多个rb样品管处,并放置在qiacube上,其具有与离心机及转子适配器支架中的数量相匹配的数量。弯曲所述盖子并将它们放在所述样品盘中所提供的盖子的位置。
7.关闭所述盖子,并且开始用10微米的ffpe组织的1个至2个切片来进行mirneasy的ffpe纯化的所述运行方案。
后提取rna的处理及qiacube的维护:
1.移除所有样品管rb,包括具有第一型dna酶的培育混合物的所述样品管及从所述垃圾箱到所述生物危害箱中的多个过滤尖管。
2.取下所述试剂瓶的架子,盖上所有瓶子以便储存。
3.从所述离心机中取出转子适配器。关闭所述具有最后的rna洗脱液的多个收集管的所述多个盖子,并且储存在-80℃的环境下,直到准备好样品。将所述多个核酸纯化柱置于所述生物危害箱中,并将所述流体丢弃到标有「硫氰酸胍」的所述垃圾桶中。将所述转子适配器放入所述生物危害箱中。
4.使用具有1.5微升的最终洗脱液的nanodrop的多个分光光度计来测定从每种前列腺的多个粗针穿刺切片的材料,以获得总rna的所述浓度。
5.将多种rna材料转移并储存在预条形码的96孔rna孔盘、无dna酶的孔盘中,其具有对应于每个孔的匹配登录号及qc概要,其储存在私人服务器上以用于电子笔记本。
6.所有样品应储存在指定的-80℃的冰箱中直到准备用于分析。
实例4:测定的设计
分子生物学的最新进展已经揭示了小的非编码rna在许多人类疾病中的新作用,并且显而易见的是,多种类型的rna的组合的作用有助于多种人类疾病的病因学。这保证了开发能够在多个临床样品中询问多种rna种类的多个新的分析。
可以将两种不同类型的rna种类的所述检测及分析,组合到一单个平台中以同时进行检测及分析(图8)。相反地,通过多个rt-qpcr的分析来扩增数据的输出,而不损害任何类型的rna的数据完整性。这个技术可进一步适用于高通量的平台,以满足多种临床应用的需求。然而,只有少数可用的测定设计的平台,例如:通过赛默飞世尔科技公司所使用的多种平台是仅能使用用于定制化测定设计所提供的任何小rna序列的最后60个核苷酸,其有时缺乏特异性。因此,在设计茎环rt-qpcr时,通过鉴定每种感兴趣的小ncrna的多个独特序列标识符号来验证所述测定的特异性是重要的。
通过赛默飞世尔科技公司的
实例5:反转录与affymetrix公司/openarray微阵列的杂交及表达谱的分析。
这个标准操作程序描述了从多个去识别及条形码的粗针穿刺切片处所获得的多种rna材料的所述制备及运行,所述制备及运行是通过quantstudiotm的12kflex实时pcr系统,在所述openarraytm平台上进行的。虽然所述openarraytm技术允许具有多个特定杂交目标的多个定制阵列,但所述各种affymetrix阵列在商业上是与多个预装杂交目标一起出售。
所述多个样品是从多个粗针穿刺切片所获得的总rna,如上所述,所述总rna已经经过预先的去识别及处理。
openarray平台上的反转录pcr(rt-pcr):
a.制备
在处理或运输多个样品时,所有实验室人员都应戴上手套并用适当的去污剂净化工作环境。
当处理多种rna材料时及在所有提取过程中使用rnase、不含dna酶的多个管及多个过滤尖管。它们在生物危害箱中经过妥善地处置,并且不再用于任何目的。
在将多种样品材料转移到并且正确对应于所述先前分配的条形码之后,多个管及多个96孔盘应该是预条形码或条形码。
需要执行所有的制备过程,并且将所述制备过程与多个冷却块一起储存在冰上直到准备在所述pcr机器上运行。
b.程序
i.cdna的合成
1.在预条形码的96孔板中,使用dna酶及无rna酶的水,将从去识别的多种活检材料中所提取的rna提取物,稀释到50纳克/3微升。样品信息及登录号将被协调地记录并以excel的格式储存,并且用于每个单独的平板以供未来的追踪。同一96孔板内的多个样品被认为是一工作批次。
2.按照以下方法制备用于cdna合成的反转录主混合物(足够用于所需的96次的反应):
3.将4.5微升的反转录主混合物装填到预条形码pcr级(dna酶、rna酶、热源、不含有dna及rna)的96孔盘中。向每个孔中加入3微升的稀释的总rna并通过移液来温和地混合。使用pcr级及无菌粘性箔来密封所述孔盘,并且短暂地离心。
4.将所述反应的孔盘在冰上培育5分钟,然后装填到所述pcr机器中以进行反转录的运行,如下表所示。
ii.前置扩增作用
1、如下所述制备用于所述前置扩增作用的多个循环的所述前置扩增作用的混合物(足够用于96个样品):
2、将22.5微升的前置扩增作用的巨大混合物装填到预条形码pcr级(dna酶、rna酶、热源、不含有dna及rna)的96孔盘中。向每个孔中加入2.5微升的cdna。用pcr级及无菌粘性箔来密封孔盘,通过倒置所述孔盘6次来混合。快速地离心。
3.将所述反应的孔盘在冰上培育5分钟,然后装载到所述pcr机器中以进行如下所示的前置扩增作用的多个循环。
iii、openarray
1.向pcr级96孔板中加入152微升的0.1倍te缓冲液。将8微升的前置扩增作用的产物转移至每个孔中,并且以1:20的比率来稀释。
2.用pcr级及无菌箔密封96孔盘,并通过将孔盘倒置六次以进行混合。短暂地离心所述孔盘。
3.将openarraytm盘加热30分钟以达到室温,并按照所述说明逐一装填openarraytm盘。将四个装载及密封的openarraytm盘组装在所述托盘上,插设在quantstudio12kflex系统中,以进行实时pcr阶段。
4.收集原始数据并用expressionsuite软件分析以获得相对表达的程度。将结果上载到所述安全的mir诊断云端以供未来的分析。
iv、反转录pcr之后,进行样品处理
使用适当的qr码来储存所有初始rna材料,并且在指定的-80℃的环境下,储存来自cdna合成、前置扩增作用及稀释的前置扩增作用的循环中的所有作用批次的96孔盘。
实例6:使用quantstudio12kflex中定制设计的56mirna定制开放阵列来对mirna进行询问。
在实施例6中,将56个sentinelmirna的多个探针预先加载到多个定制的开放阵列板上,并且提供48个相同的样品孔,以设计用于询问56种特异性mirna。
snrna由先前描述的多个患者样品来制备。如上所述合成cdna,并且将来自每种cdna的500纳克装载到各个孔中。
在这些描述的实验中。在5'末端用羧基荧光素(fam)来标记使用的所述多个探针,并且在3'末端是用tamra来标记所述相应的报告子/淬灭剂。
将所述数位pcr设定为40个循环。
在每个循环期间,所述cdna的成功扩增导致探针的置换,并且从所述特定盘中的每个目标的复制处进行切割,从而导致荧光的增加。所述相机/检测器用于报告每个孔中的每个循环结束时的总荧光量。
所述原始数据是取决于探针及循环次数。从每个孔、每个循环及每个生物样品中,检索原始荧光数据的读数。(参见表1)。
已经给出了相对于前置循环的荧光变化(δrn)并且转置以提供每个循环的荧光的相对变化。在这个示例中,随后通过多种临床描述符号(即,患者编号及核心编号)对所述数据进行分类。
实施例7:使用quantstudio12kflex中的384孔块对混合的mirna及snorna进行询问。
使用一测试组的6个小分子核糖核酸(mir15b、mir20a、mir21、mir22、mir320c及mir1275)及6个sncrna(4个h/aca盒snorna(aca20、aca34、aca42、aca54及2个c/d盒snornau35a及u74)来验证所述测定的有效询问一混合的多种mirna及多种小ncrna的能力。如本文的多个实施例中所述,使用如本文所述的多种基因特异性引物,在一单一的rt混合物中,进行反转录及扩增这些rna种类的所述多种cdna。使用相同的多个反转录cdna产物并且使用其自身的特异性rt-qpcr来成功地测定每个单独的mirna及ncrna。所述信号的采集是如实例6中所述。图10中的所述图显示未转化的数据、所述数据显示所述多个ct曲线。所述数据的所述转换是用以确定事件发生的时间,所述事件是消除与具有略微不同的杂交动力学的多个探针的所述ct的测定相关的多个问题。
对于实验来说,所述taqman探针含有fam荧光团及tamra作为所述淬灭剂。tamra可以被mgb(小沟槽结合剂)取代,以增强所述测定的特异性及灵敏性。
荧光团及猝灭剂的所述选择略微取决于使用的所述平台。根据可用的多种激发激光及所述检测系统/照相机对所述发射波长的灵敏度、可以扩展的荧光团进行所述选择。
实例8:ncrna的多种序列。
表1、ncrna的多种序列(seqidno:1至seqidno:209)
- 还没有人留言评论。精彩留言会获得点赞!