PNA探针的制作方法
本发明涉及肽核酸化合物。具体地,尽管不是唯一地,本发明涉及肽核酸单体、二聚体和/或寡聚体,其被修饰以在所需位置(例如在其骨架中)包含诸如带电部分的部分。
发明背景
dna测序是一种已作为许多研究的主题的已知方法。多种dna测序方法已被报道,包括maxim和gilbert的化学方法(a.m.maxam和w.gilbert,pnas,1977,74,560-564)和sanger的基于酶的方法(f.sanger等,pnas,1976,5463-5467)。
许多较新的方法已被报道,其分为三类:(i)通过重复单碱基添加进行测序;(ii)焦磷酸测序和(iii)用解卷积/解码的限制性酶介导的切割或激酶连接。
在pct申请公开号wo2009/037473(bradley等)中公开了这些方法的实例。
肽核酸(pna)是已经用于多种应用的合成化合物,包括作为遗传探针(参见p.paulosova和f.pellestor,ann.genetique,2004,47,349-358的综述)。
肽核酸(pna)类似于天然存在的核酸-脱氧核糖核酸(dna)和核糖核酸(rna)。然而,虽然dna和rna分别具有脱氧核糖或核糖骨架,但pna的骨架包含通过肽键连接的重复的n-(2-氨基乙基)-甘氨酸单元。pna的各种嘧啶和/或嘌呤碱基(或核碱基)通过形成酰胺键与肽骨架连接。本领域技术人员应理解,通过酰胺键与单个n-(2-氨基乙基)-甘氨酸单元连接的单个核碱基可以描述为pna单体,但是其他pna可以包括例如含有经修饰的氨基乙基-甘氨酸骨架的那些pna,例如基于吡咯烷的(r.j.worthington等,org.biomol.chem.,2007,5,249-259)和基于吲哚的dna模拟物(式9)。本领域技术人员会认识到其他合适的寡聚体。
在hyunjungjang等,journalofclinicalmicrobiology,2010,vol.48,no.9,3127-3131中讨论了使用pna阵列检测抗病毒耐药性(antivial-resistant)乙型肝炎病毒中的点突变的实例。
在huanhuanshi等,biosensorsandbioelectronics,2015,66,481-489中讨论了肽核酸(pna)微阵列的制备、检测和应用的综述。
pct申请公开号wo2009/037473(bradley等)公开了经修饰的核碱基、经修饰的pna单体及其二聚体和寡聚体、以及它们在遗传分析方法中的用途,例如核酸测序和表征单核苷酸多态性(snp)。snp代表基因组中的一种变异形式,其中基因组的特定核苷酸在群体成员之间变化。举例来说,snp可以包含两个等位基因(即特定基因座处的两个可能核苷酸之一),并且在这种情况下,群体中的一些个体可以在特定基因座携带一个snp等位基因而其他个体可以在同一基因座携带另一个等位基因。
wo2009/037473(bradley等)公开了一种pna寡聚体,其中肽骨架的一个或多个仲胺未被衍生化以包含核碱基并且保持未偶联。提供这种“空白”或“无碱基”pna单元提供了核酸序列中核碱基的改进表征。例如,这种方法可以包括使核酸与经修饰的肽核酸(pna)寡聚体(所述寡聚体能够与核酸的一部分杂交并且缺乏与核酸的核碱基互补的核碱基)接触以形成核酸/pna双链;使核酸/pna双链与包含可检测标签的修饰碱基接触。与核酸的核碱基互补的修饰核碱基与核酸/pna双链整合,然后可以通过所述可检测标签表征。
然而,已经发现在pna寡聚体探针中提供一个或多个“空白”或“无碱基”单元可能导致意想不到的困难。例如,当探针连接到固体支持物(例如,树脂支撑材料)的表面时,观察到由于在“空白”位置不存在核碱基而产生的空间可导致探针由其“正常”线性构型发生挠曲(flex)、弯曲(bend)或其它变形。这可能会导致许多问题:
首先,发现这种探针倾向不仅与待表征核酸的核碱基互补的核碱基结合,而且还与待表征的核碱基不互补的核碱基结合。这种现象可以描述为特异性降低。
其次,发现结合于与待表征(例如通过检测与包含于pna探针的“空白”位置的修饰核碱基相关的可检测标签)核酸的核碱基互补的核碱基的探针的检测功效或产率可以变化和/或可以受影响和/或减少。这种现象可以描述为灵敏度降低。
本发明的目的是消除或减轻与现有技术相关的至少一个上述问题。
发明概述
本发明基于以下发现:与使用未以这种方式修饰的pna单体制备的pna分子相比,经修饰以包含带电部分或能够在预定ph下携带电荷的部分的pna可用于提供更好地与互补核酸链杂交的pna分子。
本文描述的修饰可以应用于任何类型的基于pna的分子,包括例如pna单体、二聚体、寡聚体和基于pna的探针(为方便起见,这些基于pna的分子在下文中统称为“pna分子”)。
本领域技术人员应理解pna分子具有多种用途并且可以(在某些方案中)固定到固体基质上-在这种条件下,已发现现有技术的基于pna的分子在使用中表现出一定程度的不希望的变形、挠曲和/或弯曲。不希望的变形、挠曲和/或弯曲可能影响pna分子在测定中的性能(例如,特异性和/或灵敏度)-阻止适当的靶标结合等。
发明人已经发现,通过修饰pna单体以包括带电部分或能够在预定ph下携带电荷的部分,可以改善pna分子的稳定性,使得例如在使用中,pna分子更多容易保持其构型,表现出较少的(或没有显著的或实质的)变形、挠曲和/或弯曲-特别是当固定在表面或基质上时;由本文所述的任何修饰的pna制备的pna分子还可以在包括遗传分析和核碱基表征分析的测定中表现出改善的性能。
根据本发明的第一方面,提供了一种pna单体,其在其γ位包含带电部分或能够在预定ph下携带电荷的部分。
所述pna单体可以来自于甘氨酸单元。
通常,pna单体可以来自于n-(2-氨基乙基)-甘氨酸单元。如上所述,pna单体可以在γ位包含带电部分,或能够在预定ph下携带电荷的部分。
pna单体可具有通式:
其中:g是带电部分,或能够在预定ph下携带电荷的部分;
p1是保护基团p,或者是氢;
p2是保护基团p,或者是氢,或者是选自烷基、环烷基、芳基、芳烷基或卤素的基团;
p3是氢,或是保护基团p,或是由下式(ii)表示的基团:
其中nb是核碱基。
在整个说明书中,术语“包括”用于表示本公开的方面和实施例“包括”特定的一个特征或多个特征。术语“包括”还可以包括基本上由或由相关特征或多个特征组成的方面和/或实施例。
有利地,在pna单体的γ位提供带电部分或能够在预定ph下携带电荷的部分,允许制备具有更稳定构型的pna分子,例如pna寡聚体,特别是当探针附着在固体支持物的表面上时。这种pna寡聚体,例如pna探针,不易从其“正常”线性构型挠曲、弯曲或以其他方式变形。例如,当探针用于遗传分析方法时,例如核酸测序方法和表征单核苷酸多态性(snp),本文所述的修饰可以使探针对与待表征核酸的核碱基互补的碱基具有改善的特异性和/或改善的灵敏度。
不希望受理论束缚,建议在pna单体的γ位提供带电部分或能够在预定ph下携带电荷的部分会在pna单体中引入手性中心。
在一个实施方案中,p3不是由式(ii)表示的基团。在这种情况下,p3可以是保护基团p或可以是氢。
保护基团(“p”)应理解为是指能够进一步衍生p所连接基团的基团。
在一些实施方案中,保护基团p可选自乙酰基、n-[1-(4,4-二甲基-2,6-二氧代环己-1-亚基)乙基](dde)、芴基甲氧基羰基(fmoc)、三苯甲基、二硫化物(ardec(芳基二硫乙氧基羰基))轻裂解保护基(基于硝基藜芦酰基(nitroveratyl))、丁氧基羰基(boc)、苄氧基羰基(cbz)、三氟乙酰基(tfa)、邻苯二甲酰亚胺、苄基、烯丙氧基羰基(alloc)、甲苯磺酰基(ts)、甲氧基甲基醚(mom)、四氢吡喃醚(thp)、烯丙基醚、丁基醚、亚苄基缩醛(green,wiley-interscience,newyork,1999)。
本领域技术人员应理解,术语“核碱基”(式ii中的nb:本文中另外认为或称为“核苷酸”或“碱基”)可包含嘌呤和嘧啶。术语“核碱基”可包括,例如特定碱基腺嘌呤、鸟嘌呤、胸腺嘧啶、胞嘧啶和尿嘧啶以及变体,例如黄嘌呤、次黄嘌呤、异鸟嘌呤、尿酸和统称为“合成碱基”的核碱基组。
在式(i)化合物中,当p3是保护基团p或是氢时,肽单体的仲胺不被衍生化以包含核碱基nb。换句话说,pna骨架的仲胺不衍生为包含核碱基并且保持“未偶联”。在这种情况下,pna单体可以描述为“空白”或“无碱基”pna单体(术语“空白”是指未衍生的仲胺)。提供这种“空白”或“无碱基”pna单体在促进核酸序列中核碱基表征的方法中特别有用。合适的方法描述于例如wo2009/037473(bradley等:其全部内容通过引用并入本文)。通常,在这种情况下,p3可以是保护基团p。通过这样的提供,可以避免和/或防止假肽单体的仲胺的化学反应。
如本文所述的空白或无碱基团pna单体可用于生成pna探针。pna探针可以采取pna寡聚体的形式,其包含多个pna单体(包括至少一个是空白或无碱基单体的pna单体)。pna寡聚体(探针)可能能够与特定核酸序列杂交,并且尽管包含空白/无碱基团pna单体,但缺少与待表征核苷酸互补的碱基。
如上所述,可能利用本文所述类型的pna探针(寡聚体)的详细方法描述于wo2009/037473(通过引用并入本文),并且本发明提供用于这些方法的经修饰的pna分子。这些经修饰的分子在例如遗传分析方法(包括wo2009/037473中描述的那些核碱基/snp表征方法)中表现出更大或更好的稳定性。
本文描述的pna分子可以与一种或多种“经修饰的碱基”组合使用。术语“经修饰的碱基”可以包括含有烷基链的碱基/核碱基,所述烷基链还包含能够进行可逆共价反应的官能团。优选地,可以修饰碱基的杂环以包含烷基链和官能团。更具体地,杂环的杂原子或碳原子可以被修饰以包含烷基链和官能团。示例性的经修饰的碱基描述于wo2009/037473(其相关内容通过引用并入本文)。
在“经修饰的碱基”的上下文中,应理解能够“可逆共价反应”的官能团可以是例如包含醛和/或酮的基团,并且在一个实施方案中,可逆共价反应可以包括经修饰的碱基的醛/酮基与胺、一个酰肼和多个酰肼(a.dirksen等,j.am.chem.soc.,2006,128,15602-15603),烷氧基胺(v.a.polyakov等,j.phys.org.chem.1999,12,357-363)或醇、二醇和/或硼酸(o.abed等,chem.mater.,2006,18,1247-1260)之间的反应。在一个实施方案中,能够可逆共价反应的基团不是醇。
术语“可检测标签”可以包括标签或标记物,其例如可以光学地或以其他方式彼此区分。许多这样的标签或标记物是本领域技术人员已知的,但是,举例来说,合适的标签可包括例如荧光或质量标记化合物。更具体地,并且在一个实施方案中,本发明的经修饰的碱基/核碱基可包含一种或多种可检测标签(例如荧光团),其选自具有从例如蓝色到远红色光谱范围的光学可检测染料的标签组。可能合适的标签的实例包括,例如,丹酰、荧光素、罗丹明、德克萨斯红、iaedans、花青染料(cy3、cy3.5、cy5、cy5.5、cy7)、bodipy染料(invitrogen)、seta染料(如seta425(setabiomedicals))和/或alexafluor染料(invitrogen)。
合适的“质量标签”化合物可包括,例如,包含溴化物部分的标签或能够在质谱技术(例如maldi-tof)中提供清晰同位素模式的其他化合物、分子或部分。当经修饰的碱基是经修饰的尿嘧啶碱基时,质量标签可以不是溴。
因此,本领域技术人员应理解,本文所述的任何经修饰的核碱基可以通过例如荧光显微术或质谱技术(如maldi-tof)等检测。
有利地,本文所述的每个经修饰的碱基/核碱基的杂环可包含可检测标签,其例如通过杂原子或碳原子连接在任何数量的位置。在一个实施方案中,可以修饰杂原子以进一步包含合适的间隔/碳间隔部分,例如炔烃、亚烯基或亚炔基部分,其可以独立地被一个或多个上述可检测标签取代。举例来说,杂环的杂原子和/或经修饰的杂原子可包含一个或多个荧光团(t.s.seo等,pnas,2004,101,5488-5493;z.li等,pnas,2003,100,414-419;l.thoresen等,chem.eur.j.2003,9,4603-4610)和/或质量标签,即溴化物、氯化物(c.portal等,j.comb.chem.,2005,7,554-560)。在一个实施方案中,嘌呤和/或嘧啶杂环可以通过例如使用钯催化剂的交叉偶联反应进行修饰(l.thoresen等,chem.eur.j.2003,9,4603-4610;n.k.garg等,chem.commun.,2005,4551-4553)。
有利地,每个经修饰的碱基/核碱基可包含不同的可检测标签。以这种方式,可检测标签可以允许例如经修饰的腺嘌呤核碱基与任何其他经修饰的核碱基区别开。
pna单体可具有通式:
其中:g是带电部分,或能够在预定ph下携带电荷的部分;
p1是保护基团p,或者是氢;
p2是保护基团p,或者是氢,或者是选自烷基、环烷基、芳基、芳烷基或卤素的基团;和
nb是核碱基。
pna单体可具有通式:
其中:g是带电部分,或能够在预定ph下携带电荷的部分;
p1是保护基团p,或者是氢;和
p2是保护基团p,或者是氢,或者是选自烷基、环烷基、芳基、芳烷基或卤素的基团。
因此,式(ib)的pna单体可描述为“空白”或“无碱基”单体,其包含代替核碱基的boc保护基团。
通常,可以衍生n-末端和/或c-末端位置中的任一个以包含保护基团(如上所述)。因此,pna单体可以被保护和/或可以包含n-末端或c-末端位置的保护基团p。
如果p1是保护基团p,则p2是氢,反之亦然。
p1可以是保护基团p,p2可以是氢。在这种情况下,pna单体可具有通式:
当g是带电部分时,g可以包含一个或多个负电荷,和/或g可以包含一个或多个正电荷。
在一个实施方案中,g可以包括一个负电荷或一个正电荷。
g可包含一个或多个带负电荷的基团,其选自由羧酸盐或酯、磺酸盐或酯、硫酸盐或酯、膦酸盐或酯、磷酸盐或酯组成的组。
g可包含一个或多个带正电荷的基团,其选自由胍鎓、季铵、鏻、锍组成的组。
g可以包括可以在第一ph下不带电荷,但可以在第二或预定ph下携带电荷的一个或多个基团(例如中性基团)。在这种情况下,g可以选自胺、酰肼、肼、胍、烷氧基胺、磺酸和/或其衍生物、和/或膦酸和/或其衍生物。
g可以包含能够在第一ph或ph范围携带第一电荷(例如负电荷)和在第二ph或ph范围携带第二电荷(例如正电荷)的一个或多个基团。
应当理解,技术人员可以基于在使用来自pna单体的pna寡聚体期间预期的条件选择合适的基团“g”。特别地,当所得pna寡聚体打算用于检测时,技术人员可以选择合适的基团“g”,使得基团“g”在检测的ph环境下携带电荷部分。
当g是能够在预定ph下携带电荷的基团时,基团g能够携带电荷的ph可以在6-8的范围内。
当g能够带负电荷时,基团g能够携带负电荷的ph可以在6-8的范围内。
当g能够带正电荷时,基团g能够携带正电荷的ph可以在6-8的范围内。
在一些实施方案中,能够在预定ph下携带负电荷的基团g可包含酸和/或其衍生物,例如酯。基团g可包括羧酸或其衍生物、磺酸或其衍生物、硫酸或其衍生物、膦酸或其衍生物、磷酸或其衍生物。
在一些实施方案中,能够在预定ph下携带正电荷的基团g可包含碱和/或其衍生物。基团g可包含胺、酰肼、肼、胍鎓、烷氧基胺和/或其衍生物。
在一个实施方案中,g可具有通式:
在这种情况下,pna单体可具有通式:
其中:fmoc是芴基甲氧基羰基。
根据本发明的第二方面,提供了具有下述通式的pna单体:
其中:g是带电部分,或能够在预定ph下携带电荷的部分;
p1是保护基团p,或者是氢;
p2是保护基团p,或者是氢,或者是选自烷基、环烷基、芳基、芳烷基或卤素的基团;
p3是氢,或是保护基团p,或是由下式(ii)表示的基团:
其中nb是核碱基。
在一个实施方案中,p3不是由式(ii)表示的基团。在这种情况下,p3可以是保护基团p或可以是氢。
关于本发明的任何其他方面描述的特征可以同样适用于根据本发明的第二方面的pna单体,并且出于简洁的原因在此不再重复。
根据本发明的第三方面,提供了一种pna二聚体,其在至少一个γ位包含带电部分或能够在预定ph下携带电荷的部分。
pna二聚体可以来自于甘氨酸单元。
通常,pna二聚体可以来自于n-(2-氨基乙基)-甘氨酸单元。如上所述,pna二聚体可以在一个或两个重复单元的γ位包含带电部分,或能够在预定ph下携带电荷的部分。
pna二聚体可具有通式:
其中:g1和g2独立地为氢或g,其中g是带电部分,或能够在预定ph下携带电荷的部分;
p1是保护基团p,或者是氢;
p2是保护基团p,或者是氢,或者是选自烷基、环烷基、芳基、芳烷基或卤素的基团;
p3为氢,或为保护基团p,或为下式(ii)所示的基团;
其中nb是核碱基;
条件是:
g1和g2中至少有一个是g,
如果p3是氢或保护基团p,那么g1=g,和
如果p4是氢或保护基团p,那么g2=g。
当g是带电部分时,g可以包含一个或多个负电荷,和/或g可以包含一个或多个正电荷。
在一个实施方案中,g可以包括一个负电荷或一个正电荷。
g可包含一个或多个带负电荷的基团,其选自由羧酸盐或酯、磺酸盐或酯、硫酸盐或酯、膦酸盐或酯、磷酸盐或酯组成的组。g可包含一个或多个带正电荷的基团,其选自由胍鎓、季铵、鏻或锍组成的组。
g可以包括可以在第一ph下不带电荷,但可以在第二或预定ph下携带电荷的一个或多个基团(例如中性基团)。在这种情况下,g可以选自胺、酰肼、肼、胍、烷氧基胺、磺酸和/或其衍生物、和/或膦酸和/或其衍生物。
g可以包含一个或多个能够在第一ph或ph范围携带第一电荷(例如负电荷)和/或在第二ph或ph范围内携带第二电荷(例如正电荷)的基团。
应当理解,技术人员可以基于在使用来自pna单体的pna寡聚体时预期的条件选择合适的基团“g”。特别地,当所得pna寡聚体打算用于检测时,技术人员可以选择合适的基团“g”,使得基团“g”在检测的ph环境下携带电荷部分。
当g是能够在预定ph下携带电荷的基团时,基团g能够携带电荷的ph可以在6-8的范围内。
当g能够携带负电荷时,基团g能够携带负电荷的ph可以在6-8的范围内。
当g能够携带正电荷时,基团g能够携带正电荷的ph可以在6-8的范围内。
在一些实施方案中,能够在预定ph下携带负电荷的基团g可包含酸和/或其衍生物,例如酯。基团g可包括羧酸或其衍生物、磺酸或其衍生物、硫酸或其衍生物、膦酸或其衍生物、磷酸或其衍生物。在一些实施方案中,能够在预定ph下携带正电荷的基团g可包含其碱和/或衍生物。基团g可包含胺、酰肼、肼、胍鎓、烷氧基胺和/或其衍生物。
在一个实施方案中,g可具有通式:
通常,可以衍生n-末端和/或c-末端位置中的任一个以包含保护基团(如上所述)。因此,pna单体可以被保护和/或可以包含n-或c-末端位置的保护基团p。
在一个实施方案中,如果p1是保护基团p,则p2是氢,反之亦然。
在优选的实施方案中,p1是保护基团p,p2是氢。
关于本发明的任何其他方面描述的特征可以同样适用于根据本发明的第三方面的pna二聚体,并且出于简洁的原因在此不再重复。
根据本发明的第四方面,提供了具有下述通式的pna二聚体:
其中:g1和g2独立地为氢或g,其中g是带电部分,或能够在预定ph下携带电荷的部分;
p1是保护基团p,或者是氢;
p2是保护基团p,或者是氢,或者是选自烷基、环烷基、芳基、芳烷基或卤素的基团;
p3为氢,或为保护基团p,或为下式(ii)所示的基团;
其中nb是核碱基;
条件是:
g1和g2中至少有一个是g;
如果p3是氢或保护基团p,那么g1=g,和
如果p4是氢或保护基团p,那么g2=g。
关于本发明的任何其他方面描述的特征可以同样适用于根据本发明的第四方面的pna二聚体,并且出于简洁的原因在此不再重复。
根据本发明的第五方面,提供了一种pna寡聚体,其中至少一个重复单元在其γ位包含带电部分或能够在预定ph下携带电荷的部分。
通常,用于获得pna寡聚体的pna单体,或pna寡聚体的一个或多个重复单元,来自于n-(2-氨基乙基)-甘氨酸单元。如上所述,pna单体或pna寡聚体的一个或多个重复单元可以在其γ位包含带电部分,或能够在预定ph下携带电荷的部分。
pna寡聚体可具有通式:
其中:g是带电部分,或能够在预定ph下携带电荷的部分;
nb是核碱基;和
l≥0;m≥0;n≥0,条件是l+m+n≥2且n+m≥1。
优选地,l≥1。
优选地,m≥1。
通常,m=1。
优选地,n≥1。
应当理解,式(v)的pna寡聚体的重复单元可以不必顺序提供或作为嵌段1、m和n的嵌段聚合物提供,但重复单元可以以任何顺序提供。
通常,寡聚体中pna单元的总数(1+m+n)可以在5-50的范围内,例如7-40,例如10-30,通常为12-24。
应当理解,在其各自的γ位包含带电部分或能够在预定ph下携带电荷的部分的重复单元的数目,和/或式(v)中具有“g”部分的单元的数目,可以取决于为pna分子(例如pna寡聚体)设想的特定应用。
通常,在其各自的γ位包含带电部分或能够在预定ph下携带电荷的部分的重复单元的数目,和/或式(v)中具有“g”部分的单元的数目可以是在1-10的范围内,例如2-8,例如3-5。换句话说,(n+m)可以在1-10的范围内,例如2-8,例如3-5。
例如,已发现,对于具有约12-22个重复单元的pna分子/寡聚体,许多重复单元在其各自的γ位包含带电部分或能够在预定ph下携带电荷的部分,和/或式(v)中具有“g”部分的单元的数目在3-5的范围内,提供了显著改善的性能。
在其各自的γ位包含带电部分或能够在预定ph下携带电荷的部分的重复单元的数量和/或式(v)中具有“g”部分的单元的数目与重复单元总数的比例可以在1∶20-1∶1的范围内,通常为1∶10-1∶2,例如1∶5-1∶2。
比例(n+m)/(1+m+n)可以在1∶20-1∶1的范围内,通常为1∶10-1∶2,例如1∶5-1∶2。
通常,当pna分子包含“空白”或“无碱基”单元时,“空白”或“无碱基”单元在γ位包含带电部分或能够在预定ph下携带电荷的部分。已发现在“空白”或“无碱基”单元的γ位提供带电部分或能够在预定ph下携带电荷的部分,提供了pna分子的显著改善的性能。
通常,m=1。
在γ位包含带电部分或能够在预定ph下携带电荷的部分的重复单元可以分布在pna分子中,以提供最佳的稳定性和/或性能。
pna寡聚体可以包含至少一部分,其中在其γ位包含带电部分或能够在预定ph下携带电荷的部分的每个重复单元每1-5个单元(例如每2-4个单元)分布在pna寡聚体的所述部分中。
当pna分子包含“空白”或“无碱基”单元(其在γ位包含带电部分或能够在预定ph下携带电荷的部分)时,pna寡聚体包含与“空白”或“无碱基”单元相邻或附近的至少一部分,其中在其γ位包含带电部分或能够在预定ph下携带电荷的部分的每个重复单元每1-5个单元(例如每2-4个单元)分布在该部分中。
不希望受理论束缚,暗示“空白”或“无碱基”单元附近或周围的“经修饰”单元的存在和/或分布可改善pna分子(例如pna寡聚体)的尺寸稳定性和/或性能。
“空白”或“无碱基”单元可位于pna寡聚体的一个或多个末端的远端。通常,“空白”或“无碱基”单元可以位于距离pna寡聚体的一个或多个末端(优选两个末端)至少一个,例如至少两个,例如至少三个重复单元。通过这样的设置,可以改善探针的性能。应当理解,pna寡聚体内“空白”或“无碱基”单元的确切位置,和/或“空白”或“无碱基”单元相对于pna寡聚体的一个或多个末端的距离,可以取决于pna寡聚体的总长度和探针的特定应用。
当g是带电部分时,g可以包含一个或多个负电荷,和/或g可以包含一个或多个正电荷。
在一个实施方案中,g可以包括一个负电荷或一个正电荷。
g可包含一个或多个带负电荷的基团,其选自由羧酸盐或酯、磺酸盐或酯、硫酸盐或酯、膦酸盐或酯、磷酸盐或酯组成的组。
g可包含一个或多个带正电荷的基团,其选自由胍鎓、季铵、鏻或锍组成的组。
g可以包括可以在第一ph下不带电荷,但可以在第二或预定ph下携带电荷的一个或多个基团(例如中性基团)。在这种情况下,g可以选自胺、酰肼、肼、胍、烷氧基胺、磺酸和/或其衍生物、和/或膦酸和/或其衍生物。
g可以包含一个或多个能够在第一ph或ph范围携带第一电荷(例如负电荷)和/或在第二ph或ph范围内携带第二电荷(例如正电荷)的基团。
应当理解,技术人员可以基于在使用来自pna单体的pna寡聚体期间预期的条件选择合适的基团“g”。特别地,当所得pna寡聚体打算用于检测时,技术人员可以选择合适的基团“g”,使得基团“g”在检测的ph环境下携带电荷部分。
当g是能够在预定ph下携带电荷的基团时,基团g能够携带电荷的ph可以在6-8的范围内。
当g能够带负电荷时,基团g能够带负电荷的ph可以在6-8的范围内。
当g能够带正电荷时,基团g能够带正电荷的ph可以在6-8的范围内。
在一些实施方案中,能够在预定ph下带负电荷的基团g可包含酸和/或其衍生物,例如酯。基团g可包括羧酸或其衍生物、磺酸或其衍生物、硫酸或其衍生物、膦酸或其衍生物、磷酸或其衍生物。
在一些实施方案中,能够在预定ph下携带正电荷的基团g可包含碱和/或衍生物。基团g可包含胺、酰肼、肼、胍鎓、烷氧基胺和/或其衍生物。
在一个实施方案中,g可具有通式:
本文所述的pna分子,例如pna寡聚体,可以与支持物连接、结合和/或相关联。
在一个实施方案中,pna分子可以共价连接到支持物上。
支持物可包含固体支持物。
支持物可以以二维和/或基本平坦的表面的形式提供,例如膜、薄膜、片等。
支持物可包括膜。膜可包括基于聚合物的膜,例如尼龙或尼龙官能化的膜。
支持物可包含硅酸盐表面。硅酸盐表面可包括官能化玻璃表面或硅表面。支持物可以以颗粒、珠子等的形式提供。在这种情况下,支持物可包括树脂支持物,例如交联聚苯乙烯微珠、交联聚苯乙烯顺磁微珠、交联聚苯乙烯彩色标记微珠(例如,来自luminexinc.)、聚苯乙烯乳胶珠等。支持物(例如二维支持物和/或颗粒支持物)可包含和/或可由表面修饰的材料制成,例如表面修饰的树脂。所述材料可包含经修饰以并入化学基团的表面,所述化学基团能够与pna分子或其组分(例如用于获得pna寡聚体的pna单体)在n末端或c末端位置结合(例如共价结合)。
关于本发明的任何其他方面描述的特征可以同样适用于根据本发明的第五方面的pna寡聚体,并且出于简洁的原因在此不再重复。
根据本发明的第六方面,提供了具有下述通式的pna寡聚体:
其中:g是带电部分,或能够在预定ph下携带电荷的部分;
nb是核碱基;和
l≥0;m≥0;n≥0,条件是l+m+n≥2且n+m≥1。
优选地,l≥1。
优选地,m≥1。
通常,m=1。
优选地,n≥1。
应当理解,式(v)的pna寡聚体的重复单元可以不必顺序提供或作为嵌段l、m和n的嵌段聚合物提供,但重复单元可以以任何顺序提供。
通常,寡聚体中pna单元的总数(1+m+n)可以在5-50的范围内,例如7-40,例如10-30,通常为12-24。
关于本发明的任何其他方面描述的特征可以同样适用于根据本发明的第六方面的pna寡聚体,并且出于简洁的原因在此不再重复。
根据本发明的第七方面,提供了如本文所述的经修饰的pna分子(例如pna寡聚体)在遗传或核酸分析方法中的用途。
应理解,术语“遗传”或“核酸”分析方法可包括,例如,旨在表征、鉴定和/或测序核酸的核碱基的方法。在一个实施方案中,此类方法可用于表征单个核苷酸,单核苷酸多态性(snp)和/或核酸测序。
因此,短语“表征核碱基”可以被认为包括识别或确定特定核酸序列的特定核碱基的行为-换句话说,鉴定特定核苷酸包含哪个核碱基。在使用所述方法表征snp的情况下,术语“表征”可以包括确定特定核酸序列中存在哪个特定snp等位基因(或核碱基)的行为。
在一个优选的实施方案中,用于遗传分析方法(例如表征核酸序列中的一个或多个核苷酸的方法)的经修饰的pna分子(例如pna寡聚体)可能缺乏与待表征核苷酸的碱基互补的碱基。在这种情况下,pna寡聚体可以描述为包含“空白”或“无碱基”pna单元。
关于本发明的任何其他方面描述的特征可以同样适用于根据本发明的第七方面的用途,并且出于简洁的原因在此不再重复。
根据本发明的第八方面,提供了一种制备pna分子的方法,例如根据本发明的第一或第二方面的pna单体,该方法包括:
提供根据式(a3)的化合物;
使式(a3)化合物与含核碱基的酸衍生物或保护基团p反应;和
水解。
其中g是带电部分,或能够在预定的ph下携带电荷的部分,和
其中p1是保护基团。
含核碱基的酸衍生物可以是根据式nb-1的化合物。
其中nb是核碱基。
因此,该方法可包括根据方案1的反应:
在一个实施方案中,式(a3)化合物中引入的保护基团p可以是boc保护基团。
在一个实施方案中,保护基团p1可以是fmoc。
该方法可包括根据方案2的反应:
因此,式(a5)化合物可称为无碱基或“空白”pna单体。
该方法可包括制备式(a3)化合物。
该方法可包括n-保护的α-修饰的甘氨酸化合物(例如根据式(a1)的化合物)的胺化。
胺化可包括使n-保护的α-修饰的甘氨酸化合物(例如式(a1)的化合物)与甘氨酸甲酯反应。
胺化可包括根据方案3的反应:
该方法可包括制备式(a1)的化合物。
该方法可包括氧化根据式(a0)的化合物。
氧化可包括根据方案4的反应。
通常,可以衍生n-末端和/或c-末端位置中的任一个以包含保护基团(如上所述)。因此,pna单体可以被保护和/或可以包含n-或c-末端位置的保护基团p。
在一个实施方案中,如果p1是保护基团p,则p2是氢,反之亦然。
在优选的实施方案中,p1是保护基团p,p2是氢。在这种情况下,pna单体可具有通式:
关于本发明的任何其他方面描述的特征可以同样适用于根据本发明的第八方面的方法,并且出于简洁的原因在此不再重复。
根据本发明的第九方面,提供了制备根据本发明的第五或第六方面的pna寡聚体的方法,该方法包括使根据本发明的第一或第二方面的一个或多个pna单体反应,以便形成pna寡聚体。
该方法可包括使根据本发明的第一或第二方面的一个或多个pna单体(即在γ位具有基团“g”的pna单体)与不同的pna单体反应,例如在γ位不包含基团“g”的一个或多个pna单体。
该方法可包括使用在n-末端包含保护基团p的一个或多个pna单体合成pna寡聚体。在一个实施方案中,该方法可以包括使用dde-保护的pna单体按照bradley等,tetrahedron,2005,61,8295-8305中公开的方法在固相(j.j.diaz-mochon等,org.lett.2004,6,1127-1129)合成pna寡聚体。
该方法可以包括将pna单体固定在支持物(例如固体支持物)上的预备步骤,例如通过其c-末端。
该方法可以包括通过经修饰的支持物和pna单体的c-末端之间的共价键合来固定pna单体。
应当理解,固定在支持物上或与支持物结合的pna单体可以是根据本发明第一方面的pna单体,或者在γ位不包含基团“g”的不同pna单体,这取决于带电部分要在pna寡聚体中所处的一个或多个位置。
关于本发明的任何其他方面描述的特征可以同样适用于根据本发明的第九方面的方法,并且出于简洁的原因在此不再重复。
根据本发明的第十方面,提供了一种表征核酸序列中的核苷酸的方法,所述方法包括以下步骤:
(a)使核酸与本文所述的肽核酸(pna)寡聚体接触,所述pna寡聚体能够与所述核酸的一部分杂交,以形成核酸/pna双链;和
(b)使核酸/pna双链与一种或多种选自下组的经修饰的碱基接触:
其中y是能够可逆共价反应的官能团;
x1-x4是可检测标签,间隔-标签组合或氢;和
z是碳或氮;
其中pna寡聚体包含能够与官能团y可逆地反应的部分,并且其中与核酸/pna双链整合的经修饰的碱基与待表征核苷酸的碱基互补,所述核苷酸通过质谱法或通过经修饰的碱基的可检测标签表征。
在一个优选的实施方案中,pna寡聚体可以缺少与待表征核苷酸的碱基互补的碱基。在这种情况下,pna寡聚体可以描述为包含“空白”或“无碱基”pna单元。
pna寡聚体可具有通式:
其中:g是带电部分,或能够在预定ph下携带电荷的部分;
nb是核碱基;和
l≥1;m≥0;n≥0,条件是l+m+n≥2且n+m≥1。
优选地,m≥1。
通常,m=1。
优选地,n≥1。
在一个实施方案中,pna分子可以连接到支持物上。通常,pna分子可以共价连接到支持物上。
支持物可包含固体支持物,例如,关于根据本发明第五方面的pna寡聚体中所述的支持物。
关于本发明的任何其他方面描述的特征可以同样适用于根据本发明的第十方面的方法,并且出于简洁的原因在此不再重复。
附图说明
现在将参考以下附图详细描述本发明,附图示出:
图1:用于制备根据本发明实施方案的pna单体的反应方案;
图2:表示测试pna探针的比色方法的方案;
图3:测试的pna分子的实例;
图4:测量图3的pna分子的强度的结果;
图5:测试的pna分子的替代实例;
图6:对图5的pna分子测量的强度结果;
图7:测试的pna分子的替代实例;
图8:对图8的pna分子测量的强度结果;
图9:对pna分子的替代实施方案测量的强度的结果;
图10:使用不同支持物测试的pna分子的实例;
图11:对图10的pna分子测量的强度的结果。
图12:表示用于测试pna探针的两种替代方法的方案:a)化学发光方法(使用酶标仪);b)荧光方法(利用流式细胞术)。
图13:表1(见下文)中描述的pna寡聚体的性能。(+)阳性信号-oligo122(15nm)。(-)阴性信号-水作为对照。
图14:表2(见下文)中描述的pna寡聚体的流式细胞术分析。a)使用含有pna寡聚体dgl21_6.0,smart-a-核碱基-生物素和oligodna21(15nm)的微球进行微球标记;b)作为阴性对照的水(无标记)。
图15:表2(见下文)中报告的pna寡聚体的流式细胞术分析。使用含有pna寡聚体的dgl21_2.0(a)和dgl21_3.0(b),smart-a-核碱基-生物素和oligodna21(15nm)的微球进行微球标记。
实施例
制备
单体制备
制备了本发明的γ-修饰的含核碱基的和“空白”pna单体。
在该实施方案中,pna单体基于(l)谷氨酸氨基衍生物。
在该实施方案中,如下制备含核碱基的γ-修饰的pna单体(a8)和“空白”γ-修饰的pna单体(a9)。
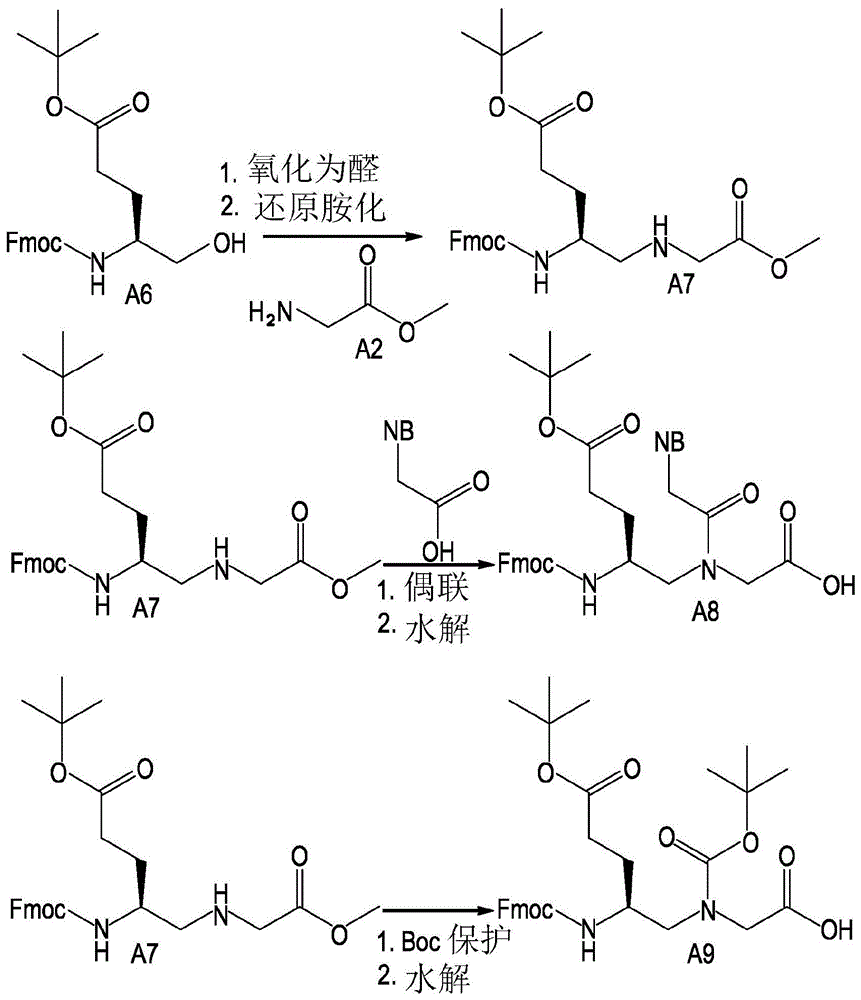
在第一步中,通过1)氧化和2)式(a6)的(l)fmoc-glutamol的还原胺化制备式(a7)的γ-修饰的化合物。将醇氧化成醛(ibx或dmp),然后在还原胺化条件下使其与甘氨酸甲酯(a2)反应,得到γ-修饰的化合物(a7)。
在第二步中,使γ-修饰的化合物(a7)反应得到含核碱基的pna单体(a8)或“空白”pna单体(a9)。
为了制备含核碱基的pna单体(a8),将γ谷氨酸化合物(a7)与核碱基(a、c、g、t)偶联,然后在水解条件下处理得到γ-修饰的含核碱基的pna单体(a8)。
为了制备手性“空白”pna单体(a9),用保护基团保护化合物(a7)的仲胺,在该实施方案中为boc,并且在水解条件下处理所得产物以获得“空白”pna单体(a9)。
这在图1的反应方案中说明。
pna分子
制备和评估了各种pna分子,包括含有和/或来自于上述单体a8和a9的pna寡聚体。
为了评估pna分子的特异性和灵敏度,使用了经生物素修饰的smartc核碱基。使用在其n-末端通过氨基聚乙二醇化基团支撑在尼龙膜上的pna探针进行比色法(如图2的方案中所示)。
在该方法中,将在其n-末端用氨基聚乙二醇化基团修饰的destina探针(10至100μm溶液)固定在immunodyneabc(来自pall的活化尼龙6.6膜)上。使用30μlsmart-c-peg-生物素(smart“读出碱基(readerbase)”)(100μm),45μl100nm的核酸链(kwtdna和k12sdna)或45ulpcrkwt和k12s以及20μl还原剂氰基硼氢化钠(15mm)和205μl含0.1%sds的0.1m柠檬酸盐缓冲液(ph6)制备destina主混合物。然后将destina主混合物加到斑点膜上并在41℃下温育20至30分钟。然后使用真空歧管将膜用0.5x盐水柠檬酸钠(ssc)和0.5%十二烷基硫酸钠(sds)洗涤两次。用含有bsa和酪蛋白的封闭溶液将膜封闭5分钟,然后将链霉抗生物素蛋白-碱性磷酸酶溶液加到膜上并在29℃下温育5分钟。然后使用真空歧管将膜用tris-hcl0.1m/吐温200.5%洗涤四次。最后,加入nbt/bcip显色溶液并在36℃温育8分钟。洗涤步骤后,拍摄膜的照片并测量响应强度。图像由led照明辅助的lifecam拍摄。通过光密度图像软件测量信号强度。信号值是与同一膜内的生物素标记强度相关的任意单位。
a)含有6个γ-修饰单元和“未修饰”无碱基位置的pna分子
将含有6个γ-修饰单元(以黑色表示)并具有“未修饰”无碱基位置的四种不同pna探针(如图3所示)固定在尼龙膜上并进行测试。
特别地,以白色显示的重复单元在γ位没有任何取代基,并且以黑色显示的重复单元在其γ位具有含羧酸基团的部分。
探针的特异性和灵敏度评估如下:
(i)特异性:当与以下物质反应时,两种pna探针之间的最高信号差异:
(a)kwtdna(阳性对照-核酸链的一部分,其含有作为待表征的核苷酸“g”;因此该核苷酸通过经修饰的核碱基携带的可检测标签来表征,在这种情况下,遵循沃森和克里克配对规则,经修饰的碱基是“c”)或
(b)k12sdna(阴性对照-核酸链的一部分,其含有作为待表征的核苷酸“a”;因此该核苷酸不应通过经修饰的核碱基携带的可检测标签来表征,因为其互补的经修饰碱基“t”不携带可检测标签)。
(ii)灵敏度:使用dnakwt时,测试的四种探针12src-12dav-13src-13dav给出的信号应该相似。
kwtdna阳性对照和k12s阴性对照dna的特异性结构和每个探头测量的信号结果如图4所示。
在图4中,将来自pcr扩增和pna(dgl)序列的dna进行比对。错配的核苷酸加下划线。探针在100μm下被发现。
可以发现,除k13src外,所有四种探针的特异性(kwt和k12s膜之间的信号差异)非常好。还发现,敏感性(如果与同一膜内的k12dav和k13dav相比,探针k12src和k13src提供的信号强度的差异)不令人满意(76-90对44-44),并且难以基于图3所示序列进行预测和理解。
b)在无碱基或“空白”位置含有可替代变体的pna分子
固定在尼龙膜上并按照图2测试的探针的特定结构显示在下面的图5中。在这种情况下,探针在50μm下被发现(图4中测试的6-neg探针浓度的一半)。
在图5中,glu探针在c末端和n末端具有标准谷氨酸单元。u和glu对应于在γ位没有任何取代基的无碱基单元。cbu对应于在其γ位包含中性(甲基)基团的无碱基单元。cbc对应于在其γ位具有含羧酸基团的部分的无碱基单元。
每个探头测量的信号结果如图6所示。
可以发现,cbc探针(其中单元在无碱基位置含有羧基)在四种不同探针(k12src、k12dav、k13src和k13dav)之间表现出非常相似的强度,同时保持可接受的特异性水平。但是,信号强度相对较低。
还发现,其他探针在4种类型的探针之间的强度方面承受高水平的变化。
c)在无碱基或“空白”位置含有替代变体的pna分子,以及含有核碱基的其他单元的变体
固定在尼龙膜上并按照图2测试的探针的特定结构显示在下面的图7中。探针在10、20和50μm下被发现。
每个探头测量的信号结果如图8所示。
可以发现,就特异性而言,3rcc构型对于pnak12src和k12dav是最佳的(分别为55对3和55对5)。在该构型中,空白位置在每一侧与在其γ位具有含羧酸基团的部分的核碱基单元被在γ位没有任何取代基的核碱基单元分开。与使用6negpna结构获得的结果不同,该构型还允许信号具有相似的强度。还发现,当在其γ位具有含羧酸基团的部分的核碱基单元不与无碱基手性单元(3cc探针)紧邻时,探针表现更好。
还发现,标准探针(u和glu探针,其仅在c和n末端通过其天然氨基酸谷氨酸基团具有负电荷)产生较低的特异性,因为当使用阴性对照dnak12s时它们触发更高的信号。
然后用3rcc构型测试探针k13src和k13dav。探针在20μm下被发现。结果如图9所示。
从图9中可以看出,3rcc修饰在灵敏度和特异性方面都提供了优异的性能。
d)使用珠子支持物作为膜的替代物
探针dgl-13src-cbc和dgl-13src-3rcc(参见下面的图10)共价结合到磁性微球而不是尼龙膜上,并且通过电化学检测而不是比色法检测smart核碱基并入。
使用标准碳二亚胺偶联化学法分两步将探针偶联至dynabeads羧酸微球(thermofisherscientific,us)。洗涤微球(x2,0.02%tween-20,200μl和x2,0.1%sds,200μl),重悬于水中(每100μl约1百万个微球)并用将ph调节至6.0的2x盐水柠檬酸钠(ssc)和0.1%十二烷基硫酸钠(sds)(缓冲液a)(100微球/μl)稀释。将23.5μl缓冲液a,12.5μl官能化微球(分散于缓冲液a中,每μl含100个微球),4μlsmart-c-peg-生物素(500μm),7.5μls-mirna122或对照s-mirna21和s-mirna122-a(1μm、100nm、10nm或1nm)和2.5μl还原剂氰基硼氢化钠(20mm)加入到200μl的eppendorf中,涡旋并温育(41℃30分钟,热循环仪)。然后用缓冲液a洗涤微球两次,重悬(在50μl缓冲液a中),然后加入10μl链霉素抗生物素-hrp10分钟。在洗涤步骤(磁分离3分钟)之后,将氢醌(hq)用作电子转移介体,氧过氧化物(h2o2)用作hrp底物。在此阶段,使用丝网印刷碳电极(spce)(dropsens,spain)进行电流测量。
结果如图11所示。
可以发现,dgl-13src-3rcc探针(空白位置处的γ-修饰单元在每侧与具有含羧酸基团的部分的γ-修饰的核碱基单元被在γ位没有任何取代基的核碱基单元分开)与dgl-13src-3cbc探针(空白位置处的γ-修饰单元没有γ-修饰的核碱基单元)相比,产生的特异性信号提高了3倍。
上述实验表明了在pna探针中的不同位置和无碱基单元组合手性修饰的能力的优点。
虽然上述测试显示在空白位置具有在每侧与具有含羧酸基团的部分的γ-经修饰的核碱基单元被在γ位没有任何取代基的核碱基单元分开的γ-修饰单元的探针的优异性能,应当理解,可以改变探针中γ-修饰的核碱基单元的特定位置,而不会损害探针的改善性能。例如,γ-修饰的核碱基单元可以位于远离空白位置两个、三个或四个单元。一个或多个γ-修饰的核碱基单元的最佳位置可取决于许多因素,例如探针的长度,以及探针的具体应用。
e)使用手性修饰的pna探针用化学发光平台(酶标仪)循环microrna(mirna)检测。
设计/制备了含有和/或来自于上述单体a8和a9的pna寡聚体,以允许与成熟mirna122链的反平行杂交(表1)。如表1所示(见下文),合成了含有未修饰pna单体的pna寡聚体,例如探针dgl122_3.0-5.0和携带三个或更多个γ-修饰单元的一些其他探针(dgl122_1.2,4.1,4.2)。
为了测试pna分子,使用了经生物素标记的经修饰的核碱基(smart-c-核碱基-生物素)以及化学发光方法(如图12a的方案中所示)。
测试pna分子以评估pna分子与以下相关的特异性和灵敏度:i)γ-修饰单元的存在;ii)无碱基单元内存在γ-修饰;iii)无碱基单元的位置和pna寡聚体的长度(参见下表1)。
在该方法中,根据制造商(thermofisherscientific)的两步方案(无nhs)碳二亚胺偶联化学法,在其n-末端用氨基-聚乙二醇化基团修饰的探针与羧化的
用50μl微球(4×104珠/ul),smart-c-核碱基-生物素(读出碱基(readerbase))(2μm),15nm的核酸链(oligodna122)或水作为对照和还原剂氰基硼氢化钠(1mm)和scd缓冲液(2×ssc和0.1%sds-ph6.0)制备主混合物,最终体积为50μl。然后涡旋destina主混合物并在热循环仪中于41℃温育1小时。完成反应后,用200μl洗涤缓冲液a(pbs-tween0.1%)洗涤微球三次。然后沉淀微球并除去上清液并在室温下与100ulpiercehighsensitivitystreptavidin-hrp(1:8000)溶液(thermofisherscientific)一起温育5分钟。洗涤步骤(缓冲液a中4×)后,沉淀微球并在100ul底物-supersignalelisapicochemiluminescentsubstrate(thermofisherscientific)中再次沉清。将微球在室温下温育5分钟。温育完成后,将微球/底物转移(100μl)至基底(白色96孔板),使用具有化学发光检测能力的平板读数器(fluostaromega)进行最终读数(图12a)。结果如图13所示。
使用捕获探针122_1.2、122_4.1和122_4.2获得了最佳性能结果。具体而言,可以发现,与dgl122_3.0-5.0探针相比(在空白位置没有γ-修饰的单元或在pna骨架上没有γ-修饰的核碱基单元),在空白位置(γ修饰的无碱基位置)具有γ-修饰的单元或分布在pna骨架上的122_1.2,122_4.1和122_4.2探针具有改善的特异性信号。
pna寡聚体122_4.1(在空白位置不具有γ-修饰的单元,在左侧具有两个γ-修饰的核碱基,在右侧具有单个γ-修饰的核碱基(参见表1))表现出良好的性能。这表明pna寡聚体的性能(即信号-背景比的改善;其中背景与使用水作为对照进行反应时获得的背景进行比较(图13中destina探针后面跟着“-”))部分取决于γ-修饰的核碱基单元在探针内的位置。这些结果证实,γ-修饰的核碱基单元的最佳位置和数量可取决于许多因素和探针的特定应用。
f)使用手性修饰的pna探针利用流式细胞术循环microrna(mirna)检测
流式细胞术用于进一步研究在“空白位置”以及分布在pna寡聚体主链上的γ-修饰单元的影响(图12b)。
设计/制备了含有和/或来自于上述单体a8和a9的三个pna寡聚体,以允许与成熟mirna21链的反平行杂交(表2)。设计了pna寡聚体dgl21_2.0和dgl21_6.0以与成熟mirna21的相同区域杂交。两个寡聚体分别在空白位置旁边(或相邻)的两个胸腺嘧啶核碱基上携带两个γ-修饰的单元。此外,dgl21_6.0在空白位置包含γ-修饰的单元,并且序列稍长(19-聚体而不是17)。设计了另一种17-聚体pna寡聚体(dgl21_3.0),使其能够与成熟mirna21链的不同区域进行反向平行杂交,并在空白位置两侧的胸腺嘧啶核碱基上携带两个γ-修饰单元(表2)。对于三种pna寡聚体,将空白位置定位成使得后杂交,成熟mirna21链在空白位置前呈现尿嘧啶(表2,以绿色显示的核碱基),从而允许并入用生物素标记的腺嘌呤修饰的核碱基(smart-a-核碱基-生物素)。
使用标准碳二亚胺偶联化学在两个步骤中将pna寡聚体dgl21_2.0、dgl21_6.0和dgl21_3.0共价结合到dynabeads羧酸微球(thermofisherscientific)上(如上所述进行偶联)。为了评估pna分子的特异性和灵敏度,通过选择性并入smart-a-核碱基-生物素(读出碱基(readerbase))来评估微球的性能。
使用流式细胞术方法处理微球。用50μl微球(8×107珠/ul),smart-a-核碱基-生物素(30μm),15nm的核酸链(oligodna21)或水作为对照和还原剂氰基硼氢化钠(150μm)和磷酸盐缓冲液ph6(150mm)制备主混合物,最终体积为50μl。然后将主混合物涡旋并在热循环仪中于41℃温育1小时。在反应完成后,用200ul洗涤缓冲液a(pbs-tween0.1%)洗涤微球三次。然后沉淀微球并除去上清液并与购自thermofisherscientific的100ul链霉素抗生物素-r-藻红蛋白缀合物-sape(20μg/ml)在室温一起温育1小时。在sape温育后,通过bdfacscanto(pe-通道,滤波片585/42)分析微球,并通过flowjo获得点图。
结果如图14所示。
用含有pna寡聚体dgl21_6.0的微球可以清楚地观察到pe通道上的群体移位。据观察,与dgl21_2.0和dgl21_3.0探针(在空白位置没有γ-修饰单元)相比(图15),dgl21_6.0探针(在空白位置包含γ修饰单元,其他分布在pna骨干上)能够有效地动态结合读出碱基(readerbase)并产生特异信号(pe通道上的群体移位)(图14)。这些结果表明,与非常相似的序列但在空白位置没有γ-修饰(如dgl21_2.0)(见表2)相比,在空白位置添加γ-修饰(dgl21_6.0)可以带来更好的smart-a-核碱基-生物素并入。
表
表1:用于循环microrna122的pna分子。具有与成熟mirna122链互补的核碱基序列的六种pna寡聚体。寡聚体含有未修饰pna单体(白色圆圈)和在γ-位含有手性修饰,具有含羧酸基团的部分的单体(黑色圆圈)。黑色和空椭圆分别显示在γ位有或没有修饰的无碱基单元。
表2:用于循环microrna21的三种pna分子。参见表1的图例。
- 还没有人留言评论。精彩留言会获得点赞!
- 带DNA分子探针的石墨烯微电极电化学检测传感器的制造方法与工艺
- 一种小型化时间分辨的激光泵浦X射线探测仪的制造方法与工艺
- 一种气冷高温稳态压力探针的制造方法与工艺
- 基于超磁致伸缩与石英摆线复合机理的隔微振装置的制造方法
- 纳米材料制备装置及纳米材料制备方法与流程
- 一种用于EB病毒荧光定量PCR检测的引物和探针组、及试剂盒的制造方法与工艺
- 一种用于鉴定川贝母及伪品的荧光PCR检测引物、探针组合物、试剂盒及检测方法与应用与流程
- 用于基因甲基化检测的引物和探针、采样方法、试剂盒与流程
- 一种基于荧光PCR检测ESR1基因突变的引物及探针的制造方法与工艺
- 转基因甜菜GTSB77品系特异性实时荧光PCR检测引物、探针、方法和试剂盒与流程
- 一种快速检测BCR/ABL基因融合的探针组、试剂盒及方法与流程
- 一种低成本的CBFB基因断裂快速检测探针及其制备方法和应用与流程
- 一种表面修饰分子印迹固相微萃取探针及其制备与应用的制造方法与工艺
- 一种生物芯片智能监测记录装置的制造方法
- 一种检测食管癌相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种检测皮肤癌相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种检测骨髓瘤相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种基于数据采集卡的多振幅交流偏置探针等离子体诊断方法与制造工艺
- 一种基于双链DNA保护的荧光探针及在制备检测恶性疟原虫乳酸脱氢酶药物中的应用的制造方法与工艺
- 一种双重包覆壳层隔绝针尖的制备方法与制造工艺