化脓链球菌CAS9突变基因和由其编码的多肽的制作方法
相关申请的交叉引用
本申请根据35u.s.c.119要求2016年10月7日提交的名称为“novels.pyogenescas9mutationsthatreduceofftargetgeneeditingwhilemaintainingontargetpotency”的美国临时专利申请序列号62/405,601的优先权的权益,其全部内容通过引用并入本文。
序列表
本申请包含已经通过efs-web以ascii格式提交的序列表,并且其全部内容通过引用并入本文。在2015年12月18日创建的ascii副本名为idt01-009-pct_st25.txt,大小为_______字节。
本发明涉及cas9突变基因,由其编码的多肽及其在crispr-cas系统组合物中的用途。
背景技术:
使用规则成簇的间隔短回文重复序列(crispr)和相关的cas蛋白(crispr-cas系统)进行位点特异性dna切割已经显示许多生物学应用的巨大潜力。crispr用于基因组编辑;转录抑制因子(crispri)和激活因子(crispra)对内源基因的基因组规模特异性靶向;以及用cas酶研究rna定向dna靶向的其他应用。
crispr-cas系统是细菌和古细菌天然的,可提供针对病毒和质粒的适应性免疫。三类crispr-cas系统可潜在适合于研究和治疗试剂。ii型crispr系统在与适当的指导rna(grna)的复合物中利用单一crispr相关(cas)核酸酶(特别是cas9)方面具有期望的特征。在细菌或古细菌中,cas9指导rna包含2种不同的rna种类。靶特异性crispr激活rna(crrna)指导cas9/grna复合物结合并靶向特定dna序列。crrna具有2个功能结构域:5'-结构域是靶特异性的,3'-结构域指导crrna与反式激活crrna(tracrrna)的结合。tracrrna是更长的通用rna,其结合crrna并介导grna复合物与cas9的结合。tracrrna的结合诱导cas9结构的改变,从非活性构象转变为活性构象。grna功能也可以作为人工单一指导rna(sgrna)提供,其中crrna和tracrrna融合成单一种类(参见jinek,m.等,science337p816-21,2012)。sgrna形式允许从可以由含有转录启动子和sgrna序列的双链dna(dsdna)盒提供单个转录单位转录功能性grna。在哺乳动物系统中,这些rna是通过体外转录后转染含有驱动rna转录的rnapoliii启动子(如u6或h1)的dna盒,病毒载体和单链rna而引入(参见xu,t.等,applenvironmicrobiol,2014.80(5):p.1544-52)。
在crispr-cas系统中,使用存在于化脓链球菌中的系统作为例子(s.py.或spy),天然crrna长约42个碱基,并含有与靶序列互补的长约20个碱基的5'区域(也称为crrna的原型间隔子序列或原型间隔子结构域),和通常长约22个碱基的3'区域,其与tracrrna序列的区域互补并介导crrna与tracrrna的结合。crrna:tracrrna复合物包含能够指导cas9切割互补靶dna的功能性grna。天然tracrrna长约85-90个碱基,并具有含有与crrna互补的区域的5'-区域。tracrrna的剩余3'区域包括二级结构基序(本文称为“tracrrna3'-尾”),其介导crrna:tracrrna复合物与cas9的结合。
jinek等广泛研究了crispr-cas系统正常运作所需的crrna和tracrrna的物理结构域(science,2012.337(6096):p.816-21)。他们设计了截短的crrna:tracrrna片段,其仍然可以在crispr-cas中起作用,其中crrna是野生型42个核苷酸,并且tracrrna被截短为75个核苷酸。他们还开发了一个实施方式,其中用接头环连接crrna和tracrrna,形成单一指导rna(sgrna),其在不同的实施方式中在99-123个核苷酸之间变化。
至少有三组已经阐明了化脓链球菌cas9(spycas9)的晶体结构。在jinek,m.等中,该结构未显示与指导rna或靶dna复合的核酸酶。他们进行了分子模拟实验以揭示复合物中的蛋白与rna和dna之间的预测相互作用(science,2014.343,p.1215,doi:10.1126/science/1247997)。
在nishimasu,h.等中,spycas9的晶体结构显示与sgrna及其靶dna在2.5埃分辨率下复合(cell,2014.156(5):p.935-49,其全部内容通过引入并入本文)。晶体结构鉴定出cas9酶的两个叶:识别叶(rec)和核酸酶叶(nuc)。sgrna:靶dna异二聚体(带负电荷)坐落在两个叶之间的带正电的槽中。rec叶未显示与已知蛋白质的结构相似性,因此可能是cas9特异性功能结构域,与crrna和tracrrna彼此互补的部分相互作用。
另一组,briner等(molcell,2014。56(2):p.333-9,其全部内容并入本文),鉴定和表征了天然crrna:tracrrna双链体和sgrna内的六个保守模块。anders等(nature,2014,513(7519),p.569-73)阐明了与sgrna指导相关的cas9对原始间隔子相关基序(pam)序列的dna序列识别的结构基础。
crispr-cas核酸内切酶系统如下用于基因组工程:grna复合物(crrna:tracrrna复合物或sgrna)与cas9结合,诱导构象变化,激活cas9并打开dna结合裂隙,crrna(或sgrna)的原型间隙子结构域与互补靶dna对齐,cas9结合pam序列,启动靶dna的解旋,然后将原型间隔子结构域退火至靶,之后发生靶dna的切割。cas9含有两个结构域,分别与核酸内切酶hnh和ruvc同源,其中hnh结构域切割与crrna互补的dna链,并且ruvc样结构域切割非互补链。这导致基因组dna中的双链断裂。当通过非同源末端连接(nhej)修复时,通常以不精确的方式修复断裂,导致dna序列移位1个或更多个碱基,导致天然dna序列的破坏,并且在许多情况下如果事件发生在蛋白质编码基因的编码外显子中,则导致移码突变。断裂也可以通过同源定向重组(hdr)修复,其允许基于用cas9/grna复合物引入细胞的外源dna插入新的遗传物质,将其引入由cas9切割产生的切割位点。
野生型(wt)cas9蛋白以高效率切割大多数dna靶,但表现出足够水平的不需要的脱靶编辑,使研究应用复杂化并为医学应用提供严重顾虑。在这种情况下,脱靶切割定义为dna切割事件,其发生在其中基因组dna靶位点不同于crrna或sgrna的原型间隔子结构域的完全互补性的位点。通过这样的脱靶切割途径在非靶向位点引入切割事件是不期望的。通常,仅期望在基因组中与grna具有完全互补性的位点处进行切割。多个小组已经发表了新的突变cas9酶,其显示减少的脱靶切割活性(参见:slaymaker等,science,2016,351p.84-88;kleinstiver等,nature,2016,529p.490-495)。;chen等,nature,2017,http://dx.doi.org/10.1038/nature24268(2017))。这三篇出版物中描述的突变体是通过选择性突变cas9蛋白中的特定氨基酸残基来设计,所述特定氨基酸残基基于cas9蛋白的晶体结构被鉴定为蛋白质和rna指导和/或dna底物之间的接触位点。虽然不需要知道作用机制来实施这些发明(即,进行具有改进的特异性的基因组编辑),但最初认为保真度改善的突变体是通过相对于wt酶减少突变cas9核酸酶对底物dna的相对亲和力来工作,使得指导rna和底物dna之间的错配更可能是不稳定的。最近提议突变限制cas9结构从非活性构象转换到活性构象,并且该转换在rna指导和dna靶之间的错配的存在下更低效发生。无论机制如何,根据期望,这些突变cas9酶确实显示与指导rna具有不完全互补性的靶dna的切割减少。然而,这种改善的特异性是以减少的中靶活性为代价,这是不期望的。在公开改进的特异性cas9突变体的所有3个现有技术实例中,使用crispr/cas9方法的基因组编辑是使用质粒或其他基于表达的方法进行,即2013年首次描述的方法(参见:cong等,science,2013,339,第819-823页;mali等,science,2013,339,第823-826页)。然而,现在认识到质粒系统在基因组编辑中引入了复杂化。例如,质粒可以整合到宿主基因组中,从而导致不期望的其他基因组变化,或者它可以触发先天免疫应答并导致细胞死亡。由于这些和其他原因,质粒系统对于期望精确编辑的研究应用是不理想的,并且对于不能容忍这样的副作用的医学应用是不实际的。最近,已经显示使用核糖核蛋白(rnp)复合物的方法,其中与合成grna预复合的重组cas9蛋白已经显示比使用基于dna的表达构建体更好。rnp方法导致高活性基因组编辑,副作用减少(参见:cho等,genomeresearch,2014,24p.132-141;aida等,genomebiology,2015,16p.87-98)。因此,期望开发与rnp方案相容的高保真基因组编辑方法。先前引用的描述特异性改进的cas9突变体的已发表实例均使用基于质粒的dna表达盒来进行和研究基因组编辑结果。该方法导致突变cas9蛋白长时间高水平过表达,增加突变体的表观酶活性。我们在本文中描述了当使用rnp方法进行基因组编辑时,这些特异性改进的cas9突变体(espcas9(1.1)和cas9-hf1)具有减少的酶活性,结果是与wtcas9蛋白的切割相比,靶dna位点的切割显著受损,通常达到使用wtcas9蛋白高效工作的位点当使用突变体变体时没有显示任何切割证据的程度。因此,公布的突变cas9蛋白对于精确基因组编辑具有有限的效用,特别是当采用更医学相关的rnp方法时。因此,仍然需要提高cas9基因组编辑特异性的方法。特别是,需要当以rnp形式使用时,显示改善的特异性,同时维持与wtcas9酶类似的高酶活性的cas9突变体。
技术实现要素:
本发明涉及用于crispr系统的cas9突变基因和多肽及其使用方法。
在第一方面,提供了分离的突变cas9蛋白。分离的突变cas9蛋白在规律成簇的间隔短回文重复序列(crispr)/crispr相关蛋白核酸内切酶系统(“crispr/cas核酸内切酶系统”)中有活性。crispr/cas核酸内切酶系统相对于野生型crispr/cas核酸内切酶系统显示减少的脱靶编辑活性并维持中靶编辑活性。
在第二方面,提供了分离的核糖核蛋白(rnp)复合物。rnp复合物包含突变cas9蛋白和grna复合物。分离的核糖核蛋白复合物作为crispr/cas核酸内切酶系统有活性,其中所得crispr/cas核酸内切酶系统相对于野生型crispr/cas核酸内切酶系统显示减少的脱靶编辑活性并维持中靶编辑活性。
在第三方面,提供了编码突变cas9蛋白的分离的核酸。突变cas9蛋白在crispr/cas核酸内切酶系统中有活性,其中crispr/cas核酸内切酶系统相对于野生型crispr/cas核酸内切酶系统显示减少的脱靶编辑活性并维持中靶编辑活性。
在第四方面,提供了crispr/cas核酸内切酶系统。crispr/cas核酸内切酶系统包括突变cas9蛋白和grna。crispr/cas核酸内切酶系统相对于野生型crispr/cas核酸内切酶系统显示减少的脱靶编辑活性并维持中靶编辑活性。
在第五方面,提供了一种执行基因编辑的方法,其具有减少的脱靶编辑活性并维持中靶编辑活性。该方法包括使候选编辑dna靶位点基因座与活性crispr/cas核酸内切酶系统接触的步骤,所述活性crispr/cas核酸内切酶系统具有与合适的grna(例如,crrna:tracrrna复合物或sgrna)复合的突变cas9蛋白。所述相互作用可以在任何情况下发生,例如,在活动物中,在活细胞中,或在体外分离的dna中。
附图说明
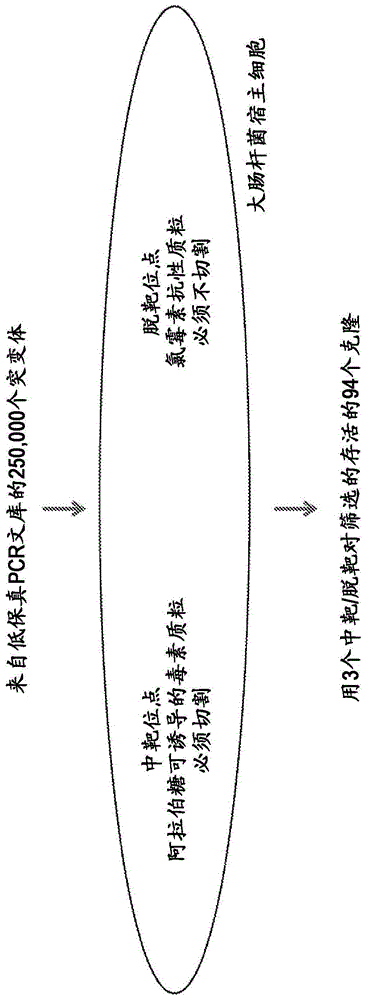
图1是用于选择具有高中靶切割活性和低脱靶切割活性的突变cas9序列的细菌遗传筛选的示意图。
图2描绘了化脓链球菌cas9中的示例性单氨基酸突变,其在通过质粒(在实施例3中描述)递送cas9核酸酶时减少脱靶编辑,其中crispr/cas9编辑实验使用一系列突变cas9质粒表达盒(表达wtcas9或所指示的突变cas9),与靶向人基因emx1的
图3描绘了化脓链球菌cas9中的示例性单氨基酸突变,其在通过质粒(在实施例3中描述)递送cas9核酸酶时减少脱靶编辑,其中crispr/cas9编辑实验使用一系列突变cas9质粒表达盒(表达wtcas9或所指示的突变cas9),与靶向人heksite4基因座的
图4描绘了化脓链球菌cas9中的示例性氨基酸突变,其减少通过cas9进行的脱靶编辑,当细菌筛选的突变氨基酸被丙氨酸可替换地置换时产生相同或进一步减少的脱靶编辑。如图2所示递送cas9grna复合物与靶向emx1基因座的
图5描绘了化脓链球菌cas9中的示例性氨基酸突变,其减少通过cas9进行的脱靶编辑,当细菌筛选的突变氨基酸被丙氨酸可替换地置换时产生相同或进一步减少的脱靶编辑。如图3所示递送cas9grna复合物与靶向heksite4基因座的
图6描绘了示例性crispr/cas9编辑实验,其显示了比较cas9蛋白中的不同单和双氨基酸突变的相对中靶和脱靶编辑效率,其中如图3所示递送cas9grna复合物与靶向heksite4基因座的
图7证实,当作为核糖核蛋白(rnp)复合物递送时,纯化的重组r691acas9突变蛋白显示比已知的espcas9(1.1)或spcas9-hf1蛋白更优异的中靶编辑活性。用wt(黑色),espcas9(1.1)(白色),spcas9-hf1(灰色)或r691a(对角)cas9蛋白和靶向hrpt基因座内的不同位点(crrnasseqidno:89-100)的alt-rcrrna:tracrrnagrna复合物形成rnp复合物(1μm)。向细胞递送的rnp包括10nmrnp(cas9:tracrrna:crrna(alt-rcrrna为1:1:1比率),1.2微升rnaimax脂质转染到hek293细胞中48小时,然后进行分析。误差线表示均值的标准误差。
图8证实,当作为核糖核蛋白(rnp)复合物递送时,纯化的重组r691acas9突变蛋白显示比已知的espcas9(1.1)或spcas9-hf1蛋白更优异的中靶编辑活性。用wt(黑色),espcas9(1.1)(白色),spcas9-hf1(灰色)或r691a(对角)cas9蛋白和靶向ctla4基因座内的不同位点(crrnasseqidno:101-112)的alt-rcrrna:tracrrnagrna复合物形成rnp复合物(1μm)。实验细节和误差分析类似于图7中描述的。
图9描绘了实验的示例性结果,其显示r691a突变cas9当作为rnp复合物递送时对于3种不同crrna在3个独立验证的脱靶位点,脱靶编辑活性是t7ei分析检测不到的。使用wt(黑色),espcas9(1.1)(白色),spcas9-hf1(灰色)或r691a(对角)cas9蛋白和靶向人emx1(左)(seqidno:113),heksite4(中心)(seqidno:114)或vegfa3(右)(seqidno:116)基因座的alt-rcrrna:tracrrnagrna复合物形成rnp复合物(1μm)。emx1和heksite4基因座的中靶和脱靶位点分别如图2和图3所述。用指示pam位点的下划线核苷酸指示针对vegfa3基因座的中靶编辑(5’-ggtgagtgagtgtgtgcgtgtgg-3’(seqidno:137))和针对该指导的有问题的已知脱靶位点(5’-agtgagtgagtgtgtgtgtgggg-3’(seqidno:138),脱靶位点相对于中靶位点之间的碱基差异以粗体突出显示(tsai等,naturebiotechnology33:187-197,2015)。
图10描绘了实验的示例性结果,其显示r691a突变体在指导位点维持高中靶编辑活性,所述指导位点常规表现出低效编辑,因此可用于区分中靶编辑效率的差异,而将该突变与在细菌筛选中鉴定的其他氨基酸变化组合为双重或三重突变体(即,组合减少通过cas9进行的脱靶编辑活性的选定突变)也显著减少了中靶编辑活性。用wt,r691a,n692a,t740a,s845a,s872a,r691a/t740a,r691a/s845a,r691a/s872a,r691a/n692a/t740a,r691a/n692a/s845a或r691a/n692a/s872acas9蛋白与靶向hrpt38509基因座的
图11描绘了实验的示例性结果,其显示r691a突变体在具有挑战性的中靶位点维持高中靶编辑活性,而将该突变与在细菌筛选中鉴定的其他氨基酸变化组合为双重或三重突变体(即,组合减少通过cas9进行的脱靶编辑活性的选定突变)显著减少了中靶编辑活性。用wt,r691a,n692a,t740a,s845a,s872a,r691a/t740a,r691a/s845a,r691a/s872a,r691a/n692a/t740a,r691a/n692a/s845a或r691a/n692a/s872acas9蛋白与靶向heksite4基因座的
图12描绘了示例性实验结果,其显示了在r691位置处引入每个可能的氨基酸置换突变对hprt38509位点处的编辑的影响,其中许多置换维持中靶编辑活性,而其他损害编辑效率。通过质粒递送cas9蛋白,其中crispr/cas9编辑实验使用质粒携带的cas9(表达wt“r691”cas9(seqidno:5)或指示的突变cas9(seqidno:7,71-88)),并与靶向hprt38509基因座的
图13描绘了示例性实验结果,其显示在r691位置处引入每个可能的氨基酸置换突变对heksite4位点处的编辑的影响,其中大多数突变显著减少脱靶编辑,同时还显示保留中靶活性。通过质粒递送cas9蛋白,其中crispr/cas9编辑实验使用质粒携带的cas9(表达wt“r691”cas9(seqidno:5)或指示的突变cas9(seqidno:7,71-88),与靶向heksite4基因座的
图14描绘了实验的示例性结果,其显示在r691位置具有不同氨基酸置换的所选cas9突变蛋白在人hprt基因内的不同指导位点处维持靶编辑活性。用wt(r691),r691a,r691d,r691g,r691h,r691y或r691wcas9蛋白(分别为seqidno:5,7,73,77,78,87和86)与靶向hrpt38509或hprt38087基因座的
图15描绘了实验的示例性结果,其显示在r691位置具有不同氨基酸置换的所选cas9突变蛋白维持与多种指导的中靶编辑活性并减少脱靶编辑活性。用wt(r691),r691a,r691d,r691g,r691h,r691y或r691wcas9蛋白(分别为seqidno:5,7,73,77,78,87和86)与靶向heksite4(seqidno:114)或emx1(seqidno:113)基因座的
图16描绘了在活细胞中使用先前描述的guide-seq程序(tsai等,naturebiotechnology33:187-197,2015)在无偏和全基因组环境中的脱靶编辑活性的示例性减少。用wt(seqidno:6)或r691a(seqidno:8)cas9蛋白与靶向emx1(seqidno:113),vegfa3(seqidno:116)或ar(seqidno:115)基因指导位点的
具体实施方式
本文所述的本发明的方法和组合物提供用于crispr-cas系统的突变spycas9核酸和多肽。本发明描述了新的cas9突变体,其将脱靶编辑活性减少至低水平,同时相对于野生型蛋白质维持高中靶编辑活性,甚至是作为rnp复合物递送时。从本文提供的本发明的描述中,本发明的这些和其他优点以及另外的发明特征将是显而易见的。
术语“野生型cas9蛋白”(“wt-cas9”或“wt-cas9蛋白”)包括具有天然存在的化脓链球菌cas9的相同氨基酸序列(例如,seqidno.:5),并且当与合适的指导rna(例如sgrna或双crrna:tracrrna组合物)组合以形成活性crispr-cas核酸内切酶系统时,具有生物化学和生物学活性的蛋白质。
术语“野生型crispr/cas核酸内切酶系统”是指crispr/cas核酸内切酶系统,其包括野生型cas9蛋白和合适的grna。
短语“活性crispr/cas核酸内切酶系统相对于野生型crispr/cas核酸内切酶系统显示减少的脱靶编辑活性并维持中靶编辑活性”是指当两种crispr/cas核酸内切酶系统包括用于给定靶序列的相同grna时,包括突变cas9蛋白的crispr/cas核酸内切酶系统的活性,其相对于包括野生型cas9蛋白的野生型crispr/cas核酸内切酶系统的相应脱靶和中靶编辑活性显示脱靶编辑活性减少,所述减少通常大于中靶编辑活性的减少。优选的crispr/cas核酸内切酶系统的脱靶活性和靶活性取决于grna和感兴趣的靶序列;在实施例中说明了具有突变cas9蛋白的crispr/cas核酸内切酶系统的这样的优选的脱靶和中靶活性。
术语“突变cas9蛋白”包括具有与野生型化脓链球菌cas9不同的氨基酸序列,并且当与合适的指导rna(例如sgrna或双crrna:tracrrna组合物)组合以形成活性crispr-cas核酸内切酶系统时具有生物化学和生物学活性的蛋白质形式。这包括具有与野生型化脓链球菌cas9不同的氨基酸序列的直系同源物和cas9变体。
本文提及的突变cas9蛋白氨基酸序列包括表达为全长氨基酸序列的那些,如本公开和序列表中所示。然而为了简洁,本文提供了缩短的突变cas9蛋白氨基酸编码命名法,其中相对于野生型cas9蛋白氨基酸序列(例如,seqidno:5)的氨基酸的位置和身份提供给定置换突变的位置和身份。例如,在野生型cas9蛋白氨基酸序列的r691处引入的单置换突变是指替代野生型cas9蛋白氨基酸序列内的残基位置691处的精氨酸的置换突变。例如,特定的单置换突变r691a是指突变cas9蛋白氨基酸序列,其在野生型cas9蛋白氨基酸序列的残基位置691处包含丙氨酸代替精氨酸(参见,例如,seqidno:7)。
本发明的突变cas9蛋白在crispr/cas核酸内切酶系统中有活性,其中所得crispr/cas核酸内切酶系统相对于野生型crispr/cas核酸内切酶系统显示减少的脱靶编辑活性并维持中靶编辑活性。如本文所用,“突变cas9蛋白”具体地排除slaymaker等,science,2016,351p.84-88;kleinstiver等,nature,2016,529p.490-495;chen等,nature,2017,http://dx.doi.org/10.1038/nature24268(2017))中公开的突变cas9蛋白到那些突变cas9蛋白在包括在crispr/cas核酸内切酶系统中时相对于野生型crispr/cas核酸内切酶系统显示减少的脱靶编辑活性并维持中靶编辑活性的程度和到其中公开的突变cas9蛋白被认为是关于本申请和美国临时专利申请序列号62/405,601的法定“现有技术”的程度。例如,如本文所用并且受上述条件限制的“突变cas9蛋白”具体地排除选自k775a,r780a,k810a,r832a,k848a,k855a,k862a,k961a,k968a,k974a,r976a,h982a,k1003a,k1014a,k1047a,k1059a,r1060a,h1241a,k1289a,k1296a,h1297a,k1300a,h1311a,k1325a,espcas9(1.0)(k810a/k1003a/r1060a),espcas9(1.1)(k848a/k1003a/r1060a),spcas9-hf1(n497a/r661a/q695a/q926a)和hypa-cas9(n692a/m694a/q695a/h698a;“簇1”),簇2(g582a/v583a/e584a/d585a/n588a),簇3(t657a/r661a/g658a/w659a),簇4(n497a/f491a/m495a/t496a),簇5(k918a/v922a/r925a)的突变cas9蛋白。
术语“多肽”是指包含多于一个氨基酸的任何直链或支链肽。多肽包括蛋白质或其片段或其融合物,条件是这样的蛋白质、片段或融合物保留有用的生物化学或生物学活性。
融合蛋白通常包括额外的氨基酸信息,其对于额外的氨基酸信息所共价连接的蛋白质而言不是天然的。这样的额外的氨基酸信息可包括能够纯化或鉴定融合蛋白的标签。这样的额外的氨基酸信息可包括使融合蛋白能够转运到细胞中和/或转运到细胞内的特定位置的肽。用于这些目的的标签的实例包括以下:avitag,其是允许bira酶进行生物素化的肽,因此蛋白质可以通过链霉抗生物素蛋白分离(glndifeaqkiewhe);钙调蛋白标签,其是由蛋白质钙调蛋白结合的肽(krrwkknfiavsaanrfkkisssgal);聚谷氨酸标签,是有效结合阴离子交换树脂的肽,如mono-q(eeeeee);e标签,其是抗体识别的肽(gapvpypdplepr);flag标签,其是抗体识别的肽(dykddddk);ha标签,其是来自由抗体识别的血凝素的肽(ypydvpdya);his标签,其通常是由镍或钴螯合物结合的5-10个组氨酸(hhhhhh);myc-标签,其是衍生自由抗体识别的c-myc的肽(eqkliseedl);ne-标签,其是新型18-氨基酸合成肽(tkenprsnqeesyddnes),被单克隆igg1抗体识别,可用于广泛应用,包括蛋白质印迹,elisa,流式细胞术,免疫细胞化学,免疫沉淀,和重组蛋白质的亲和纯化;s标签,其是衍生自核糖核酸酶a的肽(ketaaakferqhmds);sbp标签,其是与链霉抗生物素蛋白结合的肽;(mdekttgwrgghvveglageleqlrarlehhpqgqrep);softag1,其旨在用于哺乳动物表达(slaellnaglggs);softag3,其旨在用于原核表达(tqdpsrvg);strep-标签,其是与链霉抗生物素蛋白或称为streptactin的经修饰链霉抗生物素蛋白结合的肽(strep-标签ii:wshpqfek);tc标签,其是由flash和reash双砷化合物(ccpgcc)v5标签识别的四半胱氨酸标签,其是由抗体识别的肽(gkpipnpllgldst);vsv标签,由抗体识别的肽(ytdiemnrlgk);xpress标签(dlyddddk);isopeptag,其是与pilin-c蛋白共价结合的肽(tdkdmtitftnkkdae);spytag,其是与spycatcher蛋白共价结合的肽(ahivmvdaykptk);snooptag,其是与snoopcatcher蛋白共价结合的肽(klgdiefikvnk);bccp(生物素羧基载体蛋白),其是由bira生物素化以使能够通过链霉抗生物素蛋白识别的蛋白质结构域;谷胱甘肽-s-转移酶标签,其是与固定化谷胱甘肽结合的蛋白质;绿色荧光蛋白标签,其是自发荧光并可被抗体结合的蛋白质;halotag,其是突变的细菌卤代烷脱卤素酶,其与反应性卤代烷底物共价连接,以允许连接至各种各样的底物;麦芽糖结合蛋白标签,其是与直链淀粉琼脂糖结合的蛋白质;nus-标签;硫氧还蛋白标签;和fc标签,衍生自免疫球蛋白fc结构域,其允许二聚化和溶解,并且可用于在蛋白-a琼脂糖凝胶上纯化。核定位信号(nls),例如从sv40获得的那些,允许蛋白质在进入细胞后立即转运到细胞核。鉴于天然cas9蛋白是细菌来源并因此不天然地包含nls基序,预期在重组cas9蛋白中添加一个或多个nls基序以在用于靶基因组dna底物存在于细胞核中的真核细胞中时显示改善的基因组编辑活性。本领域技术人员将理解这些各种各样的融合标签技术,以及如何制备和使用包含它们的融合蛋白。
术语“分离的核酸”包括dna,rna,cdna和编码它们的载体,其中dna,rna,cdna和载体不含可以从其衍生它们或与之相关的其他生物材料,例如细胞组分。通常,分离的核酸将与可以从其衍生它们或与之相关的其他生物材料纯化,例如细胞组分。
术语“分离的野生型cas9核酸”是编码野生型cas9蛋白的分离的核酸。分离的野生型cas9核酸的实例包括seqidno:1和2。
术语“分离的突变cas9核酸”是编码突变cas9蛋白的分离的核酸。分离的突变cas9核酸的实例包括seqidno:3和4。
术语“长度修饰的”,在该术语修饰rna时,是指缺少核苷酸序列的参考rna的缩短或截短形式或包括额外核苷酸序列的参考rna的细长形式。
术语“化学修饰的”,在该术语修饰rna时,是指含有化学修饰的核苷酸或与rna共价连接的非核苷酸化学基团的参考rna的形式。如本文所述,化学修饰的rna通常是指使用寡核苷酸合成程序制备的合成rna,其中在rna寡核苷酸的合成期间掺入修饰的核苷酸。然而,化学修饰的rna还包括合成后用合适的修饰剂修饰的合成rna寡核苷酸。
合格的crispr-cas核酸内切酶系统包括用分离的cas9蛋白和选自双crrna:tracrrna组合或嵌合单分子sgrna之一的分离的指导rna形成的核糖核蛋白(rnp)复合物。在一些实施方式中,将分离的长度修饰和/或化学修饰形式的crrna和tracrrna与纯化的cas9蛋白、编码cas9蛋白的分离的mrna或编码cas9蛋白的基因组合在表达载体中。在某些测定中,可以将分离的长度修饰和/或化学修饰形式的crrna和tracrrna引入细胞系中,所述细胞系稳定地从编码cas9基因的内源表达盒表达cas9蛋白。在其他测定中,可以将长度修饰形式和/或化学修饰形式的crrna和tracrrna与突变cas9mrna或突变cas9蛋白组合的混合物引入细胞中。
申请人已经呈现了先前新颖的crrna和tracrrna寡核苷酸组合物,其在规则成簇的间隙短回文重复序列(crispr)-crispr相关(cas)(crispr-cas)核酸内切酶系统中显示稳健的活性。寡核苷酸组合物包括长度修饰形式的crrna和tracrrna,以及化学修饰形式的crrna和tracrrna。长度修饰形式的crrna和tracrrna使人们能够通过常规获得的成本有效且有效的寡核苷酸合成方案制备这些rna的活性形式。crrna和tracrrna的化学修饰形式提供某些特定性质可调的活性剂,例如在细胞和体内环境中改善的稳定性,或者触发哺乳动物细胞中的先天免疫应答的风险减少。crrna和tracrrna的长度修饰形式也可以包括修饰,由此使得能够获得宽范围的具有crispr-cas核酸内切酶系统环境中的活性的组合物。这些寡核苷酸组合物及其在crispr-cas核酸内切酶系统中的特性可与本文公开的突变cas9核酸和蛋白质一起使用。这些寡核苷酸组合物及其在crispr-cas核酸内切酶系统中的性质在collingwood等(申请人:integrateddnatechnologies,inc.(skokie,il(us)),2015年12月18日提交的名称为“crispr-basedcompositionsandmethodsofuse”的美国专利申请序列号14/975,709中公开,其在2016年6月23日公布为美国专利公开号us2016-0177304a1,并且在______授权为美国专利号__________,其全部内容通过引用并入本文。
具有减少的脱靶基因编辑活性的突变cas9蛋白
在第一方面,提供了分离的突变cas9蛋白。分离的突变cas9蛋白在规则成簇的间隙短回文重复序列(crispr)/crispr相关蛋白核酸内切酶系统(“crispr/cas核酸内切酶系统”)中有活性。所得crispr/cas核酸内切酶系统相对于野生型crispr/cas核酸内切酶系统显示减少的脱靶编辑活性并维持中靶编辑活性。
优选的单突变cas9蛋白包括在以下位置之一引入wt-cas9的置换突变:r494,n522,n588,n612,t657,s663,r691,n692,s730,t740,r765,t770,n776,r778,r783,s793,n803,s845,n854,s872和r925。示例性单突变cas9蛋白包括引入wt-cas9的以下特定突变:r494c,r494a,n522k,n522a,n588d,n588a,n612a,t657a,s663a,r691s,r691a,n692d,n692a,s730g,s730a,t740a,r765g,r765a,t770k,t770a,n776a,r778a,r783a,s793a,n803d,n803a,s845a,n854k,n854a,s872a,r925c和r925a。示例性的单突变cas9蛋白包括选自seqidno:7至seqidno:38的至少一个成员。另外的置换突变可以包括在单突变cas9蛋白氨基酸序列的氨基酸背景中,条件是所得突变cas9蛋白作为crispr/cas核酸内切酶系统有活性,其中所得crispr/cas核酸内切酶系统相对于野生型crispr/cas核酸内切酶系统显示减少的脱靶编辑活性并维持中靶编辑活性。
优选的双突变cas9蛋白包括在以下位置中的两个引入wt-cas9的突变:r494,n522,n588,n612,t657,s663,r691,n692,s730,t740,r765,t770,n776,r778,r783,s793,n803,s845,n854,s872和r925。高度优选的双突变cas9蛋白包括在以下位置引入wt-cas9的突变:r691/n692,r691/r494,r691/n522,r691/n588,r691/n612,r691/s663,r691/t730,r691/t740,r691/r765,r691/t770,n692/t740,r691/s845,n692/s845,r691/s872和n692/s872。示例性双突变cas9蛋白包括引入wt-cas9中的选自以下氨基酸突变的两种不同的特定突变:r494c或r494a;n522k或n522a;n588d或n588a;n612a;t657a;s663a;r691s或r691a;n692d或n692a;s730g或s730a;t740a;r765g或r765a;t770k或t770a;n776a;r778a;r783a;s793a;n803d或n803a;s845a;n854k或n854a;s872a;和r925c或r925a。示例性双突变cas9蛋白包括选自seqidno:39-88的至少一个成员。另外的置换突变可以包括在双突变cas9蛋白氨基酸序列的氨基酸背景中,条件是所得突变cas9蛋白作为crispr/cas核酸内切酶系统有活性,其中所得crispr/cas核酸内切酶系统相对于野生型crispr/cas核酸内切酶系统显示减少的脱靶编辑活性并维持中靶编辑活性。
在第二方面,提供了分离的核糖核蛋白复合物。rnp包含突变cas9蛋白和grna复合物。在一个方面,grna包括化学计量(1:1)比率的crrna和tracrrna。在第二个方面,crrna包括针对用于给定基因座的特定编辑靶位点的
在第三方面,提供了编码突变cas9蛋白的分离的核酸。优选的分离的核酸编码如上所述的突变cas9蛋白。编码突变cas9蛋白的示例性分离的核酸可以通过重组dna程序或化学合成方法从编码野生型cas9蛋白的核酸容易地产生。用于该目的优选核酸包括为细菌(例如,大肠杆菌)或哺乳动物(例如人)细胞中的cas9蛋白的表达而优化的核酸。用于在大肠杆菌和人细胞中表达wt-cas9(seqidno:5)的示例性密码子优化的核酸分别包括seqidno:1和2。用于在大肠杆菌和人细胞中表达突变cas9蛋白(例如,r691a突变cas9蛋白;seqidno:7)的示例性密码子优化的核酸分别包括seqidno:3和4。此外,本发明设想wt-cas9和突变cas9的融合蛋白,其中wt-cas9和突变cas9的编码序列与编码用于真核细胞中的融合蛋白的核定位(“nls”)的氨基酸序列或促进蛋白质纯化的氨基酸序列融合。包含wt-cas9氨基酸序列或突变cas9氨基酸序列(例如,r691a突变cas9蛋白)的示例性融合蛋白分别包括seqidno:6和8。
在一个方面,分离的核酸包括编码上述突变cas9蛋白之一的mrna。在第二方面,分离的核酸包括编码上述突变cas9蛋白之一的基因的dna。优选的dna包括编码编码突变cas9蛋白的基因的载体。这样的递送方法包括质粒和本领域技术人员熟知的各种病毒递送载体。还可以使用合适的表达载体将突变cas9蛋白稳定地转化到细胞中,以产生组成型或诱导型表达突变cas9的细胞系。上述方法也可以应用于胚胎以产生组成型或诱导型表达突变型cas9的后代动物。
在第四方面,提供了crispr/cas核酸内切酶系统。crispr/cas核酸内切酶系统包括突变cas9蛋白。优选的突变cas9蛋白包括如上所述的那些。在一个方面,crispr/cas核酸内切酶系统由dna表达载体编码。在一个实施方式中,dna表达载体是质粒携带的载体。在第二个实施方式中,dna表达载体选自细菌表达载体和真核表达载体。在第三方面,crispr/cas核酸内切酶系统包括核糖核蛋白复合物,其包含突变体cas9蛋白和grna复合物。在一个方面,grna包括化学计量(1:1)比率的crrna和tracrrna。在第二个方面,crrna包括针对用于给定基因座的特定编辑靶位点的
在第五方面,提供了一种执行基因编辑的方法,其具有减少的脱靶编辑活性和/或增加的中靶编辑活性。该方法包括使候选编辑靶位点基因座与具有突变cas9蛋白的活性crispr/cas核酸内切酶系统接触的步骤。在一个方面,该方法包括具有在以下位置之一引入wt-cas9中的突变的单突变cas9蛋白:r494,n522,n588,n612,t657,s663,r691,n692,s730,t740,r765,t770,n776,r778,r783,s793,n803,s845,n854,s872和r925。示例性单突变cas9蛋白包括引入wt-cas9的以下特定突变:r494c,r494a,n522k,n522a,n588d,n588a,n612a,t657a,s663a,r691s,r691s,r691a,n692d,n692a,s730g,s730a,t740a,r765g,r765a,t770k,t770a,n776a,r778a,r783a,s793a,n803d,n803a,s845a,n854k,n854a,s872a,r925c和r925a。示例性的单突变cas9蛋白包括选自seqidno:7至seqidno:38的至少一个成员。另外的置换突变可以包括在单突变cas9蛋白氨基酸序列的氨基酸背景中,条件是所得突变cas9蛋白在该方法中作为crispr/cas核酸内切酶系统有活性,其中所得crispr/cas核酸内切酶系统相对于野生型crispr/cas核酸内切酶系统显示减少的脱靶编辑活性并维持中靶编辑活性。
另一方面,该方法包括双突变cas9蛋白,其在具有在以下位置中的两个引入wt-cas9的突变:r494,n522,n588,n612,t657,s663,r691,n692,s730,t740,r765,t770,n776,r778,r783,s793,n803,s845,n854,s872和r925。高度优选的双突变cas9蛋白包括在以下位置引入wt-cas9的突变:r691/n692,r691/r494,r691/n522,r691/n588,r691/n612,r691/s663,r691/t730,r691/t740,r691/r765,r691/t770,n692/t740,r691/s845,n692/s845,r691/s872和n692/s872。示例性双突变cas9蛋白包括选自以下氨基酸突变的引入wt-cas9的两种不同的特定突变:r494c或r494a;n522k或n522a;n588d或n588a;n612a;t657a;s663a;r691s或r691a;n692d或n692a;s730g或s730a;t740a;r765g或r765a;t770k或t770a;n776a;r778a;r783a;s793a;n803d或n803a;s845a;n854k或n854a;s872a;和r925c或r925a。示例性双突变cas9蛋白包括选自seqidno:39-88的至少一个成员。另外的置换突变可以包括在双突变cas9蛋白氨基酸序列的氨基酸背景中,条件是所得突变cas9蛋白在该方法中作为crispr/cas核酸内切酶系统有活性,其中所得crispr/cas核酸内切酶系统相对于野生型crispr/cas核酸内切酶系统显示减少的脱靶编辑活性并维持中靶编辑活性。
基于cas9的工具的应用是多种多样的。它们包括但不限于:植物基因编辑,酵母基因编辑,哺乳动物基因编辑,活体动物器官中的细胞编辑,胚胎编辑,敲除/敲入动物系的快速生成,产生动物疾病状态模型,纠正疾病状态,插入报告基因和全基因组功能筛选。
实施例
实施例1
野生型和突变型cas9蛋白的dna和氨基酸序列。
下面的列表显示了本发明中描述的不同野生型(wt)和突变型cas9核酸酶。本领域技术人员将理解,许多不同的dna序列可以编码/表达相同的氨基酸(aa)序列,因为在许多情况下,多于一种密码子可以编码相同的氨基酸。下面显示的dna序列仅用作实例,并且设想编码相同蛋白质(例如,相同氨基酸序列)的其他dna序列。还应理解,可以将附加特征、要素或标签添加到所述序列,例如nls结构域等。示出了wtcas9和突变体r691acas9的实例,其显示了单独的cas9以及c末端和n末端融合sv40nls结构域和his-标签cas9的那些蛋白质的氨基酸和dna序列。对于其他cas9突变体,仅提供氨基酸序列,但设想可以类似添加nls和his-标签结构域以便于用于产生用于哺乳动物细胞的重组蛋白。使用带下划线的粗体字体识别与wt序列不同的突变。
seqidno.1
wtspycas9dna序列,密码子优化用于在e.coli中表达。
atgggcagcagcgccccaaagaagaagcggaaggtcggtatccacggagtcccagcagccatggacaaaaagtactctattggcctggatatcgggaccaacagcgtcgggtgggctgttatcaccgacgagtataaagtaccttcgaaaaagttcaaagtgctgggcaacaccgatcgccattcaatcaaaaagaacttgattggtgcgctgttgtttgactccggggaaaccgccgaggcgactcgccttaaacgtacagcacgtcgccggtacactcggcgtaagaatcgcatttgctatttgcaggaaatctttagcaacgagatggcaaaagtcgatgactcgtttttccaccgcctcgaggaaagctttctggtggaggaagacaaaaagcatgagcgtcacccgatcttcggcaacattgtcgatgaagtagcgtatcatgaaaaatacccaaccatttaccacttacgcaaaaagctggtggacagcactgacaaagctgatttgcgccttatctatttagccctggcacatatgattaagtttcgtggtcacttcctgatcgaaggagacttaaatcccgacaacagtgatgttgataaattgtttattcagcttgtccaaacttacaatcaactgttcgaggaaaacccgatcaatgcctccggtgtggatgcaaaagccattttaagtgcacgccttagcaagtcccgtcgcttagaaaaccttatcgcgcagctgcccggcgagaaaaagaatggtttgtttgggaaccttattgccttgagcttaggcctcaccccgaatttcaaaagtaatttcgatcttgcagaagacgccaaattacaactgtcgaaggatacttatgatgacgatctcgataatctgttagcgcagattggtgaccaatacgccgatctttttctggcggctaaaaatctgagcgacgccatcttgctttcggatattctccgcgttaacaccgaaatcacgaaagcgcctcttagtgccagcatgattaaacgttatgatgaacaccaccaggacctgaccttactcaaagcgttggttcgccagcaactgccagagaagtacaaagaaatcttctttgatcagtcaaagaatggttatgccggctatattgacgggggtgcaagccaagaggaattctacaaatttatcaagcctattctggagaaaatggatggcaccgaagagttattggtgaagcttaaccgtgaagacctcctgcggaaacagcgcacattcgataatggttcgatcccacaccaaatccatttgggggagttacacgctattttgcgtcgccaggaagacttttaccctttcctgaaggataaccgggagaaaattgagaagatccttacctttcgtattccgtattacgtaggccccttagcacggggtaatagccgtttcgcgtggatgacacggaagtcggaagagacgatcaccccgtggaacttcgaagaggtagtcgacaagggcgcatcagcgcagtcttttattgaacgtatgacgaatttcgataaaaacttgcccaatgagaaggtgcttccgaaacattccttgttatatgaatattttacagtttacaacgagctgaccaaggttaaatacgtgacggaaggaatgcgcaagcccgcttttcttagcggtgagcaaaaaaaggcgatcgtcgacctgttattcaaaacgaatcgtaaggtgactgtaaagcaactcaaagaagattacttcaaaaagattgagtgcttcgacagcgtcgaaatctctggggtagaggatcggtttaacgcaagtttaggtacctaccatgacctgcttaaaatcattaaggataaagacttcttagataatgaagagaacgaagatattctcgaggacatcgtcttgacgttaaccttatttgaggatcgtgaaatgattgaggaacgcctcaaaacttatgcccacctgttcgacgataaggtgatgaagcagctgaaacgtcggcgctacacaggatggggccgcttgagtcgcaaacttattaacggaatccgtgacaagcaatccggcaaaacgattctggatttcttgaagtcggacggatttgctaatcgcaacttcatgcagttgatccatgatgactccctgacttttaaagaggatattcaaaaggcgcaggttagtggtcaaggcgacagcttacacgaacacatcgcaaatttggctggttcgccggccattaaaaaggggatcctccagaccgtgaaagttgtagatgagcttgttaaggtcatgggtcgtcataagcccgaaaacatcgtgattgaaatggcgcgggagaatcaaacgacccagaaaggacaaaagaatagccgtgaacggatgaagcggatcgaggaaggcattaaagagctggggtctcaaatcttgaaggaacaccctgtggagaacactcagctccaaaatgaaaaactttacctgtactatttgcagaacggacgcgatatgtacgtggaccaagagttggatattaatcggctgagtgactacgacgttgatcatatcgtcccgcagagcttcctcaaagacgattctattgacaataaggtactgacgcgctctgataaaaaccgtggtaagtcggacaacgtgccctccgaagaggttgtgaaaaagatgaaaaattattggcgccagcttttaaacgcgaagctgatcacacaacgtaaattcgataatttgaccaaggctgaacggggtggcctgagcgagttagataaggcaggatttattaaacgccagttagtggagactcgtcaaatcaccaaacatgtcgcgcagattttggacagccggatgaacaccaagtacgatgaaaatgacaaactgatccgtgaggtgaaagtcattactctgaagtccaaattagttagtgatttccggaaggactttcaattctacaaagtccgtgaaattaataactatcatcacgcacatgacgcgtacctgaatgcagtggttgggaccgcccttatcaagaaatatcctaagctggagtcggagtttgtctatggcgactataaggtatacgatgttcgcaaaatgattgcgaaatctgagcaggagatcggtaaggcaaccgcaaaatatttcttttactcaaacattatgaatttctttaagacagaaatcactctggccaacggggagattcgcaaacgtccgttgatcgaaacaaacggcgagactggcgaaattgtttgggacaaagggcgtgatttcgcgacggtgcgcaaggtactgagcatgcctcaagtcaatattgttaagaaaaccgaagtgcagacgggcgggttttccaaggaaagcatcttacccaaacgtaattcagataaacttattgcacgcaaaaaggactgggatccgaaaaagtatggaggcttcgacagtccaaccgtagcctactctgttctcgttgtagcgaaagtagaaaagggtaaatccaagaaactgaaatctgtcaaggagttgcttggaatcaccattatggagcgtagctccttcgagaagaacccgattgactttctggaagccaaaggatataaagaggtcaagaaagatcttatcattaagctgcctaagtattcactcttcgagctggaaaatggtcgtaaacgcatgctcgcttctgccggcgagttgcagaagggcaatgaattagcacttccatcaaagtacgttaacttcctgtatttggccagccattacgagaaactgaaggggtctccagaggacaacgaacagaaacaattatttgtagagcagcacaagcattatcttgatgaaatcattgagcaaatttccgaattcagtaaacgcgtaatcctggccgatgcaaacctcgacaaggtgctgagcgcttacaataagcatcgcgacaaacctatccgtgagcaggctgaaaatatcattcacctgttcacattaacgaacctgggcgctccggccgcttttaaatatttcgacacgacaatcgaccgtaagcgctataccagtacgaaagaagtgttggatgcgacccttattcaccagtcaattacaggattatatgagacccgtatcgaccttagccaattaggtggggatgcggccccgaagaaaaaacgcaaagtggatccgaagaaaaaacgcaaagtggcggccgcactcgagcaccaccaccaccaccactga
seqidno.2
wtspycas9dna序列,密码子优化用于在智人中表达。
atgggcaagcccatccctaaccccctgttggggctggacagcaccgctcccaaaaagaaaaggaaggtgggcattcacggcgtgcctgcggccgacaaaaagtacagcatcggccttgatatcggcaccaatagcgtgggctgggccgttatcacagacgaatacaaggtacccagcaagaagttcaaggtgctggggaatacagacaggcactctatcaagaaaaaccttatcggggctctgctgtttgactcaggcgagaccgccgaggccaccaggttgaagaggaccgcaaggcgaaggtacacccggaggaagaacaggatctgctatctgcaggagatcttcagcaacgagatggccaaggtggacgacagcttcttccacaggctggaggagagcttccttgtcgaggaggataagaagcacgaacgacaccccatcttcggcaacatagtcgacgaggtcgcttatcacgagaagtaccccaccatctaccacctgcgaaagaaattggtggatagcaccgataaagccgacttgcgacttatctacttggctctggcgcacatgattaagttcaggggccacttcctgatcgagggcgaccttaaccccgacaacagtgacgtagacaaattgttcatccagcttgtacagacctataaccagctgttcgaggaaaaccctattaacgccagcggggtggatgcgaaggccatacttagcgccaggctgagcaaaagcaggcgcttggagaacctgatagcccagctgcccggtgaaaagaagaacggcctcttcggtaatctgattgccctgagcctgggcctgacccccaacttcaagagcaacttcgacctggcagaagatgccaagctgcagttgagtaaggacacctatgacgacgacttggacaatctgctcgcccaaatcggcgaccagtacgctgacctgttcctcgccgccaagaacctttctgacgcaatcctgcttagcgatatccttagggtgaacacagagatcaccaaggcccccctgagcgccagcatgatcaagaggtacgacgagcaccatcaggacctgacccttctgaaggccctggtgaggcagcaactgcccgagaagtacaaggagatctttttcgaccagagcaagaacggctacgccggctacatcgacggcggagccagccaagaggagttctacaagttcatcaagcccatcctggagaagatggatggcaccgaggagctgctggtgaagctgaacagggaagatttgctccggaagcagaggacctttgacaacggtagcatcccccaccagatccacctgggcgagctgcacgcaatactgaggcgacaggaggatttctaccccttcctcaaggacaatagggagaaaatcgaaaagattctgaccttcaggatcccctactacgtgggccctcttgccaggggcaacagccgattcgcttggatgacaagaaagagcgaggagaccatcaccccctggaacttcgaggaagtggtggacaaaggagcaagcgcgcagtctttcatcgaacggatgaccaatttcgacaaaaacctgcctaacgagaaggtgctgcccaagcacagcctgctttacgagtacttcaccgtgtacaacgagctcaccaaggtgaaatatgtgaccgagggcatgcgaaaacccgctttcctgagcggcgagcagaagaaggccatcgtggacctgctgttcaagaccaacaggaaggtgaccgtgaagcagctgaaggaggactacttcaagaagatcgagtgctttgatagcgtggaaataagcggcgtggaggacaggttcaacgccagcctgggcacctaccacgacttgttgaagataatcaaagacaaggatttcctggataatgaggagaacgaggatatactcgaggacatcgtgctgactttgaccctgtttgaggaccgagagatgattgaagaaaggctcaaaacctacgcccacctgttcgacgacaaagtgatgaaacaactgaagagacgaagatacaccggctggggcagactgtccaggaagctcatcaacggcattagggacaagcagagcggcaagaccatcctggatttcctgaagtccgacggcttcgccaaccgaaacttcatgcagctgattcacgatgacagcttgaccttcaaggaggacatccagaaggcccaggttagcggccagggcgactccctgcacgaacatattgcaaacctggcaggctcccctgcgatcaagaagggcatactgcagaccgttaaggttgtggacgaattggtcaaggtcatgggcaggcacaagcccgaaaacatagttatagagatggccagagagaaccagaccacccaaaagggccagaagaacagccgggagcgcatgaaaaggatcgaggagggtatcaaggaactcggaagccagatcctcaaagagcaccccgtggagaatacccagctccagaacgagaagctgtacctgtactacctgcagaacggcagggacatgtacgttgaccaggagttggacatcaacaggctttcagactatgacgtggatcacatagtgccccagagctttcttaaagacgatagcatcgacaacaaggtcctgacccgctccgacaaaaacaggggcaaaagcgacaacgtgccaagcgaagaggtggttaaaaagatgaagaactactggaggcaactgctcaacgcgaaattgatcacccagagaaagttcgataacctgaccaaggccgagaggggcggactctccgaacttgacaaagcgggcttcataaagaggcagctggtcgagacccgacagatcacgaagcacgtggcccaaatcctcgacagcagaatgaataccaagtacgatgagaatgacaaactcatcagggaagtgaaagtgattaccctgaagagcaagttggtgtccgactttcgcaaagatttccagttctacaaggtgagggagatcaacaactaccaccatgcccacgacgcatacctgaacgccgtggtcggcaccgccctgattaagaagtatccaaagctggagtccgaatttgtctacggcgactacaaagtttacgatgtgaggaagatgatcgctaagagcgaacaggagatcggcaaggccaccgctaagtatttcttctacagcaacatcatgaactttttcaagaccgagatcacacttgccaacggcgaaatcaggaagaggccgcttatcgagaccaacggtgagaccggcgagatcgtgtgggacaagggcagggacttcgccaccgtgaggaaagtcctgagcatgccccaggtgaatattgtgaaaaaaactgaggtgcagacaggcggctttagcaaggaatccatcctgcccaagaggaacagcgacaagctgatcgcccggaagaaggactgggaccctaagaagtatggaggcttcgacagccccaccgtagcctacagcgtgctggtggtcgcgaaggtagagaaggggaagagcaagaaactgaagagcgtgaaggagctgctcggcataaccatcatggagaggtccagctttgagaagaaccccattgactttttggaagccaagggctacaaagaggtcaaaaaggacctgatcatcaaactccccaagtactccctgtttgaattggagaacggcagaaagaggatgctggcgagcgctggggaactgcaaaagggcaacgaactggcgctgcccagcaagtacgtgaattttctgtacctggcgtcccactacgaaaagctgaaaggcagccccgaggacaacgagcagaagcagctgttcgtggagcagcacaagcattacctggacgagataatcgagcaaatcagcgagttcagcaagagggtgattctggccgacgcgaacctggataaggtcctcagcgcctacaacaagcaccgagacaaacccatcagggagcaggccgagaatatcatacacctgttcaccctgacaaatctgggcgcacctgcggcattcaaatacttcgataccaccatcgacaggaaaaggtacactagcactaaggaggtgctggatgccaccttgatccaccagtccattaccggcctgtatgagaccaggatcgacctgagccagcttggaggcgactctagggcggacccaaaaaagaaaaggaaggtggaattccaccacactggactagtggatccgagctcggtaccaagcttaagtttaaaccgctga
seqidno.3
r691a突变spycas9dna序列,密码子优化用于在e.coli中表达。
seqidno.4
r691a突变spycas9dna序列,密码子优化用于在智人中表达。
seqidno.5
wtspycas9aa序列。
mdkkysigldigtnsvgwavitdeykvpskkfkvlgntdrhsikknligallfdsgetaeatrlkrtarrrytrrknricylqeifsnemakvddsffhrleesflveedkkherhpifgnivdevayhekyptiyhlrkklvdstdkadlrliylalahmikfrghfliegdlnpdnsdvdklfiqlvqtynqlfeenpinasgvdakailsarlsksrrlenliaqlpgekknglfgnlialslgltpnfksnfdlaedaklqlskdtydddldnllaqigdqyadlflaaknlsdaillsdilrvnteitkaplsasmikrydehhqdltllkalvrqqlpekykeiffdqskngyagyidggasqeefykfikpilekmdgteellvklnredllrkqrtfdngsiphqihlgelhailrrqedfypflkdnrekiekiltfripyyvgplargnsrfawmtrkseetitpwnfeevvdkgasaqsfiermtnfdknlpnekvlpkhsllyeyftvyneltkvkyvtegmrkpaflsgeqkkaivdllfktnrkvtvkqlkedyfkkiecfdsveisgvedrfnaslgtyhdllkiikdkdfldneenediledivltltlfedremieerlktyahlfddkvmkqlkrrrytgwgrlsrklingirdkqsgktildflksdgfanrnfmqlihddsltfkediqkaqvsgqgdslhehianlagspaikkgilqtvkvvdelvkvmgrhkpeniviemarenqttqkgqknsrermkrieegikelgsqilkehpventqlqneklylyylqngrdmyvdqeldinrlsdydvdhivpqsflkddsidnkvltrsdknrgksdnvpseevvkkmknywrqllnaklitqrkfdnltkaergglseldkagfikrqlvetrqitkhvaqildsrmntkydendklirevkvitlksklvsdfrkdfqfykvreinnyhhahdaylnavvgtalikkypklesefvygdykvydvrkmiakseqeigkatakyffysnimnffkteitlangeirkrplietngetgeivwdkgrdfatvrkvlsmpqvnivkktevqtggfskesilpkrnsdkliarkkdwdpkkyggfdsptvaysvlvvakvekgkskklksvkellgitimerssfeknpidfleakgykevkkdliiklpkyslfelengrkrmlasagelqkgnelalpskyvnflylashyeklkgspedneqkqlfveqhkhyldeiieqisefskrviladanldkvlsaynkhrdkpireqaeniihlftltnlgapaafkyfdttidrkrytstkevldatlihqsitglyetridlsqlggd
seqidno.6
wtspycas9aa序列,具有添加的nls结构域和his-标签纯化结构域。
mgssapkkkrkvgihgvpaamdkkysigldigtnsvgwavitdeykvpskkfkvlgntdrhsikknligallfdsgetaeatrlkrtarrrytrrknricylqeifsnemakvddsffhrleesflveedkkherhpifgnivdevayhekyptiyhlrkklvdstdkadlrliylalahmikfrghfliegdlnpdnsdvdklfiqlvqtynqlfeenpinasgvdakailsarlsksrrlenliaqlpgekknglfgnlialslgltpnfksnfdlaedaklqlskdtydddldnllaqigdqyadlflaaknlsdaillsdilrvnteitkaplsasmikrydehhqdltllkalvrqqlpekykeiffdqskngyagyidggasqeefykfikpilekmdgteellvklnredllrkqrtfdngsiphqihlgelhailrrqedfypflkdnrekiekiltfripyyvgplargnsrfawmtrkseetitpwnfeevvdkgasaqsfiermtnfdknlpnekvlpkhsllyeyftvyneltkvkyvtegmrkpaflsgeqkkaivdllfktnrkvtvkqlkedyfkkiecfdsveisgvedrfnaslgtyhdllkiikdkdfldneenediledivltltlfedremieerlktyahlfddkvmkqlkrrrytgwgrlsrklingirdkqsgktildflksdgfanrnfmqlihddsltfkediqkaqvsgqgdslhehianlagspaikkgilqtvkvvdelvkvmgrhkpeniviemarenqttqkgqknsrermkrieegikelgsqilkehpventqlqneklylyylqngrdmyvdqeldinrlsdydvdhivpqsflkddsidnkvltrsdknrgksdnvpseevvkkmknywrqllnaklitqrkfdnltkaergglseldkagfikrqlvetrqitkhvaqildsrmntkydendklirevkvitlksklvsdfrkdfqfykvreinnyhhahdaylnavvgtalikkypklesefvygdykvydvrkmiakseqeigkatakyffysnimnffkteitlangeirkrplietngetgeivwdkgrdfatvrkvlsmpqvnivkktevqtggfskesilpkrnsdkliarkkdwdpkkyggfdsptvaysvlvvakvekgkskklksvkellgitimerssfeknpidfleakgykevkkdliiklpkyslfelengrkrmlasagelqkgnelalpskyvnflylashyeklkgspedneqkqlfveqhkhyldeiieqisefskrviladanldkvlsaynkhrdkpireqaeniihlftltnlgapaafkyfdttidrkrytstkevldatlihqsitglyetridlsqlggdaapkkkrkvdpkkkrkvaaalehhhhhh
seqidno.7
r691a突变spycas9aa序列。
seqidno.8
r691a突变spycas9aa序列,具有添加的nls结构域和his-标签纯化结构域。
seqidno.9
r494c突变spycas9aa序列。
seqidno.10
r494a突变spycas9aa序列。
seqidno.11
n522k突变spycas9aa序列。
seqidno.12
n522a突变spycas9aa序列。
seqidno.13
n588d突变spycas9aa序列。
seqidno.14
n588a突变spycas9aa序列。
seqidno.15
n612a突变spycas9aa序列。
seqidno.16
t657a突变spycas9aa序列。
seqidno.17
s663a突变spycas9aa序列。
seqidno.18
n692d突变spycas9aa序列。
seqidno.19
n692a突变spycas9aa序列。
seqidno.20
s730g突变spycas9aa序列。
seqidno.21
s730a突变spycas9aa序列。
seqidno.22
t740a突变spycas9aa序列。
seqidno.23
r765g突变spycas9aa序列。
seqidno.24
r765a突变spycas9aa序列。
seqidno.25
t770k突变spycas9aa序列。
seqidno.26
t770a突变spycas9aa序列。
seqidno.27
n776a突变spycas9aa序列。
seqidno.28
r778a突变spycas9aa序列。
seqidno.29
r783a突变spycas9aa序列。
seqidno.30
s793a突变spycas9aa序列。
seqidno.31
n803d突变spycas9aa序列。
seqidno.32
n803a突变spycas9aa序列。
seqidno.33
s845a突变spycas9aa序列。
seqidno.34
n854k突变spycas9aa序列。
seqidno.35
n854a突变spycas9aa序列。
seqidno.36
s872a突变spycas9aa序列。
seqidno.37
r925c突变spycas9aa序列。
seqidno.38
r925a突变spycas9aa序列。
seqidno.39
r691a/n692a突变spycas9aa序列。
seqidno.40
r691a/r494c突变spycas9aa序列。
seqidno.41
n692a/r494c突变spycas9aa序列。
seqidno.42
r691a/n522k突变spycas9aa序列。
seqidno.43
n692a/n522k突变spycas9aa序列。
seqidno.44
r691a/n588d突变spycas9aa序列。
seqidno.45
n692a/n588d突变spycas9aa序列。
seqidno.46
r691a/n612a突变spycas9aa序列。
seqidno.47
n692a/n612a突变spycas9aa序列。
seqidno.48
r691a/s663a突变spycas9aa序列。
seqidno.49
n692a/s663a突变spycas9aa序列。
seqidno.50
r691a/s730g突变spycas9aa序列。
seqidno.51
n692a/s730g突变spycas9aa序列。
seqidno.52
r691a/t740a突变spycas9aa序列。
seqidno.53
n692a/t740a突变spycas9aa序列。
seqidno.54
r691a/r765g突变spycas9aa序列。
seqidno.55
n692a/r765g突变spycas9aa序列。
seqidno.56
r691a/t770k突变spycas9aa序列。
seqidno.57
n962a/t770k突变spycas9aa序列。
seqidno.58
r691a/s793a突变spycas9aa序列。
seqidno.59
n692a/s793a突变spycas9aa序列。
seqidno.60
r691a/n803d突变spycas9aa序列。
seqidno.61
n692a/n803d突变spycas9aa序列。
seqidno.62
r691a/s845a突变spycas9aa序列。
seqidno.63
n692a/s845a突变spycas9aa序列。
seqidno.64
r691a/n854k突变spycas9aa序列。
seqidno.65
n692a/n854k突变spycas9aa序列。
seqidno.66
r691a/s872a突变spycas9aa序列。
seqidno.67
n692a/s872a突变spycas9aa序列。
seqidno.68
r691a/n692a/t740a突变spycas9aa序列。
seqidno.69
r691a/n692a/s845a突变spycas9aa序列。
seqidno.70
r691a/n692a/s872a突变spycas9aa序列。
seqidno.71
r691s突变spycas9aa序列。
seqidno.72
r691n突变spycas9aa序列。
seqidno.73
r691d突变spycas9aa序列。
seqidno.74
r691c突变spycas9aa序列。
seqidno.75
r691q突变spycas9aa序列。
seqidno.76
r691e突变spycas9aa序列。
seqidno.77
r691g突变spycas9aa序列。
seqidno.78
r691h突变spycas9aa序列。
seqidno.79
r691i突变spycas9aa序列。
seqidno.80
r691l突变spycas9aa序列。
seqidno.81
r691k突变spycas9aa序列。
seqidno.82
r691m突变spycas9aa序列。
seqidno.83
r691f突变spycas9aa序列。
seqidno.84
r691p突变spycas9aa序列。
seqidno.85
r691t突变spycas9aa序列。
seqidno.86
r691w突变spycas9aa序列。
seqidno.87
r691y突变spycas9aa序列。
seqidno.88
r691v突变spycas9aa序列。
实施例2
富集具有减少的脱靶切割,同时维持高中靶活性的突变cas9肽的细菌遗传筛选。
以下实施例详述了在大肠杆菌中进行的遗传筛选,以鉴定感兴趣的候选cas9突变体酶,用于随后从~250,000个突变体克隆的文库中进行更详细的表征。
现有技术中揭示的具有减少的脱靶效应的cas9突变体均通过基于先前公开的cas9、cas9-grna和cas9-grna-dna复合物的晶体和共晶体结构,紧邻cas9核酸结合口袋进行带电氨基酸的丙氨酸置换,而使用合理的设计方法开发。这将可用于突变的序列空间限制为数量非常有限的氨基酸残基。本发明而是使用由cas9表达盒的低保真pcr产生的大量随机突变体的无偏筛选,其极大地扩展了对有用突变进行质询的潜在序列空间,鉴定了新的有用的cas9突变体。
在本发明中,我们使用细菌筛选方法,选择cas9中促进中靶切割但避免脱靶切割的任何氨基酸置换。筛选方法改编自先前针对其他应用进行的筛选,参见chen和zhao(nucleicacidsresearch,33(18)pe1542005)和kleinstiver等(nature,523p.481-485,2015)。本筛选是基于大肠杆菌细胞与两种质粒的共转化:i)编码与crispr/cas9中靶切割位点(vegfa3,heksite4或emx1,seqidno:133,135,137)连接的阿拉伯糖诱导的细胞增殖毒素的毒素质粒,其中中靶切割消除毒素产生(即,如果不切割中靶位点,细胞将死亡),和ii)含有随机诱变的(~每千碱基6个突变)cas9序列,对每个中靶位点特异的单一指导rna(sgrna),以及针对每个指导rna的已知脱靶切割位点的氯霉素抗性质粒(seqidno:134,136,138)(与氯霉素表达连接,使得如果暴露于选择性标记物氯霉素,如果发生切割,则不表达抗性基因,细胞将死亡)。筛选的设计使得能够连续使用与合适的脱靶位点(氯霉素)成对的不同的中靶位点(毒素),使得可以重复进行筛选,以确保不仅仅基于针对单个grna靶位点的性能选择分离物。
筛选方法如下:在不存在阿拉伯糖的情况下,用含有vegfa3靶位点的毒素质粒转化大肠杆菌k12菌株mg1655,其中不产生毒素并允许细胞存活。然后用氯霉素cas9-sgrna-脱靶质粒转化具有稳定复制的毒素质粒的细胞,在37摄氏度下非选择性生长1小时以恢复,然后将转化物涂布在含有氯霉素和阿拉伯糖两者的选择性培养基上。生长的细菌是i)用cas9-sgrna-脱靶质粒成功转化,ii)表达足够的cas9和vegfa3sgrna以切割毒素中靶质粒,和iii)避免切割足够的氯霉素cas9-sgrna-脱靶质粒以允许足够的氯霉素抗性以在选择下存活的那些。产生了允许在所有3种测试指导(vegfa3,heksite4和emx1)下存活的候选突变的池。在该池中,在整个筛选过程中多次分离的突变(总共94个克隆)推进到在哺乳动物细胞中进一步分析。该筛选方法的示意图如图1所示。
实施例3
新型cas9突变体的质粒递送减少了脱靶基因,同时维持了中靶活性。
以下实施例证实了本发明通过质粒递送cas9核酸酶来减少脱靶基因编辑活性的能力。在初级筛选中鉴定的单点突变(实施例2)用作起点,通过定点诱变从中产生选择的双突变体或三突变体变体。在质粒表达的环境中,其中cas9酶过表达,具有多个突变组合的克隆可以显示脱靶编辑活性的改善的减少,对中靶编辑活性影响有限。
该
这些结果显示在指定的cas9氨基酸位置处的点突变(seqidno:9,11,13,15,16,17,18,20,22,23,25,27,28,29,30,31,33,34,36,37和71)减少靶向emx1(图2)或heksite4基因座(图3)的crrna的脱靶基因编辑活性。从我们的筛选中分离出的许多点突变导致丙氨酸以外的氨基酸置换。对于那些来自初始筛选的非丙氨酸置换的突变体,我们进行了定点突变,并将这些突变改为在这些位置的丙氨酸置换,并将它们与wtcas9和原始氨基酸置换进行比较(新的丙氨酸突变体包括seqid号:7,10,12,14,19,21,24,26,32,35和38)。我们观察到从初级筛选中分离的原始突变体与新丙氨酸突变体之间的相似表型(图4和5)。在某些情况下,丙氨酸置换导致更高的中靶编辑活性和更低的脱靶编辑活性。通常,丙氨酸突变体的表现与分离的原始突变体一样好或更好,因此仅使用丙氨酸置换测试前移突变组合。位置r691和n692的突变显示emx1和heksite4crrna的脱靶基因编辑活性的最大减少。r691处的突变显示wtcas9水平的中靶编辑活性,而n692处的突变显示两种crrna的中靶编辑活性略微减少。出于这个原因,我们选择基于r691a或n692a突变作为起点制备双突变体和三突变体组合。我们还制作并测试了r691a/n692a双突变体。新的双突变cas9序列包括seqidno:39-70。这些突变的所有组合具有加合效果,因为未检测到可检测的脱靶编辑活性(图6)。两种已发表的现有技术高保真cas9蛋白,espcas9(1.1)(k848a,k1003a和r1060a)(slaymaker等,science,351p.84-88,2016)和spcas9-hf1(n497a,r661a,q695a,和q926a)(kleinstiver等,naturep.490-495,2016),当通过质粒递送时也具有不可检测的脱靶编辑活性,但相对于野生型蛋白具有减少的中靶编辑活性。与现有技术的这些突变体相比,当作为质粒递送时,本发明的突变体具有优异的总体编辑活性谱。表1中提供了实施例中使用的所有crisprgrna的靶特异性原型间隔子结构域的序列。这些rna序列代表随靶位点改变的grna的可变结构域。在实践中,原型间隔子结构域与另外的通用rna序列邻接以组成完整的功能性cas9crrna或sgrna(参见:jinek等,science,2012.337(6096):第816-21页和jacobi等,methods,2017.121-122,p.16-28)。在实施例中研究的dna中靶和脱靶结构域和dsdnaguide-seq标签的序列示于表2中。
表1.crrna原型间隔子结构域和pcr引物的序列
a,g,c,u=rna
a,g,c,t=dna
表2.中靶和脱靶dna位点和guide-seq标签的序列
a,g,c,t=dna
“*”=硫代磷酸酯核苷酸间键
p=磷酸盐
通过脱靶dna序列中的错配的下划线突出显示脱靶位点和中靶位点之间不同的碱基。
guide-seq标签是dsdna,序列以双链体格式对齐显示。
实施例4
新型cas9突变体的rnp递送减少了脱靶编辑活性,同时维持了中靶编辑活性。
以下实施例证实,当cas9-grna复合物作为rnp复合物递送到哺乳动物细胞中时,本发明的cas9突变体减少脱靶基因编辑活性和维持中靶编辑活性的能力。
将本发明中描述的cas9氨基酸突变转移到cas9蛋白表达/纯化质粒的环境中,该质粒允许在大肠杆菌中表达重组蛋白,并且所得蛋白含有促进哺乳动物细胞中核递送的nls结构域以及简化纯化的his-标签(参见wtcas9dna序列seqidno:1和r691a突变体seqidno:3)。具有结构域添加的氨基酸序列显示为示例性模型(wtseqidno:6,r691a突变体seqidno:8)。用固定化金属亲和力和肝素色谱法纯化野生型和突变型cas9蛋白。还使用该方法纯化了已发表的高保真cas9蛋白espcas9(1.1)和spcas9-hf1。通过首先在25℃下在opti-mem中5分钟,形成具有纯化cas9蛋白和2部分
图7显示了使用rnp方法在哺乳动物细胞中在人hprt基因中的12个位点处的基因组编辑效率,图8显示了在人ctla4基因中的12个位点,比较了wt,突变体r691a,espcas9(1.1)和cas9-hf1蛋白。本发明的r691acas9突变体在95%的测试位点显示与野生型cas9相当的中靶编辑活性,而spcas9-hf1和espcas9(1.1)分别在仅29%和57%的位点显示有用的功能。
使用相同的系统研究3个不同基因(emx1seqidno:113,heksite4seqidno:114和vegfa3seqidno:116)中的crrna位点的先前鉴定的位点处的脱靶编辑活性。图9中显示了中靶位点与脱靶位点对齐(seqidnos:121-126,129和130)。在所有3个位点观察到wtcas9酶的显著的脱靶编辑活性,然而使用该测定,3种突变cas9酶均未显示可检测的脱靶活性。然而,本发明的新r691a突变体在这3个位点显示相同的中靶活性,而现有技术突变体espcas9(1.1)和cas9-hf1仅在emx1位点显示完全活性,并且在heksite4和vegf3a基因座观察到显著减少的活性。这证实了本发明的实用性:对于r691acas9突变体,脱靶活性减少,而中靶活性维持高,并且提供了相对于现有技术的现存突变体的性能的显著改善。
制备另外的cas9突变体(包括单突变体,双突变体和三突变体)作为纯化的重组蛋白,并如上所述在哺乳动物细胞中使用rnp递送研究位点hprt-38509(seqidno:92)处的中靶活性(图10)和heksite4(seqidno:114)处的中靶活性相对于脱靶活性。研究的cas9酶包括wt(seqidno:5)和突变体(seqidno:7,19,22,33,36,52,62,66,68,69和70)。hprt38509是通常不显示高水平的编辑活性,并且对cas9活性变化敏感的grna位点。
图10显示当用rnp方法用于哺乳动物细胞时,所有测试的cas9单突变体显示高水平的中靶活性,而所有双突变体和三突变体显示活性显著丧失。注意,当从质粒模板过表达时,这些相同的双突变体显示良好活性(图6)。
这些突变体也作为rnp递送以测试脱靶活性和heksite4基因座。总体而言,n692a突变体与r691a类似地表现,仅在中靶编辑活性方面适度减少(图10),以及不可检测的脱靶编辑活性(图11)。孤立的其他单突变体在该困难位点处显示优异的中靶编辑活性(图10),但脱靶编辑活性适度或没有减少(图11)。尽管使用质粒递送的含有r691a或n692a的突变的多种组合显示优异的中靶编辑活性结合不可检测的脱靶编辑活性,但这些突变体在使用rnp递送时显示减少的中靶编辑活性(图10和11)。由于r691a突变体在多个测试位点表现出脱靶编辑活性减少与中靶编辑活性维持的最佳整体组合,因此对该位点进行了更深入的研究。
实施例5
使用质粒和rnp递送方法测试位置r691处的另外的氨基酸突变。
到目前为止,位点r691已被表征为wt和突变体r691a和r691s。本实施例展示了cas9中该位置的17种其他可能的氨基酸置换的活性。
使用定点诱变将该位置处的17种新氨基酸置换引入哺乳动物cas9表达质粒中,并使用质粒递送(实施例3中所述的方法)测试hek293细胞中的功能。使用crrnahprt38509(seqidno:92)研究中靶编辑活性,在该位点处的所有20种可能氨基酸(seqidno:5,7和71-88)的结果显示在图12中。突变体r691n,r691c,r691t,r691i,r691l和r691v显示减少的中靶活性,而wt和在该位置使用14种其他氨基酸的突变体都显示高活性。
在crrnaheksite4(seqidno:114)研究这组20个cas9变体的组合的中靶和脱靶活性,其是wtcas9的中靶和脱靶两者的高活性位点。图13证实wtcas9和突变体r691k和r691p在该位点显示高的脱靶活性,而所有17种其他cas9突变体显示显著减少的脱靶活性。这证实位点r691是进行突变以改善cas9功能的理想位点,并且在此背景下多种不同的氨基酸置换表现良好。
将这些突变体的最佳表现,r691d,r691g,r691h,r691y和r691w,制备为重组蛋白,并使用rnp递送与wtcas9和突变体r691a比较测试中靶和脱靶编辑活性(方法如实施例4所述)。如图14和15所示,所有这些突变体在crrna位点hprt38509(seqidno:92),hprt38087(seqidno:94),emx1(seqidno:113)和heksite4(seqidno:114)显示非常相似的中靶编辑活性水平。所有突变体还显示位点emx1和heksite4的脱靶活性显著减少(图15),但是对于r691g,r691h和r691y突变体,观察到低但可检测的脱靶编辑活性。当考虑质粒和rnp递送方法两者时,r691a,r691d,和r691w突变体提供了中靶编辑活性与脱靶编辑活性减少的最佳组合。
使用名为guide-seq的已发表的无偏基因组宽下一代测序(ngs)测定法(tsai等,naturebiotechnology,33p.187-197,2015)测试r691a突变体的全局脱靶效应,所述测定法是在上述实施例中研究的emx1,heksite4和vegf3acrrna的验证的脱靶位点的来源。使用wtcas9或r691a突变cas9与rnp递送,使用crrna指导emx1(seqidno:113),vegfa3(seqidno:116)和ar(seqidno:115),如所推荐的进行guide-seq方案。如前所述(tsai等,naturebiotechnology33:187-197,2015)进行ngs文库构建和数据处理,结果(图16)证实r691a突变体显著减少全局脱靶编辑活性,同时与wtcas9核酸酶相比维持中靶编辑活性。
本文引用的所有参考文献,包括出版物、专利申请和专利均通过引用并入本文,其程度如同每个参考文献被单独且具体地指出通过引用并入并且在本文中完整地阐述。
在描述本发明的上下文中(特别是在以下权利要求的上下文中)术语“一个/种(a/an)”和“该/所述(the)”以及类似的指示物的使用应被解释为涵盖单数和复数,除非本文另有说明或与上下文明显矛盾。除非另有说明,否则术语“包含”,“具有”,“包括”和“含有”应被解释为开放式术语(即,意味着“包括但不限于”)。除非本文另有说明,否则本文中对数值范围的描述仅旨在用作单独提及落入该范围内的每个单独值的简写方法,并且每个单独值并入本说明书中,如同其在本文中单独引用一样。除非本文另有说明或上下文明显矛盾,否则本文所述的所有方法均可以任何合适的顺序进行。除非另外声明,否则本文提供的任何和所有实例或示例性语言(例如,“如”)的使用仅旨在更好地说明本发明,并且不对本发明的范围构成限制。说明书中的任何语言都不应被解释为表明任何未要求保护的要素对于本发明的实践是必要的。
本文描述了本发明的优选实施方式,包括发明人已知的实施本发明的最佳方式。在阅读前面的描述后,那些优选实施方式的变化对于本领域普通技术人员来说可以变得显而易见。发明人预期熟练的技术人员适当地采用这样的变化,并且发明人意图本发明以不同于本文具体描述的方式实施。因此,本发明包括适用法律所允许的所附权利要求中记载的主题内容的所有修改和等同方式。此外,除非本文另有说明或上下文明显矛盾,否则本发明涵盖上述要素以所有可能变化方式的任何组合。
- 还没有人留言评论。精彩留言会获得点赞!