用于T细胞受体合成和向TCR呈递细胞进行稳定的基因组整合的两部分装置的制作方法
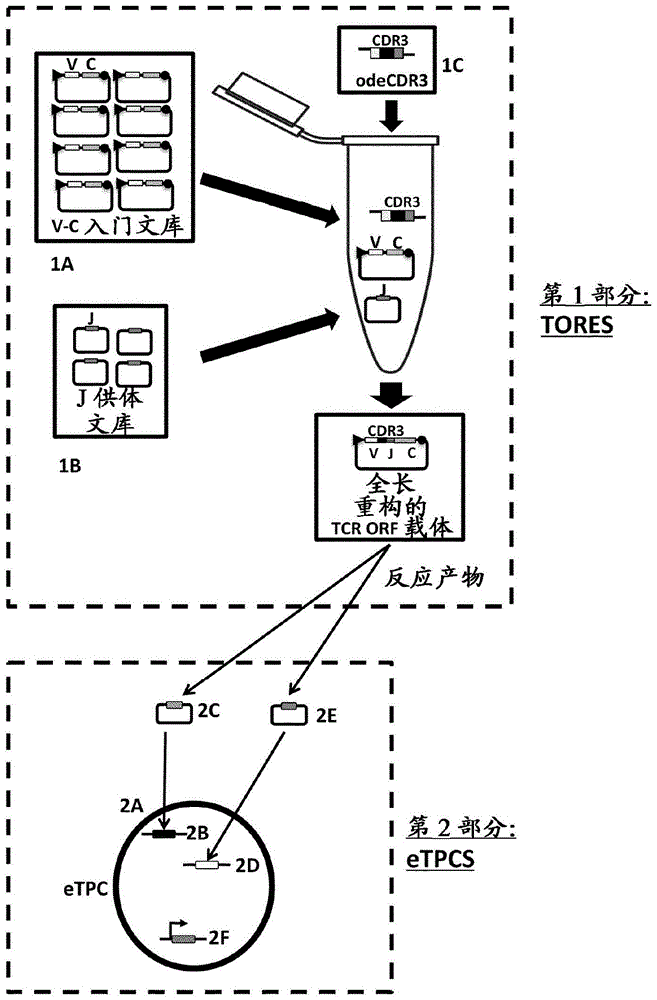
本发明涉及两部分装置的构建、装配和用途,所述装置用于快速合成天然和序列多样化的t细胞受体(tcr)可读框(orf)以及将这些tcrorf向tcr呈递细胞基因组的整合。归因于天然tcr发生过程中体细胞重组所致的庞大程度的多样性,难以基于高通量和成本效益的方式来提供在基因构建体内的tcr可读框(orf),用于检验和操作tcr功能。本发明的第一部分提供预装配的双组分载体文库系统,其由可变-恒定入门载体(v-c入门)和连接供体(j供体)载体组成,包含tcr基因区段的一些部分。该双组分系统以如此方式设计,从而当选自v-c入门载体文库的v-c入门载体与选自j供体载体文库的j供体载体,连同编码tcr互补决定区3的合成dna寡核苷酸双链体(odecdr3),在限制性酶消化/连接酶循环反应中组合时,可以产生单一载体,重构全长tcrorf。这种载体文库系统使得pcr非依赖性方法可以用于在选定载体背景下快速和成本有效地产生tcrorf。此外,这种系统允许以新颖过程产生合成的tcr序列用于亲和力和/或功能成熟过程。在与本发明第二部分——工程化的tcr呈递细胞(etpc)——组合时,这种tcrorf重构和工程化系统(tores)因此是用于tcr功能性分析和工程化的强大工具。这些etpc细胞含有与来自tores的tcr编码载体输出物配对的一对人造基因组接受位点。由此,在tores内部生成的tcrorf可以直接被提交至etpc的基因组以整合,从而etpc可以用于快速、高通量生成呈递tcr对的稳定衍生性细胞(etpc-t)用于各种分析性目的。重要地,etpc以组成型方式表达cd3复合体的全部组分,但是缺少tcrα、β、γ和δ链的内源性表达。总之,这个两部分装置可以用来快速地生成etpc-t以作为分析性和临床免疫诊断系统的中心组分。另外,本发明涉及两部分装置鉴定、表征和工程化tcr用于诊断学、药物、研究和开发的用途。发明介绍t淋巴细胞(t细胞)的免疫监视是全部有颌类脊椎动物的适应性免疫中的核心功能。t细胞免疫监视通过t细胞亚型的丰富功能多样性来实现,其这些t细胞亚型的作用包括,消除病原体感染细胞和肿瘤细胞、以及协调适应性免疫应答以对抗正在入侵的病原体、共生性微生物、共生非自我因素(如食品原料的分子组分)、和甚至维持自我免疫耐受性。为了响应于各种外来因素和自我因素,t细胞必须能够特异性检测这些外来因素和自我因素的分子组分。因此t细胞必须能够以足够的特异性来检测个体遭遇到的庞大自我分子和非自我分子,从而针对致病生物和患病自我发动有效应答,同时避免对健康自我发动这类应答。考虑到外来分子和自我分子的多样性实际上不受限制且致病生物处于逃避t细胞检测的进化压力下,这项任务的高度复杂性质是明显的。t细胞受体(tcr)t细胞主要依据表达的t细胞受体(tcr)界定。tcr是t细胞的组分,其负责与t细胞适应性免疫的靶标相互作用并感知该靶标。概括而言,tcr由呈递在细胞表面上的异二聚体蛋白质复合体组成。两条tcr链各自由两个胞外结构域组成,即可变(v)区和恒定(c)区,两者均为免疫球蛋白超家族(igsf)结构域,形成反平行β-折叠。这些结构域由连接短胞质尾的i型跨膜结构域锚定在细胞膜中。t细胞能够适应并且检测分子组分多样性的性质,源自tcr链在t细胞发生期间产生的变异。这种变异与类似于b细胞中抗体生成的方式通过体细胞重组而产生。tcr链多样性t细胞集合由几个功能上和表型上异质的亚群组成。但是,t细胞可以根据它们在表面表达的经体细胞重排的tcr同种型,广义地划分为αβ或γδ。存在两种tcr链对同种型;tcrα(tra)和tcrβ(trb)对;和trcγ(trg)和tcrδ(trd)对。表达tra:trb对的t细胞称作αβt细胞,而表达trg:trd对的t细胞经常称作γδt细胞。αβ形式和γδ形式的tcr负责识别多样的配体或‘抗原’,并且每个t细胞在t细胞成熟期间从头生成αβ或γδ受体链。这些新生tcr链对通过在称作体细胞v(d)j重组的过程中产生受体序列多样性,实现多样性识别,此后,每个t细胞表达单一一种独特重排的tcr的拷贝。在tra基因座和trg基因座,多个离散的可变(v)和功能(j)基因区段可用于重组并与恒定(c)基因区段并置,因此称作vj重组。在trb基因座和trd基因座处的重组额外地包括多样性(d)基因区段,并且称作vdj重组。每个重组的tcr具有用于独特配体特异性的潜力,这由α链和β链(在αβt细胞情况下)或γ链和δ链(在γδt细胞情况下)形成的配体结合位点的结构决定。tcr的结构多样性主要限于每条链上的三个短发夹环,称作互补决定区(cdr)。受体链对的每条链各贡献三个cdr,合在一起这六个cdr环位于tcr胞外结构域的远膜端,形成抗原结合位点。每条tcr链中的序列多样性以两种方式实现。首先,通过随机选择基因区段以重组,提供了基本的序列多样性。例如,trb重组在47个独特v、2个独特d和13个独特j种系基因区段之间发生。通常而言,v基因区段贡献cdr1环和cdr2环,并且因此是种系编码的。产生序列多样性的第二方式出现在高变性cdr3环内部,其中通过在正在重组的v、(d)和j基因区段之间的交界处随机缺失模板核苷酸和加入非模板核苷酸,产生所述cdr3环。tcr:cd3复合体成熟的αβ和γδtcr链对在细胞表面呈递,与多种称作ε、γ、δ和ζ的辅助cd3亚基形成复合体。这些亚基以三种二聚体(εγ、εδ、ζζ)形式与αβ或γδtcr缔合。这种tcr:cd3复合体形成当αβ或γδtcr与相关抗原(cognateantigen)接合时启动细胞信号传导响应的单位。缔合在tcr:cd3复合体中的cd3辅助亚基贡献了信号传导基序,其称作免疫受体基于酪氨酸的活化基序(itam)。cd3ε,cd3γ和cd3δ各自贡献单一itam,而cd3ζ同型二聚体含有3个itam。与tcr装配的三种cd3二聚体(εγ、εδ、ζζ)因此贡献10个itam。一旦tcr与相关抗原连接,则串联酪氨酸残基的磷酸化可以为含有src同源性2(sh2)结构域的蛋白质(如关键的ζ链缔合70kda蛋白(zap-70))提供配对的对接位点。招募这类蛋白质将启动最终负责t细胞活化和分化的tcr:cd3信号传导复合体的形成。αβt细胞人类中αβt细胞通常比其γδt细胞对应物更丰富。大部分的αβt细胞与细胞表面上由复合体呈递的肽抗原相互作用。这些复合体称作主要组织相容性复合体(mhc),由人类白细胞抗原(hla)基因家族编码,为了简洁起见所述基因和mhc在本文中统一地称作hla。识别肽-hla(phla)的t细胞是首先被描述并且迄今最充分表征的。也已经描述了比较少见形式的αβt细胞。粘膜相关的不变t(mait)细胞看起来具有相对有限的α链和β链多样性,并且识别细菌代谢物而非蛋白质片段。不变天然杀伤t细胞(inkt细胞)和种系编码的分枝酰(mycolyl)反应性t细胞(gemt细胞)限于识别由非hla分子交叉呈递的糖脂。大部分认为inkt细胞与cd1d呈递的糖脂相互作用,而gemt细胞与cd1b呈递的糖脂相互作用。其他形式的t细胞据认为与cd1a和cd1c背景中的糖脂相互作用,然而,这些细胞仍待详细表征。常规αβt细胞大部分αβt细胞的关键特征是识别hla分子背景下的肽抗原。这些细胞经常称作‘常规’αβt细胞。在个体内部,自我-hla分子向t细胞呈递源于自我和外来蛋白的肽,从而为针对恶性肿瘤和外来病原体的适应性免疫、针对共生生物、食品原料和自我的适应性耐受,提供必要基础。编码hla蛋白的hla基因座是人类基因组中基因最密集和最具多态性的区域,并且人类中描述了存在超过12,000个的等位基因。hla基因座中的高度多态性确保了个体之间的肽抗原呈递多样性,这对群体水平的免疫力是重要的。hlai类和ii类存在两种形式的经典hla复合体:hlai类(hlai)和hlaii类(hlaii)。存在三个经典的hlai基因:hla-a、hla-b、hla-c。这些基因编码跨膜α链,其与不变的β2-微球蛋白(β2m)链缔合。hlaiα链由具有免疫球蛋白折叠的三个结构域:α1、α2和α3组成。α3结构域在近膜端并且基本上不变,而α1结构域和α2结构域共同形成远膜端的多态性抗原结合槽。存在六个经典的hlaii基因:hla-dpal、hla-dpb1、hla-dqa1、hla-dqb1、hla-dra和hla-drb1。这些基因编码包含α链和β-链的配对的dp、dq和dr异二聚hla复合体。每条链具有两个具有免疫球蛋白折叠的主要结构域,其中α2结构域和β2结构域包含类似于hlaiα3结构域的近膜端且基本上不变的模块。hlaiiα2和β2结构域共同形成远膜端的抗原结合槽并且是高多态性区域。hlai和hlaii的抗原结合槽包含在八个反平行β-折叠的平台上的两个反平行α-螺旋。在这个槽中,肽抗原结合并以延伸的构象呈递。在hlai和hlaii中接触肽的残基是最具序列多态性的位置,构成了不同hla等位基因呈递的肽库多样性的分子基础。肽与抗原结合槽广泛接触,并且因此,每个hla等位基因对呈递的肽施与不同的序列约束和偏好性。因此,给定的肽将仅结合有限数目的hla,并且对应地,每个等位基因仅容纳来自给定蛋白质的肽集合的一个特定部分。每位个体中存在的hlai和hlaii等位基因集合称作hla单倍型。hlai基因和hlaii基因的多态性和遗传的等位基因的共显性表达在人类群体中驱动了极庞大的hla单倍型多样性,这与αβtcr的众多序列多样性组合,为这些hla-抗原-tcr相互作用的分析标准化设置了高度障碍。hlai和hlaii的αβtcr接合作用(engagement)αβtcr通过混合的phla结合界面的一部分识别肽,所述结合界面由hla和肽抗原(改变的自我)的残基形成。hlai复合体呈递在几乎全部有核细胞的表面上并且通常被认为呈递衍生自内源蛋白的肽。t细胞因此可以通过采样相互作用性细胞的phlai复合体,探查hlai呈递细胞的内源性细胞蛋白质组。hlai接合需要由相互作用性t细胞表达tcr共同受体cd8,因此hlai采样限于cd8+αβt细胞。相反,hlaii复合体的表面呈递主要地限于专职apc,并且通常视为呈递从外源于呈递细胞的蛋白质衍生的肽。相互作用性t细胞可以因此探查呈递细胞所在的胞外微环境的蛋白质组。hlaii接合需要由相互作用性t细胞表达tcr共同受体cd4,因此hlaii采样限于cd4+αβt细胞。αβtcr的胸腺选择如上文所述的αβtcr的作用是检测phla复合体,由此呈递tcr的t细胞可以产生与该t细胞在建立免疫中的作用密切相关的应答。应当考虑到,在个体内部生成的αβtcr组库必须解决在抗原实际出现之前、在特定单倍型背景下可能遭遇到的全部外来抗原的浩瀚和不可预见的多样性。这种结果可以在如下背景下实现,其中按照准随机化的方式生成极端多样和众多的αβtcr,其潜在地识别未明确的phla复合体,而仅被特别地指导以避免与自我phla的强烈相互作用。在称作胸腺选择的过程中,这在t细胞成熟期间被仔细地协调。在胸腺中t细胞成熟的第一步,携带不能够与自我-phla复合体以足够亲和力相互作用的αβtcr的t细胞,将被剥夺存活信号并被消除。这个称作正向选择的步骤可以确保存活的t细胞携带这样的tcr组库,所述的tcr组库(repertoire)至少潜在地能够识别在正确hla背景下呈递的外来肽或变异肽。随后,通过负向选择过程,主动移除与自我-phla强烈相互作用并且因此具有驱动自身免疫性的可能性的αβtcr。正向选择和负向选择的这种组合,导致只有携带对自我-phla具有低亲和力的αβtcr的t细胞在外周增殖。由此建立自我限制的但非自我反应的αβt细胞库。t细胞生成过程针对hla单倍型的这种高度个体化性质,加大了对αβtcr-抗原-hla相互作用进行标准化分析的挑战性。另外,这也形成移植排异和移植物抗宿主病和如下一般原则的基础,所述的一般原则是:在一位个体中鉴定到的αβtcr可能在第二位个体中具有完全不同作用,这对于临床实践中出现的基于tcr和基于t细胞的治疗和诊断策略具有明确意义。非常规αβt细胞非hla限制或‘非常规’形式的αβt细胞具有非常不同的分子抗原靶。这些非常规的αβt细胞不接合经典hla复合体,反而接合保守的hla样蛋白质如cd1家族或mr1。cd1家族包括参与抗原交叉呈递的四种形式(cd1a、b、c和d)。这些细胞表面复合体具有与hlai相似的α链,其与β2m形成异二聚体。在该α链的远膜端表面呈献的疏水性小口袋形成病原体衍生的基于脂质的抗原的结合位点。先天样nkt细胞(inkt细胞)是最充分理解的识别脂质/cd1家族的一个例子,gemt细胞是另一明显例子。已知‘i型’inkt细胞与在cd1d背景下的脂质α-galcer强烈相互作用。这些inkt细胞展示非常有限的tcr多样性,具有固定的tcrα链(vα10/jα18)和数目有限的β-链(受限的vβ利用),已经被类比于先天病原体相关的分子模式(pamps)识别受体如toll样受体和nod样受体。相反,‘ii型’nkt细胞展示更多样的tcr组库,并且看起来具有更多样的cd1d-脂质复合体接合模式。gemt细胞识别cd1b呈递的分枝杆菌(mycobacteria)来源糖脂,然而,对通过cd1a、b和c的抗原呈递的分子细节以及它们的t细胞识别的理解,才刚开始。mait细胞主要表达能够与一系列tcrβ-链配对的不变tcrα链(trav1-2,连接于traj33、traj20或traj12)。替代肽或脂质,maittcr可以结合hlai样分子(mr1)呈递的、基于叶酸和基于核黄素的病原体衍生代谢物。在maittcr上观察到的有限但明显的tcr多样性,看起来能够在保守的mr1背景下实现多样但相关代谢物的识别。并不充分理解,非经典hla限制肽αβt细胞tcr在胸腺中在成熟期间如何被选择的。但是,看上去上文所概述的负向选择和正向选择的基本过程可能仍适用,并且一些证据表明,这在胸腺中在特化的微生境中发生。γδt细胞与αβtcr生成和phla接合的详细机理性理解相反,对抗原靶及其γδt细胞对应物的情况,所知道的相对少。这部分地归因于它们在循环t细胞区室中相对低的丰度。但是,广泛地认为,γδt细胞不是严格hla限制性的,并且类似于抗体,似乎更自由地识别表面抗原。最近,已经获悉,γδt细胞可以在上皮组织的常驻性t细胞区室(免疫系统与外来抗原相互作用的主要部位)中占主导。此外,文献中开始出现γδt细胞如何免疫监测肿瘤和监测其他自我失调形式的各种机制。先天样和适应性γδt细胞两者的特定抗原靶仍界定模糊,但是pamp的组织分布和快速识别提示,两种γδt细胞在外来抗原的早期应答以及适应性免疫系统仍在成熟的生命早期具有重大作用。γδt细胞的多样功能似乎基于不同的vγvδ基因区段的利用,并且可以按照两个主要类别宽泛地理解,其中主要具有不变tcr的γδt细胞介导感染期间极早期的pamp先天样识别。除了pamp之外,还认为这些类型的γδt细胞识别自我分子,包括磷酰抗原,这些分子可能提供细胞应激、感染和潜在地肿瘤形成的极早期标签。对pamp和这类所谓危险相关分子模式(damps)以及大量组织限制性先天样γδt细胞的认识,强烈地表明,这些细胞适合快速应答抗原攻击,而无需先前活化、归巢和克隆性扩增。第二形式的γδt细胞被认为在本质上是更为适应性的,具有高度多样的γδtcr组库并能够外周循环和直接接近淋巴组织。已经描述了针对人常见病原体如cmv的这类抗原特异性γδt细胞,并且它们似乎形成记忆应答。但是,也已经观察到,γδt细胞在活化后仅显示相对有限的克隆性增殖,并且关于γδt细胞在外周循环中或在组织中的tcr多样性和特异性应答的程度,可用数据甚少。另外,尽管通常认为γδtcr不与phla复合体相互作用并且因此不与在此背景下的肽抗原接合,但仅有γδt细胞的少数抗原靶已经得到表征,并且潜藏的分子构架仅有很少的理解。人体中外周γδt细胞的低频率和研究组织常驻性t细胞的困难性,已经限制我们对这种重要和多样的t细胞类型如何参与适应性免疫应答的了解。这个新兴的研究领域需要更可靠的技术来捕获和表征罕见γδt细胞、分离其tcr对、以及鉴定其相关抗原。抗原和抗原呈递细胞在t细胞和tcr的情况下,抗原可以定义为可以由tcr接合并且在t细胞中导致信号转导的任何分子。最充分表征的t细胞抗原是在hlai和hlaii复合体中呈递并且由常规αβt细胞接合的肽。但是,近几年,已经显而易见,非常规的αβt细胞和γδt细胞能够接合广泛类型的生物分子作为抗原,包括脂质、脂肽、糖肽、糖脂和一系列代谢物和分解代谢物。此外,已经提出,γδt细胞或许能够以抗体样方式直接接合充分折叠的蛋白质。因此,t细胞抗原基本上限制于hla呈递肽的观点已经在过去二十年期间扩展为包括几乎任何生物分子。由此概念,定义什么可以被视为抗原呈递细胞(apc)是有意义的。如上文章节中所指出,hlai和hlaii具有跨细胞类型的不同表达谱。广泛认可的是,几乎全部有核细胞均在细胞表面上呈递hlai复合体,并且因此有能力呈递肽抗原供t细胞采样。相反,hlaii具有限的表达谱,并且至少在稳态条件中仅表达在具有抗原呈递专职作用的细胞的表面上,所述细胞包括树状细胞(dc)、巨噬细胞和b细胞。这些专职细胞类型经常称作专职apc。出于本文的目的,术语apc用来描述能够呈递抗原供αβ或γδt细胞采样的任何有核细胞。这类抗原不限于在特异性抗原呈递复合体如hla和hla样分子中作为‘载货’呈递的那些,还可以包括在细胞表面呈递的、能够接合携带αβ或γδtcr的细胞的任何结构部分。tcr的治疗性用途原代t细胞过继转移(adoptivetransfer)在二十世纪九十年代早期首次在临床环境下试验,始于离体扩增的t细胞,这些t细胞被极化以针对病毒性抗原,旨在赋予免疫受损患者对病毒的免疫力。之后很快,在恶性肿瘤治疗中,使用离体扩增的针对特定癌抗原的原代t细胞,试验了相似方案。在这些早期方案中出现的且持续成为如今难题的一个限制是,对于t细胞的本质和多样性缺乏理解,这与精细优化治疗产品的组成的需求发生冲突。目前,离体扩增的原代t细胞的使用已经基本上为制药业摒弃,除了屈指可数的使用具有病毒抗原特异性的原代t细胞的举措。近年来,将遗传物质可靠引入人原代细胞的能力已经见证了多种实验性基因修饰的t细胞治疗药的出现。这类治疗用细胞产品旨在利用t细胞应答的能力并使t细胞特异性针对疾病相关性抗原靶(例如,恶性细胞独特表达的抗原)重定向。这些产品主要依赖于将嵌合抗原受体(car)转移入接受者t细胞,而非实际的tcr链对。car代表导引部分(最经常是靶向恶性细胞的表面表达蛋白质的单链抗体元件),其中所述导引部分移植到信号受体元件(如cd3复合体的ζ链)上,以产生模拟cd3-tcr功能的人造嵌合受体。这些所谓的cart细胞(car-t)产品迄今在临床试验中达到综合成功,然而尽管如此,它们的潜力并不容易超出具有固有唯一分子靶的肿瘤(如b细胞恶性肿瘤)的范围。备选地,将全长tcr链对的orf转移入t细胞,正在越来越多地被关注。这类tcr工程化的t细胞治疗药目前受限于生产工艺的挑战性以及(类似于car-t产品)缺少已验证的抗原靶和导引构建体。迄今,一直致力于使用αβtcr识别hlai呈递在恶性细胞上的肽抗原,而这种方法的一个基本问题是需要特异于恶性细胞的抗原。由于tcr-phla相互作用具有相对低的亲和力,所以天然tcr被认为可能次优于tcr工程化的t细胞疗法。已经构思了几种方案以使tcr按照几乎与单链抗体亲和力成熟过程相同的方式在体外亲和力成熟。这些tcr亲和力成熟方案通常也利用单链样式,其中一条链的v区与另一条链的v区融合以产生单一多肽构建体。这类单一多肽随后可以用于改编自抗体工程化作业流程的噬菌体展示系统或酵母展示系统中,并且经过多轮次基于靶结合的选择。就产生功能性tcr链对而言,这种单链tcr方案中存在两个固有局限性。首先,选择过程基于的是靶结合亲和力。但是,文献已经充分记载,tcr亲和力并不总是与tcr信号传导输出的强度或能力相关。其次,一旦将单链构建体重构为全长受体后,基于亲和力对单链构建体的选择并不总是能够转换成等同的亲和力。在治疗用背景中,对于亲和力成熟的tcr对,存在一个附加和决定性的限制。即,考虑到它们的序列已经改变,所产生的构建体依据定义已经不再接受胸腺选择,在胸腺选择中与自我抗原强烈反应的tcr将从组库中被去除。因此,这些修饰的tcr携带自反应性的内在风险,所述风险很难使用现有方法在体外排除。出于相同理由,用于治疗性应用时,任何选择的或工程化的tcr需要个体化。如果tcr是跨个体应用的经人工工程化或天然的tcr,则必须基于每个特定个体的hla单倍型和呈递的肽组库来排除交叉反应,以避免潜在灾难性的自身免疫性。原因是:胸腺选择是在仅特异于给定个体的全部可用hla分子的背景上进行的。不清楚这种交叉反应性的可能性。但是,我们的tcr组库将相同物种的其他个体的phla复合体识别为外来的能力,是适应性免疫的基本特性,并且是移植排异和移植物抗宿主病的基础。使用针对癌特异性黑素瘤相关抗原(mage)的成熟tcr链对,进行的最近临床试验,凸显了绕过胸腺选择的潜在问题。将携带成熟tcr的自体t细胞返输回两位癌症患者时,这些患者快速地出现致命的心脏病。后续研究确定,mage特异的成熟tcr与hlai呈递的来自心脏蛋白质肌联蛋白的肽交叉反应。这强烈地表明,交叉反应性是治疗性使用tcr时的一种明显的可能性。出于治疗目的利用tcr的一个不同途径是,按照几乎与抗体治疗用物质相同的方式使用它们作为亲和试剂。已经试验,单链tcr分子可以用于递送缀合的药物物质至特定的hla抗原表达细胞群。总体上认为这种方案比car-t或tcr工程化的t细胞治疗药更安全,因为可以简单地停止该药物物质的施用。但是,难以预测的交叉反应性及脱靶效应可能性仍是这种设定下的潜在限制。临床诊断中的tcr组库检测在一个相关方面,日益浮现的兴趣是,出于临床诊断目的,检测特定tcr序列的丰度。尤其随着深度测序方法出现,可以全局地以及针对特定背景下的匹配αβ对,捕获某个体内部的完整tcr多样性。这潜在地构成了一种诊断特定状况和疾病状态的手段,其中仅检测扩增的t细胞克隆的丰度,作为患者中疾病相关性抗原的既定免疫应答的替代性读出结果。但是,这类全局方案目前受限于十分强烈的免疫反应和确立的临床时间点,并且遭遇以下基础性难题:鉴定依据测序鉴定的任何具体tcr的特异性抗原靶。t细胞抗原的治疗性和诊断性用途利用适应性免疫应答的该基本手段可以转换成一个核心技术难题,即,tcr-抗原相互作用的精致特异性需要详细知晓与每种病原体、癌细胞或自身免疫疾病特异性相关的抗原。另外,每种抗原可以由特定的抗原呈递复合体或其等位基因呈递,从而抗原开发必须针对每个相关的hla基因和等位基因来进行。对于与强烈适应性免疫应答相关并且通常显示保守性表位应答层级的几种传染性疾病如hiv、流感和cmv,已经在某些常见hla的背景下作图定位最重要的表位。类似地,癌症、过敏和自身免疫性领域已经见证增长和系统性的相关t细胞抗原定位工作。但是,这些是有挑战性的过程,并且由于缺少有效、稳健、快速和可放大方案,也阻碍了系统性描述与不同临床背景相关的t细胞抗原的进行。特别地,癌细胞代表一个有挑战性和重要的方面,这是因为呈递在恶性细胞表面上的大部分肽是自身抗原或与自身抗原十分相似。因此,胸腺选择将已经去除可能强烈识别这些肽的tcr,而与此同时,肿瘤会演进以逃避免疫识别。这意味着,针对已建立肿瘤,强力免疫应答是相对少见的,并且难以预测或发现靶标。但是,这些应答的确存在,并且重要地,通常与更好的结果相关。在大多数情况下,这类应答的靶,肿瘤相关抗原(taa),将具有区别于自我的特征,并且衍生自这样蛋白质,所述蛋白质在癌形成期间过量表达、或者在此形成阶段从细胞类型中缺失、或通过遗传突变或翻译后修饰(如磷酸化)被特异性改变。这类表位的知识,如果可获得,则允许探查相关的t细胞应答,用于基础发现、诊断目的和例如检测疫苗效力。重要地,也可以为过敏和自身免疫中的t细胞耐受作用提供高度特异的靶,并且至关重要的是,可以指出用于特异性免疫疗法和对抗恶性细胞的有价值靶。恶性肿瘤是特别有价值的靶点,除了癌类型的特异标记物碰巧可获得的少数情况,细胞免疫疗法的前景和t细胞操作的进展因缺少已验证的靶taa而被延缓。鉴于细胞疗法的潜力和缺少已验证的靶,鉴定有前景的tcr抗原仍是基于tcr的免疫治疗的最急迫瓶颈之一,在治疗癌症的工作中尤其如此。tcr和t细胞抗原分析的技术方面总体上,基于tcr的疗法的开发仍处于早期,并且成功有限。诊断方案,尽管潜力巨大,但一直很少用于旨在评估患者疾病状态或治疗响应的对照临床研究中。用于可靠捕获天然tcr链对以及用于高通量地在细胞-细胞通讯的功能背景下标准化地系统分析tcr-抗原相互作用的技术仍开发不足,这已经成为基于tcr的疗法和诊断学发展的主要障碍。深度测序方案已经导致对健康和疾病情况下t细胞受体多样性的理解改进。但是,这些方案总体上聚焦于跨越cdr3区域(主要地tcrβ-链)的短段。大部分研究忽略了tcrα链的贡献,并且很少研究力图分析配对的αβ链以及确定为有意义的tcr的抗原特异性。使用单细胞包囊化和遗传条形码的最近作业流程,已经能够使天然tcrαβ链对或γδ链对配对及分析全长序列,然而,这类作业流程仍是实验性的。可以按生物物理模式或功能模式,从抗原特异性方面分析分离的tcr链对。生物物理分析需要重组产生tcr以及分析物抗原的可溶性形式。在hla限制型肽tcr的情况下,这将因此需要产生全部独立tcr以及相关的phla复合体。这在技术上有高度挑战性、缓慢且通量十分低。另外,这种分析将仅提供相互作用亲和力,后者并不以可预测方式与功能特征充分相关。直至最近,细胞背景下已分离tcr序列的详细功能性分析尚限于以下繁琐方案:将分析物tcr链对转染入原代t细胞或永生t细胞系,通过传统的细胞活化流式细胞分析来检测细胞应答、或检测已转染细胞在抗原攻击时产生的分泌因子。在guo等人的最新发表物中,报道了来自单细胞的配对tcr链的快速克隆、表达和功能性表征(moleculartherapy-methodsandclinicaldevelopment(2016)3:15054)。在这项研究中,人αβtcr对分析物在报道细胞系中表达,所述报道细胞系缺少αβtcr表达并含有nur77启动子连接的绿色荧光蛋白(gfp)报道分子系统,该报道系统可以在tcr刺激时被激活。这个系统仍是低效的,原因在于缺少向报道细胞系基因组中的标准化tcr整合,并且未提供通过apc元件用于细胞结合型抗原攻击的系统方式。类似于鉴定已知t细胞抗原的tcr的作业流程,在健康和疾病情况下从头发现新t细胞抗原仍高度有挑战性。大部分方案在本质上仍是生物物理的,并且旨在产生候选抗原,以便可以在免疫接种方案中测试、或通过鉴定如上所述的相关tcr而测试。在t细胞抗原开发领域,很少存在或不存在标准化,并且该领域主要限于学术研究。尽管对tcr及其相关抗原在治疗性和诊断使用中的兴趣日益积累并且出现了捕获明显数目的天然tcrαβ和γδ链对的手段,但是仍缺少系统分析tcr-抗原相互作用的可靠高通量和标准化技术。重要地,缺少在天然的细胞-细胞通讯背景下功能性分析tcr链对的标准化系统,其中tcr和抗原均由活细胞呈递。另外,缺少在细胞-细胞通讯的相关背景下可以实现候选tcr选择和/或tcr链对的亲和力/功能成熟的系统。如所述,目前缺少标准化技术用于高通量产生和表达tcr链以及将其表达在天然细胞背景中。迫切需要这样的系统,其中全长tcr可以快速产生并作为单拷贝插入tcr呈递细胞的基因组,由此所述tcr可以呈递在天然cd3细胞表面复合体中供分析。cd3复合体呈递的tcr对可以确保亲和力分析反映实际的天然tcr组成,这对于单链tcr和其他非天然tcr展示技术而言并非如此。另外,在cd3复合体中呈递tcr对是功能性分析tcr对所绝对必需的。功能性分析,意指分析tcr信号传导输出,这在tcr选择和工程化作业流程中具有关键重要性,在这些流程中信号输出是通常对治疗用途而言最为重要的参数,但功能分析与tcr与相关抗原/hla的亲和力并不充分关联。发明详述本发明解决了上文提到的需求。本发明提供两部分装置,所述装置适用于遗传重构tcrorf和/或使其序列多样化,以及随后将这些orf插入工程化的tcr呈递细胞(etpc)中供功能性分析和/或选择。这种装置适于获得天然和/或序列多样化的链对,所述链对可以在cd3复合体的天然细胞表面背景下被快速地分析和选择。两部分装置的第一部分含有一种两组分载体系统,所述系统包含携带tcr链的可变(v)序列、连接(j)序列和恒定(c)序列的载体的预装配文库。该系统的第一组分包含含有v序列和c序列的v-c入门载体(组分1a)。该系统的第二组分包含含有j序列的j供体载体(组分1b)。两组分载体系统可以预装配成分别具有全部想要的v-c序列组合和j序列的v-c入门载体和j供体载体的文库。该两组分载体系统以如此方式设计,从而具有所需序列的单一v-c入门载体和单一j供体载体可以与第三组分(编码cdr3的短dna寡核苷酸双链体(odecdr3)(组分1c)序列)组合,以在单试管反应中以限制性酶和连接酶依赖性和pcr非依赖性方式在体外重构全长tcrorf。这种三组分tcrorf重构和工程化系统(tores)理想地适合快速生成天然的、序列多样化的或合成的tcrorf的大文库,用于亲和力或功能成熟作业流程。图1第1部分中总结了本发明的第一部分,定义为tores。含有目标全长tcrorf所需要的v和ctcr基因区段的选定v-c入门载体与含有所需jtcr基因区段的j供体载体组合。通过加入odecdr3完成全长tcrorf,其中odecdr3构成在v(d)j重组期间生成的非种系序列,其间插在分别由v-c入门载体和j供体载体编码的固定种系v和j编码序列之间。该两组分载体系统和第三odecdr3组分如此设计,从而当合并在限制性酶和连接酶反应中时,可以重构所需的完整v-cdr3-j-ctcrorf。因此,两部分装置的第一部分用来将tcrorf装配入特定载体背景,从而这些tcr编码载体成为可以用于运行两部分装置的第二部分的整合载体。两部分装置的第二部分,包含工程化的多组分细胞系统,定义为工程化t细胞受体呈递细胞系统(etpcs)。第二部分:图1第2部分中总结了包含至少三种组分的该多组分系统。第一,工程化的tcr呈递细胞(etpc)(组分2a)。第二,含有一对工程化的基因组接受位点(组分2b和2d)。第三,衍生自两部分装置的第一部分tores的编码tcr的遗传整合载体(组分2c和2e),所述载体匹配包含于etpc中的基因组接受位点。匹配的基因组接受位点和整合载体(称作整合对偶)用于遗传物质编码tcr对的快速、稳定整合。etpc还可以进一步包括任选的第四组分,tcr-刺激反应元件(组分2f),用于体外检测和表征tcr信号传导响应。两部分装置因此用来获得在特定整合载体背景下的天然或序列多样化的tcrorf或其文库,和通过将这些整合载体与匹配的etpc组合,获得表达单一tcr对的分析物etpc(etpc-t)或其文库。本发明用于快速、高通量生成稳定的衍生性分析物细胞(etpc-t),所述etpc-t细胞呈递全长tcr对。这种两部分装置充分适用于向分析系统产生以tcr为中心的基于细胞的输入,所述分析系统可以在研究环境和临床免疫诊断方法中直接使用。因此,两部分装置通常用于衍生tcrorf以随后制备一个或多个分析物etpc-t。这些分析物etpc-t随后可以与一个或多个分析物抗原(总体上etpc:抗原系统,etpc:a)组合,以获得一个或多个输出(图24)。分析物抗原由分析物抗原呈递细胞(apc)提供和/或作为可溶性或固定化分析物抗原提供和/或呈递在非基于细胞的粒子(ncbp)上。本发明提供标准化、灵活和可系统化的两部分装置以产生tcrorf(tores)以及在细胞表面上稳定表达tcr对的工程化细胞系(etpcs)。可以由两部分装置中的工程化细胞呈递单一tcrorf对以供详细分析,同样可以呈递tcrorf文库。天然或序列多样化的tcr呈递细胞文库的生成,可以用于分析性或筛选目的,以鉴定或工程化产生新颖的tcr特异性,或鉴定特定tcr对的相关抗原。就重现性增加、生产周期时间减少并且因此产生这类分析物材料的成本减少而言,作为本发明核心的标准化是现有方法学的显著改进。通过允许在受控基因组位置以受控拷贝数可靠整合orf的稳健整合载体/基因组接受位点子系统,实现这种标准化;与先前随机整合和病毒方案相比,显著改善以实现相似的tcr呈递细胞。tores:两部分装置的第一部分两部分装置的第一部分称作tores,其包含两组分载体系统,所述两组分载体系统装配成文库,含有用于重构目标tcrorf的全部所需v、c和j基因区段(图1,第1部分)。例如,可以构建文库以含有编码人tra和trb基因座的天然蛋白序列的全部基因区段,如实施例1中所述。使用tores,使用确定目标tcr、v、j和c基因区段利用情况以及非种系cdr3序列的序列信息,足以重构全长tcrorf。从所述信息,首先可以选择与目标tcrorf的v/c和j利用情况对应的v-c入门载体和j供体载体。还生成odecdr3,其代表第一部分的第三组分,对应于完成全长tcrorf所需要的非种系cdr3序列。这三种组分与iis型限制性酶和dna连接酶在反应中组合以产生目标全长tcrorf和副产物,如图2中所述。所得到的重构全长tcr含于v-c入门载体骨架内部,因此含有在这个亲本构建体内部所含的全部载体特征。在限制性酶/连接酶反应中iis型限制性酶对三种合并的组分(图2、b、c)的作用,产生两种反应副产物和两种反应中间体。v-c入门载体衍生的反应副产物是切下的天然选择标记和iis型结合位点(图2d)。已经从中切除j区段部分的j供体载体骨架代表第二反应副产物(图2e)。从j供体载体切下的j区段部分是反应中间体,并且含有j区段部分、来自c区段的一个小c部分、和连接所要求的单链突出端(图2f)。第二反应中间体是含有v和c区段和连接所要求的单链突出端的亲本v-c入门骨架(图2g)。反应的终产物是在亲本v-c入门载体骨架内部重构的全长tcrorf,由odecdr3(图2c)、切下的j区段部分(图2f)和携带v和c基因区段的v-c入门骨架(图2g)连接而成。第一部分的v-c入门载体组分和j供体载体组分两部分装置的第一部分包括一个或多个v-c入门载体(组分1a),其含有a.复制起点b.第一正向选择标记,c.5’遗传元件或多个元件,d.kozak序列e.tcr可变基因区段,f.第一iis型序列,用于iis型限制性酶进行位点特异性识别和剪切,g.负向选择标记,h.第二iis型序列i.tcr恒定基因区段,和j.3’遗传元件或多个元件,其中,a)和b)用于细菌宿主中增殖和选择亲本v-c入门载体和含有重构tcrorf的载体;c)和j)用来定义整合至两部分装置的第二部分的匹配基因组接受位点(组分2b或2d)中的模式、以及下游应用所需的任何额外特征;d)确保真核细胞中的高效翻译起始;e)是可变(v)基因区段,从起始密码子至cdr3区5’边缘处的基序,所述基序在给定的两组分载体系统中在所有的v区段中是保守的;f)是iis型识别序列,其指导iis型限制性酶以5′方向切割,从而在v基因区段3′末端产生标准化单链突出端;g)是负向选择标记,用于在系统运行期间消除亲本v-c入门载体以便重构全长tcrorf;h)是iis型识别序列,指导iis型限制性酶以3’方向切割,从而在c基因区段5’末端产生标准化单链突出端;i)是自c基因区段5′末端的基序(在所有c区段中均保守)开始的c基因区段、或是缺少c基因区段5’末端的一部分的部分c基因区段,其在给定的两组分载体系统中定义与j区段的边界(参见图2a)。两部分装置的第一部分包含命名为1b的组分,其包含一个或多个含有以下者的j-供体载体,a.复制起点b.第二正向选择标记,c.第三iis型序列,d.tcr的连接区(j)基因区段,e.c部分,对应于恒定基因区段的一个5’小部分,和f.第四iis型序列。其中,a)和b)用于j供体载体的增殖和选择;c)是指导iis型限制性酶以3’方向切割从而在j基因区段5′端产生标准化单链突出端的iis型识别序列;d)是连接区(j)基因区段,所述连接区基因区段从5’基序开始至3’序列,其中所述5’基序界定cdr3区的3’边缘,在给定的两组分载体系统的全部j区段中保守,其中所述3’序列并入c部分,其是双组分系统的v-c入门载体编码的c区段的5’部分;f)是iis型识别序列,其指导iis型限制性酶以5′方向切割,从而在j基因区段的3′端以及c部分的部分序列内部产生标准化单链突出端(参见图2b)。j-供体载体不严格需要携带c部分序列,后者编码c基因区段的5’小部分。此c部分可以用来优化及标准化用于tores运行期间的重构反应的突出端。原因是在j基因区段的3′端发现有较高序列变异,由此c部分的纳入可以通过在多样性更小的c基因区段中产生突出端而允许标准化。针对无3’j区段多样性的其他生物的tcr基因座或使用合成j基因区段来构建tores的情况下,可以省略此c部分,有利于在所述j区段中的突出端的标准化。这将降低j供体文库构建的复杂度。在v-c入门载体和j供体载体中编码的第一、第二、第三和第四iis型序列的每一者可以相同或不同。优选地,它们是相同的。这确保两组分载体系统内部的每个限制性位点相容于同一种iis型酶,并且在使用tores重构全长tcrorf期间仅需要单一酶用于限制性酶/连接酶反应。iis型酶不在它们的识别序列内部切割,并且因此在识别序列外生成单链突出端。因此,依赖iis型限制性酶作用生成的突出端的性质取决于识别序列的取向以及事实上相邻序列两者(参见实施例1)。备选地,每个iis型限制性序列可以彼此不同。但是,随着添加每个独特识别序列,必须在限制性酶/连接酶反应中并入额外的iis型酶。这将增加装配全长tcrorf的重构反应的复杂度和成本。分别在v-c入门载体和j供体载体内部的第一和第二正向选择标记优选不同。这将确保v-c入门载体可以独立于j供体载体被选择(所述v-c入门载体提供最终全长tcrorf产物之骨架),并且由此可以消除否则将造成重构反应背景的、携带未消化或再环化j供体载体的转化体(参见图2)。正向选择标记可以选自a.抗生素耐药基因,b.营养缺陷型互补基因,c.报道基因其中本领域技术人员熟知这类正向选择标记的选择、格式和应用。并入v-c入门载体的5’遗传元件可以包含一个或多个选自以下的元件a.基因顺式/作用元件,b.用于重组酶的异特异性识别位点(heterospecificrecognitionsite),c.针对目的基因组位点的5’同源重组臂d.mrna剪接受体位点,e.内部核糖体进入位点,和f.表观遗传绝缘子序列其中,纳入b)和c)至少之一并且其匹配于作为组分2b和2d包括在两部分装置中的基因组接受位点;a)驱动由v-c入门载体骨架内部重构的全长tcrorf产物编码的转录物表达;b)是这样的序列,所述序列在重组酶存在下指导位点定向重组,以将v-c入门载体骨架内部重构的全长tcrorf产物插入两部分装置的部分2的etpc的特定基因组背景中;c)是这样的序列,所述序列指导位点定向同源重组,以将v-c入门载体骨架内部重构的全长tcrorf产物插入两部分装置的部分2的etpc的基因组背景中;d)允许工程化结构域融合方案,以操纵从v-c入门载体骨架中重构的全长tcrorf表达的蛋白质的形式;e)允许从v-c入门载体骨架中重构的全长tcrorf表达的mrna的非帽依赖性翻译起始;f)允许隔绝转录活性,否则该转录活性将受到在v-c入门载体骨架中重构的全长tcrorf可能插入的基因组背景中的增强子元件的影响。可以纳入顺式/作用元件,以驱动重构入v-c入门载体骨架中的tcr在插入到etpc的基因组接受位点后表达。但是,这将引起tcr链在整合期间在递送生成的整合载体至etpc时瞬时表达。因此,优选在基因组接受位点自身内部纳入顺式/作用元件,从而tcr链仅可以在整合至正确基因组背景中后表达。v-c入门载体骨架可以编码用于重组酶的异特异性识别位点,从而当所述含有重构tcrorf的载体在适宜的重组酶存在下转染入哺乳动物细胞后,允许重构全长tcrorf的重组酶介导的盒交换(rmce),实施例1。在v-c入门载体中包含的第一iis型识别序列定向成在所述识别序列的5’及tcr可变基因区段中造成切割(图2a),以在可变基因区段3′端产生单链dna突出端(图2g),所述的突出端与合成的odecdr3的5′端处的单链dna突出端互补(图2c)。关于如何设计这种第一iis型识别序列的详情,参见实施例1和2。v-c入门载体在第一iis型识别序列和第二iis型识别序列之间含有负向选择标记(见下文,图2a)。此负向选择标记可以选自以下一者或多者a.不包含于第一组分的其它位置或tcr连接区基因区段中的限制性酶识别位点,b.编码杀细菌物质的基因,c.报道分子元件。其中,当使用第一正向选择标记选择在v-c入门载体骨架内部含有目标tcrorf的转化体时,负向选择标记可以用来消除亲本v-c入门载体转化的宿主细胞,并且因此减少重构反应的背景(参见实施例3)。除负向选择标记本身例外,双组分系统中的全部其他序列必须不含所述序列,从而不会出现因在该系统的其它位置包括该序列而造成的过度负向选择。在本发明语境下,v-c入门载体中包含的第二iis型识别序列定向成在所述识别序列的3’及tcr恒定基因区段中造成切割(图2a),以在恒定基因区段5′端产生这样的单链dna突出端(图2g),所述突出端与j供体片段反应中间体的3′端处的单链dna突出端互补(图2f)。关于如何设计这种第二iis型识别序列的详情,参见实施例1和2。并入v-c入门载体的3’遗传元件可以包含一个或多个选自以下的元件a.终止子元件,b.用于重组酶的异特异性识别位点,c.针对目的基因组位点的3’同源重组臂d.mrna剪接供体位点,e.内部核糖体进入位点,和f.表观遗传绝缘子序列。其中,纳入b)和c)至少之一并且其匹配于作为组分2b和2d纳入两部分装置的基因组接受位点;a)是这样的序列,所述序列原位指导tcrorf的转录终止以有效产生mrna,并且可以编码聚腺苷酸信号;b)是这样的序列,所述序列在重组酶存在下指导位点定向重组,以将v-c入门载体骨架内部重构的全长tcrorf产物插入两部分装置的部分2的etpc的特定基因组背景中;c)是这样的序列,所述序列指导位点定向同源重组,以将v-c入门载体骨架内部重构的全长tcrorf产物插入两部分装置的部分2的etpc的特定基因组背景中;d)允许tcrorf在整合入编码下游mrna剪接受体位点的基因组座位中后可以与转录单位融合,从而操纵tcr表达水平强度或从v-c入门载体骨架中重构的全长tcrorf表达的蛋白质的形式;e)允许从v-c入门载体骨架中重构的全长tcrorf表达的mrna的非帽依赖性翻译起始;f)防止相邻染色质区域之间不适宜的相互作用,由此在v-c入门载体骨架中重构的tcrorf可能插入的基因组背景中使全长tcrorf隔绝于相邻的转录调节作用或异染色质扩散。可以纳入终止子元件,以在重构入v-c入门载体骨架中并整合入etpc的基因组接受位点中的tcr的表达期间确保转录终止。如实施例1中所概述的,也可以在基因组接受位点自身内部包括终止子序列。v-c入门载体骨架可以编码重组酶的异特异性识别位点,当所述含有重构tcrorf的载体在适宜重组酶存在下转染入具有匹配的基因组接受位点的etpc时,如实施例3、4和5中所概述的,这将允许重构全长tcrorf的重组酶介导的盒交换(rmce),实施例1。j供体载体含有j基因区段以及在j基因区段3’的c-部分序列,所述序列是c基因区段的5’片段(图2b)。c-部分序列设计成通过iis型酶作用在j供体载体衍生的j片段反应中间体的3′端生成的单链突出端(图2f)以及在iis型消化的开放v-c入门载体反应中间体内部的c基因区段的5′端生成的单链突出端(图2g)标准化。在j供体载体中包含的第三iis型识别序列定向成在所述识别序列的3’及tcr连接区基因区段中造成切割(图2b),以在连接区基因区段5′端产生这样的单链dna突出端(图2g),所述突出端与合成的odecdr3的5′端单链dna突出端互补(图2c)。关于如何设计这种第三iis型识别序列的详情,参见实施例1和2。j供体载体中包含的第四iis型识别序列定向成在所述识别序列的5’及tcrc部分内部造成切割(图2b),以在c部分的3′端产生这样的单链dna突出端(图2f),所述突出端与iis型消化的开放v-c入门载体反应中间体的5’单链dna突出端互补(图2g)。关于如何设计这种第四iis型识别序列的详情,参见实施例1和2。在两部分载体系统之内,全部载体序列均不应当含有用于tores装配反应的iis型限制性酶的额外iis型识别序列。纳入这类序列将在编码的基因区段或部分内部导致iis型限制性酶作用,并且导致破坏tcr重构过程。类似地,iis型识别序列不应当纳入第三系统组分odecdr3中(参见下文)。可以针对任何tcr链集合构建tores的两组分载体系统。在下文实施例1中,针对分别编码人tcrα链和β链的人tra和trb基因座构建两组分载体系统。这种tores的构建同等地适用于分别编码tcrδ和γ链对的trd和trg基因座,或实际上适用于有颚脊椎动物中存在的任何tra/trb、trd/trg或变体tcr链对系统。这种tores系统还可以并入合成的tcr基因片段以允许装配合成的变体tcrofr,以对细胞表达的tcr或重组tcr蛋白进行工程化。两部分系统的第一部分的第三odecdr3组分为了使用任何给定的tores重构全长tcrorf,需要双组分v-c入门载体和j供体载体系统不编码的小orf片段作为第三组分。这种第三组分采取编码cdr3的寡核苷酸双链体形式(odecdr3)(命名为组分1c)。这种第三组分1c,odecdr3,包含a.与如下iis型限制性酶所产生的突出端互补的第一单链突出端序列,其中所述iis型限制性酶与v-c入门载体的tcr可变基因区段中的第一iis型识别位点结合;b.双链区段,其编码tcrcdr3区,并缺少负向选择元件(所述负向选择元件如权利要求10中限定),并且还缺少添加至tores反应混合物的iis型限制性酶的任何iis型限制性序列;c.与如下iis型限制性酶所产生的突出端互补的第二单链突出端序列,其中所述iis型限制性酶与j供体载体的tcr连接区基因区段中的第三iis型识别位点结合。备选地,d.odecdr3可以包含旁侧分布有与第一或第二组分相符的两个iis型酶位点的编码cdr3的dsdna分子,所述位点如此取向,从而当消化时,生成包含前述a、b和c的产物及编码iis型位点的短dsdna片段的两个副产物。这种备选性dsdnaodecdr3相容于限制性酶/连接酶反应,不需要事先消化。使用tores重构全长tcrorf的方法tores,两部分装置的第一部分,可以用来从序列信息重构全长tcrorf在遗传载体背景中,如实施例3中针对人tra/trb链对所展示的。为了运行tores以从序列信息重构全长tcrorf,根据用于给定tcr链的两组分载体系统的来源,该方法可以包括a.选择v-c入门载体,b.选择j供体载体,c.选择odecdr3,d.将a、b和c组合,以i)与iis型限制性酶(一种或多种)反应从而切割存在于v-c入门载体中和j供体载体中的全部iis型限制性酶识别和切割位点,ii)与dna连接酶反应,iii)对合并的混合物进行温度受控的反应,e.将获得自步骤d的反应产物转化入有能力进行dna载体增殖的可选择宿主生物,以及f.对宿主生物进行选择以获得在v-c入门载体骨架中重构的全长tcr可读框。其中,a)和b)的选择基于如下基础进行,即,选择的载体可以编码目标全长tcrorf中的v、j和c基因区段;c)的选择基于如下基础进行,即,提供不由a)和b)中选择的v-c入门载体或j供体载体编码但被所述载体中编码的可变区段和连接区区段环绕的序列来完成全长tcrorf;d)将三个选定的组分,连同将切割v-c入门载体和j供体载体内部第一、第二、第三和第四iis型限制性酶识别序列的限制性酶一起,组合在反应混合物中;e)通常是转化感受态细菌;f)宿主的选择基于v-c入门载体骨架提供的第一正向选择标记进行。通常,选择和确定用于重构的全长tcrorf的遗传元件的工作流程,需要来自目标生物组织的tcr链的从头测序。一个广泛适用的工作流程包括,对来自分选的单细胞的tcr链对的逆转录和基于pcr的扩增,以及后续进行sanger测序。可以应用备选测序方法;通常关键的参数是维持tcrorf配对。另外,要求跨tcrorf的v、cdr3、j和c区段的高质量序列信息,这取决于所采取的具体测序方案。一种选择和重构tcr可读框的方法因此包括a.获得tcr可读框序列,其中所述序列信息足以鉴定i)可变基因区段利用情况、ii)恒定基因区段利用情况、iii)连接区基因区段利用情况、iv)跨可变基因区段边界至连接区基因区段边界的完整cdr3序列,和b.选择与步骤a.i)和a.ii)中分别鉴定的可变基因区段和恒定基因区段相对应的v-c入门载体,和c.选择与步骤a.iii)中鉴定的连接区基因区段相对应的j供体载体,和d.产生与步骤a.iv)中鉴定的cdr3序列相对应的odecdr3,和e.将b、c和d组合,以i)与iis型限制性酶反应从而切割存在于v-c入门载体中和j供体载体中的全部iis型限制性酶识别和切割位点,ii)与dna连接酶反应,iii)使得合并的混合物经历温度受控的反应,和f.将获得自步骤e.的反应产物转化入有能力进行质粒复制的可选择宿主生物中,和g.对宿主生物进行选择以获得在v-c入门载体骨架中重构的全长tcrorf。其中,a)通过本领域技术人员熟知的能够获得足够序列长度和质量以鉴定全部四个所需遗传元件的测序方法实施;b)和c)自含有所要求的载体的tores文库选择;d)从头合成或自odecdr3文库选择;e)在单一反应容器中进行。为了选择适宜的v-c入门载体、j供体载体和odecdr3,将目标tcr序列针对v、c和j基因区段文库,就其相应的tcr链进行比对,以确定目标链的v、c区段和j区段利用情况。此序列比对和分析步骤必须也允许定义cdr3编码序列,并且因此定义odecdr3序列。因此,这种序列分析总体上允许选择v-c入门载体和j供体载体供tcr链重构。该分析还允许合成odecdr3用于每个链重构反应。期望在单一反应中实施iis型消化和dna连接酶依赖的连接(步骤e)。这最大限度减少处理步骤,并且这可以通过如下方式实现:采用在其识别序列外部进行切割的iis型限制性酶设计系统,从而可以用单一酶产生多个独特突出端,由此保证j供体载体反应中间体和odecdr3高效定向克隆入v-c入门载体骨架。备选地,iis型限制消化和dna连接可以按后续方法进行。例举tores常见应用的一个例子:,通过单细胞荧光激活细胞分选(facs)自人组织得到的抗原特异性t细胞,用于逆转录和pcr扩增tra/trbtcr链对,随后进行sanger测序。这是一个广泛适用的工作流程,其中来自任何有颚脊椎动物的任何组织均可以是t细胞源,并且细胞可以基于任何表型特征分选。分选的单细胞不必使用phla-多聚体试剂就抗原特异性进行染色。使用的tcr测序方案不限于任何具体方法或技术,前提是获得足够的高品质序列信息,从而可以基于所述序列信息确定上文限定的tcrorf的遗传特征。通过使用facs划分单细胞从而可以测序并鉴定天然tcr链对,是一种强有力的方法,原因是可以用多特异性抗体组合采集到准确和丰富的表型信息。但是,存在划分细胞的其他方法,包括;乳液pcr;使用微流体细胞囊化的数字pcr方案、使用物理划分底物的微滴式数字pcr。通常期望从源材料获得天然tcr对,因为tcr对的两条链均有助于hla-抗原接合和识别。但是,存在其中可能想要回收仅单链的情况,如针对设定的特异性的单链高通量筛选。在这种情况下,可以从未划分的细胞扩增tcr和/或对其测序。使用tores产生序列多样化的全长tcrorf的方法tores系统理想地适合在几种系统模式下产生多样化的全长tcrorf。这种系统多样化可以适用于tcr链的亲和力成熟和/或功能成熟作业流程。实施例5中充分描述目标tcr链序列的这种多样化。这类tcrorf序列多样化方法遵循与重构反应相同的总体方案。可以在多个平行的重构反应中实施多样化,其中每个反应生成tcrorf的单一变体。但是,在大部分场景下,想要在单一反应中产生变体tcrorf的汇集物。通过向重构反应提供遗传组分(v-c入门载体、j供体载体、odecdr3)之一者或多者的多个变体,可以实现这些方案的每一者。如实施例5中所述,可以通过添加具有限定的位置序列多样性的odecdr3汇集物,在cdr3区系统性多样化tcrorf(图3)。一种选择和重构tcr可读框以在cdr3区实现tcrorf多样性的方法因此包括a.获得tcr可读框序列,其中所述序列信息足以鉴定i)可变基因区段利用情况、ii)恒定基因区段利用情况、iii)连接区基因区段利用情况、iv)跨可变基因区段边界至连接区基因区段边界的完整cdr3序列,和b.选择与步骤a.i)和a.ii)中分别鉴定的可变基因区段和恒定基因区段相对应的v-c入门载体,c.选择与步骤a.iii)中鉴定的连接区基因区段相对应的j供体载体,d.产生两种或更多种与步骤a).iv)中鉴定的cdr3序列相对应的具有变异序列组成的odecdr3,e.将b、c和d组合,以i)与iis型限制性酶反应从而切割存在于v-c入门载体中和j供体载体中的全部iis型限制性酶识别和切割位点,ii)与dna连接酶反应,iii)使得合并的混合物经历温度受控的反应,f.将获得自步骤e.的反应产物转化入有能力进行质粒复制的可选择宿主生物中,g.对宿主生物进行选择以获得在v-c入门载体骨架中重构的全长tcr可读框。其中,a)通过本领域技术人员熟知的能够获得足够序列长度和质量以鉴定全部四个所要求遗传元件的测序方法实施;b)和c)选自含有所要求载体的tores文库;d)从头合成或选自odecdr3文库;e)在单一反应容器中实施。这种方法可以通过将全部odecdr3变体汇集到单一反应中以产生序列多样化的汇集物来实现,但也可以通过向平行反应提供每个odecdr3变体来同等实现。可以借助本领域技术人员熟知的多种方法生成变异odecdr3。odecdr3简并性/多样性的位置和程度的选择,可以从单一位置的单一残基变化至odecdr3长度的完全序列简并。可以通过以下方式使tcrorf系统性多样化:通过提供单一odecdr3维持cdr3区,但通过向重构反应提供两种或更多种v-c入门载体和/或j供体载体,使v、c和j区段利用情况多样化(图4、图5和图6)。一种选择并重构v、c和/或j区段利用情况多样化的tcr可读框的方法因此包括a.获得tcr可读框序列,其中所述序列信息足以鉴定i)可变基因区段利用情况、ii)恒定基因区段利用情况、iii)连接区基因区段利用情况、iv)跨可变基因区段边界至连接区基因区段边界的完整cdr3序列,和b.选择两种或更多种不与步骤a.i)和a.ii)中分别鉴定的可变基因区段和恒定基因区段相对应的v-c入门载体,c.选择两种或更多种不与步骤a.iii)中鉴定的连接区基因区段相对应的j供体载体,d.产生与步骤a.iv)中鉴定的cdr3序列相对应的odecdr3,e.将b、c和d组合,以i)与iis型限制性酶反应从而切割存在于v-c入门载体中和j供体载体中的全部iis型限制性酶识别和切割位点,ii)与dna连接酶反应,iii)使得合并的混合物经历温度受控的反应,f.将获得自步骤e.的反应产物转化到有能力进行质粒复制的可选择宿主生物中,g.对宿主生物进行选择以获得在v-c入门载体骨架中重构的全长tcr可读框。其中,a)通过本领域技术人员熟知的能够获得足够序列长度和质量以鉴定全部四个所要求遗传元件的测序方法实施;b)和c)选自含有所要求载体的tores文库;d)是从头合成的或选自odecdr3文库;e)在单一反应容器中实施。这种方法可以通过将全部v-c入门载体和/或j供体载体变体汇集到单一反应中以产生序列多样化的汇集物来实现,但也可以通过向平行反应提供每个载体变体来同等实现。可以从给定文库选择每个v-c入门载体和j供体载体以提供对v、c和j基因区段的全面覆盖。上述cdr3和v、c和j多样化的任何组合可以用来产生多样化tcrorf的汇集物或文库。这种系统可以用来产生全面覆盖天然v、c和j基因区段利用情况和确定的cdr3特征的全合成tcrorf文库。就重构和多样化方法而言的tores特征如上文提到,期望用单一iis型限制性酶实施装配反应。这可以节省限制性酶使用的成本,并且这可以通过iis型作用的性质以及在两组分载体系统和odecdr3中设计独特单链突出端来实现。备选地,使用多达四个iis型限制性酶识别序列跨越v-c入门载体和j供体载体的四个iis型识别位点。为了高效克隆tcrorf产物,在使用tores装配全长tcrorf期间进行至少一个步骤负向选择,其选自a.进行反应产物的限制性酶消化以消除亲本v-c入门载体b.进行条件杀细菌物质选择以消除亲本v-c入门载体转化的感受态宿主,和/或c.借助报道分子鉴定,对亲本v-c入门载体转化的宿主细胞进行选择。其中,负向选择用来消除保持未被iis型酶消化或消化后已经再连接成亲本形式的亲本v-c入门载体。考虑到v-c入门载体骨架并且因此此骨架中携带的正向选择标记被用于正向选择含有全长tcrorf反应产物的载体,消除亲本v-c入门载体至关重要。在本发明语境下,使用已经设计在自v-c入门载体切除的反应副产物内部的限制性酶位点,进行负向选择(图2d)。实施例3中描述这种负向选择法。任一个上文提到的负向选择方法或其组合可以用来从最终克隆产物消除亲本v-c入门载体。如果认为克隆效率高到足以高效回收克隆的反应产物,则可以省略这种负向选择过程。需要在转化的宿主生物中选择含有克隆的全长tcrorf的载体以获得最终克隆的产物。本领域技术人员熟知这类选择。宿主生物可以是经诱导具有感受态或天然具有转化感受态的细菌,并且对含有在v-c入门载体骨架中的全长tcrorf的转化体的选择可以包括抗生素选择。这需要向其中存在已转化细胞的培养系统添加抗生素,并且这种抗生素的耐药性由作为v-c入门载体骨架中第一正向选择标记的基因编码。备选地,自存在转化体的培养系统中移除营养缺陷因子,也可以是一种形式的正向选择,其中营养缺陷型互补作用由v-c入门载体骨架中编码的基因产物赋予。可以使用上述正向选择的组合。v-c入门载体和j供体载体文库为了高效运行tores以进行选定tcrorf的重构或多样化,需要预构建v-c入门载体和j供体载体文库。从对每种tcr链形式特异的文库进行选择,以在补充odecdr3序列时满足目标tcrorf序列的v/j/c利用情况。可以构建v-c入门载体和j供体载体文库以含有具有这类tcr的生物的全部种系tcrv/j/c基因区段。就如实施例1中展示的trb基因座特异性tores,这种文库也可以在v-c入门载体中包括所有v-c组合,其中针对每个可变区段,两个恒定基因区段在该文库中重复。v-c入门载体和j供体载体文库可以含有v/j/c基因区段,其中相对于种系基因区段编码的蛋白质序列,编码的蛋白质的已翻译氨基酸序列是未修饰的。这种文库允许基础性核酸序列的变化,从而产生否则将缺少不想要的iis型识别序列或正向选择和负向选择元件的文库。基础性核酸序列的变化也可以用于密码子优化,以最佳表达重构的tcr链。备选地,v-c入门载体和j供体载体文库可以含有v/j/c基因区段,其中相对于种系基因区段编码的蛋白质序列,编码的蛋白质的已翻译氨基酸序列是修饰的。这种文库可以用来构建具有针对不同诊断用途或治疗性用途进行优化的特征的tcr。v/j/c基因区段中构架残基或区域的变化可以用来多种场景下(如表达tcr作为可溶性试剂时)增加表达或稳定性。类似地,不涉及hla-抗原直接触的构架区中的变化可以用来改变通过tores产生的重构tcr的信号传导能力。也可以在构架区内部编码亲和标签或免疫原性序列,从而在下游应用中辅助纯化和/或检测重构的tcr。v-c入门载体和j供体载体文库可以装配成包含以下组合的试剂盒a.一个或多个编码可变基因区段和恒定基因区段组合的v-c入门载体,和b.一个或多个编码j基因区段的j供体载体,和任选地c.一个或多个odecdr3、或一个或多个odecdr3汇总文库,其具有单链突出端,所述突出端预先暴露或其旁侧分布有旨在于限制酶切消化/连接反应期间释放该突出端的iis型限制性位点,所述突出端匹配于v-c入门载体和j供体载体的单链突出端,和任选地d.一个或多个标准化具有单链突出端的odecdr3作为阳性对照odecdr3,其中所述突出端预先暴露、或旁侧分布有旨在于限制酶切消化/连接反应期间释放该突出端的iis型限制性位点,所述突出端匹配于v-c入门载体和j供体载体的单链突出端,和任选地e.预装配的全长tcrorf作为参比其中,a)和b)覆盖来自目标生物的基因区段的所要求的遗传多样性,具有对预期应用有意义的未修饰或修饰的氨基酸序列;c)用于以限定的或多样化的cdr3重构tcr链;d)用作重构反应中的阳性对照,e)用作全长tcrorf的下游应用中的阳性对照,其中所述全长tcrorf用所述试剂盒中提供的v-c入门载体和j供体载体文库重构。对第1部分装置输出作为第2部分装置输入的定义在整个两部分装置的运行中,第一部分(tores)用来产生一个或多个在限定的载体背景内部的tcr链。tcr是异二聚复合体,从而tores将通常包括针对tcr链对的每条链的两个平行装配子系统。因此作为两部分装置的第一部分,tores将生成包含两种整合载体的两个输出,所述整合载体各自编码tcr链对的一条链或其文库。tores系统的产物组分2c和组分2e,是存在于组分1a的v-c入门骨架中的整合载体。使用这些来自两部分装置第1部分的输出作为两部分装置的第二部分的直接输入(图1)。这些输入第二部分的来自第一部分的载体输出被命名为组分2c和组分2e。这些输入的每一者分别与etpc(组分2a)内部编码的基因组接受位点组分2b和组分2d配对,以形成两个独立的整合对偶。该对整合对偶独立地彼此分开,从而确保每个整合事件仅为tcr对的每条链递送单一tcrorf,并且因而优选获得呈递单一种类的tcr表面蛋白(tcrsp)的标准化etpc,命名为etpc-t。etpcs:两部分装置的第二部分在图1,第2部分中描述多组分etpc系统(etpcs)。多组分etpcs包括命名为组分2a的第一组分etpc,其含有两个基因组接受位点,组分2b和2d,所述基因组接受位点与从装置的第一部分获得的两个编码tcr的整合载体(组分2c和2e)配对。总体上,借助整合载体(组分2c和2e)向基因组接受位点(组分2b和2d)引入tcr链互补对,使etpc(组分2a)转化成表达tcr表面蛋白(tcrsp)的变异etpc,其命名为etpc-t(图8)。etpc(组分2a)是多组分系统的基础组分,与系统的全部其他组分相关。因此,etpc含有某些天然或工程化的特征,这些特征使etpc同时适用于产生分析物etpc-t群体及其用途。etpc,即,组分2a,i.缺少tcrα、β、δ和γ链的内源性表达,并且ii.表达仅当细胞表达tcr链互补对时才在细胞表面上条件呈递的cd3蛋白知iii.含有命名为组分2b和组分2d的又一修饰,其为基因组接受位点,用于在各位点整合编码一个分析物tcr链(α、β、δ或γ)的单一orf。其中i)可以通过选择缺少所述表达的天然细胞群体来获得,或可以经工程化以缺少这类表达;ii)可以通过选择包含所述表达的天然细胞群体来获得,或可以经工程化以包含这类表达;iii)可以通过使用etpc的基因组所固有的或通过基因工程引入的序列来实现。可以通过本领域熟知的方法实现从天然存在的细胞群体选择缺少tcrα、β、δ和γ链的候选etpc细胞。用针对tcrα、β、δ和γ链特异的亲和试剂着染靶细胞,并且选择缺少tcrα、β、δ和γ链的细胞,可以直接实现这点。可以通过非定向和定向手段实现etpc的工程化以缺少tcrα、β、δ和γ链表达。可以通过向细胞提供化学、放射学或其他诱变剂并且随后选择缺少目标tcrα、β、δ和γ链表达的细胞,实现细胞非定向诱变。可以通过不同手段实现基因组座位的定向突变,所述手段包括但不限于借助以下方式的位点定向诱变i.锌指核酸酶ii.crispr/cas9介导的打靶iii.合成的转录激活物样效应核酸酶(talen)其中所述位点定向核酸酶在靶基因座处诱导增加易错dna修复概率的位点特异性双链dna断口,此后通过选择缺少tcrα、β、δ和γ表达的细胞获得突变的细胞。用于整合cd3和组分2b和/或2d的可选方法是本领域技术人员熟知的,可以包括同源定向重组(hdr)法和/或随机整合法,其中hdr可以通过在有待发生hdr的基因组座位处进行定向突变而促进,并且可以通过不同手段实现,所述手段包括但不限于借助以下方式的位点定向诱变i.锌指核酸酶ii.crispr/cas9介导的打靶iii.合成的转录激活物样效应核酸酶(talen)其中所述位点定向核酸酶通过hdr在靶基因座处诱导位点特异性dna-修复。在这类事件后,一定比例的细胞将已经掺入hdr载体,可以通过以下各项的任何组合来选择和/或确定,iv.非破坏性表型表达分析v.破坏性的表型表达分析vi.遗传分析:其中iv和vi是选择和确定成功基因组整合事件的优选方法。备选地,病毒载体可以用来按位点定向或非定向方式递送所需组分。考虑到etpc组分2a设计成与分析物抗原联合用于分析性作业流程,在优选的方面中,etpc含有如下特征,所述特征可以最大限度减少将在这类分析中起干扰作用的etpc呈递因子。etpc组分2a任选地缺少至少一个分析物抗原呈递复合体(aapx)和/或分析物抗原性分子(aam)家族的内源性表面表达,其中选择缺少该表面表达,以在靶分析物抗原的匹配分析中最大限度减少干扰。aapx家族可以为以下任一者i.hlai类ii.hlaii类iii.非hla抗原呈递复合体。aam选自i.从分析物抗原性分子orf(一个或多个)翻译的多肽或多肽复合体ii.从翻译自分析物抗原性分子orf(一个或多个)的多肽衍生的肽iii.从改变组分a蛋白质组衍生的肽iv.从改变组分a蛋白质组衍生的多肽v.从改变组分a代谢组衍生的代谢物组分2aetpc可以任选地额外包含t细胞共同受体,其中这类特征允许稳健形式或可变形式的分析物etpc与分析物apc通讯,其中该可调谐通讯对鉴定或表征特定分析物tcrsp和/或分析物抗原有意义。在本发明语境下,etpc组分2a可以任选地表达cd4和/或cd8,其中cd4或cd8的表达将etpc分别限于接合hlaii型或hlai型的aapx。etpc组分2a可以任选地表达cd28和/或cd45,其中cd28和cd45可以通过正前馈影响信号传导来有助于信号灵敏度,它们也可以通过负反馈影响信号传导来有助于信号特异性,因为在于它与通过表达的分析物tcrsp的信号传导相关。组分2aetpc可以任选地额外包含引入的细胞表面黏附分子组分、或消除内源细胞表面黏附分子,以促进etpc与分析物apc接合和免疫突触形成,或以避免在涉及apc的分析性作业流程中的紧密结合和有害细胞团簇形成。这类可以作为额外orf引入组分2a或从组分2a遗传消除的黏附分子,可以选自整联蛋白家族的黏附蛋白。etpc可以设计成用来在使用etpc:a系统的分析性作业流程中分析相关分析物抗原的结合,其中通过可检测的分析物抗原试剂的接合或通过以天然或工程化etpc为中心的对相关抗原刺激的应答,来实现所述分析(参见下文)。因此,期望具有标准化的报道分子读出,可以用于读取因刺激表达的tcrsp所致的信号传导响应。因此,etpc组分2a可以还含有命名为2f的组分,合成基因组tcr刺激反应元件,其选自,i.含有至少一个天然启动子和/或至少一个人造启动子和至少一个报道分子的单组分人造构建体ii.经设计具有至少一个天然启动子和/或至少一个人造启动子和至少一个报道分子的多组分合成构建体,其中i和/或ii的激活依赖于至少一个选自合成途径、天然途径或其组合的信号转导途径。与作为etpc之部分的基因组接受位点形成配对的编码tcr的整合载体,命名为组分2c和组分2e。这些组分2c和2e各自编码单一tcr链orf,并且需要其使etpc转化成表达tcrsp的etpc-t。载体,组分2c或2e,分别携带5’和3’遗传元件,所述遗传元件侧置于tcr编码orf的侧翼,设计成分别靶向基因组接受位点2b或2d。这些整合对偶必须合理地彼此隔绝,从而确保仅一个tcrorf插入一个基因组接受位点,这由2b-2c或2d-2e整合对偶关系来确定。如上所述,组分2c和2e衍生自作为装置第一部分的tores。因此,第一部分的特征是载体骨架架构匹配于组分2aetpc的基因组接受位点,组分2b和2d。如上文所述包含于etpc内部的整合对偶对优选地具有这样的特征,所述特征允许重新使用该位点以从一度整合的基因组接受位点移除单一tcr链。在tcrorf和非tcrsp表达构建体之间的这种循环,可以允许交换etpc-t中表达的单一tcrorf,从而产生中间表达tcr的单链,并因此无tcrsp表达。这种中间体命名为etpc-x(参见图7)。这种再循环可以用重组酶实现,从而执行rcme。也可以在使用或不使用位点定向核酸内切酶的情况下,通过使用其他重组酶样酶、使用转座元件和/或使用同源指导的重组,实现基因组接受位点再循环。基因组接受位点,组分2b和2d,可以选自以下i.设计用于重组酶介导的盒交换(rmce)的合成构建体ii.设计用于位点定向同源重组的合成构建体其中i)是用于rmce的优选形式的基因组接受位点。rmce方法可以利用选定的异特异性位点,其中所述种特异性位点分别对不同重组酶特异,从而组分2b和2d各自具有隔绝的特异性。基因组接受位点,组分2b和组分2d,可以包含以下至少一个遗传元件i.异特异性重组酶位点ii.同源臂iii.真核启动子iv.真核条件性调节元件v.真核终止子vi.选择标记vii.剪接受体位点viii.剪接供体位点ix.非蛋白质编码基因x.绝缘子xi.可移动遗传元件xii.大范围核酸酶(meganuclease)识别位点xiii.内部核糖体进入位点(ires)xiv.病毒自我剪切性肽元件xv.kozak共有序列其中,应当包括至少i)或ii)。优选的基因组接受位点可以包含使用选自前述元件列表的以下元件的两种不同排布。借助rmce整合,第一种排布用于接受编码一个tcr链和整合选择标记的单一orf,其中该排布是5’-[a][b][c][d][e][f]-3’其中a)是元件iii)组成型或诱导型真核启动子b)是元件i)异特异性重组酶位点1c)是元件xv)kozak共有序列d)是元件vi)facs和/或macs相容性编码的蛋白质标记e)是元件i)异特异性重组酶位点2f)是元件v)真核终止子。借助rmce整合,第二种排布用于接受编码一个或多个tcr链和/或整合选择标记的两个orf,其中该排布是5’-[a][b][c][d][e][f][g][h][i]-3’其中a)是元件iii)组成型或诱导型真核启动子b)是元件i)异特异性重组酶位点1c)是元件xv)kozak共有序列d)是元件vi)facs和/或macs相容性编码的蛋白质标记1e)是元件v)真核双向转录终止子f)是元件vi)facs和/或macs相容性编码的蛋白质标记2g)是元件xv)kozak共有序列h)是元件i)异特异性重组酶位点2i)是元件iii)组成型或诱导型真核启动子另外,在此第二种排布中,元件f、g和i按反义方向编码。组分2c和2e包含以下至少一个遗传元件i.异特异性重组酶位点ii.同源臂iii.真核启动子iv.真核条件性调节元件v.真核终止子vi.选择标记vii.剪接受体位点viii.剪接供体位点ix.非蛋白质编码基因x.绝缘子xi.可移动遗传元件xii.大范围核酸酶识别位点xiii.内部核糖体进入位点(ires)xiv.病毒自我剪切性肽元件xv.kozak共有序列xvi.整合选择标记xvii.抗生素耐药性盒xviii.细菌复制起点xix.酵母复制起点xx.克隆位点优选的遗传整合载体,组分2c和组分2e,可以包含使用选自前述元件列表的以下元件的两种不同的可能排布。借助rmce整合,第一种排布用于递送编码一个或多个tcr链和/或整合选择标记的单一orf,其中该排布是5’-[a][b][c][d][e]-3’其中a)是元件i)异特异性重组酶位点1b)是元件xv)kozak共有序列c)是元件xx)编码tcr链和/或元件xvi)整合选择标记的单一orf的克隆位点,d)是元件i)异特异性重组酶位点2e)是元件xvii)抗生素耐药性盒和元件xviii)细菌复制起点,无特定取向另外,元件viii和/或xiv可以用来将多条tcr链和/或元件xvi连接在一起。借助rmce整合,第二种排布用于递送编码tcr链之一和/或整合选择标记的一个或多个orf,其中该排布是5’-[a][b][c][d][e][f]-3’其中a)是元件i)异特异性重组酶位点1b)是元件xv)kozak共有序列c)是元件xx)用于引入两个或更多个orf的克隆位点,所述orf带有真核终止子、编码至少一条tcr链和/或元件xvi)整合选择标记d)是元件xv)kozak共有序列(反义方向)e)是元件i)异特异性重组酶位点2f)是元件xvii)抗生素耐药性盒和/或元件xviii)细菌复制起点,无特定取向另外,元件viii和/或xiv可以用来将每个orf内部的多条tcr链和/或元件xvi连接在一起。用于etpc-t转化成etpc-x的优选遗传整合载体(组分2y和组分2z)(参见图7和图10)将包含与上述2c和2e相同的整合载体要求,但不编码任何tcr链orf,并且优选地编码整合标记。使用整合对偶(integrationcouples)编纂etpc-x和etpc-t上述多组分系统可以按照多种方式用来制备不同形式的分析物etpc群体或其文库,它们起到以下作用:在etpc:a系统的分析性或制备性作业流程中呈递分析物tcrsp给分析物抗原。对于运行标准化etpcs而言,可预测拷贝数的一个或多个orf高效整合入基因组接受位点是高度有利的,其中可以快速地制备并表征分析物etpc-t群体。因此,基因组接受位点和配对的整合载体对etpcs的功能至关重要。如上所述,还期望组分2b和组分2d适应于etpc-t制备方法,其中可以快速、可重复引入单一一对互补tcr链,同时正确整合和递送仅一对tcr链的概率高。可以按几种模式实现遗传整合载体与etpc的组合,以产生etpc-x和/或etpc-t(图7)。产生的etpc-t群体需要从用于分析候选物抗原的一些来源导出分析物tcr链。可以用于确定tores反应中所用组分的分析物tcr链序列信息来源可以来自i.来自原代t细胞的tcr链orf序列的配对克隆ii.来自原代t细胞的tcr链orf序列的非配对克隆iii.合成的tcr链orf序列其中i)优选用于发现因胸腺选择而通常不太可能对自我aapx和/或aapx载货有交叉反应性的天然tcrsp;ii)可以用来鉴定候选tcr亲和试剂;iii)可以用于tcr亲和试剂的亲和力成熟或从头产生tcr链。包含两个整合对偶的多组分系统可以用来通过如下方式从组分2a制备etpc-t:提供组分2c和2e,各自与编码互补tcr链对的一条链的一个orf组合,从而两条分析物tcr链整合至基因组接受位点,即组分2b或2d,以产生2b’和2d’。所产生的细胞系表达所提供的tcr对,并且它在细胞表面作为tcrsp呈递。etpc-t可以通过同时整合两条互补tcr链以形成tcrsp来制备(图8)。etpc-t可以借助etpc-x中间体,通过逐步整合两条互补tcr链以形成tcrsp而制备(图9)。可以通过提供编码整合标记或不编码orf的其他整合载体,组分2y或2z,的任一者,从etpc-t制备etpc-x(图10)。组分2y或2z组合到etpc-t将交换任一个位点以获得表达单一tcr链的etpc-x。在上述从etpc制备分析物etpc-x群体和/或etpc-t群体的例子中,多组分系统(etpcs)可以用来按确定的方式提供已知的分析物tcr链,以制备表达已确定tcrsp的分析物etpc的分立群体。此过程可以重复许多次,以建立etpc-x和/或etpc-t的文库作为分析性或制备性作业流程的输入。替代性方案是取得与遗传整合载体组合的分析物tcr链的汇总文库,并且将这些汇总文库以鸟枪方式整合,以获得分析物etpc-t的汇总文库,其中每个etpc-t表达单一种类的tcrsp,但总体上作为汇集物呈递多个tcrsp种类(参见图11至图14)。当针对分析物抗原分析候选物tcrsp的大型文库时,这特别有用。包含两个整合对偶的etpcs可以用来通过如下方式一步从组分2a制备etpc-t汇集物:提供组分2c,与编码单一分析物tcr链的汇集物的多重orf文库组合,从而在每个细胞内部有一对整合至位点2b,以产生2b’。同时,提供组分2e,与多重orf文库组合,所述多重orf文库编码与组分2c中提供的第一文库互补的单一分析物tcr链的汇集物,从而在每个细胞内部有一个分析物互补tcr链整合至位点2d,以产生2d’。etpc-t汇集物中每个所得的细胞具有互补性分析物tcr链的随机化单一选项,从而汇集物中的每个细胞表达随机化的独特tcrsp。这种汇总文库将含有从c’和e’起源的集合所提供的互补tcr链的全部可能组合(图11)。包含两个整合对偶的etpcs可以用来从先前获得的e-tpc-x一步制备etpc-t汇集物,其中位点2b已经转变成2b’并且含有单一分析物tcr链。通过以下方式制备etpc-t:提供组分2e,与多重orf文库组合,所述多重orf文库编码与已经整合的链互补的单一分析物tcr链的汇集物,从而提供的组分2e文库的每条tcr链单一整合至位点2d,以产生2d’。etpc-t汇集物中的每个所得的细胞具有由起始etpc-x提供的分析物tcr链及随机化单一选择的互补性分析物tcr链,从而汇集物中的每个细胞都表达独特tcrsp。当针对互补tcr链对中的固定链分析变动单一链的影响时,使用这种方案(图12)。包含两个整合对偶的etpcs可以用来制备etpc-x汇集物。通过以下方式制备etpc-x:提供组分2c,与多重orf文库组合,所述多重orf文库编码单一分析物tcr链的汇集物,其中省略互补链,从而,提供的组分2c文库的每条tcr链分别在每个细胞内部整合至位点2b,以产生2b’。etpc-x中每个所得的细胞具有随机化单一选择的互补性分析物tcr链,从而汇集物中的每个细胞各表达单一独特tcr链(图13)。如先前例子中那样,当制备etpc-x文库以分析借助第二整合对偶整合的单一或多个互补性tcr链时,使用这种方法(图14)。etpc-x或其文库,可以用于瞬时转染tcr链orf,所述tcr链orf与已经在etpc-x的2b’处整合的tcrorf互补,从而可以在目标测定法中快速筛选tcrsp衍生物。分析物etpc-t与分析物抗原接触本发明涉及提供形配对部分装置的两个多组分系统,所述两部分装置用于衍生分析性etpc-t群体以编纂统称为etpc:抗原(etpc:a)系统的分析装置(图24)。在两部分装置内部,第一部分用来在整合载体背景下衍生tcrorf,后者随后被插入到包含第二部分的匹配的etpc中。因此,两部分装置的运行需要使用每种组分1a、1b和1c中一者或多者衍生一个或多个与含有至少组分2b和2d的组分2a联合使用的组分2c和2e,以编纂一个或多个etpc-t。这些分析物etpc-t随后与一个或多个分析物抗原在分析性etpc:a系统中组合,以获得一个或多个输出。分析物抗原由分析物抗原呈递细胞(apc)提供和/或作为可溶性或固定化亲和试剂提供和/或呈递在不基于细胞的粒子(ncbp)上。分析物抗原是tcr可以在etpc:a系统中推定性连接区的任何实体,斌切可以由以下是;i.aapx(分析物抗原呈递复合体)和/或ii.aam(分析物抗原性分子)和/或iii.aapx:aam(呈递分析物抗原性分子的分析物抗原呈递复合体)和/或iv.cm(非分析物载货分子)和/或v.aapx:cm(呈递载货分子的分析物抗原呈递复合体)其中aapx是能够呈递aam的复合体;aam是由tcr直接或在aapx中加载时识别的任何分子;aapx:aam是加载有aam的aapx;cm是载货分子,所述载货分子可以在aapx中加载,但不是分析物,因此可以衍生自分析物抗原呈递细胞(apc)或分析体系本身;aapx:cm是加载有cm的aapx。这些形式的分析物抗原可以在etpc:a系统内部按不同模式呈递至etpc,所述模式表现为;i.分析物抗原呈递细胞(apc)和/或ii.可溶性或固定化亲和试剂和/或iii.不基于细胞的粒子(ncbp)其中分析物抗原呈递细胞(apc)视为能够向etpc-t呈递抗原的任何apc;亲和试剂视为这样的任何试剂,所述任何试剂作为分析物制备以探测etpc:a系统中etpc-t的细胞表面上的tcrsp结合和/或刺激。这类试剂将经常是分析物抗原性分子(aam)、分析物抗原呈递复合体(aapx)或加载有aam的aapx(aapx:aam)。aapx:aam的常见例子是用来着染tcr的phla-多聚体试剂(例如,‘四聚体’)。在这种情况下,亲和试剂还可能是抗体或相似的实体;不基于细胞的粒子(ncbp)以类似于亲和试剂的方式发挥作用,原因在于该粒子呈递就etpc:a系统内部etpc-t表面的tcrsp连接区而言待评估的分析物抗原或其他实体。但是,ncbp视为还可以携带遗传信息或其他信息的较大实体,所述信息将直接或通过代理充当所呈递的分析物抗原或其他结合实体的标示物。ncbp的常见例子将是噬菌体展示场景下的噬菌体,其中噬菌体可以展示抗体片段抗原结合作用(fab)。可以将阳性标记的etpc-t随一起噬菌体回收,并测序以鉴定对etpc-t表面的tcrsp特异的fab。分析性etpc:a系统包含一个或多个分析物抗原选择项连同一个或多个etpc-t群体(图24)。使用如上文所述的多组分系统(图1至图14),制备分析物etpc-t群体。etpc:a系统以允许分析物抗原和分析物etpc-t群体之间物理接触的形式提供,其中这种触允许复合体在一个或多个分析物抗原和一个或多个分析物etpc-t的tcrsp之间形成,其中分析物抗原为以下任一者vi.aapx(分析物抗原呈递复合体)和/或vii.aam(分析物抗原性分子)和/或viii.aapx:aam(呈递分析物抗原性分子的分析物抗原呈递复合体)和/或ix.cm(非分析物载货分子)和/或x.aapx:cm(呈递载货分子的分析物抗原呈递复合体)其中分析物抗原由分析物apc呈递或由可溶性和/或固定化亲和试剂或ncbp呈递,从而复合体形成可以导致这种复合体稳定化并且其中这种复合体形成导致对etpc-t标记和/或在分析物etpc内部借助组分2f(如果纳入)诱导信号传导和/或在分析物apc中可以测量的可观察信号。在本发明语境下,etpc:a系统包括:i.单一分析物etpc-t的输入;或ii.分析物etpc-t汇总文库的输入和与以下之一组合:iii.单一分析物apc的输入;或iv.单一分析物亲和试剂的输入;或v.单一分析物ncbp的输入;或vi.分析物apc汇总文库的输入;或vii.分析物亲和试剂汇总文库的输入;或viii.分析物ncbp汇总文库的输入在缓冲系统中接触在分析物apc和分析物etpc-t之间的接触在容许性细胞培养或缓冲系统中进行,其中所述系统包含允许分析物apc和分析物etpc-t细胞二者履行功能的介质。在可溶性分析物亲和力、固定化亲和试剂和/或分析物ncbp和分析物etpc-t之间的接触在容许性缓冲系统中进行,其中所述系统包含允许分析物抗原和分析物etpc-t细胞二者履行功能的缓冲介质。用亲和试剂或ncbp标记etpc-t从两部分装置获得的分析物etpc-t可以用于表征etpc-t呈递的tcrsp。这代表征可以按以下方式实施,其中分析物etpc-t与固定化或可溶性亲和试剂或不基于细胞的粒子(ncbp)以这种方式接触,从而标记etpc-t(图15)。标记过程可以视为借助这类方法如流式细胞术、显微术、质谱或化学发光法或备选地借助固定化亲和试剂或ncbp捕获,通过直接观察到标记物来检测。按照相似的方式,亲和试剂或ncbp可以刺激道分子元件,组分2f,如果纳入。对组分2f的刺激将允许选择etpc-t和/或亲和试剂或ncbp供鉴定(图16)。信号响应定义从两部分装置获得的分析物etpc-t用于针对分析物抗原,表征表达分析物tcrsp的分析物etpc-t的信号响应,其中这种信号响应可以是二态或渐变的,并且可以计量为etpc-t固有(图15、图16和图17)或apc固有,若纳入(图18)。可以通过多种方法如流式细胞术、显微术、质谱或化学发光法或本领域技术人员已知的其他方法检测到这类信号。与具有信号响应的apc接触分析物apc也可以与etpc-t在etpc:a系统内部接触。通常,将在etpc-t中依据报告的信号测量响应(图17),但是也可以在apc内部依据报告的信号测(图18)。一般方法-选择etpc-t从源自合并型etpc:a系统的输入分析物etpc-t或分析物etpc-t文库中,选择一个或多个分析物etpc-t,以获得一个或多个分析物etpc-t的方法(其中表达的tcrsp与一个或多个分析物抗原结合)包括i.将一个或多个分析物etpc-t与一个或多个分析物抗原组合,导致分析物tcrsp与分析物抗原之间接触,和至少一个以下操作ii.测量一个或多个分析物tcrsp与一个或多个分析物抗原之间复合物的形成(如果存在的话)和/或iii.测量来自所标记分析物抗原的信号和/或iv.测量受一个或多个分析物tcrsp与一个或多个分析物抗原之间的复合物形成诱导的由etpc-t所作的信号响应(如果存在的话),和/或v.测量受一个或多个分析物tcrsp与一个或多个分析物抗原之间的复合物形成诱导的由apc所作的信号响应(如果存在的话),和vi.基于步骤ii、iii、iv和/或v,选择一个或多个分析物etpc-t,其中依据正量值和/或负量值作出选择其中i、iv和vi或i、v和vi包括优选的排布。一般方法-选择分析物抗原从输入分析物抗原或分析物抗原文库中选择一个或多个分析物抗原,以获得一个或多个分析物抗原的方法(其中表达的分析物抗原与分析物etpc-t呈递的一个或多个分析物tcrsp结合)包括i.将一个或多个分析物抗原与一个或多个分析物etpc-t组合,导致分析物etpc-t呈递的分析物抗原与一个或多个分析物etpc-t的分析物tcrsp之间接触,和ii.测量一个或多个分析物抗原与一个或多个分析物tcrsp之间复合物的形成(如果存在的话)和/或,iii.测量来自所标记分析物抗原的信号和/或iv.测量一个或多个etpc-t中受分析物tcrsp与分析物抗原之间的复合物形成诱导的信号响应(如果存在的话),和/或v.测量受一个或多个分析物tcrsp与一个或多个分析物抗原之间的复合物形成诱导的由apc所作的信号响应(如果存在的话),和vi.从步骤ii、iii、iv和/或v选择一个或多个分析物抗原,其中依据正量值和/或负量值作出选择其中i、iv和vi或i、v和vi包括优选的排布。信号响应的一般方法一种基于报告的信号响应,从合并型etpc:a系统选择分析物etpc-t和/或分析物apc和/或亲和试剂和/或ncbp的方法包括i.确定天然信号传导响应和/或ii.如果etpc-t含有组分2f和/或如果apc含有等同的合成报道分子元件,则确定人造的信号传导响应。通过检测以下一者或多者增加或减少,测量作为apc和/或etpc-t固有的诱导型天然或合成信号响应i.分泌的生物分子ii.分泌的化学物iii.胞内生物分子iv.胞内化学物v.表面表达的生物分子vi.分析物etpc-t对分析物apc的细胞毒作用vii.分析物etpc-t对分析物apc的旁分泌作用,从而在分析物eapc中诱导信号响应并且通过检测i至v的任一者增加或减少来确定该信号响应viii.分析物etpc-t的增殖ix.分析物etpc-t和分析物apc之间的免疫突触其中将所述检出的信号响应与分析物apc和/或分析物etpc-t在装配合并型etpc:a系统和/或平行装配的合并型系统之前固有的非诱导的信号响应状态比较,其中分析物apc和/或分析物etpc-t可以呈递已知在所用合并型etpc-t:a系统内部不诱导信号响应的对照分析物抗原和/或分析物tcr种类和/或可溶性分析物抗原。借助标记和/或信号响应进行选择的方法一种基于所述亲和试剂或ncbp可测量地标记etpc-t,从合并型etpc:a系统选择分析物etpc-t和/或分析物亲和试剂和/或分析物ncbp的方法包括;i.确定etpc-t由亲和试剂或ncbp标记,并且还可以包括ii.确定天然信号传导响应和/或iii.如果etpc-t含有组分2f,则确定人造的信号传导响应。其中通过检测出标记etpc-t而选择etpc-t和/或亲和试剂和/或ncbp可以包括通过在亲和试剂和/或ncbp上包含可检测标记物,检测亲和试剂和/或ncbp对etpc-t的表面标记。这类可检测标记物可以是荧光、发光、分光光度、化学、放射化学或亲和力部分。因此,这种对etpc-t的选择可以基于facs、macs或等同性高通量筛选和选择方法学实施。概述在合并型etpc:a系统内部,测量一个或多个分析物etpc-t中或一个或多个分析物apc中的信号响应,或etpc-t标记情况,前者可以受分析物tcrsp与分析物抗原之间复合物形成所介导,对选择初级系统输出至关重要(图24步骤v),其中初级系统输出是单一细胞或细胞汇集物,和/或单一亲和试剂或亲和试剂汇集物和/或单一ncbp或ncbp汇集物。可以根据接触的分析物apc细胞或分析物etpc细胞的任一者和/或两者中存在或不存在报告的信号响应,或通过亲和试剂或ncbp对etpc-t的可度量标记,选择细胞或试剂。从etpc:a系统获得初级系统输出本发明涉及提供从中衍生分析物etpc-t的两部分装置。这些分析物etpc-t随后通过如前所述的etpc:a系统与一个或多个分析物抗原组合,以获得一个或多个输出。分析物抗原由分析物抗原呈递细胞(apc)提供和/或作为可溶性或固定化分析物抗原提供和/或呈递在不基于细胞的粒子(ncbp)上。该系统包含一个或多个分析物抗原选择项连同一个或多个etpc-t群体(图24)。etpc:a系统以允许分析物抗原和分析物etpc-t群体之间物理接触的形式提供,其中这种触允许复合体在一个或多个分析物抗原和一个或多个分析物etpc-t的tcrsp之间形成,其中分析物抗原为以下任一者i.aapx和/或ii.aam和/或iii.aapx:aam和/或iv.cm和/或v.aapx:cm其中分析物抗原作为分析物apc提供、由其呈递或由可溶性和/或固定化分析物亲和试剂或分析物ncbp呈递,从而复合体形成可以导致这种复合体稳定化并且导致对etpc-t标记和/或在分析物etpc内部(如果纳入)和/或分析物apc中诱导可以报告和测量的信号传导。上文描述了诱导的信号响应报告模式和/或etpc-t标记,并且正是在获得编纂入中etpc:a系统的两部分装置的初级输出中需要测量这些报告的响应和/或标记。来自etpc:a系统的初级输出是选择的细胞群体和/或选择的亲和试剂或选择的ncbp,其中依据以下作出选择;i.亲和试剂或ncbp可测量地标记etpc-t和/或ii.etpc-t中检测到的信号响应和/或iii.在etpc-t中缺少检测到的信号响应和/或iv.分析物apc中检测到的信号响应和/或v.分析物apc中缺少检测到的信号响应;其中初级输出可以表现为单一细胞、或细胞汇集物和/或一个或多个etpc-t缔合的亲和力试剂或ncbp。可以基于发生接触的细胞中的应答从合并型etpc:a系统选择分析物亲和试剂、ncbp或分析物apc和/或分析物etpc-t。即,可以基于发生接触的分析物etpc-t中报告的响应或其缺乏,选择分析物apc。相反,可以,基于发生接触的分析物抗原中报告的响应或其缺乏,选择分析物etpc-t,或在分析物抗原是分析物亲和试剂或ncbp的情况下,分析物亲和试剂或ncbp可以选自etpc-t应答。来自系统的初级apc输出是选择的细胞,其中基于分析物apc或etpc-t中存在或不存在报告的信号响应作出选择,并且这些细胞可以包含一个或多个apc和/或etpc-t,其中选择的细胞可以包括单个细胞、身份相同的细胞的汇集物、身份不同的细胞的汇集物(图24步骤v)。来自系统的初级etpc输出是选择的细胞,其中基于存在或不存在报告的信号响应作出选择,并且这些细胞包含etpc-t,其中选择的细胞可以包括单个细胞、身份相同的细胞的汇集物、身份不同的细胞的汇集物(图24步骤v)。来自系统的初级分析物亲和试剂或ncbp输出是缔合或未缔合亲和试剂或ncbp的选择的细胞,其中基于存在或不存在标记或由分析物etpc-t报告的信号响应作出选择,其中选择的亲和试剂或ncbp可以包括单一亲和试剂或ncbp、身份相同的亲和试剂或ncbp的汇集物、身份不同的亲和试剂或ncbp的汇集物(图24步骤v)。合并型etpc:a系统中分析物apc和/或分析物etpc-t内报告的信号可以用来选择分析物细胞群体或分析物亲和试剂或ncbp以提供初级输出。在其中合并型etpc:a系统属于双元培养物性质的情形下(例如,图15至图18),可以通过从双元系统选择所需的分析物apc群体和/或分析物etpc-t群体,实现apc型和/或etpc-t型初级输出。在其中合并型etpc:a系统属于一个或多个具有分析物抗原的分析物etpc-t的双元组成的情形下(例如,图19至图21),可以通过etpc:a系统内部选择经分析物亲和试剂或ncbp标记或由分析物亲和试剂或ncbp或分析物apc激活的所需分析物etpc-t群体,实现etpc-t初级输出。在其中合并型etpc:a系统属于一个或多个具有分析物亲和试剂或ncbp的分析物etpc-t的双元组成的情形下(例如,图21),可以通过从etpc:a系统选择经分析物亲和力试剂或ncbp标记或具有由前者诱导的信号的所需分析物etpc-t群体,实现分析物亲和试剂或ncbp的初级输出。在其中合并型etpc:a系统属于固定性分析物etpc-t和分析物apc汇总文库的情形下(例如,图22),可以通过基于分析物apc内部检测到响应或缺少响应部而选择分析物apc,实现apc初级输出。从etpc:a系统获得输出的模式存在其中可以获得初级输出的几种不同模式,其中每种模式需要分选步骤。可以通过荧光激活细胞分选法(facs)和/或磁激活的细胞分选(macs)和/或不同的亲和力激活细胞分选方法实现分选。可以通过以下方式获得初级输出apc和/或etpc-t细胞,和/或etpc缔合的亲和试剂或ncbp:单细胞分选以获得单一细胞,和/或将细胞分选到一个池中,以获得细胞汇集物。可以通过以下方式获得初级输出apc和/或etpc-t细胞:单细胞分选以获得单一细胞,并且任选地随后培育单一细胞,以获得所选择apc细胞或etpc-t细胞的单克隆汇集物。可以通过以下方式获得初级输出apc细胞和/或etpc-t细胞:将细胞分选到一个池中,以获得细胞汇集物,并且任选地随后培育细胞汇集物,以获得所选择apc细胞和/或etpc-t细胞的汇集物。从etpc:a系统获得终端系统输出后续于上述的获得初级输出方法,其中初级输出是选择的分析物apc和/或分析物etpc-t,后者基于测量的信号响应或或稳定的复合体形成来选择,从而可以通过进一步处理选择的apc和/或etpc初级输出,获得来自etpc:a系统的终端输出。在本发明语境下,来自多组分系统的终端输出是以下者的身份i.aapx和/或ii.aam和/或iii.aapx:aam和/或iv.cm和/或v.aapx:cm和/或vi.tcrsp由分析物apc或分析物etpc-t或分析物亲和试剂或ncbp呈递,并且通过从合并型etpc:a系统选择它们,作为来自多组分系统的初级输出获得。在etpc:a系统内部,分析物apc和分析物etpc呈递的分析物分子往往是遗传编码的。也可以以下情况:分析物ncbp具有遗传编码的身份,例如在噬菌体展示的ncbp情况下。因此,为了鉴定分析物apc或分析物etpc-t呈递的分析物分子,可以对制备的分析物apc、etpc-t和分析物ncbp进行基因测序。可以加工apc,从而获得分选和/或扩增的apc细胞的基因组或转录组的基因序列以确定以下者的身份i.aapx和/或ii.aam和/或iii.aapx:aamiv.cm和/或v.aapx:cm和/或其中获得的身份是来自etpc:a系统的终端输出。在本发明语境下,可以加工拥有遗传组分的分析物ncbp,从而获得分选和/或扩增的ncbp的基因组或转录组的基因序列,以确定分析物ncbp的身份,其中获得的身份是来自etpc:a系统的终端输出。可以加工etpc-t,从而获得分选和/或扩增的etpc-t细胞的组分2b’和/或组分2d’的基因序列以确定tcrsp的身份,其中tores生成的tcrsp的所获得身份是来自etpc:a系统的终端输出。可以加工etpc,从而获得分选和/或扩增的etpc-t细胞的基因组或转录组的基因序列以确定tcrsp的身份,其中获得的tcrsp的身份是来自etpc:a系统的终端输出。可以通过一系列模式并且从一系列遗传物质源,在进行和不进行特异性加工情况下,实现基因测序。在本发明语境下,可以在测序步骤之前i.提取基因组dna和/或ii.提取组分2b’和/或2d’rna转录物和/或iii.通过pcr扩增编码组分2b’和/或2d’的dnaiv.通过rt-pcr扩增衍生自组分2b’和/或2d’的rna转录物。测序步骤可能对作为初级输出从多组分系统获得的apc或etpc-t或分析物ncbp或其汇集物有破坏性。如果其中测序步骤对初级输出etpc-t有破坏性的情况下,想要从etpc:a系统获得初级输出,则作为两部分装置的终端输出所获得的序列信息可以用来制备与etpc-t等同的etpc-t输出。在遗传编码的分析物分子的上述场景下,可以通过从组分2b’和/或2d’,和/或从细胞基因组和/或转录组获得序列信息,获得etpc:a系统的终端输出。但是,在一些实施方案中,抗原信息将不是遗传编码的。可能无法通过遗传手段合理鉴定翻译后修饰的抗原、通过非遗传手段向合并型etpc:a系统提供的抗原、从分析物apc蛋白质组或代谢物的诱导型状态或修饰型兴起的抗原、为etpc:a系统固有的cm和无遗传元件的亲和试剂或ncbp。在可能通过非遗传手段向etpc:a系统提供aam的重要情况下,存在apc可能将提供的aam作为aapx:aam复合体呈递的两种不同模式。在第一场景下,aam以可以直接与aapx结合并在细胞表面形成aapx:aam复合体的形式提供。这种aam的例子将是hla复合体的肽抗原。在第二场景下,aam以可以按这样的形式,所述形式可以由分析物apc摄取并加工,从而它作为载货加载于aapx中并在细胞表面形成aapx:aam复合体。一种选择并鉴定aam载货或cm载货的方法,其中载货是在作为多组分系统的初级输出而选择并依据其所获得的apc的aapx中装载的代谢物和/或肽,i.分离aapx:aam或aapx:cm或载货am或载货cm和ii.鉴定加载的载货其中鉴定的加载的载货(cm或aam)是两部分装置的终端输出。通常存在两种可以从选择的apc鉴定载货分子的模式。首先,从aapx:aam或aapx:cm强迫释放载货导致分离出可获用于后续鉴定的aam或cm。这种情况的例子是酸洗apc以从hla复合体释放肽aam。其次,捕获aapx:aam或aapx:cm(例如,通过释放复合体和免疫亲和分离方法)导致分离出aapx:aam复合体或aapx:cm复合体,从而可以鉴定aam或cm。用于鉴定直接分离或从分离的aapx:aam或aapx:cm复合体分离的aam和/或cm的方法可以包括i.质谱分析ii.肽测序分析其中所含aam和/或cm的身份是来自两部分装置的终端输出。使用两部分装置如etpc:a系统测定tcrsp对分析物抗原的亲和力后续于上述的获得初级输出方法,其中初级输出是选择的分析物etpc-t细胞,后者基于测量的信号响应来选择,etpc-t初级输出可以接受亲和力分析,以测定tcrsp对相关分析物抗原的亲和力,其中分析物抗原为以下任一者i.aapx和/或ii.aam和/或iii.aapx:aam和/或iv.cm和/或v.aapx:cm并且其中分析物抗原作为可溶性亲和试剂提供或由分析物apc或分析物ncbp呈递,从而根据以下方法测定分析物tcrsp的亲和力i.用一系列浓度的分析物抗原标记选择的分析物etpc-tii.对步骤a的染色的分析物etpc-t实施facs分析iii.在分析物抗原的浓度范围内测定分析物etpc-t的荧光标记的强度iv.计算tcrsp对分析物抗原的亲和力也可以通过前述方法测定分析物tcrsp的亲和力,但其中还可以纳入标记的参比物,从而使用分析物抗原荧光强度对参比物荧光强度的比率,计算亲和力,其中标记的参比物选自i.用针对分析物tcr链之一或针对两条分析物tcr链的亲和试剂标记的分析物etpc-tii.用针对一个或多个cd3蛋白的亲和试剂标记的分析物etpc-tiii.呈递已标记的单一tcr链参比物或标记的成对tcr链参比物的细胞或粒子附图简述图1.两部分装置,包含tcrorf重构和工程化系统(tores)和工程化tcr呈递细胞系统(etpcs)。两部分装置的第一部分代表tcrorf重构和工程化系统(tores,上半小图)。这个系统代表序列固定的基于文库的两组分载体系统,与序列不固定的第三组分组合时,两组分载体系统用来重构并多样化tcrorf。上半小图中说明tcrorf重构系统的总体文库特征的功能。单一v-c入门载体选自v-c组合变动的v-c入门载体文库(组分1a)。这种选择基于已选定tcr链所要求的v-c组合序列。单一j入门载体选自编码的j基因区段变动的j供体载体文库(组分1b)。这种选择基于与v-c入门载体相同的已选定tcr链所要求的j组合序列。最后,选择编码cdr3的低聚双链体(odecdr3)作为目标tcr链的完整全长orf(组分1c)。将这三个组分(1a、1b和1c)连同适宜的限制酶和连接酶一起合并入单一反应。反应循环以单一步骤在v-c入门载体骨架背景下产生重构的tcrorf(反应产物)。这种tcrorf代表两部分装置的第二部分的整合载体组分2c和2e。两部分装置的第二部分代表包含五种或六种组分的工程化tcr呈递细胞系统(etpcs)。第一组分2a是具有该细胞全部所需工程化特征的etpc系本身。etpc2a含有三个其他组分,其中两者是2b和2d,它们是整合分析物tcr链对的基因组接受位点。etpc2a中所含的任选第三组分是当tcr连接时受诱导的人造报道分子构建体2f。两个额外的独立组分2c和2e分别代表将orf定向整合入位点2b和2d的遗传整合载体位点,其中箭头表示成双的特异性。组分2c和2e各自代表来自两部分装置的第一部分的反应产物。图2.对使用tores装配tcrorf的两组分载体系统的遗传输入、副产物、中间体和产物的类属性说明。描述了载体系统的两种组分(a和b)、寡核苷酸双链体(c),当这三种组分合并入具有iis型限制性酶和连接酶的单一反应时,生成两种反应副产物(d和e)、两种反应中间体(f和g)和一种反应产物(h)。将输入载体和双组分系统的产物作为环化质粒示意图描述,所述环化质粒示意图具有作为已标记框描述的遗传元件;代表副产物或中间体的开放质粒载体是非环化质粒示意图,其具有作为已标记框描述的遗传元件;并且将线性dna描述为一系列描述遗传元件的已标记框。a)描述了具有作为已标记框描述的最低要求遗传元件的v-c入门载体的环化质粒示意图。kozak,指在起始高效翻译中发挥作用的共有序列。v-区段,指编码某比例的tcr可变种系orf、或突变/人造orf的选定序列。iis型←,指如此定向,从而这类酶以5′方向切割的iis型限制性酶结合位点。iis型→,指如此定向,从而这类酶以3′方向切割的iis型限制性酶结合位点。-ve选择,指负向选择元件,其旨在全长tcr重建反应或后续选择步骤期间损坏携带该序列的质粒。c-区段,指编码某比例的tcr恒定种系orf、或突变/人造orf的选定序列。+ve选择#1,指tores的第一正向选择标记,其用来向携带载体的生物传输选择优势,并且与第二载体组分(b)的正向选择标记不同。ori,指用于相容性宿主内部增殖质粒的复制起点。5′遗传元件,指任何所需的基因元件,其提供为下游应用重构的全长tcr所需的属性,并且应当位于重构的全长tcr的5’,至少包含这样的序列,所述序列引导向etpcs内部所含基因组接受位点的定向整合。3′遗传元件,指任何所需的基因元件,其提供为下游应用重构的全长tcr所需的属性,并且应当位于全长tcrorf的3’,至少包含这样的序列,所述序列引导向etpcs内部所含基因组接受位点的定向整合。b)描述了具有作为已标记框描述的最低要求遗传特征的j供体载体的环化质粒示意图。j区段部分,指编码某比例的tcr接合种系orf、或突变/人造j基因区段的dna序列。c部分,指tcr恒定基因区段的5’小部分。iis型←,指如此定向,从而这类酶以5′方向切割的iis型限制性酶结合位点。iis型→,指如此定向,从而这类酶以3′方向切割的iis型限制性酶结合位点。+ve选择#2,指tores的第二正向选择标记,其用来向携带载体的生物传输选择优势,并且与第一载体组分(a)的第一正向选择标记不同。ori,指用于相容性宿主内部增殖质粒的复制起点。c)描述的是完善作为编码cdr3区域的寡核苷酸双链体(odecdr3)的目标tcrorf序列的第三组分。这种含有cdr3序列的dna双链体旁侧分布有两个单链dna突出端:突出端≠1-5’和突出端≠1-3’。突出端≠1-5’与开放v-c入门载体中间体(g)中的突出端≠1-3’相容。突出端≠2-3’与供体片段中间体(f)中的突出端≠2-5’相容。d)用iis型限制性酶消化v-c入门载体(a)产生了含有-ve选择元件和iis型←和iis型→元件的线性dnav-c入门载体反应副产物。e)用iis型限制性酶消化j供体载体(b)产生了线性化质粒副产物,其含有亲本质粒的全部遗传元件,不包括切除的j供体片段中间体(f)中携带的那些遗传元件。f)用iis型限制性酶消化j供体载体(b)产生了含有j区段部分和c部分的线性dna片段,其旁侧分布有单链dna突出端:突出端≠2-5’和突出端≠3-3’。突出端≠2-5’是与cdr3dna寡核苷酸双链体(c)中的突出端≠2-3’相容。突出端≠3-3’与开放v-c入门载体中间体(g)中的突出端≠3-5’相容。g)用iis型限制性酶消化v-c入门载体(a)产生了非环化质粒中间体,其含有亲本质粒的全部遗传元件,不包括切除的线性dnav-c入门载体反应副产物(d)中携带的那些遗传元件。消化额外地产生两个单链dna突出端:突出端≠1-3’和突出端≠3-5’。突出端≠1-3’与cdr3dna寡核苷酸双链体(c)中的突出端≠1-5’相容。突出端≠3-5’与j供体片段中间体(f)中突出端≠3-3’相容。h)连接全部三个相容性单链dna突出端产生作为环化质粒(h)的全长tcrorf载体。这种质粒含有亲本v-c入门载体(a)的全部遗传元件,不包括切除的v-c入门载体反应副产物(d)。此外,全长tcrorf载体整合来自cdr3dna寡核苷酸双链体(c)的cdr3序列和来自j供体片段反应中间体(f)的j区段部分和c部分。箭头指示相容性单链dna突出端≠1、≠2和≠3之间连接的近似点。连接点≠1包含分别由v-c入门载体反应中间体(g)和cdr3dna寡核苷酸双链体(c)供应的≠1-3’和≠1-5’元件。连接点≠2包含分别由cdr3dna寡核苷酸双链体(c)和j供体片段反应中间体(f)供应的≠2-3’和≠2-5’元件。连接点≠3包含分别由j供体片段反应中间体(f)和v-c入门载体反应中间体(g)供应的≠3-3’和≠3-5’元件。图3运行tores以产生cdr3多样化的tcr链描述了用来产生cdr3插入物多样化的全长tcr链时tores的示意图。以v-j-c利用情况和定义的cdr3区序列限定亲本tcr。将相应的单一v-c入门载体(框i)和单一j供体载体(框ii)置于反应管中。合成了具有改变已编码氨基酸序列的明确位置核苷酸简并性和/或点诱变的odecdr3汇集物(框iii)。这种cdr3汇集物可以在确定的odecdr3构架的边界内部包含完全随机化的cdr3序列,从而产生含有具有种系v-j-c利用情况的全长tcrorf的‘人造’cdr3。将这三个组分(框i、ii和iii)连同适宜的限制酶和连接酶一起合并入单一反应。反应循环以单一步骤在v-c入门载体骨架背景(框iv)下产生众多重构的变异全长tcrorf,与包含的变异odecdr3的数目成正比。图4运行tores以产生v-区段多样化的tcr链描述了用来产生具有多样化v-区段利用情况的全长tcr链时tores的示意图。以v-j-c利用情况和定义的cdr3区序列限定亲本tcr。将相应的单一j供体载体(框ii)置于反应管中,将所合成以对应于亲本cdr3区序列(框iii)的单一odecdr3同样置于反应管中。还向反应管添加选择的v-c入门载体,其与产物v-区段多样化的全长tcrorf产物中所需的v-区段和c-区段相对应(框i)。将这三个组分(框i、ii和iii)连同适宜的限制酶和连接酶一起合并入单一反应。反应循环以单一步骤在v-c入门载体骨架背景下产生众多重构的变异全长tcrorf,与包含的变异v-c入门载体的数目成正比(框iv)。图5运行tores以产生j-区段多样化的tcr链描述了用来产生具有多样化j-区段利用情况的全长tcr链时tores的示意图。以v-j-c利用情况和定义的cdr3区序列限定亲本tcr。将相应的单一v-c入门载体(框i)置于反应管中,将所合成以对应于亲本cdr3区序列的单一odecdr3(框iii)同样置于反应管中。还向反应管添加选择的j供体,其与产物j区段多样化的全长tcrorf产物中所需的v-区段和c-区段相对应(框ii)。将这三个组分(框i、ii和iii)连同适宜的限制酶和连接酶一起合并入单一反应。反应循环以单一步骤在v-c入门载体骨架背景下产生众多重构的变异全长tcrorf,与包含的变异供体载体的数目成正比(框iv)。图6运行tores以产生v/j-区段多样化的tcr链描述了用来产生具有多样化v-区段和j-区段利用情况的全长tcr链时tores的示意图。以v-j-c利用情况和定义的cdr3区序列限定亲本tcr。合成相应的单一odecdr3以对应于亲本cdr3区序列(框iii)。还向反应管添加v-c入门载体和j供体载体选项,其与产物v/j-区段多样化的全长tcrorf产物中所需的v-(c-)区段和j-区段组合相对应(框ii)。将这三个组分(框i、ii和iii)连同适宜的限制酶和连接酶一起合并入单一反应。反应循环以单一步骤在v-c入门载体骨架背景下产生众多重构的变异全长tcrorf,与从所包含的载体中可能的v-c和j供体载体组合数目成正比(框iv)。图7编纂来自etpc的中间体etpc-x和分析物etpc-t群体。两部分装置的运行需要将tores内部制备的载体插入etpcs以制备分析物etpc群体,以便产生表达分析物tcrsp的细胞或表达单一分析物tcr链的中间体。呈递tcrsp的etpc称作etpc-t,并且可以通过向etpc引入两个编码互补tcr链的orf来产生(步骤i)。仅表达单一分析物tcr链的etpc称作etpc-x,并且可以通过向etpc引入编码单一tcr链的orf来产生(步骤ii)。etpc-t可以备选地从etpc-x产生,其中向现有的etpc-x引入编码第二互补tcr链的orf(步骤iii)。在一些情况下,可以通过移除单一分析物tcr链,从etpc-t产生etpc-x(步骤iv)。图8按一个步骤编纂etpc-t。etpc2a含有不同的基因组接受位点2b和2d。etpc2a可以还含有tcr信号响应元件2f。在tores内部生成的不同遗传整合载体2c和2e分别独立地与2b和2d成双。整合载体2c编码单一tcr链,并且整合载体2e编码第二互补性tcr链。etpc2a与整合载体2c和2e组合。所产生的细胞使得插入物2c交换成2b基因组接受位点,以产生位点2b’并递送第一tcr链的orf。此外,所产生的细胞系使得插入物2e交换成2d基因组接受位点,以产生位点2d’并递送第二tcr链的orf。这种细胞能够在表面呈递tcrsp,并且因此命名为etpc-t。图9借助etpc-x中间体按两个步骤编纂etpc-t。etpc2a含有不同的基因组接受位点2b和2d。etpc2a可以还含有tcr信号响应元件2f。在tores内部生成的不同遗传整合载体2c和2e分别独立地与2b和2d成双。整合载体2c编码单一tcr链,并且整合载体2e编码第二相应tcr链。在步骤1中,etpc2a与整合载体2c组合。所产生的细胞使得2c的tcrorf交换成2b基因组接受位点,以产生位点2b’并递送第一tcr链的orf。这种细胞仅表达单一tcr链并且因此命名为etpc-x。基因组接受位点2d仍未使用。在步骤2中,etpc-x与整合载体2e组合。所产生的细胞使得插入物2e交换成2d基因组接受位点,以产生位点2d’并递送第二互补tcr链的orf。这种细胞能够在表面呈递tcrsp,并且因此命名为etpc-t。图10etpc-t回复突变成etpc-x上半小图中所述的细胞能够在表面呈递tcrsp,并且因此命名为etpc-t。这种etpc-t具有为tcrorf占据的基因组接受位点2b和2d,从而使其处于2b’和2d’形式。携带基因组接受位点标记并且与位点2b’或2d’成双的遗传整合载体,命名为2y和2z。添加2y或2z至etpc-t将使基因组接受位点标记交换为2b’或2d’编码的tcr链。所产生的细胞仅表达单一tcr链,并且因此命名为etpc-x。图11-鸟枪法编纂来自etpc的etpc-t汇集物,以从tcr链文库表达tcrsp的随机组合。etpc2a含有不同的基因组接受位点2b和2d。不同的遗传整合载体2c和2e分别独立地与2b和2d成双。整合载体2ci和2cii各自编码单一tcr链,并且整合载体2ei和2eii各自编码互补的单一tcr链。etpc2a可以还含有tcr信号响应元件2f。etpc2a与整合载体2ci、2cii、2ei和2eii组合。所得到的细胞汇集物使得2ci或2cii的tcrorf在多个独立情形下交换成2b基因组接受位点,以产生位点2b’i和2b’ii,所述位点各自递送tcr链的单一orf。所得到的细胞汇集物进一步使得插入物2ei或2eii交换成多个独立情形下的2d基因组接受位点,以产生位点2d’i和2d’ii,所述位点各自递送与位点2c’i和2c’ii处那些互补的tcr链的单一orf。所得到的etpc-t细胞汇集物包含四个不同细胞群组的混合群体,所述群组各自在表面表达分立的随机化tcrsp,后者包含初始载体文库中所含的各自互补性tcr链之一。这个过程可以放大到不同数目的2c和2e变体,以实现以各种规模呈递随机化tcrsp的细胞文库。图12-用非配对分析物tcr链,鸟枪法编纂来自etpc-x的etpc-t汇集物,以从tcr链文库表达配对tcr链对的随机组合。预编纂的etpc-x含有表达单一tcr链的交换的基因组接受位点2b’和不同的基因组接受位点2d。不同的遗传整合载体2ei和2eii与2d成双。整合载体2ei和2eii各自编码单一tcr链。etpc-x可以还含有tcr信号响应元件2f。etpc-x与整合载体2ei和2eii组合。所得到的细胞汇集物使得插入物2ei或2eii在多个独立情形下交换成2d基因组接受位点,以产生位点2ei和2eii,所述位点各自递送tcr链的单一orf。所得到的etpc-t细胞汇集物包含不同细胞群组的混合群体,所述细胞群组在表面表达分立的tcrsp,后者包含从2b’表达的与初始载体文库中所含的单一随机化互补性tcr链配对的tcr链。图13-鸟枪法编纂来自etpc的etpc-x汇集物,以表达tcr链文库的随机成员。etpc2a含有不同的基因组接受位点2b和2d。不同的遗传整合载体2c和2e分别独立地与2b和2d成双。整合载体2ci、2cii和2cii各自编码单一tcr链。etpc2a可以还含有tcr信号响应元件2f。etpc2a与整合载体2ci、2cii和2ciii组合。所得到的细胞汇集物使得2ci、2cii或2ciii的tcrorf在多个独立情形下交换成2b基因组接受位点,以产生位点2b’i、2b’ii或2b’iii,所述位点各自递送tcr链的单一orf。所得到的etpc-x细胞汇集物包含不同细胞群组的混合群体,所述细胞群组各自表达在初始载体文库中所含的分立的随机化tcr链。这个过程可以放大到不同数目的2c变体,以实现以各种规模呈递随机化tcr链的细胞文库。图14-用非配对分析物tcr链,鸟枪法编纂来自etpc-x汇集物的etpc-t汇集物,以从tcr链文库表达配对tcrsp的随机组合。etpc-x汇集物含有各自表达单一tcr链的交换的基因组接受位点2b’i、2b’ii或2b’iii和不同的基因组接受位点2d。不同的遗传整合载体2e与2d成双。整合载体2e编码单一tcr链。etpc-x可以还含有tcr信号响应元件2f。etpc-x汇集物与整合载体2e组合。所得到的细胞汇集物使得2e的tcrorf在多个独立情形下交换成2d基因组接受位点,以产生位点2d’,所述位点递送tcr链的单一orf。所得到的etpc-t细胞汇集物包含不同细胞群组的混合群体,所述细胞群组在表面表达分立的tcrsp,后者包含从2b’编码的tcr链的组合表达的与2d’中所含tcr链配对的tcr链。这个过程可以放大到不同数目的2e变体,以实现以各种规模呈递随机化tcrsp的细胞文库。图15显示可能的分析物亲和试剂结合型或ncbp结合型etpc-t输出状态的合并型分析物etpc:a系统的运行。分析物etpc-t含有各自以在表面编码相应tcrsp的一个orf整合的位点2b’和2d’。使分析物etpc-t和分析物亲和试剂或ncbp接触时,可以实现不同的etpc-t标记状态;在这个例子中,一个阴性状态和三个阳性状态。阴性状态是输入etpc-t的静息状态,其中无可检测的分析物亲和试剂或ncbp结合,标明分析物亲和试剂或ncbp没有成功地与etpc-t呈递的tcrsp形成稳定复合体。三个阳性状态显示如细胞的深阴影所示的假定范围的分析物亲和试剂或ncbp结合程度。这表示分析物亲和试剂或ncbp分析物分级结合于etpc-t群体表达的tcrsp。图16显示响应于分析物亲和试剂或ncbp的信号报告的可能etpc-t输出状态的合并型分析物etpc:a系统的运行。分析物etpc-t含有各自以在表面编码相应tcrsp的一个orf整合的位点2b’和2d’。etpc-t还含有tcr信号响应元件2f。使分析物etpc-t和分析物亲和试剂或ncbp接触时,可以实现不同的etpc-t响应状态,在这个例子中,一个阴性状态和三个阳性状态。阴性状态是etpc-t的静息状态,其中在2f元件无信号强度,表示分析物亲和试剂或ncbp没有成功地形成复合物及刺激etpc-t呈递的tcrsp。三个阳性状态显示来自2f的信号强度增加。状态2f’+、2f’++和2f’+++分别表示低、中等和高信号强度。作为六角体所指示的基因产物2f积累以报告每个细胞状态的信号强度,如通过细胞的更深阴影所指示。这表示etpc-t群体表达的分析物tcrsp分级响应于导致信号转导至2f元件的分析物亲和试剂或ncbp。图17显示响应于分析物apc的信号报告的可能etpc-t输出状态的合并型分析物etpc:a系统的运行。分析物etpc-t含有各自以在表面编码相应tcrsp的一个orf整合的位点2b’和2d’。etpc-t还含有tcr信号响应元件2f。使分析物etpc-t群体和分析物apc群体接触时,可以实现不同的etpc-t响应状态,在这个例子中,一个阴性状态和三个阳性状态。阴性状态是etpc-t的静息状态,其中在2f元件无信号强度,表示分析物apc呈递的aapx:aam/cm或aam没有成功地刺激etpc-t呈递的tcrsp。三个阳性状态显示来自2f的信号强度增加。状态2f’+、2f’++和2f’+++分别表示低、中等和高信号强度。作为六角体所指示的基因产物2f积累以报告每个细胞状态的信号强度,如通过细胞的更深阴影所指示。这表示etpc-t群体表达的分析物tcrsp分级响应于分析物apc呈递的分析物aapx:aam/cm或aam。图18显示可能的分析物apc输出状态的合并型分析物etpc:a系统的运行。分析物etpc-t含有各自以在表面编码相应tcrsp的一个orf整合的位点2b’和2d’。etpc-t还含有tcr信号响应元件2f。使分析物etpc-t群体和分析物apc群体接触时,可以实现不同的apc响应状态,在这个例子中,一个阴性状态和三个阳性状态。阴性状态是分析物apc的静息状态,表示tcrsp链对没有成功地刺激分析物apc呈递的aapx:aam/cm或aam复合体。三个阳性状态显示来自已接触的aapx:aam/cm或aam的信号强度增加。每个细胞状态的报告的信号强度由*、**、**指示,并且还由细胞的更深阴影指示。这表示分析物aapx:aam/cm或aam分级响应于分析物etpc-t呈递的分析物tcrsp链对。图19运行合并型etpc:a从etpc-t汇集物鉴定与分析物亲和试剂或ncbp结合的tcrsp链对。etpc-t汇集物含有携带位点2b’i、ii或iii和2d’i、ii或iii的细胞,其中每个etpc-t用编码一对互补性tcr链的一对orf整合,并且因此群体中的每个细胞群组在表面表达分立的tcrsp。使分析物亲和试剂或ncbp与分析物etpc-t汇集物接触。在这个例子中,仅表达自2b’i/2d’i的tcr链对(tcrspi)对分析物亲和试剂或ncbp特异,从而,仅携带tcrspi的细胞群组etpc-t(ettpc-t*)能够可检测地结合分析物抗原或ncbp(*)。可以从汇集物中基于亲和试剂标记或ncbp标记选择与分析物亲和试剂或ncbp结合的etpc-t*。随后,选择编码分析物tcrsp的orf,并且可以通过对2b’和2d’dna直接测序或通过2b’和2d’的已表达转录物的逆转录酶pcr进行间接测序,鉴定分离的etpc-t*。图20运行合并型etpc:a系统以借助分析物亲和试剂或ncbp刺激诱导信号报告的响应,自etpc-t汇集物鉴定tcrsp链对。etpc-t汇集物含有携带位点2b’i、ii或iii和2d’i、ii或iii的细胞,其中每个etpc-t细胞用编码一对互补性tcr链的一对orf整合,并且因此群体中的每个细胞群组在表面表达分立的tcrsp。etpc-t还含有tcr信号响应元件2f。使分析物抗原或ncbp与分析物etpc-t汇集物接触。在这个例子中,仅表达自2b’i/2d’i的tcr链对(tcrspi)对分析物亲和试剂或ncbp特异,从而,仅携带tcrspi的etpc-t细胞群组(etpc-t*)能够借助元件2f(*)诱导信号报告的响应。可以从etpc-t汇集物中基于亲和试剂标记或ncbp标记选择与分析物亲和试剂或ncbp结合的etpc-t*。随后,选择编码分析物tcrsp的orf,并且可以通过对2b’和2d’dna直接测序或通过2b’和2d’的已表达转录物的逆转录酶pcr进行间接测序,鉴定分离的etpc-t*。图21运行合并型etpc:a系统以借助分析物apc刺激诱导信号报告的响应,从etpc-t汇集物鉴定tcrsp链对。etpc-t汇集物含有携带位点2b’i、ii或iii和2d’i、ii或iii的细胞,其中每个etpc-t细胞用编码相应tcr链对的一对orf整合,并且因此群体中的每个细胞群组在表面表达分立的tcrsp。etpc-t还含有tcr信号响应元件2f。分析物apc在表面上表达aapx:aam/cm或aam。在本例子中,仅表达自2b’i/2d’i的trc链对(tcrspi)特异于分析物apc呈递的aapx:aam/cm或aam,从而etpc-t汇集物和分析物apc群体接触时,仅携带tcrspi的etpc-t细胞群组(etpc-t*)借助状态2f’报告tcrsp接合情况。可以基于信号报告的响应从汇集物选择分析物apc刺激的etpc-t*。随后,选择编码分析物tcrsp的orf,并且可以通过对2b’和2d’dna直接测序或通过2b’和2d’的已表达转录物的逆转录酶pcr进行间接测序,鉴定分离的etpc-t*。图22运行合并型etpc:a系统以借助诱导apc为中心的信号报告响应,鉴定分析物apc呈递的分析物抗原分析物apc汇集物含有在其表面上表达变化的aapx:aam/cm或aam的细胞。分析物etpc-t含有驱动tcrsp在表面表达的交换的基因组接受位点2b’和2d’。在本例子中,仅复合体aapx:aam/cm或aami特异于分析物etpc-t呈递的tcrsp,从而分析物apc汇集物和分析物etpc-t群体接触时,仅表达aapx:aam/cmi的细胞群组响应(*)。这种响应可以是etpc-t接合过程的固有信号响应,如表面表型、转录物丰度或细胞死亡的变化。可以选择响应的分析物apc以确定已经被分析物etpc-t呈递的分析物tcrsp接触的aapx:aam/cm或aam。图23运行合并型etpc:a系统以通过etpc-t捕获亲和试剂或ncbp试剂,从这类实体的汇集物鉴定亲和试剂或ncbp分析物etpc-t含有驱动tcrsp在表面表达的交换的基因组接受位点2b’和2d’。使亲和试剂或ncbp汇集物与分析物etpc-t接触,这允许结合对分析物etpc-t呈递的tcrsp特异的分析物亲和试剂或ncbp。在本描述中,tcrsp仅特异性结合亲和试剂或ncbpi,并且因此仅用亲和试剂或ncbpi标记分析物etpc-t。可以因此借助与etpc-t结合从汇集物选择亲和试剂或ncbp,以鉴定那些对分析物etpc-t呈递的分析物tcrsp特异的亲和试剂或ncbp。图24运行两部分tores/etpcs装置制备etpc-t,以装配合并型etpc:a系统总体分析系统,其中两部分tores/etpcs装置用来将具有各种分析物抗原或抗原呈递细胞或粒子的分析物工程化tcr呈递细胞(etpc-t)制备成合并型etpc:a系统。正是从合并型etpc:a系统衍生出初级输出,并且正是从这些初级输出衍生出终端输出。总体系统的运行包括两个阶段,制备阶段和分析阶段。在第1阶段的一个方面,将分析物抗原作为分析物亲和试剂提供,制备了apc和/或ncbp。这类分析物抗原表达处于多种形式的抗原:抗原性部分;分析物抗原呈递复合体(aapx);分析物抗原性分子(aam);加载aam载货的aapx(aapx:aam);载货分子(cm);加载cm的aapx(aapx:cm);其中分析物抗原代表针对分析物etpc-t待测试其亲和力或信号诱导作用的那些抗原(步骤i)。在第1阶段的独立方面,使用两部分tores/etpcs装置制备在细胞表面表达分析物tcr链对(tcrsp)的细胞(步骤ii)。在细胞表面呈递tcrsp的etpc称作etpc-t。其中etpc-t向分析物抗原呈递tcrsp以针对分析物抗原测试亲和力或信号诱导作用。etpc-t和分析物抗原的接触因组合的etpc:a系统的装配所致(步骤iii)。总体系统的第2阶段是接触在第1阶段制备的etpc-t和分析物抗原,导致合并型etpc:a系统装配(步骤iii)。接触的分析物亲和试剂、apc和ncbp向分析物etpc-t呈递分析物抗原部分并且基于与呈递的tcrsp形成复合体,潜在地结合etpc-t。在合并型etpc:a系统内部,分析物抗原的输出或分析物etpc-t可以改变其信号状态(用*和更深阴影指示),从而可以鉴定那些发生响应的种类(步骤iv)。基于etpc:a系统内部改变的信号状态,特定的分析物亲和试剂、apc和/或ncbp可以依据它们在etpc-t中诱导响应的能力或etpc-t在它们中诱导响应的能力来选择。响应可以是任何分析物状态的任何可检测变化,包括来自基于细胞的分析物的基于主动信号的报告响应,或一种分析物与另一种分析物的结合。类似地,分析物etpc-t可以依据在接触的分析物抗原中诱导响应的能力或那些分析物在etpc-t中诱导信号响应的能力来选择。基于这种响应性的选择产生合并型etpc:a系统的初级输出(步骤v)。通过从步骤v获得分析物细胞、亲和试剂或ncbp,可以将呈递的分析物aapx、aam、aapx:aam、cm、aapx:cm和/或tcrsp作为装置运行的终端输出鉴定(步骤vi)。图25构建v-c入门载体的v克隆性片段的排布描述了用来如实施例1中所述那样装配用于人tra和trbtcr链的tores的v-c入门载体的v克隆性片段的示意图。v克隆性片段在5’和3’末端旁侧分布有独特的引物结合序列以促进pcr介导的克隆性片段扩增。bbsi位点代表装配v-c入门载体时使用的特异性iis型限制性酶结合位点,其中→代表该识别位点布置成按该位点的3’方向切割,并且←代表位点代表该识别位点布置成按该位点的5’方向切割。bbsi→位点切割所编码的kozak序列的5’以产生突出端*1。bsai←位点发生切割,以在noti5’片段内部产生5’noti突出端。在装配v-c入门载体时,突出端*1和5’noti突出端最终分别与消化的v-c入门载体骨架的突出端*1’和消化的c克隆性片段的3’noti突出端连接。noti5’片段代表noti识别序列的6核苷酸5’片段,其中noti充当运行tores时消除亲本v-c入门载体的负向选择标记。完整的noti识别位点用c克隆性片段提供的3’noti片段重构。v-区段代表由最终v-c入门载体待编码的tcrv基因区段,并且从给定v区段的atg起始密码子至定义cdr3区域边界的v区段最末cys密码子编码。bsai←位点是运行tores系统期间用以重构全长tcrorf的iis型限制性酶识别序列。bsai酶的作用,其中该位点布置成以5′方向切割,导致在v区段的3′端产生突出端≠1,其涵盖每个v区段的最末cys密码子的三个核苷酸和这个cys密码子之前的密码子的第三核苷酸。这种突出端在给定的tores集合中在全部v区段之间均标准化。最终在运行tores系统时,v区段3’处的突出端≠1与odecdr3的5’处的突出端≠1连接,以重构全长tcrorf。全部sp均指添加一个或多个核苷酸,以在iis型识别序列和靶突出端序列之间产生正确间距,或以隔开noti识别位点和切割位点以便有效发挥作用。图26构建v-c入门载体的c克隆性片段的排布描述了用来如实施例1中所述那样装配用于人tra和trbtcr链的tores的v-c入门载体的c克隆性片段的示意图。c克隆性片段在5’和3’末端旁侧分布有独特的引物结合序列以促进pcr介导的克隆性片段扩增。bbsi位点代表装配v-c入门载体时使用的特异性iis型限制性酶结合位点,而→代表该识别位点布置成按该位点的3’方向切割,并且←代表位点代表该识别位点布置成按该位点的5’方向切割。bbsi→位点发生切割,以在noti3’片段内部产生3’noti突出端。bsai←位点切割c区段的终止密码子的3’,以在c区段的3′端产生突出端*2。在装配v-c入门载体时,突出端*2和3’noti突出端最终分别与消化的v-c入门载体骨架的突出端*2’和消化的v克隆性片段的5’noti突出端连接。noti3’片段代表noti识别序列的6核苷酸3’片段,其中noti充当运行tores时消除亲本v-c入门载体的负向选择标记。完整的noti识别位点用v克隆性片段提供的5’noti片段重构。c-区段代表由最终v-c入门载体待编码的tcrc基因区段,并且从c基因区段的第一glu密码子的5’胞嘧啶残基至终止密码子编码。bsai→位点是运行tores系统期间用以重构全长tcrorf的iis型限制性酶识别序列。bsai酶的作用,其中该位点布置成以3′方向切割,导致在c区段的5′端产生突出端≠3。这种突出端在给定的tores集合中全部c区段之间均标准化。最终在运行tores系统时,c区段5’处的突出端≠3与j供体载体的3’c部分处的突出端≠3连接,以重构全长tcrorf。全部sp均指添加一个或多个核苷酸,以在iis型识别序列和靶突出端序列之间产生正确间距,或以隔开noti识别位点和切割位点以便有效发挥作用。图27构建v-c入门载体的v-c入门载体骨架的排布描述了用来如实施例1中所述那样装配用于人tra和trbtcr链的tores的v-c入门载体的v-c入门载体骨架的示意图。环状质粒dna含有复制起点(ori)和正向选择标记#1。这种选择标记用于装配期间分离v-c入门载体骨架的克隆和v-c入门载体时选择转化的宿主,并且还用于tores运行期间选择含有全长tcrorf的载体。5’和3’遗传元件编码目标元件,其中所述目标元件置于通过tores运行产生全长tcrorf后的最终tcrorf侧部。5’遗传元件可能代表驱动tcr转录物表达的哺乳动物启动子元件,并且3’遗传元件可能代表转录终止子序列。acc65i位点代表一个限制性酶识别序列,其中acc65i酶的作用导致突出端*1’产生。在装配v-c入门载体期间,这个突出端*1’与消化的v克隆性片段中的突出端*1连接。xbai位点代表一个限制性酶识别序列,其中xbai酶的作用导致突出端*2’产生。在装配v-c入门载体期间,这个突出端*2’与消化的c克隆性片段中的突出端*2连接。sp指添加核苷酸以隔开acc65i识别位点和xbai识别位点,以便两种酶高效发挥作用。图28j接受盒片段的排布描述了在如实施例1中所述那样装配用于人tra和trbtcr链的tores的j供体载体时使用的j接受盒片段的示意图。j接受盒片段插入j供体骨架中,以产生j接受盒载体。通过以下方式产生j接受盒片段:使两个互补性寡核苷酸复性以产生在5’和3’末端具有4核苷酸单链突出端的线性双链dna构建体,所述突出端用于将片段插入j供体载体骨架。在j接受盒片段5′端的突出端*3与消化的j供体载体骨架的突出端*3’连接,而在3′端的突出端*4与消化的j供体载体骨架的突出端*4’连接。bsai位点代表在运行tores期间用以装配全长tcrorf的iis型限制性识别位点。bsai←位点布置成以5′方向切割,并且作用于c部分序列,以在3’c部分产生突出端≠3。bsai→位点最终作用于j供体载体的j区段部分,以在j区段部分的5’端产生突出端≠2。bsai→元件还含有突出端*5,其中通过装配j供体载体期间bbsi作用于bbsi←位点,产生所述突出端。bbsi位点代表用以装配j供体载体的iis型限制性识别位点。bbsi←位点切割bsai→元件以产生突出端*5,而bbsi→位点切割c部分的5′端以产生突出端*6。突出端*5和突出端*6最终分别与j区段部分的突出端*5’和突出端*6’连接。c部分代表目标c基因区段的小部分,所述的小部分允许运行tores期间标准化产生无回文突出端。最终在j区段部分的3′端携带这种c部分,并且形成序列的部分,其中在运行tores时,所述的部分与消化的v-c入门载体携带的c区段连接以产生全长tcrorf。noti位点代表在产生j供体载体期间用来消除亲本j接受盒载体的负向选择标记。全部sp均指添加一个或多个核苷酸,以在iis型识别序列和靶突出端序列之间产生正确间距,或以隔开noti识别位点和切割位点以便有效发挥作用。图29j供体骨架的排布描述了在如实施例1中所述那样装配用于人tra和trbtcr链的tores的j供体载体时使用的j供体载体骨架的示意图。j接受盒片段插入j供体骨架中,以产生j接受盒载体。环状质粒dna含有复制起点(ori)和正向选择标记#2。这种选择标记用于装配期间分离j供体载体骨架的克隆和j供体载体时选择转化的宿主。重要地,这种正向选择标记区别于v-c入门载体内部的正向选择标记#1,从而亲本j供体载体运行tores期间,在依据#1的正向选择下消除,以产生v-c入门载体骨架背景下的全长tcrorf。ecori位点代表一个限制性酶识别序列,其中ecori酶的作用导致突出端*3’产生。在装配j接受盒载体期间,这个突出端*3’与复性的j接受盒片段中的突出端*3连接。xbai位点代表一个限制性酶识别序列,其中xbai酶的作用导致突出端*4’产生。在装配j接受盒载体期间,这个突出端*4’与复性的j接受盒片段中的突出端*4连接。sp指添加核苷酸以隔开acc65i识别位点和xbai识别位点,以便两种酶高效发挥作用。图30j接受盒载体的排布描述了在如实施例1中所述那样装配用于人tra和trbtcr链的tores的j供体载体时使用的j供体载体骨架的示意图。通过将j接受盒片段插入j供体骨架中,产生j接受盒载体。环状质粒dna含有复制起点(ori)和正向选择标记#2。这种选择标记用于装配期间分离j供体载体骨架的克隆和j供体载体时选择转化的宿主。重要地,这种正向选择标记区别于v-c入门载体内部的正向选择标记#1,从而亲本j供体载体运行tores期间,在依据#1的正向选择下消除,以产生v-c入门载体骨架背景下的全长tcrorf。bsai位点代表在运行tores期间用以装配全长tcrorf的iis型限制性识别位点。bsai←位点布置成以5′方向切割,并且作用于c部分序列,以在3’c部分产生突出端≠3。bsai→位点最终作用于j供体载体的j区段部分,以在j区段部分的5’端产生突出端≠2。bsai→元件还含有突出端*5,其中通过装配j供体载体期间bbsi作用于bbsi←位点,产生所述突出端。bbsi位点代表用以装配j供体载体的iis型限制性识别位点。bbsi←位点切割bsai→元件以产生突出端*5,而bbsi→位点切割c部分的5′端以产生突出端*6。突出端*5和突出端*6最终分别与j区段部分的突出端*5’和突出端*6’连接。c部分代表目标c基因区段的小部分,所述的小部分允许运行tores期间标准化产生无回文突出端。最终在j区段部分的3′端携带这种c部分,并且形成序列的部分,其中在运行tores时,所述的部分与消化的v-c入门载体携带的c区段连接以产生全长tcrorf。noti位点代表在产生j供体载体期间用来消除亲本j接受盒载体的负向选择标记。全部sp均指添加一个或多个核苷酸,以在iis型识别序列和靶突出端序列之间产生正确间距,或以隔开noti识别位点和切割位点以便有效发挥作用。图31j区段部分的排布描述了在如实施例1中所述那样装配用于人tra和trbtcr链的tores的j供体载体时使用的j区段部分的示意图。将j区段部分插入j接受盒载体以产生j供体载体。使互补性单链寡核苷酸复性以形成在任意末端带单链突出端的线性双链dna构建体,这产生j区段部分。在5′末端的突出端*5’与bbsi消化的j接受盒载体内部生成的突出端*5复性。在3′末端的突出端*6’与bbsi消化的j接受盒载体内部生成的突出端*6复性。j区段部分代表目标j基因区段序列。取决于构建的j供体载体的形式(即短或长),差异地确定j区段部分的5’边界。对于短j供体载体,j区段部分的5’边界定义为用来限定全长tcrorf的j部分和cdr3部分之间典型边界的phe-ala/gly基序或trp-gly基序。对于长j供体载体,j区段部分的5’边界延长到phe-ala/gly基序或trp-gly基序5’的十个至十二个核苷酸。这延长了由j供体载体编码的总体tcrorf的部分,并且反过来缩短运行tores时为构建全长tcrorf所要求的odecdr3的长度。在j区段部分的3′端编码一个单一腺嘌呤残基(a),其代表c片段的第一核苷酸。这个腺嘌呤从j接受盒载体排除。图32通过整合至etpc验证重构的torestra载体和trb载体tores系统用来产生一个对hla-a*02:01中呈递的hcmv抗原具有已知特异性的模型tcrα/β对(jg9-tcr)。tores在组分2c或2e背景下产生每条链(参见实施例3)。通过将组分2c和2e质粒和编码flp重组酶的构建体转染入etpc细胞系acl-488,借助rmce产生etpc-t,所述细胞系携带两个基因组整合位点2b和2d,分别编码报道分子bfp和rfp。在转染后10天,分选由组分2b和2d选择标记编码的bfp信号和rfp信号削弱的独立细胞作为单一细胞。将所得的单克隆etpc-tacl-851与亲本etpc平行分析,并且展示单一例子。a)和b)将亲本etpc细胞系acl-488和示例单克隆通过流式细胞术分析bfp信号和rfp信号。图中将活的单一细胞展示作为bfp对rfp,显示etpc细胞系对组分2b和2d中存在的选择标记为阳性(a),并且所得的单克隆已经如对2b/2c和2d/2e之间整合对偶事件所预期那样,丧失这些标记(b)。百分数值代表a)中双阳性细胞的百分数和b)中双阴性细胞的百分数。c)至f)将etpcacl-488和单克隆etpc-tacl-851用针对cd3和tcrα/β(tcrab)的抗体和对jg9-tcr(dexhla-a*02:01-nlvp)特异的hla多聚体试剂染色并且通过流式细胞术分析并且对活的单一细胞设门。亲本etpc系未显示细胞表面上cd3或tcr的阳性染色(c)并且对hla多聚体试剂染色也为阴性(d)。相反,所产生的单克隆对细胞表面上cd3和tcr均显示阳性染色(e)并且显示对表达的jg9-tcr特异的多聚体试剂染色为阳性。百分数值代表c)和e)中cd3/tcrab双阳性细胞的百分数,以及d)和f)中cd3/hla-多聚体双阳性细胞的百分数。g)将基因组dna从单克隆etpc-tacl-851制备并接受采用以下引物的pcr,所述引物对组分2d’编码的jg9-tcr-α链或组分2b’编码的jg9-tcr-β链特异。通过琼脂糖凝胶解析pcr产物并且观察为预期条带大小。h)将基因组dna从单克隆etpc-tacl-851制备并接受采用以下引物和探针的滴式数字pcr,所述引物和探针对组分2d’编码的jg9-tcr-α链或组分2b’编码的jg9-tcr-β链特异。纳入用于tcrα恒定(trac)的内含子的参比扩增子引物/探针对。该表展示参比物对tcrα和tcrβ的比率。接近于0.33的比率表示作为三倍体细胞系的etpc-t细胞系acl-851中存在每个tcrα链和β链的单拷贝。图33:从etpc-t逆转etpc-x的展示。通过将组分d’与编码gfp的供体载体(组分z)交换,将位点d’和b’处表达tcrα链和β链的亲本etpc-t细胞系acl-851分别逆转成etpc-x系。组分z含有侧置于gfporf的重组酶异特异性f14/f15位点,并且因此与组分d’相容。将etpc-t细胞系acl-851用组分z连同编码flp重组酶的构建体转染。转染后7天,分选gfp信号阳性的独立细胞并培育为单克隆。将所得的单克隆etpc-x细胞系通过流式细胞术与亲本etpc-t平行分析,并且展示单一例子。a)和b)将衍生自亲本etpc-tacl-851的单克隆etpc-x(acl-987)连同亲本系一起通过流式细胞术分析gfp表达。图中展示设门的活单一细胞的ssc对gfp参数。亲本细胞系没有gfp表达(a),而单克隆acl-987如预期那样已经获得gfp(b),这表明tcrαorf交换成gpforf。c)和d)将衍生自亲本acl-851的单克隆etpc-xacl-987连同亲本etpc-tacl-851一起用针对cd3和tcrab的抗体染色并通过流式细胞术分析。图中展示对活的单一细胞设门的cd3对tcrab参数。亲本细胞显示cd3和tcrab均阳性染色(c),而衍生的单克隆显示二者均阴性染色(d);证实在衍生的etpc-x系中tcrαorf丢失。图34:鸟枪法整合入etpc-x以产生etpc-t汇集物的展示etpc-t汇集物从etpc-x亲本系产生,所述亲本系在组分b’中表达单一tcrβ链。etpc-x系将gfp在可用位点2d表达为报道分子。用tores系统构建了64条变异tcrα链(包括亲本链)的汇集物,以代表组分2e汇集物(参见实施例5)。亲本tcr链对代表对hla-a*02:01中呈递的hcmv抗原的特异性已知的jg9-tcr。将组分2e汇集物连同编码flp重组酶的构建体转染入亲本etpc-xacl-987。转染后10天,通过分选gfp阳性细胞,选择多克隆系。随后基于gfp阴性染色和hla多聚体试剂(dexhla-a*02:01-nlvp)阳性染色或阴性染色,分选所产生的acl-988多克隆etpc-t。对回收的单一细胞测序以鉴定编码的tcr-α链并且就亲本tcr链对特异性hla多聚体试剂染色而言,与配对于天然tcr-β链的每个tcr-α链变体的平行分析结果比较。a)和b)将亲本etpc-xacl-987系和所得的多克隆etpc-tacl-988系通过流式细胞术分析gfp表达。图中展示活的单一细胞的ssc对gfp参数。亲本细胞系显示gfp阳性信号,表明组分2d完整(a)。衍生的多克隆系显示一半阳性和一半阴性gfp(b),这表明多克隆群体中的半数细胞已经可能将2d处的gfporf交换成tcrαorf以形成组分2d’。c)和d)将亲本etpc-xacl-987系和所得的多克隆etpc-tacl-988系用针对亲本jg9-tcr(dexhla-a*02:01-nlvp)具有特异性的cd3抗体和hla多聚体,并通过流式细胞术分析。图中展示活的单一细胞的cd3对hla多聚体参数。亲本细胞系对cd3和hla多聚体染色均为阴性(c)。左侧小图d)显示设门的gfp阴性事件,并且右侧小图显示设门的gfp阳性事件。若组分2d转化成2d’,仅gfp阴性事件显示cd3阳性染色,其子集显示对hla多聚体阳性染色。从设门的hla多聚体阴性门和阳性门分选单一细胞并且对组分2d’处整合的orf测序以确定tcrαorf的身份。e)将全部64个jg9-tcr-α变体克隆入允许将每种变体独立转染至亲本etpc-x(acl-987)的表达构建体。对每种变体测定hla-a*02:01-nlvp四聚体试剂的相对染色单位(rsu)。rsu计算为cd3阳性群体对cd3阴性群体的hla-a*02:01-nlvp四聚体信号的平均荧光强度(mfi)比率,并且表示每种tcr链对变体针对hla多聚体试剂的结合强度。图e)中作图的每个点代表对64个变体中每个变体观察到的rsu。空心圆圈与回收自gfp阴性/hla多聚体阳性门的已测序细胞相关。空心三角形与回收自gfp阴性/hla多聚体阴性门的已测序细胞相关。图35:组分2f的功能性展示etpc-t细胞系携带组分2f(acl-1277),其中组分2b’和2d’处的tcr链编码对hla-a*02:01中呈递的hmcv抗原性肽nlvpmvatv特异的tcr对。组分2f报道分子是rfp。使这种etpc-t与具有不同hla特征的多种apc细胞系在模式肽抗原存在和不存在下接触24小时,并且通过流式细胞术分析接触培养物。流式细胞术柱状图显示活的单一t细胞的rfp信号的事件计数,其中通过针对apc未呈递的特异性表面标记的抗体染色鉴定所述细胞。a)和b)将仅表达hla-a*02:01(acl-209)的apc细胞用nlvpmvatv(a)肽或vyalplkml(b)肽脉冲并随后与etpc-t共培养24小时。c)和d)将仅表达hla-a*24:02(acl-963)的apc细胞用nlvpmvatv(c)肽或vyalplkml(d)肽脉冲并随后与etpc-t共培养24小时。e)仅表达hla-a*02:01的apc细胞(acl-209)不接受肽脉冲并随后与etpc-t共培养24小时。f)将细胞表面上不表达hla的apc细胞(acl-128)用nlvpmvatv脉冲并随后与etpc-t共培养24小时。仅在用nlvpmvatv(其代表已表达tcr的已知靶)脉冲的表达hla-a*02:01的细胞存在下,etpc-tacl-1277中rfp信号才显著增加。柱状图门和值反映在rfp阳性门和rfp阴性门中事件的百分数。这表示组分2f特异性响应于etpc-t表达的tcrsp与相关hla/抗原(aapx:aam)的接合。材料和方法dna测序呈献的实施例中所提到的全部测序均通过sanger方法实施,并由瑞典gatcbiotecab实施。dna合成呈献的实施例中所提到的全部dna合成均由比利时dnatechnologiesbvba实施。将>125bp的dna片段合成为线性双链dna分子,如‘gblock基因片段’产物。将15-60nt的dna片段合成为单链dna分子,如‘定制寡核苷酸片段’产物。将61-124nt的dna片段合成为单链dna分子,如‘ultramerdna寡核苷酸片段’产物。载体文库装配和克隆实施例中描述的载体构建包括本领域技术人员熟知的多种方法,并且实施例1至3中详细描述具体的反应组成。以下关键材料用于所描述的方法中:表1:载体文库装配和克隆试剂装配编码cdr3的寡核苷酸双链体(odecdr3)通过使部分互补的单链寡核苷酸复性,常规地装配odecdr3。实施例2中提供反应组成和条件的详细描述。以下关键材料用于所描述的方法中:表2:寡核苷酸双链体装配试剂产物供应商供应商编号t4连接酶缓冲液10xnewenglandbiolabsb0202st4pnknewenglandbiolabsm0201ltcr重构实施例3中提供反应组成和条件的详细描述。以下关键材料用于所描述的方法中:表3:tcr重构试剂细胞转染本申请中所用的全部细胞均衍生自hek293细胞。在转染之前一天,将细胞以1.2-1.4x106个细胞/60mm培养皿的密度接种在90%dmem+2mml-谷氨酰胺+10%hi-fbs(lifetechnologies)中。次日,将具有65%汇合度的细胞用总量5ugdna和(polyplus转染试剂,lifetechnologies)按n/p比率6转染。将dna和的母液分别稀释于无菌1mnacl和150mmnacl中。每种溶液的终体积等于总混合物体积的50%。随后添加pei溶液至稀释的dna并将混合物在室温温育15分钟。最后,将dna/pei混合物添加至60-mm培养皿,小心切勿破坏细胞膜。在dna递送标记表达分析之前,将细胞在(37℃,5%co2,95%相对湿度)温育48小时。在转染前更换培养基。配对的整合对偶之间的rmce对于rmce整合,将细胞用0.6μg编码flp的dna载体(v4.i.8)、2μg组分2c/2y、2μg组分2e/2z、0.4μg编码旨在追踪dna递送的标记的dna转染。转染后2天,通过facs分选dna递送标记阳性(gfp阳性或rfp阳性)的细胞。转染后4-10天,通过facs分选出展示由组分2d和2b选择标记编码的荧光蛋白信号削弱的独立细胞。对于产生acl-987是例外的,其中通过facs分选出展示gfp阳性的独立细胞。瞬时表达tcr链对以表征它们的rsu为了瞬时表达,将细胞用编码flp(v4.i.8)、jg9-tcr-α变体(vp.7751.rc1.a1至vp.7751.rc1.h8)、jg9-tcr-βwt链(v3.c.5)的dna载体和dna载体溶媒(v1.c.2)转染。转染后2天,全部细胞均用hla-a*02:01-nlvp四聚体和抗cd3抗体染色。rsu计算为cd3阳性群体对cd3阴性群体的hla-a*02:01-nlvp四聚体信号的平均荧光强度(mfi)比率,并且表示每种tcr链对变体的结合强度。荧光激活的细胞分选法(facs)使用bdinflux仪,通过标准细胞分选方法学实现单细胞分选或多克隆分选。简而言之,将acl细胞用trypletmexpresstrypsin(thermofisherscientific)收获并且在含有20%hi-fbs和抗-抗100x的dmem1x培养基(lifetechnologies)中重悬于合适体积的dpbs1x(lifetechnologies)中,之后进行细胞分选。将细胞用hla-多聚体试剂在冰上染色10分钟,随后其用cd3和/或tcrab抗体染色。表4中定义了通过bdinflux仪检测特异性细胞荧光特性。分选单一细胞以产生单克隆,将展示目的表型的细胞沉积至含有200ul生长培养基的96孔板中。每份样品分选一至两块平板。使用细胞分选仪influxtm(bdbiosciences)中的双路分选设定,将多克隆细胞分选物导入含有培养基的facs管中。将用于分子表征其jg9-tcr-α变体的单细胞分选物分选至事先载有5μl无核酸酶的水的pcr平板中。将标本急冻直至后续加工。表4表5提取基因组dna用于遗传表征使用qiaampdnaminikit(qiagen),从5x106个细胞提取dna。dna储存在1xte(10mmtrisph8.0和0.1mmedta)中。评估tra-orf和trb-orf向组分2b或2d中rmce整合的pcr反应。用来评估tra-orf整合的引物与作为基因组接受位点预先存在部分的tra-c区段复性(正向引物1.f.7)和与sv40pa终止子复性(反向引物15.h.2)。预期大小566bp用来评估trb-orf整合的引物与作为基因组接受位点预先存在部分的trb-c区段复性(正向引物1.f.9)和与sv40pa终止子复性(反向引物15.h.2)。预期大小610bp。表6-评估tra-orf或trb-orf整合的pcr试剂表7-pcr循环条件使用powerpacbasic(bio-rad),将pcr产物在1%琼脂糖凝胶上1xtae缓冲剂中走胶,用10,000稀释度的sybersafe染色并用fusionsl(vilberlourmat)分析。评估dna递送后基因组中tra-orf和trb-orf的拷贝数的ddpcr反应通过使用靶向目的tcr_orfc区段的特异性引物和探针,分析所选择acl-851单克隆的dna。用来评估tra-orf拷贝数的引物和探针,复性至tra-c区段(正向引物1.f.7、反向引物1.f.8和探针1.g.1)。用来评估trb-orf拷贝数的引物和探针,复性至trb-c区段(正向引物1.f.9、反向引物1.f.10和探针1.g.2)。在全部情况下,使用引物10.a.9和10.a.10连同与hex缀合的荧光探针10.b.6,同时筛选参比基因(trac)以确定染色体拷贝数。认定hek293细胞对参比基因为三倍体(trac)的整合拷贝数。在滴式数字pcr之前,用mfei(neb)消化dna以分离串联整合。使用qx200tm滴式读数仪和滴式发生器及c1000touchtm深孔热循环仪(bio-rad),根据探针用ddpcrtm超级混合物(无dutp)(bio-rad)的方案,遵循反应设置和循环条件。表8使用检测fam的ch1和针对hex的ch2,使用quantasofttm软件获得数据。表9表10-acl细胞系来自单一t细胞的tcrα链和β链测序facs分选的独立etpc-t细胞经历一个两步骤扩增过程,该过程需要针对每种tra和trb链的v区特异性引物集合,随后进行产生tra和trb扩增子供序列分析的配对巢式pcr反应。先前描述了这种方法(han等人,natbiotechnol.201432(7):684-692)。以下材料用于所述方法中:表11:单一细胞rt-pcr和巢式pcr试剂功能性组分2f的展示将etpc-t细胞和apc细胞在0.2x10∧6-1.5x10∧6个细胞/ml之间,在37℃,90%相对湿度和5%co2常规培养于rpmi+10%热灭活胎牛血清(完全培养基)中。肽nlvpmvatv和vyalplkml由genescript合成并且冻干收到。肽主原液悬浮于10%dmso中并储存在-80℃。施用时按50μm在完全培养基中配制工作原液(50x浓缩)。使用以下呈递hla-a*02:01(acl-209)或hla-a*24:02(acl-963)或hla-无效(acl-128)的apc。etpc-t细胞系(acl-1277,组分2a)经两个独特基因组接受位点(组分2b,2d)工程化,工程化成hla无效,利用天然cd3表达,并且携带两组分、人造反应元件(组分2f)。此外,acl-1277使得组分b、d转化成b’/d’,整合了编码对phla:hla-a*02:01-nlvpmvatv特异的tcrsp的tcrα/βorf(参见实施例8)。抗原脉冲操作悬浮活跃生长的apc细胞培养物(0.5-1.0x10∧6个细胞/ml),取得样品并计数以确定细胞浓度。随后,收获1百万个细胞,用dulbecco磷酸盐缓冲盐水(dpbs,gibco)洗涤一次,随后按1至2x10∧6个细胞/ml之间的细胞浓度悬浮于含1μm肽或无肽的完全培养基中。将细胞在标准培养条件下,在24孔培养板中温育2小时。2小时后,收获细胞,通过离心沉淀(400rcf,3分钟),随后用dpbs进行3x10ml洗涤。随后将细胞按0.2x10∧6个细胞/ml悬浮在完全培养基中。etpc-t收获悬浮活跃生长的etpc-t细胞培养物(0.5-1.0x10∧6个细胞/ml),取得样品并计数以确定细胞浓度。收获细胞,用pbs洗涤一次并且随后按0.6x10∧6个细胞/ml的浓度悬浮在完全培养基中。使etpc-t和apc在etpc:a系统中接触向96孔圆底平板的每个孔,添加50μl完全培养基、50μlapc,随后添加50μletpc-t。对于比率1∶3按大约0.27x10∧6个细胞/ml的总细胞浓度,这等于大约10,000个apc和30,000个etpc-t。随后将细胞混合物在标准培养条件温育大约24小时。染色和分析在24小时温育后,收获细胞并移植到0.75mlv形底micronic管中,用500μldpbs洗涤一次并随后用死细胞标记(dcm-apc-h7)如下染色;向每个孔添加25μl染色液,通过混合,使细胞悬浮并且随后温育15-20分钟。染色液包含每100μl染色液0.5μldcm-apc-h7。在温育后,将细胞用500μldpbs+2%fcs(洗涤缓冲液)洗涤两次。随后将细胞对etpc-t独特的表面标记染色;向每个孔添加30μl染色液,通过混合,使细胞悬浮并且随后温育30-45分钟。染色液包含每100μl染色液2.5μl抗myc-af647(克隆9e10,santacruzbiotech)。在温育后,将细胞用500μl洗涤缓冲液洗2次,而后悬浮于200μl洗涤缓冲液中并且随后通过facs在lsrfortessa(bdbiosciences)上分析。实施例实施例1用于人tra和trb链的tores系统的设计和装配tores由给定tcr链的v-c入门载体文库和j供体载体文库组成。与待插入选择的v-j-c背景中的目标odecdr3序列组合时,可以重构全长tcrorf。通过变动odecdr3序列特征和/或v/j/c选择,这个重构步骤还可以代表tcrorf工程化作业流程中的序列多样化步骤。在本实施例中,描述了用于人tra和trb链的完整tores系统的设计和装配。用于人天然tra组库的trav-c入门载体文库的设计和装配在本实施例中,描述了含有人天然trav-c序列组库的trav-c入门载体文库的设计和装配。使用模块式装配方法,从而可以用源自人、其他生物的其他tcr链或人造tcr链快速地周转v-c入门载体文库的构建。trav-c载体文库需要的dna组分是:i.用于人类基因组中编码的每种有功能trav基因区段的trav克隆性片段ii.单一trac克隆性片段iii.v-c入门载体骨架在本实施例中,合成trav和trac克隆性片段并用来在单一限制性酶和连接酶反应中装配入目标v-c入门载体骨架。在本实施例中,一对异特异性frtv-c入门载体骨架用来装配tra和trbv-c入门载体文库。每个tra和trbv-c入门载体文库均用含有不同翻转酶识别靶(frt)序列的载体骨架构建,所述载体骨架代表在v-c入门系统中所包含的5’和3’遗传元件,组分2c和2e。因此,可以提交在运行这种tores时生成的产物tra/trb对,供快速基因组整合入含有基因组接受位点(组分2b和2d)的etpc细胞,所述细胞在它们的5’和3’遗传元件内部包括相容性frt位点。在本实施例中,trav-c入门载体分别含有f14和f15frt序列作为5’和3’遗传元件。这种f14/f15v-c入门载体骨架序列作为seq0688呈献。在本实施例中,使用iis型限制性酶bbsi,构建trav-c入门载体文库。在完整tores运行时用来重构全长traorf的iis型限制性酶是bsai。人造trav克隆性片段的设计图25中描述本实施例中遗传元件trav克隆性片段的排布。trav克隆性片段的每个末端编码20个核苷酸的标准化5’和3’引物结合dna序列,以借助pcr扩增整个片段。临近于5′引物结合,编码一个bbsiiis型限制性酶结合位点,其中bbsi结合位点的方向引导bbsi酶切割其识别序列3′的dna。bbsi酶活性产生的突出端由突出端*1编码。这个突出端设计成允许用v-c入门载体骨架的臂进行连接酶依赖性定向克隆。在trav基因区段中atg起始密码子的5′,编码一个共有性kozak序列用于最终重构和表达的tramrna的高效翻译起始。在本实施例中,每个trav区段编码从trav区段的甲硫氨酸起始残基直至其最末半胱氨酸(cys)的全部氨基酸。通常认为这个cys残基是tra可变基因区段的边界,在天然存在的重组和有功能的tra链中罕见其缺失。根据需要,已经编辑天然的人trav共有序列以移除在tores装配操作或重构操作范围内所用的任何限制性酶的识别序列,并且还移除下游应用中使用的任何酶的识别序列。在trav区段的3’末端,编码了bsaiiis型限制性酶结合位点bsai←。bsai结合位点的方向引导bsai酶切割其识别序列5′的dna。所产生的突出端序列旨在涵盖v区段元件的最末半胱氨酸密码子和该半胱氨酸之前的氨基酸密码子的第3核苷酸。因此,bsai作用于设计的序列产生在trav区段的3′端的travcys突出端≠1。在本实施例中,这个cys-突出端≠1在包含的全部trav区段之间标准化以简化和统一化克隆策略。根据需要,改变编码trav遗传元件的核苷酸,以编码这种标准化突出端,但不改变翻译的氨基酸序列。在全长tra重构反应期间利用这个bsai←位点。在本实施例中,v-c入门载体负向选择标记是noti限制性酶结合位点。为了构建noti结合位点,当trav克隆性片段和trac克隆性片段连接在一起时,两个对半位点合并。trav克隆性片段编码六个核苷酸的noti5′区段。在3′引物结合序列的5′末端,编码第二bbsi限制性位点,其指导bbsi酶切割其识别序列bbsi←的5′的dna。bbsi作用于设计的序列因此产生了4个核苷酸的突出端,noti5′突出端,其设计成与tracdna片段上产生的突出端互补并在连接时重构noti结合位点。sp指向trav克隆性片段的特定点的核苷酸添加,旨在iis型限制性酶结合位点和切割位点毗邻时,实现对这类位点的正确间隔。侧置于noti限制性酶结合位点序列的sp块已经用来适当地隔开noti结合位点和切割位点,以便有效发挥作用。选择被视为潜在影响bsai结合位点的dam甲基化的核苷酸。在人天然tra链的这个实施施中,将trav克隆性片段的完整dna序列作为seq0001至seq0046提供。这些序列包括5’引物结合序列和3’引物结合序列。人造trac克隆性片段的设计图26中描述本实施例中遗传元件trac克隆性片段的排布。trac克隆性片段的每个末端编码20个核苷酸的标准化5’和3’引物结合dna序列,以借助pcr扩增整个片段。临近于5′引物结合序列,编码一个bbsi限制性酶识别位点,从而bbsi酶切割其识别序列bbsi→的3′的dna。trac克隆性片段编码六个核苷酸的noti3′区段,其补全将构成v-c入门载体负向选择标记的noti识别位点。相邻的bbsi→限制性位点作用于noti3′元件以产生四个核苷酸的noti3′突出端。这个突出端设计成与travdna片段上产生的noti5’突出端互补并且在装配v-c入门载体时重构完整的noti结合位点。在noti3′元件的3’末端,trac克隆性片段编码bsai限制性酶结合位点,bsai→。bsai结合位点的方向引导bsai酶切割其识别序列5′的dna。所得到的突出端序列设计成始于trac基因片段的第一胞嘧啶,trac突出端≠3。在全长tra重构反应期间利用这个bsai→位点。bsai→酶作用于v-c入门载体中编码的trac区段,以在重构反应期间产生必要的trac突出端≠3。在本实施例中,trac克隆性片段中包含从第一谷氨酰胺密码子5′的胞嘧啶残基直至终止密码子的共有trac序列。在3′引物结合序列的5’,编码一个bbsi限制性酶识别序列,bbsi←。bbsi结合位点的方向引导bbsi酶切割其识别序列5′的dna。bbsi酶活性产生的突出端由突出端*2编码。这个突出端的设计允许装配期间用v-c入门载体骨架的臂进行连接酶依赖性定向克隆。sp指向trac克隆性片段的特定点的核苷酸添加,旨在iis型限制性酶结合位点和切割位点毗邻时,实现对这类位点的正确间隔。侧置于noti限制性酶结合位点序列的sp块已经用来适当地隔开noti结合位点和切割位点,以便有效发挥作用。选择被视为潜在影响bsai结合位点的dam甲基化的核苷酸。在人天然tra链的这个实施例中,将trac克隆性片段的完整dna序列作为seq0047展示。这个序列包括5’引物结合序列和3’引物结合序列。设计v-c入门载体骨架用于哺乳动物细胞瞬时表达重构的traorf在本实施例中,v-c入门载体骨架衍生自pma质粒。它编码cole1复制起点,ori,连同抗生素耐药性β-内酰胺酶基因,正向选择#1。β-内酰胺酶赋予针对β-内酰胺类抗生素(如氨苄青霉素和羧苄青霉素)的青霉素基团的抗性。如图27中所示,载体骨架编码要求的遗传元件,所述遗传元件向完整重构的traorf的下游应用赋予适宜的功能。在本实施例中,5′遗传元件编码cmv组成型哺乳动物启动子并且3′遗传元件编码sv40pa多聚腺苷化信号,以允许完整重构的traorf在哺乳动物细胞中瞬时表达。在本实施例中,载体骨架编码分别产生突出端*1’和突出端*2’的acc65i和xbai限制性酶结合位点。突出端*1’与trav克隆性片段内部的突出端*1互补(图25)。突出端*2’与trac克隆性片段内部的突出端*2互补(图26)。这些互补突出端允许将trav和trac克隆性片段定向克隆若v-c入门载体骨架中。sp特征指在acc65i和xbai限制性酶识别位点之间添加的为了隔开这两个位点以高效发挥作用所需要的核苷酸。从编码frtf14位点的5′遗传元件至编码frtf15的3′遗传元件的载体骨架序列作为seq0688展示。装配trav-c入门载体文库的方法这种方法利用标准分子生物学技术将选择的trav克隆性片段(图25)和trac克隆性片段(图26)装配入给定的v-c入门载体骨架(图2),以产生trav-c入门载体(组分1a,图2a)。在本实施例中,该方法在单一反应中执行限制性酶消化和连接反应。re消化和连接反应100ng线性载体骨架(通过acc65i和xbai消化线性化)10ngtrav基因片段20ngtrac基因片段2μl10xneb连接酶缓冲液0.5μlbbsi1μlt4dna连接酶加h2o直至20μl反应条件步骤1;在37℃,2分钟步骤2;在16℃,3分钟重复步骤1和步骤2,20次50℃,5分钟80℃,5分钟返回室温将所得的产物转化入针对羧苄青霉素抗性菌落接受选择的感受态大肠杆菌细胞。对分离自选定菌落的质粒测序以确定正确装配的构建体。对每个独立的v区段克隆性片段重复该方法。所产生的构建体构成trav-c入门载体文库,所述文库用于重构全长traorf,后者稍后用于哺乳动物细胞中瞬时表达所述重构的tra。构成trav-c入门载体文库的克隆的v-c片段的序列作为seq0049至seq0094展示。展示的序列包括位于可变区段的起始密码子之前的全部kozac序列,直至c区段的终止密码子。用于人天然tra组库的traj供体载体文库的设计和装配在本实施例中,构建traj接受盒片段并插入j供体载体骨架,以产生j接受盒载体。随后,可以将人造traj区段部分装配入traj接受盒载体,以产生j供体载体文库。这种灵活的多步骤装配方法允许快速和成本有效地工程化j供体区段特征,如j区段长度变动。traj供体载体文库需要的dna组分是:i.traj接受盒片段ii.j供体载体骨架iii.traj接受盒载体iv.traj区段部分人造traj接受盒片段的设计两个单链dna寡核苷酸的复性用来产生接受位点盒片段,按照设计,所述接受位点盒片段在dna片段的每个末端含有4核苷酸单链突出端:突出端*3和突出端*4。4核苷酸突出端允许连接酶依赖性定向克隆入j供体载体骨架,以产生traj接受盒载体,如图28中描述。成对iis型限制性位点,bsai←和bsai→位于接受位点盒dna片段的5′和3′末端处。bsai识别位点的方向应引导bsai酶向构建体的中心切割dna。在traorf重构方案期间通过产生突出端≠2-5′和突出端≠3-3′,使用这些位点。突出端≠3是接受盒片段中编码的trac部分的组分,而在克隆traj区段部分后限定突出端≠2(参见下文)。bbsi成对iis型识别位点bbsi←和bbsi→在盒的中间附近编码并在产生合成的traj区段部分所包含的互补突出端时,用于装配traj供体载体(参见下文)。5’bbsi位点,bbsi←,切割入bsai位点,以在这个特征的3′端产生突出端*5。3’bbsi位点,bbsi→,切割入trac部分元件,以在这个元件的5′端产生突出端*6。这些突出端在这个构建体的bsai和trac部分特征内部编码,从而避免添加会并入重构的最终traorf中的非天然核苷酸。在bbsi→酶生成的突出端和bsai←酶生成的突出端之间的区域编码某个比例的trac区域,其始于trac基因片段(trac部分)的第二核苷酸。从trac基因片段的第二核苷酸开始的动机是因为在人tra基因座tores的这个实施例中,所得的突出端是tatc,并且不是回文突出端,若包括trac基因片段的始端(所得的突出端atat),情况就是如此。应当避免回文突出端,因为它将引起两个载体末端在不插入所要求的traj区段部分的情况下连接。bbsi→位点的取向允许全部traj片段3’′末端依赖的连接酶符合可读框地克隆至接受位点盒中trac区域的5′始端。bsai←位点的取向允许trac区域的始端与剩余trac片段在使用完整tores的tra全长orf重构方案的最终步骤中发生符合可读框的连接酶依赖性克隆。在两个bbsi结合位点之间是酶noti的8核苷酸识别序列。利用这个限制性位点作为减少亲本质粒菌落背景的负向选择标记。在已经进行traj基因片段插入后添加noti酶时,实现这一点。因此,正确克隆traj基因片段的质粒将在noti酶存在时保持环状,而未将其noti位点交换成traj基因片段的亲本质粒将线性化,这转而偏转细菌转化过程,以增殖含有完整环状traj片段的质粒。sp指向traj接受盒片段的特定点的核苷酸添加,旨在iis型限制性酶结合位点和切割位点毗邻时,实现对这类位点的正确间隔。侧置于noti限制性酶结合位点序列的sp块已经用来适当地隔开noti结合位点和切割位点,以便有效发挥作用。已经包括额外的核苷酸以维持重构的最终全长tra内部的正确可读框。选择被视为潜在影响bsai结合位点的dam甲基化的核苷酸。在人天然tra链的这个实施例中,将traj接受盒片段寡核苷酸的完整dna序列作为seq0095和seq0096展示。列出正向(f1)和反向(r1)寡核苷酸序列。j供体载体骨架的设计j供体载体骨架用来插入traj接受盒片段,以产生traj接受盒载体。因此携带骨架至j供体载体文库。在产生tra全长orf的最终反应中,这个骨架是反应副产物(图2e),并且因此携带如图29中所示的最少特征。在本实施例中,j供体载体骨架编码cole1复制起点,ori。抗生素耐药性是氨基糖苷类抗生素3′-磷酸转移酶基因,正向选择选择#2。氨基糖苷类抗生素3′-磷酸转移酶赋予针对抗生素底物(如卡那霉素、链霉素、新霉素和庆大霉素)的抗性。这种替代性正向选择用来确保在全长tcrorf重构后不选择j供体载体,其中依据正向选择#1选择所述载体。在本实施例中,载体ecori和xhoi限制性酶结合位点分别生成互补突出端,突出端*3’和突出端*4’。突出端*3’与traj接受盒片段内部所含的突出端*3互补。突出端*4’与traj接受盒片段内部所含的突出端*4互补。这些突出端允许定向克隆traj接受盒片段。sp段指在ecori和xhoi限制性酶结合位点之间添加的用于隔开这两个位点以确保高效作用的核苷酸。在本实施例中,将j供体骨架作为seq0097展示。装配traj接受盒载体的方法这种方法利用标准分子生物学技术将给定的traj接受盒片段(图28)装配入给定的j供体载体骨架(图29),以产生traj接受盒载体(图30)。所产生的traj接受盒载体用来插入traj区段部分(图31),以构建traj供体载体(组分1b,图2b)。首先,形成traj接受盒dna片段的两种寡核苷酸必须磷酸化并复性。反应混合物反应条件37℃温育1小时95℃变性5分钟通过将反应按照3℃/分钟缓慢冷却下来至25℃,使有义和反义寡核苷酸复性traj接受盒片段和j供体载体骨架的装配连接。反应混合物反应条件在25℃温育1小时在65℃热失活10分钟将所得的产物转化入感受态大肠杆菌细胞并针对卡那霉素抗性菌落选择。选择抗性菌落以确定正确装配的构建体。所产生的质粒是traj接受盒载体。在本实施例中,traj接受盒载体作为seq0098展示并在图30中描述。人造traj区段部分的设计产生traj接受盒载体后,必须产生插入至这种载体中的人造traj区段部分。将每个traj序列插入独立的traj接受盒载体背景中,以产生traj供体载体文库作为人tratores的部分。traj供体载体文库以两种不同形式存在,包含长或短的j区段部分。短traj区段部分编码从cdr3边界密码子起点开始的全部氨基酸。但是,考虑在tcr重排期间大部分traj区段被削减到小于10个核苷酸,设计了含有较长traj种系区段(长traj区段部分)的traj供体文库。较长traj基因片段文库的动机在于,如果使用短traj片段,则全长tra重构将需要编码cdr3的较短寡核苷酸双链体(odecdr3)。由于高度可变的序列作为短寡核苷酸双链体odecdr3提供,较短cdr3寡核苷酸合成更不可能含有截短或突变的寡核苷酸污染物,并且因此减少全长tra重建期间克隆具有序列差错的寡核苷酸双链体的可能性。另外,较短odecdr3合成节省费用。通过使设计成在dna片段的每个末端含有4核苷酸单链突出端的两种单链dna寡核苷酸复性,构建traj区段部分。图31中描述所产生的traj区段部分。命名为突出端*5’的5’突出端与j供体接受盒载体内部通过bbsi作用所产生的突出端*5互补。命名为突出端*6’的3’突出端与j供体接受盒载体内部通过bbsi作用所产生的突出端*6互补。这对互补突出端允许traj区段部分定向克隆入traj接受盒载体。短traj区段部分编码从cdr3-j边界phe密码子起点开始的全部氨基酸。cdr3定义为旁侧分布有v区的c末端保守cys和作为phe-gly/ala保守基序之部分的j区phe的序列。这个保守的phe-gly/ala基序用来将traj片段的5′突出端标准化成tttg用于下游tra重构。本实施例中这种标准化的例外是借助trp和gly毗邻cdr3区的人traj33和traj38。在本实施例中,traj33和traj38的5′突出端是tggg。长traj区段部分设计成编码cdr3边界氨基酸n端的更多氨基酸。每个长基因片段的起始点均在氨基酸密码子的第一核苷酸处,位置距种系编码的tcr接合元件的5′末端10-12nt。每个长traj区段部分的5′末端保持与短traj区段部分相同。向短的和长的traj区段部分,添加在图11中作为a块表示的腺嘌呤至每个traj区段部分的3′末端。这个腺嘌呤代表trac片段的第一核苷酸,其从traj接受盒排除。人天然j区段的这个实施例的短traj区段部分的序列作为seq0099至seq0210展示并且长traj区段部分的序列作为seq0211至seq0322展示。在两种情况下,列出正向(f1)和反向(r1)寡核苷酸序列。装配短或长j-供体载体文库的方法这种方法利用标准分子生物学技术将短traj区段部分或长traj区段部分(图31)克隆入traj接受盒载体(图30),以产生含有短或长traj区段的traj供体载体(组分1b,图2b)。在本实施例中,该方法在单一反应中执行限制性酶消化和连接反应。j供体载体文库需要的dna组分如下:i.短traj区段部分或长traj区段部分ii.j供体接受盒载体形成traj区段部分dna片段的两种寡核苷酸的磷酸化和复性反应混合物反应条件37℃温育1小时95℃变性5分钟通过将反应按照3℃/分钟缓慢冷却下来至25℃,使有义和反义寡核苷酸复性re消化和连接反应反应条件步骤1;在37℃,2分钟步骤2;在16℃,3分钟重复步骤1和步骤2,20次50℃,5分钟80℃,5分钟返回室温添加0.5μlnoti酶并在37℃温育30分钟以线性化亲本载体。将反应产物转化入感受态大肠杆菌细胞和并针对卡那霉素抗性选择。对选择的抗性菌落测序以确定正确装配的构建体。所得到的构建体构成traj供体载体文库,其编码长或短的traj基因片段。对于tra短j供体文库,所得文库的序列,不包括bsai识别位点外部的骨架序列,作为seq0323至seq0378展示,并且对于tra长j供体文库,作为seq0379至seq0434展示。用于人天然trb组库的trbv-c入门载体和trbj供体载体文库的设计和装配在以上部分,详述了用于人天然tra组库的v-c入门载体和j供体载体文库的设计和装配。编码trb组库的序列的这类载体文库的总体设计和装配实质上相同。在本实施例中,将略述旨在构建tores或人天然trbtcr基因座的trbv-c入门载体和trbj供体载体文库的设计和装配。重要指出的是,对于tra和trb链的v-c入门载体骨架含有不同的frt位点,从而将从本系统运行所得到的载体产物(组分2c和2e)与etpc-t的基因组接受位点(组分2b和2d)配对。这意味着,借助配对的整合对偶,仅单一tra或trb链将整合入每个etpc细胞。在本实施例中,tra链已经置于frtf14和f15位点界定的v-c入门载体背景中,但trb链已经由frtfrt和f3位点界定。用于人天然trb组库的trbv-c入门载体文库的设计和装配在本实施例中,描述了含有人天然trbv-c序列组库的trbv-c入门载体文库的设计和装配。trbv-c载体文库需要的dna组分是:i.用于人类基因组中编码的每种有功能trbv基因区段的trbv克隆性片段ii.trbc1或trbc2克隆性片段iii.v-c入门载体骨架与人tra基因座相反,人trb基因座编码两个不同的恒定区段,trbc1和c2。因此,为了捕获两个恒定区,构建两个v-c入门载体集合,以使每个v区段与每个c1和c2区段配对。在本实施例中,合成trbv和trbc克隆性片段并用来在单一限制性酶和连接酶反应中装配入目标v-c入门载体骨架。在本实施例中,目标v-c入门骨架设计成允许重构的trborf在哺乳动物细胞内部瞬时表达。在本实施例中,使用iis型限制性酶bbsi,构建trbv-c入门载体文库。在文库运行时用来重构全长trborf的iis型限制性酶是bsai。人造trbv克隆性片段的设计如图25中所示,遗传元件trbv克隆性片段的排布与上文1描述的trav克隆性片段的那些排布相同。在人天然trb链的这个实施施中,将trbv克隆性片段的完整dna序列作为seq0435至seq481展示。人造trbc克隆性片段的设计如图26中所示,遗传元件trbc克隆性片段的排布与上文描述的trac克隆性片段的那些排布相同。trb基因座编码两个不同的c区段,并且二者均纳入trbv-c入门载体文库的设计中。在人天然trb链的这个实施施中,将trbc克隆性片段的完整dna序列作为seq0482和seq0483展示。装配trbv-c入门载体文库的方法将给定trbv和trbc克隆性片段装配入给定v-c入门载体骨架以产生trbv-c入门载体的方法与上文对tra系统描述的方法相同。在本实施例中,用于trbv-c入门载体的v-c入门载体骨架分别含有frt和f3frt序列作为5’和3’遗传元件。这种frt/f3v-c入门载体骨架序列作为seq0689展示。在tra系统和trbtores系统之间的不同frt位点背景使整合载体彼此隔绝,并使其与etpc的基因组接受位点作为一对整合对偶配对。克隆的v-c片段的序列构成作为seq0484至seq0577展示的trav-c入门载体文库。用于人天然trb组库的trbj供体载体文库的设计和装配在本实施例中,描述了含有人天然trbj序列组库的trbj供体载体文库的设计和装配。在本实施例中,构建trbj接受盒片段并插入j供体载体骨架,以产生trbj接受盒载体。随后,可以将人造trbj区段部分装配入trbj接受盒载体,以产生trbj供体载体文库。这种灵活的多步骤装配方法允许快速和成本有效地工程化j供体区段特征,如j区段长度变动。这种方法遵循与实施例2中描述的traj供体载体装配相同的方式。但是,应当指出,由于j接受盒片段含有部分c区段,traj和trbj接受盒片段在c部分序列方面不同,所述c部分序列必须对应于相应的c基因区段。另外,与仅需要单一j接受盒片段的traj场景相反,trbj需要两个不同的j接受盒片段以导致使用替代性c1和c2区段。trbj供体载体文库需要的dna组分是:i.trbjc1或trbjc2接受盒片段ii.j供体载体骨架iii.trbjc1或trbjc2接受盒载体iv.trbj区段部分人造traj接受盒片段的设计两个单链dna寡核苷酸的复性用来产生接受盒片段,所述接受盒片段在dna片段的每个末端含有4核苷酸单链突出端,如图28中描述。4核苷酸突出端允许连接酶依赖性定向克隆入j供体载体骨架,以产生trbj接受盒载体。备选地使用c1和c2区段所需要的两个接受盒片段作为seq0578和seq0581展示。对于每种片段,提供正向(f1)和反向(r1)寡核苷酸序列。装配trbj接受盒载体的方法装配trbj接受盒载体的方法与实施例2中所述的装配traj接受盒载体的方法相同。相同的j供体载体骨架(seq0097)用来产生两个trbj接受盒载体,其各自含有一个与trb基因座的替代性c区段相对应的c1或c2部分。所产生的两个trbj接受盒载体用来插入trbj区段部分,以构建trbj供体载体。所产生的trbj接受盒载体作为seq0582和seq0583展示。人造trbj区段部分的设计通过使设计成在dna片段的每个末端含有4核苷酸单链突出端的两种单链dna寡核苷酸复性,构建trbj区段部分。这个部分的排布和装配方法与traj区段部分相同并在图31中描述。在这种情况下,短trbj区段部分编码从cdr3-j边界phe密码子起点开始的全部氨基酸。cdr3定义为旁侧分布有v区的c末端保守cys和作为全部人trbj区段间保守的phe-gly基序之部分的j区phe的序列。这个保守的phe-gly基序用来将traj片段的5′突出端标准化成tttg用于下游trb重构。不同于traj区段,在本实施例中不存在traj区段部分中这种标准化突出端的例外。向短的和长的trbj区段部分,添加在图11中作为a块表现的腺嘌呤至每个trbj区段部分的3′末端。这个腺嘌呤代表trbc片段的从trbj接受盒排除的第一核苷酸。人天然j区段的这个实施例的短trbj区段部分的序列作为seq0584至seq0609展示并且长trbj区段部分的序列作为seq0610至seq0635展示。在两种情况下,列出正向(f1)和反向(r1)寡核苷酸序列。装配trb短或长j供体载体文库的方法装配trbj供体文库的方法与上述tra文库相同。但是,在trb文库的情况下,与tra基因座区段的短文库和长文库相反,应产生四种文库。在trb文库情况下,可以构建每个短文库和长文库以携带每个替代性c1和c2c区段,在trbj供体文库中产生四个子集。j供体载体文库需要的dna组分如下:i.短trbj区段部分或长trbj区段部分ii.trbjc1或trbjc2接受盒载体遵循如上文所述的相同方法,在trbj供体文库中产生所得的四个子集。展示所得文库的序列,不包括bsai识别位点外部的骨架序列。作为seq0636至seq0648展示的trbc1短j供体文库作为seq0649至seq0661展示的trbc2短j供体文库作为seq0662至seq0674展示的trbc1长j供体文库作为seq0675至seq0687展示的trbc2长j供体文库实施例2编码cdr3的寡核苷酸双链体(odecdr3)的设计和产生在上文实施例中,描述了作为人tra和trb链v-c入门载体和j供体载体文库的tores的设计和构建,以输出全长人tcr链作为整体两部分装置的组分2c和2e。这些v-c入门载体和j供体载体文库用于单步重构全长tcr可读框的用法需要提供编码cdr3的寡核苷酸双链体(odecdr3)构建体,以便补全目标全长tcr链序列(图2c)。一旦产生v-c入门载体和j供体载体文库,这些载体代表可以无限用于选择目标全长tcr链序列的所需v-j-c组合的常备品。相反,odecdr3代表对目标全长tcrorf特异的独特短序列。本实施例描述人天然tra和trb载体平台中所用odecdr3的设计和产生。traodecdr3的设计两个单链dna寡核苷酸的复性产生在dna片段的每个末端含有4核苷酸单链突出端的odecdr3,如图2c中描述。4-核苷酸突出端设计成允许连接酶依赖性定向克隆至入门载体中编码的trav区段的3′末端(突出端≠1-5′)和tra重构期间的traj片段的5′末端(突出端≠2-3′)。将突出端≠1-5′标准化成ctgc,互补于trav-c入门载体的v区段中编码的标准化突出端≠1-5。在突出端≠2-3′情况下,存在可以采取的两种序列形式,这决定于来自人tra基因座的j区段之间的序列趋异性。对于人天然traj区段traj33和traj38,将突出端≠2-3′标准化成tggg,互补于这两种j区段的j供体载体中编码的突出端≠2-3。对于全部其他的人traj区段,将突出端≠2-3′标准化成tttg,互补于这些j区段的j供体载体中编码的突出端≠2-3(参见实施例1)。trbodecdr3的设计就trbodecdr3而言,两个单链dna寡核苷酸的复性产生在dna片段的每个末端含有4核苷酸单链突出端的odecdr3,如图4c中描述。4-核苷酸突出端设计成允许连接酶依赖性定向克隆至入门载体中编码的trbv区段的3′末端(突出端≠1-5′)和trb重构期间的trbj片段的5′末端(突出端≠2-3′)。将突出端≠1-5′标准化成ttgc,互补于trbv-c入门载体的v区段中编码的标准化突出端≠1-5。与其中需要两个备选突出端≠2-3形式的traodecdr3相反,对于trbodecdr3,将突出端≠2-3标准化成tttg,互补于全部trbj区段的j供体载体中编码的突出端≠2-3(参见实施例1)。odecdr3一般设计通常,odecdr3设计必须匹配于这样的4-核苷酸突出端,其设计成允许连接酶依赖性定向克隆至入门载体中编码的v区段的3′末端(突出端≠1-5′)和重构期间的j片段的5′末端(突出端≠2-3′)。产生磷酸化cdr3dna寡核苷酸双链体的方法形成odecdr3的两种寡核苷酸的磷酸化和复性反应混合物反应条件37℃温育1小时95℃变性5分钟通过将反应按照3℃/分钟缓慢冷却下来至25℃,使有义和反义寡核苷酸复性实施例3包含tores和etpcs以产生etpc-t的两部分装置的展示这个实施例描述了用于定义为重构具有目标tcr的给定序列信息的tra和trb全长tcrorf所要求的载体文库组分和odecdr3的步骤。本实施例展示了装配全长模型tra和trbtcr链对的tores过程。借助rmce使所述载体整合入etpc以产生etpc-t并且随后通过特异性hla-多聚体试剂着染表面呈递的tcr而确认其tcr对特异性,本实施例还展示了etpcs。v-c入门载体、j供体载体和odecdr3的选择将克隆性文库中代表的全部可能种系片段的序列与目的tra或trb序列比对。与tra或trb序列具有最高同一性确定的基因片段决定了哪种v、j和c遗传元件将构成所需的tra或trb克隆型序列。对于tra,基于确定所需tra的v利用情况,选择适宜的v-c入门载体。对于trb,当序列覆盖度足以确定v和c利用情况时,除了所需trb克隆类型是否使用trbc1或trbc2之外,还选择与所述克隆类型的v利用情况对应的适宜v-c入门载体。在短形式和长形式的特定traj或trbj遗传元件分别与tra和trb序列比对的情况下,编码较长遗传元件的相应质粒将用于tra重建。确定合成tra所需要的odecdr3序列为trav比对的基因片段的3′末端和比对的traj基因片段的5′末端之间的区域。寡核苷酸有义链需要额外的5′4-核苷酸突出端,突出端≠1-5′,ctgc,所述突出端适应于trav入门载体上用bsai消化时产生的突出端,突出端≠1-3′。互补性寡核苷酸反义链需要额外的5′4-核苷酸突出端,突出端≠2-3′,所述突出端对添加至tra重建反应的traj载体专用的突出端(突出端≠2-5′)为独特的。确定合成trb所需要的cdr3序列为trbv比对的基因片段的3′末端和比对的trbj基因片段的5′末端之间的区域。寡核苷酸有义链需要额外的5′4-核苷酸突出端,突出端≠1-5′,ttgc,所述突出端适应于trbv入门载体上用bsai消化时产生的突出端,突出端≠1-3′。互补性寡核苷酸反义链需要额外的5′4-核苷酸突出端,突出端≠2-3′,所述突出端对添加至tcr重建反应的trbj载体专用的突出端(突出端≠2-5′)为独特的。在本实施例中,使用一个对hla-a*02:01中呈递的人巨细胞病毒(hcmv)抗原具有已知特异性的模型tcrtra/trb对(jg9-tcr)。这种抗原性肽衍生自hcmvpp65蛋白,并且在hla-a*02:01中呈递的肽抗原的完整氨基酸序列是nlvpmvatv。tra(jg9-tcr-α)链和trb(jg9-tcr-β)链的序列分别作为seq701和seq702展示。基于这个全长序列,从tra文库和trb文库选择适宜v-c入门载体和j供体载体是简单明了的。在本实施例中,选择seq0698骨架中的trav-c入门载体seq0088(来自列表0049至0094),和j供体载体seq0371(来自列表0323至0378)。在本实施例中,选择seq0688骨架中的trbv-c入门载体seq0563(来自列表0484至0577),和j供体载体seq0637(来自列表0636至0687)。为tra链合成的odecdr3分别在seq703和seq704中作为有义链和反义链展示。为trb链合成的odecdr3分别在seq705和seq706中作为有义链和反义链展示。全长重构方法对于上文选择的每种tra组分和trb组分,限制性酶/连接酶循环反应如下文描述那样进行。re消化和连接反应反应条件步骤1;在37℃,2分钟步骤2;在16℃,3分钟重复步骤1和步骤2,20次50℃,5分钟80℃,5分钟返回室温添加0.5μlnoti酶并在37℃温育30分钟。将所得的反应产物转化入感受态大肠杆菌细胞和铺种在含有羧苄青霉素的平板上。筛选羧苄青霉素抗性菌落并对其测序以确定正确装配的构建体。通过分离的质粒dna的限制性酶鉴别性消化进行菌落筛选,并且通过dna电泳观察到预期的dna片段大小。所产生的构建体编码全长tcrα和β克隆序列。验证重构的tra载体和trb载体为了验证上文重构的tcrtra/trb对的特异性,用所述对产生etpc-t,其中亲本etpc含有不同的人造基因组接受位点组分2b和2d。所述位点组分2b和2d设计成匹配产生的整合载体组分2c和2e中的rmce位点,所述整合载体各自编码tcr对(jg9-tcr)的单链。这个实施例使用亲本etpc细胞系acl-488,其为tcr无效、hla无效、cd4无效和cd8无效并且还含有组分2b和2d。组分2b包含两个独特异特异性重组酶位点frt和f3,所述位点侧置于kozak序列和编码选择标记-蓝色荧光蛋白(bfp)的orf。在frt位点的5’编码efla启动子并且在f3位点的3’编码sv40多聚腺苷化信号终止子。组分2d包含不同于组分2b的两个独特异特异性重组酶位点f14和f15。这些位点侧置于kozak序列和编码选择标记-红色荧光蛋白(rfp)的orf。在f14位点的5’编码ef1a启动子并且在f15位点的3’编码sv40多聚腺苷化信号终止子。用tores产生的上述组分2c和2e包含两个异特异性重组酶位点frt/f3(2c)和f14/f15(2e),因此分别匹配于组分2b和2d。组分2c还在frt/f3位点之间包含kozak序列、起始密码子和编码jg9-tcr-β链的tcrorf。组分2e还在f14/f15位点之间包含kozak序列、起始密码子和编码jg9-tcr-α链的tcrorf。借助rmce,通过电穿孔acl-488(etpc),产生etpc-t。电穿孔后四至十天,通过facs分选出展示由组分2d和2b选择标记编码的荧光蛋白信号(bfp和rfp)削弱的独立细胞。使独立单克隆长成并且随后进行表型评估。所产生的单克隆acl-851是bfp和rfp阴性的(图32a和b)。acl-851还显示tcr和cd3表面表达,而亲本细胞系则否(图32c和e)。另外,引入的jg9-tcr显示hla-a*02:01-nlvp四聚体特异性染色,这表明它是在etpc-t的表面上有功能的tcrsp(图32d至f)。通过pcr确认acl-851含有由整合至基因组中的组分2b’和组分2d’编码的tcrsp(图32g和h)。总之,通过使用基于rmce的整合方法,将etpc转化成etpc-t,其中所述方法使tores中产生、在组分2c和2e中递送的tcrorf整合,从而使组分2b和2d转化成组分2b’和2d’,并且从而etpc-t在细胞表面上表达有功能的tcrsp。另外,这个实施例展示了简单etpc:a系统的运行,其中组合etpc-t和分析物抗原的二元组合物并且基于可溶性分析物抗原之间的复合体形成(hla多聚体:hla-a*02:01-nlvpmvatv)选择etpc-t。实施例4:从etpc-t逆转为etpc-x的展示。本实施例描述etpc-t转化成etpc-x,其中etpc-x具有编码tcr链orf的组分2b’并且组分2d可用于整合互补tcr链orf。通过使用匹配于组分2d’的遗传供体载体(组分2z),实现使etpc-t的组分2d’转化成etpc-x的组分d。在这个实施例中,使用在实施例3中产生的亲本etpc-t细胞系acl-851。组分2z是包含匹配于组分2d’的两个异特异性重组酶位点f14/f15、kozak序列、起始密码子和编码绿色荧光蛋白(gfp)作为整合选择标记的orf的质粒载体。通过电穿孔,将etpc-t与组分2z和编码rmce重组酶的载体组合,因此,随后对细胞选择cd3呈递作用丢失和获得整合gfp的选择标记。通过facs对单克隆acl-987进行表型特征,并且观察到acl-987已经获得gfp并丢失cd3和tcrab(图33b、d),这表明jg9-tcr-α与gfporf成功交换及组分d’转化成组分d,并且因此产生etpc-x。相比而言,作为亲本etpc-t的acl-851缺少gfp表达并且具有cd3和tcrab表面表达(图33a至c)。总之,这个实施例展示了etpc-t转化成etpc-x,其中移除组分2d’处的jg9-tcr-αtcrorf以交换整合gfp的选择标记,因而产生组分2d,用于备选互补tcr链orf的进一步整合偶联事件。使用基因组整合的rmce方法,实施这个转化。实施例5:借助tores按一个步骤产生序列多样化的tcr变体汇集物和鸟枪法整合入etpc-x以产生etpc-t汇集物的展示本实施例描述如何产生编码64个单一jg9-tcr-α变体(作为组分2e)载体的汇集物并将其整合入含有(实施例4中描述的)单一jg9-tcr-β的亲本etpc-x细胞系,以产生汇总etpc-t文库,其中每种独立细胞整合单一tra链,以呈递其中每个细胞在表面上表达单一分立tcrsp的etpc-t文库。这种方法称作‘鸟枪’整合法。已经通过图3中描述的方法,修饰处于v片段和j片段交界的cdr3序列,产生64个jg9-tcrα变体。显示当特定hla-多聚体试剂随其先天trb链对一起在哺乳动物细胞表面上呈递时,这个单一反应多样化产生对所述试剂具有广泛类型亲和力的tcr集合。这种方法理想地适用于利用可在活哺乳动物细胞的功能背景下呈递并受到选择的全长tcrorf快速进行tcr工程化。借助odecdr3简并性的tcr链快速多样化想要多样化和选择tcrorf,以工程化具有改变的特异性、亲和力和/或信号传导能力的tcr链对。tores系统适合快速产生从原始目标序列系统性改变的tcr链集合。在本实施例中,展示了通过将选定的密码子位置处具有定义的和有限的核苷酸简并性的odecdr3纳入重构反应,使模型tcr链对多样化的方案。这种方法用来使实施例3中的模型jg9-tcr对的jg9-tcr-α链多样化。多样性tra链集合的产生图3展示了通过使用odecdr3汇集物,在单一反应中产生序列多样化的tcr链集合的总体策略。选择单一c-v入门载体和j供体载体以代表最终的全长tcr产物中的目标v、j和c基因区段(图3,框i和框ii)。产生具有选定多样性的odecdr3汇集物,从而存在odecdr3汇集物中代表的众多不同cdr3序列(图3,框iii)。当全部组分合并入限制性酶/连接酶循环反应时,所产生的产物是含有定义的v、j、c基因区段利用情况和cdr3区内多样性确定的全长tcr链的一组构建体(图3,框iv)。终产物中多样化全长tcr链的数目与添加至反应的初始odecdr3汇集物中odecdr3变体的数目完全成正比。在本实施例中,jg9-tra-α链是序列多样化目标,并且通过合成在3个不同位置具有核苷酸简并性的odecdr3有义和反义寡聚物,实现这种多样化,所述核苷酸简并性各自改变独立的密码子,以产生三个密码子的每者处存在4种不同氨基酸的可能性。跨cdr3环间隔为简并性所选择的密码子。odecdr3寡聚物作为seq0743和seq0744展示,其中n表示简并密码子。通过实施例2中略述的方法,使odecdr3寡聚物复性,3个独立的密码子位置处的4种氨基酸简并性产生了具有64个独特序列(包括原始编码性序列(即,seq0701))的odecdr3产物汇集物。通过实施例3中略述的方法,使用odecdr3装配全长traorf,产生在3个不同密码子位置具有4种氨基酸简并性的64个独特traorf。在本实施例中,合成在所示位置具有简并性核苷酸使用情况的odecdr3,并且因此在单管中进行重构以产生全部64个链变体。平行的,还将每种变异jg9-tcr-α链和jg9-tcr-β链克隆入独立的v-c入门骨架(seq0048),后者允许瞬时转染供平行表征。全部预期的克隆均作为分离的载体制备并且确认序列。表征具有trb链对的多样化jg9-tcr-α链在这个实施例中,使用表达jg9-tcr-β链(在组分2b’中)和cd3链的亲本etpc-x细胞系acl-987(实施例4中描述该细胞系的构建)。组分2d编码选择标记gfp并且在实施例6中描述。在这个实施例中,生成64个jg9-tcr-α变体,产生组分2e汇集物,其旁侧分布有f14/f15位点。借助rmce,通过使64个组分2e电穿孔入acl-987,产生etpc-t汇集物。基于gfp表达选择多克隆。所产生的多克隆acl-988包含gfp阳性细胞群体和gfp阴性细胞群体,不同于仅包含gfp阳性细胞的亲本系(图34a和b)。但是,仅gfp阴性群体显示始终强烈的cd3表达,这表明组分2d成功转化成组分2d’并且因此etpc-x已经转化成etpc-t(图34c和d)。另外,用jg9-tcr特异性四聚体试剂(hla-a*02:01-nlvp)染色时,acl-988gfp阴性群体显示两种不同的强度,这显示该群体包含了表达结合效率不同的tcr变体的细胞。平行地,在亲本etpc(acl-987)中瞬时表达表征的全部64个jg9-tcr-α变体连同wtjg9-tcr-β。使用这种瞬态测定法,相对于参比,对表达变体jg9-tcr的上述汇总etpc-t中呈递的每个tcr对,测定针对hla-a*02:01-nlvp四聚体试剂的相对染色单位(rsu)。rsu计算为cd3阳性群体对cd3阴性群体的hla-a*02:01-nlvp四聚体信号的平均荧光强度(mfi)比率,并且表示每种tcr链对变体的结合强度。用每个jg9-tcr-α变体独立转染亲本acl-987系后,将细胞用针对cd3的抗体并用hla-a*02:01-nlvp四聚体试剂染色,并且通过流式细胞术分析。图34e中作图的每个点代表对64个变体中每个变体观察到的rsu。为了确认hla-a*02:01nlvp阳性的acl-988细胞编码高rsutra变体及hla-a*02:01nlvp阴性的前述细胞编码低rsutra变体,对每个群体的独立细胞和它们的tra测序并在图34e中作图。实际上,hla-a*02:01nlvp阳性的独立acl-988细胞编码在单独测试的变体优势显示高rsu结果的tra变体(图34e,空心圆圈)。另外,hla-a*02:01nlvp阴性的独立acl-988细胞编码优势显示低rsu结果的tra变体(图34e,空心三角形)。总之,本实施例在单一反应中产生编码cdr3多样化tcrorf的载体汇总文库。在匹配于etpc基因组接受位点的载体背景编码这个汇总文库。使用向编码天然相应tcrorf的etpc-x中的鸟枪法整合,以单一步骤成功地产生含有多个tcr的etpc-t汇总文库。产生的基因修饰的多克隆细胞系acl-988呈递了可以针对hla四聚体试剂的一系列染色强度功能性选择的tcrsp文库,其中所述四聚体试剂对先天对特异。这代表一种选择性工程化tcr对的有力和快速方案,其中在人细胞表面上呈递的cd3复合体的先天背景下选择所述tcr对。实施例6:组分2f的功能性展示这里,描述了etpc细胞系(acl-1063,组分2a),所述细胞系用两个独特的基因组接受位点(组分2b和2d)工程化,经工程化成hla表达无效,利用天然cd3表达,并且携带两组分、人造反应元件(组分2f)。反应元件包含驱动物-激活物组分和放大物-报告组分,其中两个单元均利用人造增强子。驱动物是响应于天然tcr信号传导途径的人造增强子,其编码三组串联的nfat-ap1-nfkb转录因子结合位点(3xnf-ap-nb)。当转录激活时,驱动物诱导激活蛋白(设计的人造转录因子)表达,其中通过融合疱疹病毒vp16激活结构域、gal4dna结合结构域和两个在n末端和c末端的核定位信号(nv16g4n),衍生所述设计的人造转录因子,其相关dna识别序列在放大物增强子区域中串联存在6次。驱动物增强子和放大物增强子均利用紧邻相应转录因子结合位点3’的来自cmvie1启动子的核心启动子序列(b识别元件(bre)、tata框、起始子(inr)和转录起始位点(tss))。当转录激活时,放大物驱动报道分子rfp表达。在这个实验中,将etpc细胞系如实施例3中前述那样转化成etpc-t细胞系(acl-1277),其中组分2b’和2d’处的tcr链编码对hcmvhla-a*02:01-nlvpmvatv特异的tcr对。随后针对呈递hla-a*02:01的apc(acl-209)或hla-a*24:02的apc(acl-963)激发etpc-t细胞系或apc为hla无效(acl-128)。其中通过用肽nlvpmvatv或vyalplkml脉冲或不用肽脉冲apc。随后,将30,000个etpc-t与10,000个apc共培养24小时。在24小时后,将细胞收获,洗涤,用针对etpc和apc特异的标记染色以区分群体,并通过流式细胞术分析。仅在相关靶抗原(即,具有a*02:01-nlvpmatv的apc)激发的etpc-t中观察到etpc-t,组分2f的强烈活化(rfp+表达>80%)(图35)。总之,工程化了含有功能的组分2f的etpc细胞系,并且该细胞系随后用来产生etpc-t。一旦etpc-t与呈递其相关靶t细胞抗原的apc相互作用,则应答作为rfp表达增加可度量。相反,与呈递非相关t细胞抗原和hla或没有hla等位基因的apc接触时,etpc-t不展示高于背景的可度量rfp表达增加。具有功能性组分2f的etpc-t可以因此用于鉴定和表征t细胞受体和由apc呈递的相关t细胞抗原之间的功能性相互作用。序列下文给出显示本文所提到序列的表。<210>745<223>pcdna3.1_gfp载体v1.a.4<210>746<223>pcdna3.1_rfp载体v1.a.6<210>747<223>pma-sv40pa载体v1.c.2<210>748<223>pma-cs-jg9-tcrβ载体v3.c.5<210>749<223>pma-f14-gfp-f15载体v4.h9<210>750<223>pma-f14-tcr-jg9-α-f15载体v7.a.3<210>751<223>pma-frt-tcr-jg9-β-f3载体v7.a.4<210>752<223>f14-tcraf15cdr3degen.64mix载体v8.f.8<210>753<223>cmvpro-flp-sv40pa-v2载体v4.i.8<210>754<223>jg9-tracdr364变体载体骨架vp.7751.rc1-a1至h8<210>755<223>jg9-tra64变体vp.7751.rc1_a1的cdr3序列<210>756<223>jg9-tra64变体vp.7751.rc1_a2的cdr3序列<<10>757<223>jg9-tra64变体vp.7751.rc1_a3的cdr3序列<210>758<223>jg9-tra64变体vp.7751.rc1_a4的cdr3序列<210>759<223>jg9-tra64变体vp.7751.rc1_a5的cdr3序列<210>760<223>jg9-tra64变体vp.7751.rc1_a6的cdr3序列<210>761<223>jg9-tra64变体vp.7751.rc1_a7的cdr3序列<210>762<223>jg9-tra64变体vp.7751.rc1_a8的cdr3序列<210>763<223>jg9-tra64变体vp.7751.rcl_b1的cdr3序列<210>764<223>jg9-tra64变体vp.7751.rc1_b2的cdr3序列<210>765<223>jg9-tra64变体vp.7751.rc1_b3的cdr3序列<210>766<223>jg9-tra64变体vp.7751.rc1_b4的cdr3序列<210>767<223>jg9-tra64变体vp.7751.rc1_b5的cdr3序列<210>768<223>jg9-tra64变体vp.7751.rc1_b6的cdr3序列<210>769<223>jg9-tra64变体vp.7751.rc1_b7的cdr3序列<210>770<223>jg9-tra64变体vp.7751.rc1_b8的cdr3序列<210>771<223>jg9-tra64变体vp.7751.rc1_c1的cdr3序列<210>772<223>jg9-tra64变体vp.7751.rc1_c2的cdr3序列<210>773<223>jg9-tra64变体vp.7751.rc1_c3的cdr3序列<210>774<223>jg9-tra64变体vp.7751.rc1_c4的cdr3序列<210>775<223>jg9-tra64变体vp.7751.rc1_c5的cdr3序列<210>776<223>jg9-tra64变体vp.7751.rc1_c6的cdr3序列<210>777<223>jg9-tra64变体vp.7751.rc1_c7的cdr3序列<210>778<223>jg9-tra64变体vp.7751.rc1_d1的cdr3序列<210>779<223>jg9-tra64变体vp.7751.rc1_d2的cdr3序列<210>780<223>jg9-tra64变体vp.7751.rc1_d3的cdr3序列<210>781<223>jg9-tra64变体vp.7751.rc1_d4的cdr3序列<210>782<223>jg9-tra64变体vp.7751.rc1_d5的cdr3序列<210>783<223>jg9-tra64变体vp.7751.rc1_d6的cdr3序列<210>784<223>jg9-tra64变体vp.7751.rc1_d7的cdr3序列<210>785<223>jg9-tra64变体vp.7751.rc1_d8的cdr3序列<210>786<223>jg9-tra64变体vp.7751.rc1_e1的cdr3序列<210>787<223>jg9-tra64变体vp.7751.rc1_e2的cdr3序列<210>788<223>jg9-tra64变体vp.7751.rc1_e3的cdr3序列<210>789<223>jg9-tra64变体vp.7751.rc1_e4的cdr3序列<210>790<223>jg9-tra64变体vp.7751.rc1_e5的cdr3序列<210>791<223>jg9-tra64变体vp.7751.rc1_e6的cdr3序列<210>792<223>jg9-tra64变体vp.7751.rc1_e7的cdr3序列<210>793<223>jg9-tra64变体vp.7751.rc1_e8的cdr3序列<210>794<223>jg9-tra64变体vp.7751.rc1_f1的cdr3序列<210>795<223>jg9-tra64变体vp.7751.rc1_f2的cdr3序列<210>796<223>jg9-tra64变体vp.7751.rc1_f3的cdr3序列<210>797<223>jg9-tra64变体vp.7751.rc1_f4的cdr3序列<210>798<223>jg9-tra64变体vp.7751.rc1_f5的cdr3序列<210>799<223>jg9-tra64变体vp.7751.rc1_f6的cdr3序列<210>800<223>jg9-tra64变体vp.7751.rc1_f7的cdr3序列<210>801<223>jg9-tra64变体vp.7751.rc1_f8的cdr3序列<210>802<223>jg9-tra64变体vp.7751.rc1_g1的cdr3序列<210>803<223>jg9-tra64变体vp.7751.rc1_g2的cdr3序列<210>804<223>jg9-tra64变体vp.7751.rc1_g3的cdr3序列<210>805<223>jg9-tra64变体vp.7751.rc1_g4的cdr3序列<210>806<223>jg9-tra64变体vp.7751.rcl_g5的cdr3序列<210>807<223>jg9-tra64变体vp.7751.rc1_g6的cdr3序列<210>808<223>jg9-tra64变体vp.7751.rc1_g7的cdr3序列<210>809<223>jg9-tra64变体vp.7751.rc1_g8的cdr3序列<210>810<223>jg9-tra64变体vp.7751.rc1_h1的cdr3序列<210>811<223>jg9-tra64变体vp.7751.rc1_h2的cdr3序列<210>812<223>jg9-tra64变体vp.7751.rc1_h3的cdr3序列<210>813<223>jg9-tra64变体vp.7751.rc1_h4的cdr3序列<210>814<223>jg9-tra64变体vp.7751.rc1_h5的cdr3序列<210>815<223>jg9-tra64变体vp.7751.rc1_h6的cdr3序列<210>816<223>jg9-tra64变体vp.7751.rc1_h7的cdr3序列<210>817<223>jg9-tra64变体vp.7751.rc1_h8的cdr3序列缩写aam分析物抗原性分子aapx分析物抗原呈递复合体α-galcerα-半乳糖基神经酰胺at分析物tcrapc抗原呈递细胞apx抗原呈递复合体b细胞b淋巴细胞β2mβ2微球蛋白bfp蓝色荧光蛋白c(-区域)恒定区car嵌合抗原受体car-tcart细胞cd1b分化抗原簇1bcd1d分化抗原簇1dcd3分化抗原簇3cdr互补决定区cm载货分子.cmv巨细胞病毒c-区域恒定区crispr成簇规律间隔的短回文重复序列d(-区域)多样化区域damps危险相关分子样式dc树状细胞dna脱氧核糖核酸dsdna双链dnaeapc工程化抗原呈递细胞eapc-a表达分析物抗原性分子的工程化抗原呈递细胞eapc-p呈递分析物抗原呈递复合体的工程化抗原呈递细胞呈递分析物抗原呈递复合体和分析物抗原性分子的工程化抗原呈eapc-pa递细胞eapcs工程化的抗原呈递细胞系统etpc工程化tcr呈递细胞etpc-t呈递全长tcr对的工程化tcr呈递细胞etpcs工程化tcr呈递细胞系统fab结合抗原的抗体片段facs荧光激活的细胞分选法frt翻转酶识别靶gemt细胞种系编码的分枝酰(mycolyl)反应性t细胞gfp绿色荧光蛋白grnacas9向导rnahcmv人巨细胞病毒hdr同源定向重组hiv人类免疫缺陷病毒hla人白细胞抗原hlaihlai类hlaiihlaii类igsf免疫球蛋白超家族inkt细胞不变性天然杀伤t细胞ires内部核糖体进入位点itam免疫受体基于酪氨酸的激活基序j-供体连接供体j-区域连接区macs磁激活的细胞分选mage黑素瘤相关抗原mait粘膜相关的不变性tmhc主要组织相容性复合体mr1主要组织相容性复合体i类相关的基因蛋白质mrna信使核糖核酸ncbp不基于细胞的粒子nkt细胞天然杀伤t细胞odecdr3编码cdr3的寡核苷酸双链体orf可读框pamps病原体相关的分子模式pcr聚合酶链反应phla肽hlarfp红色荧光蛋白rmce重组酶介导的盒交换rna核糖核酸rt逆转录sh2src同源性2t细胞t淋巴细胞taa肿瘤相关抗原talen转录激活物样效应核酸酶tcrt细胞受体tcrsp与cd3复合的tcr表面蛋白torestcrorf重构和工程化系统tratcrαtrbtcrβtrdtcrδtrgtcrγv-c入门载体可变-恒定入门载体v(区)可变区zap-7070kdaζ链相关蛋白定义适应性免疫:整体免疫系统的子系统,由高度特化的全身性细胞和消除病原体或防止它们生长的过程组成。成对互补tcr链:二条tcr链,其中翻译的蛋白质能够在tcr呈递细胞的表面上形成tcrsp亲和力:两个或更多个分子或蛋白质之间相互作用的动力学参数或平衡参数亲和试剂:作为分析物制备以探测etpc:a系统中etpc-t的细胞表面上tcrsp结合和/或刺激的任何试剂等位基因:给定基因的变体形式aam:分析物抗原性分子。通常由细胞从其基因组dna和/或引入的特定遗传序列表达的蛋白质,但还可能是代谢物。am在细胞中表达并且片段随后可以由apx作为载货或本身呈递在细胞表面上。作为载货或者不作为载货,am随后可以是携带t细胞受体的细胞或相关亲和试剂的靶。扩增子:使用多种方法(包括pcr)时作为人工扩增的来源和/或产物的一段dna或rna。分析物:在组合系统中令人感兴趣地鉴定和/或测量和/或查询的实体抗体:由免疫系统的特化细胞(称作b细胞)表达和含有两条链的亲和分子。抗原:可以由tcr接合并且在t细胞中导致信号转导的任何分子分析物抗原:总体上代表任何实体呈递抗原供分析性确定的etpc:抗原系统(etpc:a)抗原结合槽:作为肽抗原与mhc-i分子结合的位点的长槽或沟。apc:抗原呈递细胞。能够在其细胞表面上、通常在hla背景下呈递抗原的细胞。aapx:分析物抗原呈递复合体。由有核细胞从基因/编码orf的基因组dna和/或引入的特定遗传序列表达并呈递在细胞表面上的蛋白质。apx呈递作为肽或其他代谢物分子的载货。自身免疫性:是生物对其自身健康细胞和组织发生免疫应答的系统。c(区域):恒定基因区段。用来装配t细胞受体的基因区段之一。c-区域是在免疫系统中定义其一般功能而非驱动tcr多样性的独特区段。c克隆性片段:恒定克隆性片段。也称作c基因区段克隆性片段。携带用来构建v-c入门载体的c基因区段部分的构建体。载货加载装置:从细胞中存在的蛋白质或其他已呈递分子产生载货分子并使其加载于apx上的一套细胞蛋白质。顺式作用元件:调节附近orf转录的非编码性dna区域。c-部分:恒定部分。恒定基因区段序列的小部分,由j接受盒片段、j接受盒和j供体载体携带以使突出端序列标准化,以运行tores重构tcrorf。cdr:互补决定区。在tcr和抗体的面向抗原的末端上执行大部分靶结合功能的短序列。每种抗体和tcr含有六个cdr并且它们通常是分子的最可变部分,允许检测庞大数目的多样性靶分子。cm:载货分子。由抗原呈递复合体(例如hlai或hlaii)呈递的肽或代谢物。cm可以由细胞从基因组dna固有表达,被引入培养基或从特异性引入的基因序列表达。相关抗原:被特定tcr识别的抗原,经常由hla呈递。tcr和抗原是相关物。拷贝数:在细胞的基因组中编码的定义序列的存在整数。细胞遗传学:与染色体结构和功能有关的遗传研究,即确定细胞的核型细胞毒的/细胞毒性:t细胞释放直接和特异性损伤靶细胞的因子的过程。d(-区域):多样化基因区段。用来装配t细胞受体的基因区段之一。每名个体具有这些区域的众多不同变种,从而每名个体可能为t细胞武装种类非常庞大的不同tcr。二聚体:是由键接合的两个结构上相似的单体组成的低聚物,所述键可以强键或弱键、共价键或分子间键。dna:脱氧核糖核酸。形成编码基因和蛋白质的遗传物质的分子的化学名称。内源的:源自细胞中的物质etpc:a系统:etpc:抗原系统。其中etpc-t与分析物抗原接触的系统真核条件性调节元件:可以影响启动子的活性的dna序列,所述启动子在限定条件下可能被诱导或阻遏。真核启动子:编码rna聚合酶结合位点及反应元件dna序列。启动子区的序列控制rna聚合酶和转录因子结合,因此启动子在确定何处和何时您的目的基因将表达方面发挥巨大作用。真核终止子/信号终止子:与rna聚合酶ii结合并触发转录过程终止的蛋白质因子识别的dna序列。它还编码聚腺苷酸信号。工程化的细胞:基因组已经通过基因修饰过程工程化的细胞。表位:表位也称作抗原决定簇,是由免疫系统识别,特别由抗体、b细胞或t细胞识别的抗原部分。例如,表位是抗原中与抗体结合的特定段。表观遗传隔绝子序列:破坏调节序列(如增强子或沉默子)和启动子之间通讯的dna元件。etpc系统:etpcs是籍此制备etpc-t细胞或其文库以便在eapc:etpc系统中组合的系统。facs/流式细胞术:荧光激活的细胞分选法。流式细胞术是籍此可以对独立细胞分析特定细胞表面标记和胞内标记表达的技术。该技术的变型,细胞分选,允许取回携带限定标记集合的细胞供进一步分析。apx家族:编码构成抗原呈递复合体的功能相关蛋白质的一套数个相似基因。flp重组酶:衍生自面包酵母(酿酒酵母(saccharomycescerevisiae))2μm质粒的重组酶(翻转酶,flp)。荧光(蛋白)标记:具有特定消光特征和发射特征并且可以用显微术、facs和相关技术检测到的分子。种系基因区段:人类中天然存在的(tcr)基因区段。基因顺式作用元件:存在于它们调节的基因的相同dna分子上,而反式调节元件可以调节与这些元件转录自其中的基因相距一段距离的基因。顺式调节元件经常是一种或多种反式作用因子的结合位点。遗传条形码:dna条形码是使用某生物的dna中的短遗传标记物鉴定该生物属于特定物种的分类学方法。基因组接受位点:基因组中用于定向整合在遗传供体载体内部编码的供体遗传物质的位点。基因组接受位点再循环:被占据的基因组接受位点反转返回其中可以整合新分析物(tcr)orf的构象单倍型:位于单一染色体上的遗传决定子集合。hla单倍型:每位个体中存在的hlai和hlaii等位基因集合。异特异性重组酶位点:由重组酶识别以促进两个dna分子交叉互换的dna序列hlai:人白细胞抗原i类。在人体的全部有核细胞中表达并将表达产物输出到细胞表面上的基因,在所述细胞表面,它将内部蛋白质的短片段、肽作为载货呈递至t细胞受体。就这一点而论,它提供潜在持续感染性片段连同固有蛋白质。hlai可以额外地将添加至培养基、从表达自所引入遗传元件的蛋白质产生或从细胞摄取的蛋白质产生的肽作为载货呈递。hlai类基因呈多态性,这意味着不同个体可能在相同基因中具有变异,其导致呈递过程变异。与hlaii类相关,hlaii:人白细胞抗原ii类。在人体中协调并帮助适应性免疫应答的特定细胞(例如树状细胞)中表达的基因。与hlai类相关。hlaii类蛋白输出至细胞表面,在那里它们将外部蛋白的短片段、肽作为载货呈递给t细胞受体。就这一点而论,它提供潜在持续感染性片段连同固有蛋白质。hlaii可以额外地将添加至培养基、从表达自所引入遗传元件的蛋白质产生或从细胞摄取的蛋白质产生的肽作为载货呈递。hlaii类基因呈多态性,这意味着不同个体可能在相同基因中具有变异,其导致呈递过程变异。同源臂:一段dna,其与互补性同源臂具有几乎相同序列同一性并因此通过细胞过程(同源性指导的修复)促进两个dna分子发生交换。免疫监视:其中免疫系统检测并因感染、恶性肿瘤或其他潜在致病性变异而变得活化的过程。免疫疗法:促进身体对抗疾病的先天防御的治疗类型。它利用由身体或在实验室中产生的物质改善或恢复免疫系统功能。隔绝体:防止基因受附近基因激活或阻遏过程影响的dna序列。隔绝体还防止异染色质从沉默的基因扩散至活跃转录的基因。整合:dna序列物理连接入细胞的染色体。整合载体:tores的产物,含有tcrorf并匹配于基因组接受位点,在5’和3’末端含有能够实现整合的遗传元件。整合对偶:匹配的整合载体和基因组接受位点内部核糖体进入位点(ires):一旦转录则编码允许翻译以非帽依赖性方式起始的rna元件的dna序列同工型:两种或更多种功能上相似的蛋白质的任一者,所述蛋白质具有相似但不相同的氨基酸序列并且由不同基因编码或由来自相同基因的已经移除不同外显子的rna转录物编码。j(区域):连接区段。用来装配t细胞受体的基因区段之一。每名个体具有这些区域的众多不同变种,从而每名个体可能为t细胞武装种类非常庞大的不同tcr。j供体骨架:连接供体骨架。向其中插入j接受盒片段以产生j接受盒载体的载体骨架。j供体载体:两组分载体系统的载体,其携带jtcr区段并在重构全长tcrorf期间将这个区段供给v-c入门载体。j接受盒片段:连接接受盒片段。携带用来构建j接受盒载体的c-部分的克隆性片段。j接受盒载体:连接接受盒载体。其中插入j区段部分以产生j供体载体的载体,携带c-部分。j区段部分:连接区段部分。携带j基因区段的部分的dna构建体,其中将所述部分插入j接受盒载体以产生j供体载体。kozak序列:高效翻译起始所要求的短序列主要hlai类:包含基因hla-a、hla-b和hla-c的apx家族匹配:此时,两种组分编码了指导并限制互补的组分之间相互作用的遗传元件大范围核酸酶识别位点:由常称作大范围核酸酶的内切脱氧核糖核酸酶识别的dna序列。代谢物:通过细胞的代谢途径产生或改变的分子移动遗传元件:可以允许具有转座酶活性的dna整合的dna序列单克隆细胞系:通过反复细胞复制从单一祖先细胞产生的定义的细胞群体mrna剪接受体位点:在dna的5′末端,核苷酸是gt[前信使rna(前mrna)中gu];在其3′末端是ag。这些核苷酸是剪接位点的部分。剪接供体:在内含子始端的剪接位点,内含子5′左侧末端。剪接接纳体:在内含子末端的剪接位点,内含子3′右侧末端。多聚体:由多个相同单体组成的蛋白质复合体。经常用于hla多聚体试剂背景下。天然:在细胞中天然存在的实体负向选择标记:向载体和/或携带所述标记携带载体的宿主生物赋予负向选择作用的选择标记不基于细胞的粒子:(ncbp)以类似于亲和试剂的方式发挥作用,原因在于该粒子呈递就etpc:a系统内部etpc-t表面的tcrsp接合而言待评估的分析物抗原或其他实体。但是,ncbp视为还可以携带遗传信息或其他信息的较大实体,所述信息将直接或通过代理充当所呈递的分析物抗原或其他结合实体的标示物。ncbp的常见例子将是噬菌体展示场景下的噬菌体非编码性基因:转录成有功能的非编码性rna分子的不编码蛋白质的dna序列odecdr3:编码互补决定区的寡核苷酸双链体。携带带末端突出端的cdr3基因序列的人造构建体,与两组分载体系统联合使用以重构全长tcrorf。复制起点:载体、质粒或基因组中引发复制的特定序列。orf:可读框。一段编码翻译框架以借助核糖体合成蛋白质(多肽)的遗传物质突出端:在双链核酸分子末端处的单链序列。经常称作粘性末端或粘末端。pcr:其中指数扩增特定靶dna分子的聚合酶链反应肽:6-30个氨基酸长度之间的短氨基酸串表型分析:细胞可观测特征的分析。质粒:可以在细菌或原生动物的细胞质中独立于染色体发生复制的基因构建体,一般为小型环状dna链。多态性:在相同物种的个体中因存在相同基因的不同等位基因而以不同形式存在。多肽:由一段肽组成,形成三维结构的蛋白质。正向选择标记:向载体和/或携带所述标记携带载体的宿主生物赋予正向选择作用的选择标记引物:允许例如在pcr期间特异性识别靶dna序列的短dna序列。专职apc:能够呈递抗原供αβ和γδt细胞采样的任何有核细胞。启动子:用于基因表达受控起始的调节性dna元件重组酶:介导遗传重组的酶。报道元件:遗传元件,其在携带所述元件的生物或载体中介导报告的信号。可以用作正向或负向选择标记。限制性酶剪切序列:由限制性酶切割的基因序列,可以相对于所述限制性酶的识别序列为外来或固有。限制性酶识别序列:限制性酶识别和接合的基因序列。选择标记:赋予适于人工选择方法的性状的dna序列剪接受体位点:在内含子am、apxcm或亲和试剂3′端与表面上具有tcrsp的细胞或基于tcrsp的试剂相互作用的dna序列剪接供体位点:在内含子5′端的dna序列体细胞v(d)j重组:一个过程,在该过程之后每个t细胞表达单个差异性重排的tcr的拷贝的过程。指在trb和trd基因座处的重组并且额外地包含多样性(d)基因区段。自杀基因:一种基因,其将会在携带所述基因的宿主生物内部介导细胞死亡。可以用作正向或负向选择标记。人造的:人工产生的实体。t细胞:t淋巴细胞。在其表面上表达t细胞受体的白细胞。受免疫系统选择不与自体反应,但是具有识别感染和恶性肿瘤以及排斥来自相同物种大部分成员的移植物的潜力。t细胞成熟:允许t细胞区分属于身体并且健康的细胞与那些不健康或根本不属于身体的细胞的过程。在胸腺中发生t细胞组库:不同的t细胞受体集合tcr:t细胞受体。由称作t-淋巴细胞的淋巴细胞亚群表达的亲和分子。在人体中,tcr识别apxcm或apxam呈递的载货,包括来自病毒或细菌性感染或癌细胞的片段。因此,tcr识别是适应性免疫系统的有机部分。tcr由两条在细胞表面上配对的链组成。在每个细胞的表面上表达的tcr从巨大的变异基因(v、d、j和c区段)汇集物中随机装配,并且因此每名个体具有表达非常庞大和多样的不同tcr组库的t细胞汇集物。终止子元件:是一段在转录期间标示基因组dna中基因或操纵子之末端的核酸序列。这个序列通过在新合成的mrna中提供触发从转录复合体释放mrna的过程的信号,介导转录性终止。这些过程包括mrna二级结构与复合体直接相互作用和/或已招募的终止因子的间接活性。释放无转录复合体的rna聚合酶和相关的转录装置以开始新mrna的转录。终止元件处于dna的模板链中并且由通过六个碱基分隔并跟随有一系列腺嘌呤(a)的两个反向重复序列组成。胸腺选择:未成熟的胸腺细胞基于其t细胞受体的特异性经历选择过程。这包括选择有功能的t细胞(正向选择)并且消除具有自身反应性的t细胞(负向选择)。胸腺的髓质是t细胞发生成熟的部位。肿瘤相关抗原:肿瘤抗原是肿瘤细胞中产生的抗原性物质,即,它在宿主中触发免疫应答。肿瘤抗原是诊断性检验鉴定肿瘤细胞时有用的肿瘤标记并且是用于癌疗法的潜在候选物。tra:编码tcrα的基因座。编码可以形成vdj重组的tcr链的基因的四个不同基因座之一。翻译的tcrα链蛋白一般与翻译的tcrβ链蛋白配对,以形成α/βtcrsp。trb:编码tcrβ的基因座。编码可以形成vdj重组的tcr链的基因的四个不同基因座之一。翻译的tcrβ链蛋白一般与tcrα链蛋白配对,以形成α/βtcrsp。trd:编码tcrδ的基因座。编码可以形成vdj重组的tcr链的基因的四个不同基因座之一。翻译的tcrδ链蛋白一般与翻译的tcrγ链蛋白配对,以形成γ/δtcrsp。trg:编码tcrγ的基因座。编码可以形成vdj重组的tcr链的基因的四个不同基因座之一。翻译的tcrγ链蛋白一般与翻译的tcrδ链蛋白配对,以形成γ/δtcrsp。两组分载体系统:具有所需序列的单一v-c入门载体和单一j供体载体可以在单管反应中以限制性酶和连接酶依赖性和pcr非依赖性方式与编码cdr3的短dna寡核苷酸双链体(odecdr3)组合,以体外重构全长tcrorf。i型跨膜结构域:锚定至脂质膜的单次通过分子,其具有转移停止锚序列并且其n端结构域在合成期间靶向内质网腔(并且如果成熟形成位于原生质膜上,则靶向胞外间隙)。iis型限制性酶:识别非对称dna序列并在其识别序列外部切割的限制性酶。v(区):可变区。用来装配t细胞受体的基因区段之一。每名个体具有这些区域的众多不同变种,从而每名个体可能为t细胞武装种类非常庞大的不同tcr。v-c入门载体:两组分载体系统的载体,其携带v和ctcr区段并且在重构全长tcrorf期间接受来自j供体载体的序列和odecdr3。v克隆性片段:可变克隆性片段。也称作v基因区段克隆性片段。携带用来构建v-c入门载体的v基因区段部分的构建体。载体:载体是携带遗传信息的遗传构建体。在本发明语境下,载体通常描述质粒型dna载体。载体可以代表在宿主生物中可以扩增并选择的任何这类构建体。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1