产生去甲阿片类和NAL-阿片类苄基异喹啉生物碱的方法与流程
本申请要求于2016年10月18日提交的美国临时申请号62/409,837和于2017年3月17日提交的美国临时申请号62/473,215的权益,以上申请通过引用并入本文。
背景技术:
药用阿片类物质被用于治疗中度至重度疼痛,但可能表现出成瘾性质。由于药用阿片类物质减轻疼痛的机制,这些药物是现代医学中最有效的止痛药之一。然而,此外,药用阿片类物质也被广泛滥用。在解决药用阿片类物质的使用问题方面,决策者的任务是在平衡疼痛治疗不足的同时减少阿片类物质滥用的风险。已证明药物疗法在治疗和预防阿片类物质成瘾方面是有效的,但这些疗法的高成本是治疗方案的范围和延伸的限制因素。
技术实现要素:
本公开内容提供了用于将第一阿片类物质脱甲基化为第二阿片类物质的方法。本公开内容进一步提供了用于将阿片类物质脱甲基化为去甲阿片类物质的方法。另外,本公开内容提供了用于将阿片类物质改变为nal-阿片类物质的方法。此外,本公开内容提供了工程化细胞,用于由存在于所述工程化细胞内的阿片类物质产生去甲阿片类物质。本公开内容还提供了工程化细胞,用于由存在于所述工程化细胞内的去甲阿片类物质产生nal-阿片类物质。
本发明的一个方面提供了将第一阿片类物质脱甲基化为第二阿片类物质的方法。所述方法包括使所述第一阿片类物质与至少一种酶接触,其中使所述第一阿片类物质与所述至少一种酶接触通过失去o-连接的甲基基团将所述第一阿片类物质转化为第二阿片类物质,其中所述第一阿片类物质不选自可待因和蒂巴因。
本发明的另一方面提供了将阿片类物质脱甲基化为去甲阿片类物质的方法。所述方法包括使第一阿片类物质与至少一种酶接触,其中使所述第一阿片类物质与所述至少一种酶接触通过失去o-连接的甲基基团将所述第一阿片类物质转化为第二阿片类物质。所述方法还包括使所述第二阿片类物质与至少一种酶接触,其中使所述阿片类物质与所述至少一种酶接触通过失去n-连接的甲基基团将所述第二阿片类物质转化为去甲阿片类物质。
本发明的另一方面提供了另一种将阿片类物质脱甲基化为去甲阿片类物质的方法。所述方法包括使所述阿片类物质与至少一种酶接触,其中使所述阿片类物质与所述至少一种酶接触通过从所述阿片类物质中去除n-连接的甲基基团将所述阿片类物质转化为去甲阿片类物质,其中当所述阿片类物质与所述至少一种酶在体外接触时,所述阿片类物质不是蒂巴因。
本发明的另一方面提供了将阿片类物质改变为nal-阿片类物质的方法。所述方法包括使所述阿片类物质与至少第一酶接触,其中使所述阿片类物质与所述至少第一酶接触通过从所述阿片类物质中去除n-连接的甲基基团将所述阿片类物质转化为去甲阿片类物质。所述方法还包括使所述去甲阿片类物质与至少第二酶接触,其中在辅因子存在下使所述去甲阿片类物质与所述至少第二酶接触通过从所述辅因子转移侧链将所述去甲阿片类物质转化为nal-阿片类物质。
本发明的另一方面提供了另一种将阿片类物质改变为nal-阿片类物质的方法。所述方法包括使第一阿片类物质与至少一种酶接触,其中使所述第一阿片类物质与所述至少一种酶接触通过失去o-连接的甲基基团将所述第一阿片类物质转化为第二阿片类物质。所述方法还包括使所述第二阿片类物质与至少第二酶接触,其中使所述阿片类物质与所述至少第二酶接触通过失去n-连接的甲基基团将所述第二阿片类物质转化为去甲阿片类物质。另外,所述方法包括使所述去甲阿片类物质与至少第三酶接触,其中在辅因子存在下使所述去甲阿片类物质与所述至少第三酶接触通过从所述辅因子转移侧链将所述去甲阿片类物质转化为nal-阿片类物质。
本发明的另一方面提供了工程化细胞,其由存在于所述工程化细胞内的阿片类物质产生去甲阿片类物质,所述工程化细胞包含编码由所述工程化细胞产生的n-脱甲基酶的异源编码序列,其中所述n-脱甲基酶将所述工程化细胞内的阿片类物质转化为所述去甲阿片类物质,并且其中在所述工程化细胞内产生所述去甲阿片类物质。
本发明的进一步方面提供了工程化细胞,其由存在于所述工程化细胞内的去甲阿片类物质产生nal-阿片类物质,所述工程化细胞包含编码由所述工程化细胞产生的n-甲基转移酶的异源编码序列,其中所述n-甲基转移酶将所述工程化细胞内的去甲阿片类物质转化为所述nal-阿片类物质。
援引并入
本说明书中所提到的所有出版物、专利和专利申请均通过引用并入本文,其程度如同特别地且单独地指出每个单独的出版物、专利或专利申请通过引用而并入。
附图说明
本发明的新颖特征在所附的权利要求书中具体阐述。通过参考以下对利用本发明原理的说明性实施方案加以阐述的详细描述和附图,将会获得对本发明的特征和优点的更好的理解,在这些附图中:
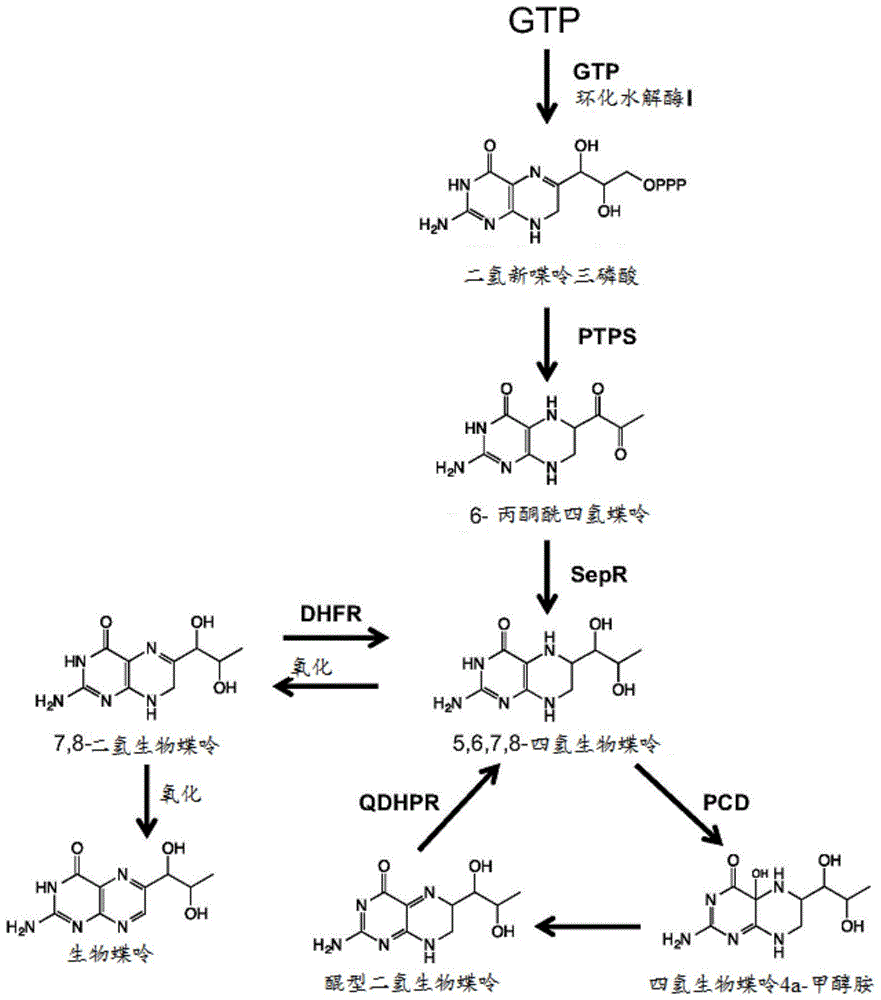
图1示出了根据本发明的实施方案,四氢生物蝶呤的合成、再循环和补救途径的示例。
图2示出了根据本发明的实施方案,用于将葡萄糖转化为4-hpa、多巴胺和3,4-dhpa的生物合成方案。
图3示出了根据本发明的实施方案,(r)-1-苄基异喹啉生物碱形成的示意性示例。
图4示出了根据本发明的实施方案,cyp-cor酶的氨基酸序列。
图5示出了根据本发明的实施方案,用于通过去甲乌药碱(norcoclaurine)将l-酪氨酸转化为牛心果碱(reticuline)的生物合成方案。
图6示出了根据本发明的实施方案,用于通过全去甲劳丹碱(norlaudanosoline)将l-酪氨酸转化为牛心果碱的生物合成方案。
图7示出了根据本发明的实施方案,用于将l-酪氨酸转化为吗啡喃生物碱的生物合成方案。
图8示出了根据本发明的实施方案,用于产生半合成的阿片类物质的生物合成方案。
图9示出了根据本发明的实施方案,改善在工程化酵母菌株中由糖产生牛心果碱的酪氨酸羟化酶突变体。
图10示出了根据本发明的实施方案,改善在工程化酵母菌株中通过酪氨酸羟化酶的l-dopa产生的二氢叶酸还原酶(dhfr)的共表达。
图11a示出了向培养基中添加抗氧化剂改善在工程化酵母菌株中通过酪氨酸羟化酶的l-dopa产生。
图11b示出了根据本发明的实施方案,向培养基中添加抗氧化剂提高bh4水平。
图12a示出了将l-酪氨酸转化为双bia的生物合成方案。
图12b示出了根据本发明的实施方案,被工程化以生物合成双bia的酵母菌株。
图13示出了根据本发明的实施方案,细胞色素p450氧化酶-可待因酮还原酶样(cyp-cor)融合物的系统树。
图14示出了根据本发明的实施方案,被工程化以将(s)-牛心果碱转化为沙罗泰里啶(salutaridine)的酵母菌株的lc/ms-ms分析。图14a示出了显示牛心果碱和沙罗泰里啶针对两种差向异构酶变体(cyp-cor_89405、cyp-cor_4328)以及标准品的色谱图迹线。图14b示出了重新作图以展示与标准品的共洗脱的(a)中的沙罗泰里啶的相同色谱图迹线。
图15示出了根据本发明的实施方案,被工程化以将外消旋的全去甲劳丹碱转化为(r)-牛心果碱的酵母菌株的手性lc/ms-ms分析。
图16a示出了异源表达的沙罗泰里啶合酶的n-连接的糖基化状态。
图16b示出了根据本发明的实施方案,当在酵母而不是植物中异源表达时观察到的消除蛋白质的n-连接的糖基化的沙罗泰里啶合酶的工程化融合物。
图17a和图17b示出了根据本发明的实施方案,碎叶紫堇碱(cheilanthifoline)合酶-沙罗泰里啶合酶的融合设计。
图18示出了根据本发明的实施方案,改善在酵母中的活性的沙罗泰里啶合酶密码子优化和工程化融合物。
图19a和图19b示出了根据本发明的实施方案,小规模分批发酵的lc/ms-ms分析,其中工程化酵母催化(r)-牛心果碱转化为蒂巴因和外消旋-全去甲劳丹碱转化为蒂巴因。
图20示出了根据本发明的实施方案,通过随机诱变和筛选生成在酵母中表现出增强活性的codm酶变体。
图21a、图21b和图21c示出了根据本发明的实施方案,通过工程化酵母将(r)-牛心果碱转化为蒂巴因的发酵优化。
图22示出了根据本发明的实施方案,用于由l-酪氨酸产生关键的分支点中间体牛心果碱的酵母平台菌株。
图23示出了根据本发明的实施方案,具有阿片类物质3-o-脱甲基酶活性的酶。
图24示出了根据本发明的实施方案,具有阿片类物质n-脱甲基酶活性的酶。
图25示出了根据本发明的实施方案,具有n-甲基转移酶活性的酶。
图26示出了根据本发明的实施方案,微生物细胞中的生物合成方案。
图27示出了根据本发明的实施方案,bm3变体的功能表达。
图28示出了根据本发明的实施方案,用于酶表达和工程化的质粒/yac载体。
图29示出了根据本发明的实施方案,codm的功能表达。
图30示出了根据本发明的实施方案,用于产生半合成的阿片类物质的生物合成方案。
具体实施方式
nal-阿片类物质是用于对抗阿片类物质成瘾和阿片类物质相关副作用的一类重要的药物疗法。类似可待因和吗啡等阿片类物质是来自鸦片罂粟(opiumpoppy)的植物分子,其具有独特的五元环结构,使它们在脑、脊柱、肠道和外周传感器中结合μ-阿片类受体并模拟身体对疼痛的自然减弱。可对这些相同的阿片剂分子进行修饰以充当拮抗剂,例如纳曲酮和纳洛酮。在一些实例中,可通过引入允许与阿片类受体结合但阻止下游信号传导反应激活的化学修饰来修饰阿片类分子。其他分子,如丁丙诺啡,可与阿片类受体结合并充当混合部分激动剂。
拮抗剂和混合部分激动剂阿片类物质的套组统称为nal-阿片类物质,可形成竞争性调节剂的工具包,其可在已摄入强阿片类激动剂的患者中占据受体结合位点。例如,在成瘾的患者群体中,nal-阿片类物质可用于:(1)治疗过量,通过施用强拮抗剂如纳洛酮;(2)解毒,通过用混合部分激动剂如丁丙诺啡管理症状;和/或(3)维持,通过例如用丁丙诺啡/纳洛酮组合药物阻断奖励反应。在患有严重疼痛的患者群体中,nal-阿片类物质可用于:(4)预防,例如通过滥用威慑性组合的激动剂/拮抗剂制剂,如吗啡/纳曲酮组合,当药物被误用时可阻止欣快和中毒;和/或(5)减少副作用,通过施用外周作用的拮抗剂(例如,纳洛酮的聚合物缀合物(movantiktm)),该拮抗剂可从肠道中的受体取代阿片类激动剂,在肠道中该阿片类激动剂可引起便秘。
用于nal-阿片类物质合成的原始起始材料是从鸦片罂粟药物作物中提取的天然阿片剂,如蒂巴因。传统上,这些分子接着通过一系列低效的反应步骤被化学修饰为半合成的拮抗剂、弱激动剂和混合部分激动剂,该反应步骤需要使用催化剂、溶剂、试剂和纯化方法以从起始材料和反应中间体中分离nal-阿片类物质产物。目前的半合成生产方法效率较低,并且给整个过程增加了大量成本。
本公开内容提供了用于在工程化宿主细胞中产生各种nal-阿片类物质的方法。本公开内容还提供了用于在工程化宿主细胞中产生各种去甲阿片类物质的方法。另外,本公开内容提供了用于在工程化宿主细胞中产生o-脱甲基酶和n-脱甲基酶的方法。在特定情况下,本公开内容提供了用于通过阿片类物质到去甲阿片类物质的脱甲基化而在工程化宿主细胞中产生去甲阿片类产物的方法。在另外的特定情况下,本公开内容提供了用于通过采用能够添加n-连接的侧链的酶如n-甲基转移酶修饰去甲阿片类物质来产生各种nal-阿片类物质的方法。
本公开内容提供了用于在工程化宿主细胞中产生nal-阿片类和去甲阿片类化合物的方法。在整个本公开内容中,术语“化合物”可用于指包含两种或更多种元素的物质,例如nal-阿片类分子或nal-阿片类组合物。nal-阿片类化合物可以指很大程度上纯的nal-阿片类组合物,或者可含有或不含有杂质的nal-阿片类组合物。
感兴趣的nal-阿片类物质
提供了产生感兴趣的bia的宿主细胞。在一些实例中,宿主细胞的工程化菌株如本文所讨论的实施方案的工程化菌株可提供用于产生感兴趣的nal-阿片类物质的平台,该感兴趣的nal-阿片类物质包括但不限于:纳曲酮、纳洛酮、纳美芬、纳洛芬(nalorphine)、烯丙吗啡(nalorphine)、nalodeine、naldemedine、纳洛昔醇(naloxegol)、6β-纳曲醇、纳曲吲哚、甲基纳曲酮、methylsamidorphan、爱维莫潘、axelopran、bevenpran、二烟酸酯、左洛啡烷、samidorphan、丁丙诺啡、地佐辛、依他佐辛、布托啡诺、左啡诺、纳布啡、喷他佐辛、非那佐辛、norbinaltorphimine和二丙诺啡。
感兴趣的去甲阿片类物质
提供了产生感兴趣的去甲阿片类物质的宿主细胞。在一些实例中,宿主细胞的工程化菌株如本文所讨论的实施方案的工程化菌株可提供用于产生感兴趣的去甲阿片类物质的平台,该感兴趣的去甲阿片类物质包括但不限于:去甲可待因、去甲羟考酮、去甲蒂巴因、去甲氢可酮、去甲二氢可待因、去甲-14-羟基-可待因、去甲可待因酮、去甲-14-羟基-可待因酮、去甲吗啡、去甲羟吗啡酮、去甲东罂粟碱、去甲氢吗啡酮、去甲二氢吗啡、去甲-14-羟基-吗啡、去甲吗啡酮、去甲-14-羟基-吗啡酮。
感兴趣的苄基异喹啉生物碱(bia)
提供了产生感兴趣的bia的宿主细胞。在一些实例中,宿主细胞的工程化菌株如本文所讨论的实施方案的工程化菌株可提供用于产生跨越若干结构种类的感兴趣的苄基异喹啉生物碱及其修饰物的平台,所述种类包括但不限于前体bia、苄基异喹啉类、原吗啡喃类(promorphinans)、吗啡喃类等等。这些种类中的每一种旨在包括可产生该种类的成员的工程化宿主细胞生物合成途径的任何适宜成员的生物合成前体、中间体及其代谢物。对于这些结构种类中的每一种,在下文给出化合物的非限制性实例。在一些情况下,给定实例的结构本身可以表征为或可以不表征为苄基异喹啉生物碱。在一些情况下,本发明的化学实体旨在包括所有可能的异构体,包括单一对映体、外消旋混合物、光学纯形式、非对映体的混合物和中间体混合物。
bia前体可包括但不限于去甲乌药碱(nc)和全去甲劳丹碱(nl),以及nc和nl前体,如酪氨酸、酪胺、4-羟基苯乙醛(4-hpa)、4-羟基苯丙酮酸(4-hppa)、l-3,4-二羟基苯丙氨酸(l-dopa)、3,4-二羟基苯乙醛(3,4-dhpa)和多巴胺。在一些实施方案中,一种或多种bia前体为3,4-二羟基苯乙醛(3,4-dhpa)和多巴胺。在某些情况下,一种或多种bia前体为4-羟基苯乙醛(4-hpa)和多巴胺。具体地讲,nl和nc可通过pictet-spengler缩合反应由前体分子分别合成,其中反应可自发发生或者可通过任何适宜的酶催化。
苄基异喹啉类可包括但不限于去甲乌药碱、全去甲劳丹碱、乌药碱、3’-羟基乌药碱、4’-o-甲基全去甲劳丹碱、4’-o-甲基-全劳丹碱、n-甲基去甲乌药碱、全劳丹碱(laudanosoline)、n-甲基乌药碱、3’-羟基-n-甲基乌药碱、牛心果碱、去甲牛心果碱、罂粟碱、劳丹碱、劳丹素、四氢罂粟碱、1,2-二氢罂粟碱和东罂粟灵(orientaline)。
原吗啡喃类可包括但不限于沙罗泰里啶、沙罗泰里啶醇和沙罗泰里啶醇-7-o-乙酸酯。
吗啡喃类可包括但不限于蒂巴因、可待因酮、可待因、吗啡、吗啡酮、东罂粟碱、尼奥品酮(neopinone)、尼奥品、尼奥吗啡(neomorphine)、氢可酮、二氢可待因、14-羟基可待因酮、羟考酮、14-羟基可待因、吗啡酮、氢吗啡酮、二氢吗啡、二氢埃托啡、乙基吗啡、埃托啡、美托酮、丁丙诺啡、福尔可定和异可待因(heterocodeine)。
宿主细胞
可在主题宿主细胞和方法中利用任何适宜的细胞。在一些情况下,宿主细胞为非植物细胞。在一些情况下,宿主细胞可表征为微生物细胞。在某些情况下,宿主细胞为昆虫细胞、脊椎动物细胞、哺乳动物细胞、植物细胞、真菌细胞、细菌细胞或酵母细胞。任何适宜类型的宿主细胞可被用于产生主题去甲阿片类物质或nal-阿片类物质产生细胞,参见例如,us2008/0176754和us2014/0273109,其公开内容通过引用以其全文并入。感兴趣的宿主细胞包括但不限于细菌细胞如枯草芽孢杆菌(bacillussubtilis)、大肠杆菌(escherichiacoli)、链霉菌属(streptomyces)和鼠伤寒沙门氏菌(salmonellatyphimuium)细胞,昆虫细胞如黑腹果蝇(drosophilamelanogaster)s2和草地夜蛾(spodopterafrugiperda)sf9细胞,哺乳动物细胞如hela和293细胞,植物细胞如烟草by-2细胞,以及酵母细胞如酿酒酵母(saccharomycescerevisiae)、粟酒裂殖酵母(schizosaccharomycespombe)和巴斯德毕赤酵母(pichiapastoris)细胞。在一些实例中,宿主细胞为酵母细胞或大肠杆菌细胞。在一些情况下,宿主细胞为酵母细胞。在一些情况下,宿主细胞来自被工程化以产生感兴趣的去甲阿片类或nal-阿片类bia,如去甲蒂巴因或纳洛酮的酵母菌株。在一些情况下,宿主细胞来自被工程化以产生感兴趣的酶的酵母菌株。在一些情况下,宿主细胞来自被工程化以产生o-脱甲基酶的酵母菌株。该o-脱甲基酶可以能够将底物如第一阿片类物质转化为第二阿片类物质。在一些情况下,宿主细胞来自被工程化以产生n-脱甲基酶的酵母菌株。该n-脱甲基酶可以能够将底物如第二阿片类物质转化为去甲阿片类物质。在一些情况下,宿主细胞来自被工程化以产生甲基转移酶的酵母菌株。另外,该甲基转移酶可以能够将去甲阿片类物质转化为nal-阿片类物质。在一些情况下,宿主细胞来自被工程化以产生差向异构酶的酵母菌株。该差向异构酶可具有氧化酶和还原酶。另外,该差向异构酶可以能够将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱。此外,差向异构酶可被分离成保持氧化酶或还原酶活性的更小的酶,以便用于将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱。
smolke等人的us2008/0176754和us2014/0273109中所述的任何宿主细胞可适用于主题细胞和方法。在某些实施方案中,酵母细胞可以是酿酒酵母(s.cerevisiae)物种。在某些实施方案中,酵母细胞可以是粟酒裂殖酵母物种。在某些实施方案中,酵母细胞可以是巴斯德毕赤酵母物种。酵母作为感兴趣的宿主细胞是因为细胞色素p450蛋白能够正确地折叠到内质网膜中,使得它们的活性得以保持。在实例中,细胞色素p450蛋白参与一些感兴趣的生物合成途径。在另外的实例中,细胞色素p450蛋白参与感兴趣的bia如纳洛酮或纳曲酮的产生。在进一步的实例中,细胞色素p450蛋白参与感兴趣的酶如具有氧化酶和还原酶的差向异构酶的产生。
可用于本发明的感兴趣的酵母菌株包括但不限于:cen.pk(基因型:mata/αura3-52/ura3-52trp1-289/trp1-289leu2-3_112/leu2-3_112his3δ1/his3δ1mal2-8c/mal2-8csuc2/suc2)、s288c、w303、d273-10b、x2180、a364a、∑1278b、ab972、sk1和fl100。在某些情况下,酵母菌株是以下中的任一种:s288c(matα;suc2malmelgal2cup1flo1flo8-1hap1)、by4741(matα;his3δ1;leu2δ0;met15δ0;ura3δ0)、by4742(matα;his3δ1;leu2δ0;lys2δ0;ura3δ0)、by4743(mata/matα;his3δ1/his3δ1;leu2δ0/leu2δ0;met15δ0/met15;lys2/lys2δ0;ura3δ0/ura3δ0)以及wat11或w(r),w303-b菌株(mata;ade2-1;his3-11、-15;leu2-3、-112;ura3-1;canr;cyr+)的衍生物,两者分别表达拟南芥(arabidopsisthaliana)nadph-p450还原酶atr1和酵母nadph-p450还原酶cpr1。在另一个实施方案中,酵母细胞是w303α(matα;his3-11,15trp1-1leu2-3ura3-1ade2-1)。另外的感兴趣的酵母菌株的身份和基因型可见于euroscarf(web.uni-frankfurt.de/fb15/mikro/euroscarf/col_index.html)。
在一些情况下,宿主细胞是真菌细胞。在某些实施方案中,真菌细胞可以是曲霉属(aspergillus)物种,并且菌株包括黑曲霉(aspergillusniger)(atcc1015、atcc9029、cbs513.88)、米曲霉(aspergillusoryzae)(atcc56747、rib40)、土曲霉(aspergillusterreus)(nih2624、atcc20542)和构巢曲霉(aspergillusnidulans)(fgsca4)。
在某些实施方案中,异源编码序列可经密码子优化以在曲霉属物种中表达并由适当的启动子表达。在某些实施方案中,启动子可选自磷酸甘油酸激酶启动子(pgk)、mbfa启动子、细胞色素c氧化酶亚单位启动子(coxa)、srpb启动子、tvda启动子、苹果酸脱氢酶启动子(mdha)、β-甘露糖苷酶启动子(manb)。在某些实施方案中,终止子可选自葡糖淀粉酶终止子(glaa)或trpc终止子。在某些实施方案中,由启动子、异源编码序列和终止子组成的表达盒可由质粒表达或整合到宿主的基因组中。在某些实施方案中,可用抗生素选择如潮霉素或者氮源利用如使用乙酰胺作为唯一的氮源进行维持质粒或整合盒的细胞的选择。在某些实施方案中,可使用已建立的转化方法如原生质体转化、乙酸锂或电穿孔将dna构建体引入宿主细胞中。在某些实施方案中,在进行或不进行选择的情况下,可以在液体me或固体mea(3%麦芽提取物、0.5%蛋白胨和±1.5%琼脂)中或在vogel基本培养基中培养细胞。
在一些情况下,宿主细胞是细菌细胞。细菌细胞可选自任何细菌属。细菌细胞可来自的属的实例包括鱼腥蓝细菌属(anabaena)、节杆菌属(arthrobacter)、醋杆菌属(acetobacter)、醋酸杆菌属(acetobacterium)、芽孢杆菌属(bacillus)、双歧杆菌属(bifidobacterium)、短状杆菌属(brachybacterium)、短杆菌属(brevibacterium)、肉杆菌属(carnobacterium)、梭菌属(clostridium)、棒杆菌属(corynebacterium)、肠杆菌属(enterobacter)、埃希氏菌属(escherichia)、葡糖酸醋酸杆菌属(gluconacetobacter)、葡糖杆菌属(gluconobacter)、哈夫尼菌属(hafnia)、盐单胞菌属(halomonas)、克雷伯氏菌属(klebsiella)、考克氏菌属(kocuria)、乳杆菌属(lactobacillus)、明串珠菌属(leucononstoc)、巨球菌属(macrococcus)、甲基单胞菌属(methylomonas)、甲基细菌属(methylobacter)、甲基细胞菌属(methylocella)、甲基球菌属(methylococcus)、微杆菌属(microbacterium)、微球菌属(micrococcus)、微囊蓝细菌属(microcystis)、穆尔氏菌属(moorella)、酒球菌属(oenococcus)、片球菌属(pediococcus)、原绿球蓝细菌属(prochlorococcus)、丙酸杆菌属(propionibacterium)、变形菌属(proteus)、假交替单胞菌属(pseudoalteromonas)、假单胞菌属(pseudomonas)、嗜冷杆菌属(psychrobacter)、红细菌属(rhodobacter)、红球菌属(rhodococcus)、红假单胞菌属(rhodopseudomonas)、沙雷氏菌属(serratia)、葡萄球菌属(staphylococcus)、链球菌属(streptococcus)、链霉菌属(streptomyces)、聚球蓝细菌属(synechococcus)、集胞蓝细菌属(synechocystis)、四联球菌属(tetragenococcus)、魏斯氏菌属(weissella)和发酵单胞菌属(zymomona)。可与本公开内容的方法一起使用的细菌物种的实例包括烟草节杆菌(arthrobacternicotianae)、醋化醋杆菌(acetobacteraceti)、阿氏节杆菌(arthrobacterarilaitensis)、蜡状芽孢杆菌(bacilluscereus)、凝结芽孢杆菌(bacilluscoagulans)、地衣芽孢杆菌(bacilluslicheniformis)、短小芽孢杆菌(bacilluspumilus)、球形芽孢杆菌(bacillussphaericus)、嗜热脂肪芽孢杆菌(bacillusstearothermophilus)、枯草芽孢杆菌(bacillussubtilis)、青春双歧杆菌(bifidobacteriumadolescentis)、奶酪发酵小短状杆菌(brachybacteriumtyrofermentans)、扩展短杆菌(brevibacteriumlinens)、广布肉杆菌(carnobacteriumdivergens)、微黄棒杆菌(corynebacteriumflavescens)、屎肠球菌(enterococcusfaecium)、欧罗巴葡糖酸醋酸杆菌(gluconacetobactereuropaeus)、约翰娜葡糖酸醋酸杆菌(gluconacetobacterjohannae)、氧化葡糖杆菌(gluconobacteroxydans)、蜂房哈夫尼菌(hafniaalvei)、伸长盐单胞菌(halomonaselongata)、嗜根考克氏菌(kocuriarhizophila)、酸粉乳杆菌(lactobacillusacidifarinae)、詹氏乳杆菌(lactobacillusjensenii)、乳酸乳球菌(lactococcuslactis)、果汁乳杆菌(lactobacillusyamanashiensis)、柠檬明串珠菌(leuconostoccitreum)、溶酪巨球菌(macrococcuscaseolyticus)、叶片微杆菌(microbacteriumfoliorum)、里拉微球菌(micrococcuslylae)、酒酒球菌(oenococcusoeni)、乳酸片球菌(pediococcusacidilactici)、产丙酸丙酸杆菌(propionibacteriumacidipropionici)、普通变形菌(proteusvulgaris)、荧光假单胞菌(pseudomonasfluorescens)、速生嗜冷杆菌(psychrobacterceler)、调料葡萄球菌(staphylococcuscondimenti)、唾液链球菌嗜热亚种(streptococcusthermophilus)、灰色链霉菌(streptomycesgriseus)、嗜盐四联球菌(tetragenococcushalophilus)、食窦魏斯氏菌(weissellacibaria)、高丽魏斯氏菌(weissellakoreensis)、运动发酵单胞菌(zymomonasmobilis)、谷氨酸棒杆菌(corynebacteriumglutamicum)、两岐/短/长双岐杆菌(bifidobacteriumbifidum/breve/longum)、浅青紫链霉菌(streptomyceslividans)、天蓝色链霉菌(streptomycescoelicolor)、植物乳杆菌(lactobacillusplantarum)、清酒乳杆菌(lactobacillussakei)、干酪乳杆菌(lactobacilluscasei)、柠檬假交替单胞菌(pseudoalteromonascitrea)、恶臭假单胞菌(pseudomonasputida)、扬氏/醋酸/丙酮丁醇/拜氏/丁酸梭菌(clostridiumljungdahlii/aceticum/acetobutylicum/beijerinckii/butyricum)以及热纤/热醋穆尔氏菌(moorellathemocellum/thermoacetica)。
在某些实施方案中,细菌细胞可以是大肠杆菌菌株。在某些实施方案中,大肠杆菌菌株可选自bl21、dh5α、xl1-blue、hb101、bl21和k12。在某些实施方案中,异源编码序列可经密码子优化以在大肠杆菌中表达并由适当的启动子表达。在某些实施方案中,启动子可选自t7启动子、tac启动子、trc启动子、四环素诱导型启动子(tet)、lac操纵子启动子(lac)、laco1启动子。在某些实施方案中,由启动子、异源编码序列和终止子组成的表达盒可由质粒表达或整合到基因组中。在某些实施方案中,质粒选自puc19或pbad。在某些实施方案中,可用抗生素选择如卡那霉素、氯霉素、链霉素、壮观霉素、庆大霉素、红霉素或氨苄青霉素进行维持质粒或整合盒的细胞的选择。在某些实施方案中,可以使用已建立的转化方法如缀合、热休克化学转化或电穿孔将dna构建体引入宿主细胞中。在某些实施方案中,可在有或没有抗生素的情况下,在37℃下在液体luria-bertani(lb)培养基中培养细胞。
在某些实施方案中,细菌细胞可以是枯草芽孢杆菌菌株。在某些实施方案中,枯草芽孢杆菌菌株可选自1779、gp25、ro-nn-1、168、bsn5、best195、1a382和62178。在某些实施方案中,异源编码序列可经密码子优化以在芽孢杆菌属物种中表达并由适当的启动子表达。在某些实施方案中,启动子可选自grac启动子、p43启动子或trnq启动子。在某些实施方案中,由启动子、异源编码序列和终止子组成的表达盒可由质粒表达或整合到基因组中。在某些实施方案中,质粒选自php13、pe194、pc194、pht01或pht43。在某些实施方案中,整合载体如pdg364或pdg1730可用于将表达盒整合到基因组中。在某些实施方案中,可用抗生素选择如红霉素、卡那霉素、四环素和壮观霉素进行维持质粒或整合盒的细胞的选择。在某些实施方案中,可使用已建立的转化方法如自然感受态、热休克或化学转化将dna构建体引入宿主细胞中。在某些实施方案中,可在37℃下在液体luria-bertani(lb)培养基中或在m9培养基加葡萄糖和色氨酸中培养细胞。
对宿主细胞的遗传修饰
宿主细胞可被工程化以包含一个或多个修饰(诸如两个或更多个、三个或更多个、四个或更多个、五个或更多个乃至更多修饰),其提供感兴趣的bia的产生。另外地或备选地,宿主细胞可被工程化以包含一个或多个修饰(诸如两个或更多个、三个或更多个、四个或更多个、五个或更多个乃至更多修饰),其提供感兴趣的酶的产生。在一些情况下,修饰为遗传修饰,如基因或其片段的突变、添加或缺失,或者基因或其片段的转录调控。如本文所用,术语“突变”是指相对于参考序列或基序,氨基酸残基或核苷酸残基的缺失、插入或置换。突变可作为原始基因座处的天然基因的定向突变而并入。在一些情况下,突变可作为在单独基因座处作为遗传整合引入的基因的另外拷贝或者作为附加型载体如2μ或着丝粒质粒上的另外拷贝而并入。在某些情况下,酶的底物抑制性拷贝处于天然细胞转录调控下。在一些情况下,通过将酶的底物抑制性拷贝置于合成启动子的控制下,从而在工程化的蛋白质表达的组成型或动态调控的情况下引入所述拷贝。在一些实例中,一个或多个修饰的对象可以是天然基因。在一些实例中,一个或多个修饰的对象可以是非天然基因。在一些实例中,非天然基因可插入宿主细胞中。在进一步的实例中,可在非天然基因插入宿主细胞中之前通过一个或多个修饰改变非天然基因。
工程化宿主细胞可过量产生一种或多种感兴趣的去甲阿片类bia。工程化宿主细胞可过量产生一种或多种感兴趣的nal-阿片类bia。过量产生意指,相对于对照细胞(例如,未修饰的细胞),细胞具有改善或增加的感兴趣的去甲阿片类和/或nal-阿片类bia分子的产生。改善或增加的产生意指以下两种情况:在对照不产生感兴趣的去甲阿片类和/或nal-阿片类bia的情况下产生一定量的感兴趣的去甲阿片类和/或nal-阿片类bia,以及在其中对照具有一些感兴趣的去甲阿片类和/或nal-阿片类bia产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可过量产生一种或多种去甲阿片类物质。在一些情况下,工程化宿主细胞可在对照不产生去甲阿片类物质的情况下产生一定量的感兴趣的去甲阿片类物质,以及在其中对照具有一些感兴趣的去甲阿片类物质产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可进一步过量产生一种或多种nal-阿片类物质。在一些情况下,工程化宿主细胞可在对照不产生nal-阿片类物质的情况下产生一定量的感兴趣的nal-阿片类物质,以及在其中对照具有一些感兴趣的nal-阿片类物质产生的情况下增加约10%或更多、诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可过量产生一种或多种感兴趣的bia。过量产生意指,相对于对照细胞(例如,未修饰的细胞),细胞具有改善或增加的感兴趣的bia分子的产生。改善或增加的产生意指以下两种情况:在对照不产生感兴趣的bia的情况下产生一定量的感兴趣的bia,以及在其中对照具有一些感兴趣的bia产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可过量产生一种或多种(s)-1-苄基异喹啉生物碱。在一些情况下,工程化宿主细胞可在对照不产生(s)-1-苄基异喹啉生物碱的情况下产生一定量的感兴趣的(s)-1-苄基异喹啉生物碱,以及在其中对照具有一些感兴趣的(s)-1-苄基异喹啉生物碱产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可进一步过量产生一种或多种(r)-1-苄基异喹啉生物碱。在一些情况下,工程化宿主细胞可在对照不产生(r)-1-苄基异喹啉生物碱的情况下产生一定量的感兴趣的(r)-1-苄基异喹啉生物碱,以及在其中对照具有一些感兴趣的(r)-1-苄基异喹啉生物碱产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。工程化宿主细胞可进一步过量产生吗啡喃和原吗啡喃生物碱中的一种或多种。
在一些情况下,相对于缺乏一个或多个修饰(例如,如本文所述)的对照宿主细胞,工程化宿主细胞能够产生增加量的(r)-牛心果碱。在某些情况下,(r)-牛心果碱增加的量为相对于对照宿主细胞约10%或更多,诸如相对于对照宿主细胞约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多、约2倍或更多、约5倍或更多或甚至约10倍或更多。在一些情况下,(r)-牛心果碱为工程化宿主细胞内的差向异构化反应的产物。在这些情况下,(s)-牛心果碱可以是差向异构化反应的底物。
另外,工程化宿主细胞可过量产生一种或多种感兴趣的酶。过量产生意指,相对于对照细胞(例如,未修饰的细胞),细胞具有改善或增加的感兴趣的酶的产生。改善或增加的产生意指以下两种情况:在对照不产生的情况下产生一定量的感兴趣的酶,以及在其中对照具有一些感兴趣的酶产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可过量产生一种或多种o-脱甲基酶(odm)。可用于本文所述实施方案的odm酶的实例见表3。在一些情况下,工程化宿主细胞可在对照不产生odm酶的情况下产生一定量的odm酶,以及在其中对照具有一些odm酶产生的情况下,增加约10%或更多诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可过量产生一种或多种n-脱甲基酶(ndm)。可用于本文所述实施方案的ndm酶的实例见表4。在一些情况下,工程化宿主细胞可在对照不产生ndm酶的情况下产生一定量的odm酶,以及在其中对照具有一些ndm酶产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可过量产生一种或多种n-甲基转移酶(nmt)。可用于本文所述实施方案的nmt酶的实例见表5。在一些情况下,工程化宿主细胞可在对照不产生nmt酶的情况下产生一定量的nmt酶,以及在其中对照具有一些nmt酶产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可过量产生一种或多种cyp-cor酶。在一些情况下,工程化宿主细胞可在对照不产生cyp-cor酶的情况下产生一定量的cyp-cor酶,以及在其中对照具有一些cyp-cor酶产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
工程化宿主细胞可进一步过量产生衍生自cyp-cor酶的一种或多种酶。在一些情况下,工程化宿主细胞可在对照不产生衍生自cyp-cor酶的酶的情况下产生一定量的衍生自cyp-cor酶的酶,以及在其中对照具有一些衍生自cyp-cor酶的酶产生的情况下增加约10%或更多,诸如约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约80%或更多、约100%或更多,诸如2倍或更多,诸如5倍或更多,包括10倍或更多。
在一些情况下,一个或多个(诸如两个或更多个、三个或更多个或者四个或更多个)修饰可选自:生物合成酶基因中的底物抑制减轻突变;生物合成酶基因中的产物抑制减轻突变;辅因子回收促进机制;生物合成酶基因中的反馈抑制减轻突变;生物合成酶基因中的转录调节修饰;酶基因中的失活突变;差向异构化修饰;双bia生成修饰;以及编码酶的异源编码序列。包含一个或多个修饰的细胞可称为工程化细胞。
底物抑制减轻突变
在一些情况下,工程化宿主细胞是在细胞的一个或多个生物合成酶基因中包含一个或多个底物抑制减轻突变(诸如两个或更多个、三个或更多个、四个或更多个、五个或更多个乃至更多)的细胞。在一些实例中,一个或多个生物合成酶基因对于细胞是天然的(例如,存在于未修饰的细胞中)。在一些实例中,一个或多个生物合成酶基因对于细胞是非天然的。如本文所用,术语“底物抑制减轻突变”是指减轻细胞的底物抑制控制机制的突变。
减轻底物抑制的突变相对于对照细胞减少感兴趣的细胞中受调控的酶的抑制,并且提供水平增加的受调控的化合物或其下游生物合成产物。在一些情况下,减轻受调控的酶的抑制意指抑制的ic50增加2倍或更多,诸如增加3倍或更多、5倍或更多、10倍或更多、30倍或更多、100倍或更多、300倍或更多、1000倍或更多乃至更多。水平增加意指该水平为对照细胞中受调控的化合物或其下游产物的水平的110%或更高,诸如工程化宿主细胞中受调控的化合物或其下游产物的120%或更高、130%或更高、140%或更高、150%或更高、160%或更高、170%或更高、180%或更高、190%或更高或200%或更高,诸如至少3倍或更高、至少5倍或更高、至少10倍或更高乃至更高。
工程化宿主细胞中针对感兴趣的nal-阿片类或去甲阿片类bia或其前体的水平的调控的多种底物抑制控制机制和生物合成酶可被靶向以供底物抑制减轻。工程化宿主细胞可在一个或多个生物合成酶基因中包含一个或多个底物抑制减轻突变。一个或多个突变可位于其中生物合成酶受到调控控制的任何适宜的生物合成酶基因中。在一些实施方案中,一个或多个生物合成酶基因编码一种或多种酪氨酸羟化酶。在某些情况下,一个或多个底物抑制减轻突变存在于生物合成酶基因tyrh中。在一些实施方案中,工程化宿主细胞可在一个或多个生物合成酶基因(诸如表2中所述的那些基因中的一个)中包含一个或多个底物抑制减轻突变。
在某些实施方案中,一个或多个底物抑制减轻突变存在于tyrh基因中。tyrh基因编码酪氨酸羟化酶,该酪氨酸羟化酶是将酪氨酸转化为l-dopa的酶。然而,tyrh受其底物酪氨酸的抑制。诸如在人或大鼠中所见的哺乳动物酪氨酸羟化酶活性可通过缓解底物抑制的tyrh基因的突变来改善。具体而言,可通过tyrh基因中的点突变w166y缓解由酪氨酸造成的底物抑制。tyrh基因中的点突变w166y还可改善酪氨酸羟化酶的辅底物bh4的结合,以催化酪氨酸到l-dopa的反应。tyrh的突变体当在酵母菌株中表达以由糖产生bia时(诸如美国临时专利申请序列号61/899,496中所述的那些)可显著改善bia的产生。
可利用任何适宜数目和类型的突变来减轻底物抑制控制机制。在某些实施方案中,本发明的工程化宿主细胞可在工程化宿主细胞内的一个或多个生物合成酶基因中包含1个或多个、2个或更多个、3个或更多个、4个或更多个、5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个或甚至15个或更多个底物抑制减轻突变,诸如1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个底物抑制减轻突变。
辅因子回收促进机制
在一些情况下,工程化宿主细胞是在细胞的一个或多个生物合成酶基因中包含一种或多种辅因子回收促进机制(诸如两种或更多种、三种或更多种、四种或更多种、五种或更多种乃至更多种)的细胞。在一些实例中,一个或多个生物合成酶基因对于细胞是天然的(例如,存在于未修饰的细胞中)。在一些实例中,一个或多个生物合成酶基因对于细胞是非天然的。如本文所用,术语“辅因子回收促进机制”是指促进细胞的辅因子回收控制机制的机制。
工程化宿主细胞中针对感兴趣的去甲阿片类或nal-阿片类bia或其前体的水平的调控的多种辅因子回收控制机制和生物合成酶可被靶向以供辅因子回收促进。工程化宿主细胞可在一个或多个生物合成酶基因中包含一种或多种辅因子回收促进机制。在实例中,工程化宿主细胞可包含编码二氢叶酸还原酶(dhfr)的异源编码序列。当表达dhfr时,其可将7,8-二氢生物蝶呤(bh2)转化为四氢生物蝶呤(bh4),从而回收bh4作为tyrh辅底物。在一些实例中,工程化宿主细胞可在一个或多个生物合成酶基因(诸如表2中所述的那些基因中的一个)中包含一种或多种辅因子回收促进机制。
可利用任何适宜数目和类型的机制来促进辅因子回收控制机制。在某些实施方案中,本发明的工程化宿主细胞可在工程化宿主细胞内的一个或多个生物合成酶基因中包含1种或多种、2种或更多种、3种或更多种、4种或更多种、5种或更多种、6种或更多种、7种或更多种、8种或更多种、9种或更多种、10种或更多种、11种或更多种、12种或更多种、13种或更多种、14种或更多种或甚至15种或更多种辅因子回收促进机制,诸如1、2、3、4、5、6、7、8、9、10、11、12、13、14或15种辅因子回收促进机制。
产物抑制减轻突变
在一些情况下,工程化宿主细胞是在细胞的一个或多个生物合成酶基因中包含一个或多个产物抑制减轻突变(诸如两个或更多个、三个或更多个、四个或更多个、五个或更多个乃至更多)的细胞。在一些实例中,一个或多个生物合成酶基因对于细胞是天然的(例如,存在于未修饰的细胞中)。在一些实例中,一个或多个生物合成酶基因对于细胞是非天然的。如本文所用,术语“产物抑制减轻突变”是指减轻工程化宿主细胞的短期和/或长期产物抑制控制机制的突变。短期产物抑制是其中在辅底物结合位点处存在竞争性结合的细胞的控制机制。长期产物抑制是其中存在化合物远离期望途径的不可逆结合的细胞的控制机制。
减轻产物抑制的突变相对于对照细胞减少感兴趣的细胞中受调控的酶的抑制,并且提供水平增加的受调控非化合物或其下游生物合成产物。在一些情况下,减轻受调控的酶的抑制意指抑制的ic50增加2倍或更多,诸如增加3倍或更多、5倍或更多、10倍或更多、30倍或更多、100倍或更多、300倍或更多、1000倍或更多或甚至更多。水平增加意指该水平为对照细胞中受调控的化合物或其下游产物的110%或更高,诸如工程化宿主细胞中受调控的化合物或其下游产物的120%或更高、130%或更高、140%或更高、150%或更高、160%或更高、170%或更高、180%或更高、190%或更高或200%或更高,诸如至少3倍或更高、至少5倍或更高、至少10倍或更高乃至更高。
工程化宿主细胞中针对感兴趣的去甲阿片类或nal-阿片类bia的水平的调控的多种产物抑制控制机制和生物合成酶可被靶向以供产物抑制减轻。工程化宿主细胞可在一个或多个生物合成酶基因中包含一个或多个产物抑制减轻突变。突变可位于其中生物合成酶受到调控控制的任何适宜的生物合成酶基因中。在一些实施方案中,一个或多个生物合成酶基因编码一种或多种酪氨酸羟化酶。在某些情况下,一个或多个产物抑制减轻突变存在于生物合成酶基因tyrh中。在一些实施方案中,工程化宿主细胞在一个或多个生物合成酶基因(诸如表2中所述的那些基因中的一个)中包括一个或多个产物抑制减轻突变。
在某些实施方案中,一个或多个产物抑制减轻突变存在于tyrh基因中。tyrh基因编码酪氨酸羟化酶,该酪氨酸羟化酶为将酪氨酸转化为l-dopa的酶。tyrh需要四氢生物蝶呤(bh4)作为辅底物来催化羟化反应。一些微生物菌株,如酿酒酵母,不在天然情况下产生bh4,但是可被工程化用于通过四酶合成和再循环途径产生该底物,如图1中所示。图1示出了根据本发明的实施方案,四氢生物蝶呤的合成、再循环和补救途径的实例。图1提供了以下酶的使用:ptps,丙酮酰四氢蝶呤合酶;sepr,墨蝶呤还原酶;pcd,蝶呤4a-甲醇胺脱水酶;qdhpr,二氢蝶啶还原酶;和dhfr,二氢叶酸还原酶。在图1所示的酶中,酵母合成内源性gtp环化水解酶i。gtp和二氢新蝶呤三磷酸在酵母中天然合成。另外,图1中的其他代谢物不在酵母中天然产生。
tyrh受到其产物l-dopa以及其他儿茶酚胺(特别是多巴胺)的抑制。诸如来自人或大鼠的哺乳动物酪氨酸羟化酶活性可通过缓解产物抑制的突变得到改善。例如,短期产物抑制,诸如在辅底物结合位点处的竞争性结合,可通过tyrh基因上的点突变w166y缓解。具体而言,tyrh基因上的点突变w166y可改善辅底物的结合。另外,用来缓解辅底物结合位点处的竞争性结合的短期产物抑制可通过tyrh基因上的点突变s40d得到改善。短期产物抑制也可通过tyrh基因上的r37e、r38e的联合突变得到改善。具体地讲,r37e、r38e突变可在多巴胺的存在下一起特定改善酪氨酸羟化酶活性。
另外,长期产物抑制可通过tyrh基因上的点突变得到缓解。长期产物抑制缓解可包括儿茶酚胺与铁在活性位点中的不可逆结合,使得存在较少的儿茶酚胺充当酪氨酸羟化酶活性的产物抑制剂。长期产物抑制可分别通过tyrh基因中的突变e332d和y371f得到缓解。
可对突变进行组合(诸如同时两个或三个或更多个突变)来缓解多种类型的底物和产物抑制,从而进一步改善tyrh的活性。tyrh的突变体当在酵母菌株中表达以由糖产生去甲阿片类和/或nal-阿片类bia时(诸如美国临时专利申请序列号61/899,496中所述的那些)可显著改善bia的产生。
可利用任何适宜数目和类型的突变来减轻产物抑制控制机制。在某些实施方案中,本发明的工程化宿主细胞可在工程化宿主细胞内的一个或多个生物合成酶基因中包含1个或多个、2个或更多个、3个或更多个、4个或更多个、5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个或甚至15个或更多个产物抑制减轻突变,诸如1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个产物抑制减轻突变。
反馈抑制减轻突变
在一些情况下,工程化宿主细胞是在细胞的一个或多个生物合成酶基因中包含一个或多个反馈抑制减轻突变(诸如两个或更多个、三个或更多个、四个或更多个、五个或更多个乃至更多个)的细胞。在一些情况下,一个或多个生物合成酶基因对于细胞是天然的(例如,存在于未修饰的细胞中)。另外地或备选地,在一些实例中,一个或多个生物合成酶基因对于细胞是非天然的。如本文所用,术语“反馈抑制减轻突变”是指减轻工程化宿主细胞的反馈抑制控制机制的突变。反馈抑制是其中受调控的化合物的合成途径中的酶在所述化合物积累到一定水平时受到抑制,从而平衡细胞中的化合物的量的细胞控制机制。减轻反馈抑制的突变相对于对照细胞减少工程化宿主细胞中受调控的酶的抑制。以这种方式,工程化宿主细胞提供水平增加的受调控的化合物或其下游生物合成产物。在一些情况下,减轻受调控的酶的抑制意指抑制的ic50增加2倍或更多,诸如增加3倍或更多、5倍或更多、10倍或更多、30倍或更多、100倍或更多、300倍或更多、1000倍或更多或甚至更多。水平增加意指该水平为对照细胞中受调控的化合物或其下游产物的110%或更高,诸如120%或更高、130%或更高、140%或更高、150%或更高、160%或更高、170%或更高、180%或更高、190%或更高或200%或更高,诸如宿主细胞中受调控的化合物或其下游产物的至少3倍或更高、至少5倍或更高、至少10倍或更高或甚至更高。
针对感兴趣的bia的水平的调控的多种反馈抑制控制机制和生物合成酶可被靶向以供宿主细胞中的减轻。宿主细胞可在细胞天然的一个或多个生物合成酶基因中包含一个或多个反馈抑制减轻突变。一个或多个突变可位于其中生物合成酶受到调控控制的任何适宜的生物合成酶基因中。在一些实施方案中,一个或多个生物合成酶基因可编码选自3-脱氧-d-阿拉伯糖-庚酮糖-7-磷酸(dahp)合酶和分支酸变位酶的一种或多种酶。在一些实施方案中,一个或多个生物合成酶基因编码3-脱氧-d-阿拉伯糖-庚酮糖-7-磷酸(dahp)合酶。在一些情况下,一个或多个生物合成酶基因可编码分支酸变位酶。在某些情况下,一个或多个反馈抑制减轻突变可存在于选自aro4和aro7的生物合成酶基因中。在某些情况下,一个或多个反馈抑制减轻突变可存在于生物合成酶基因aro4中。在某些情况下,一个或多个反馈抑制减轻突变存在于生物合成酶基因aro7中。在一些实施方案中,工程化宿主细胞可在一个或多个生物合成酶基因(诸如表2中所述的那些基因中的一个)中包含一个或多个反馈抑制减轻突变。
可利用任何适宜数目和类型的突变来减轻反馈抑制控制机制。如本文所用,术语“突变”是指相对于参考序列或基序,氨基酸残基或核苷酸残基的缺失、插入或置换。突变可作为原始基因座处的天然基因的定向突变而掺入。在一些情况下,突变可作为在单独基因座处作为遗传整合引入的基因的另外拷贝或作为附加型载体如2μ或着丝粒质粒上的另外拷贝而掺入。在某些情况下,酶的反馈抑制性拷贝处于天然细胞转录调控下。在一些情况下,通过将酶的反馈抑制性拷贝置于合成启动子的控制下,从而在工程化的蛋白质表达的组成型或动态调控的情况下引入所述拷贝。
在某些实施方案中,一个或多个反馈抑制减轻突变可存在于aro4基因中。感兴趣的aro4突变可包括但不限于在229位上用亮氨酸置换赖氨酸残基、在166位上用赖氨酸残基置换谷氨酰胺残基,或者如hartmannm等人((2003)procnatlacadsciusa100(3):862-867)或fukuda等人((1992)jfermentbioeng74(2):117-119)所述的突变。在一些情况下,赋予反馈抑制的突变可选自酶突变体的诱变文库。此类选择的实例可包括用过量的酪氨酸拯救培养基中的o-氟-d,l-苯丙氨酸突变酵母菌株的生长或aro3突变酵母菌株的生长,如fukuda等人((1990)breedingofbrewingyeastproducingalargeamountofbeta-phenylethylalcoholandbeta-phenylethylacetate.agrbiolchemtokyo54(1):269-271)所述。
在某些实施方案中,本发明的工程化宿主细胞可在工程化宿主细胞内的一个或多个生物合成酶基因中包含1个或多个、2个或更多个、3个或更多个、4个或更多个、5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个或甚至15个或更多个反馈抑制减轻突变,诸如1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个反馈抑制减轻突变。
转录调节修饰
宿主细胞可包含所述细胞的一个或多个生物合成酶基因的一个或多个转录调节修饰(诸如两个或更多个、三个或更多个、四个或更多个、五个或更多个或甚至更多个修饰)。在一些实例中,一个或多个生物合成酶基因对于细胞是天然的。在一些实例中,一个或多个生物合成酶基因对于细胞是非天然的。细胞的任何适宜的生物合成酶基因可被靶向以供转录调节。转录调节意指相对于对照细胞(例如,未修饰的细胞)调节修饰的细胞中的感兴趣的基因的表达,例如,增加或减少、增强或阻遏。在一些情况下,感兴趣的基因的转录调节包括增加或增强表达。增加或增强表达意指相较于对照,即未修饰的相同细胞中的表达,感兴趣的基因的表达水平增加2倍或更多,诸如5倍或更多,且有时25、50或100倍或更多,并且在某些实施方案中300倍或更多或者更高(例如,通过使用任何适宜的基因表达测定)。或者,在细胞中的感兴趣的基因的表达低至不可检测的情况下,如果表达被增加至可易于检测的水平,则感兴趣的基因的表达水平被认为增加。在某些情况下,感兴趣的基因的转录调节包括减少或阻遏表达。减少或阻遏表达意指相较于对照,感兴趣的基因的表达水平减少2倍或更多,诸如5倍或更多,且有时25、50或100倍或更多,并且在某些实施方案中300倍或更多或者更高。在一些情况下,表达被减少至不可检测的水平。可适于在主题宿主细胞中使用的感兴趣的宿主细胞过程的修饰描述于smolke等人的美国公开号20140273109(14/211,611)中,其公开内容通过引用以其全文并入本文。
任何适宜的生物合成酶基因可被转录调节,并且包括但不限于,图2中所述的那些生物合成酶。具体而言,图2示出了根据本发明的实施方案,用于将葡萄糖转化为4-hpa、多巴胺和3,4-dhpa的生物合成方案。图2中所述的酶的实例包括aro3、aro4、aro1、aro7、tyr1、tyr、tyrh、dodc、mao、aro10、aro9和tkl。在一些情况下,一个或多个生物合成酶基因可选自aro10、aro9和tkl。在一些情况下,一个或多个生物合成酶基因可以是aro10。在某些情况下,一个或多个生物合成酶基因可以是aro9。在一些实施方案中,一个或多个生物合成酶基因可以是tkl。在一些实施方案中,宿主细胞包含对一个或多个基因(诸如表2中描述的那些基因中的一个)的一个或多个转录调节修饰。
在一些实施方案中,转录调节修饰可包括用强启动子置换一个或多个生物合成酶基因的天然启动子,或在强启动子的控制下表达基因的另外的拷贝。驱动感兴趣的基因的表达的启动子可以是组成型启动子或诱导型启动子,条件是所述启动子在宿主细胞中可以是活性的。感兴趣的基因可由其天然启动子表达。另外地或备选地,感兴趣的基因可由非天然启动子表达。虽然不是必要的,但此类启动子在使用它们的宿主中可为中等至高强度的。启动子可以是受调控的或组成型的。在一些实施方案中,可使用不受葡萄糖阻遏的启动子或者在培养基中存在葡萄糖时仅受轻微阻遏的启动子。存在多种合适的启动子,所述启动子的实例包括糖酵解基因的启动子,诸如枯草芽孢杆菌tsr基因(编码果糖二磷酸醛缩酶)的启动子或来自酵母酿酒酵母的gapdh(编码甘油醛-磷酸脱氢酶)启动子(bitterg.a.,meth.enzymol.152:673-684(1987))。其他感兴趣的强启动子包括但不限于面包酵母的adhi启动子(ruohonenl.等人,j.biotechnol.39:193-203(1995))、磷酸盐饥饿诱导的启动子如酵母的pho5启动子(hinnen,a.等人,inyeastgeneticengineering,barr,p.j.等人编著,butterworths(1989))、来自地衣芽孢杆菌(b.licheniformis)的碱性磷酸酶启动子(lee.j.w.k.等人,j.gen.microbiol.137:1127-1133(1991))、gpd1和tef1。感兴趣的酵母启动子包括但不限于诱导型启动子如gal1-10、gal1、gall、gals,阻遏型启动子met25、teto,以及组成型启动子如甘油醛3-磷酸脱氢酶启动子(gpd)、醇脱氢酶启动子(adh)、翻译延长因子-1-α启动子(tef)、细胞色素c-氧化酶启动子(cyc1)、mrp7启动子等。在一些情况下,强启动子为gpd1。在某些情况下,强启动子为tef1。含有可被激素如糖皮质激素、类固醇和甲状腺激素诱导的启动子的自主复制型酵母表达载体也是已知的,并且包括但不限于糖皮质激素反应性元件(gre)和甲状腺激素反应性元件(tre),参见例如,美国专利号7,045,290中描述的那些启动子。可使用含有组成型或诱导型启动子如α因子、醇氧化酶和pgh的载体。另外,任何启动子/增强子组合(根据真核启动子数据库epdb)也可用于驱动感兴趣的基因的表达。应当理解,可选择对宿主细胞具有特异性的任何适宜的启动子,例如大肠杆菌t7启动子、lac启动子或teto启动子。在一些情况下,可使用启动子选择来优化转录,并因此优化酶水平以使产生最大化,同时使能源最小化。
失活突变
工程化宿主细胞可包含所述细胞的酶的一个或多个失活突变(诸如两个或更多个、三个或更多个、四个或更多个、五个或更多个乃至更多个)。包含一个或多个失活突变可修饰工程化宿主细胞的合成途径的通量以增加感兴趣的去甲阿片类或nal-阿片类bia或者产生所述bia的期望的酶或前体的水平。在一些实例中,一个或多个失活突变针对对于细胞天然的酶。另外地或备选地,一个或多个失活突变针对对于细胞非天然的酶。如本文所用,“失活突变”意指细胞的基因或调控性dna序列的一个或多个突变,其中所述突变使由所述感兴趣的基因表达的蛋白质的生物活性失活。在一些情况下,基因对于细胞是天然的。在一些情况下,所述基因编码失活的酶,并且该酶是由宿主细胞产生的感兴趣的去甲阿片类和/或nal-阿片类bia的合成途径的一部分或与所述合成途径连接。在一些情况下,失活突变位于控制感兴趣的基因的调控性dna序列中。在某些情况下,失活突变针对基因的启动子。任何适宜的突变(例如,如本文所述)可用于使感兴趣的基因或调控性dna序列失活。“失活的”或“失活”意指相对于由未突变的对照基因表达的对照蛋白质,由突变基因表达的蛋白质的生物活性被降低10%或更多,诸如20%或更多、30%或更多、40%或更多、50%或更多、60%或更多、70%或更多、80%或更多、90%或更多、95%或更多、97%或更多或者99%或更多。在一些情况下,蛋白质是酶,并且失活突变降低酶的活性。
在一些实例中,工程化宿主细胞在对于细胞天然的酶中包含失活突变。任何适宜的酶可被靶向以供失活。感兴趣的酶可包括但不限于在表2中所述的那些酶,所述酶在工程化宿主细胞的合成途径中的作用倾向于降低感兴趣的去甲阿片类物质或nal-阿片类物质的水平。在一些情况下,所述酶具有葡萄糖-6-磷酸脱氢酶活性。在某些实施方案中,包含失活突变的酶是zwf1。在一些情况下,所述酶具有醇脱氢酶活性。在一些实施方案中,包含失活突变的酶选自选自adh2、adh3、adh4、adh5、adh6、adh7和sfa1。在某些实施方案中,包含失活突变的酶是adh2。在某些实施方案中,包含失活突变的酶是adh3。在某些实施方案中,包含失活突变的酶是adh4。在某些实施方案中,包含失活突变的酶是adh5。在某些实施方案中,包含失活突变的酶是adh6。在某些实施方案中,包含失活突变的酶是adh7。在一些情况下,所述酶具有醛氧化还原酶活性。在某些实施方案中,包含失活突变的酶选自ald2、ald3、ald4、ald5和ald6。在某些实施方案中,包含失活突变的酶是ald2。在某些实施方案中,包含失活突变的酶是ald3。在某些实施方案中,包含失活突变的酶是ald4。在某些实施方案中,包含失活突变的酶是ald5。在某些实施方案中,包含失活突变的酶是ald6。在一些实施方案中,宿主细胞包含表2中描述的一个或多个基因的一个或多个失活突变。
差向异构化修饰
本文提供的一些方法、过程和系统描述了(s)-1-苄基异喹啉生物碱到(r)-1-苄基异喹啉生物碱的转化。这些方法、过程和系统中的一些可包括工程化宿主细胞。在一些实例中,(s)-1-苄基异喹啉生物碱到(r)-1-苄基异喹啉生物碱的转化是底物到各种范围的生物碱的转化的关键步骤。在一些实例中,(s)-1-苄基异喹啉生物碱到(r)-1-苄基异喹啉生物碱的转化包括差向异构化反应。在一些情况下,底物生物碱的差向异构化可通过以下方式进行:将(s)-底物氧化成对应的席夫碱(schiffbase)或亚胺中间体,然后将该中间体立体定向地还原为(r)-产物(如图3中所提供和方案1中大致表示的)。如方案1中所提供的,r1、r2、r3和r4可为h或ch3。r5可为h、oh或och3。
方案1
在一些实例中,(s)-底物到(r)-产物的转化可涉及至少一个氧化反应和至少一个还原反应。在一些情况下,任选地在氧化反应之后进行还原反应。在一些情况下,氧化反应和还原反应中的至少一个在酶的存在下进行。在一些情况下,氧化反应和还原反应中的至少一个通过酶催化。在一些情况下,氧化反应和还原反应两者均在至少一种酶的存在下进行。在一些情况下,至少一种酶可用于催化氧化反应和还原反应。氧化反应和还原反应可由相同的酶催化。
在本文所述的一些方法、过程和系统中,氧化反应可在酶的存在下进行。在一些实例中,酶可以是氧化酶。氧化酶可使用(s)-1-苄基异喹啉作为底物。氧化酶可将(s)-底物转化为对应的亚胺或席夫碱衍生物。氧化酶可被称为1,2-脱氢牛心果碱合酶(drs)。适用于本公开内容的(s)-1-苄基异喹啉生物碱的氧化的酶的非限制性实例包括细胞色素p450氧化酶、2-氧戊二酸依赖性氧化酶和黄素蛋白氧化酶。例如,(s)-四氢原小檗碱氧化酶(stox,e.c1.3.3.8)可将(s)-去甲牛心果碱和其他(s)-1-苄基异喹啉生物碱氧化为1,2-脱氢去甲牛心果碱和其它对应的1,2-脱氢产物。在一些实例中,包含前述实例中的任一个的氧化酶结构域的蛋白质可进行氧化。在一些实例中,氧化酶可催化宿主细胞(诸如如本文所述的工程化宿主细胞)内的氧化反应。
在一些实例中,还原反应可在氧化反应之后进行。还原反应可通过酶进行。在一些实例中,还原酶可使用衍生自1-苄基异喹啉的亚胺或席夫碱作为底物。还原酶可将亚胺或席夫碱衍生物转化为(r)-1-苄基异喹啉。还原酶可被称为1,2-脱氢牛心果碱还原酶(drr)。适用于衍生自(s)-1-苄基异喹啉生物碱的亚胺或席夫碱的还原的酶的非限制性实例包括醛酮还原酶(例如,可待因酮还原酶样酶(ec1.1.1.247))和短链脱氢酶(例如,沙罗泰里啶还原酶样酶(ec1.1.1.248))。在一些实例中,包含前述实例中的任一个的还原酶结构域的蛋白质可进行还原。在进一步的实施方案中,还原是立体定向的。在一些实例中,还原酶可催化宿主细胞(诸如如本文所述的工程化宿主细胞)内的还原反应。
可进行将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的差向异构化反应的酶的实例包括具有氧化酶结构域和还原酶结构域的差向异构酶。具体而言,差向异构酶可具有细胞色素p450氧化酶82y2样结构域。另外,差向异构酶可具有可待因酮还原酶样结构域。此外,具有细胞色素p450氧化酶82y2样结构域并且还具有可待因酮还原酶样结构域的差向异构酶可被称为cyp-cor酶。具体而言,cyp-cor酶可以是融合酶。cyp-cor酶也可被称为drs-drr(脱氢牛心果碱合酶-脱氢牛心果碱还原酶)。
可用于进行(s)-1-苄基异喹啉生物碱到(r)-1-苄基异喹啉生物碱的转化的cyp-cor酶的氨基酸序列的实例提供于图4中。具体而言,图4示出了根据本发明实施方案的cyp-cor酶的氨基酸序列。如图4所示,下划线的文本表示细胞色素p450cyp82y2样结构域(与afb74617.1具有59%同一性)。点状下划线的文本表示醛酮还原酶nadph依赖性可待因酮还原酶样结构域(与acm44066.1具有75%同一性)。cyp-cor酶的另外的氨基酸序列在表1中阐述。用于将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的差向异构酶的氨基酸序列可与如表1中列出的给定氨基酸序列75%或更多相同。例如,这样的差向异构酶的氨基酸序列可包含与如本文提供的氨基酸序列至少75%或更多、80%或更多、81%或更多、82%或更多、83%或更多、84%或更多、85%或更多、86%或更多、87%或更多、88%或更多、89%或更多、90%或更多、91%或更多、92%或更多、93%或更多、94%或更多、95%或更多、96%或更多、97%或更多、98%或更多或者99%或更多相同的氨基酸序列。另外,在某些实施方案中,“相同的”氨基酸序列在氨基酸水平上与特定的氨基酸序列包含至少80%-99%的同一性。在一些情况下,“相同的”氨基酸序列在氨基酸水平上包含至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%和更多的同一性,在某些情况下,包含至少95%、96%、97%、98%和99%的同一性。在一些情况下,氨基酸序列可以是相同的,但是dna序列有所改变,例如以优化宿主生物体的密码子使用。
可提供产生将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的差向异构酶的工程化宿主细胞,其中差向异构酶包含选自以下的氨基酸序列:seqidno:1、2、3、4、5、6、7、8、9、10、11、12、13、14和15。可回收和纯化在工程化宿主细胞内产生的差向异构酶,以便形成生物催化剂。在一些情况下,差向异构酶可分裂成一种或多种酶。另外,可从工程化宿主细胞中回收通过分裂差向异构酶产生的一种或多种酶。由分裂差向异构酶产生的这一种或多种酶也可用于催化(s)-1-苄基异喹啉生物碱到(r)-1-苄基异喹啉生物碱的转化。具体而言,从产生差向异构酶的工程化宿主细胞中回收的一种或多种酶可用于将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的过程中。所述过程可包括使(s)-1-苄基异喹啉生物碱与足以将所述(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的量的差向异构酶接触。在实例中,(s)-1-苄基异喹啉生物碱可与足量的所述一种或多种酶接触,使得至少5%的所述(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱。在进一步的实例中,(s)-1-苄基异喹啉生物碱可与足量的所述一种或多种酶接触,使得至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少82%、至少84%、至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.7%或100%的所述(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱。
可用于将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的一种或多种酶可在体外接触(s)-1-苄基异喹啉生物碱。另外地或备选地,可用于将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的一种或多种酶可在体内接触(s)-1-苄基异喹啉生物碱。另外,可用于将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱的一种或多种酶可提供给在其中具有(s)-1-苄基异喹啉生物碱的细胞,或者可在工程化宿主细胞内产生。
在一些实例中,所述方法提供产生生物碱产物的工程化宿主细胞,其中(s)-底物到(r)-产物的差向异构化可构成生物碱产物的产生中的关键步骤。在一些实例中,所产生的生物碱为(r)-1-苄基异喹啉生物碱。在其他实施方案中,所产生的生物碱衍生自(r)-1-苄基异喹啉生物碱,包括例如,4环原吗啡喃和5环吗啡喃生物碱。在另一个实施方案中,(s)-1-苄基异喹啉生物碱是去往工程化宿主细胞的产物的中间体。在其他实施方案中,生物碱产物选自吗啡喃和原吗啡喃生物碱。
在一些实例中,(s)-底物为选自以下的(s)-1-苄基异喹啉生物碱:(s)-去甲牛心果碱、(s)-牛心果碱、(s)-四氢罂粟碱、(s)-去甲乌药碱、(s)-乌药碱、(s)-n-甲基乌药碱、(s)-3’-羟基-n-甲基乌药碱、(s)-去甲异东罂粟灵、(s)-东罂粟灵、(s)-异东罂粟灵、(s)-去甲原青藤碱((s)-norprotosinomenine)、(s)-原青藤碱、(s)-全去甲劳丹碱、(s)-全劳丹碱、(s)-4’-o-甲基全劳丹碱、(s)-6-o-甲基全去甲劳丹碱、(s)-4’-o-甲基全去甲劳丹碱。
在一些实例中,(s)-底物为式i的化合物:
或其盐,其中:
r1、r2、r3和r4独立地选自氢和甲基;并且
r5选自氢、羟基和甲氧基。
在一些其他实例中,r1、r2、r3、r4和r5中的至少一个为氢。
在其他实例中,(s)-底物为式ii的化合物:
或其盐,其中:
r3选自氢和c1-c4烷基;
r6和r7在每次出现时独立地选自羟基、氟、氯、溴、甲醛、c1-c4酰基、c1-c4烷基和c1-c4烷氧基;
n为0、1、2、3或4;并且
n’为0、1、2、3、4或5。
当键画在整个环上时,意指取代可发生在非特异性环原子或位置处。例如,在以上所示的式ii中,6元环中的任何-ch-的氢可用r7取代,形成-cr7-。
在一些实例中,r6和r7独立地为甲基或甲氧基。在一些其他实例中,n和n’独立地为1或2。在其他实施方案中,r3为氢或甲基。
在一些实例中,所述方法提供了由(s)-牛心果碱产生生物碱产物的工程化宿主细胞。(s)-牛心果碱到(r)-牛心果碱的差向异构化可构成由前体产生各种生物碱产物的关键步骤。在一些实例中,前体为l-酪氨酸或糖(例如,葡萄糖)。各种生物碱产物可包括但不限于吗啡喃和原吗啡喃生物碱。
可使用任何合适的碳源作为去往差向异构化的1-苄基异喹啉生物碱的前体。合适的前体可包括但不限于单糖(例如,葡萄糖、果糖、半乳糖、木糖)、寡糖(例如,乳糖、蔗糖、棉子糖)、多糖(例如,淀粉、纤维素)或其组合。在一些实例中,可使用来自可再生原料的未纯化混合物(例如,玉米浆液、糖用甜菜糖蜜、大麦麦芽、生物质水解产物)。在其他实施方案中,碳前体可以是一碳化合物(例如,甲醇、二氧化碳)或二碳化合物(例如,乙醇)。在其他实施方案中,可利用其他含碳化合物,例如,甲胺、葡糖胺和氨基酸(例如,l-酪氨酸)。在一些实例中,可将1-苄基异喹啉生物碱直接添加到工程化宿主细胞,该1-苄基异喹啉生物碱包括例如全去甲劳丹碱、全劳丹碱、去甲牛心果碱和牛心果碱。在进一步的实施方案中,1-苄基异喹啉生物碱可作为单一对映体(例如,(s)-1-苄基异喹啉生物碱)或对映体的混合物(包括例如外消旋混合物)添加到工程化宿主细胞。
在一些实例中,所述方法提供1-苄基异喹啉生物碱或其衍生物的立构中心的差向异构化。在进一步的实施方案中,该方法包括使1-苄基异喹啉生物碱与至少一种酶接触。所述至少一种酶可将1-苄基异喹啉生物碱或其衍生物的立构中心的立体化学反转为相反的立体化学。在一些实例中,所述至少一种酶将(s)-1-苄基异喹啉生物碱转化为(r)-1-苄基异喹啉生物碱。在利用至少一种酶的(s)-1-苄基异喹啉生物碱到(r)-1-苄基异喹啉生物碱的这种转化的一些实例中,(s)-1-苄基异喹啉生物碱选自(s)-去甲牛心果碱、(s)-牛心果碱、(s)-四氢罂粟碱、(s)-去甲乌药碱、(s)-乌药碱、(s)-n-甲基乌药碱、(s)-3’-羟基-n-甲基乌药碱、(s)-去甲异东罂粟灵、(s)-东罂粟灵、(s)-异东罂粟灵、(s)-去甲原青藤碱、(s)-原青藤碱、(s)-全去甲劳丹碱、(s)-全劳丹碱、(s)-4’-o-甲基全劳丹碱、(s)-6-o-甲基全去甲劳丹碱和(s)-4’-o-甲基全去甲劳丹碱。
在其他实施方案中,差向异构化的1-苄基异喹啉生物碱可包含两个或更多个立构中心,其中两个或更多个立构中心中的仅一个被反转以产生底物的非对映体(例如,(s,r)-1-苄基异喹啉生物碱转化为(r,r)-1-苄基异喹啉生物碱)。在其中当与至少一种酶接触时1-苄基异喹啉生物碱的仅一个立构中心反转的实例中,产物被称为1-苄基异喹啉生物碱的差向异构体。
在一些实例中,1-苄基异喹啉生物碱作为单一立体异构体呈现给酶。在一些其他实例中,1-苄基异喹啉生物碱作为立体异构体的混合物呈现给酶。在进一步的实施方案中,立体异构体的混合物可以是外消旋混合物。在一些其他实例中,立体异构体的混合物可在一种立体异构体方面相较于另一立体异构体得到富集。
在一些实例中,回收1-苄基异喹啉生物碱或其衍生物。在一些实例中,从细胞培养物中回收1-苄基异喹啉生物碱。在进一步的实施方案中,相较于呈现给酶的1-苄基异喹啉生物碱的原始混合物,回收的1-苄基异喹啉生物碱在对映体方面富集一种立体异构体。在进一步的实施方案中,回收的1-苄基异喹啉生物碱具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少82%、至少84%、至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.7%或100%的对映体过量。
“异构体”是具有相同分子式的不同化合物。“立体异构体”是仅在原子的空间布置方式上不同的异构体。“对映体”是一对彼此为不可重叠的镜像的立体异构体。一对对映体的1:1混合物为“外消旋”混合物。“非对映异构体”或“非对映体”是具有至少两个不对称原子但是彼此不互为镜像的立体异构体。如本文所用的术语“差向异构体”是指具有相同的化学式,但是在特定位置处具有不同的光学构型的化合物。例如,化合物的(r,s)和(s,s)立体异构体为彼此的差向异构体。在一些实例中,1-苄基异喹啉生物碱被转化为其差向异构体(例如,差向异构-1-苄基异喹啉生物碱)。绝对立体化学根据cahn-ingold-prelogr-s系统规定。当化合物为纯对映体时,每个手性碳处的立体化学可被规定为r或s。其绝对构型未知的拆分化合物可根据它们在钠d线波长处旋转平面偏振光的方向(右旋或左旋)而指定为(+)或(-)。本文所述的某些化合物包含一个或多个非对称中心,因此可产生对映体、非对映体,以及就绝对立体化学而言可被定义为(r)-或(s)-的其他立体异构形式。
表1.cyp-cor融合酶的示例性部分长度和全长氨基酸序列。
双bia生成修饰
本文提供的一些方法、过程和系统描述了双苄基异喹啉生物碱(双bia)的产生。双bia是可通过两个bia单体之间的偶联反应形成的二聚分子。在实例中,双bia可通过碳-氧偶联反应形成。在其他实例中,双bia可通过碳-碳偶联反应形成。在一些实例中,双bia二聚分子为同二聚体,包含两个相同的bia单体。在实例中,工程化宿主细胞可产生一种bia单体。在这些实例中,当与一种或多种偶联酶接触时,bia单体可形成同二聚体。在其他实例中,双bia二聚分子为异二聚体,包含两个不同的bia单体。例如,双bia可以是包含彼此为对映体的bia单体的异二聚体。在一些实例中,工程化宿主细胞可产生两种或更多种bia单体。在这些实例中,当与一种或多种偶联酶接触时,bia单体可形成同二聚体和异二聚体。
描述双bia的产生的这些方法、过程和系统中的一些可包括工程化宿主细胞。在一些实例中,工程化宿主细胞可被工程化以产生bia单体,所述bia单体继而可用作用于形成双bia的结构单元分子。可用于形成双bia的bia单体的实例包括乌药碱、n-甲基乌药碱、劳丹碱、去甲乌药碱、全去甲劳丹碱、6-o-甲基-全去甲劳丹碱、3’-羟基-n-甲基乌药碱、3’-羟基乌药碱、牛心果碱、去甲牛心果碱、去甲劳丹碱、劳丹素和罂粟碱。具体而言,工程化宿主细胞可通过包括o-甲基转移酶、n-甲基转移酶和3'-羟化酶在内的异源酶的表达,由去甲乌药碱或全去甲劳丹碱合成bia单体。o-甲基转移酶的实例可包括来自黄唐松草(thalicrumflavum)、莲(nelumbonucifera)、胡杨(populuseuphratica)或另外物种的去甲乌药碱6-o-甲基转移酶(6omt)。o-甲基转移酶的进一步的实例可包括来自智人(homosapiens)、小家鼠(musmusculus)、褐家鼠(rattusnorvegicus)、大猩猩(gorillagorilla)或另外物种的儿茶酚o-甲基转移酶(comt)。n-甲基转移酶的进一步的实例可包括来自黄唐松草、莲、流苏马兜铃(aristolochiafimbriata)或另外物种的乌药碱n-甲基转移酶(cnmt)。3’羟化酶的实例可包括来自花菱草(eschscholziacalifornica)、黄唐松草、莲或另外物种的n-甲基乌药碱3'-羟化酶(cyp80b1)。
工程化宿主细胞可产生任何给定bia单体的(s)或(r)对映体。另外地或备选地,工程化宿主细胞可产生两种对映体的混合物。(s)和(r)对映体的比率可由合成bia单体的一种或多种酶的底物和产物特异性决定。或者,存在的每种对映体的量可通过如上文所讨论的进行一种立体异构体到另一种立体异构体的差向异构化的另外的酶的表达而改变。
这些bia单体可融合成二聚双bia支架。具体而言,bia单体可利用由工程化宿主细胞产生的一种或多种酶融合成二聚双bia支架。另外地或备选地,bia单体可利用从工程化宿主细胞外部的来源提供给bia单体的一种或多种酶融合成二聚双bia支架。一种或多种酶可用于形成碳-氧和/或碳-碳偶联反应,以在一个、两个或三个位置处融合两个bia单体。在一些实例中,两个bia单体可通过醚桥连接。在一些实例中,可使用直接的碳-碳键连接两个bia单体。在一些实例中,通过融合两个bia单体形成的双bia可包含一个二苯基醚键。在一些实例中,两个bia单体可融合以形成包含两个二苯基醚键的双bia。在一些实例中,由两个bia单体形成的双bia可包含三个二苯基醚键。在一些实例中,双bia可包含一个二苯基醚键和一个苄基苯基醚键。在一些情况下,双bia可包含一个苄基苯基醚键和两个二苯基醚键。
在实例中,bia单体可与足量的一种或多种酶接触,所述酶可用于形成偶联反应以融合两个bia单体,使得至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少82%、至少84%、至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.7%或100%的所述bia单体转化为双bia。可用于将bia单体二聚化成双bia的一种或多种酶可在体外接触bia单体。另外地或备选地,可用于将bia单体二聚化成双bia的一种或多种酶可在体内接触bia单体。另外,一种或多种双bia二聚化酶可在产生bia单体的宿主细胞中表达。或者,可向表达双bia二聚化酶的工程化宿主细胞提供bia单体。或者,可向在其中具有bia单体的细胞提供一种或多种双bia二聚化酶。
在一些实例中,双苄基异喹啉生物碱是式va-vu中的任一种的化合物:
或其盐,其中:
r1a、r1b、r2a和r2b独立地选自氢和c1-c4烷基;
r3a、r3b、r6a、r6b、r8a和r8b独立地选自氢、羟基、氟、氯、溴、甲醛、c1-c4酰基、c1-c4烷基和c1-c4烷氧基;
r4a和r5a独立地选自氢和c1-c4烷基,或者r4a和r5a一起形成亚甲基桥;
r4b和r5b独立地选自氢和c1-c4烷基,或者r4b和r5b一起形成亚甲基桥;并且
r7a、r7b和r9a独立地选自氢和c1-c4烷基。
在一些实例中,r1a和r1b各自为氢;r2a和r2b各自为甲基;r3a和r3b各自为氢;r4a和r5a独立地为氢或甲基;r4b和r5b独立地为氢或甲基,或者r4b和r5b一起形成亚甲基桥;r6a、r6b、r8a和r8b各自为氢;并且r7a、r7b和r9a独立地为氢或甲基。
如上文所示,式va、vb和vd的双bia化合物通过使用碳-氧偶联反应融合两个bia单体形成。另外,式vc、vf和vh的双bia化合物通过使用碳-氧偶联反应和碳-碳偶联反应两者融合两个bia单体形成。此外,式ve、vg、vi、vj、vk、vl、vm、vo、vp和vq的双bia化合物通过使用两个碳-氧偶联反应融合两个bia单体形成。式vn的双bia化合物通过使用两个碳-氧偶联反应和一个碳-碳偶联反应融合两个bia单体形成。另外,式vr的双bia化合物通过使用三个碳-氧偶联反应融合两个bia单体形成。
可用于形成偶联反应的一种或多种酶可包括已知的细胞色素p450,诸如匍枝小檗(berberisstolonifera)cyp80a1或来自天然合成这些化合物的其他植物的类似的细胞色素p450酶。或者,偶联反应可通过不是细胞色素p450的酶进行。可用于形成偶联反应的一种或多种酶可被工程化以接受非天然底物。因此,可用于形成偶联反应的一种或多种酶可用于生成非天然双bia分子。在实例中,一种或多种酶可将天然bia单体与非天然bia单体融合,以产生非天然双bia分子。在其他实例中,一种或多种酶可将两个非天然bia单体融合,以产生非天然双bia分子。可使用酶工程化策略鉴定可用于形成融合bia单体以产生双bia的偶联反应的一种或多种酶。在实例中,酶工程化策略可包括定点诱变、随机诱变和筛选、dna改组和筛选。
一旦形成双bia,双bia可进行进一步衍生化或修饰。可利用由工程化宿主细胞产生的一种或多种酶衍生化或修饰双bia。具体而言,可通过使双bia与工程化宿主细胞产生的一种或多种酶接触来衍生化或修饰双bia。另外地或备选地,可通过使双bia与从工程化宿主细胞外部的来源提供给双bia的一种或多种酶接触来衍生化或修饰双bia。可用于衍生化或修饰双bia的一种或多种酶可用于进行裁剪(tailoring)反应。裁剪反应的实例包括氧化、还原、o-甲基化、n-甲基化、o-脱甲基化、乙酰化、亚甲基二氧桥形成以及o,o-脱亚甲基化。可使用一种或多种裁剪反应衍生化或修饰双bia。
裁剪反应的实例提供于表8中。在一些实例中,裁剪酶可用于催化在双bia或其衍生物上进行的碳-碳偶联反应。可用于催化碳-碳偶联反应的裁剪酶的实例包括来自罂粟(papaversomniferum)、花菱草、日本黄连(coptisjaponica)、匍枝小檗、黄唐松草(thalictrumflavum)或另外物种的小檗碱桥酶(bbe);来自罂粟或另外物种的沙罗泰里啶合酶(salsyn);以及来自日本黄连或另外物种的紫堇块茎碱合酶(corsyn)。可通过裁剪酶催化的反应的非限制性实例在方案2中示出,其中ra、rb、rc和rd独立地选自氢、羟基、氟、氯、溴、甲醛、c1-c4酰基、c1-c4烷基和c1-c4烷氧基。在一些实例中,ra、rb及其所附接的碳原子任选地形成碳环或杂环。在一些实例中,rc、rd及其所附接的碳原子任选地形成碳环或杂环。
方案2
在一些实例中,裁剪酶可用于催化在双bia或其衍生物上进行的氧化反应。可用于催化氧化反应的裁剪酶的实例包括来自日本黄连、蓟罂粟(argemonemexicana)、金花小檗(berberiswilsonae)或另外物种的四氢原小檗碱氧化酶(stox);来自罂粟或另外物种的二氢苯并菲啶氧化酶(dbox);来自罂粟或另外物种的甲基刺罂粟碱羟化酶(msh);以及来自罂粟、花菱草或另外物种的原阿片碱6-羟化酶(p6h)。
裁剪酶也可用于催化在双bia或其衍生物上进行的亚甲基二氧桥形成反应。可用于催化亚甲基二氧桥形成反应的裁剪酶的实例包括来自罂粟、花菱草、蓟罂粟或另外物种的刺罂粟碱合酶(stysyn或sts);来自罂粟、花菱草、蓟罂粟或另外物种的碎叶紫堇碱合酶(chesyn或cfs);以及来自黄唐松草、黄连(coptischinensis)或另外物种的坎那定合酶(cas)。
在其他实例中,裁剪酶可用于催化在双bia或其衍生物上进行的o-甲基化反应。可用于催化o-甲基化反应的裁剪酶的实例包括来自罂粟、黄唐松草、日本黄连、大红罂粟或另外物种的去甲乌药碱6-o-甲基转移酶(6omt);来自罂粟、黄唐松草、日本黄连、黄连或另外物种的3’羟基-n-甲基乌药碱4’-o-甲基转移酶(4’omt);来自罂粟、花菱草或另外物种的牛心果碱7-o-甲基转移酶(7omt);以及来自罂粟、黄唐松草、日本黄连、黄连或另外物种的金黄紫堇碱9-o-甲基转移酶(9omt)。
另外,裁剪酶可用于催化在双bia或其衍生物上进行的n-甲基化反应。可用于催化n-甲基化反应的裁剪酶的实例包括来自罂粟、黄唐松草、日本黄连或另外物种的乌药碱n-甲基转移酶(cnmt);来自罂粟、花菱草、大红罂粟或另外物种的四氢原小檗碱n-甲基转移酶(tnmt)。
此外,裁剪酶可用于催化在双bia或其衍生物上进行的o-脱甲基化反应。可用于催化o-脱甲基化反应的裁剪酶的实例包括来自罂粟或另外物种的蒂巴因脱甲基酶(t6odm);以及来自罂粟或另外物种的可待因脱甲基酶(codm)。
裁剪酶也可用于催化在双bia或其衍生物上进行的还原反应。可用于催化还原反应的裁剪酶的实例包括来自罂粟、大红罂粟或另外物种的沙罗泰里啶还原酶(salr);来自罂粟或另外物种的可待因酮还原酶(cor);以及来自花菱草或另外物种的血根碱还原酶(sanr)。在其他实例中,裁剪酶可用于催化在双bia或其衍生物上进行的乙酰化反应。可用于催化乙酰化反应的裁剪酶的实例包括来自罂粟或另外物种的沙罗泰里啶乙酰转移酶(salat)。
o-脱甲基化修饰
本文提供的一些方法、过程和系统描述了通过去除o-连接的甲基基团从第一苄基异喹啉生物碱到第二苄基异喹啉生物碱的转化。这些方法、过程和系统中的一些可包括工程化宿主细胞。在一些实例中,第一苄基异喹啉生物碱到第二苄基异喹啉生物碱的转化是底物到去甲阿片类物质或nal-阿片类物质的转化的关键步骤。在一些实例中,第一生物碱到第二生物碱的转化包括脱甲基酶反应。
图23示出了根据本发明的实施方案,具有阿片类3-o-脱甲基酶活性的酶。具体而言,酶可作用于任何吗啡喃生物碱结构,以从与碳3结合的氧去除甲基基团。
odm酶的氨基酸序列的实例在表3中阐述。用于将第一生物碱转化为第二生物碱的odm的氨基酸序列可与表3中列出的给定氨基酸序列75%或更多相同。例如,这样的差向异构酶的氨基酸序列可包含与如本文提供的氨基酸序列至少75%或更多、80%或更多、81%或更多、82%或更多、83%或更多、84%或更多、85%或更多、86%或更多、87%或更多、88%或更多、89%或更多、90%或更多、91%或更多、92%或更多、93%或更多、94%或更多、95%或更多、96%或更多、97%或更多、98%或更多、或者99%或更多相同的氨基酸序列。另外,在某些实施方案中,“相同的”氨基酸序列在氨基酸水平上与特定的氨基酸序列包含至少80%-99%的同一性。在一些情况下,“相同的”氨基酸序列在氨基酸水平上包含至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%和更多的同一性,在某些情况下,包含至少95%、96%、97%、98%和99%的同一性。在一些情况下,氨基酸序列可以是相同的,但是dna序列有所改变,例如以优化宿主生物体的密码子使用。
可提供工程化宿主细胞,其产生将第一生物碱转化为第二生物碱的odm,其中odm包含如表3中列出的给定氨基酸序列。可提供产生一种或多种odm酶的工程化宿主细胞。可回收和纯化在工程化宿主细胞内产生的odm,以便形成生物催化剂。所述过程可包括使第一生物碱与足以将所述第一生物碱转化为第二生物碱的量的odm接触。在实例中,第一生物碱可与足量的一种或多种酶接触,使得至少5%的所述第一生物碱转化为第二生物碱。在进一步的实例中,第一生物碱可与足量的一种或多种酶接触,使得至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少82%、至少84%、至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.7%或100%的所述第一生物碱转化为第二生物碱。
可用于将第一生物碱转化为第二生物碱的一种或多种酶可在体外接触第一生物碱。另外地或备选地,可用于将第一生物碱转化为第二生物碱的一种或多种酶可在体内接触第一生物碱。在一些实例中,可用于将第一生物碱转化为第二生物碱的一种或多种酶可提供给在其中具有第一生物碱的细胞。在一些实例中,可用于将第一生物碱转化为第二生物碱的一种或多种酶可在工程化宿主细胞内产生。
在一些实例中,所述方法提供产生生物碱产物的工程化宿主细胞,其中底物到产物的o-脱甲基化可构成生物碱产物的产生中的关键步骤。在一些实例中,所产生的生物碱为去甲阿片类物质或nal-阿片类物质。在其他实施方案中,所产生的生物碱衍生自去甲阿片类物质或nal-阿片类物质。在另一个实施方案中,第一生物碱为去往工程化宿主细胞的产物的中间体。在其他实施方案中,生物碱产物选自吗啡、脱氢吗啡、东罂粟碱、氢吗啡酮、二氢吗啡、14-羟基吗啡、吗啡酮和14-羟基吗啡酮。
在一些实例中,底物生物碱是选自以下的阿片类物质:可待因、羟考酮、蒂巴因、氢可酮、二氢可待因、14-羟基可待因、可待因酮和14-羟基可待因酮。
n-脱甲基化修饰
本文提供的一些方法、过程和系统描述了通过去除n-连接的甲基基团从第一生物碱到第二生物碱的转化。这些方法、过程和系统中的一些可包括工程化宿主细胞。在一些实例中,第一生物碱到第二生物碱的转化是底物到去甲阿片类物质或nal-阿片类物质的转化的关键步骤。在一些实例中,第一生物碱到第二生物碱的转化包括脱甲基酶反应。
图24示出了根据本发明的实施方案,具有阿片类n-脱甲基酶活性的酶。具体而言,酶可作用于任何吗啡喃生物碱结构,以从氮去除甲基基团。
表4中提供了可用于进行第一生物碱到第二生物碱的转化的n-脱甲基酶的氨基酸序列的实例。用于将第一生物碱转化为第二生物碱的ndm的氨基酸序列可与如表4中列出的给定氨基酸序列75%或更多相同。例如,这样的差向异构酶的氨基酸序列可包含与如本文提供的氨基酸序列至少75%或更多、80%或更多、81%或更多、82%或更多、83%或更多、84%或更多、85%或更多、86%或更多、87%或更多、88%或更多、89%或更多、90%或更多、91%或更多、92%或更多、93%或更多、94%或更多、95%或更多、96%或更多、97%或更多、98%或更多、或者99%或更多相同的氨基酸序列。另外,在某些实施方案中,“相同的”氨基酸序列在氨基酸水平上与特定的氨基酸序列包含至少80%-99%的同一性。在一些情况下,“相同的”氨基酸序列在氨基酸水平上包含至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%和更多的同一性,在某些情况下,包含至少95%、96%、97%、98%和99%的同一性。在一些情况下,氨基酸序列可以是相同的,但是dna序列有所改变,例如以优化宿主生物体的密码子使用。
可提供工程化宿主细胞,其产生将第一生物碱转化为第二生物碱的ndm,其中ndm包含如表4中列出的给定氨基酸序列。可提供产生一种或多种ndm酶的工程化宿主细胞。可回收和纯化在工程化宿主细胞内产生的ndm,以便形成生物催化剂。所述过程可包括使第一生物碱与足以将所述第一生物碱转化为第二生物碱的量的ndm接触。在实例中,第一生物碱可与足量的一种或多种酶接触,使得至少5%的所述第一生物碱转化为第二生物碱。在进一步的实例中,第一生物碱可与足量的一种或多种酶接触,使得至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少82%、至少84%、至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.7%或100%的所述第一生物碱转化为第二生物碱。
可用于将第一生物碱转化为第二生物碱的一种或多种酶可在体外接触第一生物碱。另外地或备选地,可用于将第一生物碱转化为第二生物碱的一种或多种酶可在体内接触第一生物碱。在一些实例中,可用于将第一生物碱转化为第二生物碱的一种或多种酶可提供给在其中具有第一生物碱的细胞。在一些实例中,可用于将第一生物碱转化为第二生物碱的一种或多种酶可在工程化宿主细胞内产生。
在一些实例中,所述方法提供产生生物碱产物的工程化宿主细胞,其中底物到产物的n-脱甲基化可构成生物碱产物的产生中的关键步骤。在一些实例中,所产生的生物碱为去甲阿片类物质或nal-阿片类物质。在其他实施方案中,所产生的生物碱衍生自去甲阿片类物质或nal-阿片类物质。在另一个实施方案中,第一生物碱为去往工程化宿主细胞的产物的中间体。在其他实施方案中,生物碱产物选自去甲可待因、去甲羟考酮、去甲蒂巴因、去甲氢可酮、去甲二氢可待因、去甲-14-羟基-可待因、去甲可待因酮、去甲-14-羟基-可待因酮、去甲吗啡、去甲羟吗啡酮、去甲东罂粟碱、去甲氢吗啡酮、去甲二氢吗啡、去甲-14-羟基-吗啡、去甲吗啡酮和去甲-14-羟基-吗啡酮。
在一些实例中,底物生物碱是选自以下的阿片类物质:可待因、羟考酮、蒂巴因、氢可酮、二氢可待因、14-羟基可待因、可待因酮和14-羟基可待因酮、吗啡、羟吗啡酮、东罂粟碱、氢吗啡酮、二氢吗啡、14-羟基-吗啡、吗啡酮或14-羟基-吗啡酮。
n-甲基转移酶修饰
本文提供的一些方法、过程和系统描述了通过添加n-连接的侧链基团的第一生物碱到第二生物碱的转化。本文提供的一些方法、过程和系统描述了通过将侧链基团从辅底物转移至第一生物碱的第一生物碱到第二生物碱的转化。这些方法、过程和系统中的一些可包括工程化宿主细胞。在一些实例中,第一生物碱到第二生物碱的转化是底物到nal-阿片类物质的转化的关键步骤。在一些实例中,第一生物碱到第二生物碱的转化包括甲基转移酶反应。
图25示出了根据本发明的实施方案,具有n-甲基转移酶活性的酶。具体而言,酶可作用于任何吗啡喃生物碱结构,以将甲基基团或其他碳部分添加到氮。s-腺苷甲硫氨酸(sam)可作为官能团(甲基、烯丙基、环丙基甲基等等)的供体。
nmt酶的氨基酸序列的实例在表5中阐述。用于将第一生物碱转化为第二生物碱的nmt的氨基酸序列可与如表5列出的给定氨基酸序列75%或更多相同。例如,这样的差向异构酶的氨基酸序列可包含与如本文提供的氨基酸序列至少75%或更多、80%或更多、81%或更多、82%或更多、83%或更多、84%或更多、85%或更多、86%或更多、87%或更多、88%或更多、89%或更多、90%或更多、91%或更多、92%或更多、93%或更多、94%或更多、95%或更多、96%或更多、97%或更多、98%或更多、或者99%或更多相同氨基酸序列。另外,在某些实施方案中,“相同的”氨基酸序列在氨基酸水平上与特定的氨基酸序列包含至少80%-99%的同一性。在一些情况下,“相同的”氨基酸序列在氨基酸水平上包含至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%和更多的同一性,在某些情况下,包含至少95%、96%、97%、98%和99%的同一性。在一些情况下,氨基酸序列可以是相同的,但是dna序列有所改变,例如以优化宿主生物体的密码子使用。
可提供工程化宿主细胞,其产生将第一生物碱转化为第二生物碱的nmt,其中nmt包含如表5中提供的氨基酸序列。可提供产生一种或多种nmt酶的工程化宿主细胞。可回收和纯化在工程化宿主细胞内产生的nmt,以便形成生物催化剂。所述过程可包括使第一生物碱与足以将所述第一生物碱转化为第二生物碱的量的nmt接触。在实例中,第一生物碱可与足量的一种或多种酶接触,使得至少5%的所述第一生物碱转化为第二生物碱。在进一步的实例中,第一生物碱可与足量的一种或多种酶接触,使得至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少82%、至少84%、至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.7%或100%的所述第一生物碱转化为第二生物碱。
可用于将第一生物碱转化为第二生物碱的一种或多种酶可在体外接触第一生物碱。另外地或备选地,可用于将第一生物碱转化为第二生物碱的一种或多种酶可在体内接触第一生物碱。在一些实例中,可用于将第一生物碱转化为第二生物碱的一种或多种酶可提供给在其中具有第一生物碱的细胞。在一些实例中,可用于将第一生物碱转化为第二生物碱的一种或多种酶可在工程化宿主细胞内产生。
在一些实例中,所述方法提供产生生物碱产物的工程化宿主细胞,其中底物到产物的n-甲基转移酶可构成生物碱产物的产生中的关键步骤。在一些实例中,所产生的生物碱为nal-阿片类物质。在其他实施方案中,所产生的生物碱衍生自去甲阿片类物质或nal-阿片类物质。在另一个实施方案中,第一生物碱为去往工程化宿主细胞的产物的中间体。在其他实施方案中,生物碱产物选自纳洛酮、纳曲酮和纳美芬。
在一些实例中,底物生物碱为选自以下的阿片类物质:去甲可待因、去甲羟考酮、去甲蒂巴因、去甲氢可酮、去甲二氢可待因、去甲-14-羟基-可待因、去甲可待因酮、去甲-14-羟基-可待因酮、去甲吗啡、去甲羟吗啡酮、去甲东罂粟碱、去甲氢吗啡酮、去甲二氢吗啡、去甲-14-羟基-吗啡、去甲吗啡酮和去甲-14-羟基-吗啡酮。在一些实例中,辅底物为s-腺苷甲硫氨酸、烯丙基-s-腺苷甲硫氨酸或环丙基甲基-s-腺苷甲硫氨酸。
异源编码序列
在一些情况中,工程化宿主细胞携带一个或多个异源编码序列(诸如两个或更多个、三个或更多个、四个或更多个、五个或更多个),所述异源编码序列编码使工程化宿主细胞能够产生期望的感兴趣的酶和/或感兴趣的bia(例如,如本文所述)的活性。如本文所用,术语“异源编码序列”用于指示编码或最终编码通常不存在于宿主生物体中且可在适当条件下在宿主细胞中表达的肽或蛋白质或其等效氨基酸序列(例如,酶)的任何多核苷酸。因而,“异源编码序列”包括通常存在于宿主细胞中的编码序列的多个拷贝,以使得所述细胞表达通常不存在于所述细胞中的编码序列的另外拷贝。异源编码序列可以是rna或其任何类型(例如,mrna)、dna或其任何类型(例如,cdna)或rna/dna的杂合体。感兴趣的编码序列包括但不限于包含诸如编码序列、内含子、启动子区、3'-utr和增强子区等特征的全长转录单位。
工程化宿主细胞还可被修饰为具有一个或多个遗传改变以适应异源编码序列。天然宿主基因组的改变包括但不限于修饰基因组以减少或消除可能干扰期望途径的特定蛋白质的表达。此类天然蛋白质的存在可将该途径的中间体或终产物中的一种迅速转化成代谢物或在期望途径中不可用的其他化合物。因此,如果天然酶的活性被降低或完全不存在,所产生的中间体将会更容易地可用于掺入期望产物中。
异源编码序列包括但不限于编码通常负责产生植物中感兴趣的bia的酶的序列(野生型序列或等效序列)。在一些情况下,异源序列所编码的酶可以是1-bia途径中的任何酶,并且可来自任何适宜的来源。针对于特定合成途径的由异源编码序列编码的酶的选择和数目可基于期望产物进行选择。在某些实施方案中,宿主细胞可包含1个或多个、2个或更多个、3个或更多个、4个或更多个、5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个或甚至15个或更多个异源编码序列,诸如1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个异源编码序列。
如本文所用,术语“异源编码序列”还包括肽或酶的编码部分,即肽或酶的cdna或mrna序列,以及全长转录单位的编码部分,即包含内含子和外含子的基因,以及编码酶或编码其等效氨基酸序列的“密码子优化的”序列、截短序列或其他形式的改变序列,条件是该等效氨基酸序列产生功能蛋白质。此类等效氨基酸序列可具有一个或多个氨基酸的缺失,其中缺失是n末端、c末端或内部的。设想到截短形式,只要它们具有本文所指示的催化能力。还设想到两种或更多种酶的融合物以有助于途径中代谢物的转移,条件是催化活性得以维持。
可操作的片段、突变体或截短形式可通过建模和/或筛选进行鉴定。在一些情况下,通过以逐步方式删除例如蛋白质的n末端、c末端或内部的区域,然后相较于原始序列关于所得衍生物针对期望反应的活性对所得衍生物进行分析来实现这一点。如果所讨论的衍生物在这种能力方面起作用,则认为正确构成了酶的等效衍生物。
在实例中,一些异源蛋白当在重组宿主中表达时可显示出它们被不被正确加工的发生。例如,在微生物产生宿主中表达的植物蛋白如细胞色素p450酶,可具有不正确加工的发生。具体而言,沙罗泰里啶合酶当在酵母中异源表达时可经历n-连接的糖基化。这种n-连接的糖基化在植物中可能观察不到,这可指示初生salsyn转录物的不正确的n末端分选,从而降低在异源微生物宿主中的酶活性。在此类实例中,针对校正初生转录物的n末端分选以便去除n-连接的糖基化模式的蛋白质工程化可导致沙罗泰里啶合酶在重组产生宿主中的活性改善。这在下文的实施例8中进一步解释。
本发明的一些方面还涉及编码与各种酶的天然氨基酸序列等效的氨基酸序列的异源编码序列。“等效”的氨基酸序列被定义为与特定氨基酸序列不相同而是包含至少一些氨基酸变化(缺失、置换、反转、插入等)的氨基酸序列,当用于期望目的时,与特定氨基酸序列的类似活性相比,所述氨基酸变化不实质影响蛋白质的生物活性。在差向异构酶的实例中,生物活性是指其催化活性。等效序列还意在包括已被工程化和/或进化为具有不同于原始氨基酸序列的特性的那些序列。感兴趣的易突变性质包括催化活性、底物特异性、选择性、稳定性、溶解性、定位等。
在一些情况下,每种类型的酶的表达通过另外的基因拷贝(即,多个拷贝)而增加,其增加中间体积累和/或感兴趣的bia产生。本发明的一些实施方案包括通过同时表达单一或多种酶的多个种类的变体而增加宿主细胞中的感兴趣的bia的产生。在一些情况下,单一或多种酶的另外的基因拷贝包含在宿主细胞中。可利用任何适宜的方法,包括针对宿主细胞中的酶的异源编码序列的多个拷贝。
在一些实例中,工程化宿主细胞包含针对酶的异源编码序列的多个拷贝,诸如2个或更多个、3个或更多个、4个或更多个、5个或更多个或甚至10个或更多个拷贝。在某些实施方案中,工程化宿主细胞包含针对一种或多种酶的异源编码序列的多个拷贝,诸如两种或更多种、三种或更多种、四种或更多种等酶的多个拷贝。在一些情况下,针对酶的异源编码序列的多个拷贝相较于宿主细胞衍生自两种或更多种不同的来源生物体。例如,工程化宿主细胞可包含一个异源编码序列的多个拷贝,其中所述拷贝中的每一个衍生自不同的来源生物体。因此,基于由异源编码序列编码的感兴趣的酶的种间差异,每个拷贝可包含显式序列中的一些变异。
可对工程化宿主细胞培养基进行取样并且监测感兴趣的bia的产生。可使用任何适宜的方法观察和测量感兴趣的bia。感兴趣的方法包括但不限于lc-ms方法(例如,如本文所述),其中通过与已知量的标准化合物比较来分析感兴趣的样品。另外,存在可观察和/或测量感兴趣的bia的其他方式。观察和/或测量bia的备选方式的实例包括gc-ms、紫外-可见光谱法、nmr、lc-nmr、lc-uv、tlc、毛细管电泳等等。可通过例如m/z和ms/ms片段化模式确认身份,并且可通过已知保留时间的lc迹线峰和/或通过参考已知量的化合物标准品的对应lc-ms分析进行的eicms峰分析来实现化合物的量化或测量。
另外,可对工程化宿主细胞的培养物进行取样并且监测感兴趣的酶如cyp-cor酶的产生。可使用任何适宜的方法观察和测量感兴趣的酶。感兴趣的方法包括酶活性测定、聚丙烯酰胺凝胶电泳、一氧化碳光谱法以及western印迹分析。
方法
培养用于bia产生的宿主细胞的方法
如上文所总结的,本发明的一些方面包括制备感兴趣的去甲阿片类和nal-阿片类bia的方法。另外,本发明的一些方面包括制备感兴趣的酶的方法。因而,本发明的一些方面包括在其中功能性地表达一种或多种宿主细胞修饰(例如,如本文所述)的条件下培养工程化宿主细胞,使得所述细胞将感兴趣的起始化合物转化为感兴趣的产物去甲阿片类和/或nal-阿片类bia。还提供包括在适于蛋白质产生的条件下培养工程化宿主细胞的方法,使得功能性地表达一个或多个异源编码序列并且将感兴趣的起始化合物转化为感兴趣的产物酶或者去甲阿片类和/或nal-阿片类bia。在实例中,所述方法是制备感兴趣的去甲阿片类和/或nal-阿片类bia的方法,其包括培养工程化宿主细胞(例如,如本文所述);将起始化合物添加至细胞培养物;以及从细胞培养物回收去甲阿片类物质和/或nal-阿片类物质。在一些实例中,所述方法是制备酶的方法,其包括培养工程化宿主细胞(例如,如本文所述);将起始化合物添加至细胞培养物;以及从细胞培养物回收酶。
发酵培养基可包含合适的碳底物。适用于进行本公开内容的方法的碳源可涵盖多种含碳底物。合适的底物可包括但不限于单糖(例如,葡萄糖、果糖、半乳糖、木糖)、寡糖(例如,乳糖、蔗糖、棉子糖)、多糖(例如,淀粉、纤维素)或其组合。在一些情况下,可使用来自可再生原料的未纯化混合物(例如,玉米浆液、糖用甜菜糖蜜、大麦麦芽)。在一些情况下,碳底物可以是一碳底物(例如,甲醇、二氧化碳)或二碳底物(例如,乙醇)。在其他情况下,可利用其他含碳化合物,例如,甲胺、葡糖胺和氨基酸。
培养工程化宿主细胞的任何适宜的方法可用于产生感兴趣的去甲阿片类和/或nal-阿片类bia。所采用的具体方案可例如根据工程化宿主细胞、异源编码序列、感兴趣的酶、感兴趣的去甲阿片类和/或nal-阿片类bia等而变化。细胞可存在于任何适宜的环境中,诸如其中细胞能够表达一种或多种功能性异源酶的环境。在一些实施方案中,细胞在有利于酶表达的条件下培养,并且与可用于允许在体内产生感兴趣的去甲阿片类和/或nal-阿片类bia的适当底物一起培养。在一些实施方案中,从工程化宿主提取功能性酶,以用于在体外条件下产生感兴趣的去甲阿片类和/或nal-阿片类bia。在一些情况下,将工程化宿主细胞放回到多细胞宿主生物体中。工程化宿主细胞处于任何生长期,包括但不限于稳定期和对数生长期等。此外,培养物本身可以是连续培养物,或者它们可以是分批培养物。
细胞可在介于14-40℃之间的温度下在适当的发酵培养基中生长。细胞可在任何适宜速度(例如,200rpm)的振荡下生长。细胞可在合适的ph下生长。适用于发酵的ph范围可介于ph5-9之间。发酵可在有氧、缺氧或微氧条件下进行。可使用任何合适的生长培养基。合适的生长培养基可包括但不限于常见的商业制备的培养基,如合成限定的(sd)基本培养基或酵母提取物蛋白胨右旋糖(yepd)丰富培养基。可使用适合于微生物的任何其他丰富、限定或合成性生长培养基。
可在基本上任何大小和形状的容器中培养细胞。适用于进行本公开内容的方法的容器的实例可包括但不限于多孔摇板、试管、烧瓶(带挡板和不带挡板的)以及生物反应器。培养物的体积可在10微升至大于10,000升的范围内。
可包括向生长培养基添加已知以产生生物碱所期望的方式调节代谢的试剂。在非限制性实例中,可向生长培养基添加环腺苷2’3’-单磷酸以调节分解代谢物阻遏。
可利用针对特定细胞类型的任何适宜的细胞培养条件。在某些实施方案中,使用标准细胞培养基和补充剂,将在标准或容易优化的条件下培养包含一个或多个修饰的宿主细胞。作为一个实例,当不需要用于质粒维持的选择压力时,标准生长培养基可包含20g/l酵母提取物、10g/l蛋白胨和20g/l右旋糖(ypd)。含有质粒的宿主细胞在含有1.7g/l酵母含氮碱基、5g/l硫酸铵和20g/l右旋糖的合成完全(sc)培养基中生长,该培养基补充有生长和选择所需的适当氨基酸。可用于诱导型酶表达的备选碳源包括但不限于蔗糖、棉子糖和半乳糖。在实验室中,细胞在任何适宜的温度(例如,30℃)下伴有任何适宜速率(例如,200rpm)的振荡在容器中生长,例如在1-1000ml或更大范围的体积的试管或烧瓶中生长。
可按比例放大培养体积以用于在较大发酵容器中生长,例如作为工业过程的一部分。工业发酵过程可在封闭分批、分批补料或连续恒化器条件下或者任何合适的发酵模式下进行。在一些情况下,可将细胞作为全细胞催化剂固定在底物上并使其经受发酵条件以产生生物碱。
分批发酵是封闭系统,其中培养基的组成在发酵开始时设定并且在发酵过程中不改变。在发酵开始时将期望的生物体接种到培养基中。在一些情况下,分批发酵在对系统做出改变以控制诸如ph和氧浓度等因素(但不包括碳)的情况下运行。在这种类型的发酵系统中,系统的生物质和代谢物组成在整个发酵过程中连续变化。细胞通常经历迟滞期,然后到达对数期(高生长速率),然后到达稳定期(生长速率降低或停止),并且最终到达死亡期(如果保持未处理)。
连续发酵是开放式系统,其中将确定的发酵培养基连续添加至生物反应器,并从容器连续移取等量的发酵培养基以供处理。通常对连续发酵系统进行操作以维持稳态生长条件,使得由于移取培养基造成的细胞损失必须通过发酵中的生长速率进行平衡。连续发酵通常在细胞处于恒定的高细胞密度的条件下操作。连续发酵允许调节影响靶标产物浓度和/或细胞生长的一个或多个因素。
液体培养基可包括但不限于具有上述添加剂组分的丰富培养基或合成限定培养基。培养基组分可溶解于水中并且通过加热、压力、过滤、辐射、化学物质或其任何组合进行灭菌。若干培养基组分可单独制备并灭菌,然后在发酵容器中进行组合。培养基可以是缓冲的,以便帮助在整个发酵过程中维持恒定的ph。
可在整个发酵过程中监测或控制过程参数,包括温度、溶解氧、ph、搅拌、通气速率和细胞密度。例如,可通过浸入培养基中的温度探头监测发酵过程的温度。可通过调控夹套温度将培养温度控制在设定点。可将水在外部冷却器中冷却,然后使其流动到生物反应器控制塔中并且以维持容器中的设定点温度所需的温度循环至夹套。
另外,可监测发酵过程中的气体流动参数。例如,气体可通过喷雾器流动到培养基中。适用于本公开内容的方法的气体可包括压缩空气、氧气和氮气。气体流动可处于固定的速率或被调控以维持溶解氧设定点。
还可监测培养基的ph。在实例中,可通过浸入容器内部的培养基中的ph探头监测ph。如果实行ph控制,可通过酸碱泵调整ph,所述酸碱泵以所需速率向培养基添加每种溶液。用于控制ph的酸溶液可以是硫酸或盐酸。用于控制ph的碱溶液可以是氢氧化钠、氢氧化钾或氢氧化铵。
此外,可通过浸入培养基中的溶解氧探头监测培养基中的溶解氧。如果实行溶解氧调控,可通过增大或减小搅拌速度来调整氧水平。还可通过增大或减小气体流动速率来调整溶解氧水平。气体可以是压缩空气、氧气或氮气。
还可监测发酵过程中的搅拌速度。在实例中,搅拌机马达可驱动搅动器。搅拌机速度可在整个发酵过程中设定为恒定rpm或者可动态调控以维持设定的溶解氧水平。
另外,可监测发酵过程中的浊度。在实例中,可使用浊度探头测量细胞密度。或者,可通过从生物反应器取样并且在分光光度计中对它们进行分析来测量细胞密度。此外,可通过无菌取样装置以一定时间间隔从生物反应器移取样品。可针对宿主细胞产生的生物碱对样品进行分析。还可针对其他代谢物和糖、培养基组分的消耗或细胞的密度对样品进行分析。
在另一个实例中,可监测发酵过程期间的原料参数。具体而言,可使用外部泵向发酵添加原料,所述原料包含糖和其他碳源、营养素和辅因子。还可在发酵过程中添加其他组分,包括但不限于消泡剂、盐、螯合剂、表面活性剂和有机液体。
用于优化宿主细胞中的异源多核苷酸的表达的任何适宜的密码子优化技术可适用于在主题宿主细胞和方法中使用,参见例如,gustafssonc.等人(2004)trendsbiotechnol,22,346-353,其通过引用以其全文并入。
主题方法还可包括将起始化合物添加至细胞培养物。任何适宜的添加方法可适于在主题方法中使用。细胞培养物可补充有足量的感兴趣的起始材料(例如,如本文所述),例如mm至μm范围的量,诸如约1-5mm的起始化合物。应当理解,所添加的起始材料的量、添加的时间设置和速率、所添加的材料的形式等可根据多种因素而变化。可添加纯的或预先溶解于合适的溶剂(例如,细胞培养基、水或有机溶剂)中的起始材料。起始材料可以以浓缩形式(例如,超过期望浓度10x)添加以使添加时细胞培养基的稀释最小化。起始材料可以以一个或多个批次添加,或通过在延长的时间段(例如,数小时或数天)内的连续添加而添加。
用于从发酵培养基分离产物的方法
主题方法还可包括从细胞培养物回收感兴趣的去甲阿片类和/或nal-阿片类bia。任何适宜的分离和隔离方法(例如,色谱方法或沉淀方法)可适于在主题方法中使用以从细胞培养物回收感兴趣的去甲阿片类和/或nal-阿片类bia。过滤方法可用于分离细胞培养物的可溶性部分与不溶性部分。在一些情况下,液相色谱方法(例如,反相hplc、尺寸排阻或正相色谱法)可用于分离感兴趣的bia与细胞培养物的其他可溶性组分。在一些情况下,萃取方法(例如,液体萃取、基于ph的纯化、固相萃取、亲和色谱法、离子交换等)可用于分离感兴趣的去甲阿片类和/或nal-阿片类bia与细胞培养物的其他组分。
可使用本领域已知的方法分离所产生的生物碱与发酵培养基。可在发酵之后立即(或在一些情况下,在发酵期间)进行多个回收步骤,以初始回收期望产物。通过这些步骤,可将生物碱(例如,去甲阿片类物质或nal-阿片类物质)与细胞、细胞碎片和废物分离,并且其他营养素、糖和有机分子可保留在废培养基中。可使用该过程产生富含去甲阿片类物质或nal-阿片类物质的产物。
在一个实例中,通过向间歇式反应器提供工程化酵母细胞以及包含营养素和水的原料来形成具有去甲阿片类或nal-阿片类产物的产物流。具体而言,可通过将工程化酵母细胞温育至少约5分钟的时间段来使工程化酵母细胞进行发酵,从而产生包含去甲阿片类或nal-阿片类产物以及细胞物质的溶液。一旦工程化酵母细胞已经进行发酵,可使用至少一个分离装置将去甲阿片类或nal-阿片类产物与细胞物质分离以提供包含去甲阿片类或nal-阿片类产物的产物流。具体而言,产物流可包含去甲阿片类或nal-阿片类产物,以及另外的组分,诸如澄清的酵母培养基。另外,去甲阿片类或nal-阿片类产物可包含一种或多种感兴趣的去甲阿片类物质或nal-阿片类物质,诸如一种或多种去甲阿片类或nal-阿片类化合物。
可使用不同的方法从生物反应器培养基移取包含感兴趣的酶以及/或者去甲阿片类物质或nal-阿片类物质的细胞。在实例中,通过随时间推移的沉降移取细胞。这种沉降过程可通过冷却或通过添加澄清剂如二氧化硅来加速。然后可从反应器顶部虹吸废培养基或者可从反应器底部滗析细胞。或者,可通过用过滤器、膜或其他多孔材料过滤来移取细胞。还可通过离心,例如通过连续流动离心或通过使用连续萃取器来移取细胞。
可以使用不同的方法从生物反应器培养基移取包含感兴趣的bia如纳洛酮或纳曲酮的细胞。在实例中,可通过随时间推移的沉降移取细胞。这种沉降过程可通过冷却或通过添加澄清剂如二氧化硅来加速。然后可从反应器顶部虹吸废培养基或者可从反应器底部滗析细胞。或者,可通过用过滤器、膜或其他多孔材料过滤来移取细胞。还可通过离心,例如通过连续流动离心或通过使用连续萃取器来移取细胞。
如果一些有价值的感兴趣的去甲阿片类和/或nal-阿片类bia存在于细胞内部,可将细胞透化或裂解,并且可通过上述方法中的任一种移除细胞碎片。用于使细胞透化的试剂可包括但不限于有机溶剂(例如,dmso)或盐(例如,乙酸锂)。用来裂解细胞的方法可包括添加表面活性剂如十二烷基硫酸钠,或通过珠磨或超声处理进行机械破坏。
可通过添加与水性培养基不混溶的有机液体,通过液-液萃取从澄清的废培养基萃取感兴趣的去甲阿片类和/或nal-阿片类bia。在实例中,可在其他处理步骤之外使用液-液萃取。合适的有机液体的实例包括但不限于肉豆蔻酸异丙酯、乙酸乙酯、氯仿、乙酸丁酯、甲基异丁基酮、油酸甲酯、甲苯、油醇、丁酸乙酯。可以以水性培养基的体积的至少10%或至多100%添加有机液体。
在一些情况下,可在发酵开始时或在发酵期间的任何时间添加有机液体。该萃取发酵过程可通过将去甲阿片类物质和/或nal-阿片类物质连续地移取至有机相而提高来自宿主细胞的感兴趣的去甲阿片类和/或nal-阿片类bia的产率。
搅拌可使有机相与水性培养基形成乳液。促进两个相分成不同层的方法可包括但不限于添加破乳剂或成核剂,或者调整ph。还可通过例如连续锥形板离心将乳液离心以分离两个相。
或者,可将有机相与水性培养基隔离开,以使在萃取后可以物理移取所述有机相。例如,可将溶剂包封在膜中。
在实例中,可使用吸附方法从发酵培养基提取感兴趣的去甲阿片类和/或nal-阿片类bia。在实例中,可通过添加树脂如
还可使用过滤从发酵培养基提取感兴趣的去甲阿片类物质或nal-阿片类物质。在高ph下,感兴趣的去甲阿片类物质或nal-阿片类物质可在生物反应器中形成晶状沉淀。可通过用过滤器、膜或其他多孔材料过滤直接移取该沉淀。还可通过离心和/或滗析收集沉淀。
上述提取方法可原位(在生物反应器中)或非原位(例如,在外部回路中,培养基通过所述外部回路流出生物反应器并接触提取剂,然后再循环回到容器中)进行。或者,提取方法可在发酵结束之后使用从生物反应器容器移取的澄清培养基进行。
用于纯化来自富含生物碱的溶液的产物的方法
后续纯化步骤可涉及使用本领域已知的方法处理富含感兴趣的去甲阿片类或nal-阿片类产物的发酵后溶液,从而回收高纯度的单一的感兴趣的产物物质。
在一个实例中,可将在有机相中萃取的感兴趣的去甲阿片类物质或nal-阿片类物质转移到水溶液中。在一些情况下,可通过加热和/或真空蒸发有机溶剂,并且可将所得粉末溶解于合适ph的水溶液中。在进一步的实例中,可通过添加促进将感兴趣的去甲阿片类物质或nal-阿片类物质萃取到水相中的合适ph的水溶液来从有机相萃取感兴趣的bia。然后可通过滗析、离心或另外的方法移除水相。
可对含有去甲阿片类物质或nal-阿片类物质的溶液进行进一步处理以移除金属,例如,通过用合适的螯合剂处理。可通过沉淀进一步处理含有感兴趣的去甲阿片类物质或nal-阿片类物质的溶液以移除其他杂质,如蛋白质和dna。在一个实例中,用适当的沉淀剂如乙醇、甲醇、丙酮或异丙醇处理含有感兴趣的去甲阿片类物质或nal-阿片类物质的溶液。在备选的实例中,可通过渗析或通过将较小的生物碱与污染的生物大分子分离的其他尺寸排阻方法移除dna和蛋白质。
在进一步的实例中,可使用本领域已知的方法通过连续交叉流过滤将包含感兴趣的去甲阿片类物质或nal-阿片类物质的溶液萃取至高纯度。
如果溶液包含感兴趣的去甲阿片类物质或nal-阿片类物质的混合物,那么可使用本领域已知的方法使其经受酸-碱处理,以得到单一的感兴趣的去甲阿片类或nal-阿片类物质。在该过程中,调整水溶液的ph以沉淀单一的去甲阿片类物质或nal-阿片类物质。
对于高纯度的小规模制备,可通过液相色谱法在单个步骤中纯化去甲阿片类物质或nal-阿片类物质。
lcms方法:
可使用液相色谱法分离感兴趣的bia化合物如纳洛酮或纳曲酮,并使用质谱法进行检测和定量。化合物的同一性可通过特征洗脱时间、质荷比(m/z)和碎裂模式(ms/ms)来确认。可通过将化合物峰面积与已知的参考标准化合物的标准曲线进行比较来进行定量。另外,感兴趣的bia可通过备选方法如gc-ms、紫外-可见光谱法、nmr、lc-nmr、lc-uv、tlc和毛细管电泳进行检测。
purpald测定方法
对于脱甲基化反应的高通量筛选,可使用purpald测定。例如,由2-氧戊二酸依赖性双加氧酶催化的脱甲基化产生甲醛a作为产物,如通用化学方程式所示:
酵母衍生的生物碱api与植物衍生的api
澄清的酵母培养基(cycm)可包含多种杂质。澄清的酵母培养基可通过真空和/或加热脱水,以得到富含生物碱的粉末。该产物类似于由罂粟生长国出口且由活性药物成分(api)制造商购买的罂粟杆浓缩物(cps)。出于本发明的目的,cps是任何类型的纯化的植物提取物的代表性实例,可由其最终进一步纯化期望的生物碱产物。表9和表10强调了这两种产物中的杂质,它们是cycm或cps特定的,或可存在于两者中。因此,可基于非颜料杂质,针对杂质评估这些去甲阿片类物质或nal-阿片类物质。通过针对这些杂质的子集对未知来源的产物进行分析,本领域技术人员可确定产物源自酵母还是植物的产生宿主。
api级药物成分是高度纯化的分子。因而,可指示api的植物或酵母来源的杂质(诸如表9和表10中列出的那些)可能不存在于api级的产物中。实际上,源自本发明的酵母菌株的许多api产物可能非常难以与传统的植物衍生的api区分开。然而,在一些情况下,可使用化学合成方法使常规的生物碱化合物经受化学修饰,其可在需要此类化学修饰的基于植物的产物中表现为化学杂质。例如,化学衍生化通常可导致与化学合成过程相关的一组杂质。在某些情况下,这些修饰可在酵母产生平台中以生物学方式进行,从而避免与化学衍生相关联的一些杂质存在于酵母衍生的产物中。具体而言,来自化学衍生产物的这些杂质可存在于使用化学合成过程产生的api产物中,但可不存在于使用酵母衍生的产物产生的api产物中。或者,如果将酵母衍生的产物与化学衍生的产物混合,所得杂质可能存在,但是其量少于在仅含或主要包含化学衍生产物的api中将预期的量。在该实例中,通过针对这些杂质的子集对api产物进行分析,本领域技术人员可确定产物源自酵母产生宿主还是传统的化学衍生化路线。
可存在于化学衍生化吗啡喃api中但不存在于生物合成的api中的杂质的非限制性实例包括api可待因中的可待因-o(6)-甲基醚杂质;api羟考酮中的8,14-二羟基-7,8-二氢可待因酮;以及api氢可酮中的四氢蒂巴因。可待因-o(6)-甲基醚可通过吗啡的化学过度甲基化形成。api羟考酮中的8,14-二羟基-7,8-二氢可待因酮可通过蒂巴因的化学过度氧化形成。另外,api氢可酮中的四氢蒂巴因可通过蒂巴因的化学过度还原形成。
然而,在其中酵母衍生的化合物和植物衍生的化合物均通过化学合成方式受到化学修饰的情况下,可预期产物中与化学合成过程相关联的相同杂质。在这样的情况下,可如上所述对起始材料(例如,cycm或cps)进行分析。
宿主细胞衍生的nal-阿片类物质与化学衍生的nal-阿片类物质
通过化学合成产生的nal-阿片类物质可含有多种杂质。这些杂质可由许多不同的原因引起,例如,未反应的起始材料、不完全的反应、副产物的形成、中间体的持久性、二聚化或降解。未反应的起始材料的实例可以是在纳曲酮制剂中剩余的羟吗啡酮。由不完全反应引起的杂质的实例可以是由蒂巴因的不完全3-o-脱甲基化产生的3-o-甲基丁丙诺啡。化学修饰可导致在脱靶位点处添加或去除官能团。例如,在纳曲酮合成期间氧化c10以产生10-羟基纳曲酮和10-酮基纳曲酮,或在丁丙诺啡合成期间去除6-o-甲基基团以得到6-o-脱甲基丁丙诺啡。杂质可由反应中间体的持久性引起,例如在n-脱甲基化过程期间形成的n-氧化物如羟吗啡酮n-氧化物的持久性。杂质的另一个来源是二聚化,即两个阿片类分子的共轭,例如两个丁丙诺啡分子(2,2’-双丁丙诺啡)、两个纳曲酮分子(2,2’-双纳曲酮)或两个纳洛酮分子(2,2’-双纳洛酮)。杂质可由起始材料、反应中间体或反应产物的降解引起。化学合成中使用的极端物理条件可使得更可能存在降解。可由降解引起的杂质的实例是在丁丙诺啡合成期间通过氧化条件产生的脱氢丁丙诺啡。
宿主细胞中通过酶催化产生的nal-阿片类物质可含有与通过化学合成产生的nal-阿片类物质不同的杂质。宿主细胞中通过酶催化产生的nal-阿片类物质可含有比通过化学合成产生的nal-阿片类物质更少的杂质。宿主细胞中通过酶催化产生的nal-阿片类物质可缺乏在通过化学合成产生的nal-阿片类物质中发现的某些杂质。在实例中,酶合成的关键特征可包括,(1)酶以高保真度靶向特定底物和残基;(2)酶在不损害分子的稳定性的细胞内的温和生理条件下进行反应;以及(3)酶被工程化成为驱动反应完成的有效催化剂。
表11强调了对于化学产生的nal-阿片类物质可以是特异性的一些杂质。因此,可针对杂质对nal-阿片类物质进行评估以确定存在或不存在来自表11的任何杂质。通过针对这些杂质的子集对未知来源的产物进行分析,本领域技术人员可确定产物源自化学合成还是酶合成。使宿主细胞工程化的方法
还包括出于产生感兴趣的去甲阿片类和/或nal-阿片类bia的目的工程化宿主细胞的方法。将dna插入宿主细胞中可使用任何适宜的方法来实现。所述方法用于将异源编码序列插入工程化宿主细胞中,使得宿主细胞功能性地表达酶并且将感兴趣的起始化合物转化成感兴趣的产物去甲阿片类和/或nal-阿片类bia。
任何适宜的启动子可用于主题工程化宿主细胞和方法中。驱动异源编码序列的表达的启动子可以是组成型启动子或诱导型启动子,条件是所述启动子在工程化宿主细胞中是活性的。异源编码序列可由其天然启动子表达,或者可使用非天然启动子。此类启动子在使用它们的宿主中可为低至高强度。启动子可以是调控型或组成型的。在某些实施方案中,使用不受葡萄糖阻遏的启动子或者在培养基中存在葡萄糖时仅受轻微阻遏的启动子。感兴趣的启动子包括但不限于糖酵解基因的启动子如枯草芽孢杆菌tsr基因的启动子(编码果糖二磷酸醛缩酶基因的启动子区)或来自酵母酿酒酵母基因的编码甘油醛3-磷酸脱氢酶(gpd、gapdh或tdh3)的启动子,面包酵母的adh1启动子,磷酸盐饥饿诱导的启动子如酵母的pho5启动子,来自地衣芽孢杆菌的碱性磷酸酶启动子,酵母诱导型启动子如gal1-10、gal1、gall、gals,阻遏型启动子met25、teto,以及组成型启动子如甘油醛3-磷酸脱氢酶启动子(gpd)、醇脱氢酶启动子(adh)、翻译延长因子-1-α启动子(tef)、细胞色素c-氧化酶启动子(cyc1)、mrp7启动子等。还可使用含有可受激素(诸如糖皮质激素、类固醇和甲状腺激素)诱导的启动子的自主复制酵母表达载体,并且包括但不限于糖皮质激素反应性元件(gre)和甲状腺激素反应性元件(tre)。这些和其他实例描述于美国专利号7,045,290中,其通过引用并入,包括其中引用的参考文献。可使用包含组成型或诱导型启动子如α因子、醇氧化酶和pgh的另外的载体。另外,任何启动子/增强子组合(根据真核启动子数据库epdb)也可用于驱动基因的表达。可针对宿主细胞选择任何适宜的适当启动子,可在大肠杆菌细胞中使用的启动子的实例包括t7、lac和teto启动子。还可使用启动子选择以优化转录,并因此优化酶水平以使产生最大化,同时使能源最小化。
任何适宜的载体可用于主题工程化宿主细胞和方法中。感兴趣的载体包括用于在酵母和其他细胞中使用的载体。酵母载体的类型可分成4种一般类别:整合载体(yip)、自主复制高拷贝数载体(yep或2μ质粒)、自主复制低拷贝数载体(ycp或着丝粒质粒)以及用于克隆大片段的载体(yac)。经由任何适宜的转化或转染技术将载体dna引入原核或真核细胞中。另外来源的dna(例如,pcr生成的双链dna产物或者合成的双链或单链寡核苷酸)可通过整合到基因组中来用于使酵母工程化。任何单个转化事件可包括一种或若干核酸(载体、双链或单链dna片段)以对宿主细胞进行遗传修饰。
效用
本文公开的工程化宿主细胞和方法(例如,如上文所述)适用于多种应用。感兴趣的应用包括但不限于:研究应用和治疗应用。本文公开的方法适用于多种不同的应用,包括其中产生感兴趣的去甲阿片类和/或nal-阿片类bia的任何适宜的应用。
主题工程化宿主细胞和方法适用于多种治疗应用。感兴趣的治疗应用包括其中对于制备包含去甲阿片类物质或nal-阿片类物质的药物产品感兴趣的那些应用。本文所述的工程化宿主细胞产生感兴趣的去甲阿片类物质或nal-阿片类物质以及感兴趣的酶。牛心果碱是包括工程化行为以产生终产物如阿片类产物的bia合成中感兴趣的主要分支点中间体。主题宿主细胞可用于由简单且廉价的起始材料产生感兴趣的去甲阿片类物质或nal-阿片类物质,所述材料可适用于产生包括牛心果碱在内的感兴趣的bia和bia终产物,诸如去甲阿片类物质或nal-阿片类物质。因此,主题宿主细胞适用于供应治疗活性的感兴趣的去甲阿片类物质或nal-阿片类物质。
在一些情况下,工程化宿主细胞和方法适用于产生商业规模量的其去甲阿片类物质或nal-阿片类物质,其中这些化合物的化学合成是低产率的并且不是大规模生产的可行手段。在某些情况下,宿主细胞和方法用于发酵设施中,所述发酵设施将包括例如5,000-200,000升容量的生物反应器(发酵罐),从而允许快速产生用于治疗性产物的其感兴趣的去甲阿片类物质或nal-阿片类物质。此类应用可包括由可发酵的碳源如纤维素、淀粉和游离糖以工业规模产生感兴趣的去甲阿片类物质或nal-阿片类物质。
主题工程化宿主细胞和方法适用于多种研究应用。主题宿主细胞和方法可用于分析多种酶对多种感兴趣的去甲阿片类和/或nal-阿片类bia的生物合成途径的作用。此外,工程化宿主细胞可被工程化以产生感兴趣的去甲阿片类和/或nal-阿片类bia,所述感兴趣的去甲阿片类和/或nal-阿片类bia适用于测试在尚未证实的治疗功能方面的感兴趣的生物活性。在一些情况下,对宿主细胞进行工程化以包含编码多种酶的多种异源编码序列阐明了针对感兴趣的去甲阿片类和/或nal-阿片类bia的高产率生物合成途径。在某些情况下,研究应用包括产生用于感兴趣的治疗分子的感兴趣的去甲阿片类和/或nal-阿片类bia,所述治疗分子随后可进行进一步化学修饰或衍生化为期望产物或针对增加的感兴趣的治疗活性进行筛选。在一些情况下,宿主细胞菌株用于筛选在此类途径中感兴趣的酶活性,其可导致经由在这些菌株中产生的去甲阿片类或nal-阿片类代谢物的转化而发现酶。
主题工程化宿主细胞和方法可用作植物特化代谢物的产生平台。主题宿主细胞和方法可用作药物文库开发以及植物酶发现的平台。例如,主题工程化宿主细胞和方法可适用于通过采用酵母菌株产生感兴趣的支架分子如去甲可待因或去甲蒂巴因,并且通过组合的生物合成或通过化学手段使化合物结构进一步功能化,从而开发基于天然产物的药物文库。通过以这种方式产生药物文库,任何潜在药物命中已经与易于大规模培养和产生的产生宿主相关联。作为另一个实例,这些主题工程化宿主细胞和方法可适用于植物酶发现。主题宿主细胞提供限定的代谢物的干净背景以表达植物est文库,从而鉴定新的酶活性。主题宿主细胞和方法提供用于酵母中的植物酶的功能性表达和活性增加的表达方法和培养条件。
试剂盒和系统
本发明的一些方面进一步包括试剂盒和系统,其中所述试剂盒和系统可包含本文公开的方法中采用的一种或多种组分,例如,工程化宿主细胞、起始化合物、异源编码序列、载体、培养基等,如本文所述。在一些实施方案中,主题试剂盒包含工程化宿主细胞(例如,如本文所述),以及选自以下的一种或多种组分:起始化合物、异源编码序列和/或包含所述异源编码序列的载体、载体、生长原料、适合在表达系统中使用的组分(例如,细胞、克隆载体、多克隆位点(mcs)、双向启动子、内部核糖体进入位点(ires)等)以及培养基。
本文所述的任何组分可提供于试剂盒中,例如,包含一个或多个修饰的宿主细胞、起始化合物、培养基等。适合在制备和使用异源编码序列、克隆载体和表达系统中使用的多种组分可适用于主题试剂盒。试剂盒还可包含管、缓冲液等,以及使用说明。根据需要,试剂盒的各种试剂组分可存在于单独的容器中,或所述组分中的一些或全部可在单个容器中预先组合成试剂混合物。
还提供了用于产生感兴趣的去甲阿片类和/或nal-阿片类bia的系统,其中所述系统可包含含有一个或多个修饰(例如,如本文所述)的工程化宿主细胞、起始化合物、培养基、发酵罐和发酵设备,例如,适于维持宿主细胞的生长条件的装置、取样和监测设备以及组分等。适合在酵母细胞的大规模发酵中使用的多种组分可适用于主题系统。
在一些情况下,所述系统包含用于工程化宿主细胞的大规模发酵以及监测和纯化由发酵的宿主细胞产生的去甲阿片类或nal-阿片类化合物的组分。在某些实施方案中,在发酵罐中的工程化宿主细胞产生一种或多种期望的感兴趣的去甲阿片类或nal-阿片类产物的条件下将一种或多种起始化合物(例如,如本文所述)添加至所述系统。在一些情况下,宿主细胞产生感兴趣的去甲阿片类物质或nal-阿片类物质(例如,如本文所述)。在某些情况下,感兴趣的去甲阿片类或nal-阿片类产物是阿片类拮抗剂,如纳洛酮、纳曲酮、纳美芬或纳洛芬。在某些情况下,感兴趣的去甲阿片类或nal-阿片类产物是阿片类拮抗剂,如纳曲吲哚或norbinaltorphimine。在一些实例中,感兴趣的去甲阿片类或nal-阿片类产物是部分激动剂,如丁丙诺啡。
在一些情况下,所述系统包含用于监测和/或分析通过主题宿主细胞产生的一种或多种感兴趣的去甲阿片类和/或nal-阿片类bia化合物的过程。例如,如本文所述的lc-ms分析系统、色谱法系统或任何适宜的系统,其中可对样品进行分析并且与标准品比较,例如,如本文所述。可通过取样和分析在发酵之前和期间的任何适宜的时间监测发酵培养基。当起始化合物到感兴趣的去甲阿片类或nal-阿片类产物的转化完成时,发酵可停止并且可进行去甲阿片类或nal-阿片类产物的纯化。因此,在一些情况下,主题系统包含适用于从感兴趣的去甲阿片类或nal-阿片类产物在其中产生的宿主细胞培养基纯化感兴趣的去甲阿片类或nal-阿片类产物的纯化部件。纯化部件可包括可用于纯化发酵产生的感兴趣的去甲阿片类或nal-阿片类产物的任何适宜的手段,包括但不限于,二氧化硅色谱法、反相色谱法、离子交换色谱法、hic色谱法、尺寸排阻色谱法、液体萃取和ph萃取方法。在一些情况下,在将一种或多种起始化合物输入系统之后,主题系统提供感兴趣的酶以及/或者去甲阿片类或nal-阿片类发酵产物的产生和分离。
给出以下实施例以便为本领域的普通技术人员提供如何制备和使用本发明的完整公开内容和描述,并且既不旨在限制发明人所认为的他们的发明的范围,也不旨在表示以下实验是所进行的全部或仅有的实验。尽管已经力图确保关于所用数字(例如,量、温度等)的精确性,但应考虑到一些实验误差和偏差。除非另有说明,否则份为重量份,分子量为重均分子量,温度为摄氏度,并且压力为大气压或接近大气压。
酶列表的讨论
宿主细胞可被工程化以变化提供感兴趣的去甲阿片类和/或nal-阿片类bia的产生的一个或多个修饰(诸如两个或更多个、三个或更多个、四个或更多个、五个或更多个乃至更多个修饰)。表2提供了可受到一个或多个修饰的作用以便提供工程化宿主细胞中感兴趣的去甲阿片类和/或nal-阿片类bia以及/或者感兴趣的酶的产生的示例性基因的列表。
如表2中提供的基因的修饰可用于由工程化宿主细胞产生感兴趣的去甲阿片类和/或nal-阿片类bia,所述工程化宿主细胞配有包含生长所需的基本营养素的培养基。该基本培养基可包含碳源、氮源、氨基酸、维生素和盐。例如,如表2中提供的基因的修饰可用于由供给供应有糖的工程化宿主细胞产生感兴趣的去甲阿片类和/或nal-阿片类bia。另外,如表2中提供的一个或多个基因的修饰可用于加强可被工程化用于药物产生的宿主细胞的生物合成过程。
另外,使用这些修饰以提供工程化宿主细胞中感兴趣的去甲阿片类和/或nal-阿片类bia以及/或者感兴趣的酶的产生仅由可由所述基因产生的酶的鉴定并不显而易见。具体而言,在宿主细胞(诸如如本文所述的酵母细胞)中已经重构的合成途径包括在天然不在单个生物体内一起作用的多种酶。另外,本文讨论的一些酶在它们的天然背景下不用于去甲阿片类和/或nal-阿片类bia生物合成。此外,本文所述的一些酶在特定的宿主细胞如酵母细胞中未进化成行使功能,并且未进化成一起行使功能。此外,产生的一些去甲阿片类物质或nal-阿片类物质并非天然存在的。在这些情况下,将不太清楚酶是否将会在宿主细胞如酵母中的合成去甲阿片类和/或nal-阿片类途径的背景下表现出足够的活性,以具有通过所述途径的足够通量从而产生下游去甲阿片类或nal-阿片类终产物。
例如,植物酶通常难以在异源微生物宿主如酵母中功能性地表达。在许多情况下,酶可能错误折叠、不正确地定位在宿主细胞内和/或不正确地加工。酵母与植物之间的蛋白质翻译和加工的差异可导致这些酶在酵母宿主中表现出大大降低直至不可检测的活性。这些挑战通常针对于内膜定位的酶如细胞色素p450(其在产生去甲阿片类物质或nal-阿片类物质的bia途径中强烈表示)而产生。即使降低的酶活性也可对酵母工程化以产生复杂的bia提出巨大挑战,因为该过程的每个步骤均需要足够的活性以确保期望的bia产物的高水平积累。
另外,在一些宿主细胞如酵母中存在内源酶/途径,它们可作用于bia途径中的许多早期前体(即,从酪氨酸到去甲乌药碱的中间体),因此鉴于这些竞争性内源途径,是否将存在通过异源途径以实现大量bia产生的足够通量可能并不显而易见。例如,酵母中的erlich途径(hazelwood等人2008.appl.environ.microbiol.74:2259-66;larroy等人2003.chem.biol.interact.143-144:229-38;larroy等人2002.eur.j.biochem.269:5738-45)是将会用作将早期bia途径中的许多中间体转化为非期望产物并且使来自合成途径的通量转向的主要内源途径。
此外,如本文所讨论和如表2中所提供的许多酶可在天然植物宿主中在非常特定的调控策略(包括部分调控)下行使功能,其可能在转移至异源酵母宿主时丢失。此外,植物呈现出与酵母细胞极为不同的生化环境,酶在所述生化环境下进化以行使功能,所述生化环境包括ph、氧化还原态,以及底物、辅底物、辅酶和辅因子可利用性。鉴于天然宿主与异源酵母宿主之间的生化环境和调控策略的差异,酶在处于酵母环境的背景下时是否将表现出显著活性并不清楚,并且它们是否将会一起作用以引导简单的前体如糖成为复杂的bia化合物也并不清楚。在酵母宿主中维持酶的活性是尤其重要的,因为许多途径具有许多反应步骤(>10),使得如果这些步骤无效,那么期望的下游产物的积累将不可预期。
此外,在天然植物宿主中,这些途径中的相关代谢物可遍布不同的细胞和组织类型进行定位。在若干实例中,存在可被特化用于生物合成的细胞类型和可被合成用于代谢物积累的细胞类型。当在异源酵母宿主内表达所述途径时,这种类型的细胞特化可能会丢失,并且可能在控制这些代谢物对细胞的毒性方面起到重要作用。因此,酵母是否可被成功工程化用于生物合成和积累这些代谢物而不受到这些化合物的毒性的伤害并不清楚。
作为一个实例,在天然植物宿主中,酶bbe被报道为具有动态的亚细胞定位。具体而言,酶bbe最初起始于er中,然后被分选至液泡(bird和facchini.2001.planta.213:888-97)。已经表明,植物中bbe与er的关联(alcantara等人2005.plantphysiol.138:173-83)提供对于bbe活性最佳的碱性ph(ph~8.8)(ziegler和facchini.2008.annu.rev.plantbiol.59:735-69)。作为另一个实例,有证据表明血根碱生物合成发生在植物细胞内的特化囊泡中(amann等人1986.planta.167:310-20),但是仅一些中间体在囊泡中积累。这可能发生以使得它们与其他酶活性和/或毒性作用相隔绝。
作为另一个实例,吗啡喃途径分支中的生物合成酶全部定位在韧皮部,韧皮部是植物中的维管组织的一部分。在韧皮部中,途径酶可在以下两种细胞类型之间进一步划分:所有植物共有的筛管成分;以及乳汁器,其为仅存在于制备特化的次生代谢物的某些植物中的特化细胞类型。上游酶(即,从ncs到salat)主要处于筛管成分中,并且下游酶(即,t6odm、cor、codm)大部分处于乳汁器中(onoyovwe等人2013.plantcell.25:4110-22)。另外,据发现,那可丁生物合成途径中的最终步骤发生在乳汁器中(chen和facchini.2014.plantj.77:173-84)。这种区室化被认为对于通过分离或运输中间体、提供最佳ph、增强辅因子供应来调控生物合成是高度重要的,但是罂粟乳汁器微环境的性质尚在研究中(ziegler和facchini.2008.annu.rev.plantbiol.59:735-69)。此外,据推测,几种酶可充当多酶复合物或植物次生代谢常见的代谢通道(kempe等人2009.phytochemistry.70:579-89;allen等人2004.nat.biotechnol.22:1559-66)。当来自不同宿主的生物合成酶进行组合和/或所述生物合成酶在异源酵母细胞中重组表达时,这些复合物或通道是否将会像它们在天然宿主中那样形成尚不清楚。在另一个实例中,在日本黄连中,小檗碱在根组织中进行生物合成,然后通过特化的atp结合盒转运蛋白的作用积累在根茎内(shitan等人2013.phytochemistry.91:109-16)。在鸦片罂粟中,吗啡喃生物碱积累在乳汁(乳汁器细胞的细胞质)内(martin等人1967.biochemistry.6:2355-63)。
此外,即使不考虑这些,也存在用于本文所述途径中的若干步骤的植物酶尚未得到表征的情况。例如,酪氨酸到早期苄基异喹啉生物碱支架去甲乌药碱的转化尚未得到表征。因此,对于本文所述途径中的若干步骤,通过使天然通常不一起存在的酶活性一起用于bia的生物合成,或由基因组序列信息鉴定新的酶活性以用于重构的途径中,从而产生备选的生物合成方案。
例如,可通过组合至少5种哺乳动物酶和1种细菌酶来实现酪氨酸到多巴胺的两步转化,所述至少5种哺乳动物酶和1种细菌酶天然不一起存在并且未进化成该途径的背景下行使功能或与植物酶一起行使功能。在这些情况下,可能不太清楚是否可利用这些酶进行它们天然并未进化出的化合物的生物合成,一件它们在异源微生物宿主的背景下和该途径中是否会有效地行使功能。
下文讨论了作为修饰对象以便产生感兴趣的去甲阿片类和/或nal-阿片类bia以及/或者感兴趣的酶的基因的实例。另外,在示出用于生成bia以及感兴趣的去甲阿片类和/或nal-阿片类bia以及/或者感兴趣的酶的途径的一系列附图的背景下对所述基因进行讨论。
[tlk1]在一些实例中,工程化宿主细胞可修饰酶转酮醇酶的表达。转酮醇酶由tkl1基因编码。在实例中,转酮醇酶催化果糖-6-磷酸+甘油醛-3-磷酸
[zwf1]在一些实例中,工程化宿主细胞可修饰酶葡萄糖-6-磷酸脱氢酶的表达。葡萄糖-6-磷酸脱氢酶由zwf1基因编码。在实例中,葡萄糖-6-磷酸脱氢酶催化葡萄糖-6-磷酸→6-磷酸葡糖酸内酯的反应,参考图2。工程化宿主细胞可被修饰以在工程化宿主细胞中缺失zwf1基因的编码区。或者,工程化宿主细胞可被修饰以使zwf1基因的功能性失效,如通过引入失活突变。
[aro4]在一些实例中,工程化宿主细胞可修饰酶3-脱氧-d-阿拉伯糖-庚酮糖-7-磷酸(dahp)合酶的表达。dahp合酶由aro4基因编码。在实例中,dahp合酶催化赤藓糖-4-磷酸+磷酸烯醇式丙酮酸→dahp的反应,参考图2。工程化宿主细胞可修饰aro4基因以掺入一个或多个反馈抑制减轻突变。具体而言,反馈抑制减轻突变(例如,aro4fbr)可如下掺入:作为原始基因座处的天然aro4基因的定向突变;作为在单独基因座处作为遗传整合引入的另外的拷贝;或作为附加型载体如2-μm或着丝粒质粒上的另外的拷贝。突变aro4fbr中的标识符“fbr”称为反馈抗性突变体和突变。dahp合酶的反馈抑制拷贝可在天然酵母转录调控下,诸如当工程化宿主细胞为酵母细胞时。或者,可通过将dahp合酶的反馈抑制拷贝置于合成启动子的控制下,在蛋白质表达的工程化组成型或动态调控的情况下将所述dahp合酶的反馈抑制拷贝引入工程化宿主细胞中。在一些情况下,aro4基因可衍生自酿酒酵母。在一些情况下,aro4基因可与天然存在的基因具有100%的相似性。aro4基因的修饰的实例包括反馈抑制抗性突变、k229l或q166k。
[aro7]在一些实例中,工程化宿主细胞可修饰酶分支酸变位酶的表达。分支酸变位酶由aro7基因编码。在实例中,分支酸变位酶催化分支酸酯→预苯酚酸酯的反应,参考图2。工程化宿主细胞可修饰aro7基因以掺入一个或多个反馈抑制减轻突变。具体而言,反馈抑制减轻突变(例如,aro7fbr)可如下掺入:作为原始基因座处的天然aro7基因的定向突变;作为在单独基因座处作为遗传整合引入的另外的拷贝;或作为附加型载体如2-μm或着丝粒质粒上的另外的拷贝。突变aro7fbr中的标识符“fbr”称为反馈抗性突变体和突变。分支酸变位酶的反馈抑制拷贝可在天然酵母转录调控下,诸如当工程化宿主细胞为酵母细胞时。或者,可通过将分支酸变位酶的反馈抑制拷贝置于合成启动子的控制下,在蛋白质表达的工程化组成型或动态调控的情况下将所述分支酸变位酶的反馈抑制拷贝引入工程化宿主细胞中。在一些情况下,aro7基因可衍生自酿酒酵母。在一些情况下,aro7基因可与天然存在的基因具有100%的相似性。aro7基因的修饰的实例包括反馈抑制抗性突变或t226i。
[aro10]在一些实例中,工程化宿主细胞可修饰酶苯丙酮酸脱羧酶的表达。苯丙酮酸脱羧酶由aro10基因编码。在实例中,苯丙酮酸脱羧酶催化羟基苯丙酮酸酯→4-羟基苯乙酸酯(4hpa)的反应,参考图2。工程化宿主细胞可被修饰以在工程化宿主细胞中包括aro10基因的组成型过表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控aro10基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入aro10基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达aro10基因的强启动子元件的引入。aro10基因可衍生自酿酒酵母或另外的物种。在一些实例中,aro10基因可与天然存在的基因具有100%的相似性。
[adh2-7、sfa1]在一些实例中,工程化宿主细胞可修饰醇脱氢酶的表达。醇脱氢酶可由adh2、adh3、adh4、adh5、adh6、adh7和sfa1基因中的一个或多个编码。在实例中,醇脱氢酶催化4hpa→酪醇的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中缺失adh2、adh3、adh4、adh5、adh6、adh7和sfa1基因中的一个或多个的编码区。备选地,工程化宿主细胞可被修饰以使adh2、adh3、adh4、adh5、adh6、adh7和sfa1基因中的一个或多个的功能性失效,诸如通过引入失活突变。
[ald2-6]在一些实例中,工程化宿主细胞可修饰醛氧化酶的表达。醛氧化酶可由ald2、ald3、ald4、ald5和ald6基因中的一个或多个编码。在实例中,醛氧化酶催化4hpa→羟基苯乙酸的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中缺失ald2、ald3、ald4、ald5和ald6基因中的一个或多个的编码区。或者,工程化宿主细胞可被修饰以使ald2、ald3、ald4、ald5和ald6基因中的一个或多个的功能性失效,诸如通过引入失活突变。
[aro9]在一些实例中,工程化宿主细胞可修饰酶芳族转氨酶的表达。芳族转氨酶由aro9基因编码。在实例中,芳族转氨酶催化羟基苯丙酮酸酯+谷氨酸酯→酪氨酸+α-酮戊二酸酯的反应,参考图2。工程化宿主细胞可被修饰以在工程化宿主细胞中包括aro9基因的组成型过表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控aro9基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入aro9基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达aro9基因的强启动子元件的引入。aro9基因可衍生自酿酒酵母或另外的物种。在一些实例中,aro9基因可与天然存在的基因具有100%的相似性。
[tyr]在一些实例中,工程化宿主细胞可修饰酶酪氨酸酶的表达。酪氨酸酶由tyr基因编码。在实例中,酪氨酸酶催化酪氨酸→l-dopa的反应,参考图2。在其他实例中,酪氨酸酶催化l-dopa→多巴醌的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括tyr基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控tyr基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入tyr基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达tyr基因的强启动子元件的引入。tyr基因可衍生自青枯雷尔氏菌(ralstoniasolanacearum)、双孢蘑菇(agaricusbisporus)或另外的物种。在一些实例中,tyr基因可与天然存在的基因具有100%的相似性。
[tyrh]在一些实例中,工程化宿主细胞可修饰酶酪氨酸羟化酶的表达。酪氨酸羟化酶由tyrh基因编码。在实例中,酪氨酸羟化酶催化酪氨酸→l-dopa的反应,参考图2和图5。工程化宿主细胞可被修饰以在工程化宿主细胞中包括tyrh基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控tyrh基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入tyrh基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达tyrh基因的强启动子元件的引入。tyrh基因可衍生自智人、褐家鼠、小家鼠或另外的物种。在一些实例中,tyrh基因可与天然存在的基因具有100%的相似性。
[dodc]在一些实例中,工程化宿主细胞可修饰酶l-dopa脱羧酶的表达。l-dopa脱羧酶由dodc基因编码。在实例中,l-dopa脱羧酶催化l-dopa→多巴胺的反应,参考图2和图5。工程化宿主细胞可被修饰以在工程化宿主细胞中包括dodc基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控dodc基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入dodc基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达dodc基因的强启动子元件的引入。dodc基因可衍生自恶臭假单胞菌、褐家鼠或另外的物种。在一些实例中,dodc基因可与天然存在的基因具有100%的相似性。
[tydc]在一些实例中,工程化宿主细胞可修饰酶酪氨酸/dopa脱羧酶的表达。酪氨酸/dopa脱羧酶由tydc基因编码。在实例中,酪氨酸/dopa脱羧酶催化l-dopa→多巴胺的反应,参考图2。工程化宿主细胞可被修饰以在工程化宿主细胞中包括tydc基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控tydc基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入tydc基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达tydc基因的强启动子元件的引入。tydc基因可衍生自罂粟或另外的物种。在一些实例中,tydc基因可与天然存在的基因具有100%的相似性。
[mao]在一些实例中,工程化宿主细胞可修饰酶单胺氧化酶的表达。单胺氧化酶由mao基因编码。在实例中,单胺氧化酶催化多巴胺→3,4-dhpa的反应,参考图2。工程化宿主细胞可被修饰以在工程化宿主细胞中包括mao基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控mao基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入mao基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达mao基因的强启动子元件的引入。在一些情况下,mao基因可经密码子优化以在酿酒酵母中表达。mao基因可衍生自大肠杆菌、智人、藤黄微球菌(micrococcusluteus)或另外的物种。在一些实例中,mao基因可与天然存在的基因具有77%的相似性。
[ncs]在一些实例中,工程化宿主细胞可修饰酶去甲乌药碱合酶的表达。去甲乌药碱合酶由ncs基因编码。在实例中,去甲乌药碱合酶催化4hpa+多巴胺→(s)-去甲乌药碱的反应,参考图5。具体而言,图5示出了根据本发明的实施方案,用于通过去甲乌药碱将l-酪氨酸转化为牛心果碱的生物合成方案。图5提供了酶tyrh,酪氨酸羟化酶;dodc,dopa脱羧酶;ncs,去甲乌药碱合酶,如本文所讨论的;6omt,6-o-甲基转移酶;cnmt,乌药碱n-甲基转移酶;cyp80b1,细胞色素p45080b1;cpr,细胞色素p450nadph还原酶;4’omt,3’羟基-n-甲基乌药碱4’-o-甲基转移酶;l-dopa,l-3,4-二羟基苯丙氨酸;以及4-hpa,4-羟基苯基乙基醛的使用。在图5所示的酶中,4-hpa和l-酪氨酸在酵母中天然合成。所示出的所有其他代谢物不在酵母中天然产生。另外,尽管tyrh被描绘为催化l-酪氨酸到l-dopa的转化,还可使用其他酶进行这一步骤,如说明书中所描述。例如,还可使用酪氨酸酶进行l-酪氨酸到l-dopa的转化。此外,还可使用其他酶如细胞色素p450氧化酶进行l-酪氨酸到l-dopa的转化。此类酶可对包括l-dopa和l-酪氨酸在内的相关bia前体化合物表现出氧化酶活性。
另外,去甲乌药碱合酶催化3,4-dhpa+多巴胺→(s)-全去甲劳丹碱的反应,参考图6。具体而言,图6示出了根据本发明的实施方案,用于通过全去甲劳丹碱将l-酪氨酸转化为牛心果碱的生物合成方案。图6提供了酶tyrh,酪氨酸羟化酶;dodc,dopa脱羧酶;maoa,单胺氧化酶;ncs,去甲乌药碱合酶;6omt,6-o-甲基转移酶;cnmt,乌药碱n-甲基转移酶;4’omt,3’羟基-n-甲基乌药碱4’-o-甲基转移酶;l-dopa,l-3,4-二羟基苯丙氨酸;以及3,4-dhpa,3,4-二羟基苯乙醛的使用。在图6所示的酶中,l-酪氨酸在酵母中天然合成。图6所示的其他代谢物不在酵母中天然产生。
工程化宿主细胞可被修饰以在工程化宿主细胞中包括ncs基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控ncs基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入ncs基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达ncs基因的强启动子元件的引入。另外,去甲乌药碱合酶可具有n末端截短。在一些情况下,ncs基因可经密码子优化以在酿酒酵母中表达。ncs基因可衍生自日本黄连、罂粟、大红罂粟、黄唐松草、岩黄连(corydalissaxicola)或另外的物种。在一些实例中,ncs基因可与天然存在的基因具有80%的相似性。
[6omt]在一些实例中,工程化宿主细胞可修饰酶去甲乌药碱6-o-甲基转移酶的表达。去甲乌药碱6-o-甲基转移酶由6omt基因编码。在一些实例中,去甲乌药碱6-o-甲基转移酶催化去甲乌药碱→乌药碱的反应,参考图5。在其他实例中,去甲乌药碱6-o-甲基转移酶催化全去甲劳丹碱→3’羟基乌药碱的反应,以及本文详细描述的其他反应,诸如图6中提供的那些反应。另外,工程化宿主细胞可被修饰以在工程化宿主细胞中包括6omt基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控6omt基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入6omt基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达6omt基因的强启动子元件的引入。6omt基因可衍生自罂粟、黄唐松草、日本黄连或另外的物种。在一些实例中,6omt基因可与天然存在的基因具有100%的相似性。
[cnmt]在一些实例中,工程化宿主细胞可修饰酶乌药碱-n-甲基转移酶的表达。乌药碱-n-甲基转移酶由cnmt基因编码。在一些实例中,乌药碱-n-甲基转移酶催化乌药碱→n-甲基乌药碱的反应,参考图5。在其他实例中,乌药碱-n-甲基转移酶可催化3’羟基乌药碱→3’羟基-n-甲基乌药碱的反应。在其他实例中,乌药碱-n-甲基转移酶可催化去甲羟吗啡酮→纳洛酮的反应,参考图26。在其他实例中,乌药碱-n-甲基转移酶可催化本文详细描述的其他反应,诸如图6中提供的那些反应。另外,工程化宿主细胞可被修饰以在工程化宿主细胞中包括cnmt基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控cnmt基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入cnmt基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达cnmt基因的强启动子元件的引入。cnmt基因可衍生自罂粟、黄唐松草、日本黄连或另外的物种。在一些实例中,cnmt基因可与天然存在的基因具有100%的相似性。
[4’omt]在一些实例中,工程化宿主细胞可修饰酶4’-o-甲基转移酶的表达。4’-o-甲基转移酶由4’omt基因编码。在一些实例中,4’-o-甲基转移酶催化3’-羟基-n-甲基乌药碱→牛心果碱的反应,参考图5。在其他实例中,4’-o-甲基转移酶催化本文详细描述的其他反应,诸如图6中提供的那些反应。另外,工程化宿主细胞可被修饰以在工程化宿主细胞中包括4’omt基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控4’omt基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入4’omt基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达4’omt基因的强启动子元件的引入。4’omt基因可衍生自罂粟、黄唐松草、日本黄连或另外的物种。在一些实例中,4’omt基因可与天然存在的基因具有100%的相似性。
[cyp80b1]在一些实例中,工程化宿主细胞可修饰酶细胞色素p45080b1的表达。细胞色素p45080b1由cyp80b1基因编码。在实例中,细胞色素p45080b1催化n-甲基乌药碱→3’-羟基-n-甲基乌药碱的反应,参考图5。工程化宿主细胞可被修饰以在工程化宿主细胞中包括细胞色素p45080b1基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控细胞色素p45080b1基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入细胞色素p45080b1基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达细胞色素p45080b1基因的强启动子元件的引入。在一些情况下,cyp80b1基因可经密码子优化以在酿酒酵母中表达。细胞色素p45080b1基因可衍生自罂粟、花菱草、黄唐松草或另外的物种。在一些实例中,p45080b1基因可与天然存在的基因具有77%的相似性。
[fol2]在一些实例中,工程化宿主细胞可修饰酶gtp环化水解酶的表达。gtp环化水解酶由fol2基因编码。在一些实例中,gtp环化水解酶催化gtp→二氢新蝶呤三磷酸的反应,参考图1。工程化宿主细胞可被修饰以在工程化宿主细胞中包括fol2基因的组成型过表达。工程化宿主细胞也还被修饰以包含天然调控。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控fol2基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入fol2基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达fol2基因的强启动子元件的引入。fol2基因可衍生自酿酒酵母、智人、小家鼠或另外的物种。在一些实例中,fol2基因可与天然存在的基因具有100%的相似性。
[ptps]在一些实例中,工程化宿主细胞可修饰酶6-丙酮酰四氢生物蝶呤(ptp)合酶的表达。丙酮酰四氢生物蝶呤合酶由ptps基因编码。在一些实例中,6-丙酮酰四氢生物蝶呤合酶催化二氢新蝶呤三磷酸→ptp的反应,参考图1。工程化宿主细胞可被修饰以在工程化宿主细胞中包括ptps基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控ptps基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入ptps基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达ptps基因的强启动子元件的引入。在一些情况下,ptps基因可经密码子优化以在酿酒酵母中表达。ptps基因可衍生自褐家鼠、智人、小家鼠或另外的物种。在一些实例中,ptps基因可与天然存在的基因具有80%的相似性。
[sepr]在一些实例中,工程化宿主细胞可修饰酶墨蝶呤还原酶的表达。墨蝶呤还原酶由sepr基因编码。在一些实例中,墨蝶呤还原酶催化ptp→bh4的反应,参考图1。工程化宿主细胞可被修饰以在工程化宿主细胞中包括sepr基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控sepr基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入sepr基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达sepr基因的强启动子元件的引入。在一些情况下,sepr基因可经密码子优化以在酿酒酵母中表达。sepr基因可衍生自褐家鼠、智人、小家鼠或另外的物种。在一些实例中,sepr基因可与天然存在的基因具有72%的相似性。
[pcd]在一些实例中,工程化宿主细胞可修饰酶4a-羟基四氢生物蝶呤(蝶呤-4α-甲醇胺)脱水酶的表达。4a-羟基四氢生物蝶呤脱水酶由pcd基因编码。在一些实例中,4a-羟基四氢生物蝶呤脱水酶催化4a-羟基四氢生物蝶呤→h2o+醌型二氢蝶啶的反应,参考图1。工程化宿主细胞可被修饰以在工程化宿主细胞中包括pcd基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控pcd基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入pcd基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达pcd基因的强启动子元件的引入。在一些情况下,pcd基因可经密码子优化以在酿酒酵母中表达。pcd基因可衍生自褐家鼠、智人、小家鼠或另外的物种。在一些实例中,pcd基因可与天然存在的基因具有79%的相似性。
[qdhpr]在一些实例中,工程化宿主细胞可修饰酶醌型二氢蝶啶还原酶的表达。醌型二氢蝶啶还原酶由qdhpr基因编码。在一些实例中,醌型二氢蝶啶还原酶催化醌型二氢蝶啶→bh4的反应,参考图1。工程化宿主细胞可被修饰以在工程化宿主细胞中包括qdhpr基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控qdhpr基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入qdhpr基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达qdhpr基因的强启动子元件的引入。在一些情况下,qdhpr基因可经密码子优化以在酿酒酵母中表达。qdhpr基因可衍生自褐家鼠、智人、小家鼠或另外的物种。在一些实例中,qdhpr基因可与天然存在的基因具有75%的相似性。
[dhfr]在一些实例中,工程化宿主细胞可修饰酶二氢叶酸还原酶的表达。二氢叶酸还原酶由dhfr基因编码。在一些实例中,二氢叶酸还原酶催化7,8-二氢生物蝶呤(bh2)→5,6,7,8-四氢生物蝶呤(bh4)的反应,参考图1。该反应可用于回收bh4作为用于将酪氨酸转化为l-dopa的辅底物,如图5中所示。工程化宿主细胞可被修饰以在工程化宿主细胞中包括dhfr基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控dhfr基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入dhfr基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达dhfr基因的强启动子元件的引入。在一些情况下,dhfr基因可经密码子优化以在酿酒酵母中表达。dhfr基因可衍生自褐家鼠、智人或另外的物种。在一些实例中,dhfr基因可与天然存在的基因具有77%的相似性。
[cyp-cor]如上文关于差向异构化1-bia所论述的,工程化宿主细胞可修饰bia差向异构酶的表达。bia差向异构酶由cyp-cor基因(例如,cyp82y2-cor基因)编码。cyp-cor基因也可称为drs-drr基因。在一些实例中,bia差向异构酶催化(s)-1-bia→(r)-1-bia的转化,参考图7。具体而言,图7示出了根据本发明的实施方案,用于将l-酪氨酸转化为吗啡喃生物碱的生物合成方案。图7提供了酶cpr,细胞色素p450还原酶;cyp-cor,细胞色素p450cyp82y1样可待因酮还原酶样融合物;salsyn,沙罗泰里啶合酶;salr,沙罗泰里啶还原酶;salat,沙罗泰里啶醇7-o-乙酰转移酶;t6odm,蒂巴因6-o-脱甲基酶;cor,可待因酮还原酶;以及codm,可待因-o-脱甲基酶的使用。
工程化宿主细胞可被修饰以在工程化宿主细胞中包括cyp-cor基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控cyp-cor基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入cyp-cor基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达cyp-cor基因的强启动子元件的引入。cyp-cor基因可衍生自大红罂粟、罂粟、渥美罂粟、白屈菜或另外的物种。在一些实例中,cyp-cor基因可与天然存在的基因具有77%的相似性。
[cpr]在一些实例中,工程化宿主细胞可修饰酶细胞色素p450还原酶的表达。细胞色素p450还原酶由cpr基因编码。在一些实例中,细胞色素p450还原酶催化(r)-牛心果碱→沙罗泰里啶的反应,参考图7。备选地,细胞色素p450还原酶催化其他反应,诸如整个申请的附图中所述的那些反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括cpr基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控cpr基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入cpr基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达cpr基因的强启动子元件的引入。cpr基因可衍生自花菱草、罂粟、智人、酿酒酵母、拟南芥或另外的物种。在一些实例中,cpr基因可与天然存在的基因具有100%的相似性。
[salsyn]在一些实例中,工程化宿主细胞可修饰酶沙罗泰里啶合酶的表达。沙罗泰里啶合酶由salsyn基因编码。在一些实例中,沙罗泰里啶合酶催化(r)-牛心果碱→沙罗泰里啶的反应,参考图7。工程化宿主细胞可被修饰以在工程化宿主细胞中包括salsyn基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控salsyn基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入salsyn基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达salsyn基因的强启动子元件的引入。在一些情况下,salsyn基因可经密码子优化以在酿酒酵母中表达。在一些实例中,salsyn可以在n末端处进行修饰。salsyn基因可衍生自罂粟、罂粟属物种、白屈菜或另外的物种。在一些实例中,salsyn基因可与天然存在的基因具有78%的相似性。
[salr]在一些实例中,工程化宿主细胞可修饰酶沙罗泰里啶还原酶的表达。沙罗泰里啶还原酶由salr基因编码。在一些实例中,沙罗泰里啶还原酶可逆地催化沙罗泰里啶醇→沙罗泰里啶的反应,参考图7。工程化宿主细胞可被修饰以在工程化宿主细胞中包括salr基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控salr基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入salr基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达salr基因的强启动子元件的引入。在一些情况下,salr基因可经密码子优化以在酿酒酵母中表达。salr基因可衍生自罂粟、大红罂粟、罂粟属物种、白屈菜或另外的物种。在一些实例中,salr基因可与天然存在的基因具有80-100%的相似性。
[salat]在一些实例中,工程化宿主细胞可修饰酶乙酰-coa:沙罗泰里啶醇7-o-乙酰转移酶的表达。乙酰-coa:沙罗泰里啶醇7-o-乙酰转移酶由salat基因编码。在一些实例中,乙酰-coa:沙罗泰里啶醇7-o-乙酰转移酶催化乙酰-coa+沙罗泰里啶醇→coa+7-o-乙酰基沙罗泰里啶醇的反应,参考图7。工程化宿主细胞可被修饰以在工程化宿主细胞中包括salat基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控salat基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入salat基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达salat基因的强启动子元件的引入。在一些情况下,salat基因可经密码子优化以在酿酒酵母中表达。salat基因可衍生自罂粟、大红罂粟、东方罂粟(papaverorientale)、罂粟属物种或另外的物种。在一些实例中,salat基因可与天然存在的基因具有77-80%的相似性。
[t6odm]在一些实例中,工程化宿主细胞可修饰酶蒂巴因6-o-脱甲基酶的表达。蒂巴因6-o-脱甲基酶由t6odm基因编码。在一些实例中,蒂巴因6-o-脱甲基酶催化蒂巴因→尼奥品酮的反应,参考图7。一旦已经产生尼奥品酮,尼奥品酮可转化为可待因酮。尼奥品酮→可待因酮的转化可自发发生。或者,尼奥品酮→可待因酮的转化可由于催化反应而发生。在其他实例中,t6odm酶可催化除蒂巴因之外的底物的o-脱甲基化。例如,t6odm可使东罂粟碱o-脱甲基化,产生吗啡酮。或者,t6odm可催化1-苄基异喹啉、原小檗碱或原阿片碱种类之内的bia(诸如分别为罂粟碱、坎那定和别隐品碱(allocryptopine))的o-脱甲基化。工程化宿主细胞可被修饰以在工程化宿主细胞中包括t6odm基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控t6odm基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入t6odm基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达t6odm基因的强启动子元件的引入。在一些情况下,t6odm基因可经密码子优化以在酿酒酵母中表达。t6odm基因可衍生自罂粟或另外的物种。在一些实例中,t6odm基因可与天然存在的基因具有76.2%的相似性。
[cor]在一些实例中,工程化宿主细胞可修饰酶可待因酮还原酶的表达。可待因酮还原酶由cor基因编码。在一些实例中,可待因酮还原酶催化可待因酮到可待因的反应,参考图7。在一些情况下,可待因酮还原酶可催化尼奥品酮到尼奥品的反应。在其他实例中,cor可催化其他吗啡喃的还原,包括氢可酮→二氢可待因、14-羟基可待因酮→14-羟基可待因,以及氢吗啡酮→二氢吗啡。工程化宿主细胞可被修饰以在工程化宿主细胞中包括cor基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控cor基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入cor基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达cor基因的强启动子元件的引入。在一些情况下,cor基因可经密码子优化以在酿酒酵母中表达。另外地或备选地,cor基因可通过添加针对线粒体、液泡、内质网或其组合的靶向序列进行修饰。cor基因可衍生自罂粟或另外的物种。在一些实例中,cor基因可与天然存在的基因具有76-78%的相似性。在实例中,cor基因可与天然存在的基因具有76.8%、77.0%、77.3%或77.7%的相似性。
[codm]在一些实例中,工程化宿主细胞可修饰酶可待因o-脱甲基酶的表达。可待因o-脱甲基酶由codm基因编码。在一些实例中,可待因o-脱甲基酶催化可待因到吗啡的反应,参考图7。可待因o-脱甲基酶还可催化尼奥品到尼奥吗啡的反应。可待因o-脱甲基酶还可催化蒂巴因到东罂粟碱的反应。在其他实例中,codm可催化1-苄基异喹啉、阿朴啡和原小檗碱种类之内的bia(诸如分别为牛心果碱、异紫堇定和金黄紫堇碱)的o-脱甲基化。在其他实例中,codm酶可催化o,o-脱亚甲基化反应,以切割原阿片碱中的亚甲基二氧桥结构。工程化宿主细胞可被修饰以在工程化宿主细胞中包括codm基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控codm基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入codm基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达codm基因的强启动子元件的引入。在一些情况下,codm基因可经密码子优化以在酿酒酵母中表达。另外地或备选地,codm基因可通过添加针对线粒体的靶向序列进行修饰。codm基因可衍生自罂粟、罂粟属物种或另外的物种。在一些实例中,codm基因可与天然存在的基因具有75%的相似性。在实例中,codm基因可与天然存在的基因具有75.2%的相似性。
[bbe]在一些实例中,工程化宿主细胞可修饰酶小檗碱桥酶的表达。小檗碱桥酶由bbe基因编码。在一些实例中,小檗碱桥酶催化(s)-牛心果碱→(s)-金黄紫堇碱的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括bbe基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控bbe基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入bbe基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达bbe基因的强启动子元件的引入。bbe基因可衍生自罂粟、蓟罂粟、花菱草、匍枝小檗、黄唐松草粉绿亚种(thalictrumflavumsubsp.glaucum)、日本黄连、罂粟属物种或另外的物种。在一些实例中,bbe基因可与天然存在的基因具有99%的相似性。
[s9omt]在一些实例中,工程化宿主细胞可修饰酶s-腺苷-l-甲硫氨酸:(s)-金黄紫堇碱9-o-甲基转移酶的表达。s-腺苷-l-甲硫氨酸:(s)-金黄紫堇碱9-o-甲基转移酶由s9omt基因编码。在一些实例中,s-腺苷-l-甲硫氨酸:(s)-金黄紫堇碱9-o-甲基转移酶催化s-腺苷-l-甲硫氨酸+(s)-金黄紫堇碱→s-腺苷-l-高半胱氨酸+(s)-四氢非洲防己碱的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括s9omt基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控s9omt基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入s9omt基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达s9omt基因的强启动子元件的引入。在一些情况下,s9omt基因可经密码子优化以在酿酒酵母中表达。s9omt基因可衍生自黄唐松草粉绿亚种、日本黄连、黄连、罂粟、唐松草属物种、黄连属物种、罂粟属物种或另外的物种。在一些实例中,s9omt基因可与天然存在的基因具有100%的相似性。在一些实例中,s9omt基因可与天然存在的基因具有80%的相似性。
[cas]在一些实例中,工程化宿主细胞可修饰酶(s)-坎那定合酶的表达。(s)-坎那定合酶由cas基因编码。在一些实例中,(s)-坎那定合酶催化(s)-四氢非洲防己碱→(s)-坎那定的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中表达cas基因。工程化宿主细胞可被修饰以在工程化宿主细胞中包括cas基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控cas基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入cas基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达cas基因的强启动子元件的引入。cas基因可衍生自黄唐松草粉绿亚种、日本黄连、唐松草属物种、黄连属物种或另外的物种。在一些实例中,cas基因可以是100%
[stox]在一些实例中,工程化宿主细胞可修饰酶(s)-四氢原小檗碱氧化酶的表达。(s)-四氢原小檗碱氧化酶由stox基因编码。在一些实例中,(s)-四氢原小檗碱氧化酶催化(s)-四氢小檗碱+2o2→小檗碱+2h2o2的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括stox基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控stox基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入stox基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达stox基因的强启动子元件的引入。在一些实例中,stox可在n末端处进行修饰。在一些情况下,stox基因可经密码子优化以在酿酒酵母中表达。stox基因可衍生自金花小檗、日本黄连、小檗属物种、黄连属物种或另外的物种。在一些实例中,stox基因可与天然存在的基因具有78%的相似性。
[tnmt]在一些实例中,工程化宿主细胞可修饰酶四氢原小檗碱-n-甲基转移酶的表达。四氢原小檗碱-n-甲基转移酶由tnmt基因编码。在一些实例中,四氢原小檗碱-n-甲基转移酶催化坎那定→n-甲基坎那定的反应,在一些实例中,四氢小檗碱-n-甲基转移酶催化去甲羟吗啡酮→纳洛酮的反应,参考图26。
在其他实例中,四氢小檗碱-n-甲基转移酶催化刺罂粟碱→顺式-n-甲基刺罂粟碱的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括tnmt基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控tnmt基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入tnmt基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达tnmt基因的强启动子元件的引入。在一些情况下,tnmt基因可经密码子优化以在酿酒酵母中表达。tnmt基因可衍生自罂粟、花菱草、大红罂粟、蓟罂粟或另外的物种。在一些实例中,tnmt基因可与天然存在的基因具有100%的相似性。在实例中,tnmt基因可与天然存在的基因具有81%的相似性。
[cfs]在一些实例中,工程化宿主细胞可修饰酶碎叶紫堇碱合酶的表达。碎叶紫堇碱合酶由cfs基因编码。在实例中,碎叶紫堇碱合酶催化金黄紫堇碱→碎叶紫堇碱的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括cfs基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控cfs基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入cfs基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达cfs基因的强启动子元件的引入。cfs基因可衍生自罂粟、花菱草、蓟罂粟或另外的物种。在一些实例中,cfs基因可与天然存在的基因具有77%、78%或79%的相似性。另外,cfs基因可经密码子优化以在酿酒酵母中表达。
[sts]在一些实例中,工程化宿主细胞可修饰酶刺罂粟碱合酶的表达。刺罂粟碱合酶由sts基因编码。在实例中,刺罂粟碱合酶催化碎叶紫堇碱→刺罂粟碱的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括sts基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控sts基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入sts基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达sts基因的强启动子元件的引入。sts基因可衍生自罂粟、花菱草、蓟罂粟或另外的物种。在一些实例中,sts基因可与天然存在的基因具有76%、78%或79%的相似性。另外,sts基因可经密码子优化以在酿酒酵母中表达。
[msh]在一些实例中,工程化宿主细胞可修饰酶顺式-n-甲基刺罂粟碱14-羟化酶的表达。顺式-n-甲基刺罂粟碱14-羟化酶由msh基因编码。在实例中,顺式-n-甲基刺罂粟碱14-羟化酶催化顺式-n-甲基刺罂粟碱→原阿片碱的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括msh基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控msh基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入msh基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达msh基因的强启动子元件的引入。msh基因可衍生自罂粟或另外的物种。在一些实例中,msh基因可与天然存在的基因具有79%的相似性。另外,msh基因可经密码子优化以在酿酒酵母中表达。
[p6h]在一些实例中,工程化宿主细胞可修饰酶原阿片碱-6-羟化酶的表达。原阿片碱-6-羟化酶由p6h基因编码。在实例中,原阿片碱-6-羟化酶催化原阿片碱→6-羟基原阿片碱的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括p6h基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控p6h基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入p6h基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达cfs基因的强启动子元件的引入。p6h基因可衍生自罂粟、花菱草或另外的物种。在一些实例中,p6h基因可与天然存在的基因具有79%的相似性。另外,p6h基因可经密码子优化以在酿酒酵母中表达。
[dbox]在一些实例中,工程化宿主细胞可修饰酶二氢苯并菲啶氧化酶的表达。二氢苯并菲啶氧化酶由dbox基因编码。在实例中,二氢苯并菲啶氧化酶催化二氢血根碱→血根碱的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括dbox基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控dbox基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入dbox基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达dbox基因的强启动子元件的引入。dbox基因可衍生自罂粟或另外的物种。在一些实例中,dbox基因可与天然存在的基因具有100%的相似性。另外,dbox基因可经密码子优化以在酿酒酵母中表达。
[mora]在一些实例中,工程化宿主细胞可修饰酶吗啡脱氢酶的表达。吗啡脱氢酶由mora基因编码。在一些实例中,吗啡脱氢酶催化吗啡→吗啡酮的反应,参考图8。在其他实例中,吗啡脱氢酶催化可待因酮→可待因的反应,同样参考图8。图8示出了根据本发明的实施方案,用于产生半合成的阿片类物质的生物合成方案。具体而言,图8示出了通过掺入mora(吗啡脱氢酶)和morb(吗啡还原酶),蒂巴因在酵母中延伸的转化。图30示出了根据本发明的实施方案,蒂巴因的另外的转化。
工程化宿主细胞可被修饰以在工程化宿主细胞中包括mora基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控mora基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入mora基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达mora基因的强启动子元件的引入。在一些情况下,mora基因可经密码子优化以在酿酒酵母中表达。mora基因可衍生自恶臭假单胞菌或另外的物种。在一些实例中,mora基因可与天然存在的基因具有73.7%的相似性。
[morb]在一些实例中,工程化宿主细胞可修饰酶吗啡酮还原酶的表达。吗啡酮还原酶由morb基因编码。在一些实例中,吗啡酮还原酶催化可待因酮→氢可酮的反应,参考图8。在其他实例中,吗啡酮还原酶催化吗啡酮→氢吗啡酮的反应,同样参考图8。在其他实例中,吗啡酮还原酶催化14-羟基可待因酮→羟考酮的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括morb基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控morb基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入morb基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达morb基因的强启动子元件的引入。在一些情况下,morb基因可经密码子优化以在酿酒酵母中表达。morb基因可衍生自恶臭假单胞菌或另外的物种。在一些实例中,morb基因可与天然存在的基因具有67.2%的相似性。
[cyp80a1]在一些实例中,工程化宿主细胞可表达酶小檗宁合酶。小檗宁合酶由针对细胞色素p450酶80a1(cyp80a1)的基因编码。在一些实例中,cyp80a1催化(s)-n-甲基乌药碱+(r)-n-甲基乌药碱→小檗宁的反应。在其他实例中,cyp80a1催化(r)-n-甲基乌药碱+(r)-n-甲基乌药碱→guattegaumerine的反应。在其他实例中,cyp80a1催化(r)-n-甲基乌药碱+(s)-乌药碱→2’去甲小檗宁的反应。工程化宿主细胞可被修饰以在工程化宿主细胞中包括cyp80a1基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控cyp80a1基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入cyp80a1基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达cyp80a1基因的强启动子元件的引入。在一些情况下,cyp80a1基因可经密码子优化以在酿酒酵母中表达。cyp80a1基因可衍生自匍枝小檗或另外的物种。在一些实例中,cyp80a1基因可与天然存在的基因具有76%的相似性。
[poda]在一些实例中,工程化宿主细胞可表达酶原阿片碱o-脱烷基酶。原阿片碱o-脱烷基酶由基因poda编码。在一些实例中,poda催化原小檗碱类和原阿片碱类如坎那定、刺罂粟碱、小檗碱、隐品碱、别隐品碱和原阿片碱的o,o-脱亚甲基化。在一些实例中,poda催化包括四氢罂粟碱、四氢巴马亭和隐品碱在内的bia的o-脱甲基化。工程化宿主细胞可被修饰以在工程化宿主细胞中包括poda基因的组成型表达。另外地或备选地,工程化宿主细胞可被修饰以合成性地调控poda基因在工程化宿主细胞中的表达。在实例中,工程化宿主细胞可被修饰以掺入poda基因的一个拷贝、多个拷贝或另外的拷贝。另外地或备选地,工程化宿主细胞可被修饰以掺入用于在工程化宿主细胞内过表达poda基因的强启动子元件的引入。在一些情况下,poda基因可经密码子优化以在酿酒酵母中表达。poda基因可衍生自罂粟或其他物种。在一些实例中,poda基因可与天然存在的基因具有70-100%的相似性。
[bm3]在一些实例中,工程化宿主细胞可表达酶bm3。bm3是在其天然宿主中与脂肪酸单加氧化有关的巨大芽孢杆菌(bacillusmegaterium)细胞色素p450。在一些情况下,bm3使阿片类物质n-脱甲基化以产生去甲阿片类物质,参考图27。bm3也易于在酵母和细菌中作为活性异源酶表达。bm3作为生物合成酶具有若干优点,包括其是可溶的、带有融合的还原酶伙伴蛋白以及可容易地被工程化以接受新的底物。另外,表6示出了bm3n-脱甲基酶的变体。
前述基因的实例可由宿主细胞中多种不同的平台表达,包括质粒(2μ,ars/cen)、yac或基因组。此外,前述基因序列的实例可以是天然的,或经密码子优化以在期望的异源宿主(例如,酿酒酵母)中表达。
实施例
以下实施例为了说明本发明的各个实施方案的目的而给出,并且不意味着以任何方式限制本发明。本发明实施例以及目前代表优选实施方案的本文所述的方法是示例性的,并非旨在限制本发明的范围。本领域技术人员将会想到包含在由权利要求范围限定的本发明精神内的其变化以及其他用途。
实施例1:酪氨酸羟化酶突变体改善工程化酵母菌株中的牛心果碱产生
使来自褐家鼠的酪氨酸羟化酶进行酵母密码子优化,合成,并且克隆到低拷贝质粒中。通过定点诱变生成单突变体(w166y,e332d,s40d,和r37er38e)、双突变体(w166y和e332d,w166y和s40d,w166y和r37er38e)以及一种三突变体(w166y、r37er38e和e332d)。每种tyrh突变体由具有gpd启动子的低拷贝质粒在酵母菌株中表达,所述酵母菌株包含对中心代谢的以下突变(如美国临时专利申请序列号61/899,496中所述):aro4fbr、δzwf1和gpd-tkl1启动子替换。此外,所述菌株表达来自恶臭假单胞菌的dopa脱羧酶(dodc)的染色体整合的拷贝,来自褐家鼠的生成辅底物四氢生物蝶呤的四种染色体整合的基因(丙酮酰四氢蝶呤合酶,ptps;墨蝶呤还原酶,sepr;蝶呤4a-甲醇胺脱水酶,pcd;二氢蝶啶还原酶,qdhpr),由具有gpd启动子的低拷贝质粒表达的来自日本黄连的去甲乌药碱合酶(ncs),以及用于由去甲乌药碱生物合成牛心果碱的五种基因(罂粟6-o-甲基转移酶,ps6omt;罂粟乌药碱n-甲基转移酶,pscnmt;花菱草细胞色素p45080b1,eccyp80b1;罂粟细胞色素p450nadph还原酶,pscpr;以及罂粟3’羟基-n-甲基乌药碱4’-o-甲基转移酶,ps4’omt)。使携带tyrh突变体的菌株在缺乏酪氨酸且具有2%右旋糖的选择性限定的培养基(ynb)中生长96小时,并且通过lc-ms/ms在mrm模式下利用330m/z至137m/z的转变测量培养基中牛心果碱的产生。图9示出了该测定的结果并且表明在与野生型tyrh进行比较时,tyrh突变体可使牛心果碱产生改善多至5倍。因而,图9示出了根据本发明的实施方案,改善在工程化酵母菌株中由糖产生牛心果碱的酪氨酸羟化酶突变体。
实施例2:dhfr的表达改善工程化酵母菌株中的酪氨酸羟化酶活性使来自褐家鼠的二氢叶酸还原酶(dhfr)进行酵母密码子优化,合成,并且克隆到在gpd启动子控制下的低拷贝质粒中。dhfr与野生型rntyrh在酵母菌株中共表达(具有gpd启动子的低拷贝质粒),所述酵母菌株包含对中心代谢的以下突变(如美国临时专利申请序列号61/899,496中所述):aro4fbr、δzwf1和gpd-tkl1启动子替换。此外,所述菌株表达来自褐家鼠的生成辅底物四氢生物蝶呤的四种染色体整合的基因(丙酮酰四氢蝶呤合酶,ptps;墨蝶呤还原酶,sepr;蝶呤4a-甲醇胺脱水酶,pcd;二氢蝶啶还原酶,qdhpr)。使表达dhfr和野生型rntyrh的菌株在缺乏酪氨酸且具有2%右旋糖的选择性限定的培养基(ynb)中生长96小时,并且通过lc-ms/ms在mrm模式下利用198m/z至152m/z的转变测量培养基中l-dopa的产生。dhfr与野生型rntyrh的表达使l-dopa产生增加1.8倍,如图10中所示。因而,图10示出了根据本发明的实施方案,改善工程化酵母菌株中通过酪氨酸羟化酶的l-dopa产生的二氢叶酸还原酶(dhfr)的共表达。
实施例3:向生长培养基添加抗氧化剂改善工程化酵母菌株中的酪氨酸羟化酶活性
使酵母菌株在缺乏酪氨酸且具有2%半乳糖和2mm抗坏血酸的选择性限定的培养基(ynb)中生长96小时,所述酵母菌株包含对中心代谢的以下突变(如美国临时专利申请序列号61/899,496中所述):aro4fbr、δzwf1和gpd-tkl1启动子替换,并且由在gpd启动子控制下的低拷贝质粒表达来自褐家鼠的生成辅底物四氢生物蝶呤的四种染色体整合的基因(丙酮酰四氢蝶呤合酶,ptps;墨蝶呤还原酶,sepr;蝶呤4a-甲醇胺脱水酶,pcd;二氢蝶啶还原酶,qdhpr)以及野生型rntyrh。
通过lc-ms/ms在mrm模式下利用198m/z至152m/z的转变测量培养基中l-dopa的产生。2mm抗坏血酸的添加使利用野生型rntyrh的l-dopa产生改善1.8倍。此外,通过lc-ms/ms在mrm模式下利用以下转变测量bh4中间体浓度:b,238m/z至178m/z;bh2,240m/z至165m/z;以及bh4,242m/z至166m/z。抗坏血酸的添加还增加培养基中的bh4,这表明防止了bh4氧化成bh2。
因此,图11a示出了根据本发明的实施方案,向培养基添加抗氧化剂改善工程化酵母菌株中通过酪氨酸羟化酶的l-dopa产生,以及(b)向培养基中添加抗氧化剂提高bh4水平。具体而言,图11a示出了野生型rntyrh(由gpd启动子控制下的低拷贝质粒表达)在酵母菌株中表达,所述酵母菌株包含对中心代谢的以下突变(如美国临时专利申请序列号61/899,496中所述):aro4fbr、δzwf1和gpd-tkl1启动子替换。此外,所述菌株表达来自褐家鼠的生成辅底物四氢生物蝶呤的四种染色体整合的基因(丙酮酰四氢蝶呤合酶,ptps;墨蝶呤还原酶,sepr;蝶呤4a-甲醇胺脱水酶,pcd;二氢蝶啶还原酶,qdhpr)。使表达野生型rntyrh的菌株在缺乏酪氨酸且具有2%右旋糖,具有和不具有2mm抗坏血酸(aa)的选择性限定的培养基(ynb)中生长96小时。通过lc-ms/ms在mrm模式下利用198m/z至152m/z的转变测量培养基中l-dopa的产生。另外,图11b示出,在图11a中所述的相同菌株中,通过lc-ms/ms在mrm模式下利用以下转变:bh4,242m/z至166m/z,来测量在具有和不具有2mm抗坏血酸(aa)的情况下生长的菌株的培养基中bh4中间体的浓度。
实施例4.差向异构酶的鉴定
为了鉴定适用于进行本文所公开的方法的差向异构化反应的差向异构酶,在公共可用的植物转录组中的单个开放阅读框(cyp-cor)中鉴定细胞色素p450氧化酶82y1样结构域和可待因酮还原酶样结构域。使用blastn通过1000plantsproject(matasci等人2014.gigascience.3:17)和phytometasyn(facchini等人2012.trendsbiotechnol.30:127-31;xiao等人2013.j.biotechnol.166:122-34)转录组的blast搜索鉴定cyp-cor融合物,其中查询导致牛心果碱积累的先前公开的cor沉默的vigs构建体的序列(wijekoon和facchini.2012.plantj.69:1052-63)。一旦观察到一个cyp-cor融合物序列作为命中,则翻译该序列并且使用氨基酸序列作为查询,从而使用tblastn进行两个数据库的二次搜索。由数据库鉴定的cyp-cor融合酶的系统树提供于图13中。基于生物信息学搜索由the1000plantsproject和phytometasyn转录组数据库鉴定该序列。另外,示例性氨基酸序列提供于图4中,如上文所讨论的。另外,表1列出了针对该cyp-cor酶鉴定的氨基酸序列的各种实例,其来自各种植物,包括罂粟(鸦片罂粟)、渥美罂粟(特洛伊罂粟)、大红罂粟(伊朗罂粟)和白屈菜(大白屈菜)。
实施例5.工程化非植物宿主细胞中(s)-牛心果碱到(r)-牛心果碱的差向异构化
非植物宿主细胞被工程化以异源表达本文所述的酶。例如,酵母菌株(酿酒酵母)被工程化以异源表达实施例4中所述的所鉴定的差向异构酶,并且在该微生物宿主的背景下验证它们的功能。将部分氨基酸序列pbr.pbrst1pf_4328和pbr.pbrst1pf_89405的酵母密码子优化的dna编码序列与ssdu-2015634(表1)的氨基酸1-40的酵母密码子优化的编码序列一起进行框内合成,以分别生成cyp-cor_4328和cyp-cor_89405。将这些cyp-cor编码序列克隆到携带ura3选择标记的低拷贝质粒中并且由tdh3启动子表达。将质粒转化到携带针对整合到染色体中的细胞色素p450还原酶的表达盒(ptef1-atr1或ptef1-pscprv2)的酵母菌株中。使携带两种质粒的这些酵母菌株在具有适当的撤除成分溶液(dropoutsolution)(-ura-trp)的合成完全培养基中生长。向酵母菌株供给(s)-牛心果碱并且在生长72小时之后通过lc-ms/ms分析对bia代谢物进行分析。
实施例6.在工程化酵母细胞中由(s)-牛心果碱产生沙罗泰里啶
酵母菌株(酿酒酵母)被工程化以异源表达实施例4中所述的所鉴定的差向异构酶并且在该微生物宿主的背景下验证它们的功能。将部分氨基酸序列pbr.pbrst1pf_4328和pbr.pbrst1pf_89405的酵母密码子优化的dna编码序列与ssdu-2015634(表1)的氨基酸1-40的酵母密码子优化的编码序列一起进行框内合成,以分别生成cyp-cor_4328和cyp-cor_89405。将这些cyp-cor编码序列克隆到携带ura3选择标记的低拷贝质粒中并且由tdh3启动子表达。将沙罗泰里啶合酶(salsyn)编码序列克隆到携带trp1选择标记的低拷贝质粒中并且由tdh3启动子表达。将质粒转化到携带整合到染色体中的细胞色素p450还原酶的表达盒(ptef1-atr1或ptef1-pscprv2)的酵母菌株中。使携带两种质粒的这些酵母菌株在具有适当的撤除成分溶液(-ura-trp)的合成完全培养基中生长。向酵母菌株供给(s)-牛心果碱并且在生长72小时之后通过lc-ms/ms分析对bia代谢物进行分析。分析表明,工程化酵母细胞能够将(s)-牛心果碱转化成(r)-牛心果碱,该(r)-牛心果碱随后受到沙罗泰里啶合酶的作用形成沙罗泰里啶(一种4环原吗啡喃生物碱)(图7、图14)。沙罗泰里啶合酶先前已经显示出作用于(r)-牛心果碱,并且对(s)-牛心果碱没有可观察到的活性(gesell等人2009.j.biol.chem.284:24432-42)。
如图7所示,cyp-cor催化(s)-牛心果碱到(r)-牛心果碱的转化,(r)-牛心果碱随后受到沙罗泰里啶合酶的作用以制备原吗啡喃生物碱沙罗泰里啶。图14示出了(a)显示牛心果碱和沙罗泰里啶针对两种差向异构酶变体(cyp-cor_89405、cyp-cor_4328)以及标准品的色谱图迹线。图14还示出了(b)重新作图以展示与标准品的共洗脱的(a)中的沙罗泰里啶的相同色谱图迹线。在该实验中,酵母包含具有ura3和trp1选择性标记、tdh3启动子以及cyp-cor和salsyn编码序列的两种低拷贝cen/ars质粒。使酵母从新鲜转化的菌落开始在3ml选择培养基中生长过夜,反向稀释到3.5ml培养基中至od0.8,生长7小时,沉淀,然后重悬于具有100μm(s)-牛心果碱(specs)的ph7.4hepes缓冲液中。在30℃下在旋转器上保持16小时之后,使酵母沉淀并且通过lc-ms/ms分析缓冲液上清液。每条迹线来自代表2个样品的单一样品。将峰归一化,以使所有色谱图中最大的峰为100%。
实施例7.在工程化非植物宿主细胞中由外消旋的全去甲劳丹碱产生(r)–牛心果碱
酵母菌株(酿酒酵母)被工程化以异源表达实施例4中所述的所鉴定的差向异构酶,并且在该微生物宿主的背景下验证它们的功能。将实施例5中所述的酵母密码子优化的dna编码序列cyp-cor_89405克隆到携带ura3选择标记的低拷贝质粒中并且由tdh3启动子表达。将该质粒转化到携带整合到染色体中的细胞色素p450还原酶的表达盒(ptef1-atr1或ptef1-pscprv2)和三种甲基转移酶(罂粟去甲乌药碱-6-o-甲基转移酶、乌药碱n-甲基转移酶和3’-羟基-n-甲基乌药碱4’-o-甲基转移酶,均由ptef1表达)的酵母菌株中。使携带质粒的该酵母菌株在具有适当的撤除成分溶液(-ura)的合成完全培养基中生长。向酵母菌株供给外消旋的全去甲劳丹碱并且在生长72小时之后通过lc-ms/ms分析对bia代谢物进行分析。对于手性表征,通过沉淀5ml酵母培养物并且向4ml上清液中添加120mgxad-4树脂,在室温下在旋转机上温育过夜,并且用0.5ml甲醇洗脱,从而从酵母培养基浓缩牛心果碱。通过反相hplc(pursuitxrs-c18,5μm,50mm×10mm),利用等度15%甲醇与0.1%甲酸经6.5min使浓缩物分级,其中流速为5ml/min并且进样体积为40-50μl。在大约4.5min时收集基于峰的级分。将级分汇集、冷冻干燥并且重悬于0.5ml异丙醇中。根据浓度,将0.5-5μl注入到手性柱(phenomenexlux纤维素-1,3μm,150mmx2mm)上,并且利用等度的72%n-己烷、28%异丙醇、0.1%二乙胺进行分离,其中流速为0.3ml/min,并且通过ms和250nmuv进行检测。通过agilent6320iontrap质谱仪,在esi源气体温度350℃、气体流10l/min、喷雾器压力40psi以及m/z330.1的隔离(宽度为1.0)进行ms检测。将牛心果碱峰的保留时间与可靠的(s)-牛心果碱和(r)-牛心果碱标准品的保留时间进行比较。分析表明,包含cyp-cor质粒的工程化酵母细胞能够将外消旋的全去甲劳丹碱转化为(r)-牛心果碱,而具有空质粒的工程化酵母细胞仅产生(s)-牛心果碱(图15)。
实施例8:沙罗泰里啶合酶的蛋白质工程化当在微生物宿主中表达时改善其加工和活性
异源蛋白当在重组宿主中表达时可能不正确地加工,例如,在微生物产生宿主中表达的植物蛋白如细胞色素p450酶。例如,将(r)-牛心果碱转化为沙罗泰里啶的沙罗泰里啶合酶当在酵母中异源表达时经历n-连接的糖基化(图16a和图16b)。在沙罗泰里啶合酶上所观察到的n-连接的糖基化模式当酶在植物中表达时未观察到,并且指示初生salsyn转录物的不正确的n末端分选,这降低了酶在异源微生物宿主中的活性。因此,针对校正初生转录物的n末端分选并从而去除n连接的糖基化模式的蛋白质工程化将导致重组产生宿主中沙罗泰里啶合酶的活性得到改善。
例如,使用来自碎叶紫堇碱合酶(cfs)的n末端α-螺旋替换来自沙罗泰里啶合酶(salsyn,图17)的n末端α-螺旋。这些融合物的接合点基于cfs和salsyn的二级结构基序或基于cfs和salsyn的氨基酸比对进行选择。通过扩增彼此与另一片段重叠15-40个核苷酸的来自cfs的n末端片段和来自salsyn的c末端片段来克隆融合物,然后通过gibson组装将它们与彼此以及载体骨架进行组装以形成完整的融合物开放阅读框(gibson等人natmethods.6:343-5)。
作为另一个实例,将来自沙罗泰里啶合酶的细胞色素p450结构域的编码序列直接置于其他稳定表达的细胞色素p450如bm3酶的p450编码区中。例如,沙罗泰里啶合酶的保守细胞色素p450结构域和来自巨大芽胞杆菌p450单加氧酶cyp102a1(bm3,(michener和smolke.2012.metab.eng.14:306-16))的工程化变体的细胞色素p450结构域通过ncbi保守结构域搜索进行鉴定。设计引物以将bm3的前几个氨基酸的编码序列与沙罗泰里啶合酶的p450结构域的编码序列融合,随后将bm3结构域c末端的编码序列与p450结构域融合。与之前相同,通过gibson组装来组装该构建体。
通过western印迹分析来分析工程化沙罗泰里啶合酶蛋白融合物,以确认在酵母中的全长表达以及n-连接的糖基化模式的修饰或消除(图16a和图16b)。将沙罗泰里啶合酶和蛋白质融合物用人流感血凝素(ha)表位进行c末端标记并且克隆到适用于酵母和植物表达的表达质粒中。对于酵母,将酶编码序列克隆到携带ura3选择标记的低拷贝酵母/大肠杆菌穿梭载体中,并且由tdh3启动子表达。对于植物,通过根癌土壤杆菌(agrobacteriumtumefaciens)浸润将序列克隆到具有卡那霉素抗性和花椰菜花叶病毒(camv)35s启动子的大肠杆菌/根癌土壤杆菌穿梭载体中以供瞬时植物表达,所述花椰菜花叶病毒(camv)35s启动子的侧翼是来自豇豆花叶病毒rna-2的5’和3’-非翻译区。被工程化以表达沙罗泰里啶合酶的酵母表现出指示n-连接的糖基化的条带模式。通过在糖基化位点上进行定点诱变,我们确认了这种模式是由n-连接的糖基化造成的。相比之下,该酶的植物表达不导致指示n-连接的糖基化的条带模式,如图16a中所示。虽然n-连接的糖基化位点是未修饰的,但是工程化沙罗泰里啶合酶蛋白融合物当在酵母中表达时未被n-糖基化,如图16b中所示。通过western印迹,我们展示了酵母表达的融合酶呈现为单个条带,类似于对于植物表达的亲本酶所观察到的表达,这表明导致n-连接的糖基化的酵母中初生蛋白质的错误加工被工程化融合物修复。
针对当在酵母中异源表达时改善的酶活性对工程化沙罗泰里啶合酶蛋白融合物进行分析。将沙罗泰里啶合酶和工程化融合物的编码序列克隆到携带ura3选择标记的低拷贝质粒中并且由tdh3启动子表达。酵母具有整合到trp1基因座中的ptef1-pscprv2并且包含具有ura3选择标记和沙罗泰里啶合酶编码序列以及tdh3启动子的单个低拷贝质粒。使酵母从新鲜转化的菌落开始在1ml选择培养基(-ura)中生长过夜,并且以1:20反向稀释到具有10μm(r)-牛心果碱(torontoresearchchemicals)的96孔板中的0.5ml选择培养基中。在振荡培养箱中保持72-96小时之后,使酵母沉淀并且通过lc-ms/ms分析培养基上清液。分析表明,当在酵母中异源表达时,工程化沙罗泰里啶合酶相对于野生型序列表现出改善的活性(图18)。
图18示出了根据本发明的实施方案,改善在酵母中的活性的沙罗泰里啶合酶密码子优化和工程化融合物。如图18中所示,黑色条柱指示沙罗泰里啶合酶的天然野生型序列pscyp719b1。具有黑色边界的灰色条柱为来自罂粟的酵母密码子优化的变体和来自大红罂粟的新鉴定的序列。有斜线图案的条柱指示基于大红罂粟序列的具有最大改善的工程化融合物。误差线指示至少两个生物学重复的范围。来自大红罂粟、罂粟或渥美罂粟(或相关植物)的沙罗泰里啶合酶的天然的、合成的密码子优化的和/或蛋白质工程化的变体可用于这些工程化菌株中。
工程化沙罗泰里啶合酶蛋白融合物可在生物合成途径的背景下使用,以增加下游苄基异喹啉生物碱产物的产生。在一个实例中,酵母被工程化以异源表达编码工程化沙罗泰里啶合酶融合物、大红罂粟沙罗泰里啶还原酶以及罂粟沙罗泰里啶醇7-o-乙酰转移酶的酵母密码子优化的基因。将三个表达盒(ptdh3-d94ypsss、ptpi1-ypbsalr、ptef1-ypssalat)组装到具有trp1区段标记的酵母人工染色体(yac)中。将yac置于携带整合到染色体中的细胞色素p450还原酶的表达盒(ptef1-atr1或ptef1-ypscprv2)的酵母中。使酵母菌株在具有适当的撤除成分溶液(-trp)的合成完全培养基中生长并且供给(r)-牛心果碱。在生长96小时后通过lc-ms/ms分析对bia代谢物进行分析。分析表明,用工程化沙罗泰里啶合酶和其他途径酶工程化的酵母菌株产生吗啡喃生物碱蒂巴因,如图19的(a)中所示。
因此,图19示出了(a)根据本发明的实施方案,小规模成批发酵的lc-ms/ms分析,其中工程化酵母催化(r)-牛心果碱到蒂巴因的转化。如图19的(a)中所提供的,酵母菌株被工程化以具有整合到trp1基因座中的ptef1-atr1表达盒并且包含单个酵母人工染色体,所述酵母人工染色体具有trp1选择标记和三个表达盒:ptdh3-yeccfs1-83-ypsss95-505、ptpi1-ypbsalr和ptef1-ypssalat。使酵母从新鲜转化的菌落开始在3ml选择培养基中生长过夜,并且以1:20反向稀释到具有100μm(r)-牛心果碱(torontoresearchchemicals)的培养管中的0.5ml选择培养基(-trp)中。在振荡培养箱中保持72小时之后,使酵母沉淀并且通过lc-ms/ms分析培养基上清液。色谱图迹线显示出由该菌株产生的蒂巴因以及积累的沙罗泰里啶醇和沙罗泰里啶,以及标准品。这些迹线代表两个样品。
实施例9:下游吗啡喃分支中酶的蛋白质工程化以改善异源微生物宿主的吗啡喃产物的产生
在本发明的一个实施方案中,途径酶被工程化以表现出增加的活性,从而增加感兴趣的bia的产生。在该实施例中,通过用mutazymeii(参见表11)扩增向特定途径酶的开放阅读框中引入突变。在扩增反应中包括足够的模板dna,以产生每个基因1-4核苷酸置换的突变率。通过缺口修复直接在酵母中将诱变文库克隆到pyes1l载体中。在若干情况下,选择用于文库表达的酵母菌株包含生成诱变酶的底物的基因的整合拷贝。例如,将codm变体的文库转化到具有t6odm和cor1.3的整合拷贝的菌株中,并且在培养基中供给蒂巴因。t6odm和cor1.3在这些菌株中的表达确保了可待因和尼奥品将可用作针对每种引入的codm变体的底物。将各个菌落接种到96孔板中并且培养96小时,然后通过液相色谱-质谱(lc-ms)针对测定它们的产物的产生。在codm文库的实例中,所筛选的产物为吗啡和尼奥吗啡。在每次筛选中,对具有增强的bia产生的变体进行测序并且重新克隆以进行验证。表11包括通过筛选鉴定的在酵母中导致增加的bia产生的突变的酶变体的总结。
图20示出了这些突变体中的一个经过验证的增强的活性的数据。具体而言,图20示出了根据本发明的实施方案,通过随机诱变和筛选生成在酵母中表现出增强的活性的codm酶变体。通过利用易错pcr诱变编码区生成codm变体的文库。将通过筛选该文库鉴定的变体codmn35s,g335v被重新克隆到携带t6odm和cor1.3的整合拷贝的酵母菌株中并且在其中表达。将该菌株和另一种表达野生型codm的对照菌株在具有1mm蒂巴因的液体培养基中培养。96小时后,针对codm活性,通过lc-ms对培养基进行分析。变体codmn35s,g335v产生比表达野生型codm的菌株多1.4x的吗啡和多2.6x的尼奥吗啡。
实施例10:用以改善异源微生物宿主的苄基异喹啉生物碱产生的表达和生长条件的优化
工程化微生物宿主的苄基异喹啉生物碱产生可通过优化途径酶的表达以及生长条件而进一步得到改善。在一个实例中,通过由一系列不同的启动子表达酶来改变沙罗泰里啶醇7-o-乙酰转移酶在酵母中的表达。酵母被工程化以由不同的启动子异源表达编码罂粟沙罗泰里啶醇7-o-乙酰转移酶的酵母密码子优化的基因(如图21a中所提供的)。将两个表达盒(ptpi1-ypbsalr、px-ypssalat)组装到具有trp1区段标记的酵母人工染色体(yac)中。将yac置于酵母中并且使细胞在具有适当的撤除成分溶液(-trp)的合成完全培养基中生长,并且供给沙罗泰里啶。在生长72小时后通过lc-ms/ms分析对bia代谢物进行分析。途径酶表达水平的优化可导致吗啡喃生物碱蒂巴因的产生增加(如图21a中所提供的)。
菌株培养条件(包括但不限于糖源、生长温度和ph)的优化可用于增加工程化酵母菌株的苄基异喹啉生物碱的产生(如图21b和图21c中所提供的)。在一个实例中,改变ph来增加工程化酵母菌株的蒂巴因产生。将两个表达盒(ptpi1-ypbsalr、ptef1-ypssalat)组装到具有trp1区段标记的酵母人工染色体(yac)中。将yac置于酵母中并且使细胞在具有适当的撤除成分溶液(-trp)的合成完全培养基中生长,重悬于ph5.7-9的缓冲液中并且供给沙罗泰里啶。在温育16小时后通过lc-ms/ms分析对bia代谢物进行分析。4环原吗啡喃生物碱沙罗泰里啶醇和5环吗啡喃生物碱蒂巴因的水平随着ph的增加而增加(如图21的(b)中所提供的)。
在另一个实例中,改变温度、糖和培养基缓冲液含量以增加工程化酵母菌株的蒂巴因产生。将三个表达盒(ptdh3-d94ypsss、ptpi1-ypbsalr、ptef1-ypssalat)组装到具有trp1区段标记的酵母人工染色体(yac)中。将yac置于携带整合到染色体中的细胞色素p450还原酶的表达盒(ptef1-atr1或ptef1-ypscprv2)的酵母中。使酵母菌株在具有适当的撤除成分溶液(-trp)的合成完全培养基中生长并且供给(r)-牛心果碱。在生长72小时后通过lc-ms/ms分析对bia代谢物进行分析。分析表明,吗啡喃生物碱蒂巴因的微生物产生在某些培养条件下得到增加(30℃的具有右旋糖的缓冲培养基,如图21c中所提供的)。
因此,图21a、图21b和图21c示出了根据本发明的实施方案,通过工程化酵母将(r)-牛心果碱转化为蒂巴因的发酵优化。(a)salat启动子变体的全细胞缓冲测定的lc-ms/ms分析,(b)在不同ph条件下生长的salr和salat菌株的全细胞缓冲测定的lc-ms/ms分析,以及(c)糖源、生长温度和培养基缓冲液含量的优化全细胞缓冲测定的lc-ms/ms分析。(a)被工程化以包含具有trp1选择标记和具有变化的salat启动子的两个表达盒ptpi1-ypbsalr和px-ypssalat的单一酵母人工染色体的酵母菌株。使酵母从新鲜转化的菌落开始在3ml选择培养基中生长过夜,并且以1:20反向稀释到具有100μm沙罗泰里啶(specs)的培养管中的0.5ml培养基中。在振荡培养箱中保持72小时之后,使酵母沉淀并且通过lc-ms/ms分析培养基上清液。(b)被工程化以包含具有trp1选择标记和两个表达盒ptpi1-ypbsalr和ptef1-ypssalat的单一酵母人工染色体的酵母菌株。使酵母从新鲜转化的菌落开始在3ml选择培养基中生长过夜,反向稀释到3.5ml培养基中至od0.8,生长7小时,沉淀,然后重悬于具有10μm沙罗泰里啶(specs)的ph5.7的mops或者ph7、8或9的tris缓冲液中。在30℃下在旋转器上保持16小时之后,使酵母沉淀并且通过lc-ms/ms分析缓冲液上清液。误差线代表两个样品的范围。(c)糖源、生长温度和培养基缓冲液含量的优化。在该实验中,酵母菌株被工程化以具有整合到trp1基因座中的ptef1-atr1并且包含具有trp1选择标记和三个表达盒ptdh3-yeccfs1-83-ypsss95-505、ptpi1-ypbsalr和ptef1-ypssalat的单一酵母人工染色体。使酵母从新鲜转化的菌落开始在3ml选择培养基中生长过夜,并且以1:20反向稀释到具有100μm(r)-牛心果碱(torontoresearchchemicals)的培养管中的0.5ml培养基中。在振荡培养箱中保持72小时之后,使酵母沉淀并且通过lc-ms/ms分析培养基上清液。
实施例11:被工程化用于由早期1-苄基异喹啉生物碱支架产生蒂巴因的酵母
酵母菌株可被工程化用于由早期1-苄基异喹啉生物碱产生吗啡喃生物碱蒂巴因或衍生自蒂巴因的吗啡喃生物碱。作为实例,工程化酵母菌株可由外消旋或(s)-去甲乌药碱或者外消旋或(s)-全去甲劳丹碱产生吗啡喃生物碱产物(图5、图6和图7以及图23的(b))。通过将三个或五个表达盒整合到酵母基因组中将酵母菌株工程化以从(s)-去甲乌药碱或者外消旋或(s)-全去甲劳丹碱产生(s)-牛心果碱。为了由外消旋的或(s)-全去甲劳丹碱产生(s)-牛心果碱,整合的表达盒编码罂粟去甲乌药碱6-o-甲基转移酶(ps6omt,ec2.1.1.128)、4’-o-甲基转移酶(ps4’omt,ec2.1.1.116)和乌药碱-n-甲基转移酶(cnmt,ec2.1.1.140),所述表达盒各自具有tef1启动子(hawkins和smolke.2008.nat.chem.biol.4:564-73)。为了由外消旋或(s)-去甲乌药碱产生(s)-牛心果碱,菌株还携带用于酵母密码子优化的花菱草n-甲基乌药碱3’-羟化酶(yeccyp80b1,ec1.14.13.71)以及由tdh3或tef1启动子表达的atr1或ypscprv2细胞色素p450还原酶(cpr,ec1.6.2.4)的整合的表达盒。这些菌株被进一步工程化以掺入差向异构化催化酶(例如,cyp-cor)、沙罗泰里啶合酶、沙罗泰里啶还原酶和沙罗泰里啶醇乙酰转移酶,以将外消旋或(s)-去甲乌药碱或者外消旋或(s)-全去甲劳丹碱转化为吗啡喃生物碱蒂巴因,或衍生自蒂巴因的吗啡喃生物碱(图7)。作为差向异构化催化酶的表达的备选,6omt、4’omt、cnmt和/或cyp80b1可被工程化,使得由外消旋-去甲乌药碱或外消旋-全去甲劳丹碱产生外消旋-牛心果碱。
在一个实例中,酵母菌株被工程化以将外消旋-全去甲劳丹碱转化为蒂巴因。酵母菌株携带编码ps6omt、ps4’omt、cnmt和ypscprv2的整合的表达盒,所述表达盒各自具有tef1启动子。在该菌株中将四个表达盒(ptdh3-yeccfs1-83-ypsss95-505、ptpi1-ypbsalr、ptef1-ypssalat、phxt7-cyp-cor_89405)组装到具有trp1选择标记的酵母人工染色体(yac)中。使携带yac和整合的盒的酵母菌株在具有适当的撤除成分溶液(-trp)和1mm外消旋-全去甲劳丹碱底物的合成完全培养基中生长。生长96小时后,针对bia代谢物通过lc-ms/ms分析对培养基进行分析。检测到将近200nm蒂巴因(图19的(b))。其他工程化沙罗泰里啶合酶变体也可用于该菌株(图18,实施例8)。
实施例12:被工程化用于由l-酪氨酸产生牛心果碱的平台酵母菌株
构建由l-酪氨酸产生关键分支点bia中间体(s)-牛心果碱的平台酵母菌株(图5)。具体而言,将四种多基因表达构建体整合到酵母菌株的基因组中。四种构建体的组成在图22中指出。每种构建体由强组成型启动子表达的4或5种基因组成。将基因定位在每个基因座处作为包含启动子、基因开放阅读框和终止子的完整表达盒,如示意图上方的注释中所指明的。示意图通过代表给定基因的箭头的方向示出每个表达盒的取向。选择性标记在注释中是斜体的并且在示意图中通过灰色箭头表示。每个选择标记侧翼为loxp位点,以允许从基因座移除标记。另外,每个构建体具有侧翼为loxp位点的选择性标记,以便其可通过cre重组酶移除。
在第一整合构建体中,将来自褐家鼠的四种异源基因与g418选择标记(kanmx)一起整合到ybr197c基因座中。需要rnptps、rnsepr、rnpcd和rnqdhpr由酵母内源叶酸合成途径来合成和再生四氢生物蝶呤(bh4)。每个基因经密码子优化以在酵母中表达。
在第二整合构建体中,将四种异源基因与his5选择标记一起整合到his3基因座中。褐家鼠酪氨酸羟化酶(rntyrh)使用由先前的整合构建体生成的辅底物bh4将酪氨酸转化为l-dopa。rntyrh基因可以是野生型的,或是赋予增强活性的改善的突变体(例如,w166y、r37e和r38e,实施例1)中的任一种。第二褐家鼠基因rndhfr编码将二氢生物蝶呤(bh4的氧化产物)还原为bh4的酶,以这种方式增加该辅底物的可用性。第三构建体中还包含来自恶臭假单胞菌的ppdodc(一种将l-dopa转化为多巴胺的酶)。第四种酶为来自日本黄连的cjncs,其缩合4-hpa与多巴胺以制备去甲乌药碱。每个基因均经密码子优化以在酵母中表达。
在第三整合构建体中,将来自植物的五种异源基因和leu2选择标记整合到基因座ydr514c中。ps6omt、ps4’omt和pscnmt为来自罂粟的甲基转移酶并且以天然植物核苷酸序列表达。第四罂粟基因ypscprv2针对酵母进行密码子优化并且编码支持来自花菱草的细胞色素p450的活性的还原酶eccyp80a1。eccyp80a1以其天然植物核苷酸序列表达。在该构建体中编码的酶进行两次o-甲基化、一次n-甲基化和一次羟基化,以由先前的整合构建体产生的去甲乌药碱产生牛心果碱。
在最后的整合构建体中,将酿酒酵母内源基因aro4q166k、aro7t226i、tkl1和aro10的另外拷贝与潮霉素抗性选择标记一起整合到aro4基因座中。aro4q166k和aro7t226i为aro4和aro10的反馈抗性突变体,其各自编码相对于野生型序列的单个碱基对置换。tkl1和aro10与天然酵母基因相同,但是在强启动子后方表达。aro4p和aro7p是包括酪氨酸在内的芳族氨基酸的生物合成中的酶。去除这些酶的反馈抑制导致内源酪氨酸生物合成的上调。tkl1p的过表达使戊糖磷酸途径上调,从而导致酪氨酸的前体赤藓糖4-磷酸(e4p)的供应增强。aro10p的过表达增加4-hpa的产生。
可利用任何数目的所述四种表达盒构建平台酵母菌株。具体而言,利用整合构建体1-4和整合构建体1-3构建平台酵母菌株。在其中不包括酪氨酸过量产生构建体(构建体4)的后一种菌株中,可在培养基中供应额外的酪氨酸以支持牛心果碱的生物合成。可将另外的遗传修饰掺入平台菌株中,以支持下游bia的产生和通往bia生物合成的通量增加。
使酵母菌株在具有适当的氨基酸撤除成分溶液的合成完全培养基中在25℃和30℃下生长。在生长48和96小时之后通过lc-ms/ms分析对培养基上清液中的bia代谢物进行分析。
实施例13:被工程化用于由l-酪氨酸产生蒂巴因和其他吗啡喃生物碱的酵母
酵母菌株可被工程化用于由早期前体如酪氨酸产生吗啡喃生物碱蒂巴因或衍生自蒂巴因的吗啡喃生物碱。作为实例,实施例12中所述的平台酵母菌株可被进一步工程化以由l-酪氨酸产生吗啡喃生物碱产物(图7)。
由l-酪氨酸产生(s)-牛心果碱的平台酵母菌株(参见实施例12中的描述)被进一步工程化以掺入差向易构化催化酶,诸如新鉴定的cyp-cor、沙罗泰里啶合酶、沙罗泰里啶还原酶以及沙罗泰里啶醇乙酰转移酶,以将生物合成的(s)-牛心果碱转化为吗啡喃生物碱蒂巴因或衍生自蒂巴因的吗啡喃生物碱(图7)。直接在平台酵母菌株中将三个表达盒(ptdh3-yeccfs1-26-ypbss33-504、ptpi1-ypbsalr、ptef1-ypssalat)组装到具有trp1选择标记的酵母人工染色体(yac)中。其他工程化沙罗泰里啶合酶变体也可并入yac中(图18,实施例8)。所得酵母菌株还用具有ura3选择标记、tdh3启动子和cyp-cor编码序列的低拷贝cen/ars质粒进行转化。
使携带yac、低拷贝质粒和整合盒的酵母菌株在具有适当的撤除成分溶液(-ura-trp)的合成完全培养基中在25℃和30℃下生长。生长96小时后,针对bia代谢物通过lc-ms/ms分析对培养基进行分析。进行关于温度、碳源、ph条件和培养基组成的进一步培养基优化来改善bia产生。
可将另外的遗传修饰引入酵母菌株中以产生衍生自蒂巴因的吗啡喃生物碱(图7)。在一个实例中,将表达盒padh1-t6odm-tadh1、phxt7-cor-tpgk1和ptef1-codm-tcyc1直接组装并整合到产生蒂巴因的酵母菌株的trp1基因座中(thodey等人,2014)。在另一个实例中,可通过直接组装表达盒pgpd-mora-tcyc1、ppgk1-morb-tpho5并且将该构建体整合到染色体上的ura3基因座中来将这些酵母菌株进一步工程化以产生另外的吗啡生物碱(thodey等人,2014)。
实施例14:阿片类分子的o-脱甲基化
对于脱甲基化反应的高通量筛选,使用purpald测定。例如,由2-氧戊二酸依赖性双加氧酶催化的脱甲基化产生甲醛作为产物,如通用化学方程式所示:
产生去甲阿片类化合物的重要步骤是诸如羟考酮等分子的o-脱甲基化(参见图23)。为了鉴定能够进行该步骤的酶,使来自表3的序列进行密码子优化以在酿酒酵母中表达,并作为合成基因进行排序(来自integrateddnatechnologies)。通过在cen.pk2酵母宿主菌株中根据标准分子生物学程序的缺口修复将密码子优化的序列克隆到表达载体pa24、pa25或pa26(或类似载体)中,如图28所示,该载体携带不同强度的启动子序列。分离单个菌落并通过pcr和测序(elimbiopharmaceuticals)进行验证。
图28示出了根据本发明的实施方案,用于酶表达和工程化的质粒/yac载体。将候选物和工程化酶克隆到这些载体中以在酿酒酵母菌株中表达。表7中提供了pa24、pa25和pa26序列的实例。
然后针对图23中列出的各种底物的基础活性水平,对表达推定的o-脱甲基酶的菌株进行测试。为了检测活性,细胞培养物在选择培养基(如上所述)中生长,通过玻璃珠破坏来裂解,并在氧化还原分子和其他辅因子(诸如nadh、nadph和铁,根据酶的需求而处于不同浓度)的存在下与底物一起温育。然后,通过用lc-ms分析实验和对照样品(例如定量的羟考酮和羟吗啡酮)来检测底物(包括但不限于图23中列出的那些)的o-脱甲基化。
为了鉴定具有改善的o-脱甲基化活性的工程化酶,对编码表3中列出的酶的序列进行随机诱变,然后通过高通量比色测定进行筛选。使用mutazymeii(agilenttechnologies)通过易错pcr生成初始文库,并通过cen.pk2筛选宿主中的缺口修复将变体克隆到pa24(或类似的)载体中。表达突变酶的菌株(具有通过基因改组或其他方法引入的单个突变或突变组合)在96孔板形式的选择培养基中在不同的发酵条件(例如,不同的培养基组分、ph和温度)下生长,沉淀,并通过玻璃珠破坏来裂解。将裂解物与底物(在图23中列出)一起温育并在purpald测定中测定甲醛产生。通过用lc-ms直接测量培养基中o-脱甲基化产物(例如,羟吗啡酮)的形成来验证具有改善的o-脱甲基化活性的酶。
实施例15:阿片类分子的n-脱甲基化
n-脱甲基酶活性去除存在于阿片类底物分子(诸如羟吗啡酮)中的n-甲基基团,并产生去甲阿片类化合物(诸如去甲羟吗啡酮),去甲阿片类化合物是nal-阿片类物质的最终生物合成中的重要中间体。为了鉴定能够进行该步骤的酶,使来自表4的序列进行密码子优化以在酿酒酵母中表达,并作为合成基因进行排序(来自integrateddnatechnologies)。通过在cen.pk2酵母宿主菌株中根据标准分子生物学程序的缺口修复将密码子优化的序列克隆到表达载体pa24、pa25或pa26(或类似载体)中,如图28所示,该载体携带不同强度的启动子序列。分离单个菌落并通过pcr和测序(elimbiopharmaceuticals)进行验证。
然后针对图24中列出的各种底物的基础活性水平,对表达推定的o-脱甲基酶的菌株进行测试。为了检测活性,细胞培养物在选择培养基(如上所述)中生长,通过玻璃珠破坏来裂解,并在氧化还原分子和其他辅因子(例如,nadh、nadph和铁)的存在下与底物一起温育。然后通过用lc-ms分析实验和对照样品来检测底物的n-脱甲基化。
为了鉴定具有改善的n-脱甲基化活性的工程化酶,对编码表4中列出的酶的序列进行随机诱变,然后通过高通量比色测定进行筛选。使用mutazymeii(agilenttechnologies)通过易错pcr生成初始文库,并通过cen.pk2筛选宿主中的缺口修复将变体克隆到pa24(或类似的)载体中。表达突变酶的菌株(具有通过基因改组或其他方法引入的单个突变或突变组合)在96孔板形式的选择培养基中在不同的发酵条件(例如,不同的培养基组分、ph和温度)下生长,沉淀,并通过玻璃珠破坏来裂解。将裂解物与底物一起温育(在图24中列出)并在purpald测定中测定甲醛产生。通过用lc-ms直接测量培养基中n-脱甲基化产物(例如,去甲羟吗啡酮)的形成来验证具有改善的n-脱甲基化活性的酶。
实施例16:对去甲阿片类化合物进行修饰以产生nal-阿片类物质
可在暴露的氮气下修饰去甲阿片类分子以生成nal-阿片类物质(参见图25),nal-阿片类物质是用于对抗阿片类物质成瘾和阿片类物质相关副作用的一类重要的药物疗法。为了鉴定能够修饰去甲阿片类分子的酶,使来自表5的序列进行密码子优化以在酿酒酵母中表达,并作为合成基因进行排序(来自integrateddnatechnologies)。通过在cen.pk2酵母宿主菌株中根据标准分子生物学程序的缺口修复将密码子优化的序列克隆到表达载体pa24、pa25或pa26(或类似载体)中,如图28所示,该载体携带不同强度的启动子序列。分离单个菌落并通过pcr和测序(elimbiopharmaceuticals)进行验证。
然后针对图25中列出的各种底物的基础活性水平,对表达推定的修饰酶的菌株进行测试。为了检测活性,细胞培养物在选择培养基(如上所述)中生长,通过玻璃珠破坏来裂解,并在氧化还原分子和其他辅因子(例如,nadh、nadph和铁)的存在下与底物一起温育。使用s-腺苷甲硫氨酸(sam)作为辅底物测试底物的n-甲基化,然后使用sam类似物测试酶的额外修饰活性(参见图25中的“辅底物”)。通过实验和对照样品的lc-ms检测bia底物的修饰。
为了鉴定具有改善的bia修饰活性的工程化酶,对编码表5中列出的酶的序列进行随机诱变,然后通过高通量比色测定进行筛选。使用mutazymeii(agilenttechnologies)通过易错pcr生成初始文库,并通过cen.pk2筛选宿主中的缺口修复将变体克隆到pa24(或类似的)载体中。表达突变酶的菌株(具有通过基因改组或其他方法引入的单个突变或突变组合)在96孔板形式的选择培养基中在不同的发酵条件(例如,不同的培养基组分、ph和温度)下生长,沉淀,并通过玻璃珠破坏来裂解。为了在高通量筛选中检测n-甲基化活性,在具有脱甲基化活性的bm3变体的存在下将裂解物与底物(诸如去甲羟吗啡酮)一起温育,并在purpald测定中测定甲醛产生(用于间接测量甲基化)。在该情况下,甲醛的形成仅可由bm3对已被感兴趣的酶n-甲基化的底物的活性而产生。使用各种sam类似物作为辅底物,针对细胞裂解物中的活性,对具有改善的修饰活性的酶进行另外的测试(参见图25),并通过lc-ms直接测量产物形成进行验证。选择最佳变体酶以用于将底物分子有效地生物转化为nal-阿片类化合物。
实施例17:bm3酶对阿片类分子的脱甲基酶活性
bm3是在其天然宿主中与脂肪酸单加氧化有关的巨大芽孢杆菌细胞色素p450。bm3也易于在酵母和细菌中表达为活性异源酶。bm3作为生物合成酶具有若干优点,包括其是可溶的、带有融合的还原酶伙伴蛋白以及可容易地工程化以接受新的底物。几种已知的bm3变体具有特异性丙氨酸置换,其允许刚性的吗啡喃五元环结构接近活性位点。这些变体在酵母中表达,并观察到将蒂巴因n-脱甲基化为去甲蒂巴因。
具体而言,将bm3变体4h9、7a1和8f11(列于表6中)整合到单个酵母菌株(cen.pk2)的基因组中,并在柠檬酸-磷酸盐缓冲液(ph5.0、6.0、7.0)和tris-hcl缓冲液(ph7.5、8.0、8.5)中与100μm蒂巴因一起温育20小时。整合除了排除bm3开放阅读框外相同的遗传构建体以生成无酶对照菌株。表达bm3的细胞在高于7.0的所有测试的ph水平下产生去甲蒂巴因。通过液相色谱质谱法对由酵母菌株产生的去甲蒂巴因进行定量。去甲蒂巴因(m/z298)的质谱缺乏与脱甲基化氮一致的m/z58产物离子(参见图27)。
图27示出了根据本发明的实施方案的bm3变体的功能表达。具体而言,图27示出了在酵母中具有蒂巴因n-脱甲基酶活性的bm3变体的功能表达。将bm3变体4h9、7a1和8f11整合到单个酵母菌株(cen.pk2)的基因组中,并在柠檬酸-磷酸盐缓冲液(ph5.0、6.0、7.0)和tris-hcl缓冲液(ph7.5、8.0、8.5)中与100μm蒂巴因一起温育20小时。整合除了排除bm3开放阅读框外相同的遗传构建体以生成无酶对照菌株。表达bm3的细胞在高于7.0的所有测试的ph水平下产生去甲蒂巴因。通过液相色谱质谱法对由酵母菌株产生的去甲蒂巴因进行定量。去甲蒂巴因(m/z298)的质谱缺乏与脱甲基化氮一致的m/z58产物离子。
实施例18:o-脱甲基化阿片类分子的生物产生
将显示出对bia分子(诸如表2中列出的那些)具有o-脱甲基酶活性的实施例14中所述和表3中所列的酶掺入从头生物合成吗啡喃生物碱的微生物菌株(酿酒酵母或大肠杆菌)中。完整的bia生物合成途径使用由宿主细胞产生的和/或在培养基中补充的酪氨酸。将两个酪氨酸分子进行修饰并缩合以形成第一苄基异喹啉结构,其可以是去甲乌药碱或全去甲劳丹碱。对苄基异喹啉进行进一步修饰以形成(s)-牛心果碱,然后通过差向异构酶的活性进行立体化学反转,产生(r)-牛心果碱。(r)-牛心果碱经历碳-碳偶联反应以形成第一原吗啡喃沙罗泰里啶,并进行进一步修饰然后经历氧-碳偶联反应以得到第一吗啡喃生物碱结构蒂巴因(参见图26)。表2列出了完整途径中的酶和活性。
图26示出了根据本发明的实施方案,微生物细胞中的生物合成方案。将由所述细胞内源产生的和/或在培养基中提供的酪氨酸转化为羟考酮(虚线箭头代表多个酶促步骤)。然后使羟考酮进行3-o-脱甲基化为羟吗啡酮,并进行n-脱甲基化为去甲羟吗啡酮。最后,n-甲基转移酶接受来自sam类似物的烯丙基和环丙基甲基碳部分,以分别产生纳洛酮和纳曲酮。
为了检测产生吗啡喃生物碱分子的菌株中的o-脱甲基酶活性(参见图26),通过发酵繁殖表达来自质粒载体或染色体整合盒的候选酶的细胞,并收集细胞上清液以分析总阿片类物质曲线(如上所述)。通过lc-ms检测携带完整bia途径的菌株中阿片类分子的o-脱甲基化(如上所述)。具体而言,检测羟考酮到羟吗啡酮的转化。为了检测通过生物催化的o-脱甲基化活性,将菌株在选择培养基中培养,然后通过玻璃珠破坏来裂解。向细胞裂解物外源地提供阿片类底物(参见图23)和酶功能所必需的其他辅因子。通过lc-ms检测阿片类分子的o-脱甲基化。
实施例19:n-脱甲基化阿片类分子的生物产生
将显示出对bia分子(诸如表2中列出的那些)具有n-脱甲基酶活性的实施例15中所述和表4中所列的酶掺入从头生物合成吗啡喃生物碱的微生物菌株(酿酒酵母或大肠杆菌)中。完整的bia生物合成途径使用由宿主细胞产生的和/或在培养基中补充的酪氨酸。将两个酪氨酸分子进行修饰并缩合以形成第一苄基异喹啉结构,其可以是去甲乌药碱或全去甲劳丹碱。对苄基异喹啉进行进一步修饰以形成(s)-牛心果碱,然后通过差向异构酶的活性进行立体化学反转,产生(r)-牛心果碱。(r)-牛心果碱经历碳-碳偶联反应以形成第一原吗啡喃沙罗泰里啶,并进行进一步修饰然后经历氧-碳偶联反应以得到第一吗啡喃生物碱结构蒂巴因(参见图26)。表2列出了完整途径中的酶和活性。
为了检测产生吗啡喃生物碱分子的菌株中的n-脱甲基酶活性(参见图26),通过发酵繁殖表达来自质粒载体或染色体整合盒的候选酶的细胞,并收集细胞上清液以分析总阿片类物质曲线(如上所述)。通过lc-ms检测携带完整bia途径的菌株中阿片类分子的n-脱甲基化(如上所述)。具体而言,检测羟吗啡酮到去甲羟吗啡酮的转化。为了检测通过生物催化的n-脱甲基化活性,将菌株在选择培养基中培养,然后通过玻璃珠破坏来裂解。向细胞裂解物外源地提供阿片类底物(参见图24)和酶功能所必需的其他辅因子。通过lc-ms检测阿片类分子的n-脱甲基化。
实施例20:nal-阿片类化合物的生物产生
将显示出对bia分子(诸如表2中列出的那些)的n-甲基化酶活性的实施例16中所述和表5中所列的酶掺入从头生物合成吗啡喃生物碱的微生物菌株(酿酒酵母或大肠杆菌)中。图26显示了从前体分子蒂巴因到最终的nal-阿片类化合物纳洛酮和纳曲酮的完整反应方案的实例。这些菌株还表达来自实施例1和2以及表1和2的酶,其负责由完整bia途径产生去甲阿片类化合物。n-甲基化酶还在缺乏生物合成途径的微生物菌株(例如,针对于酿酒酵母的cen.pk2或针对于大肠杆菌的bl21)中表达,以产生能够对几种不同的外源供应的底物分子进行生物催化的菌株。完整的bia生物合成途径使用由宿主细胞产生的和/或在培养基中补充的酪氨酸。将两个酪氨酸分子进行修饰并缩合以形成第一苄基异喹啉结构,其可以是去甲乌药碱或全去甲劳丹碱。对苄基异喹啉进行进一步修饰以形成(s)-牛心果碱,然后通过差向异构酶的活性进行立体化学反转,产生(r)-牛心果碱。(r)-牛心果碱经历碳-碳偶联反应以形成第一原吗啡喃沙罗泰里啶,并对其进行进一步修饰然后经历氧-碳偶联反应以得到第一吗啡喃生物碱结构蒂巴因(参见图26)。表2列出了完整途径中的酶和活性。
为了检测具有针对去甲阿片类物质的完整bia途径的菌株中的n-修饰活性(参见图26),通过发酵繁殖表达候选酶的细胞(如上所述),并与诸如图25中列出的那些sam或sam类似物一起温育。通过lc-ms在上清液中检测携带完整bia途径的菌株中的去甲阿片类或其他bia分子的酶促修饰(如上所述)。为了检测通过生物催化的n-修饰活性,将菌株在选择培养基中培养,然后通过玻璃珠破坏来裂解。向细胞裂解物外源地提供sam或sam类似物,以及酶功能所必需的其他辅因子。具体而言,检测去甲羟吗啡酮到纳洛酮和纳曲酮的转化(使用sam类似物烯丙基-sam或环丙烷-sam,如图25所示)。通过lc-ms检测去甲阿片类或其他bia分子的修饰。为了检测在不具有完整bia途径的菌株中通过生物催化的n-修饰活性,使表达实施例16中所述酶的cen.pk2菌株在选择培养基中培养并通过玻璃珠破坏来裂解。向细胞裂解物外源地提供sam或sam类似物、酶功能所必需的辅因子以及去甲阿片类分子,诸如图25和表2中列出的那些。通过lc-ms检测这些化合物的修饰。
实施例21:codm对阿片类分子的o-脱甲基酶活性
图29示出了根据本发明的实施方案,codm的功能表达。具体而言,图29示出了在酵母中具有羟考酮3-o-脱甲基酶活性的codm的功能表达。将酵母密码子优化的codm基因整合到酵母菌株w303的基因组中,并在合成完全培养基中培养16小时。亲本w303菌株也在合成完全培养基中培养16小时作为无酶对照。使细胞沉淀并用1ml破碎缓冲液(100mmtris-hclph7.5,10%甘油,14mm2-巯基乙醇,1x蛋白酶抑制剂)洗涤。将细胞重悬于200μl破碎缓冲液中并通过玻璃珠破坏来裂解。将粗细胞裂解物与10mm抗坏血酸、0.5mm硫酸铁(ii)、0.1mm羟考酮作为底物和10mm2-氧戊二酸作为辅底物一起温育,总体积为100μl。还添加4mmdtt作为还原剂以使铁保持在fe2+状态。将反应在30℃下温育3小时,并通过将其以1:1稀释在含有0.1%乙酸的乙醇中来淬灭。通过lc-ms检测由表达codm的酵母菌株产生的羟吗啡酮。由酵母菌株产生的羟吗啡酮的质荷比(m/z302)、保留时间和质谱与购买的羟吗啡酮标准品相匹配(参见图29)。
表2:酶列表
表3:o-脱甲基酶候选酶
表4:n-脱甲基酶候选酶
表5:n-甲基转移酶和n-修饰的候选酶
表6.bm3n-脱甲基酶的变体
表7:pa24、pa25和pa26序列
表8.裁剪酶
表9.罂粟杆浓缩物和澄清的酵母培养基中可能存在的杂质的比较。
表10:澄清的酵母培养基(cycm)中存在的不同组的分子。与罂粟杆浓缩物(cps)不同,酵母宿主菌株可被工程化以产生预定种类的生物碱分子(即,每种菌株仅有一个生物合成途径),使得不存在其他种类的生物碱。因此,cycm可包含单个生物合成途径内的分子,包括跨越一列或两列的分子的子集,而cps可包含跨越许多列的分子的子集。
表11:化合物的化学合成制剂中可能存在的杂质
尽管本文已经示出并描述了本发明的优选实施方案,但对于本领域技术人员将会显而易见的是,这些实施方案仅以示例的方式提供。本领域技术人员在不脱离本发明的情况下现将想到多种变化、改变和替代。应当理解,本文描述的本发明实施方案的各种替代方案可用于实施本发明。旨在以下述权利要求限定本发明的范围,并由此涵盖这些权利要求范围内的方法和结构及其等同物。
- 还没有人留言评论。精彩留言会获得点赞!